El carcinoma hepatocelular (CHC) es la neoplasia maligna primaria hepática más frecuente. Es el sexto cáncer en frecuencia y el tercero en mortalidad en el mundo1. En la gran mayoría de los casos el CHC aparece en el contexto de un hígado cirrótico, población en la cual supone la primera causa de muerte.
En la actualidad hay tres tipos de tratamientos que se consideran potencialmente curativos del CHC, y que pueden aplicarse en pacientes con CHC inicial según el sistema de estadificación Barcelona Clinic Liver Cancer (BCLC) (30–40% de la población diagnosticada): la resección quirúrgica, el trasplante hepático y la ablación percutánea2. Los pacientes en estadio intermedio del BCLC (30% de los CHC diagnosticados en nuestro medio) se benefician del tratamiento paliativo de quimioembolización transarterial hepática (TACE), con aumento de la supervivencia2, mientras que en aquellos enfermos con CHC avanzado el tratamiento de elección y aprobado por la FDA (Food and Drug Administration, EE.UU.) y la EMEA (European Medicines Agency) es Sorafenib3,4.
Sorafenib: datos de la moléculaDescripción del fármacoEl Sorafenib Tosilato (Nexavar®) es un inhibidor multiquinasas de bajo peso molecular y de gran biodisponibilidad que se administra por vía oral.
Sorafenib actúa bloqueando diferentes vías de señalización asociadas a la hepatocarcinogénesis, en especial la vía Raf/MEK/ERK a través de la inhibición de la Raf quinasa y diferentes tirosinquinasas (receptor 2 del factor de crecimiento endotelial vascular, receptor del factor de crecimiento derivado de plaquetas, receptores c-Kit)5–8. Sus acciones fundamentales son reducir la angiogénesis y enlentecer la proliferación celular7.
La biodisponibilidad de Sorafenib disminuye en un 29% cuando se administra con dietas que tienen alto contenido graso, por lo que se recomienda su administración en ayunas6. Alcanza el pico plasmático en aproximadamente 3 horas y concentraciones plasmáticas estables en aproximadamente 7 días. In vitro el 99,5 % circula unido a proteínas plasmáticas6.
Se metaboliza por medio de CP450 3A4 y de la vía de glucuronización 1A9 (el 77 % de la dosis se elimina por las heces, y el 19 % se excreta en orina como metabolitos glucuronizados). Sorafenib inhibe varias enzimas involucradas en el metabolismo de los fármacos e inhibe la UGT1A1 (enzima alterada en los pacientes con enfermedad de Gilbert); por ello está implicado en la aparición de hiperbilirrubinemia aislada sin acompañarse de deterioro de la función hepática.
La vida media de eliminación de Sorafenib es de 25–48h. No requiere ajuste de dosis por peso, edad, sexo o función renal.
No hay información concluyente respecto a la seguridad y a la eficacia de Sorafenib en pacientes con disfunción hepática avanzada (Child-Pugh clase C), aunque existen series con bajo número de pacientes que mencionan mayor número de complicaciones y muertes relacionadas con hemorragia digestiva alta; por lo cual, teniendo en cuenta que Sorafenib se elimina principalmente por vía hepática, la exposición puede estar incrementada en esta población, por lo que se desaconseja su uso en estos pacientes.
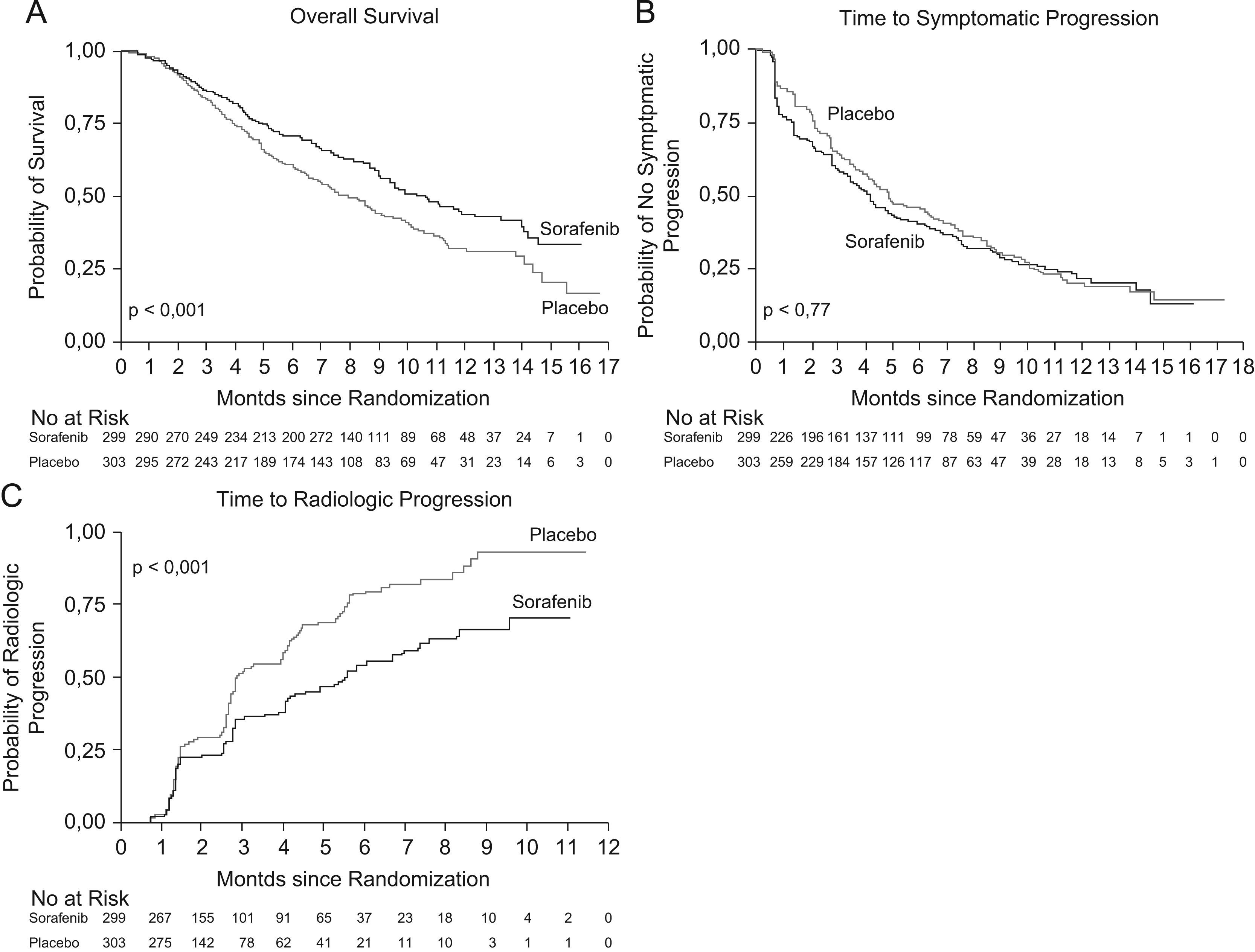
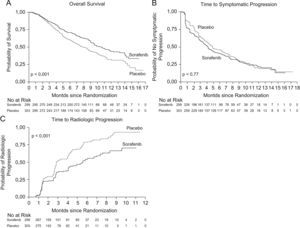
Ensayos clínicos con SorafenibTras los resultados positivos en estudios preclínicos, se realizó un ensayo no controlado, fase ii, con 137 pacientes con CHC avanzado y función hepática conservada (Child-Pugh clases A y B). Los resultados de dicho estudio indicaron que la utilización en monoterapia de Sorafenib podía tener un efecto beneficioso, con una supervivencia mediana de 9,2 meses y una mediana de tiempo respecto a la progresión de 5,5 meses9. Teniendo en cuenta estos datos, se realizó un estudio clínico internacional, multicéntrico, aleatorizado, controlado y doble ciego (Estudio SHARP) en el que se evaluó el Sorafenib en dosis de 400mg/12h respecto a placebo en pacientes con CHC avanzado, con función hepática compensada (95% Child-Pugh clase A y 5% Child-Pugh B) y sin síntomas importantes relacionados con la enfermedad tumoral (ECOG 0–2)3. Se reclutaron 602 pacientes (299 en el brazo de Sorafenib, 303 en el de placebo), administrándose el tratamiento hasta observar progresión tumoral radiológica y sintomática o aparición de efectos adversos graves. Los objetivos primarios del estudio fueron la supervivencia y el tiempo a progresión sintomática, y como objetivos secundarios el tiempo a progresión radiológica y los efectos adversos3. En el segundo análisis interino se decidió interrumpir el estudio dado el aumento significativo de supervivencia en el grupo de Sorafenib. Los resultados mostraron que la supervivencia mediana fue de 10,7 meses con Sorafenib y de 7,9 meses con placebo (razón de riesgo [Hazard ratio, HR][HR] de 0,69; intervalo de confianza [IC] del 95%; 0,55 a 0,87; p<0,001) (fig. 1. Panel A). Dicho valor de HR, es comparable al obtenido con otras terapias moleculares en otros tipos de cánceres que se han incorporado al arsenal terapéutico habitual en riñón, pulmón, mama, colon, etc10.
Panel A) supervivencia mediana del grupo Sorafenib frente al grupo placebo; Panel B) tiempo medio hasta progresión sintomática entre ambos grupos; Panel C) tiempo medio de progresión radiológica, evaluada mediante los criterios RECIST. Adaptado de Llovet et al3.
Por otro lado, la mediana de tiempo hasta la progresión radiológica, evaluada mediante los criterios RECIST, fue de 5,5 meses con Sorafenib frente a 2,8 meses con placebo (HR de 0,58; IC del 95%: 0,45 a 0,74; p<,001) (fig. 1. Panel C). El análisis de tiempo hasta la progresión sintomática no demostró diferencias entre los dos grupos, probablemente y según los propios autores, porque los cuestionarios empleados para evaluar los síntomas no discriminaban adecuadamente los efectos derivados del tratamiento de los síntomas derivados de la progresión tumoral o de la cirrosis hepática subyacente (fig. 1. Panel B).
Los efectos secundarios fueron frecuentes pero la mayoría prevenibles de modo que hasta en el 90% de los casos se pudo mantener el tratamiento ajustando las dosis. Los efectos más habituales en el grupo Sorafenib fueron diarrea, pérdida de peso y reacción cutánea mano-pie. La disfunción hepática se describió en menos del 1% de los pacientes incluidos en el brazo de Sorafenib, sobre todo como aumento de la bilirrubina sérica de forma aislada3. No se observaron diferencias significativas en la mayoría de efectos adversos de grado 3 y 4 entre el grupo tratado con Sorafenib y el grupo placebo3.
Los subanálisis realizados con posterioridad a la publicación del estudio SHARP, mostraron que los efectos beneficiosos obtenidos con Sorafenib en relación a la supervivencia se mantenían para los diferentes subgrupos de pacientes; pacientes asiáticos3, con/sin síntomas11, con/sin invasión vascular o con/sin extensión extrahepática12, BCLC-B/C12, en pacientes que recibieron o no tratamiento previo11, en CHC sobre cirrosis hepática secundaria a consumo de alcohol13, VHC14, etc12–15.
Estos resultados se reprodujeron en un ensayo clínico con un diseño similar realizado en Asia, en el que los sujetos presentaban un CHC más avanzado y la mayoría secundarios a cirrosis por virus de la hepatitis B (VHB). A pesar de tratarse de una población con un CHC más avanzado, Sorafenib demostró beneficios similares al estudio SHARP en cuanto a reducción de riesgo de muerte (HR de 0,68; IC del 95%: 0,50–0,93; p=0,014) con una supervivencia mediana de 6,5 meses con Sorafenib y de 4,2 meses con placebo, y una mediana de tiempo hasta la progresión de 2,8 meses con Sorafenib frente a 1,4 meses con placebo (HR de 0,57; IC del 95%: 0,42–0,79; p=0,0005)4.
RecomendacionesEl tratamiento con fármacos antitumorales orales requiere una rigurosa selección de pacientes y seguimiento estrecho para lograr un control y manejo adecuado de posibles efectos adversos asociados a estos fármacos. En este sentido, las guías clínicas del sistema nacional de salud recientemente aprobadas5 recomiendan que el diagnóstico y tratamiento del CHC deben llevarse a cabo en el contexto de grupos multidisciplinares en centros de referencia.
Tipo de pacienteSorafenib está indicado en diferentes tipos de pacientes:
- •
Pacientes con CHC avanzado según BCLC o CHC en un estadio anterior que no puede ser candidato a la opción terapéutica recomendada (p.ej.: pacientes en estadio intermedio, BCLC-B, con contraindicación para la TACE o progresión tras la misma3,4,16).
- •
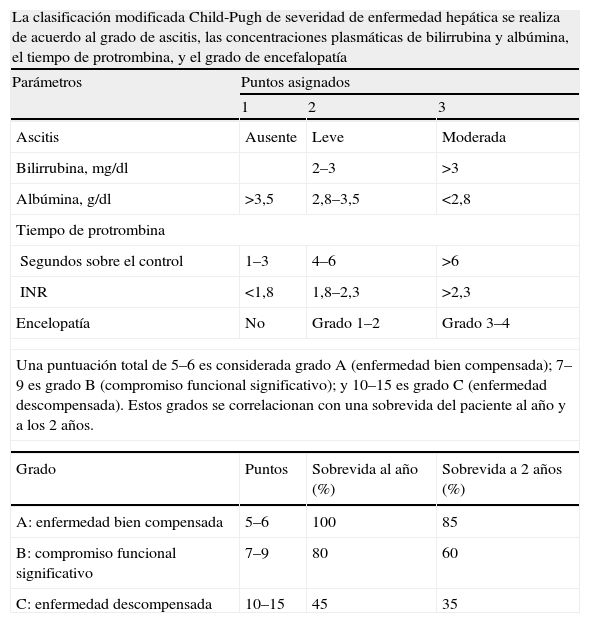
Pacientes con función hepática conservada: Child-Pugh clase A y B hasta 7 puntos, que no presenten encefalopatía. En presencia de ascitis, esta debe ser de grado leve y controlada con dieta y diuréticos3,4,17,18 (Apéndice 1).
- •
Pacientes asintomáticos o con síntomas leves que no interfieran con la actividad diaria habitual: Pacientes con un performance status (PS) ≤2 (Apéndice 2).
- •
Pacientes con ausencia de enfermedad cardiovascular19.
- •
Pacientes con ausencia de comorbilidades significativas que a juicio del médico responsable del paciente pueda dificultar el manejo del fármaco.
Una vez identificado un paciente candidato a ser tratado con Sorafenib de acuerdo a los criterios anteriormente descritos, debe realizarse una valoración inicial sobre la idoneidad del paciente. El tiempo que requiere optimizar las condiciones del paciente antes de iniciar el tratamiento puede variar de 7–28 días pero permite detectar posibles contraindicaciones, mejorar las condiciones del paciente, conocimiento y adherencia al tratamiento. Para optimizar la adherencia al tratamiento se recomienda entregar información escrita de los posibles efectos secundarios y sugerencias antes de iniciar el tratamiento.
Se sugiere realizar las siguientes exploraciones:
- •
Visita clínica: historia clínica completa, registro de síntomas basales, constantes vitales incluido el peso, exploración física con especial énfasis en descartar patología vascular periférica.
- •
Realizar una analítica que incluya amilasa, lipasa, TSH, función hepática, renal, hemograma, coagulación y perfil nutricional.
- •
Realizar una prueba de imagen (RM o TC) para correcta estadificación del paciente.
- •
Realizar un electrocardiograma basal a todos los pacientes. En aquellos pacientes con factores de riesgo cardiovascular realizar ecocardiograma y considerar evaluación por parte de un especialista de enfermedades cardiovasculares.
- •
Valorar posibles complicación de la cirrosis:
- ○
En caso de varices esofágicas: si presentó hemorragia digestiva por varices esofágicas no iniciar tratamiento hasta realizar adecuada profilaxis (secundaria), o erradicarlas.
- ○
En caso de ascitis leve, iniciar dieta hiposódica y tratamiento diurético.
- ○
- •
Profilaxis de posibles efectos secundarios:
- ○
Control de tensión arterial durante al menos una semana previo al inicio del tratamiento y en caso de hipertensión arterial (HTA), iniciar u optimizar el tratamiento antihipertensivo.
- ○
Iniciar tratamiento preventivo con cremas tópicas y remitir al paciente al podólogo en caso de hiperqueratosis plantar.
- ○
En caso de hiporexia, anorexia o desnutrición, realizar comidas más frecuentes con menos volumen, utilizar estimulantes de apetito (megestrol) y/o remitir al servicio de dietética para evaluación.
- ○
Interrogar sobre el ritmo evacuatorio: en caso de estreñimiento o diarrea (enfermedad celiaca o malabsorción intestinal) optimizar el tratamiento para regular el ritmo evacuatorio y remitir al servicio de dietética para su evolución.
- ○
Valorar el grado de depresión reactiva y de deterioro del estado general. Si se detecta depresión reactiva remitir al servicio de psicoterapia para realizar controles conjuntos.
- ○
- •
Informar al paciente y a la familia sobre el pronóstico de la enfermedad, beneficios esperados con Sorafenib y efectos adversos más frecuentes. La información proporcionada en este momento es de vital importancia para asegurar un buen cumplimiento terapéutico a pesar de los efectos adversos iniciales, que suelen aparecer durante las primeras 4–6 semanas de tratamiento20,21.
- •
Preparar psicológicamente al paciente sobre las características del tratamiento, resaltar la importancia del cumplimiento al tratarse de un tratamiento oral e informar sobre los efectos secundarios que puede experimentar tras iniciar el tratamiento. El apoyo psicológico será proporcionado tanto por el hepatólogo, equipo de enfermería del servicio y cuando sea necesario por el servicio de psiquiatría.
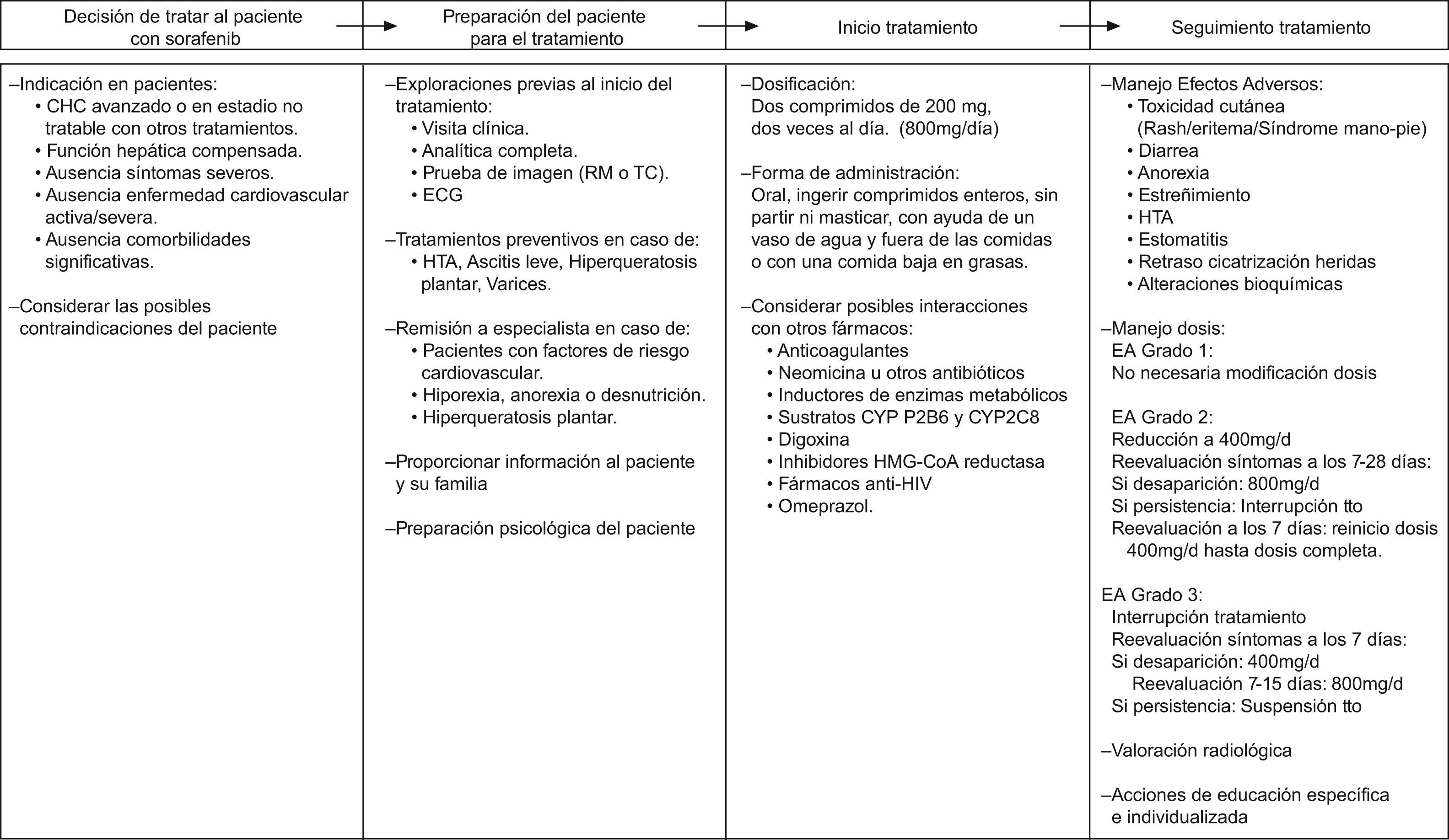
Un resumen de estas consideraciones a tener en cuenta al inicio del tratamiento con Sorafenib se muestra en la tabla 1.
Check-list previo al inicio del tratamiento con sorafenib
| Contraindicación | Considerar resolver la complicación o consultar con especialista antes de iniciar Sorafenib | Iniciar Sorafenib | |
| 1. Antecedentes: | |||
| Fallo cardíaco | • >NYHA clase 2 | • NYHA clase 1 | • Ausente |
| Angina inestable | • Presente | • Ausente | |
| Claudicación intermitente | • Severa | • Moderada-leve | • Ausente |
| Hipertensión arterial | • Descontrolada o controlada con dos fármacos | • Controlada | |
| Diabetes mellitus | • Descompensada | • Compensada | |
| Fibrilación auricular tratada con Sintrom® o digoxina | • Presente | • Ausente | |
| Infarto de miocardio hace | • <6 meses | • >6 meses | • Ausente |
| Accidente cerebrovascular | • <6 meses | • >6 meses | • Ausente |
| 2. Examen Físico | |||
| Pulso radial | • Irregular | • Regular | |
| Pulso pedio | • Ausentes | • Débil | • Bueno |
| Piel | • Acro-cianosis | • Deshidratada | • Normohidratada |
| Pies | • Hiperqueratosis | • Sin lesión | |
| Abdomen | • Ascitis a tensión | • Ascitis moderada -Leve | • Sin ascitis o ascitis |
| controlada con diuréticos | |||
| Encefalopatía | • Grado III–IV | • Grado I–II | • No presenta |
| Performance status | • 3–4 | • 2 | • 0–1 |
| Tensión arterial | • ≥150–90 | • 140–80 | |
| 3. Endoscopia | |||
| Varices esofágicas | • Signos rojos | • Grandes-mediana | • Pequeñas o ausentes |
| Gastropatía de hipertensión portal | • Grave-moderada | • Leve o ausente | |
| Sangrado activo | • Presente o en los últimos 30 días | • Ausente | |
| 4. Laboratorio y cálculo de Child-Pugh | |||
| Debe solicitarse como mínimo | |||
| Tiempo de protrombina, bilirrubina, albúmina, función renal, sodio, potasio, hemograma, plaquetas, amilasa y lipasa | |||
| Child-Pugh (puntos) | • C-B (8–9) | • B (7) | • A |
| 5. Valoración cardiológica | |||
| Arritmia tratadas con | • Antiarrítmicos diferentes a betablo-queantes o digoxina | • Betabloqueantes o digoxina | • No tiene arritmia |
| conocida | |||
| Ecocardiograma | • <50% | • 50–60% | • ≥60% |
| Fracción de eyección | |||
| Electrocardiograma | • Irregular | • Sinusal | |
| 6. Si el paciente es diabético o hipertenso conocido | |||
| Fondo de ojo | • Retinopatía moderada o severa | • Sin retinopatía | |
Se recomienda realizar un control clínico y analítico cada 4–6 semanas, que el paciente tenga acceso al centro de atención médica de forma directa (contacto telefónico – hospital de día) e instruir al paciente sobre pautas de alarma para poder detectar precozmente los efectos secundarios y realizar tratamiento sintomático o modificaciones de dosis.
La severidad de los efectos secundarios (ES) se clasifica según la version 3.0 de National Cancer Institute's Common Terminology Criteria for adverse events (CTCAE). Según la gravedad de los ES se modifica la dosis de Sorafenib y/o se sugiere tratamiento sintomático. De forma resumida, un ES grado 1 es leve y no interfiere con la vida diaria; un ES grado 2 es moderado, interfiere con la vida diaria y generalmente se recomienda disminuir la dosis de Sorafenib; un ES de grado 3 es grave, altera la calidad de vida del paciente y obliga a la suspensión temporal de la medicación; por último, un ES de grado 4 es muy grave, con riesgo vital y/o invalidez permanente.
Manejo de las reacciones cutáneasLos tratamientos moleculares inhibidores multiquinasas como el Sorafenib se asocian frecuentemente con manifestaciones dermatológicas22–24 (21–40%) durante el inicio del tratamiento, tales como xerosis cutánea, alopecia, decoloración de la piel, síndrome mano-pie, dermatitis seborreica, prurito, eritema, estomatitis, edema de cara y erupciones acneiformes o psoriasiformes. Aunque estas reacciones no parecen afectar de forma directa a la supervivencia, sí afectan a la calidad de vida del paciente y, a veces, conllevan una disminución de dosis, o incluso la suspensión temporal o total del tratamiento, con lo que puede mermar la eficacia del mismo22. Por ello, debe prepararse la piel para evitar la aparición de toxicidad cutánea20. Para prevenir el eritema y el rash debe aplicarse factor de protección solar elevado y cubrir las zonas expuestas al sol (cabeza, brazos, cuello). También se recomienda el uso de crema o spray tipo aftersun sobre el eritema si este aparece. A veces es pruriginoso, con pequeñas pústulas o se acompaña de fiebre. El tratamiento antitérmico y antihistamínico asociado a las lociones cutáneas resuelve la situación en la mayoría de los casos y no es necesario modificar la dosis de Sorafenib.
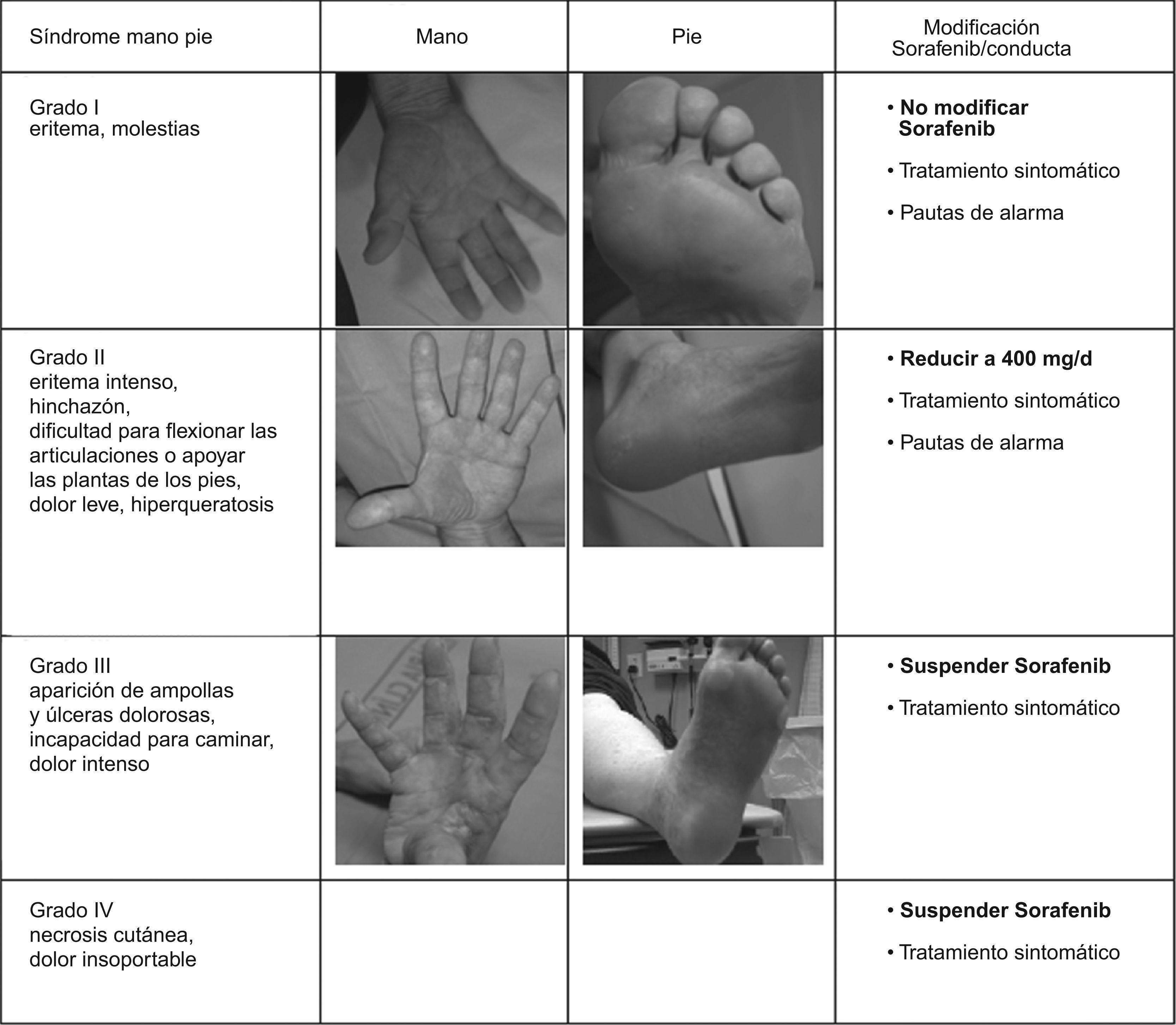
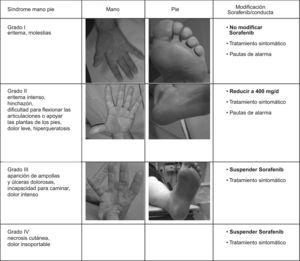
El síndrome mano-pie se caracteriza por diferentes grados de severidad (fig. 2). Sin embargo, para prevenirlo y ayudar a reducir la gravedad de sus síntomas se pueden seguir sencillas medidas como: 1) reducir la fricción y la exposición al calor de las manos y los pies (ej.: evitar la exposición prolongada al agua caliente, aplicar procedimientos de enfriamiento para proporcionar alivio temporal del dolor y la sensibilidad en pies y manos, etc.); 2) hidratar pies y manos al menos 2 veces al día (uso de emolientes); 3) eliminar áreas de hiperqueratosis en las plantas de los pies que podrían empeorar con el tratamiento; 4) uso rutinario de calcetines de algodón, plantillas, calzado cómodo y de suela gruesa; 5) aliviar el dolor mediante analgésicos suaves (paracetamol, hasta 3g al día), y 6) tomar vitamina B6 (piridoxina).
Estas simples medidas evitan que aparezcan las lesiones cutáneas y en aquellos casos en que aparezcan, ayudan a que remitan con más prontitud. Pese a todo, en ocasiones es necesario reducir la dosis al 50% (400mg/24h en toma nocturna) durante un periodo corto de tiempo hasta su resolución. A veces, la recidiva de las lesiones cutáneas tras su reintroducción a dosis plenas obliga a una reducción de dosis o suspensión temporal o definitiva.
Las lesiones cutáneas que obligan a suspender de manera cautelar el tratamiento son las de grado 3 (fig. 2): dolor intenso palmo-plantar que impida realizar la vida normal, cerrar la mano para sujetar objetos e incluso caminar, la aparición de ampollas, heridas o úlceras o la hiperqueratosis intensa. En estos casos debe suspenderse el tratamiento con Sorafenib hasta que las lesiones regresen a toxicidad grado 1 (hormigueo y eritema que no interrumpe la vida normal) o desaparezcan del todo. Una vez resueltas, se debe reiniciar el fármaco a mitad de dosis.
Manejo de síntomas gastrointestinalesLos síntomas gastrointestinales también pueden presentarse desde el inicio del tratamiento: alteración del ritmo evacuatorio, pérdida de peso, hiporexia-anorexia, y menos frecuentemente estomatitis, náuseas y vómitos. La alteración del ritmo evacuatorio puede presentarse como estreñimiento, tenesmo rectal, aumento del número de deposiciones sin diarrea, o diarrea. Las recomendaciones respecto a su manejo se detallan en la tabla 2.
Recomendaciones en el manejo de los síntomas gastrointestinales
| Alteración ritmo evacuatorio | Recomendación sintomática | Dosis de Sorafenib |
| Estreñimiento o tenesmo rectal | Lactulosa - optimizar la dieta | No modificar dosis |
| Aumento del número de deposiciones sin diarrea | Agregar fibra a la dieta | No modificar dosis |
| Diarrea: | ||
| <5 deposiciones/d |
| No modificar dosis |
| Control en 7 días | ||
| Pautas de alarma | ||
| <5 deposiciones/d |
| Reducir a 400mg/d |
| no cede | Control en 7 días | |
| Si se controla: Sorafenib 800mg/d | ||
| Pautas de alarma | ||
| >5 deposiciones/d |
| Suspender Sorafenib |
| Control en 7 días | ||
| Si OK: Sorafenib 400mg/d | ||
| Pautas de alarma |
Aunque es poco probable que la intensidad de la diarrea conlleve riesgo de deshidratación es aconsejable que los pacientes tomen líquidos en cantidad suficiente, fuera de las comidas. En raros casos la diarrea obliga a reducir o suspender la toma de Sorafenib. En algunos casos, el paciente puede confundir un aumento del peristaltismo intestinal con episodios de diarrea. Es importante instruir adecuadamente al paciente al respecto.
Durante las primeras semanas de tratamiento se puede observar pérdida de peso sin anorexia para lo cual se sugiere control nutricional y modificar la dosis de Sorafenib. La hiporexia-anorexia se presenta en fases tardías del tratamiento (22%)3, en gran medida resultado de la enfermedad tumoral en estado avanzado. Debe insistirse en la importancia de mejorar el estado nutricional, o al menos evitar su deterioro rápido. Se aconseja la distribución de la dieta en comidas de poco volumen, alto contenido calórico, más frecuentes y agregar suplementos nutricionales. También puede valorarse la posibilidad de utilizar estimuladores del apetito (megestrol, etc.).
En un 10–15% de los pacientes se observan náuseas y vómitos, que deben tratarse de modo sintomático, regulando la dieta y recurriendo a metoclopramida. La presencia de estomatitis es poco frecuente y puede mejorar con enjuagues bucales de nistatina o sales de bicarbonato.
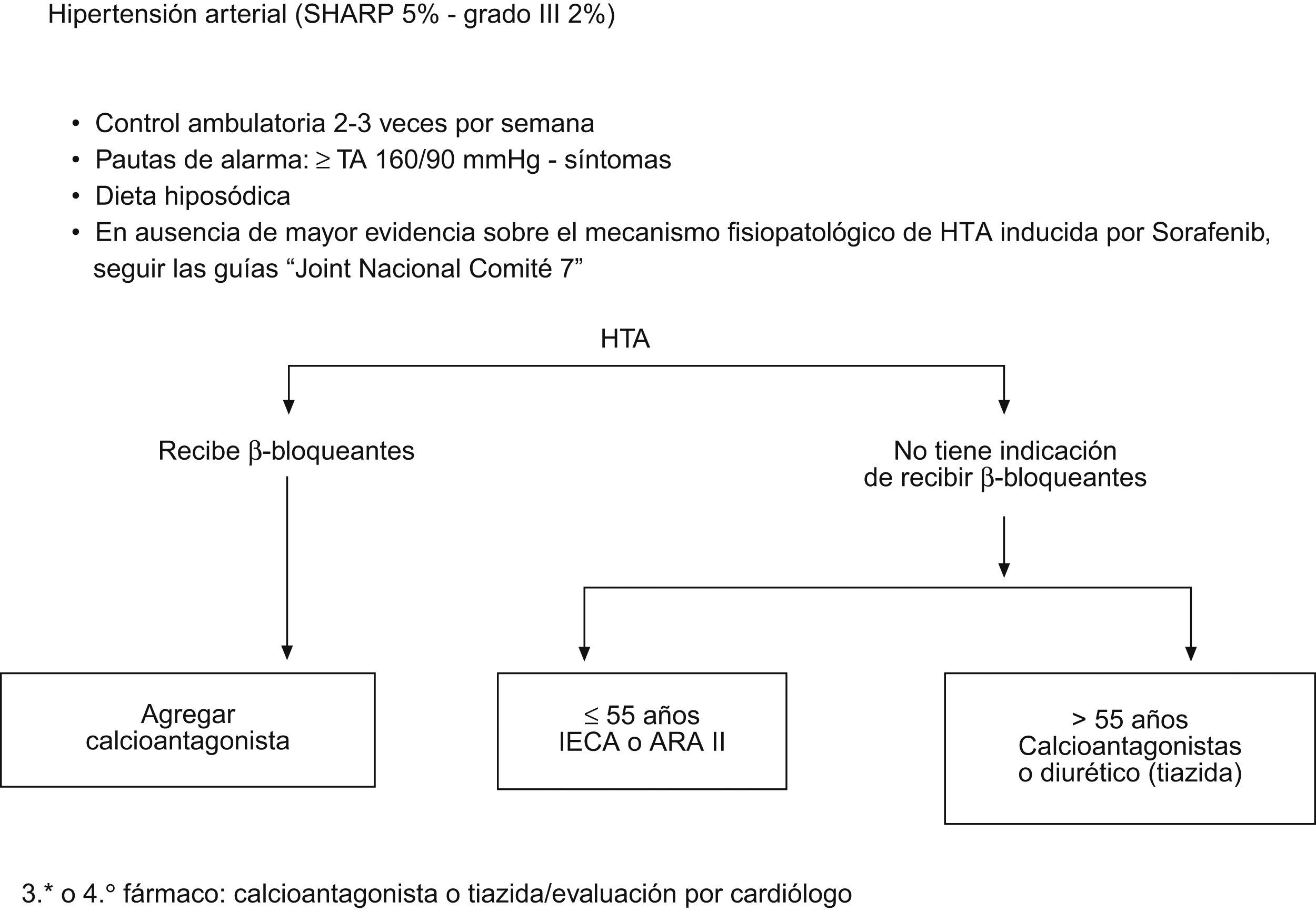
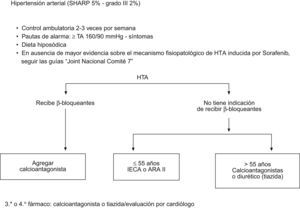
Manejo de síntomas cardiovascularesLos efectos secundarios cardiovasculares varían a lo largo del tratamiento. Durante las primeras semanas puede observarse un aumento de la tensión arterial, en general leve y de fácil manejo19. En un 10–15% de los casos se ha observado hipertensión (HTA). Se recomienda la monitorización estrecha de la TA durante las primeras 3–4 semanas de tratamiento utilizando un diario de paciente. Además de una dieta pobre en sal, se utilizarán hipotensores según la práctica clínica común25 (fig. 3). Si la HTA sigue incontrolada a pesar de estas medidas, y dependiendo del grado de severidad deberá considerarse la reducción de dosis de Sorafenib o suspensión temporal del tratamiento hasta su normalización.
Se ha descrito la aparición de alteración del ritmo cardiaco en forma de fibrilación auricular o bradicardia a lo largo del tratamiento, la media de aparición es 93,5 días (29–530)19, por lo cual se aconseja control de signos vitales en todas las consultas y ante la presencia de alteración del ritmo cardiaco, valorar causas desencadenantes como trastorno de electrolitos. Ha de realizarse una valoración por cardiología y suspender transitoriamente el Sorafenib hasta definir la causa desencadenante. Ante la ausencia de otra causa y en presencia de ritmo cardiaco sinusal reiniciar el tratamiento con 400mg/d y realizar controles clínicos frecuentes.
A pesar de que la presencia de isquemia cardiaca o infarto en el estudio SHARP fue similar en los pacientes que recibían placebo o Sorafenib (1 vs 3%)3 se recomienda control de pulsos periféricos, descartar la presencia de claudicación intermitente e interrogar sobre síntomas sugestivos de angina de pecho en cada visita, especialmente en los pacientes que reciben tratamiento prolongado con Sorafenib. La mediana de aparición de eventos isquémicos o trombosis es 290 días (37–607)19. En caso de que estos aparezcan, se recomienda suspender el Sorafenib y realizar consulta al Servicio de Cardiología o Cirugía Vascular.
Manejo de las complicaciones de la cirrosis durante el tratamientoDurante el tratamiento con Sorafenib se ha descrito desarrollo de ascitis (22%), hemorragia digestiva (7%), disfunción hepática (11%) y encefalopatía, pero ninguna de estas complicaciones fue significativamente más frecuente en el grupo tratado con Sorafenib que en el grupo que recibió placebo3.
Sin embargo se ha observado que los pacientes Child-Pugh clase B desarrollan con más frecuencia encefalopatía y ascitis que los pacientes Child Pugh clase A17. Los trabajos que describen mayor incidencia de hemorragia digestiva y disfunción hepática que la mencionada en el estudio SHARP son series descriptivas que iniciaron tratamiento en pacientes Child-Pugh clase B o C17,18,26,27.
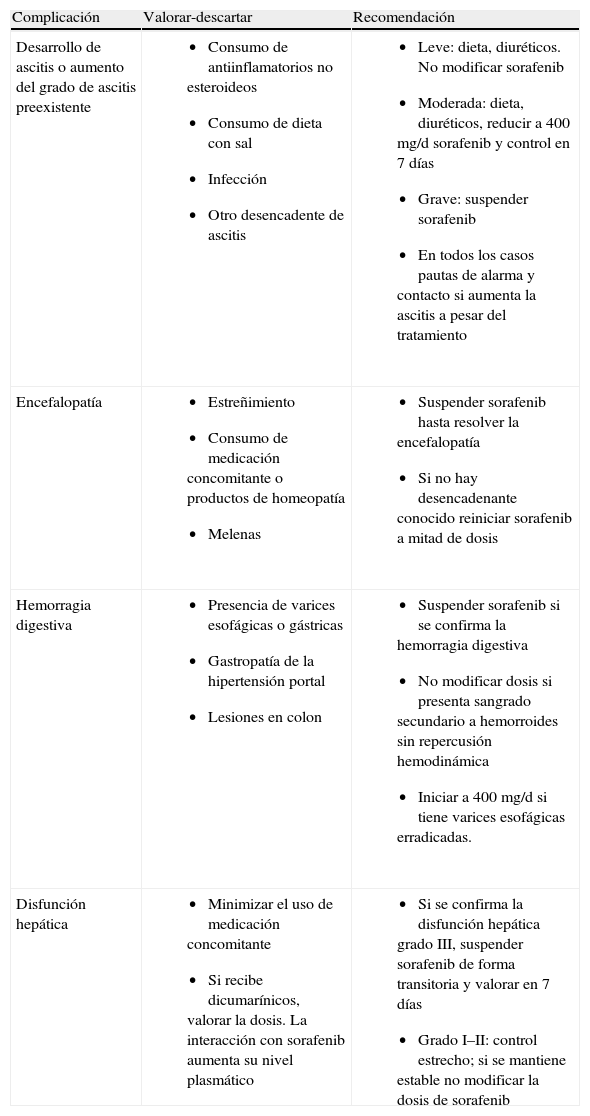
Es por ello que se recomienda continuar con los controles habituales de los pacientes cirróticos y descartar causas desencadentes de las complicaciones de la cirrosis (tabla 3) antes de modificar el tratamiento.
Manejo de las complicaciones de la cirrosis
| Complicación | Valorar-descartar | Recomendación |
| Desarrollo de ascitis o aumento del grado de ascitis preexistente |
|
|
| Encefalopatía |
|
|
| Hemorragia digestiva |
|
|
| Disfunción hepática |
|
|
El efecto antiangiogénico de Sorafenib puede producir retraso en la cicatrización de heridas; si el paciente tiene que someterse a algún procedimiento quirúrgico se sugiere suspender el tratamiento de 3 a 7 días antes del procedimiento y reinciar el tratamiento una vez resuelta la cicatrización.
Ante la presencia de dolor abdominal se sugiere descartar pancreatitis, peritonitis bacteriana espontánea en pacientes con ascitis y presencia de hemoperitoneo. Si el dolor es cólico puede ser de origen intestinal y en algunos casos se debe reducir dosis de Sorafenib y optimizar la dieta. Si el dolor es constante y se asume de origen tumoral, se debe optimizar el tratamiento del dolor.
Ante la presencia de deterioro del estado general, valorar perfil tiroideo, depresión reactiva y reducir Sorafenib a mitad de dosis. Si no resuelve suspender Sorafenib y reevaluar en 7–14 días.
Existen acontecimientos adversos de menor relevancia clínica que no conllevan reducción de dosis pero que deben ser comunicados al paciente para minimizar la ansiedad, como son: alopecia, cambios de voz, sensación de cuerpo extraño en la garganta, protrusión de los pezones, epistaxis, gingivorragia, disminución de la producción de saliva y sensación de ojo seco. Todos estos efectos adversos son de fácil manejo con medidas sintomáticas.
Manejo de dosisLa dosis habitual de Sorafenib es de dos comprimidos de 200mg, dos veces al día. Los comprimidos han de ingerirse enteros, sin partir ni masticar, con ayuda de un vaso de agua y fuera de las comidas o con una comida baja en grasas. Si el paciente tiene previsto tomar una comida rica en grasas, se recomienda la administración de los comprimidos 1 hora o 2 antes o después de la comida.
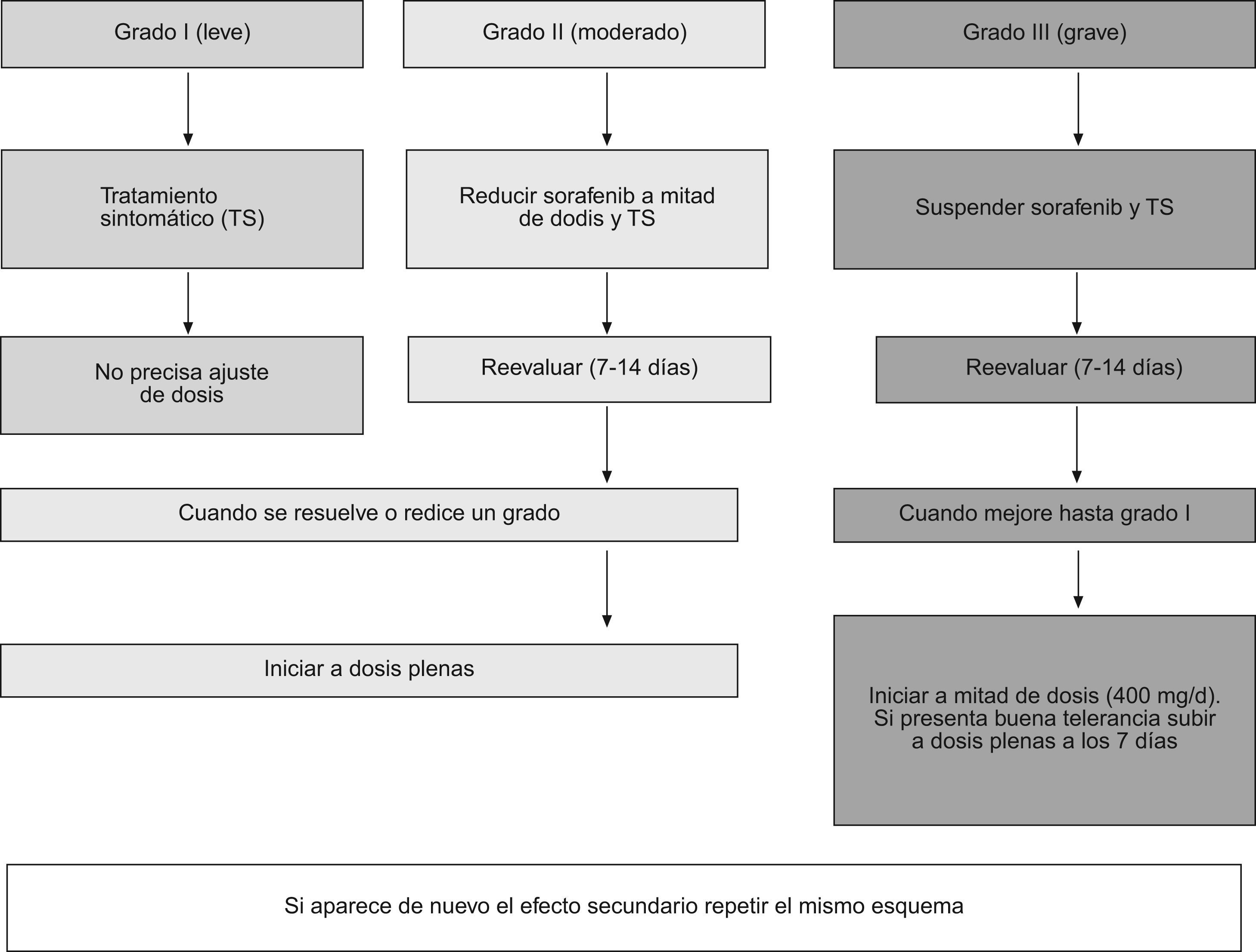
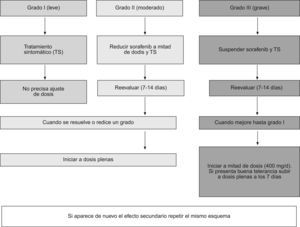
La presencia de efectos secundarios obliga a establecer unas medidas terapéuticas específicas y a efectuar ajustes de la dosis (fig. 4). Para ver la gradación de los efectos secundarios puede consultarse la página:
http://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcaev3.pdf.
Cuando son de grado 1 (leves) no es necesario modificar la dosis de 800mg/d. Ante efectos adversos de grado 2 (moderados) conviene reducir la dosis a 400mg/d (en una única toma, preferiblemente con la cena). Esta reducción de dosis debe mantenerse durante 7–28 días. Transcurrido este tiempo se reevaluará la sintomatología: si ha desaparecido, se administrará la dosis completa (800mg/d). Por el contrario, si persiste se interrumpirá el tratamiento, al menos durante 7 días. Según la persistencia/resolución de los síntomas se puede reiniciar con una dosis de 400mg/d. Si la remisión se mantiene, se intentará aumentar hasta la dosis completa.
Los efectos adversos de grado 3 (graves) obligan a interrumpir temporalmente el tratamiento durante un mínimo de 7 días. Transcurridos los mismos se reevaluará al paciente. Si los síntomas persisten se debe considerar la suspensión del tratamiento. Si por el contrario, hay disminución de los síntomas adversos se reiniciará el tratamiento con 400mg/d. La resolución de la sintomatología, tras una nueva reevaluación del enfermo a los 7–15 días, permite aumentar el fármaco hasta la dosis completa (800mg/d)28,29.
Valoración radiológica de la respuesta al SorafenibEn el seguimiento y valoración de la eficacia del Sorafenib es importante tener en cuenta que la respuesta radiológica definida como medición unidimensional de los cambios del tamaño tumoral tras el tratamiento, que es la base de los criterios World Health Organization (WHO) y response evaluation criteria in solid tumors (RECIST) utilizados en oncología, no es útil con las terapias moleculares. Esto se debe a que por su mecanismo de acción citostático y antiangiogénico la falta de respuesta radiológica no implica necesariamente la ausencia de beneficio clínico (y por tanto no es motivo de suspensión del tratamiento).
Los criterios RECIST, diseñados originalmente para evaluar la necrosis celular inducida por quimioterapia citotóxica, solo cuantifican unidimensionalmente los cambios morfológicos o de tamaño de la lesión diana, pero no siempre hay buena correlación entre la extensión de la necrosis y la respuesta objetiva. Para superar esta limitación se recomienda incluir una estimación del «tumor viable», definido como la captación tumoral de contraste en la fase arterial de una técnica radiológica dinámica. Para estandarizar los criterios de respuesta radiológica con terapias moleculares en oncohepatología se han propuesto recientemente los criterios RECIST modificados16,30 (tabla 4).
Criterios RECIST modificados de evaluación de respuesta al tratamiento
| Respuesta completa | Ausencia completa de captación de contraste en todas las lesiones diana |
| Respuesta parcial | Disminución del ≥30% en la suma de los diámetros de las lesiones diana viables (aquellas con captación de contraste en fase arterial), tomando como referencia la suma de diámetros en la exploración basal de las lesiones diana |
| Progresión | Aumento ≥20% en la suma de los diámetros de las áreas con actividad tumoral de las lesiones diana tomando como referencia el diámetro menor del área de captación basal previa al tratamiento |
| Cualquier lesión de nueva aparición >10mm con patrón radiológico típico de CHC o con crecimiento progresivo en sucesivas exploraciones | |
| Enfermedad estable | Lesión(es) que no cumplen criterios de respuesta parcial ni de progresión |
El tratamiento con Sorafenib puede presentar interacciones farmacológicas que deben tenerse en cuenta31:
- •
Interacción con fármacos anticoagulantes como warfarina y fenprocumona ya que se pueden ocasionar cambios en el INR medio32. Esta interacción requiere una monitorización más estrecha de la coagulación.
- •
Posible interacción con la administración concomitante de neomicina u otros antibióticos que causen alteraciones ecológicas importantes de la microflora intestinal, pudiendo originar una disminución de la biodisponibilidad de Sorafenib. En estos casos se debe valorar la necesidad real de su prescripción.
- •
Posible interacción con inductores de enzimas metabólicos: rifampicina, Hierba de San Juan, fenitoína, carbamacepina, fenobarbital y dexametasona, que pueden incrementar el metabolismo del Sorafenib, y reducir así las concentraciones plasmáticas del fármaco. Valorar la necesidad de prescribirlos así como sus posibles alternativas de substitución.
- •
Posible interacción con sustratos de CYP P2B6 y CYP2C8 como bupropiona, ciclofosfamida, efavirenz, ifosfamida, y metadona o paclitaxel, amodiaquina y repaglinida.
- •
Posible interacción con la digoxina y el litio, aumenta las concentraciones plasmáticas de ambos fármacos y por ello se requiere una monitorización más estrecha de sus niveles plasmáticos.
- •
Los inhibidores de la HMG-CoA reductasa, como las estatinas, pueden potenciar los efectos citotóxicos del Sorafenib33, por lo que es necesario valorar la necesidad real de su prescripción.
- •
Existe muy escasa bibliografía sobre la interacción con fármacos anti-HIV, por lo que se recomienda realizar un seguimiento conjunto con el infectólogo.
- •
La interacción con otros agentes antineoplásicos (gemcitabina, oxaliplatino) no ocasiona modificaciones farmacocinéticas34.
- •
Ante la falta de evidencia de la interacción con omeprazol, se recomienda indicarlo únicamente si es necesario.
El papel de Enfermería en el tratamiento de estos pacientes se enmarca en el ámbito de la consulta específica de CHC y en el Hospital de día, y tiene como objetivos principales: ofrecer apoyo a los pacientes reforzando la información previamente comunicada por el hepatólogo; establecer un «nexo de unión» entre los miembros del equipo multidisciplinar dedicado al tratamiento del CHC con el enfermo y su familia; y ofrecer apoyo psicológico al paciente y a su familia (a través de un diagnóstico inicial de la situación de las necesidades del paciente y su familia; mediante desarrollo de intervenciones como charlas, ayuda psicológica, resolución de problemas socio-familiares; etc.). Además es prioritario el papel del Servicio de Enfermería en la educación sanitaria específica sobre los posibles efectos adversos de Sorafenib, y su manejo a lo largo del tratamiento.
ConclusionesSorafenib es el tratamiento de elección de los pacientes con CHC avanzado. La selección rigurosa de los pacientes candidatos a ser tratados con Sorafenib, de acuerdo a los criterios descritos en este manuscrito, junto con un adecuado seguimiento del tratamiento e información al paciente y su entorno, permiten maximizar los beneficios y minimizar los efectos secundarios del tratamiento.
Un resumen de las recomendaciones básicas para el manejo del paciente con CHC avanzado con Sorafenib se muestra en la figura 5.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Ver tabla A1.
Child-Pugh
| La clasificación modificada Child-Pugh de severidad de enfermedad hepática se realiza de acuerdo al grado de ascitis, las concentraciones plasmáticas de bilirrubina y albúmina, el tiempo de protrombina, y el grado de encefalopatía | |||
| Parámetros | Puntos asignados | ||
| 1 | 2 | 3 | |
| Ascitis | Ausente | Leve | Moderada |
| Bilirrubina, mg/dl | 2–3 | >3 | |
| Albúmina, g/dl | >3,5 | 2,8–3,5 | <2,8 |
| Tiempo de protrombina | |||
| Segundos sobre el control | 1–3 | 4–6 | >6 |
| INR | <1,8 | 1,8–2,3 | >2,3 |
| Encelopatía | No | Grado 1–2 | Grado 3–4 |
| Una puntuación total de 5–6 es considerada grado A (enfermedad bien compensada); 7–9 es grado B (compromiso funcional significativo); y 10–15 es grado C (enfermedad descompensada). Estos grados se correlacionan con una sobrevida del paciente al año y a los 2 años. | |||
| Grado | Puntos | Sobrevida al año (%) | Sobrevida a 2 años (%) |
| A: enfermedad bien compensada | 5–6 | 100 | 85 |
| B: compromiso funcional significativo | 7–9 | 80 | 60 |
| C: enfermedad descompensada | 10–15 | 45 | 35 |
Clasificación pronóstica de la hepatología35,36.
Ver tabla A2.
ECOG Performance Status scale37
| Escala de estado funcional de la ECOG | |
| Grade | ECOG |
| 0 | Completamente activo, capaz de hacer todo lo que hacía antes de la enfermedad sin restricciones |
| 1 | Restringido en caso de actividad de esfuerzo, pero ambulatorio y capaz de hacer trabajos ligeros o de naturaleza sedentaria como, por ejemplo, el trabajo ligero en casa o en la oficina |
| 2 | Ambulatorio y capaz de cuidar de sí mismo pero incapaz de realizar cualquier actividad laboral. Despierto y activo más del 50% de las horas diurnas |
| 3 | Capaz de cuidar de sí mismo de forma limitada, permanece en la cama o en la silla más del 50% de las horas diurnas |
| 4 | Completamente incapacitado. No puede cuidar de sí mismo. Totalmente limitado en la cama o en la silla |
| 5 | Exitus |