La obesidad es una enfermedad multifactorial, crónica, progresiva y recidivante considerada un problema de salud pública a nivel mundial y un importante determinante de discapacidad y muerte. En España su prevalencia actual en población adulta se sitúa en el 24%, y se estima su incremento hasta el 37% en 2035. La obesidad aumenta la probabilidad de diversas enfermedades vinculadas a una mayor mortalidad, como diabetes, enfermedades cardiovasculares, hiperlipidemia, hipertensión arterial, enfermedad del hígado graso no alcohólico, varios tipos de cáncer o apnea obstructiva del sueño. Por otra parte, aunque la incidencia de enfermedad inflamatoria intestinal (EII) se está estabilizando en los países occidentales, su prevalencia supera ya el 0,3%. Paralelamente a lo que ocurre en la población general, la prevalencia actual de obesidad en pacientes adultos con EII se estima en el 15-40%. La obesidad en pacientes con EII podría comportar, además de su impacto sobre la discapacidad y la mortalidad ya conocido, una peor evolución de la EII y una peor respuesta a los tratamientos. El objetivo del presente documento, elaborado en colaboración por cuatro sociedades científicas implicadas en la atención médica de la obesidad grave y la EII, es establecer unas recomendaciones claras y concisas sobre las posibilidades terapéuticas de la obesidad grave en pacientes con EII. En el documento se establecen recomendaciones generales sobre el tratamiento dietético, farmacológico, endoscópico y quirúrgico de la obesidad grave en pacientes con EII, así como la evaluación pre y postratamiento.
Obesity is a multifactorial, chronic, progressive and recurrent disease considered a public health issue worldwide and an important determinant of disability and death. In Spain, its current prevalence in the adult population is about 24% and an estimated prevalence in 2035 of 37%. Obesity increases the probability of several diseases linked to higher mortality such as diabetes, cardiovascular disease, hyperlipidemia, arterial hypertension, non-alcoholic fatty liver disease, several types of cancer, or obstructive sleep apnea. On the other hand, although the incidence of inflammatory bowel disease (IBD) is stabilizing in Western countries, its prevalence already exceeds 0.3%. Paralleling to general population, the current prevalence of obesity in adult patients with IBD is estimated at 15-40%. Obesity in patients with IBD could entail, in addition to its already known impact on disability and mortality, a worse evolution of the IBD itself and a worse response to treatments. The aim of this document, performed in collaboration by four scientific societies involved in the clinical care of severe obesity and IBD, is to establish clear and concise recommendations on the therapeutic possibilities of severe or typeIII obesity in patients with IBD. The document establishes general recommendations on dietary, pharmacological, endoscopic, and surgical treatment of severe obesity in patients with IBD, as well as pre- and post-treatment evaluation.
La Organización mundial de la Salud (OMS) y la Federación Mundial de Obesidad (World Obesity Federation [WOF]) definen a la obesidad como una enfermedad compleja, multifactorial, crónica, recurrente y progresiva que se caracteriza por una acumulación anormal o excesiva de grasa que puede ser perjudicial para la salud1,2. La obesidad ha sido identificada como un problema de salud pública a nivel mundial y un importante determinante de discapacidad y muerte1.
Recientemente, la OMS ha publicado el World Obesity Atlas 2023 acerca del impacto de la obesidad. Según este informe, en España la prevalencia actual de obesidad en población adulta se sitúa en el 24%, y estima la prevalencia para el 2035 en del 37%. Además, reconoce que los costes relacionados con la obesidad y el sobrepeso en 2020 ascendieron a más de 29.784 millones de dólares, y estima que se incrementarán en un 47% hasta el año 2035, lo que equivaldrá al 2,4% del PIB español3.
De acuerdo a las recomendaciones de la OMS, para definir y diagnosticar la obesidad se utiliza el índice de masa corporal (IMC) expresado en kg/m2. En adultos, la OMS define sobrepeso como un IMC de 25,0 a 29,9 y obesidad como un IMC ≥30,0. Dentro de la obesidad, se diferencian tres clases: claseI (IMC 30-34,9), claseII (IMC 35-39,9) y claseIII (IMC ≥40). Sin embargo, el IMC presenta serias limitaciones y se está replanteando el enfoque actual del diagnóstico de la obesidad, orientándose hacia el porcentaje de grasa corporal, su distribución y la funcionalidad muscular4.
La obesidad aumenta la probabilidad de diversas enfermedades vinculadas a una mayor mortalidad. Un informe de la Unión Europea de 2016 considera la obesidad como la cuarta causa independiente de muerte y responsable del 10-13% de las muertes prematuras. Estas incluyen, entre otras, la diabetes tipo2 (DM2), las enfermedades cardiovasculares, la enfermedad renal crónica, la hiperlipidemia, la hipertensión arterial (HTA), la enfermedad del hígado graso no alcohólico, varios tipos de cáncer, la apnea obstructiva del sueño, la osteoartritis y la depresión5. El reciente estudio RESOURCE, una encuesta realizada en Francia, Alemania, Italia, España, Suecia y Reino Unido para evaluar las comorbilidades, el uso de recursos sanitarios y las estrategias de pérdida de peso de personas con obesidad, ha mostrado que más del 25% de las personas con obesidad presentan al menos tres comorbilidades de forma concomitante, siendo las más frecuentes DM2, HTA e hiperlipidemia6. El tratamiento específico de la obesidad que consigue una reducción de al menos el 10% del peso corporal total tiene un impacto significativo en la morbimortalidad. Además, la intervención exitosa sobre la obesidad puede prevenir hasta en un 80% el desarrollo de DM2, en un 55% la HTA, en un 35% la cardiopatía isquémica y aproximadamente en un 20% de cánceres en adultos7.
En los últimos años se han identificado más factores implicados en el desarrollo de la obesidad y se ha profundizado en cómo las hormonas intestinales, el tejido adiposo o la microbiota intestinal regulan el apetito y la saciedad en el hipotálamo. Además, sabemos que los factores genéticos juegan un papel fundamental en la determinación de la predisposición de un individuo al aumento de peso y estudios epigenéticos recientes han proporcionado herramientas muy útiles para comprender el aumento mundial de la obesidad8.
Epidemiología y relevancia clínica de la obesidad en la enfermedad inflamatoria intestinalLa incidencia y la prevalencia de la enfermedad inflamatoria intestinal (EII) están aumentando de forma acelerada y en paralelo con la epidemia mundial de obesidad9, sobre todo en los países recientemente industrializados cuyas sociedades han occidentalizado sus hábitos. Aunque la incidencia de EII se está estabilizando en los países occidentales, su impacto sigue siendo alto, ya que su prevalencia supera el 0,3%10. En España la incidencia de EII es superior a 16 casos/100.000 personas-año11. Diversos factores ambientales se han implicado en estas tendencias epidemiológicas: el tabaquismo, la mejora de los estándares de higiene, las infecciones y el uso de antibióticos, y factores dietéticos como las dietas ricas en grasas o bajas en fibra12,13.
Contrariamente a la elevada prevalencia de malnutrición que se observaba antaño en los pacientes con EII debido a la propia inflamación y a la malabsorción, la prevalencia actual de obesidad en pacientes con EII es considerable, estimándose que el 15-40% de los pacientes adultos con EII presentan obesidad y el 20-40% sobrepeso, sin diferencias según el tipo de EII9,12-16. Esta tendencia también se comparte en pacientes pediátricos17,18. Dos estudios transversales observaron que la prevalencia de obesidad gradoII-IV en la EII es del 1-4,4%16,19.
Esta elevada prevalencia de obesidad podría ser independiente de la propia EII, habiéndose relacionado con el cese de hábito tabáquico, la utilización de corticosteroides y el uso de fármacos biológicos20. Sin embargo, la obesidad en la adolescencia y en la primera edad adulta, así como la previa al embarazo, se han considerado un factor de riesgo para el desarrollo de enfermedad de Crohn (EC), pero no para el de colitis ulcerosa (CU), si bien estos datos son controvertidos21-25. La obesidad constituye un estado de inflamación crónica de bajo grado con aumento mantenido de la producción de mediadores inflamatorios. Más concretamente, el tejido adiposo central/visceral constituye un compartimento metabólicamente activo con un marcado patrón proinflamatorio y que podría predecir el riesgo de desarrollar EII mejor que la obesidad general determinada por el IMC22,26. Por otra parte, al igual que en la EII, la obesidad se ha asociado a disfunción de la barrera intestinal, translocación bacteriana, pérdida de la homeostasis inmune intestinal y disbiosis, que podrían también contribuir al desarrollo y a la perpetuación de la inflamación intestinal12,13.
Los datos sobre el impacto de la obesidad en la EII son contradictorios y limitados potencialmente por el uso del IMC12,15,24,27. De forma general, en estudios de diseño transversal la obesidad se ha asociado de manera variable a fenotipos menos agresivos de EII, con una menor prevalencia de complicaciones penetrantes pero con un riesgo comparable de estenosis y de complicaciones perianales19,24,27,28. Sin embargo, otros estudios muestran unos requerimientos terapéuticos mayores, cirugías más precoces, hospitalizaciones más largas y una mayor incidencia de complicaciones perianales y cáncer colorrectal, resultando en una mayor utilización de recursos sanitarios13,29-34. La obesidad central/visceral, específicamente, se ha asociado a un mayor riesgo de complicaciones penetrantes y estenosantes, un intervalo de tiempo más corto hasta la cirugía y un mayor riesgo de recurrencia posquirúrgica de la EC35,36. Específicamente la obesidad gradoIII se asocia con un mayor riesgo de actividad inflamatoria persistente con niveles de proteínaC reactiva más elevados en ausencia de inflamación, mayor riesgo de recidiva clínica y peor calidad de vida en pacientes con EII, pero no parece incrementar la necesidad de inmunomoduladores ni de agentes biológicos, ni de las tasas de hospitalización y de cirugía16,29.
La obesidad se ha asociado a una menor respuesta al tratamiento de forma general. Los pacientes con obesidad, en particular aquellos con obesidad gradoIII, presentan una menor probabilidad de recibir una terapia óptima adecuada al peso. En este sentido, se han descrito concentraciones subóptimas de los metabolitos de tiopurinas de forma más frecuente en pacientes con obesidad37, pero no en otras pequeñas moléculas como tofacitinib38,39. Probablemente por esta razón se ha descrito un mayor riesgo de fallo primario y pérdida secundaria de respuesta a algunos agentes biológicos, como los anti-TNF y anti-integrinas, independientemente del método de administración y de los regímenes de dosificación12,15,40-45, si bien estos hallazgos no se han corroborado en todos los estudios46,47. En el caso de ustekinumab, los pacientes con obesidad presentan niveles más bajos de fármaco pero sin repercusión en su eficacia clínica47. En cuanto a la seguridad, no se ha descrito un mayor riesgo de hospitalización, de cirugía ni de infecciones graves en pacientes con obesidad tratados con fármacos biológicos48,49. Por último, la cirugía abdominal en pacientes con obesidad es técnicamente más compleja, con un mayor tiempo operatorio y una mayor tasa de reconversión a cirugía abierta y riesgo de complicaciones postoperatorias50-53.
Cómo y cuándo evaluar la obesidad en pacientes con enfermedad inflamatoria intestinalLas peculiaridades de la asociación entre la obesidad y la EII residen en el alto riesgo de obesidad sarcopénica54, asociado a su vez con resistencia a insulina y síndrome metabólico. La pérdida de masa y de función muscular es multifactorial (ingesta dietética deficiente, hipercatabolismo proteico, malabsorción durante las fases activas de la enfermedad y falta de carga mecánica en el músculo)55. Además, los corticosteroides utilizados para el tratamiento de la EII favorecen el depósito selectivo de grasa visceral, así como una mayor pérdida neta de masa muscular56. La evaluación de la obesidad en pacientes con EII debe realizarse en la primera visita, y reevaluarse al menos anualmente. La adecuada evaluación de los pacientes con EII y obesidad debería incluir los siguientes aspectos:
- 1.
Diagnóstico de obesidad y sarcopenia mediante antropometría (cálculo del IMC, perímetro de la cintura), técnicas de composición corporal (por ejemplo, bioimpedancia eléctrica multifrecuencia) y test de funcionalidad (hand grip, test de la silla)56.
- 2.
Evaluación de enfermedad metabólica asociada a la obesidad (DM2, HTA, dislipemia, enfermedades cardiovasculares, hígado graso). Serán necesarias una historia clínica detallada y análisis de sangre que incluyan hemograma, glucemia basal, hemoglobina glucosilada, insulinemia, cálculo del índice de resistencia a la insulina, perfil hepático y cálculo de índices de enfermedad metabólica hepática57, hormonas tiroideas, estudio de anemias, proteínas, perfil lipídico y función renal (incluida microalbuminuria). Por último, deberían realizarse ecografía y elastografía hepáticas para evaluar el grado de esteatosis y fibrosis hepática58.
Hasta hace poco se ha considerado erróneamente que la obesidad era una condición relacionada con la elección voluntaria del estilo de vida y un problema de exceso de peso, por lo que las recomendaciones se basaban en «comer menos y moverse más»59-61. El tratamiento dietético sigue siendo la opción de primera línea en el manejo de la obesidad. El tratamiento dietético puede conseguir hasta un 5% en la reducción del peso corporal, aunque es necesario un seguimiento y un apoyo conductual de los pacientes para garantizar el mantenimiento del peso perdido; de lo contrario, puede recuperarse la mayor parte del peso en un plazo de 3 a 5años62-64. Esto se debe a que, cuando se realiza restricción calórica, se activa el mecanismo de adaptación metabólica (aumento de hambre y reducción de gasto energético en reposo) de forma proporcional a la velocidad de la pérdida de peso65.
En la actualidad, la Sociedad Española de Obesidad (SEEDO)66 recomienda el uso de la dieta hipocalórica equilibrada (basada en un déficit de 500-600kcal/día sobre el gasto energético en reposo medido mediante métodos directos)67 y la dieta mediterránea (baja en ácidos grasos saturados, trans y glúcidos simples, rica en fibra vegetal y ácidos grasos monoinsaturados)68. Existen otros tipos de dietas, como las disociativas, las excluyentes, las very low calory diet) que no disponen de evidencia científica suficiente en pacientes con EII.
La evidencia científica sobre la pérdida de peso intencional mediante dieta en pacientes con EII y obesidad es escasa. Se ha observado disminución en el peso corporal y la circunferencia de la cintura, así como una mejoría de la enfermedad metabólica hepática en pacientes con EII que siguieron dieta mediterránea durante seis meses, con un impacto positivo sobre la EII69. Estos efectos también se han comunicado en otras enfermedades inmunomediadas70. Sin embargo, no disponemos de evidencia específica sobre la eficacia y la seguridad de estrategias dietéticas supervisadas para el tratamiento de la obesidad gradoIII en pacientes con EII.
Las recomendaciones dietéticas para los pacientes con EII y obesidad, al igual que en pacientes con obesidad en general, se deben basar en objetivos claros de perder masa grasa y preservar masa magra, que incorporen proteína de alto valor biológico y control de la densidad energética de los alimentos, y sean variadas y fraccionadas. La falta de respuesta o la recuperación ponderal no deben atribuirse necesariamente a la falta de voluntad o de cumplimiento de los pacientes.
Recomendaciones sobre el tratamiento dietético de la obesidad en pacientes con enfermedad inflamatoria intestinal- -
En pacientes con EII y obesidad se recomienda un abordaje temprano de la obesidad para mitigar su impacto tanto sobre su salud en general como sobre la EII.
- -
El tratamiento dietético de la obesidad en pacientes con EII debe llevarse a cabo preferiblemente en la fase de remisión clínica de la EII.
- -
Es recomendable promover una pérdida de peso de manera gradual mediante estrategias dietéticas supervisadas y adaptadas e incrementando la actividad física.
- -
El soporte dietético para el tratamiento de la obesidad gradoIII en pacientes con EII debe llevarse a cabo en centros de referencia que puedan garantizar el abordaje nutricional y el seguimiento de la EII, siempre dentro de un equipo multidisciplinar.
- -
Se recomienda fomentar hábitos dietéticos saludables:
- ∘
Consumo de carnes magras y pescados blancos. Se recomienda el consumo de pescado 3-4 veces/semana y limitar a 2 veces/semana el consumo de carne roja.
- ∘
Evitar el consumo de bollería industrial y alimentos ultraprocesados.
- ∘
Incorporar a la dieta alimentos preferiblemente de origen vegetal. En función de la tolerancia digestiva, valorar el consumo de cereales integrales, frutas, verduras, hortalizas y legumbres.
- ∘
Fomentar el consumo de lácteos bajos en grasa.
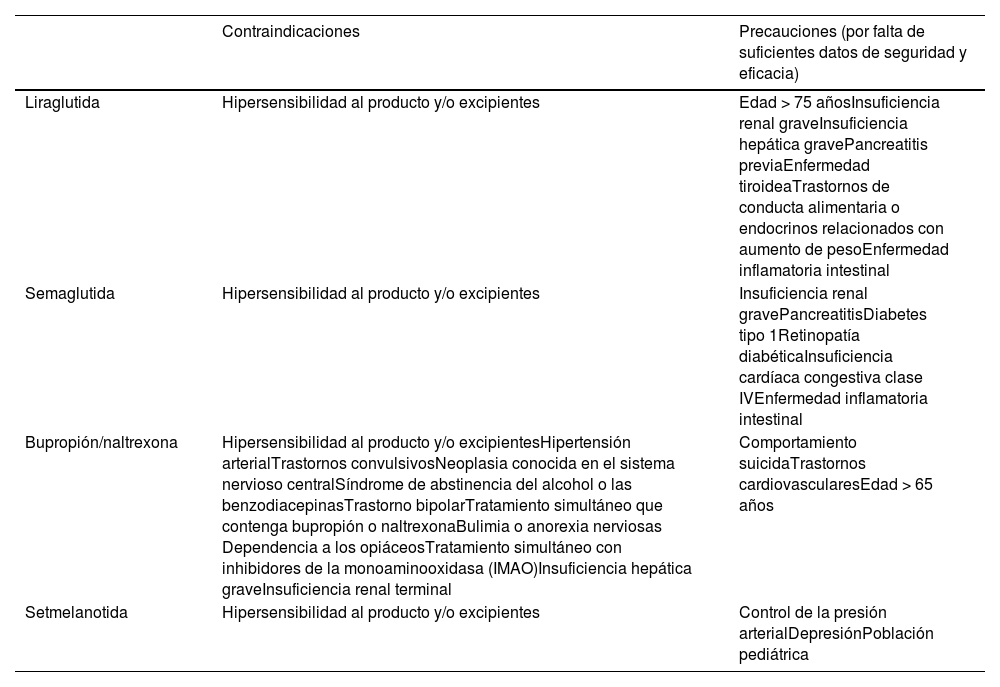
Entre los denominados medicamentos anti-obesidad (MAO), la European Medicines Agency (EMA) ha aprobado como tratamientos farmacológicos a largo plazo de la obesidad: orlistat, liraglutida, semaglutida, la combinación de bupropión y naltrexona, y setmenalotida71. Lorcaserina y la combinación fentarmina/topiramato, disponibles únicamente en Estados Unidos, no han sido aprobados por la EMA.
Los MAO están indicados en combinación con la modificación del estilo de vida para el control del sobrepeso y la obesidad en aquellas personas que han intentado mejorar su estilo de vida y continúan con un IMC ≥30kg/m2 o ≥27kg/m2 asociado a una comorbilidad relacionada con la obesidad como HTA, DM2, dislipemia o apnea del sueño. Las reacciones adversas y las contraindicaciones más comunes de estos fármacos se resumen en las tablas 1 y 2.
Reacciones adversas más comunes de los medicamentos anti-obesidad
| Liraglutida | Efectos gastrointestinales: náuseas, vómitos, diarrea, colelitiasis, pancreatitis aguda.Fatiga, mareoHipoglucemia cuando se usa con insulina o sulfonilureas |
| Semaglutida | Efectos gastrointestinales: náuseas, vómitos, diarrea, colelitiasis, pancreatitis agudaFatiga, mareoEmpeoramiento de la retinopatía diabéticaHipoglucemia cuando se usa con insulina o sulfonilureas |
| Bupropión/naltrexona | Efectos gastrointestinales: náuseas, estreñimiento, boca seca, dolor abdominalEfectos sistema nervioso: cefalea, somnolencia/insomnio, ansiedad, ideación suicida (rara), ansiedad, vértigoOtros: alopecia, fatiga, palpitaciones |
| Setmelanotida | Efectos gastrointestinales: náuseas, vómitosPiel: hiperpigmentación, alergia en el lugar de inyección, prurito, sequedad cutáneaOtros: fatiga, astenia, vértigo, cefalea |
Contraindicaciones generales de los medicamentos anti-obesidad
| Contraindicaciones | Precauciones (por falta de suficientes datos de seguridad y eficacia) | |
|---|---|---|
| Liraglutida | Hipersensibilidad al producto y/o excipientes | Edad > 75 añosInsuficiencia renal graveInsuficiencia hepática gravePancreatitis previaEnfermedad tiroideaTrastornos de conducta alimentaria o endocrinos relacionados con aumento de pesoEnfermedad inflamatoria intestinal |
| Semaglutida | Hipersensibilidad al producto y/o excipientes | Insuficiencia renal gravePancreatitisDiabetes tipo 1Retinopatía diabéticaInsuficiencia cardíaca congestiva clase IVEnfermedad inflamatoria intestinal |
| Bupropión/naltrexona | Hipersensibilidad al producto y/o excipientesHipertensión arterialTrastornos convulsivosNeoplasia conocida en el sistema nervioso centralSíndrome de abstinencia del alcohol o las benzodiacepinasTrastorno bipolarTratamiento simultáneo que contenga bupropión o naltrexonaBulimia o anorexia nerviosas Dependencia a los opiáceosTratamiento simultáneo con inhibidores de la monoaminooxidasa (IMAO)Insuficiencia hepática graveInsuficiencia renal terminal | Comportamiento suicidaTrastornos cardiovascularesEdad > 65 años |
| Setmelanotida | Hipersensibilidad al producto y/o excipientes | Control de la presión arterialDepresiónPoblación pediátrica |
Orlistat es un inhibidor de la lipasa pancreática, por lo que disminuye la absorción de grasas provenientes de la dieta. Su eficacia en relación con la pérdida de peso es escasa y su utilización como MAO ha caído en desuso.
Liraglutida es un análogo del péptido similar al glucagón tipo1 (GLP-1). El GLP-1 se libera en respuesta a la ingesta de alimentos y tiene receptores en el hipotálamo y en el intestino a través de los cuales aumenta la sensación de saciedad. Está contraindicado en cáncer de tiroides, neoplasias endocrinas múltiples de tipo2, pancreatitis y durante el embarazo y la lactancia. Los efectos adversos asociados más comunes son de tipo gastrointestinal, como náuseas y dolor abdominal. Su eficacia se sitúa en torno al 5-8% de pérdida del peso basal72. Se administra por vía subcutánea diariamente mediante una pluma precargada multidosis, incrementándose la dosis semanalmente según la tolerancia digestiva. Otro análogo de GLP-1 es semaglutida, con mecanismos de acción y contraindicaciones similares a liraglutida pero con una mayor eficacia, alcanzando pérdidas de peso en torno al 9-16% del peso inicial73. Se administra por vía subcutánea de forma semanal mediante una pluma precargada multidosis, incrementándose la dosis mensualmente según la tolerancia digestiva.
La combinación de naltrexona y bupropión actúa a nivel del hipotálamo estimulando la saciedad por un mecanismo dual: estimula la producción de propiomelanocortina y melanocortina, y bloquea los receptores endorfínicos y el placer asociado a comer. Su eficacia en relación con la pérdida de peso se sitúa alrededor del 5% del peso inicial74.
Por último, setmelanotida es un agonista selectivo de los receptores MC4 cerebrales que intervienen en la regulación del hambre, la saciedad y el gasto energético. Está indicado para el tratamiento de la obesidad monogénica debida al déficit de propiomelanocortina, de la proproteína convertasa subtilisin/kexin type1 (PCSK1) y del receptor de la leptina (LEPR)71.
Los datos publicados sobre el tratamiento farmacológico de la obesidad en la EII son escasos. Un estudio retrospectivo norteamericano reciente halló una baja tasa de prescripción MAO en pacientes con EII. De un total de 286.760 individuos adultos con EII, el 37% presentaban obesidad; entre ellos, únicamente se había prescrito MAO en el 2,8% durante el período de estudio. Las tasas de prescripción pasaron del 1,4% al 3,6% entre 2010 y 2019, reflejando una clara discrepancia entre el aumento exponencial de la obesidad en pacientes con EII y la prescripción de MAO, probablemente en relación con la falta actual de recomendaciones al respecto75.
Hasta la fecha, no se ha realizado ningún ensayo clínico aleatorizado (ECA) con MAO en pacientes con EII. Por tanto, no es posible formular indicación específica alguna al respecto y las recomendaciones deben basarse en el mecanismo de acción de los fármacos, en los efectos adversos conocidos y en los pocos datos disponibles en este escenario.
La European Society for Clinical Nutrition and Metabolism (ESPEN) y la United European Gastroenterology (UEG) han publicado recientemente sus recomendaciones conjuntas sobre el manejo de la obesidad en pacientes con enfermedades digestivas76. En ellas se considera que cualquiera de los fármacos anteriormente descritos, excepto orlistat, puede ser utilizado en pacientes con EII. Orlistat, por su mecanismo de acción, puede producir síntomas gastrointestinales como aumento del número de deposiciones, urgencia, incontinencia y esteatorrea marcada, por lo que se contraindica en pacientes con malabsorción y no se recomienda en pacientes con EII. Liraglutida podría afectar positivamente la homeostasis del sistema inmune intestinal77,78; sin embargo, al igual que con semaglutida, no se dispone de datos acerca de la pérdida de peso inducida con estos fármacos en pacientes con EII y obesidad. Además, un estudio poblacional danés comparó la estimación de incidencia de un objetivo combinado (utilización de corticoides, anti-TNF, cirugía o ingreso hospitalario) en pacientes con EII y DM2 según se hubiesen tratado con análogos GLP-1 u otros antidiabéticos, observando una menor incidencia del objetivo combinado en los tratados con análogos GLP-1, sugiriendo un posible impacto positivo sobre la evolución de la EII79.
Un estudio prospectivo de 47 pacientes con EII activa y refractaria al tratamiento médico convencional mostró que naltrexona reduce la actividad clínica y mejora los hallazgos endoscópicos80. Actualmente está en marcha un ECA en pacientes con EC leve-moderada que tiene como objetivo evaluar la eficacia de la naltrexona en inducir remisión clínico-endoscópica81. Aunque estos datos respaldarían la seguridad de naltrexona en pacientes con EII, no aportan evidencia sobre su eficacia en cuanto a la pérdida de peso. Bupropión también se ha asociado a remisión clínica en algunos casos con EC descritos en la literatura82,83, sin describirse tampoco su efecto sobre la pérdida de peso.
Recomendaciones sobre el tratamiento farmacológico de la obesidad en pacientes con enfermedad inflamatoria intestinal- -
Los MAO actualmente pueden considerarse en pacientes con un IMC ≥30kg/m2 o un IMC ≥27kg/m2 asociado a comorbilidades relacionadas con la obesidad como HTA, DM2 o apnea del sueño.
- -
Antes de iniciar el tratamiento de la obesidad con MAO, se recomienda que el paciente haya permanecido con la EII en remisión clínica durante un periodo mínimo de 6 meses.
- -
Las contraindicaciones generales a los tratamientos con MAO en pacientes con EII son las mismas que las establecidas para pacientes sin EII.
- -
En pacientes con EII se pueden utilizar MAO a excepción de orlistat, por su mecanismo de acción y por los efectos adversos gastrointestinales asociados, sin existir recomendación a favor de ningún fármaco específico contra la obesidad en estos pacientes, dada la falta de estudios controlados en pacientes con EII. En estos pacientes parece razonable que la prescripción y el seguimiento de estos tratamientos se realice en centros de referencia dentro de un equipo multidisciplinar que pueda garantizar el correcto seguimiento del tratamiento y de la EII.
El tratamiento endoscópico de la obesidad se posiciona habitualmente en aquellos casos con respuesta insuficiente al tratamiento exclusivamente médico y no candidatos al tratamiento quirúrgico; por tanto, como procedimiento transoral y endoluminal debe posicionarse entre el manejo clínico y el quirúrgico84-86. Los requerimientos generales para la realización de estas técnicas se especifican en la tabla 3.
Requerimientos generales para el tratamiento endoscópico de la obesidad
| Dependientes del paciente | Complemento al tratamiento dietético con valoración favorable por los Servicios de Nutrición-Dietética y/o EndocrinologíaCapacidad para comprender los mecanismos por los que se pierde peso tras el tratamiento endoscópico.Aceptación y entendimiento de los objetivos del tratamiento (muchas veces no es alcanzar el peso ideal u óptimo, sino un peso saludable)Compromiso de adhesión al seguimiento a realizar |
| Dependientes del grado de obesidad | Sobrepeso gradoII (casos seleccionados)Obesidad moderada gradoI (IMC 30-34,9 kg/m2)Obesidad severa gradoII (IMC 35-39,9 kg/m2) sin enfermedades metabólicas asociadas o <3 comorbilidades mayoresObesidad gradoII (IMC 35-39,9 kg/m2) con >3 comorbilidades mayores y en obesidad grave (IMC >40 kg/m2) cuando:• El paciente rechaza la cirugía• Contraindicación para la cirugía• En el período pre-cirugía, para disminuir la morbilidad quirúrgica (especialmente IMC >50 kg/m2) |
| Dependientes del equipo médico | Necesidad de unidad multidisciplinar en el tratamiento de la obesidadExperiencia clínica y técnica de cada centroDisponibilidad permanente de Servicio de Urgencias en Endoscopia y Cirugía bariátricas |
Como tratamiento de primera línea estaría indicado en casos seleccionados de sobrepeso, en obesidad gradoI y en la obesidad gradoII con menos de tres comorbilidades. También puede indicarse como alternativa en pacientes con obesidad gradoII con comorbilidades y obesidad gradoIII que rechacen la cirugía o en los que esté contraindicada. Por último, puede constituir una opción en casos de súper-obesidad (IMC >50kg/m2) como terapia puente a una posterior cirugía bariátrica. En la tabla 4 se resumen las principales contraindicaciones del tratamiento endoscópico de la obesidad.
Contraindicaciones generales del tratamiento endoscópico de la obesidad
| Generales |
| Absolutas |
| Pacientes no colaboradores o con incapacidad para entender los objetivos y seguir las normas establecidas en el protocolo |
| Enfermedades sistémicas que impidan un correcto seguimiento |
| Contraindicación psicológico-psiquiátrica en enfermedades psiquiátricas mayores |
| Toxicomanías, alcoholismo y/o drogadicción activos |
| Embarazo (actual o en el siguiente año) y lactancia |
| Contraindicación absoluta anestésica |
| Negación del paciente a firmar el consentimiento, después de haber recibido toda la información, tanto oral como escrita |
| Relativas |
| Tratamiento con fármacos anticoagulantes (cuando no puedan suspenderse) y valorar en casos de fármacos gastrolesivos o antiagregantes |
| Alteración de la coagulación sanguínea (cuando no sea reversible) |
| Contraindicación psicológico-psiquiátrica en enfermedades psiquiátricas menores |
| Causas hormonales, endocrinas o genéticas de la obesidad |
| Ámbito social-familiar desfavorable |
| Digestivas |
| Absolutas |
| Patología esofagogástrica activaa: |
| • Inflamatoria: esofagitis severa, úlcera gástrica y/o duodenal, enfermedad de Crohn |
| • Vascular: lesiones potencialmente sangrantes (varices, angiomas, angiectasias) |
| • Neoplasia |
| Alteraciones anatómicas: hernia de hiato grande (principalmente en balones y POSE) o estenosis u oclusión digestiva |
| Alergia a alguno de los componentes implantables |
| Centros sin experiencia, acreditación ni posibilidad de solucionar complicaciones |
| Las propias de una gastroscopia convencional o sedación/anestesia |
| Relativas |
| Algunas alteraciones anatómicas del tracto digestivo superior |
| Radioterapia abdominal previa |
En cualquier caso, debe realizarse una valoración previa individualizada por un equipo multidisciplinar, incluyendo evaluación dietética y/o endocrinológica, psicológica, anestésica y endoscópica. Además, se considera desaconsejable realizar estas técnicas en centros que no dispongan de una experiencia mínima acreditada o posibilidad de subsanar potenciales complicaciones.
En la tabla 5 se muestran las técnicas actualmente disponibles para el tratamiento endoscópico de la obesidad. Entre ellas, las más desarrolladas son los balones intragástricos y los sistemas de sutura. El balón intragástrico es un dispositivo intraluminal ocupante de espacio que actúa mediante reducción del volumen y retraso del vaciamiento gástricos y la regulación de las hormonas gastrointestinales87-90. Existen más de 15 modelos comercializados que difieren en duración, morfología, material, tipo y volumen de relleno, capacidad de reajuste y requerimiento endoscópico para su introducción/retirada86,91. Globalmente consiguen una pérdida media de peso >10% en >75% de pacientes tratados92,93 y una mejoría significativa de las comorbilidades relacionadas con el síndrome metabólico94-97.
Principales posibilidades actuales en el tratamiento endoscópico de la obesidad
| Balones y prótesis gástricas | Balones intragástricos estándarBalones intragástricos con sistema antimigraciónBalones intragástricos ajustablesBalones intragástricos rellenos de aireBalones intragástricos ingeribles |
| Inyección de sustancias | Toxina botulínicaAÁcido hialurónico |
| Sistemas de sutura | Gastroplastia vertical endoluminal y variantesCirugía primaria endoluminal de la obesidadGastroplastia vertical «en manga»Transoral endoscopic restrictive systemEndoZipEndomina |
| Técnicas malabsortivas | EndobarrierAspire AssistValenTxDuodenal mucosa resurfacing |
| Otras | Neuroelectroestimuladores - marcapasos gástricoSistema ButterflyMembranas tubularesNOTESMagnets - anastomosis |
A pesar de que el balón intragástrico ha sido el más utilizado en la práctica clínica y el más estudiado para el tratamiento de la obesidad, no existen estudios que valoren la eficacia y la seguridad en pacientes con EII. De hecho, la presencia de afectación esofagogastroduodenal de la EC ha representado clásicamente una contraindicación absoluta para esta técnica86,98,99. Solo existe un caso publicado sobre la exacerbación de CU en un paciente en tratamiento con mesalazina a quien se colocó un balón intragástrico, obligando a su retirada precoz, habiéndose relacionado con una liberación inadecuada del fármaco secundaria al enlentecimiento del vaciamiento gástrico100.
Son diversos los sistemas de sutura disponibles en la actualidad. El método POSE inicial, con el que se creaban 8-10 pliegues transmurales en fundus gástrico y otros 2-4 en cuerpo distal, ha dado paso al POSE 2.0™ (endomanga) que realiza 16-20 plicaturas en curvatura mayor de cuerpo gástrico, reduciendo el volumen gástrico y acortándolo en longitud. Estas técnicas ejercen un efecto mecánico restrictivo, disminuyen la capacidad de ingesta e inducen cambios hormonales que se traducen en un aumento precoz de la saciedad. Se ha descrito una pérdida media del 15-18% del peso corporal total en 6-12meses101,102. La tasa de efectos adversos se sitúa en el 1-5%, siendo la hemorragia autolimitada por la misma presión de las suturas la más frecuente103-106. La gastroplastia vertical endoscópica (Endosleeve, Sistema Apollo®) consiste en la realización de 4-6 suturas continuas transmurales en curvatura mayor de cuerpo gástrico, consiguiendo una restricción gástrica tubular107. Se ha descrito una pérdida media del 18% del peso corporal total a los 18meses108-110, manteniendo una pérdida del 16% a los cinco años con disminución de las comorbilidades asociadas111-113. La tasa de complicaciones descrita se sitúa en el 1-2%, principalmente hemorragia digestiva, dolor abdominal y colecciones perigástricas108-110.
En la actualidad no existe evidencia de calidad con respecto a la eficacia y la seguridad de otros procedimientos endoscópicos para la pérdida de peso en pacientes con EII y obesidad gradoIII. Pugliese et al.114 reportaron un caso de una paciente con CU en remisión clínica bajo tratamiento con infliximab sometida a la realización de una endomanga endoscópica con buenos resultados en términos de pérdida ponderal y sin impacto negativo sobre su EII.
Recomendaciones sobre el tratamiento endoscópico de la obesidad en pacientes con enfermedad inflamatoria intestinal- -
La indicación de tratamiento endoscópico para la obesidad gradosII yIII en pacientes con EII debe seguir, en general, los mismos criterios que los establecidos para pacientes sin EII.
- -
Antes de considerar cualquier procedimiento endoscópico para el tratamiento de la obesidad, se recomienda que el paciente haya permanecido con la EII en remisión clínica durante un periodo mínimo de 6meses.
- -
Las contraindicaciones generales a los tratamientos endoscópicos para la obesidad gradosII yIII en pacientes con EII son muy similares a las establecidas para pacientes sin EII.
- -
Las técnicas endoscópicas bariátricas en pacientes con EII y obesidad gradoIII están contraindicadas cuando la EII u otra enfermedad sistémica asociada pueda impedir un correcto seguimiento, presente signos de actividad durante los últimos 6meses, antecedente de EII con afectación esofagogástrica o de intestino delgado proximal y sospecha y/o existencia de estenosis/oclusión digestiva.
- -
Los tratamientos endoscópicos para la obesidad en pacientes con EII deben realizarse en centros de referencia con experiencia clínica y técnica, y disponibilidad de manejo conjunto del tratamiento endoscópico bariátrico y de la EII.
- -
Los pacientes con EII a los que se ha colocado un balón intragástrico deben recibir ininterrumpidamente tratamiento con inhibidores de la bomba de protones mientras el balón persista colocado.
- -
En los pacientes con EII a los que se ha colocado un balón intragástrico que presenten un brote de actividad de la EII, debe valorarse su retirada según la afectación y la gravedad del brote.
- -
En los pacientes con EII y obesidad gradoIII en los que se plantee la realización de tratamiento endoscópico bariátrico, la sutura endoscópica (endomanga o endosleeve) debería ser la técnica recomendada como alternativa a la cirugía al ser mínimamente invasiva, segura y reversible.
La cirugía bariátrica y metabólica (CBM) representa el tratamiento más efectivo para pacientes con obesidad grave sin respuesta a tratamiento conservador (dieta, ejercicio, modificación del comportamiento o tratamiento farmacológico). Consigue una pérdida de peso adecuada y mantenida en el tiempo en un porcentaje muy elevado de pacientes, con una tasa elevada de resolución de las comorbilidades, y mejorando significativamente su calidad de vida y la supervivencia, aunque un porcentaje importante de pacientes recuperan el peso perdido tras el tratamiento quirúrgico115,116.
En 1991, el comité de expertos del National Institutes of Health (NIH) convocó una conferencia de consenso tras la cual establecieron las indicaciones de cirugía de la obesidad que fueron aceptadas por las diferentes sociedades quirúrgicas y en las que, durante muchos años, se han apoyado la mayor parte de los equipos quirúrgicos bariátricos117. Estas indicaciones fueron posteriormente revisadas y aceptadas por la Sociedad Española de Cirugía de la Obesidad (SECO) en las declaraciones de Salamanca118 y de Vitoria-Gasteiz119. En 2022, la American Society for Metabolic and Bariatric Surgery (ASMBS) y la International Federation for the Surgery of Obesity and Metabolic Disorders (IFSO) elaboraron un nuevo documento que actualiza las indicaciones previamente descritas, destacando las siguientes120:
- -
La CBM está recomendada para los individuos con IMC ≥35kg/m2, independientemente de la presencia, ausencia o gravedad de las comorbilidades asociadas.
- -
La CBM se considerará en individuos con enfermedad metabólica e IMC entre 30 y 34,9kg/m2 que no alcancen una pérdida de peso suficiente o mantenida, o mejoría de sus comorbilidades mediante tratamientos no quirúrgicos.
- -
Los resultados a largo plazo de la CBM demuestran de manera consistente su seguridad y su eficacia, así como la durabilidad de esta en el tratamiento de la obesidad grave y sus comorbilidades.
- -
No existe límite de edad superior para la CBM. Los individuos ancianos que se puedan beneficiar de CBM deben ser considerados para la misma tras un estudio cuidadoso de sus comorbilidades y de su fragilidad.
- -
Mediante una selección adecuada, el colectivo infanto-juvenil puede ser considerado posible candidato para CBM.
En el caso de los pacientes con EII y obesidad, las recientes guías europeas establecen que la CBM está indicada en caso de IMC ≥40kg/m2 o ≥35kg/m2 asociado a comorbilidades y con fallo previo a medidas anti-obesidad dietéticas y farmacológicas76. Una revisión sistemática reciente mostró que la CBM es segura y eficaz para los pacientes con EII y obesidad, consiguiendo una pérdida de peso significativa tanto a los 6meses como a los 12meses de la intervención121. Esta pérdida de peso reduce la inflamación en los pacientes con EII y, por tanto, puede mejorar el curso de su enfermedad, así como de las comorbilidades asociadas, por lo que la EII no es una contraindicación de CBM122,123.
Desde sus inicios, la CBM ha evolucionado técnicamente aportando, en la actualidad, una fuerte evidencia en cuanto a eficacia y seguridad124. Siguiendo las recomendaciones de consenso de la Asociación Española de Cirujanos (AEC) y la SECO125, la mortalidad de la cirugía bariátrica debe ser inferior al 0,5%. La tasa global de morbilidad precoz (los primeros 30días) se sitúa por debajo del 7% en los centros con mayor experiencia (siendo dependiente de la técnica quirúrgica, así como del volumen de procedimientos realizados). Los resultados de pérdida de peso de la CBM se mantienen durante años después de la cirugía de forma consistente en cifras mayores de un 60% de pérdida de exceso de peso, con algunas variaciones en función de la cirugía realizada120.
Actualmente, la cirugía bariátrica debe realizarse mediante cirugía mínimamente invasiva (laparoscopia y/o robótica), consiguiendo, de esta manera, ventajas para el paciente en cuanto a recuperación precoz y menor número de complicaciones postoperatorias. De forma funcional, se podrían dividir las técnicas quirúrgicas en restrictivas puras, mixtas (con componente restrictivo e hipoabsortivo) y mixtas con predominio malabsortivo. Dentro de las primeras (donde el objetivo principal es la reducción del volumen gástrico), la gastrectomía vertical laparoscópica y la banda gástrica ajustable (cada vez en porcentaje menor) conforman los principales procedimientos. Como técnicas mixtas (donde además de la restricción gástrica se realiza una derivación intestinal destinada a disminuir la absorción principalmente de grasas), el by-pass gástrico laparoscópico, así como en by-pass de una anastomosis (BAGUA), son sus principales representantes. Como técnicas mixtas con predominio malabsortivo, la derivación biliopancreática de Scopinaro, así como el cruce duodenal, se ven desplazados actualmente por el SADIs (Single Anastomosis Duodeno-Ileal Bypass with Sleeve Gastrectomy).
Actualmente no existen contraindicaciones absolutas para la CMB más allá del excesivo riesgo quirúrgico, la presencia de una expectativa de vida inferior a 5años o un proceso oncológico que no haya estado en remisión completa más de 5años o bien un proceso infeccioso grave activo, cirrosis hepática descompensada, depresión grave o psicosis no tratadas, trastornos alimentarios no controlados ni tratados, consumo patológico activo de drogas y alcohol, coagulopatías graves y, fundamentalmente, la imposibilidad de cumplir los requisitos nutricionales, especialmente la sustitución vitamínica de por vida. Asimismo, no existen límites de edad para la CMB; sin embargo, la fragilidad se considera el mejor predictor de la aparición de complicaciones. Conviene recordar que la CMB es un tratamiento eficaz para la obesidad clínicamente grave en pacientes que necesitan otra cirugía especializada, como artroplastia articular, reparación de patología de la pared abdominal o trasplante de órganos. Del mismo modo, no existen contraindicaciones totales respecto a la elección de la técnica quirúrgica, si bien suelen evitarse las técnicas restrictivas en pacientes con enfermedad por reflujo gastroesofágico grave, esófago de Barrett, trastornos motores esofágicos o hernia hiatal de gran tamaño. En el caso de las técnicas hipoabsortivas o mixtas, la presencia enfermedades que alteren la absorción o la hepatopatía descompensada suelen considerarse habitualmente como contraindicaciones126.
En pacientes seleccionados y con EII controlada la CBM es segura, con baja tasa de complicaciones postoperatorias (comparables a la de pacientes sin dicha enfermedad) y efectivas en relación con buena pérdida de peso a los 12meses (siendo algo mejor para el by-pass gástrico que para las técnicas restrictivas). En relación con los pacientes con EII, un estudio poblacional americano evaluó el tipo de CBM realizada en pacientes con EII y obesidad, describiendo que en el 48% de los pacientes se realizó una gastrectomía tubular, en el 35% un by-pass gástrico en Y de Roux y en el 17% la banda gástrica123. Sin embargo, no se dispone de ECA ni de estudios prospectivos que comparen las diferentes técnicas quirúrgicas bariátricas en pacientes con EII. La evidencia científica actual en relación con el fenotipo, las características clínicas de la EII y el impacto de la CBM sobre el curso y los requerimientos terapéuticos de la EII se basan en escasos casos clínicos reportados.
Existen múltiples series y revisiones publicadas acerca de las características de los pacientes con EII y obesidad sometidos a CBM, así como de su eficacia y seguridad127-137. El tipo de EII más frecuentemente sometida a CBM es la EC, contando con aproximadamente dos tercios de los casos. En el caso de la EC, la localización de la enfermedad es predominantemente ileocolónica y de fenotipo inflamatorio o estenosante. El procedimiento quirúrgico más frecuentemente utilizado es la gastrectomía tubular. Dado que aproximadamente la mitad de los pacientes con EC precisarán en algún momento de su evolución una resección intestinal (principalmente con resección de válvula ileocecal e íleon terminal), parece razonable evitar la realización de CBM malabsortivas, recomendándose técnicas quirúrgicas restrictivas, siendo la técnica de elección la gastrectomía tubular. Además, la posibilidad de desarrollo de complicaciones intestinales propias de la enfermedad, como estenosis, abscesos o fístulas, tanto a nivel del intestino excluido como del intestino «funcional» en caso de técnicas malabsortivas, podría constituir un importante problema de manejo y de evaluación. En pacientes con CU existe una mayor proporción de casos a los que se ha practicado gastrectomía en Y de Roux.
En un estudio reciente norteamericano realizado en dos centros de referencia se evaluó la evolución clínica de la EII en un grupo de pacientes con obesidad grave; aquellos pacientes sometidos a CBM presentaron una menor tasa de complicaciones relacionadas con la EII en comparación con aquellos que no se operaron, sugiriendo un impacto positivo de la pérdida de peso sobre la evolución de la enfermedad136. Reenaers et al.134, en un estudio multicéntrico francés, compararon la eficacia y la seguridad de la CBM en pacientes obesos con y sin EII concomitante, observando que no existieron diferencias en cuanto a la pérdida de peso, el desarrollo de anemia, el déficit de hierro o de cobalamina en el seguimiento entre ambos grupos de estudio. Bazerbachi et al.133, en un estudio realizado a partir de un registro de pacientes ingresados entre 2011 y 2013, compararon el riesgo de complicaciones precoces y tardías tras CBM en un total de 314.864 pacientes obesos, de los cuales 790 con EII; el estudio mostró que la única diferencia en cuanto a complicaciones posquirúrgicas fue una mayor tasa de obstrucción de intestino delgado en los pacientes con EII. Finalmente, un metaanálisis reciente comparó la seguridad de la gastrectomía tubular con el by-pass en Y de Roux en 168 pacientes con EII, demostrando una tasa de complicaciones mucho mayor en la segunda (45,6% frente a 21,6%), a expensas tanto de complicaciones precoces como tardías137.
Recientemente se ha descrito la posibilidad de desarrollar una EII posteriormente a la realización de CBM. Hasta la fecha se han reportado 17 casos de CU, 60 de EC y 3 de EII inclasificable138-147. La mayor serie publicada incluyó 44 casos incidentes de EII (31 con EC) de un registro prospectivo americano de 3.709 pacientes sometidos a CBM146. Del total de casos reportados, se han podido inferir las características basales de 73 pacientes148, con una mediana de IMC previo a la CBM de 47 y una mediana de edad de 45años. El by-pass en Y de Roux fue el procedimiento quirúrgico más utilizado (80% de los casos). Los síntomas potencialmente relacionados con la EII (diarrea, dolor abdominal y pérdida de peso no explicada por el procedimiento bariátrico) ocurrieron entre 1mes y 16años posteriores al procedimiento quirúrgico. Fenotípicamente, la localización más común en la EC fue ileocólica (44%) e ileal (31%), y la extensión de la CU fue extensa en el 50% e izquierda en el 25%. Los pacientes con EC precisaron mayoritariamente (90%) terapias farmacológicas avanzadas (25% tiopurinas y 32% biológicos), y solo el 11% requirieron cirugía en el seguimiento.
Los casos reportados sugieren una posible asociación entre CBM y desarrollo de EII de novo, particularmente de EC, postulándose como posibles mecanismos fisiopatológicos precipitantes la disbiosis intestinal y la liberación de citocinas procedente del tejido adiposo secundarios a los cambios anatómicos y a la pérdida de peso masiva, en pacientes genéticamente susceptibles. Otra hipótesis sugerida es la existencia de una EII en fase preclínica previamente a la CBM. La aparición de una EII tras la CBM y los mecanismos que la explican aún no están lo suficientemente aclarados y no se puede descartar que se deba a la propia obesidad o a una cuestión del azar.
Finalmente, es importante recordar que la CBM puede inducir deficiencias nutricionales, especialmente a corto y a medio plazo, por lo que se deben seguir las recomendaciones establecidas por la SEEDO en relación con la suplementación sistemática tras la CBM149, que adquiere una relevancia todavía mayor en el caso de los pacientes con EII subyacente.
Recomendaciones sobre el tratamiento quirúrgico de la obesidad en pacientes con enfermedad inflamatoria intestinal- -
En pacientes con EII y obesidad, la cirugía bariátrica está indicada en caso de IMC ≥40kg/m2 o ≥35kg/m2 asociado a comorbilidades y con fallo previo a medidas anti-obesidad dietéticas y farmacológicas.
- -
Los pacientes con EII candidatos a cirugía bariátrica deben encontrarse sin enfermedad activa en el momento de la cirugía, así como en el mejor estado nutricional posible, con la intención de minimizar las complicaciones postoperatorias.
- -
La cirugía bariátrica para el tratamiento de la obesidad en pacientes con EII debe llevarse a cabo en centros de referencia con experiencia en cirugía bariátrica y en los que pueda realizarse el seguimiento de la EII, siempre dentro de un equipo multidisciplinar.
- -
En pacientes con colitis ulcerosa puede realizarse cualquier tipo de cirugía bariátrica. En pacientes con un mayor riesgo de colectomía, las técnicas restrictivas son de elección.
- -
En pacientes con enfermedad de Crohn se recomienda una detallada evaluación de la localización de la enfermedad antes de la cirugía para descartar formas de afectación gastrointestinal alta mediante enteroRM o cápsula endoscópica.
- -
En pacientes con enfermedad de Crohn se recomienda evitar técnicas con componente malabsortivo. La gastrectomía vertical laparoscópica constituye una buena opción, ya que preserva las opciones quirúrgicas futuras al no alterar la anatomía intestinal.
- -
Tras la cirugía bariátrica deben seguirse las recomendaciones existentes sobre suplementación y monitorización de nutrientes.
El manejo del paciente con EII y obesidad grave debe seguir un enfoque similar a los pacientes sin EII. Se recomienda derivar a la unidad multidisciplinar especializada en obesidad aquellos pacientes con EII y un IMC ≥35kg/m2, al menos, para un abordaje personalizado de las opciones terapéuticas, así como los casos con IMC ≥30kg/m2 con enfermedad metabólica asociada (fundamentalmente la enfermedad hepática por depósito graso y la DM2) u otras complicaciones de la obesidad (reflujo gastroesofágico, artropatía —en particular osteoartritis de rodilla—, apnea obstructiva del sueño).
Cuando los pacientes proceden de atención primaria, se utilizarán los criterios de derivación y circuitos propuestos por SEEDO-SEMERGEN150. Asimismo, es recomendable la participación de todos los profesionales implicados en la atención de estos pacientes en los comités multidisciplinares en los que se diseñe la estrategia terapéutica.
Teniendo en cuenta que la obesidad es una enfermedad crónica y recurrente y que en su manejo se debe promover la toma de decisiones compartidas, se recomienda aplicar la «estrategia de las 5 A» (del inglés ask, assess, advise, agree, and assist [preguntar, evaluar, aconsejar, acordar y ayudar]). Durante este proceso es recomendable evitar enfoques simplistas del origen de la enfermedad o sin evidencia científica que los sustente, así como la estigmatización de los pacientes.
Así, la evaluación de las opciones terapéuticas de la obesidad grave en los pacientes con EII se hará conforme a las guías de práctica clínica vigentes120,151,152 de manera personalizada, teniendo en cuenta los riesgos/beneficio en el contexto de la EII (impacto potencial sobre la evolución de la enfermedad, riesgo de malnutrición, sarcopenia asociada, etc.) previamente mencionados.
Del mismo modo, todos los pacientes que sean diagnosticados de EII durante el proceso de evaluación previa a cirugía bariátrica o que hayan sido remitidos para tratamiento de la obesidad y no sigan controles o no hayan sido evaluados recientemente de su EII, deben ser evaluados por una unidad asistencial especializada en EII. Con la escasa evidencia disponible y con el objetivo de minimizar el riesgo de complicaciones asociadas al tratamiento de la obesidad, sería necesario que el paciente con EII y obesidad se encuentre en remisión clínica, biológica y endoscópica/morfológica como mínimo 6meses antes de someterse a tratamiento endoscópico o CBM. Por tanto, parece razonable recomendar que el paciente durante los 6-12meses previos al procedimiento endoscópico o quirúrgico se mantenga con: 1)ausencia de síntomas digestivos relacionados con su EII (fundamentalmente en lo que se refiere a ritmo deposicional y dolor abdominal en la EC y rectorragia y número de deposiciones en la CU), y 2)normalidad de marcadores biológicos (calprotectina fecal o proteínaC reactiva). Asimismo, en los 6meses previos a la realización del tratamiento de la obesidad (farmacológico, endoscópico o quirúrgico) debe constatarse la ausencia de lesiones inflamatorias activas en las pruebas de imagen (colonoscopia en caso de afectación del colon o del íleon terminal y enteroRM o ecografía intestinal en intestino delgado).
Posteriormente a la realización del procedimiento endoscópico o CBM se recomienda una monitorización estrecha con una primera evaluación clínico-biológica a los 3meses del procedimiento. En este sentido, debe tenerse en cuenta que existen escasos datos sobre el impacto de la CBM o los tratamientos endoscópicos sobre los niveles de calprotectina fecal. En la EC se ha descrito un incremento inmediato de la calprotectina fecal tras la resección ileocólica que suele normalizarse a partir de los 3meses de la cirugía153, por lo que debe tenerse en cuenta si se utiliza este biomarcador en la monitorización precoz del paciente. Por otra parte, un estudio reciente efectuado en 30 pacientes sometidos a by-pass en Y de Roux por obesidad (sin EII conocida) evaluó distintos biomarcadores plasmáticos y fecales antes y 6meses después de la CBM. Entre los biomarcadores fecales se determinaron los niveles de calprotectina, demostrándose un incremento significativo a los 6meses (mediana de 38μg/g basales, 297μg/g a los 6meses)154. Sin embargo, no se disponía de evaluación endoscópica ni monitorización posterior.
Recomendaciones sobre la evaluación de tratamiento de la obesidad grave en pacientes con enfermedad inflamatoria intestinal- -
Los pacientes con EII y un IMC ≥35kg/m2, así como aquellos con IMC ≥30kg/m2 y enfermedad metabólica asociada, deben derivarse a centros con una unidad multidisciplinar especializada en obesidad y unidad acreditada de EII para un abordaje personalizado de las opciones terapéuticas.
- -
Los pacientes que sean diagnosticados de EII durante el proceso de evaluación previa a cirugía bariátrica o que hayan sido remitidos para tratamiento de la obesidad y no sigan controles o no hayan sido evaluados recientemente de su EII, deben ser evaluados por una unidad acreditada de EII.
- -
Durante los 6-12 meses previos a cualquier procedimiento endoscópico o quirúrgico para la obesidad, el paciente debe mantenerse sin síntomas digestivos relacionados con su EII y con marcadores biológicos de la EII dentro de la normalidad.
- -
Asimismo, en los 6 meses previos al inicio del tratamiento de la obesidad (farmacológico, endoscópico o quirúrgico) debe constatarse la ausencia de lesiones inflamatorias activas en las pruebas de imagen.
El presente trabajo no ha recibido soporte financiero alguno para su realización.
Conflicto de interesesEugeni Domènech ha recibido honorarios por la realización de conferencias o consejo de experto, asistencia a cursos o congresos, donaciones o ayudas para la realización eventos o para proyectos de investigación de AbbVie, Adacyte Therapeutics, Biogen, Celltrion, Galapagos, Gilead, GoodGut, Imidomics, Janssen, Kern Pharma, MSD, Pfizer, Roche, Samsung, Takeda, Tillots.
Andreea Ciudin ha recibido honorarios por la realización de conferencias, asistencia a cursos o congresos de NovoNordisk, Eli Lilly, AstraZeneca, Boehringer Ingelheim, Esteve, Menarini, MSD.
José María Balibrea ha recibido honorarios por la realización de conferencias o consejo de experto, asistencia a cursos o congresos, donaciones o ayudas para la realización eventos o para proyectos de investigación de iVascular, Johnson & Johnson, Medtronic, Abex, BBraun, Smith & Nephew.
Eduard Espinet-Coll es consultor médico de Apollo Endosurgery.
Fiorella Cañete ha recibido honorarios por la realización de conferencias, asistencia a cursos o congresos de AbbVie, Adacyte Therapeutics, Janssen, Pfizer, Takeda, Tillots.
Lilliam Flores ha recibido honorarios por la realización de conferencias y asistencia a cursos o congresos de Novo Nordisk y Eli Lilly España.
Román Turró es consultor de USGI Medical, GI Windows y Nitinotes.
Alejandro Hernández Camba ha recibido honorarios por la realización de conferencias, asistencia a cursos o congresos de AbbVie, Adacyte Therapeutics, Janssen, Pfizer, Ferring, Kern Farma, Takeda, Galapagos y Tillots.
Ana Gutiérrez ha recibido honorarios por la realización de conferencias o consejo de experto, asistencia a cursos o congresos, donaciones o ayudas para la realización eventos o para proyectos de investigación de AbbVie, Adacyte Therapeutics, Celltrion, Galapagos, Janssen, Kern Pharma, MSD, Pfizer, Takeda, Tillots y Lilly.
Yamile Zabana ha recibido honorarios por la realización de conferencias o consejo de experto, asistencia a cursos o congresos, o ayudas para la realización eventos de AbbVie, Adacyte, Almirall, Amgen, Dr Falk Pharma, FAES Pharma, Ferring, Janssen, MSD, Otsuka, Pfizer, Shire, Takeda, Galapagos, Boehringer Ingelheim y Tillots.
El resto de autores no declaran conflicto de intereses.
José María Balibrea. Servicio de Cirugía General y Digestiva, Hospital Universitari Germans Trias i Pujol, Badalona; Departamento de Cirugía, Universitat Autònoma de Barcelona.
Manuel Barreiro-de Acosta. Servicio de Aparato Digestivo, Hospital Clínico Universitario de Santiago de Compostela.
Javier Butragueño. LFE Research Group, Department of Health and Human Performance, Facultad de Ciencias de la Actividad Física y del Deporte (INEF), Universidad Politécnica de Madrid.
Fiorella Cañete. Servicio de Aparato Digestivo, Hospital Universitari Germans Trias i Pujol, Badalona; Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBEREHD).
Andreea Ciudin Mihai. Servicio de Endocrinología y Nutrición, Hospital Universitari Vall d’Hebron, Barcelona; Diabetes and Metabolism Research Unit, Vall d’Hebron Institut de Recerca (VHIR), Barcelona; Centro de Investigación Biomédica en Red de Diabetes y Enfermedades Metabólicas Asociadas (CIBERDEM); Departament de Fisiologia i Immunologia, Universitat Autònoma de Barcelona.
Ana B. Crujeiras. Grupo de Epigenómica en Endocrinología y Nutrición, Unidad de Epigenómica, Instituto de Investigación Sanitaria de Santiago de Compostela (IDIS), Complejo Hospitalario Universitario de Santiago de Compostela (CHUS) y CIBER Fisiopatología de la Obesidad y Nutrición (CIBERobn), Santiago de Compostela.
Andrés J. del Pozo-García. Unidad de Endoscopia, Servicio de Aparato Digestivo, Hospital Universitario 12 de Octubre, Madrid; Hospital Viamed Santa Elena, Madrid.
Eugeni Domènech, Servicio de Aparato Digestivo, Hospital Universitari Germans Trias i Pujol, Badalona; Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBEREHD); Departament de Medicina, Universitat Autònoma de Barcelona.
José Miguel Esteban López-Jamar. Unidad de Endoscopia, Servicio de Aparato Digestivo, Hospital Clínico San Carlos, Madrid.
Eduard Espinet-Coll. Unidad de Endoscopia Bariátrica, Hospital Universitario Dexeus y Clínica Diagonal, Barcelona.
Manuel Ferrer-Márquez. Servicio de Cirugía General y Digestiva, Hospital Universitario Torrecárdenas, Almería.
Lilliam Flores. Servicio de Endocrinología y Nutrición, Hospital Clínic, Barcelona.
M. Dolores Frutos. Servicio de Cirugía General y Digestiva, Hospital Clínico Universitario Virgen de la Arrixaca, Murcia; Centro de Investigación Biomédica en Red de Diabetes y Enfermedades Metabólicas Asociadas (CIBERDEM).
Ana Gutiérrez. Servicio de Aparato Digestivo, Hospital General Universitario Dr. Balmis, ISABIAL, Instituto de Investigación Sanitaria y Biomédica de Alicante, Alicante; Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBEREHD).
Alejandro Hernández-Camba. Servicio de Aparato Digestivo, Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife.
Míriam Mañosa. Servicio de Aparato Digestivo, Hospital Universitari Germans Trias i Pujol, Badalona; Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBEREHD); Departament de Medicina, Universitat Autònoma de Barcelona.
Francisco Rodríguez-Moranta. Hospital Univesitari de Bellvitge, l’Hospitalet de Llobregat.
Fàtima Sabench. Servicio de Cirugía y Anestesia, Hospital Sant Joan, Reus; Universitat Rovira i Virgili, Reus.
Román Turró. Unidad de Endoscopia Digestiva, Bariátrica y Metabólica, Servicio de Aparato Digestivo, Centro Médico Teknon, Barcelona, y Hospital Quirón, Badalona.
Yamile Zabana. Servicio de Aparato Digestivo, Hospital Universitari Mútua de Terrassa, Terrassa; Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBEREHD).