Las principales guías de práctica clínica recomiendan un adecuado manejo periprocedimiento de los fármacos antitrombóticos en caso de realización de técnicas invasivas. El principal objetivo de este estudio fue evaluar si existe mayor riesgo de eventos tromboembólicos por la supresión o la disminución de la dosis de anticoagulantes o antiagregantes en pacientes sometidos a una colangiopancreatografía retrógrada endoscópica (CPRE).
Pacientes y métodosSe realizó un estudio observacional prospectivo que incluyó 644CPRE realizadas con intención terapéutica durante el año 2019 en el Hospital Universitario Reina Sofía con un seguimiento de 30días posprocedimiento.
ResultadosSeis pacientes presentaron un evento tromboembólico, no hallando diferencias entre la incorrecta retirada/reintroducción del tratamiento antitrombótico y una mayor proporción de eventos tromboembólicos o hemorrágicos tras el procedimiento (p>0,05). La incidencia de eventos trombóticos fue significativamente mayor en pacientes en tratamiento con heparina o apixabán (p=0,001), así como con antecedente de fibrilación auricular (p=0,05), valvulopatía reumática (p=0,037) y tromboembolismo pulmonar recurrente (p=0,035), siendo este además un factor de riesgo independiente. Asimismo, la incidencia de hemorragia en los 30días postesfinterotomía fue significativamente menor en aquellos con implantación de prótesis biliar (p=0,04).
ConclusionesEl inadecuado manejo periprocedimiento de la terapia antitrombótica no se asocia a un aumento significativo de la incidencia de eventos tromboembólicos en los 30días posteriores a la CPRE. No obstante, se aconseja seguir las recomendaciones para una adecuada suspensión/reintroducción de fármacos antitrombóticos, realizando una vigilancia y un seguimiento estrechos tras el procedimiento en pacientes con factores que aumenten el riesgo trombótico.
The main clinical practice guidelines recommend adequate periprocedural withdrawal and reintroduction of antithrombotic drugs in case of invasive techniques. The main objective of this study was to assess whether, in patients receiving anticoagulant or antiplatelet therapy, the suppression or reduction of the pharmacological dose for the performance of endoscopic retrograde cholangiopancreatography (ERCP) implies a greater risk of thromboembolic events.
Patients and methodsA prospective observational study was carried out, which included 644ERCP performed with therapeutic intention during 2019 at the Reina Sofía University Hospital with follow-up during the 30days after the endoscopic intervention.
ResultsSix patients presented a thromboembolic event, finding no differences between the incorrect withdrawal/reintroduction of antithrombotic treatment and a higher proportion of thromboembolic or hemorrhagic events after the procedure (P>.05). The incidence of thrombotic events was significantly higher in patients treated with heparin or apixaban (P=.001), as well as with a history of atrial fibrillation (P=.05), rheumatic valve disease (P=.037) and recurrent pulmonary embolism (P=.035), this being also an independent risk factor. Likewise, the incidence of hemorrhage in the 30days post-sphincterotomy was significantly lower in those with implantation of a biliary prosthesis (P=.04).
ConclusionsInadequate periprocedural management of antithrombotic therapy is not associated with a significant increase in the incidence of thromboembolic events in the 30days after ERCP. However, close follow-up and surveillance during the days after this is essential in those patients with a condition that significantly increases the risk of thrombosis.
La colangiopancreatografía retrógrada endoscópica (CPRE) es un procedimiento mixto endoscópico y radiológico, con fin diagnóstico y, principalmente, terapéutico, frente a la patología obstructiva biliopancreática1. Aunque su principal complicación es la pancreatitis (1,3-7,2%), se describen otros eventos adversos, como la hemorragia (0,76-2,3%)2-4.
Es habitual que muchos pacientes sometidos a CPRE tomen fármacos anticoagulantes y antiagregantes plaquetarios. La administración de estos debe modificarse de forma previa al procedimiento, reanudándose con posterioridad, atendiendo a las recomendaciones de las guías de actuación en el manejo de la terapia antitrombótica.
Esta modificación de la pauta antitrombótica está determinada por el riesgo protrombótico del paciente y por el riesgo hemorrágico de la técnica efectuada. La modificación inapropiada podría conllevar un aumento del riesgo de aparición de eventos tromboembólicos venosos (ETEV), incrementando la morbimortalidad hasta 30días tras la realización de la CPRE.
Se consideran factores de alto riesgo protrombótico la presencia de válvula cardíaca mecánica, fibrilación auricular (FA) y/o puntuación del índice CHA2DS2-VASc>7, accidente cerebrovascular (ACV), accidente isquémico transitorio (AIT), tromboembolismo venoso reciente (<3meses) o trombofilia grave.
Respecto al riesgo hemorrágico en la CPRE, se considera elevado cuando se realiza esfinterotomía, no así cuando se efectúa esfinteroplastia o colocación de prótesis biliar o pancreática sin esfinterotomía5,6.
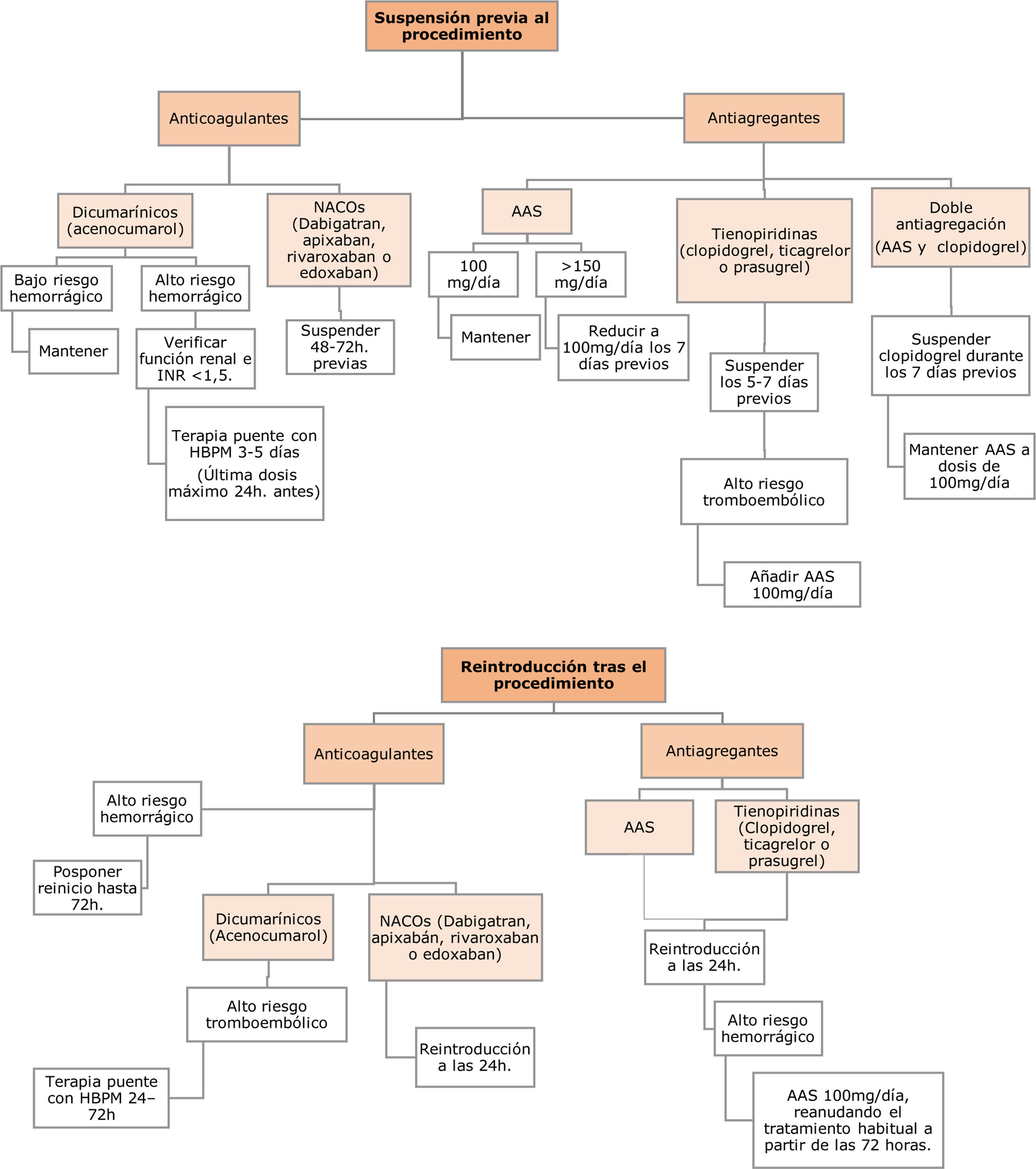
En resumen, las recomendaciones de modificación periprocedimiento de la terapia anticoagulante son (fig. 1):
- •
En cuanto a la suspensión farmacológica:
- ∘
En pacientes tratados con anticoagulantes orales dicumarínicos (acenocumarol), si la técnica es considerada de bajo riesgo hemorrágico se recomienda mantener la anticoagulación7,8. Si la CPRE es de alto riesgo hemorrágico, se suspenderá el acenocumarol entre 3-5días antes del procedimiento, realizando terapia puente con heparina de bajo peso molecular (HBPM) a dosis terapéuticas, administrando la última dosis un máximo de 24horas antes de la CPRE, valorando la función renal del paciente y verificando previamente que el INR sea menor de 1,59.
- ∘
En relación con los nuevos anticoagulantes orales (NACO) —dabigatrán, apixabán, rivaroxabán o edoxabán—, se recomienda la suspensión 48-72horas previas al procedimiento dependiendo del riesgo hemorrágico y de la función renal10,11. La pauta de terapia puente con HBPM se podría valorar solo en casos de alto riesgo trombótico.
- •
La reintroducción del tratamiento anticoagulante debe realizarse generalmente a las 24horas del procedimiento. En los dicumarínicos se aconseja terapia puente con HBPM durante 24-72horas si el riesgo tromboembólico es alto. Asimismo, solo ante un alto riesgo hemorrágico debe posponerse el reinicio del tratamiento hasta 72horas12.
- •
Sobre la terapia antiagregante, la pauta de suspensión recomendada es:
- ∘
El ácido acetilsalicílico (AAS) a dosis de 100mg/día no debe modificarse. En caso de dosis mayor a 150mg/día se debe reducir a 100mg/día 7días antes de la CPRE.
- ∘
El tratamiento con tienopiridinas debe suspenderse durante los 5-7días previos al procedimiento, según el tratamiento previo con clopidogrel/ticagrelor o prasugrel. En caso de alto riesgo de trombosis se aconseja añadir AAS 100mg/día. Ante un contexto de doble antiagregación se prefiere suspender el tratamiento con tienopiridinas durante los 7días previos a la exploración, manteniendo AAS 100mg/día13-15.
- •
El reinicio del tratamiento antiagregante debe hacerse a las 24horas con AAS 100mg/día en caso de riesgo hemorrágico alto, reanudando el tratamiento habitual a las 72horas16.
En consecuencia, se presenta el siguiente estudio, cuyo objetivo principal es evaluar si, en pacientes que reciben terapia anticoagulante o antiagregante, la supresión o la disminución de la dosis farmacológica para la realización de una CPRE supone un mayor riesgo de ETEV en los primeros 30días posteriores al procedimiento.
Los objetivos secundarios establecidos fueron los siguientes:
- •
Realizar un análisis descriptivo de los pacientes que se someten a CPRE en nuestro centro: variables epidemiológicas, antecedentes personales, fármacos antitrombóticos y características de la CPRE.
- •
Analizar las variables asociadas a la aparición de eventos tromboembólicos en los 30días posteriores a la CPRE.
- •
Identificar las variables asociadas a la aparición de eventos hemorrágicos posprocedimiento.
- •
Comparar en los diferentes grupos la mortalidad a los 30días posteriores a la CPRE.
Se realizó un estudio observacional prospectivo y abierto en el Servicio de Aparato Digestivo del Hospital Universitario Reina Sofía (HURS) de Córdoba, España. Se incluyeron un total de 644CPRE, en 544 pacientes, con intención terapéutica realizadas en el periodo comprendido entre el 1 de enero y el 31 de diciembre de 2019.
VariablesEl impacto del manejo adecuado o no de la terapia antitrombótica en el período periprocedimiento fue valorado mediante la variable principal de estudio: la aparición de ETEV en los primeros 30días posteriores a la CPRE en el grupo de pacientes que tomaban tratamiento antitrombótico previamente y en el grupo de pacientes no expuesto a esta terapia. Para el propósito del estudio se aglutinan dentro del concepto «ETEV» patologías tales como la trombosis venosa profunda (TVP), el tromboembolismo pulmonar (TEP) o la trombosis del territorio esplácnico, con diagnóstico mediante ecografía o tomografía computarizada (TC).
Como variables secundarias se recogieron las siguientes:
- •
Cuantitativas. Datos demográficos, datos analíticos: hemograma y coagulación.
- •
Cualitativas. Cardiopatía isquémica, revascularización, evento cerebrovascular, tratamiento antiagregante, tratamiento anticoagulante, hipertensión arterial, diabetes mellitus, FA, TVP, TEP, valvulopatía, enfermedad renal crónica, insuficiencia cardiaca, neoplasia, trombofilia, modificación adecuada de la terapia, fallecimiento en los 30días posteriores a la CPRE, indicación de CPRE, CHA2DS2-VASc, tipo de ingreso y datos relativos a la técnica endoscópica.
En este estudio se incluyeron pacientes mayores de 18años sometidos a una CPRE urgente o programada en el HURS que cumplimentaron adecuadamente el consentimiento informado para la CPRE.
Se excluyeron aquellos pacientes que fallecieron en los 30días posteriores a la CPRE por causa no tromboembólica, a los que fue imposible realizar la CPRE por condiciones particulares (cirugía previa o demencia avanzada), aquellos con CPRE no exitosa (imposibilidad de canulación, mala tolerancia, incapacidad de finalización) y embarazadas.
Tamaño muestralPara el tamaño de muestra se utilizó la calculadora de tamaño muestral GRANMO v.7.12.Abril 2012.
Aceptando un riesgo alfa de 0,05 y un riesgo beta de 0,2 en un contraste bilateral, se precisan 3973 pacientes con fármacos antitrombóticos y 3973 pacientes sin tratamiento antitrombótico, para detectar un riesgo relativo mínimo de 3,5817, si la tasa de enfermos en el grupo sin tratamiento es del 0,00151 18. Se ha estimado una tasa de pérdidas de seguimiento del 10%. Se ha utilizado la aproximación de Poisson.
Dado el gran tamaño muestral necesario y con la aplicación de los criterios de inclusión, se conforma una cohorte de 644 procedimientos.
Estudio estadísticoSe realizó un análisis descriptivo de las variables calculando frecuencias absolutas y relativas para las variables cualitativas, así como media aritmética y desviación típica para las variables cuantitativas. Se estimó el intervalo de confianza al 95% (IC95%) de seguridad.
Para el análisis bivariante de las variables cuantitativas se utilizaron la prueba t de Student para datos independientes y el análisis de varianza de medidas repetidas. Para las variables cualitativas, la prueba chi cuadrado (χ2) o el test de Fisher, en función de las frecuencias esperadas.
Se realizaron análisis univariante de regresión logística y multivariante para relacionar la variable ETEV con determinadas covariables clínicas.
Todos los contrastes fueron bilaterales, considerándose significativos aquellos donde p<0,05.
Los datos fueron recogidos en Microsoft Access y procesados y analizados en el programa estadístico SPSSv.17.
ResultadosCaracterísticas de los pacientesEstudio observacional con seguimiento prospectivo de 644 CPRE realizadas a un total de 544 pacientes, de los cuales el 51,6% eran varones, con una de edad de 72 (±15,1) años. Las principales características de los pacientes se recogen en la tabla 1.
Características basales de los pacientes (n=644)
| Características cohorte | n (%) |
|---|---|
| Datos de filiación | |
| Sexo (masculino) | 332 (51,6%) |
| Edad (años) | 72±15,12 |
| Antecedentes personales | |
| Hipertensión arterial | 418 (64,9%) |
| Diabetes mellitus | 170 (26,4%) |
| Insuficiencia cardiaca | 46 (7,1%) |
| FEVI ≥ 30% | 628 (97,5%) |
| Ictus/AIT | 57 (8,9%) |
| Embolia periférica arterial | 5 (0,8%) |
| Cardiopatía isquémica | 58 (9%) |
| Fibrilación auricular | 100 (15,5%) |
| Puntuación CHA2DS2-VASc | 2,58±1,73 |
| Insuficiencia renal crónica | 46 (7,1%) |
| Trombosis venosa profunda | 18 (2,8%) |
| Tromboembolismo pulmonar | 18 (2,8%) |
| Neoplasia | 5 (0,8%) |
| Trombofilia | 5 (0,8%) |
| Valvulopatía reumática | 13 (2%) |
| Válvula metálica | 5 (0,8%) |
| Valvulopatía aórtica | 5 (0,8%) |
| Valvulopatía mitral | 3 (0,5%) |
| Datos CPRE | |
| Ingreso urgente | 281 (43,6%) |
| Corrección coagulación | 52 (8,1%) |
| Corrección plaquetas | 8 (1,2%) |
| Corrección hemoglobina | 4 (0,6%) |
| Esfinterotomía | 462 (71,7%) |
| Esfinteroplastia | 95 (14,8%) |
| Etiología litiásica | 472 (73,3%) |
| Repetición CPRE mismo ingreso | 39 (6,1%) |
| Hemorragia post CPRE | 63 (9,8%) |
| Pancreatitis post CPRE | 22 (3,4%) |
| Perforación | 6 (0,9%) |
| Balón de Fogarty | 563 (87,4%) |
| Cesta de Dormia | 329 (51,1%) |
| Prótesis biliar plástica | 177 (27,5%) |
| Prótesis biliar metálica | 20 (3,1%) |
| Anticoagulación - Antiagregación | |
| Anticoagulación pre CPRE | 112 (17,4%) |
| Acenocumarol | 59 (52,7%) |
| Rivaroxabán | 24 (21,4%) |
| Heparina | 11 (9,8%) |
| Dabigatrán | 9 (8,1%) |
| Apixabán | 6 (5,3%) |
| Edoxabán | 3 (2,7%) |
| Antiagregación pre CPRE | 156 (24,2%) |
| AAS | 142 (91%) |
| Dosis 100 mg | 102 (71,8%) |
| Inhibidor P2Y12 | 26 (16,7%) |
| Clopidogrel | 25 (16%) |
| Prasugrel | 1 (0,7%) |
| Doble antiagregación | 13 (8,3%) |
Según la etiología de obstrucción biliar que justificó la realización de CPRE, en 472 (73,3%) pacientes se identificó causa litiásica; en 98 (15,2%), estenosis maligna, y en 74 (11,5%), estenosis benigna. Se observó que 281 (43,6%) de los pacientes precisaron ingreso hospitalario de modo urgente.
En cuanto a la mortalidad, 31 (4,8%) pacientes fallecieron en el intervalo de 30días tras la CPRE. Solo en un paciente la causa principal fue la aparición de un ETEV. En los demás casos, la muerte fue consecuencia de la patología responsable de la obstrucción biliar, generalmente neoplásica o colangitis grave con disfunción multiorgánica, no identificándose ningún caso de defunción debida a una complicación directamente derivada del procedimiento endoscópico.
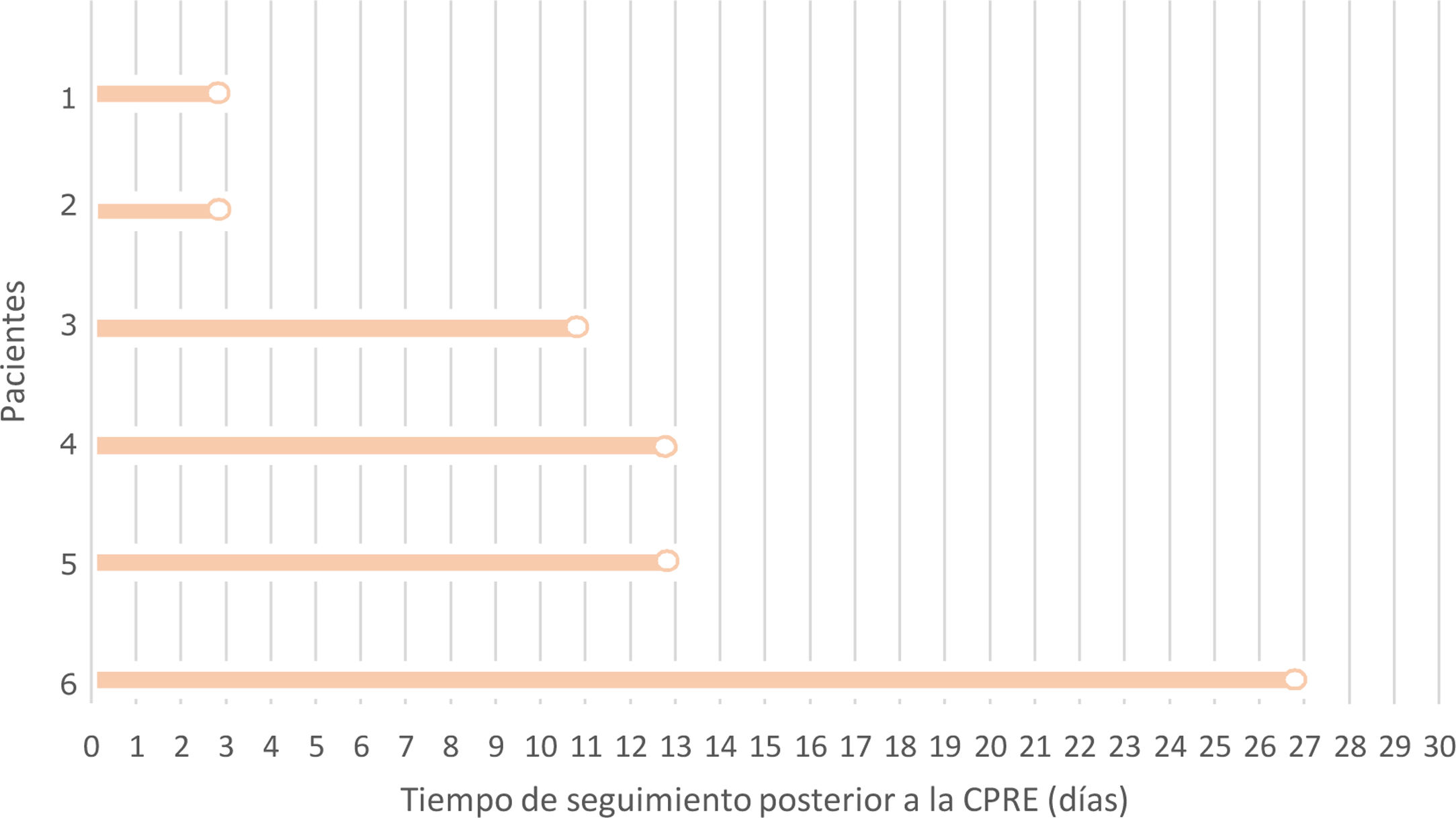
Eventos trombóticosDel conjunto de las 644 CPRE realizadas, en 6 de ellas hubo un ETEV en el período de 30días tras la misma (tabla 2). Los 15días inmediatamente posteriores a la CPRE se muestran como el período de mayor incidencia de ETEV, con un total de 5 (83,3%) casos (fig. 2). En 4 de estos pacientes se identifica como factor común la ausencia de deambulación precoz y el encamamiento prolongado en los 7días posteriores a la CPRE, bien por limitación basal para la movilidad o en el contexto de un ingreso hospitalario superior a 24horas tras la CPRE. Sin embargo, al analizar la asociación entre el inicio de la deambulación o actividad física a partir de las 24horas tras la CPRE y la aparición de ETEV, no se identifica una relación entra ambas (p>0,05).
Tipo de evento tromboembólico aparecido en cada uno de los 6 pacientes durante los 30 posteriores a la realización de CPRE, así como sus comorbilidades
| Paciente | Sexo | Edad | Comorbilidades/AP destacados | Anticoagulación / Antiagregación | Indicación de CPRE | Evento tromboembólico en <30 días posCPRE |
|---|---|---|---|---|---|---|
| 1 | ♂ | 82 | HTA, FA, marcapasos, ángor de esfuerzo, colangitis, trombosis portal | Apixabán. Suspensión adecuada. Reintroducción inadecuada | Sospecha de estenosis biliar maligna | IAM con muerte súbita. Muerte |
| 2 | ♀ | 78 | HTA, FA, prótesis biológica aórtica | Heparina. Suspensión y reintroducción adecuadas | Colangiocarcinoma distal inoperable | ACVA isquémico |
| 3 | ♀ | 84 | HTA, DM2 | No | Coledocolitiasis | ACVA isquémico (AIT) |
| 4 | ♂ | 66 | HTA | No | Colangitis por coledocolitiasis | Trombosis de una rama intrahepática de la porta derecha |
| 5 | ♂ | 84 | HTA, DLP, IRC, FA, CH, HSA, varios episodios de TVP/TEP | Rivaroxabán. Suspensión y reintroducción adecuadas | Neoplasia páncreas (estadio IV: metástasis hepática) | TVP en MII (vena femoral izquierda) |
| 6 | ♀ | 39 | No AP de interés | No | Coledocolitiasis múltiple (hematoma subcapsular post CPRE) | TVP en MII (vena femoral izquierda) |
Representación del tiempo de seguimiento hasta la aparición de un evento tromboembólico en los seis casos detectados en el total de la serie estudiada. La mayoría de los pacientes presentaron este evento durante los primeros 15días de seguimiento, mientras que tan solo un paciente lo sufrió en un tiempo superior, el día +27.
La FA se relaciona con una mayor presencia de ETEV (50% vs 15,2%; χ2: 10,91; p=0,05), de forma independiente al riesgo trombótico, cuantificado mediante la escala CHA2DS2-VASc. Valores de esta puntación menores o mayores a1 no se asociaron a la menor o mayor incidencia de ETEV (p>0,05). No obstante, se observa un aumento de la probabilidad de aparición de ETEV en pacientes con mayor riesgo trombótico según esta puntuación, aunque esta relación no alcanza la significación estadística.
El TEP recurrente se asocia a una mayor proporción de eventos trombóticos (16,7% vs 0,15%; χ2: 52,34; p<0,001), al igual que la presencia de valvulopatía reumática (16,7% vs 0,2%; χ2: 6,58; p=0,037) (tabla 3). Tras aplicar un análisis multivariante, se constata que la presencia de TEP recurrente mantiene la significación estadística en el sentido del aumento del riesgo trombótico de forma independiente tras la CPRE (p=0,035). En cambio, el uso de prótesis metálicas no se asocia estadísticamente a la aparición de ETEV (p>0,05).
Factores de riesgo reconocidos de aparición de eventos tromboembólicos en los 30 días de seguimiento tras CPRE
| Variables | Regresión logísticaOR (IC 95%) | Significación estadística (p) |
|---|---|---|
| FA | 5,57 (1,14-27,23) | 0,037 |
| TEP recurrente | 64,10 (12,45-329,78) | 0,001 |
| Valvulopatía reumática | 9,71 (1,21-77,36) | 0,039 |
Los resultados son obtenidos en análisis univariante de regresión logística. Tras aplicar un análisis multivariante, el TEP recurrente mantiene la significación estadística (p=0,035).
La incidencia de trombosis no guarda relación con la existencia de neoplasia biliar (p>0,05) ni con otras indicaciones del procedimiento, así como tampoco con el tipo de ingreso, ya sea urgente o programado.
Del total de 22 (3,4%) casos de pancreatitis aguda tras CPRE, 9 (1,4%) fueron leves; 5 (0,8%), moderadas, y 8 (1,2%), graves. La aparición de pancreatitis aguda no guarda relación con el desarrollo posterior de un ETEV (p>0,05).
En conjunto, los pacientes estaban en tratamiento anticoagulante o antiagregante en un total de 264 procedimientos (41%). Basándonos en el manejo de la terapia antitrombótica periprocedimiento, recomendado por el Documento de consenso de la Sociedad Española de Cardiología (SEC) de 20189, tomado como referencia por nuestro grupo, se realizó una suspensión adecuada en 136 (51,5%) de dichas intervenciones. En 15 (5,7%) CPRE se desconoce si se hizo de forma apropiada dado que no quedó registrada en la historia clínica digital la pauta de suspensión. Respecto a la reintroducción, al menos en 171 (64,7%) casos se reanudó de forma correcta. En 127 (48,1%) CPRE los pacientes realizaron terapia puente pre y posprocedimiento.
No se observa relación entre un inapropiado manejo terapéutico de la antiagregación y/o anticoagulación periprocedimiento y la aparición de ETEV tras CPRE (p>0,05).
De la muestra estudiada, en 112 (17,4%) intervenciones los pacientes estaban anticoagulados con diferentes fármacos antes de la realización de la CPRE. La principal causa de anticoagulación, presente en 85 (13,7%) casos, es la FA. El tipo de anticoagulante sí se asocia con la presencia de ETEV en los primeros 30días (χ2: 81,19; p<0,001), encontrando que la incidencia de casos de trombosis era mayor en pacientes que tomaban apixabán y heparina en comparación con los que realizaban tratamiento con los demás anticoagulantes (R>1,96). No obstante, estos resultados no se confirmaron tras la realización de un análisis multivariante.
En 156 (24,2%) procedimientos los pacientes estaban antiagregados antes del procedimiento. Las indicaciones más frecuentes de antiagregación son enfermedad cerebrovascular en 31 (19,87%) casos, síndrome coronario agudo en 27 (17,3%) y enfermedad coronaria estable en 15 (9,61%).
El tipo de antiagregante no se asocia con la aparición de ETEV (p>0,05).
Eventos hemorrágicosDel total de 63 (9,8%) procedimientos en los que los pacientes presentaron una hemorragia posterior a la CPRE, 49 (8%) fueron casos leves que no cedieron de modo espontáneo, precisando la realización de una técnica terapéutica endoscópica intraprocedimiento, generalmente inyección de adrenalina, sin recidiva posterior. Tres (0,4%) se consideraron graves, de acuerdo con la aparición de alguna de las siguientes características: frecuencia cardíaca mayor de 100latidos por minuto, presión arterial sistólica menor de 80mmHg, descenso del hematocrito igual o superior al 10% con respecto a la cifra basal, requerimiento de más de dos concentrados de hematíes en el intervalo de 24horas o prolongación del ingreso a causa del sangrado más de 7días. La hemorragia se clasificó como moderada en 11 (1,8%) pacientes, en el contexto de aparición de exteriorizaciones hemorrágicas digestivas tras la CPRE con repercusión analítica menor a la referida como criterio de gravedad, necesidad de aumentar el tiempo de hospitalización menor a 7días y sin alteración de la estabilidad hemodinámica. Tras el alta, 6 (0,9%) pacientes tuvieron una hemorragia que, en todos los casos, logró controlarse tras el reingreso hospitalario y la intervención endoscópica con fin terapéutico.
La realización de una esfinterotomía biliar o pancreática se asocia con mayor proporción de hemorragia posterior a la CPRE durante el ingreso (92,1% vs 7,9%; χ2: 14,11; p<0,001), considerándose además factor de riesgo de sangrado. Esta asociación se mantiene tras la aplicación de análisis multivariante (p=0,002). El uso de prótesis biliar plástica se relaciona con una menor proporción de hemorragia postesfinterotomía biliar durante el ingreso, tanto en análisis univariante como multivariante (14,37% vs 6,14%; χ2: 5,37; p=0,02), considerándose además factor protector (tabla 4). En cuanto a la prótesis biliar metálica, el uso de esta no se asocia con la menor incidencia de hemorragia posterior a la CPRE (p>0,05). No obstante, no se notifica ningún caso de hemorragia tras la colocación de una prótesis metálica, y tan solo en un caso se colocó esta como tratamiento endoscópico del sangrado asociado a la esfinterotomía.
Factores de riesgo/protectores reconocidos de aparición de hemorragia en los 30 días de seguimiento tras CPRE
| Variables | Regresión logística OR (IC 95%) | Significación estadística (p) |
|---|---|---|
| Esfinterotomía | 4,56 (1,86-11,2) | 0,002 |
| Prótesis biliar plástica | 0,39 (0,17-0,88) | 0,02 |
La esfinterotomía se considera un factor de riesgo reconocido de hemorragia en los 30 días posteriores a la CPRE. De modo contrario, la colocación de prótesis biliar plástica se asoció a un menor riesgo de sangrado tras la esfinterotomía endoscópica en esta serie.
El manejo terapéutico periprocedimiento de la terapia antitrombótica, de acuerdo o no a las recomendaciones de modificación empleadas como referente, no se asocia con la proporción de pacientes que sufrieron una hemorragia durante el ingreso. Tampoco se relaciona con la realización de terapia puente antes y después del proceso, ni con una reintroducción adecuada (p>0,05). Igualmente, tampoco se relaciona con un INR mayor de1 previo a la CPRE ni con el requerimiento de corrección de la coagulación (p>0,05).
DiscusiónEste estudio ha evaluado la asociación del manejo de la terapia antitrombótica sobre la aparición de eventos trombóticos y hemorrágicos en pacientes sometidos a una CPRE en el año 2019. Existen escasos estudios sobre este tema en el ámbito internacional. Las guías de manejo clínico establecen recomendaciones y algoritmos de decisión en este contexto, basadas mayoritariamente en estudios observacionales por la práctica inexistencia de ensayos clínicos controlados y aleatorizados. En 2010 se publicó una primera versión española de estas guías19, tras la cual se han creado nuevas actualizaciones, siendo la más reciente de 201920, que es la que se sigue como referencia en nuestro grupo.
Con respecto a los estudios disponibles21,22, Venkatachalapathy et al.17 realizaron un estudio de casos y controles sobre el riesgo tromboembólico en pacientes sometidos a una exploración endoscópica en los 90días tras esta. Cada caso fue emparejado por sexo y edad con tres controles que asistieron a una cita ambulatoria en la misma fecha en que se les diagnosticó el ETEV. Cuarenta y cinco de 436 pacientes (10,3%) se habían sometido a una endoscopia en el grupo de ETEV, en comparación con 14 de 436 controles (3,2%) (p<0,001). La odds ratio de desarrollar un ETEV posprocedimiento endoscópico fue de 3,58 (IC95%: 1,86-7,46) para los casos en relación con los controles. Cuando se excluyeron aquellos con factores de riesgo conocidos de ETEV, no se encontró un aumento significativo del riesgo de ETEV.
Estos resultados están en concordancia con nuestro estudio, en el que no se ha observado relación entre un inapropiado manejo terapéutico periprocedimiento de los fármacos antitrombóticos y una mayor proporción de ETEV. No obstante, sí se identifica una asociación entre ciertas patologías y una mayor incidencia de ETEV, como el TEP recurrente. En este contexto, dada la indicación de anticoagulación, hay que ser particularmente cuidadosos en el seguimiento, ya que es crucial un control más estricto para lograr anticiparse a la aparición de trombosis o realizar un diagnóstico temprano de estos casos.
El tipo de fármaco anticoagulante administrado y la aparición de ETEV sí parecen guardar una relación, según se deduce de los resultados extraídos. Es así que se identifica una mayor incidencia de eventos trombóticos en el grupo de pacientes que recibían tratamiento anticoagulante con apixabán y heparina en relación con los demás anticoagulantes. Este hallazgo genera cierta controversia, en contraposición a diversos estudios9,23-25 que sitúan al apixabán como el NACO con el perfil de seguridad más favorable.
Respecto a la relación entre la antiagregación plaquetaria y la aparición de hemorragia tras CPRE, dos estudios retrospectivos26,27 han examinado dicho efecto con resultados no concluyentes. En nuestro estudio tampoco fue estadísticamente concluyente la asociación del manejo antiagregante de forma previa y posterior a la realización de CPRE y la proporción de pacientes que padecieron sangrado tras ella, aunque según Nelson y Freeman26 el riesgo hemorrágico es mayor en pacientes en los que no se modificó la dosis de AAS en comparación a su control (6,5% vs 2,7%; p=0,04), demostrando que es preferible una adecuada realización del manejo terapéutico.
En relación con las prótesis metálicas autoexpandibles, en un metaanálisis28 que incluye a 338 pacientes de tres estudios diferentes se identifica un menor riesgo de hemorragia asociado a su colocación (OR=9,70; IC95%: 1,21-77,75; p=0,03), en base al efecto hemostático de compresión mecánica en sangrados persistentes a pesar del tratamiento esclerosante endoscópico1,29,30. En nuestra serie esta asociación no se puede demostrar, probablemente por el bajo número de prótesis metálicas empleadas (20) en comparación con el total de la muestra. Sin embargo, resulta llamativa la asociación apreciada entre la colocación de prótesis biliar plástica y el ulterior menor riesgo de hemorragia postesfinterotomía. Una de las hipótesis planteadas por nuestro grupo atribuye este hecho a la probable menor longitud de la esfinterotomía biliar realizada en aquellos casos con indicación de asegurar el drenaje de la vía biliar mediante la colocación de una prótesis biliar plástica, especialmente en estenosis biliar de origen maligno (39,2%) o benigno (18,2%).
Detectar las diferentes comorbilidades del paciente, previamente a la realización de la CPRE, permitiría individualizar cada caso e identificar aquellas, en base al estudio presentado, que aumentarían el riesgo trombótico en los 30días postintervención. La mayoría de los ETEV identificados se notifican en los primeros 15días de seguimiento, por lo que en este período se debería intensificar el esfuerzo en realizar una vigilancia activa del subgrupo de pacientes con mayor riesgo de complicaciones trombóticas. Esta actitud podría permitir su prevención o su diagnóstico precoz, para así llevar a cabo un tratamiento efectivo más temprano que mejore el pronóstico.
Conclusiones- •
El incorrecto manejo terapéutico de los fármacos antitrombóticos no se asocia de forma estadísticamente significativa con una mayor tasa de ETEV o hemorragia tras una CPRE en la serie analizada. No obstante, parece prudente realizar un manejo adecuado de dichos medicamentos en base a las guías clínicas y seguir sus recomendaciones para prevenir la potencial aparición de ETEV.
- •
El fármaco anticoagulante empleado sí se relaciona con la presencia de ETEV, observándose una mayor incidencia trombótica en los pacientes en tratamiento con apixabán y heparina, respecto a los demás anticoagulantes.
- •
Algunas comorbilidades del paciente, como FA, el TEP recurrente y la valvulopatía reumática, se asocian con un mayor riesgo de ETEV. El antecedente de TEP recurrente, además, se reconoce como factor de riesgo independiente.
- •
La realización de una esfinterotomía durante el procedimiento se relaciona como factor de riesgo independiente de hemorragia tras la CPRE. La colocación de una prótesis biliar plástica se asocia con una menor incidencia de sangrado postesfinterotomía.
El siguiente estudio se rigió por la Ley Orgánica de Protección de Datos de Carácter Personal (LOPD 15/1999), la Declaración de Helsinki, la Ley 14/2007, de 3 de julio, de Investigación biomédica y por las Guías de buenas prácticas clínicas.
El estudio ha sido aprobado por el Comité de Ética del Hospital Universitario Reina Sofía (HURS) de Córdoba (España).
Los datos de los pacientes fueron codificados para mantener su anonimato en el estudio y ante terceros. Se obtuvo consentimiento informado escrito para la inclusión en el estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.