El ácido acetilsalicílico (AAS) es un fármaco ampliamente empleado en su indicación para la prevención de la enfermedad cardiovascular de origen trombótico. El efecto de antiagregación plaquetaria se logra con dosis bajas, de 75-325mg/día. A este efecto beneficioso pueden asociarse efectos adversos gastrointestinales producto de su inhibición de la ciclooxigenasa 1 (COX-1). Se han desarrollado otros medicamentos cuyo efecto antiagregante plaquetario se establece a través de mecanismos de acción distintos, como el clopidogrel y la ticlopidina, que no inhiben COX-1.
La proporción de pacientes que toman AAS en dosis bajas, solo o combinado con otros agentes antigregantes, es notable, motivo por el cual es importante optimizar su uso reduciendo al máximo sus efectos adversos gastrointestinales (GI).
Conocer los factores de riesgo que aumentan el riesgo de complicaciones GI con el uso de antiagregantes plaquetarios, como la edad, el uso concomitante de otros medicamentos (anticoagulantes o antiiflamatorios no esteroideos), los antecedentes de enfermedad GI ulceropéptica complicada o no, y la infección por Helicobacter pylori, permitirá un mejor manejo individualizando de cada paciente. El uso de inhibidores de la bomba de protones y/o erradicación de H. pylori debe permitir un balance positivo aun en pacientes con factores de riesgo gastrointestinal.
Aspirin is widely used for the prevention of thrombotic cardiovascular disease. The effect of platelet antiaggregation is achieved with low doses of 75–325mg/day. Due to COX-1 inhibition, associated gastrointestinal adverse effects can occur. Other drugs whose platelet antiaggregant effect is achieved through different mechanisms of action have been developed, such as clopidogrel and ticlopidine, which do not inhibit COX-1. The proportion of patients taking low-dose aspirin alone or in combination with other antiaggregants is high and consequently the use of these drugs should be optimized by reducing their gastrointestinal adverse effects to a minimum. Knowledge of the risk factors that increase the risk of gastrointestinal adverse effects with platelet antiaggregants, such as age, concomitant use of other drugs such as anticoagulants or non-steroidal anti-inflammatory drugs, a history of peptic ulcer —whether complicated or uncomplicated—, and Helicobacter pylori infection, would help to allow management to be individually tailored to each patient. The use of proton pump inhibitors and/or H. pylori eradication should allow a positive balance, even in patients with gastrointestinal risk factors.
El ácido acetilsalicílico (AAS), que fue sintetizado por Friedrich Bayer en 1897, pero de cuyo uso médico se dispone de información que se remonta hasta el antiguo Egipto, ha superado la prueba del tiempo en lo que tiene que ver con su efectividad como fármaco antiinflamatorio, y su uso es muy amplio en el área de las afecciones reumatológicas en general, así como el de antipirético y analgésico. Sin embargo, su importancia en la medicina occidental se incrementó a partir de la segunda mitad del siglo xx, tras el anuncio de Paul Gibson, en 1948, de la posible indicación de AAS en el tratamiento de la trombosis coronaria1.
Actualmente, sólo en Estados Unidos, aproximadamente un 36% de su población (más de 50 millones de personas) reciben AAS bajo la indicación de prevención (primaria o secundaria) para la enfermedad cardiovascular (ECV)2. Si tenemos en cuenta sólo el grupo de pacientes con ECV, hasta un 80% toma AAS como uno de los medicamentos indicados por su médico3. En España, un trabajo que revisó el uso de AAS en la prevención de la ECV en pacientes diabéticos, mostró que de los 1.718 encuestados, sólo un 21% recibía AAS como medicación indicada para tal fin2; sin embargo, es muy probable que tal cifra se haya incrementado desde entonces. Estos datos permiten apreciar que se trata de un medicamento de uso masivo en la población, teniendo en cuenta que no sólo se prescribe como tratamiento preventivo de la ECV de origen trombótico, sino que además en dosis más altas todavía se sigue utilizando en forma de automedicación en pacientes que refieren diversos tipos de dolor en general, incluido el osteoarticular.
Al igual que su utilidad y sus efectos beneficiosos, también es conocida su asociación con efectos adversos gastrointestinales, entre los que destaca la hemorragia gastrointestinal (HGI). Así, por ejemplo el AAS fue el medicamento mas comúnmente relacionado (28,6%) con los casos de HGI ingresados en la Unidad de Cuidados intensivos del Hospital St. Luke's-Roosevelt de Nueva York, en 19 semanas consecutivas entre diciembre de 2004 y mayo de 2005, y a su vez que las HGI representan la principal indicación (33%) para el ingreso en dicha unidad4.
En este artículo revisaremos los efectos secundarios gastrointestinales asociados al uso de AAS y otros agentes antiagregantes plaquetarios, y se expondrán las estrategias para incrementar sus efectos beneficiosos reduciendo el riesgo de estos efectos secundarios.
Aspectos farmacológicosEl AAS produce su efecto antitrombótico a través de la acetilación irreversible de la ciclooxigenasa 1 (COX-1), de las plaquetas, lo cual bloquea la producción de tromboxano A2 durante el resto de la vida de esas plaquetas. Aun cuando dosis menores de 75mg/día provocan en pocos días una inhibición completa de la COX-1, lo que sugiere su capacidad para la protección cardiovascular5, un metaanálisis de estudios aleatorizados mostró que esa dosis no provocaba una reducción estadísticamente significativa (13%) de los eventos trombóticos, a diferencia de las dosis en el rango de 75–150mg/día (32%) o 160–325mg/día (26%)6. Estas evidencias llevaron a la aparición del término «AAS en dosis bajas» y su uso para la prevención primaria y secundaria de eventos cardiovasculares como el infarto al miocardio, dentro de un rango de 75–325mg/día.
Efectos adversos gastrointestinalesA través de la inhibición de la COX-1 en la células de la mucosa gástrica se disminuye la producción de prostaglandinas citoprotectoras (PGE2). Esta inhibición es dependiente de la dosis, comienza a apreciarse a partir de los 30mg/día y llega a una inhibición máxima en torno a los 1.300mg/día7. La inhibición del tromboxano plaquetario y la prolongación del tiempo de hemorragia se han considerado un mecanismo adicional asociado a la hemorragia digestiva por AAS.
Los efectos secundarios gastrointestinales asociados a AAS son diversos, y van desde lesiones con poca repercusión clínica a otras más graves, como la hemorragia digestiva.
La dispepsia es un síntoma comúnmente reportado por los pacientes que consumen antiinflamatorios no esteroideos (AINE) en general, incluidos los que toman AAS en dosis bajas. La correlación entre dispepsia y la presencia de lesiones es escasa8,9. En un estudio prospectivo multicéntrico, realizado en varios países, se encontró que un 20% de 187 pacientes que recibían AAS en bajas dosis como tratamiento preventivo para la ECV presentaba dispepsia8. Asimismo, un estudio con seguimiento endoscópico de hasta 8 semanas de duración, en el que se comparó un grupo de pacientes que recibían AAS en dosis bajas frente a un grupo de controles sanos, mostró que hasta un 60% de los pacientes que recibían AAS desarrolló lesiones en la mucosa gástrica y/o duodenal (petequias y erosiones), y que dichas lesiones fueron significativamente mas frecuentes (p<0,05) en los controles endoscópicos de las 2 y 4 semanas, cuando se compararon con el último control realizado a las 8 semanas9.
Cuando se evaluó endoscópicamente la producción de lesiones gastroduodenales en pacientes que recibían AAS en bajas dosis indicada como profilaxis de ECV, se encontró hasta una prevalencia puntual del 11% de úlceras gástricas y duodenales (intervalo de confianza [IC] del 95%, 6,3–15,1)8; al extender el seguimiento durante 3 meses en 113 de esos pacientes, se reportó una incidencia del 7% de úlceras (IC del 95%, 2,4–11,8). Sin embargo, en otro estudio de 12 semanas, doble ciego, en pacientes con osteartritis que fueron aleatorizados para recibir 81mg de AAS con cubierta entérica, sola o asociada a otros AINE (n=381) y placebo (n=387), no se observaron diferencias estadísticamente significativas frente a placebo en la incidencia de úlceras (el 5,8 frente al 7,3%), pero sí en la frecuencia de erosiones (el 32 frente al 20%)10.
El efecto adverso gastrointestinal más grave con AAS, al igual que de los demás AINE, es la HGI. En tal sentido, un estudio prospectivo realizado en dos hospitales de Inglaterra, que evaluó en total 18.820 ingresos, encontró que 1.225 fueron admitidos por reacciones adversas a fármacos. Al analizar más en detalle estas cifras, se encontró que el principal grupo lo representaron los AINE (29,6%), y dentro de estos medicamentos el AAS fue claramente el principal causante de hospitalización (el 60% de todos los AINE), lo que representa un 18% del total de hospitalizaciones por este concepto. En los 1.225 pacientes ingresados se registraron 28 muertes; de ellas, 15 fueron por HGI y 2 por úlcera duodenal perforada; en estos 17 pacientes fallecidos, 6 fueron atribuidos al uso exclusivo de AAS, y otros 6 a la combinación de AAS con otro AINE11.
Los estudios diseñados para evaluar la eficacia del AAS en bajas dosis como prevención de ECV, donde se usó un grupo control de pacientes que recibían placebo, han demostrado que los pacientes con AAS tenían un riesgo de HGI que se duplicaba o triplicaba frente al grupo control12,13.
Por otro lado, tanto en ensayos clínicos aleatorizados como otros de naturaleza descriptiva se ha demostrado un incremento en el riesgo de complicaciones gastrointestinales (hemorragia, perforación) con AAS en bajas dosis, llegando a duplicar ese riesgo frente a los que no tomaban AAS14–19. El uso de presentaciones con cubierta entérica u otro tipo de presentación con un supuesto mejor perfil de seguridad no ha mostrado disminuir el riesgo de sufrir complicaciones gastrointestinales14,18,19.
Un estudio observacional multicéntrico realizado en España señaló que al menos el 12% de las complicaciones gastrointestinales altas y bajas atendidas en 26 hospitales generales del país, así como la mortalidad por esta causa, se relacionaron con el uso de AAS en bajas dosis20.
Por último, un metaanálisis de 14 estudios aleatorizados y controlados con placebo, que incluyeron mas de 57.000 pacientes que recibían AAS en bajas dosis con indicación de profilaxis cardiovascular, encontró un 0,12% de casos por año de hemorragia digestiva grave, y al ser comparados con los pacientes que recibían placebo se determinó un riesgo relativo (RR) de 2,07 (IC del 95%, 1,61–2,66). Basándose en estos valores, se pudo determinar que era necesario tratar a 833 pacientes durante un año con AAS en bajas dosis para que se produjese un caso de hemorragia digestiva grave21. En cambio, en dosis diarias de 1.500mg, la cifra se reduce a 247 pacientes por año.
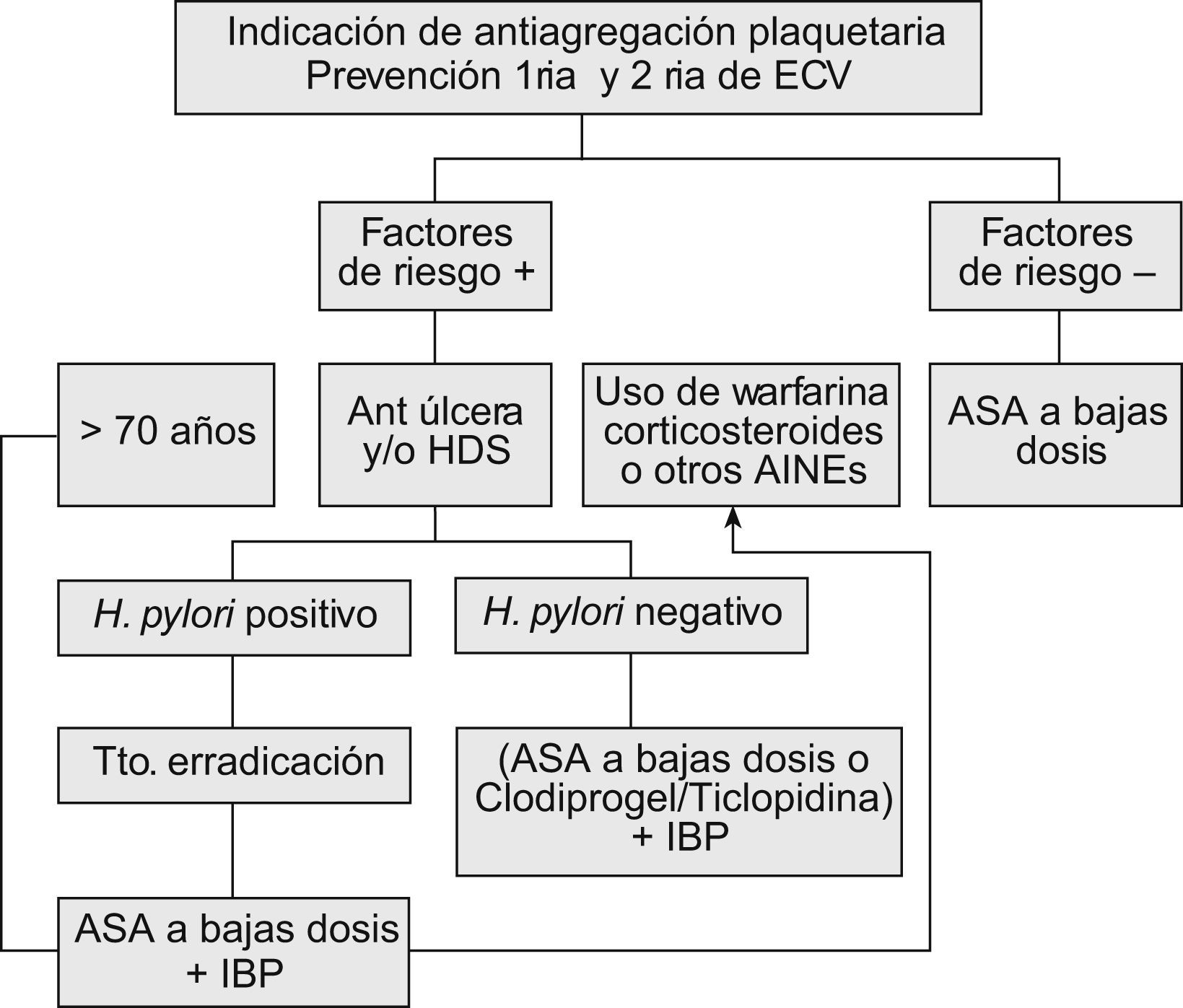
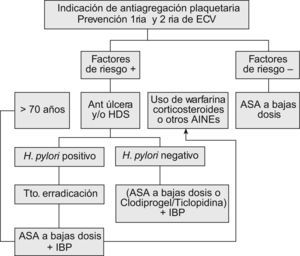
Factores de riesgo para hemorragia digestiva altaAun cuando estos riesgos han sido estudiados y están bastante descritos para los AINE en general, hay pocos estudios enfocados a evaluar el riesgo de hemorragia digestiva alta (HDA) para los pacientes que reciben AAS en bajas dosis. Sin embargo, no sorprende que en los pocos estudios que se han planteado este problema se han señalado factores de riesgo que son muy similares a los de los AINE en general: a) historia de un evento previo de úlcera o úlcera complicada; b) edad avanzada; c) uso simultáneo de anticoagulantes; d) uso de corticoides; e) dosis altas o uso simultáneo con un AINE, y f) coexistencia de enfermedad grave22 (tabla 1).
Factores de riesgo en el paciente que recibe AAS en bajas dosis
| Antecedentes de úlcera y/o complicación |
| Edad avanzada |
| Uso simultáneo con anticoagulantes |
| Uso simultáneo con corticoides |
| Aumento de la dosis de AAS |
| Uso simultáneo con otros AINE |
| Infección por H. pylori. |
AAS: ácido acetilsalicílico; AINE: antiinflamatorios no esteroideos.
En un estudio de casos y controles, entre los pacientes que tomaban AAS en dosis bajas y tenían historia previa de hemorragia por úlcera péptica, el riesgo de HDA se asoció a una odds ratio (OR) de 6,5 (IC del 95%, 2,0–21,2), mientras que ese riesgo disminuyó cuando la historia previa era de ulcus sin hemorragia con una OR de 2,1 (IC del 95%, 1,0–4,1)23. Asimismo, en otro estudio de cohortes de nuestro grupo, realizado en 903 pacientes que recibían AAS en dosis entre 75 y 325mg/día como indicación por ECV tras un ingreso hospitalario, con un seguimiento durante 45 meses, se encontró una asociación significativa entre la hospitalización por HDA y la historia de úlcera péptica con un RR de 3,1 (IC del 95%, 1,5–6,5)24.
Edad avanzadaAun cuando algunos estudios no señalan que la edad avanzada sea un factor de riesgo para HDA en pacientes que reciben AAS en bajas dosis25,26, otros señalan claramente que los pacientes de edad avanzada que reciben AAS en bajas dosis tienen un riesgo absoluto aumentado para complicaciones gastrointestinales en comparación con los paciente jóvenes, pues su riesgo basal es superior a estos últimos27.
Uso simultáneo con anticoagulantesAunque no es frecuente encontrar pacientes que tomen anticoagulates tipo dicumarínicos y AAS, varios estudios, como el Thrombosis Prevention Trial28, demuestran que la asociación de AAS en bajas dosis con anticoagulantes como la warfarina potencia el riesgo de HGI. En otros estudios esa potenciación no alcanzó valores de significación estadística29.
Uso simultáneo con corticoidesEn un estudio danés de cohortes, que evaluó el uso simultáneo de corticoides y AAS en bajas dosis (75–150mg/día) y su asociación a la HDA, se indicó un RR de 5,3 (IC del 95%, 2,9–8,8), mientras que en el grupo de pacientes que recibía sólo AAS en bajas dosis mostró un RR de 2,630.
Aumento de la dosis de AASComo se ha mencionado previamente, el rango en el cual se habla de AAS en bajas dosis oscila entre 75 y 325mg. Hay varios estudios aleatorizados que han evaluado las diversas dosis utilizadas y su riesgo de provocar una HDA12. Un metaanálisis reciente también evaluó la relación entre AAS en bajas dosis y HDA agrupando los resultados de diversos estudios aleatorizados en dos rangos (75–162,5 frente a 162,5–325mg). En este metaanálisis no se encontró un incremento estadísticamente significativo del RR de HDA entre ambos rangos de dosis (2,22 frente a 2,35)21. Sin embargo, otros estudios sí encuentran un riesgo dependiente de la dosis con aspirina en dosis bajas12,31. En cualquier caso, es cierto que con la mayoría de los AINE hay un riesgo dependiente de la dosis. Cuando se consideran dosis tan próximas como 100 o 200mg, no es extraño encontrar datos contradictorios y la recomendación es usar la dosis mínima efectiva.
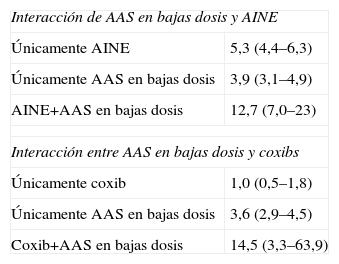
Asociación de AAS a bajas dosis con otros AINEDiversos estudios demuestran que esta asociación incrementa el riesgo de HDA de 2 a 4 veces23,32. Esta evidencia la aportan tanto los estudios epidemiológicos33 como los estudios CLASS, TARGET Y SUCCESS I34–36, lo que permite concluir que una dosis baja de AAS incrementa el riesgo de HAD en pacientes tratados con AINE tradicionales o coxibs. Actualmente, no está claro si la combinación coxib+AAS es más segura que AINE+AAS37 (tabla 2).
Riesgo relativo ajustado (intervalo de confianza del 95%) de HDA en pacientes con AAS en bajas dosis, comparado con la asociación de AINE y coxibs
| Interacción de AAS en bajas dosis y AINE | |
| Únicamente AINE | 5,3 (4,4–6,3) |
| Únicamente AAS en bajas dosis | 3,9 (3,1–4,9) |
| AINE+AAS en bajas dosis | 12,7 (7,0–23) |
| Interacción entre AAS en bajas dosis y coxibs | |
| Únicamente coxib | 1,0 (0,5–1,8) |
| Únicamente AAS en bajas dosis | 3,6 (2,9–4,5) |
| Coxib+AAS en bajas dosis | 14,5 (3,3–63,9) |
AAS: ácido acetilsalicílico; AINE: antiinflamatorios no esteroideos; HDA: hemorragia digestiva alta.Fuente: Lanas A, García-Rodríguez LA, Arroyo MT, Gomollón F, Feu F, González-Pérez A, Zapata E, Bástida G, Rodrigo L, Santolaria S, Güell M, de Argila CM, Quintero E, Borda F, Piqué JM; Asociación Española de Gastroenterología. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut. 2006 Dec;55(12):1731–8.
La presencia de la infección por Helicobacter pylori es un factor de riesgo controvertido, pero actualmente parece claro que H. pylori y los AINE son factores de riesgo independientes para la aparición de complicaciones gastroduodenales, y la polémica se ha centrado en si hay sinergia entre ambos factores a la hora de determinar el riesgo de complicaciones, en un paciente infectado que toma AINE38.
En el caso de los pacientes que toman dosis bajas de AAS, se ha encontrado un aumento de su riesgo gastrointestinal si hay infección por H. pylori. En un estudio observacional de nuestro grupo26, se encontró que la infección por H. pylori aumenta el riesgo de sufrir una hemorragia digestiva con una OR de 4,2. Por otro lado, Chan et al25, en un estudio prospectivo, demostraron que la erradicación de la infección por H. pylori fue tan eficaz como el uso de omeprazol para prevenir las complicaciones gastrointestinales con el uso de AAS en bajas dosis. Sin embargo, este estudio parece adolecer de un tamaño muestral pequeño, lo cual parece asociarse a un error beta tipo II.
La evidencia aportada por un metaanálisis que incluyó tanto estudios de cohortes como estudios controlados, mostró que la infección por H. pylori aumenta en 3,53 veces el riesgo de desarrollar úlcera en los pacientes que toman AINE, señalando que el riesgo es independiente para H. pylori (1,9) y para AINE (4,85), pero ese riesgo ascendió a 6,13 cuando ambos factores estaban presentes38. Otro metaanálisis más reciente, que incorporó 21 ensayos realizados sobre 10.146 pacientes y publicados en MEDLINE entre enero de 1989 y junio de 2004, señala que la infección por H. pylori y el uso de AINE constituyen factores de riesgo sinérgicos en la úlcera péptica con y sin complicaciones39.
El análisis post hoc del estudio VIGOR reveló que los beneficios gastrointestinales del uso de los coxibs también fue mayor en los pacientes en los que se erradicó primero H. pylori40.
Estrategias para la prevención de los efectos gastrointestinales adversos en el tratamiento con AAS en bajas dosisEl uso de un antiagregante plaquetario alternativoEl desarrollo y el uso clínico de antiagregantes plaquetarios, como clopidogrel y ticlopidina, han traído consigo las comparaciones entre el uso de ellos o de AAS en bajas dosis. Ya desde 1996, ciertos estudios, como el CAPRIE, concluían que 75mg de clopidogrel y 325mg de AAS indicados para la prevención de fenómenos trombóticos cardiovasculares tenían un riesgo bajo y similar de presentar complicaciones gastrointestinales de tipo hemorrágico (el 0,52 frente al 0,72%, respectivamente)41. Algunos estudios han encontrado un riesgo relativo de HGI ligeramente mayor en el grupo de AAS en bajas dosis comparado con el clopidogrel (4,0 y 2,3, respectivamente)17, pero en otros estudios no se logra demostrar diferencias estadísticamente significativas, como en un estudio realizado por nuestro grupo, en el que encontró un RR de 2,8 (IC del 95%, 1,9–4,2) para el grupo de pacientes que recibieron clopidogrel o ticlopidina, y de 2,7 (IC del 95%, 2,0–3,6) para el que recibió 100mg/día de AAS42.
Uso simultáneo de gastroprotectores e inhibidores de la secreción ácidaMisoprostolEs una prostaglandina sintética análoga a la PGE1, que ejerce su efecto protector en el tracto gastrointestinal superior, a través de un incremento en el flujo sanguíneo de la submucosa y un aumento en la secreción de bicarbonato. En un metaanálisis que englobó resultados de 40 estudios aleatorizados, se concluye que todas las dosis de misoprostol reducen el riesgo de desarrollar lesiones endoscópicas en paciente que reciben AINE en general, incluido el AAS en dosis bajas; sin embargo, en todas esas dosis los efectos colaterales de dolor abdominal y diarrea están presentes, muy especialmente en la única dosis que demostró ser efectiva para prevenir las complicaciones de esas úlceras, lo que lo convierte en un medicamento menos práctico que otras alternativas disponibles43.
Antagonistas H2Sólo se dispone de 2 estudios observacionales16,42 que muestran una reducción del riesgo de HDA del 60% (OR=0,4; IC del 95%, 0,19–0,73), pero ante los numerosos datos que muestran una superioridad de los inhibidores de la bomba de protones (IBP) en la prevención de la lesión gastrointestinal inducida por AINE al compararlos con los antagonistas H2, hace poco probable que se investigue más en esta línea8,16.
Inhibidores de la bomba de protonesDebido a su mayor capacidad de supresión del ácido gástrico y su buena tolerancia, los IBP son los gastroprotectores de elección en los pacientes que reciben AINE. En un ensayo aleatorizado con pacientes de alto riesgo que habían padecido una hemorragia por úlcera péptica y que recibieron 100mg/día de AAS durante 12 meses, una vez que se constató la cicatrización de sus úlceras y de haberse erradicado en todos ellos H. pylori, se comparó la recurrencia de hemoragia por úlcera, entre un grupo de pacientes que recibió 30mg/día de lansoprazol con otro grupo que recibió placebo. En este estudio los pacientes que recibían lansoprazol mostraron una recurrencia del 1,6%, frente al 14,8% del grupo control (p=0,008), lo que sugiere que el tratamiento con IBP más la erradicación de H. pylori es mejor que la erradicación sola44. Otro estudio incluyó un total de 320 pacientes que recibían AAS en bajas dosis para la profilaxis de ECV y habían tenido un evento de HDA por una úlcera. Estos pacientes, tras la cicatrización de la úlcera (todos H. pylori negativos), fueron aleatorizados en 2 grupos: uno con 75mg de clopidogrel más placebo de esomeprazol 2 veces al día, y el otro con 80mg/día de AAS más 20mg/12h de esomeprazol. Se hizo un seguimiento de 12 meses y se determinó la recurrencia de HDA. En el grupo de clopidogrel se presentaron un 8,6% de HDA (IC del 95%, 4,1–13,1), y en el de AAS más esomeprazol su incidencia fue del 0,7% (IC del 95%, 0–2), con diferencias estadísticamente muy significativas (p=0,001)45. Estos resultados coinciden con otro trabajo más reciente, en el que los pacientes que recibían AAS más esomeprazol mostraron un 0% de recurrencia de HAD, a diferencia del grupo de clopidogrel, que presentó un 13,6% de recurrencias46. Resultados como éstos indican que los pacientes en quienes el AAS en bajas dosis se relaciona con efectos adversos gastrointestinales se beneficiarán de la asociación con IBP para el tratamiento y la prevención de dichos efectos colaterales adversos en la mucosa.
Erradicación de H. pyloriVarios estudios han demostrado que la infección por H. pylori es un factor de riesgo para el desarrollo de úlcera o HGI en pacientes que toman AAS25,26,44. En otro estudio, en los pacientes que recibían AAS durante 6 meses, la erradicación de H. pylori fue tan eficaz como el omeprazol en la prevención de la recurrencia de HDA47. En otro estudio se evidenció que la erradicación de la infección per se reduce la incidencia de hemorragia por úlcera péptica en pacientes de riesgo alto (historia de hemorragia previa), similar a la que presentan los pacientes sin factores de riesgo48.
AAS en el ancianoHay que tener en cuenta varios aspectos en este grupo de pacientes, no sólo el aumento del riesgo absoluto de presentar complicaciones gastrointestinales se relacionadas con la edad, sino también la coexistencia de otras enfermedades, o la polimedicación, que en muchas ocasiones incluye otro AINE diferente del AAS. Hay otros factores, como el incumplimiento de las órdenes médicas o, aún más importante, la automedicación del AAS, que impiden un manejo adecuado del riesgo particular en función de los factores objetivos que pueda reunir el paciente que se automedica49.
Un metaanálisis de 22 estudios epidemiológicos encontró que globalmente el RR de HDA en los pacientes que toman AAS en bajas dosis50, fue de 2,6 (IC del 95%, 2,4–2,7). Este riesgo era diferente según el grupo etario. Así, en términos absolutos, el riesgo de complicaciones ulcerosas en pacientes con menos de 50 años de edad fue inferior al 0,5% anual, mientras que en los pacientes de 70-79 años fue cercano al 4%, y aproximadamente un 6% en los pacientes mayores de 80 años. Por otro lado, la presencia de cualquiera de los otros factores de riesgo en los ancianos incrementa sustancialmente su ya alto riesgo de base (fig. 1).
ConclusiónEl AAS en dosis bajas (75–325mg), como indicación para la prevención de la ECV de origen trombótico, ha demostrado su utilidad al disminuir la incidencia de dicha enfermedad. Cada día son más numerosos los pacientes que requieren esta prescripción, en especial los de mayor edad y con más factores de riesgo. Este efecto beneficioso y su bajo precio hacen que su uso aumente día a día en la población susceptible de tratamiento. Sin embargo, el hecho de que su efecto beneficioso se acompañe de un aumento del riesgo de efectos adversos, sobre todo gastrointestinales, conlleva la necesidad de conocer los factores de riesgo y las medidas disponibles para reducir su impacto. El riesgo basal de HGI en pacientes que toman AAS en prevención cardiovascular es bajo, pero en presencia de factores de riesgo éste puede aumentar de manera significativa si no se adoptan medidas preventivas. Entre los factores que incrementan el riesgo de manera clara están la edad avanzada, el antecedente de úlcera o hemoragia digestiva previa, la asociación con anticoagulantes, la combinación de agentes antiplaquetarios, el aumento de la dosis de AAS, y la asociación con otros AINE o coxibs. En estos pacientes se deben de coprescribir IBP. La erradicación de la infección por H. pylori puede ser una mediad adicional que reducirá el riesgo basal de estos pacientes, pero en presencia de un riesgo elevado puede no ser suficiente. La alternativa al AAS con otros antiagregantes no parece que ofrezca ventajas clínicamente significativas, pues estos agentes también aumentan la incidencia de HDA en los pacientes de riesgo de manera similar a lo observado con AAS en dosis bajas. Por otra parte, la frecuente asociación de AAS a copidogrel u otros antiagregantes potencia el riesgo de HDA. Independientememte a la existencia de factores de riesgo, estos pacientes también deben recibir gastroprotección, si bien la evidencia en este sentido es más limitada.