El sarcoma de Kaposi es una neoplasia vascular de bajo grado, de la cual existen cuatro variantes fundamentales, una de las cuales se relaciona con el virus de la inmunodeficiencia humana. Sus manifestaciones más características son la presencia de lesiones mucocutáneas y la afectación de los ganglios linfáticos. El tracto gastrointestinal está implicado en el 40% de los casos, aunque la aparición de lesiones en el recto y en el canal anal es excepcional. Presentamos el caso de un varón de 39 años con virus de la inmunodeficiencia humana positivo, diagnosticado endoscópicamente de sarcoma de Kaposi con afectación colorrectal y del canal anal, y sin lesiones cutáneas asociadas que presentó una respuesta parcial al tratamiento antirretroviral combinado con quimioterapia sistémica y una remisión local al aplicar radioterapia sobre la lesión anal.
Kaposi's sarcoma (KS) is a low-grade vascular tumor, with four main variants, one of which is fairly prevalent in HIV-infected patients. Mucocutaneus and lymph node involvement is characteristic. The gastrointestinal tract is involved in 40% of patients, but rectal and anal canal involvement is exceptional. We report the case of a 39-year-old HIV-infected man with an unusual presentation of KS with colorectal and anal canal involvement in the absence of cutaneous disease. The patient was treated with highly active antiretroviral therapy and systemic chemotherapy, with partial response. Local radiation therapy of the rectum produced local remission.
El sarcoma de Kaposi (SK) es una neoplasia vascular de bajo grado asociada a la infección por el virus herpes humano 8 (VHH-8). La variante clínica más prevalente en nuestro medio es la asociada a la infección por el virus de la inmunodeficiencia humana (VIH). La morfología, el número, el color, el tamaño y la distribución (endoscópica) de las lesiones en el tracto gastrointestinal son muy variables. El diagnóstico requiere una confirmación histológica, siendo especialmente relevante el estudio inmunohistoquímico con anticuerpos que confirmen el origen vascular de la celularidad neoplásica así como la presencia de VHH-81. El tratamiento se basa en la combinación del tratamiento antirretroviral y la quimioterapia sistémica, empleando en casos seleccionados la radioterapia y otros tratamientos locales2.
Observación clínicaVarón de 39 años diagnosticado en diciembre de 2007 de infección por VIH estadio C2 y sífilis latente tardía, que recibió el tratamiento antirretroviral de gran actividad (TARGA) durante 15 días, suspendiéndolo por efectos secundarios y sin realizar un seguimiento posterior. En enero de 2009 ingresó en nuestro centro por astenia y síndrome constitucional con adenopatías múltiples de 8 meses de evolución. Presentaba, además, odinofagia, cambio de tonalidad de la voz y rectorragia con dolor anal al realizar la deposición. El paciente no refería síndrome febril ni sudoración nocturna y negaba hábitos tóxicos. En la exploración física se encontraba afebril, sin objetivarse lesiones cutáneas y presentaba múltiples adenopatías bilaterales, dolorosas y móviles localizadas en los territorios retroauricular, occipital, laterocervical, supraclavicular, axilar e inguinal. Los hallazgos analíticos fueron los siguientes: creatinina de 0,61mg/dl; sodio de 131mmol/l; potasio de 4,4mmol/l; transaminasa glutamicooxalacética (o AST) de 45U/l; transaminasa glutamicopirúvica (o ALT) de 43U/l; bilirrubina total de 0,5mg/dl; lactato deshidrogenasa de 731U/l, creatinkinasa de 22U/l; proteína C reactiva de 28mg/l. En el hemograma destacó hemoglobina de 7,8g/dl; un recuento de leucocitos de 6,9×103/μl con fórmula normal (el 60% de neutrófilos), y un recuento de plaquetas de 64×103/μl. La coagulación y la gasometría venosa fueron normales. El estudio serológico confirmó infección por VIH siendo el recuento de 306cel/μl (20,4%) y la carga viral de VIH en plasma de 136.000copias/μl. El resultado del Mantoux fue negativo.
Con la sospecha de un síndrome linfoproliferativo se solicitó una TC cervicotoracoabdominopélvica en la que se identificaron múltiples conglomerados adenopáticos de tamaño patológico con afectación difusa en todos los territorios ganglionares cervicales, una gran masa orofaríngea interamigdalar y adenopatías necrosadas en el mediastino, el retroperitoneo, la pelvis y la región inguinal. Fue valorado por el servicio de otorrinolaringología realizándose una traqueotomía con cervicotomía y exéresis de la masa orofaríngea, además de una biopsia de adenopatías cervicales.
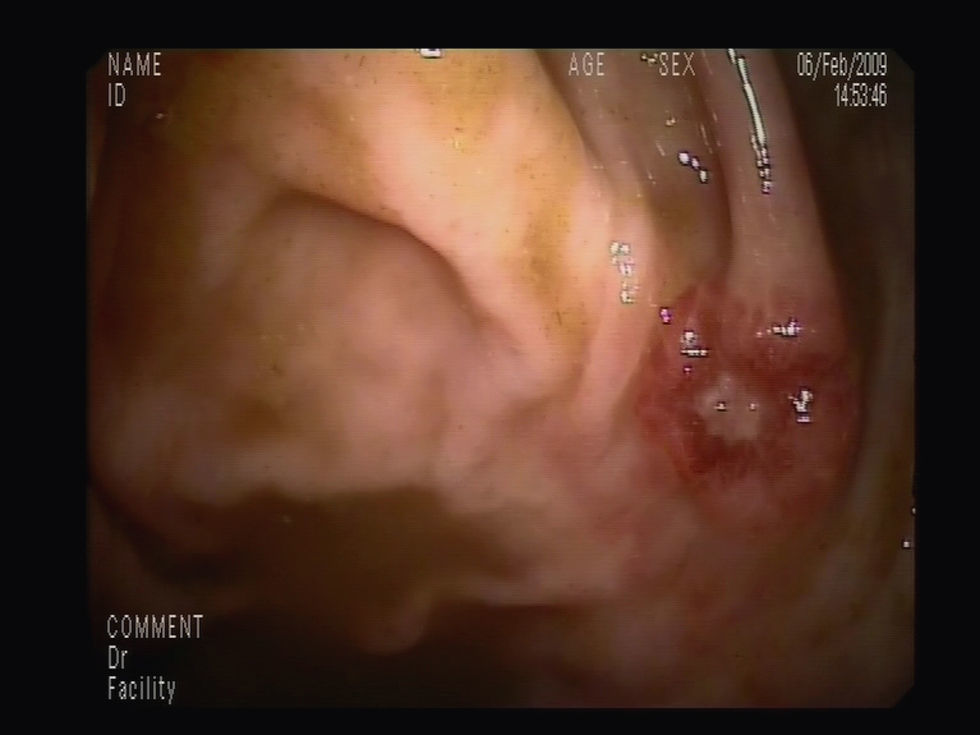
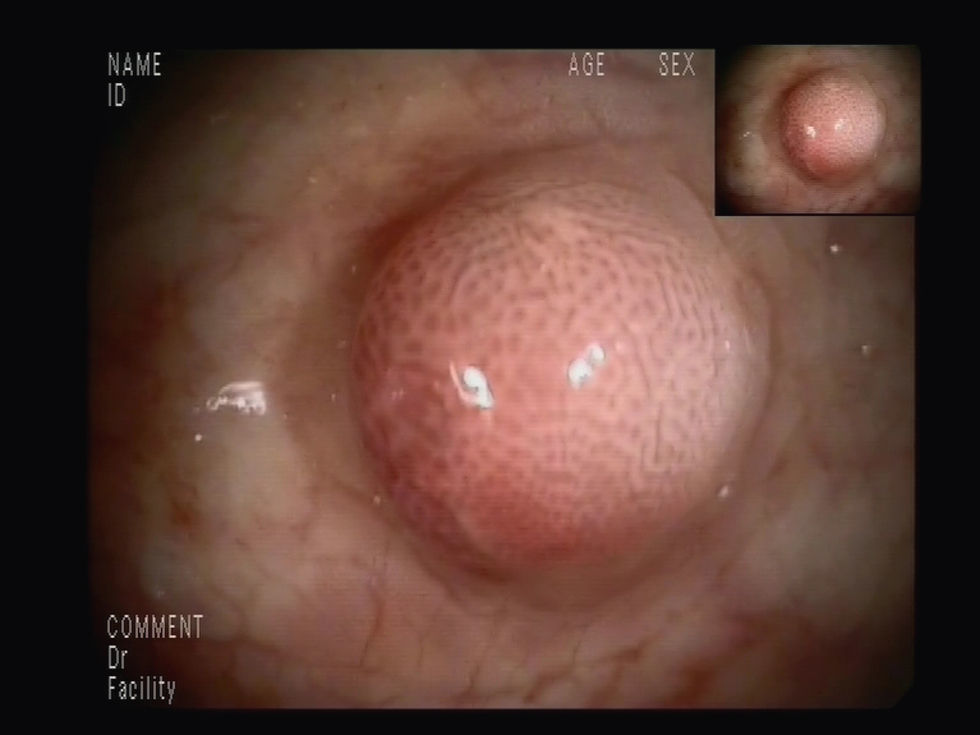
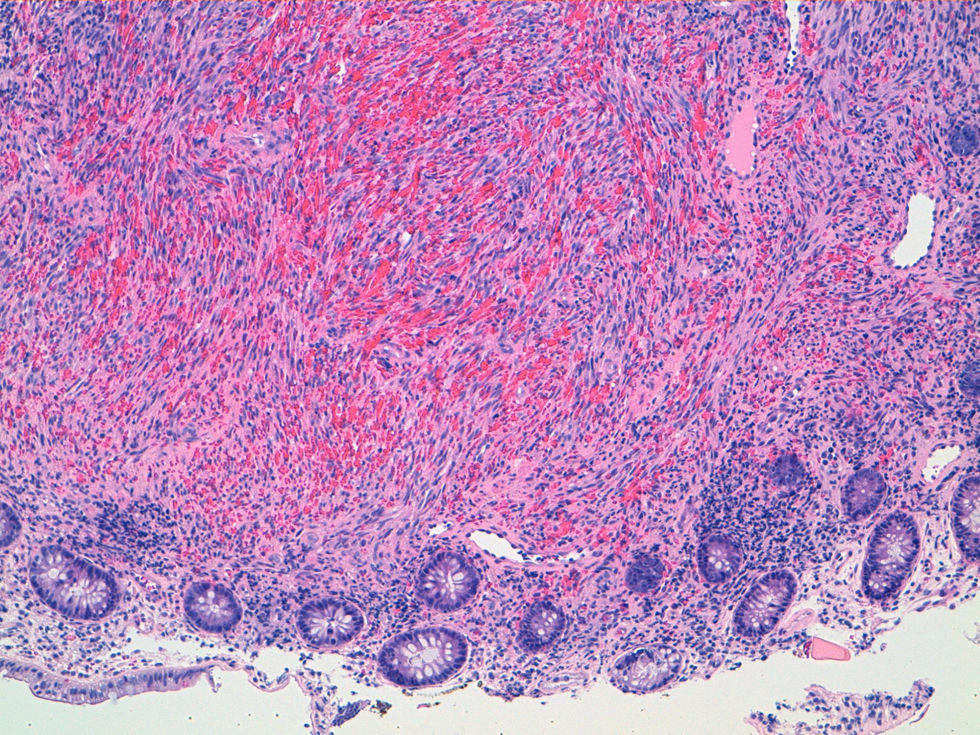
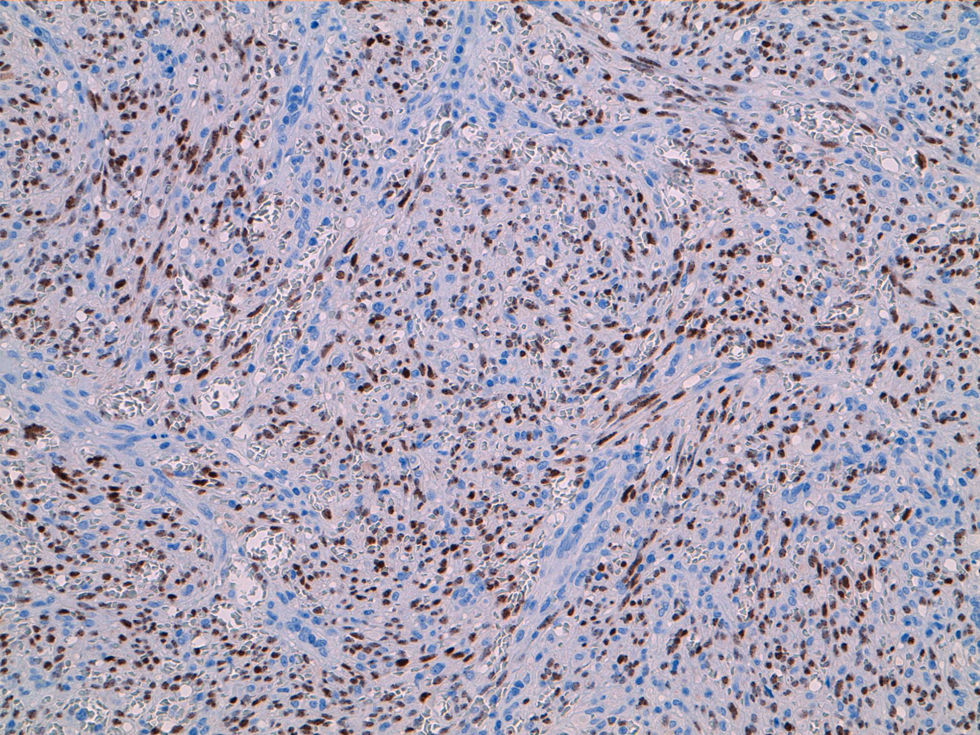
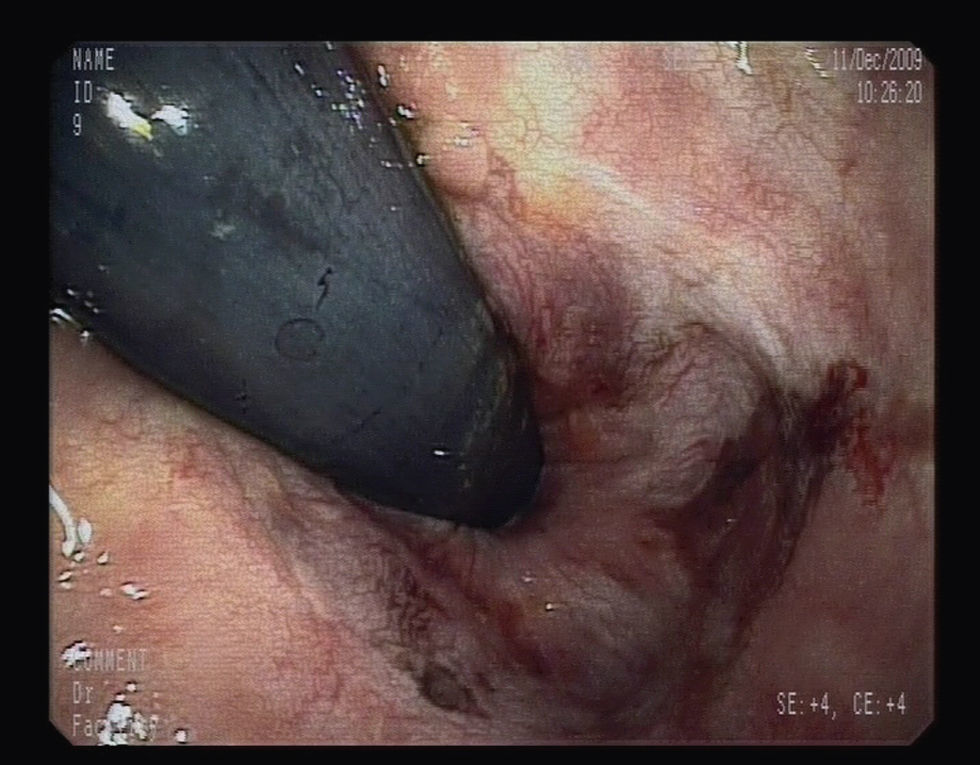
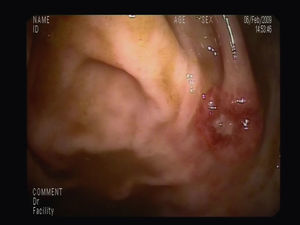
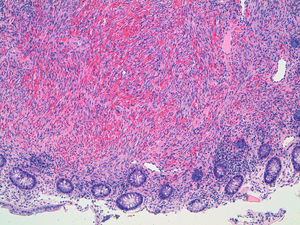
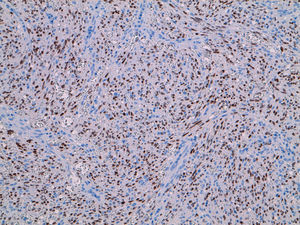
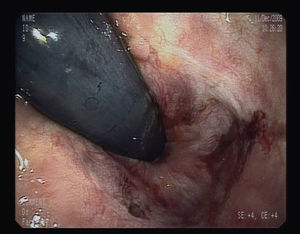
Para completar el estudio de anemia asociada a la rectorragia se solicitó una colonoscopia completa con ileoscopia, objetivándose una mucosa de íleon y colon rigurosamente normal, identificando 3 lesiones maculopapulosas, eritematosas y con centro de fibrina a nivel del polo cecal (fig. 1), y otras dos de aspecto muy vascularizado, violáceas, seudopolipoideas, de aproximadamente 1cm en el recto (fig. 2). En el canal anal se visualizó, además, una tumoración no estenosante, en forma de rodete, que ocupaba el 50% de la circunferencia y también presentaba aspecto hipervascular. Se tomaron biopsias de las lesiones de la mucosa del ciego, el recto y de la masa en el canal anal cuyo estudio histológico demostró una infiltración de la mucosa por una población tumoral fusocelular de abundante celularidad, de patrón estoriforme, con escaso pleomorfismo y moderada actividad proliferativa, con formación de canales o hendiduras vasculares con hematíes en su interior (fig. 3). Dichas células tumorales presentaban en el estudio inmunohistoquímico positividad para CD31, CD34, podoplanina (D2-40) (marcadores de células endoteliales), VHH-8 (marcador viral) (fig. 4) y vimentina focal (marcador de estirpe mesenquimal); inmunorreactividad negativa para citoqueratinas de alto y bajo peso molecular, CMV, HMB-45, S-100, actina, factor viii, CD21 y CD23 (marcadores epiteliales, melánicos y dendríticos, entre otros). El índice de proliferación celular Ki-67 se estimó en torno al 30%. Las biopsias de la masa orofaríngea mostraron similares características histológicas e inmunohistoquímicas. A la luz de los hallazgos anatomopatológicos y con el apoyo de los resultados inmunohistoquímicos se estableció el diagnóstico de certeza de SK en las muestras gastrointestinales, orofaríngeas y adenopáticas.
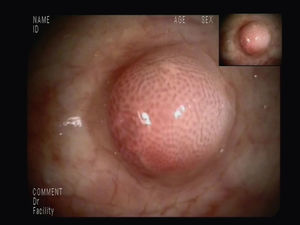
Se inició el tratamiento antirretroviral con la asociación de emtricitabina/tenofovir y lopinavir/ritonavir y el paciente fue remitido a consultas de oncología donde se instauró el tratamiento con radioterapia y supositorios de esteroides ante la persistencia de la sintomatología rectal consistente en importante dolor perianal. Tras 10 sesiones de radioterapia presentó una gran mejoría sintomática y desaparición del sangrado rectal, por lo que se inició el tratamiento quimioterapéutico con 8 ciclos de doxorrubicina liposomal pegilada de 20mg/m2, presentando una excelente tolerancia y una disminución objetiva del tamaño de las adenopatías. En la colonoscopia de control realizada a los 10 meses de la exploración inicial y tras recibir tratamiento local con radioterapia, se observó una mejoría muy significativa de la masa rectal (fig. 5), que prácticamente había desaparecido, persistiendo únicamente dos lesiones de pequeño tamaño, una en el ciego y otra en el recto.
DiscusiónEl SK es una proliferación vascular multifocal que puede afectar a la piel, las mucosas y los órganos internos. Afecta fundamentalmente a varones. Se ha clasificado en cuatro variantes clínicas: clásica o mediterránea; endémica o africana; epidémica o asociada al VIH, y iatrógenica en pacientes inmunodeprimidos receptores de trasplantes de órganos3. En nuestro medio, la variante clínica más prevalente es la relacionada con el VIH, aunque su incidencia se ha reducido en la última década como consecuencia de la generalización del TARGA, que ha conseguido disminuir la agresividad, reducir la morbimortalidad y modificar el pronóstico de la enfermedad4.
La evolución del SK asociado al VIH es extremadamente variable, oscilando entre la mínima expresión de la enfermedad encontrada de forma incidental y una neoplasia rápidamente progresiva. Su evolución depende fundamentalmente de factores relacionados con la inmunidad del huésped y de la extensión de la enfermedad. La afectación cutánea y de los ganglios linfáticos es lo más habitual, pero no es infrecuente la aparición de lesiones viscerales en la cavidad oral, el tracto digestivo y/o el aparato respiratorio. La afectación visceral del tracto gastrointestinal afecta a un 40% de pacientes en el momento del diagnóstico y puede ocurrir en ausencia de lesiones cutáneas. El SK puede aparecer en cualquier localización del tubo digestivo, aunque afecta predominantemente al tracto gastrointestinal alto a nivel gástrico5. En un estudio con 50 pacientes con SK con afectación gastrointestinal, únicamente el 8% presentó afectación colorrectal6. La afectación rectal es excepcional7. La mayoría de las lesiones del tracto gastrointestinal son silentes, aunque pueden manifestarse clínicamente como pérdida de peso, dolor abdominal, vómitos y diarrea, malabsorción, obstrucción intestinal o sangrado digestivo.
La morfología, el número, el color, el tamaño y la distribución endoscópica de las lesiones del tracto gastrointestinal son muy variables, pudiendo encontrar lesiones nodulares de aspecto hemorrágico, seudopólipos color púrpura azulados o maculopápulas color rojo vinosas. Los hallazgos histológicos incluyen la proliferación de células fusiformes, mitosis centrales, hendiduras vasculares con eritrocitos en su interior, acompañados por macrófagos cargados con hemosiderina y, ocasionalmente, un infiltrado inflamatorio linfocitario. Sin embargo, es importante tener en cuenta que las lesiones pueden comprometer a la submucosa dificultando el estudio histológico; por este motivo, el estudio inmunohistoquímico es fundamental y colabora en confirmar la sospecha anatomopatológica a través de la inmunorreactividad positiva a marcadores de estirpe vascular (CD31, CD34) y el marcaje inmunohistoquímico de componentes virales del VHH-8.
El tratamiento del SK en pacientes infectados por el VIH es el TARGA. A este se añadirán o no terapias coadyuvantes (quimioterapia sistémica, tratamiento local/tópico, radioterapia, etc.) en función de la afectación visceral y la extensión de la enfermedad8. El inicio del TARGA puede seguirse del síndrome de reconstitución inmune, un efecto paradójico consistente en un empeoramiento del cuadro clínico y una progresión acelerada de la enfermedad en las primeras 4–6 semanas como consecuencia de la recuperación del sistema inmune del paciente9. La quimioterapia sistémica se emplea generalmente en pacientes con enfermedad avanzada o evidencia de rápida progresión (afectación cutánea extensa con mala respuesta al tratamiento local/tópico, síndrome de reconstitución inmune, edema generalizado y afectación visceral sintomática). Los agentes quimioterapéuticos más utilizados son las antraciclinas liposomales (doxorrubicina y daunorrubicina). La radioterapia administrada previamente al TARGA se emplea, como en nuestro paciente, para reducir el volumen de las lesiones sintomáticas localizadas10. Actualmente no existe tratamiento específico dirigido contra el VHH-8.
Los autores consideramos relevante el caso clínico anteriormente expuesto por varios motivos: por un lado, la afectación visceral digestiva del SK en ausencia de lesiones cutáneas; por otro lado, la afectación simultánea del colon y el recto, con la peculiaridad de afectar al canal anal (localización relativamente rara dentro del tracto gastrointestinal) y de presentar lesiones de diferente semiología endoscópica en un mismo paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.