INTRODUCCIÓN
La mayoría de neoplasias gastrointestinales se originan en el epitelio superficial y presentan un fenotipo común, que es la progresión desde mucosa normal a displasia y, final-mente, a cáncer. Con el desarrollo del vídeo y unidades de carga acoplada (CCD), la tecnología endoscópica ha evolucionado de forma que los gastroenterólogos son capaces de visualizar y almacenar imágenes de alta resolución del tubo digestivo. Esto ha permitido cambiar el manejo de las lesiones precancerosas y cancerosas en el tracto gastrointestinal y el árbol biliar de forma inequívoca. Sin embargo, quedan todavía dificultades significativas, sobre todo en relación con la capacidad diagnóstica. Existen 3 importantes dificultades que se presentan en el diagnóstico de displasia. En primer término, la displasia no es identificable al ojo del endoscopista y, para poder detectarla, se tiene que relacionar con cambios morfológicos evidentes como son los pólipos. En segundo lugar, es imposible delimitar las áreas de displasia de las normales y, por lo tanto, una vez obtenido el diagnóstico histológico con su retraso habitual (24-48 h), no es posible asegurar el área de donde provenía la biopsia y, por consiguiente, no se puede administrar un tratamiento local. Por último, existe una importante discordancia entre patólogos a la hora de interpretar la displasia. Esto significa que muchas lesiones son invisibles o difíciles de visualizar con el endoscopio estándar de luz blanca y que todavía se requiere mapeo histológico con biopsias múltiples para el seguimiento de varias enfermedades. Aún más, aunque las lesiones sean visibles, sigue siendo necesario tomar biopsias para que el patólogo establezca el diagnóstico definitivo, que a veces es controvertido.
Parece lógico, por lo tanto, pensar que el próximo avance en endoscopia consista en lograr identificar estas lesiones invisibles y poder obtener un diagnóstico microscópico inmediato sin necesidad de biopsias o, como mínimo, rentabilizándolas. En los últimos años se han desarrollado múltiples técnicas que pretenden ir más allá y realizar una «biopsia óptica» que permita obtener una información más precisa desde el punto de vista tanto morfológico como funcional. Algunas de estas técnicas, como la cromoendoscopia y la magnificación, son ya una realidad en la práctica clínica, mientras otras se encuentran todavía en un plano meramente de investigación. El objetivo de este trabajo es revisar estas técnicas emergentes, sus bases y sus aplicaciones. Las potenciales aplicaciones clínicas de estas técnicas se enumeran en la tabla I1.
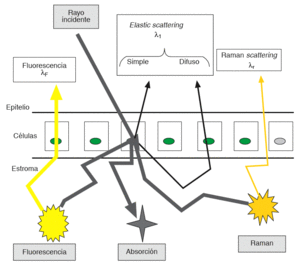
BASES ESPECTROSCÓPICASLa espectroscopia es una técnica que logra hacer visible lo invisible y es capaz de dar información morfológica y bioquímica sin necesidad de biopsias, de fijación ni procesamiento de muestras. El haz de luz no distorsiona la arquitectura y, por lo tanto, permite obtener información in situ y en tiempo real. El espectro de luz se extiende desde las ondas más cortas, en el ultravioleta, a las más largas, cercanas al infrarrojo (CIR). El ultravioleta y el azul son absorbidos por biomoléculas que producen fluorescencia. El espectro de banda visible está dominado por la absorción de la hemoglobina y presenta una profundidad de penetración relativamente baja (< 100 µm), lo cual es útil para las técnicas de imagen. El CIR no es tan absorbido por la hemoglobina y puede penetrar hasta 1.000 µm. Los videoendoscopios utilizan unos detectores (CCD) sensibles a la luz visible y al CIR. La interacción entre la luz y el tejido es compleja. Esta interacción, en algunos casos, consiste en cambios de frecuencia y en otros en redireccionamientos del haz de luz. Básicamente depende de la transferencia de energía entre las partículas de luz (fotones) y las partículas de materia, que incluye electrones, átomos y moléculas, así como células, gránulos y organelas. En la figura 1 se muestran de forma esquemática los diferentes tipos de interacción que nos interesan:
Fig. 1. Tipos de interacción entre la luz y la materia.
Definición
Se trata de un grupo de técnicas que permiten visualizar una superficie amplia de mucosa (1 cm2) y distinguir en ella áreas con patrón mucoso distinto y susceptibles de toma de biopsia. Estas técnicas son capaces de crear un mapa, pero incapaces de dar una información lo suficientemente precisa desde el punto de vista morfológico y funcional para obviar la necesidad de un posterior estudio microscópico. Son, por lo tanto, útiles para mejorar el rendimiento del mapeo con biopsias.
Cromoendoscopia
Esta técnica forma parte de la práctica clínica habitual desde hace más de 10 años y ha demostrado ser útil sobre todo para la detección de cáncer precoz en el esófago de Barrett2, para el diagnóstico de displasia en la enfermedad inflamatoria intestinal3-5 y para la detección de pólipos colónicos con la ayuda de la magnificación6,7. Dado que este tema ya está ampliamente revisado y actualizado en la bibliografía médica, no nos extenderemos más.
Imagen de banda estrecha (narrow band imaging, NBI)
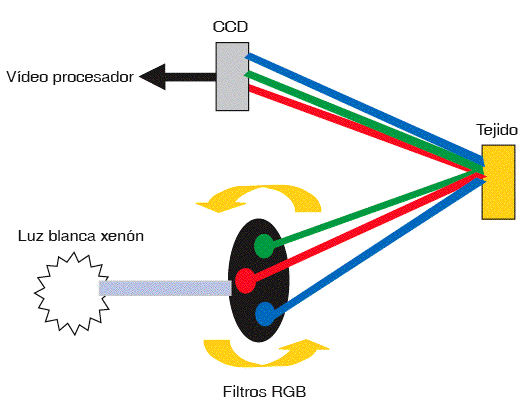
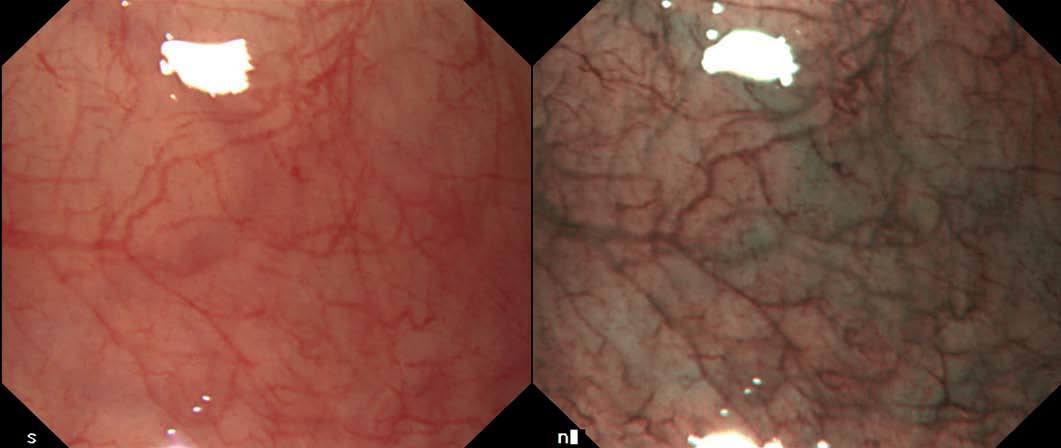
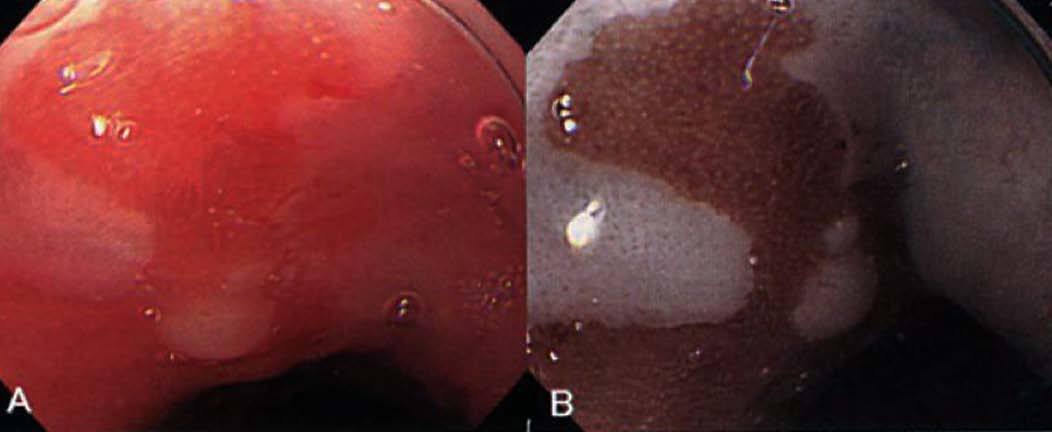
Este sistema consiste en la utilización de unos filtros de color rojo-verde-azul que rotan enfrente de la lámpara de luz blanca convencional dando una luz de banda estrecha, en lugar de la habitual luz blanca de banda ancha (fig. 2). Esta luz se emite de forma secuencial y el CCD detecta cada una de las imágenes obtenidas. El procesador compone las distintas imágenes obtenidas con la luz de banda estrecha y produce la imagen final. Teniendo en cuenta que a mayor longitud de onda, mayor penetración, la luz azul (longitud de onda corta) penetra muy poco y refleja, por lo tanto, las imágenes más superficiales representando la red capilar de la mucosa superficial. La luz verde penetra más y reproduce las imágenes de los vasos profundos, y la luz roja refleja las estructuras tisulares profundas (fig. 3). Este sistema está comercializado por Olympus (Olympus EVIS GIFQ240Z, Olympus EVIS CF-Q240Z), pero se encuentra en una fase todavía preliminar. Hasta la fecha los trabajos realizados han demostrado que es útil para el estudio de las neoplasias precoces de esófago, ya que per-mite detectar los tumores que invaden la submucosa y que no serían candidatos a tratamientos locales, con un rendimiento del 78% (comparado con el 61% en el caso de la cromoendoscopia con magnificación en manos de endoscopistas inexpertos)8. También se ha demostrado que esta técnica es mejor que la endoscopia convencional para la detección del esófago de Barrett9 (fig. 4) y se ha visto que puede ser útil para predecir las características histológicas del cáncer gástrico precoz10. Por otro lado, por lo que se refiere al colon, en un estudio piloto reciente en que se evaluó la utilidad de la NBI para distinguir los pólipos neoplásicos de los no neoplásicos en comparación con la endoscopia convencional y la cromoendoscopia, se observó que la NBI aportaba una información complementaria y presentaba un rendimiento similar a la cromoendoscopia11. Asimismo, 2 estudios preliminares recientes han demostrado que es una técnica válida para la detección de displasia en colitis ulcerosa de larga evolución12.
Fig. 2. Imagen de banda estrecha. CCD: dispositivo de carga acoplada; filtros RGB: filtros rojo, verde y azul (de red, green y blue).
Fig. 3. Mucosa plana normal visualizada con endoscopio convencional (A) y con imagen de banda estrecha (B).
Fig. 4. Unión escamocolumnar en un esófago normal visualizada con endoscopio convencional (A) y con imagen de banda estrecha (B).
Imagen endoscópica por fluorescencia (fluorescence endoscopy, laser/light-induced fluorescence spectrocopy, LIFE)
La fluorescencia ha sido una de las propiedades de la luz más empleadas en biomedicina. La irradiación de luz con una longitud de onda específica conduce a la excitación de los fluoróforos endógenos o exógenos, haciendo que los electrones pasen a un estado de energía superior. La posterior relajación de los electrones induce la emisión de la típica luz fluorescente. Existen 2 tipos de fluorescencia: la autofluorescencia y la fluorescencia exógena. La primera se debe a la existencia de sustancias intrínsecas que producen fluorescencia, como la NADH, flavinas, aminoácidos aromáticos, colágeno, elastina, porfirinas, ceramidas y lipofuscina. Estas sustancias se activan a longitudes de ondas determinadas. Los cambios metabólicos secundarios a la inflamación, isquemia y displasia provocan cambios en el estado oxidativo y metabólico de las células, y esto lleva a un cambio en la autofluorescencia del tejido. Además, como la luz ha de ser capaz de atravesar el tejido, cuando la mucosa se encuentra engrosada, disminuye la autofluorescencia del colágeno y elastina. Por otro lado, para la fluorescencia exógena, la sustancia más empleada en el campo del diagnóstico es el ácido 5-aminolevulánico (5-ALA). Esta sustancia se convierte en el ámbito intracelular en una sustancia fotoactiva endógena que es la protoporfirina IX. Las células neoplásicas presentan una reducción de la actividad ferroquelatasa que comporta la acumulación de protoporfirina IX y, por lo tanto, una mayor fluorescencia al estímulo de luz ultravioleta. La fluorescencia se utiliza como técnica de mapeo mediante endoscopios conectados a una fuente de luz blanca o azul y a espectrómetros que reinterpretan la señal. Se puede obtener la imagen convencional y la de fluorescencia durante el mismo procedimiento, mediante un cambio en la fuente de luz y en el equipo de captación de la señal. Existen 2 modelos en el mercado: el D-Light de Storz (Alemania) y el LIFE-GI de Xillix (Canadá). El D-Light recoge la autofluorescencia y la fluorescencia exógena mediante administración de 5-ALA por vía oral y requiere una fuente de luz blanca de xenón con un filtro especial (440 nm). El LIFE-GI se basa en la autofluorescencia de forma que los tejidos neoplásicos aparecen más rojos y los normales, más verdes. Este último sistema es muy poco práctico, ya que es difícil de manejar y requiere mucho tiempo para la interpretación. En estos momentos existe un nuevo sistema (LIFEII) que pretende superar estas dificultades técnicas. Desde un punto de vista clínico estas técnicas tendrían un espacio en la detección de displasia, puesto que para las neoplasias precoces colónicas (pólipos) la endoscopia de alta resolución, con o sin cromoendoscopia, ha logrado ya unos resultados muy satisfactorios y difíciles de mejorar. Las indicaciones que parece que van a ser útiles son, por lo tanto, la detección de displasia en el esófago de Barrett13,14, la detección de cáncer gástrico precoz en pacientes de riesgo15 y el seguimiento de los pacientes con afectación colónica por enfermedad inflamatoria intestinal de larga evolución16. Sin embargo, una limitación importante de esta técnica es que tiene dificultades para diferenciar los procesos inflamatorios de los neoplásicos, ya que la autofluorescencia se encuentra alterada en am-bas situaciones. Por ello, las cifras de sensibilidad y especificidad son relativamente bajas y se han visto diferencias significativas entre los experimentos in vitro que se realizaron en los años noventa y la experiencia in vivo. Aunque es posible que con la fluorescencia exógena se pueda solventar alguno de estos problemas, los sistemas de imagen por fluorescencia disponibles hasta la fecha son todavía poco prácticos y están sólo a disposición de algunos centros.
TÉCNICAS DE CONTACTODefinición
Se trata de un grupo de técnicas que permiten obtener información química y morfológica detallada, pero en un área máxima de 1 mm2. Suelen consistir en sondas delgadas y flexibles que se introducen por el canal operativo del endoscopio convencional. Estas sondas, que están formadas por una fibra central emisora y 6-9 fibras periféricas receptoras, se apoyan de forma suave sobre el tejido emitiendo una luz concreta y recogiendo la señal de respuesta que luego será captada por unos instrumentos de detección y reinterpretada por ordenador mediante modelos matemáticos y estadísticos.
Reflectancia difusa (diffuse reflectance spectroscopy, DRS)
Se trata de una técnica que capta la intensidad del reflejo del haz después de múltiples rebotes, sin cambiar de longitud de onda. Los elementos que provocan la reflexión de la luz pueden ser intracelulares (núcleos y mitocondrias) y extracelulares. Con esta técnica la profundidad de penetración es importante (0,5-1,5 mm), con lo que se obtiene información sobre la estroma. Hasta la fecha no existe ningún trabajo que haya demostrado que esta técnica sea por sí sola suficiente para detectar cambios en la mucosa, por lo que se utiliza combinada con las demás técnicas espectroscópicas17.
Light scattering spectroscopy (LSS)
Esta técnica permite captar la intensidad del reflejo del haz después de un rebote simple, sin cambiar de longitud de onda. Este rebote simple representa tan sólo del 2 al 5% de la luz reflejada. Las sustancias que provocan este reflejo son la trama colágena de la matriz extracelular, las mitocondrias, los núcleos celulares y otras estructuras intracelulares. En este caso, el haz que se estudia ha penetrado poco y aporta información sobre el número, tamaño y densidad óptica de las estructuras celulares del epitelio y, en especial, sobre sus núcleos. Se trata, pues, de una técnica con importante potencial para la detección de metaplasia y displasia en sus diferentes grados18. En un trabajo preliminar presentado recientemente, en el que se evaluó su utilidad para la detección de displasia de alto grado y cáncer en el esófago de Barrett, se obtuvieron cifras de sensibilidad, especificidad y valor predictivo negativo del 71, el 90 y el 96%, respectivamente19. De la misma forma, en las lesiones colónicas se observó que también era capaz de distinguir entre pólipos hiperplásicos y adenomatosos (sensibilidad y especificidad del 84%), entre adenoma y cáncer (sensibilidad del 80% y especificidad del 75%), entre mucosa normal e inflamatoria (sensibilidad del 77% y especificidad del 82%) y entre mucosa inflamatoria y con displasia (sensibilidad del 85% y especificidad del 88%)20. Se trata, pues, de una técnica prometedora y complementaria a la reflectancia difusa, pero, como todas las de contacto, presenta la limitación de que tan sólo es capaz de analizar un área de 1 mm2, por lo que se ve sujeta a errores de muestreo.
Espectroscopia de fluorescencia (LIFS)
Es una técnica espectroscópica que se basa en el fenómeno de fluorescencia. Es rápida, fácil de implementar y sensible a los pequeños cambios bioquímicos de la célula, por lo que es la técnica de contacto más empleada hasta la fecha. Los diversos trabajos publicados han demostrado que es capaz de distinguir el epitelio normal del esófago de Barrett y del cáncer de esófago con sensibilidad del 86% y especificidad del 95%21,22, así como la existencia de displasia en el esófago de Barrett con sensibilidad del 77% y especificidad del 71%23. En las enfermedades colónicas su rentabilidad es mayor: logra distinguir el colon normal de los pólipos hiperplásicos y adenomas con sensibilidad de hasta el 100% y especificidad del 97%24, y mucosa displásica con sensibilidad del 90% y especificidad del 95%25.
Espectroscopia de fluorescencia intrínseca (IFS)
Se trata de un perfeccionamiento de la espectroscopia de fluorescencia que optimiza la captación de la señal al extraer la fluorescencia de las moléculas no afectadas por la absorción ni por la reflectancia. Efectivamente, una limitación de la fluorescencia es que se ve distorsionada por los demás fenómenos de la luz (absorción y reflejo). Esto resulta particularmente importante cuando existen elementos absorbentes intensos como es la hemoglobina. Esta técnica logra de alguna manera amplificar la señal fluorescente y que sea más específica. Hasta la fecha un sólo trabajo ha evaluado su utilidad en pacientes, en combinación con otras técnicas17.
Espectroscopia trimodal (TMS)
Consiste en la combinación de 3 modalidades de espectroscopia: la reflectancia (DRS), fluorescencia (IFS) y rebote elástico (LSS). Como ya se ha comentado, estas 3 técnicas son complementarias, ya que aportan de forma simultánea información bioquímica, estructural y morfológica del epitelio y de la estroma. Esta combinación ha demostrado ser la más específica y sensible para distinguir los grados de displasia en el esófago de Barrett; es capaz de detectar displasia con una sensibilidad del 93% y una especificidad del 100%, y de distinguir entre los distintos grados de displasia (leve y grave) con una sensibilidad y especificidad del 100%17.
Time-resolved spectroscopy
Se basa en el tiempo de extinción de la fluorescencia excitada por un pulso corto de luz (nanosegundos). Su ventaja fundamental es que no está afectada por la reflectancia ni la absorción. En humanos se ha demostrado que la autofluorescencia se extingue más rápido en adenomas que en no adenomas, de forma que se pueden distinguir estos dos en función de la media de tiempo para la extinción, con cifras de sensibilidad del 85%, especificidad del 91% y valor predictivo negativo del 83%26. Sin embargo, en otro trabajo se comparó esta técnica con la espectroscopia de fluorescencia para el diagnóstico de displasia grave en el esófago de Barrett, sin observar mejoría en su rendimiento27. Es una técnica que se encuentra en una fase muy inicial y presenta importantes dificultades tecnológicas.
Espectroscopia de Raman
Se basa en una propiedad, que es el reflejo inelástico con pérdida de energía (emite otra longitud de onda más larga que la recibida) de la materia. Cada molécula tiene su manera de hacer rebotar la energía (huella dactilar) independiente de la longitud de la onda recibida. Se puede analizar con cualquier tipo de luz enviada. Esta técnica permite determinar la composición química cualitativa y cuantitativa de cada tejido. Sus principales limitaciones son que el efecto Raman es muy débil (sólo uno de cada 10 millones de fotones se convierten en raman scattered) y, por lo tanto, es difícil de captar, a lo que se añade que se encuentra enmascarado por LSS. Esta técnica, con un potencial importante, está todavía en una fase muy inicial y hasta la fecha prácticamente no existen endoscopios adaptados. Además, no se conoce a qué corresponden las diferentes ondas emitidas, por lo que de momento se obtiene una información indirecta. Recientemente se ha presentado el primer trabajo que utiliza una minisonda con esta técnica y en el que se demuestra que el rendimiento de la espectroscopia de Raman en la detección de esófago de Barrett es del 87%28. Asimismo, se ha visto que es posible distinguir los pólipos colónicos hiperplásicos de los adenomatosos con una sensibilidad del 100%, especificidad del 89% y rendimiento global del 95%29.
Tomografía de coherencia óptica
Se basa en una propiedad, que es la interferometría de baja coherencia. De forma esquemática, la reflectividad de cada profundidad se discrimina en función del tiempo de respuesta a cada pulso: a más tiempo, más profunda. Para su mayor comprensión, se suele realizar una analogía con la ecografía pulsada, en que se distinguen las diferentes capas o tejidos en función del tiempo que tarda en rebotar la onda acústica. La imagen que ofrece es muy similar a la de la ecoendoscopia. Además, se han ajustado los colores de forma que se mantiene la misma estructura en capas (el negro corresponde a mucosa y muscular, y el blanco, a interfase y submucosa). Como importante avance presenta una mayor discriminación que la ecoendoscopia (> 10 veces) y llega a presentar una resolución de 20 µm, lo que permite identificar correctamente criptas, bilis, vasos, glándulas y linfáticos, aunque no los núcleos30. Existen minisondas radiales y sectoriales que son muy duraderas y se desinfectan de forma estándar (sistema de la University Hospitals of Cleveland/Case Western Reserve University). Con esta técnica, a diferencia de la ecoendoscopia, no es necesario el acoplamiento acústico. Las principales limitaciones que presenta son que tan sólo alcanza 1-2 mm de profundidad (mucosa y submucosa), se necesita tiempo para obtener las imágenes y se requiere un aprendizaje que incluya interpretación de las imágenes (de forma similar a la ecoendoscopia) y conocimientos de anatomía patológica. Hasta la fecha se han publicado varios trabajos que demuestran su utilidad para el estudio de la vía biliopancreática, ya que las minisondas se pueden introducir en el interior de los conductos para obtener información sobre su pared31. Asimismo se ha utilizado para detectar displasia en el esófago de Barrett, con un rendimiento del 70% y un valor predictivo negativo del 91%32,33. Finalmente, en el colon ha demostrado no sólo ser capaz de distinguir los pólipos, sino también de distinguir criptas de hasta 60-70 µm34.
Microscopia confocal
Consiste en la obtención de un corte óptico de muestra celular o de tejido grueso y en la utilización de marcadores fluorescentes capaces de identificar receptores específicos de la célula. Se emplea un rayo láser ultravioleta muy fino y paralelo que provoca fluorescencia (autofluorescencia o fluorescencia exógena) justo en un punto. El haz de fluorescencia se capta después gracias a un filtro que impide la captación de las demás señales. De esta forma evita la interferencia de la luz externa al foco de estudio. Se reconstruyen las imágenes por ordenador. Esta técnica logra obtener secciones de 150 µm con mayor resolución que el microscopio óptico. Además, no es necesario hacer secciones finas, por lo que no hay que manipular el material y, en consecuencia, se pueden hacer exámenes in vivo. Por otro lado, como este método es capaz de captar la reflectancia y la fluorescencia, puede aportar información sobre las características morfológicas celulares y tisulares, así como sobre los cambios bioquímicos y moleculares de la mucosa. Sus limitaciones son que sigue siendo muy cara y que se requiere el uso de marcadores fluorescentes que a menu-do son tóxicos celulares. Recientemente se ha publicado el uso de una minisonda con esta técnica que ha permitido el estudio del colon. En este trabajo se administra fluoresceína por vía intravenosa y se observa que es posible detectar tejido neoplásico en el colon con una sensibilidad del 97% y una especificidad y rendimiento global del 99%35. Asimismo, en pacientes con colitis ulcerosa de larga evolución se evidencia que la combinación de una técnica de campo como la pancromoendoscopia con azul de metileno con esta técnica de contacto presenta una alto rendimiento en la detección de displasia (sensibilidad del 94%, especificidad del 96% y rendimiento global del 99%)36.
Microscopia multifotónica
Es la técnica que se encuentra todavía en la fase más experimental. De forma similar a la microsocopia confocal, logra realizar un corte óptico de una muestra celular o de tejido más grueso, utilizando marcadores fluorescentes capaces de identificar receptores específicos de la célula. Se emplean como mínimo 2 rayos láser infrarrojos paralelos muy finos que provocan fluorescencia (autofluorescencia o fluorescencia exógena) justo en un punto. Las ventajas que presenta son que se puede obtener información de secciones más gruesas y que es menos tóxico para las células vivas. Sin embargo, esta técnica presenta menor resolución que la microscopia confocal y todavía es muy cara y sofisticada.
CONCLUSIONES Y PERSPECTIVAS DE FUTURO
Desde su invención, la endoscopia ha permitido cambiar de forma sustancial el manejo y pronóstico de las enfermedades digestivas. Sin embargo, sigue siendo imprescindible la toma de biopsias para poder establecer el diagnóstico definitivo de las lesiones y para poder detectar la afección premaligna. En este artículo se han descrito unas técnicas emergentes que logran obtener información estructural, bioquímica y funcional de las células in vivo y en tiempo real. Estas técnicas se basan fundamental-mente en los principios físicos de la espectrometría y se pueden aplicar de forma que permiten detectar áreas amplias de tejido anómalo y aumentar el rendimiento de las biopsias (técnicas de mapeo) o en puntos muy concretos, logrando una información muy precisa que podría sustituir la histología convencional (técnicas de contacto). Los resultados iniciales van encaminados a mostrar que la mejor estrategia para el diagnóstico consiste en una combinación de varias de estas técnicas. Sin embargo, a pesar de que las técnicas espectroscópicas han evolucionado sustancialmente desde sus inicios, quedan todavía muchos avances por hacer y en la actualidad están sólo a disposición de centros muy concretos en el mundo. Para que se puedan incorporar a la práctica clínica habitual es importante disminuir al máximo el tamaño de los instrumentos, simplificar su utilización e interpretación y sobre todo abaratar su coste. Además, previamente, la capacidad diagnóstica de la combinación de estas técnicas deberíare desarrollar esta tecnología y que ésta sea útil no tan sólo para mejorar la detección de lesiones premalignas, sino también para poder identificar a los sujetos susceptibles de padecer una enfermedad concreta gracias a la detección de cambios en la carga genética o composición bioquímica de sus células epiteliales37, o para evaluar la respuesta en la célula diana de un tratamiento concreto y de forma directa (p. ej., respuesta a anticuerpos monoclonales en la enfermedad inflamatoria intestinal).