INTRODUCCIÓN
Las fístulas enterocutáneas del tracto digestivo son relativamente frecuentes en la práctica quirúrgica habitual, especialmente las posquirúrgicas, y sin embargo están escasamente tratadas en la literatura médica, probablemente porque la mayoría corresponden a complicaciones posquirúrgicas relacionadas, en algunas ocasiones, con defectos de la técnica quirúrgica. La estandarización de su tratamiento no ha sido posible hasta la fecha, y la compa ración de las distintas opciones terapéuticas comporta graves problemas metodológicos (variabilidad de localizaciones y del tipo de técnica quirúrgica, cuantía del débito de la fístula, tiempo de evolución de la fístula, situación clínica del paciente y tipo de la enfermedad subyacente que se trata quirúrgicamente).
Los pegamentos tisulares biológicos de fibrina se han desarrollado y utilizado extensamente por distintas especialidades quirúrgicas para conseguir una mejor adherencia tisular y la estabilización de las suturas1-3. Posteriormente se introdujeron en el arsenal endoscópico, especialmente para el tratamiento de fístulas traqueobronquiales y traqueoesofágicas4-6, gastrointestinales2,7-12, rectovaginales13 y perineales14,15.
El propósito de esta comunicación es presentar nuestra experiencia en el tratamiento endoscópico de distintos tipos de fístulas gastrointestinales, muchas de las cuales aparecieron como consecuencia de distintos procedimientos quirúrgicos.
PACIENTES Y MÉTODO
Se trata de un estudio observacional, retrospectivo, de nuestra experiencia en el tratamiento de 30 fístulas gastrointestinales durante los últimos 7 años, incluidas todas ellas en nuestra base de datos. Todas ellas fueron tratadas mediante sellado endoscópico con pegamentos biológicos de fibrina (Tissucol DUO®, Baxter, Viena, Austria) en distintas sesiones, hasta su cierre definitivo o hasta que el tratamiento se consideró fracasado tras varios intentos sin éxito.
Las fístulas se clasificaron como de alto o de bajo débito, de acuerdo con la cantidad de fluido que drenaban diariamente (>= 500 ml/día o < 500 ml/día), así como en fístulas externas o internas.
Consideramos externa una fístula cuando había un orificio fistuloso intraluminal, con un trayecto fistuloso que comunicara el tracto digestivo con un punto externo cutáneo por el que drenara material de procedencia gastrointestinal o colónica, y fístula interna cuando no hubiera comunicación con la piel16 (fístulas rectovesicales y rectovaginales). No fue posible clasificar algunas fístulas internas como de alto o bajo débito porque era imposible cuantificarlo (fístulas rectovesicales).
Manejo terapéutico
Una vez diagnosticada la fístula posquirúrgica, algunas con confirmación radiológica, se trató al paciente de modo conservador un mínimo de 10 días (dieta absoluta, fluidos intravenosos, nutrición parenteral, antibioterapia de amplio espectro y una infusión continua de somatostatina a 6 mg/24 h). Los primeros pacientes que se incluyeron en el estudio fueron tratados sin éxito de forma conservadora durante períodos muy superiores a 10 días.
Consideramos fracasado el tratamiento conservador cuando la fístula no se cerraba completamente o la cuantía de su débito no disminuía en al menos un 50%. Si la fístula no se había cerrado, se realizaba un estudio endoscópico para localizar y analizar las características del orificio fistuloso, y las posibilidades para el sellado endoscópico.
El diagnóstico de las fístulas gastrointestinales internas siempre se estableció mediante los apropiados estudios radiológicos con contrastes iodados, y posteriormente con el correspondiente estudio endoscópico.
Si una vez localizado el orifico fistuloso interno había alguna duda sobre su permeabilidad o su comunicación con el orificio fistuloso externo, se inyectaba azul de metileno para confirmar ambos aspectos.
Una vez localizado el orificio interno de la fístula, se cepillaba sus bordes con un cepillo de citología para erosionarlos y facilitar la adherencia del pegamento biológico. Posteriormente se inyectaba en el interior del trayecto 4-8 ml de Tissucol 2.0 Kit® (BAXTER) o Tissucol DUO® (BAXTER), que sustituyó al primero hace unos años. El endoscopista decidió en cada caso la cuantía del volumen del pegamento biológico a inyectar en función de la longitud del trayecto fistuloso, el diámetro de la fístula y la constatación de que el volumen final inyectado había sido suficiente para obtener un sellado completo del orificio y del tracto fistuloso. Una vez aplicado el pegamento biológico, se suspendía temporalmente todo drenaje aspirativo (un mínimo de 24-48 h) en las proximidades del trayecto fistuloso, para evitar la aspiración del pegamento antes de su completa solidificación e integración en el tracto fistuloso.
El pegamento biológico de fibrina se obtiene por mezclarse y solidificarse los 2 componentes del Tissucol DUO® en el trayecto fistuloso, la trombina de acción rápida y el fibrinógeno con aprotinina (bovina), que forman finalmente un gel blanquecino que ocupa la luz. Utilizamos para su aplicación endoscópica un catéter Duplocath® de doble luz (diámetro, 6 Fr; longitud, 180 cm) introducido por el canal del endoscopio.
El cierre completo de las fístulas enterocutáneas se establecía según la cicatrización de ambos orificios, interno (objetivado endoscópicamente) y externo, con su cicatrización y cese completo del drenaje. En las fístulas internas siempre se comprobaba el sellado del orifico interno mediante los correspondientes estudios endoscópicos y radiológicos con contrastes yodados.
En la literatura no se ha establecido la cuantía de las dosis por sesión ni el número de sesiones para alcanzar el sellado, como tampoco el calendario más apropiado de instilación del pegamento de fibrina, por lo que realizamos las instilaciones semanalmente hasta que la fístula cerrara o se superara un máximo de 5 intentos de sellado fallido, si bien en algún caso aislado se superó ese número de sesiones.
RESULTADOS
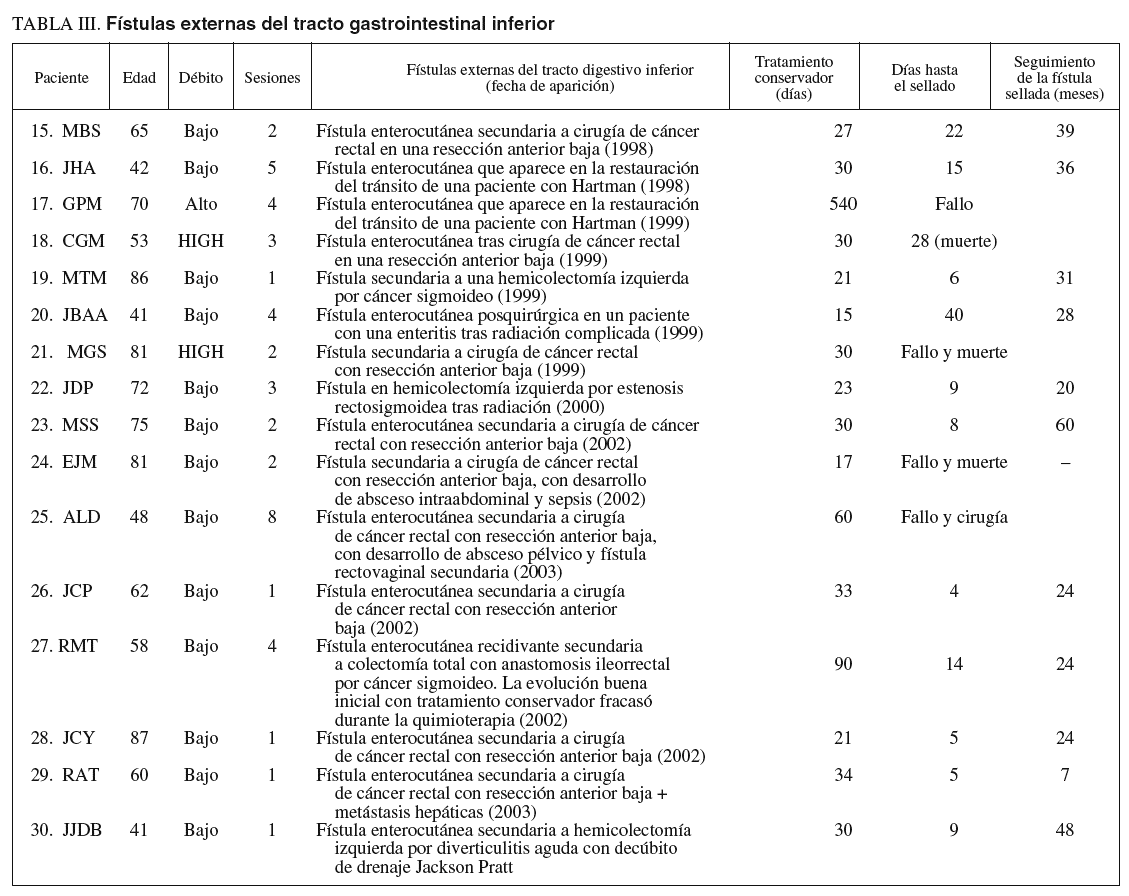
Las fístulas se distribuyeron en: 9 fístulas internas (tabla I) y 21 fístulas externas (esófago o gastrocutáneas y enterocutáneas) (tablas II y III). Las fístulas internas incluían: 3 fístulas internas rectovesicales (pacientes 3, 4 y 9), 1 fístula interna esofagopleural tardía de alto débito (paciente 1) (fig. 1) y 5 fístulas internas rectovaginales (pacientes 2, 5, 6, 7 y 8). Las fístulas externas se distribuyeron en: tracto digestivo superior (tabla II), 5 fístulas esófago o gastrocutáneas de bajo débito (pacientes 10, 11, 12, 13 y 14) (fig. 2); tracto digestivo inferior (tabla III), 1 fístula enterocutánea de bajo débito en un Hartmann del muñón rectal (paciente 20); 9 fístulas enterocutáneas, 2 de alto débito y 7 de bajo débito, en resecciones anterior baja (RAB) por neoplasias rectales, todas ellas relacionadas con fugas tempranas a nivel de las anastomosis (pacientes 15, 18, 21, 24, 25, 26, 28 y 29); 4 fístulas enterocutáneas de bajo débito en hemicolectomías izquierdas y colectomías totales (pacientes 19, 22, 27 y 30); 2 fístulas enterocutáneas de bajo débito tras la reconstrucción del tránsito intestinal en pacientes con colostomía (pacientes 16 y 17). La edad media fue de 59 ± 15 (30-87) años y el 65,6% eran varones. Un 78,1% de las fístulas fueron de bajo débito. El origen de la fístula se localizó endoscópicamente en el 100% de los casos, y se situó sobre las anas tomosis quirúrgicas o inmediatamente adyacente a ellas.
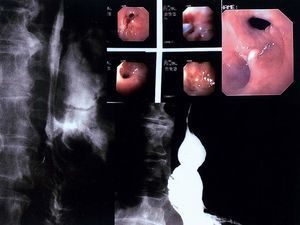
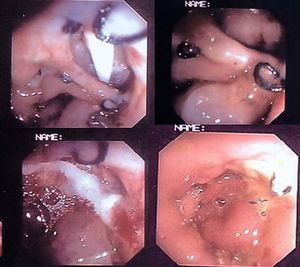
Fig. 1. Paciente 1. A: fístula interna esofagopleural con extravasación del bario a la pleura. B: imágenes endoscópicas del orificio fistuloso antes, durante y después de la aplicación del pegamento de fibrina. C: imagen endoscópica de la fístula cerrada. D: esofagograma que muestra la ausencia de extravasación del contraste fuera del esófago, una vez cerrada la fístula.
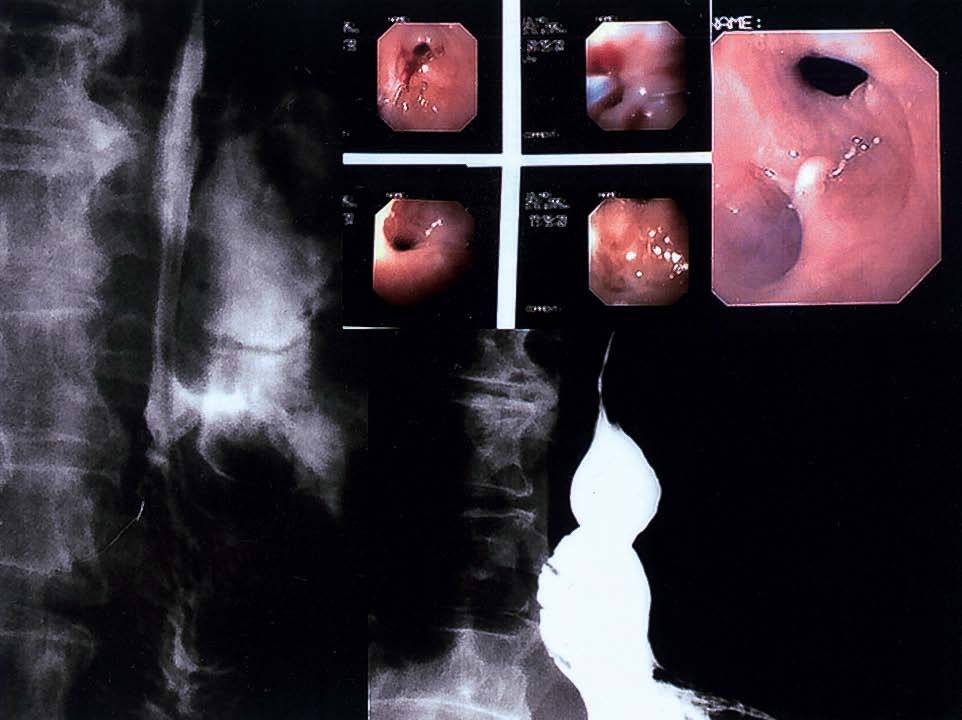
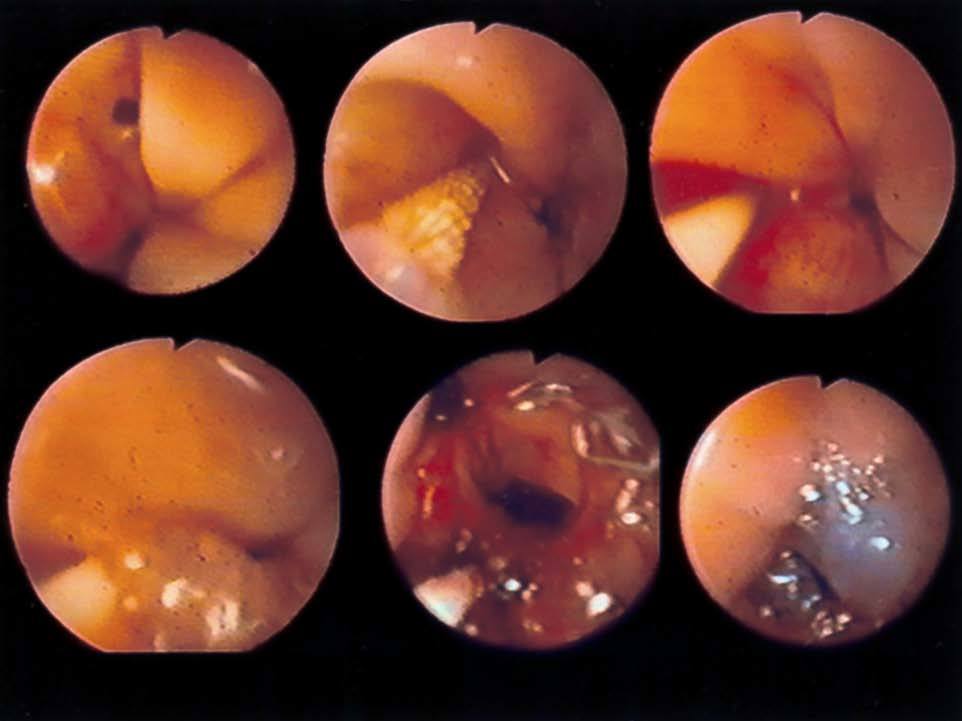
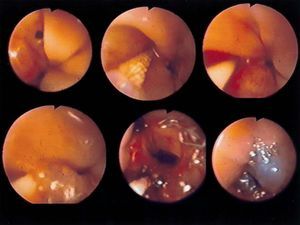
Fig. 2. Fístulas enterocutáneas que aparecieron: 2A: después de una perforación esofágica iatrogénica posvagotomía; 2B: después de una gas trectomía total por cáncer gástrico y anastomosis esofagoyeyunal, visualizando el cepillado, la colocación del catéter e introducción del Tissucol, y la imagen final después del sellado con pegamento de fi brina.
Previamente al sellado con Tissucol®, el paciente había permanecido con la fístula permeable sin tratamiento específico o con tratamiento conservador por un tiempo muy variable, de 95 ± 199 (10-730) días.
Por intención de tratar se consiguió el cierre de la fístula en el 75% de los pacientes (22 de 30 enfermos); con un 80% de éxito en las fístulas de bajo débito, un 25% de éxito en las fístulas de alto débito y en el 55,5% de las fístulas internas.
El tiempo necesario para la cicatrización de las fístulas tratadas con Tissucol® fue de 17 ± 19 (4-90) días, y se necesitó una media de 2,8 ± 2 (1-10) sesiones por paciente para conseguir el cierre, si bien el número de sesiones necesarias en los pacientes en que se consiguió con éxito el sellado fue menor de 2,3 ± 1,2.
El cierre de la fístula no se consiguió en 8 enfermos, 3 de las 5 fístulas rectovaginales, 1 de las 3 fístulas rectovesicales y 4 fístulas enterocutáneas complejas adyacentes a abscesos de pared o abscesos intraabdominales o pelvianos insuficientemente drenados (pacientes 17, 21, 24 y 25). De los pacientes con fístulas enterocutáneas complejas, 2 fallecieron en relación con sepsis y fallo cardíaco (pacientes 21 y 24). Los otros 2 permanecen vivos, uno de ellos curado y otro con una fístula abierta de débito variable a los 24 meses de seguimiento (paciente 17).
No tuvimos ninguna complicación en relación con la técnica endoscópica, siendo la mortalidad total de la serie de un 10% (3 enfermos: 18, 21 y 24). Sólo en 2 (6,6%) casos se relacionó con la evolución tórpida de la fístula y sus complicaciones (sepsis y fallo cardíaco). Un tercer paciente (paciente 18) falleció con la fístula cerrada en relación con recidiva tumoral y metástasis sistémicas.
La frecuencia de recidiva de las fístulas previamente selladas endoscópicamente fue del 3,3%. Un paciente (n.o 3) presentó recidiva de la fístula a los 8 meses de conseguirse su sellado inicial, que cerró finalmente con 2 nuevos sellados con pegamento biológico.
DISCUSIÓN
Las fístulas gastrointestinales posquirúrgicas comprenden el 75-85% de las fístulas gastrointestinales17-19 y se producen por una gran variedad de factores: infecciones, fallo de las anastomosis, colocación inadecuada de drenajes u otros problemas técnico-quirúrgicos18. Los problemas tecnicoquirúrgicos dan lugar a fístulas precoces, generalmente en los primeros 5 días de postoperatorio, mientras que las fístulas tardías son más el resultado de trastornos de la cicatrización20. La mayoría de nuestras fístulas posquirúrgicas ocurrieron en el postoperatorio tardío, con sólo 7 fístulas precoces, aunque en algunos pacientes tratados con radioterapia local previa, las lesiones tisulares posradiación pudieron facilitar su aparición.
El 46,6% de las fístulas postoperatorias aparecieron en resecciones anteriores bajas por neoplasias rectales o en gastrectomías totales con esófago-yeyuno-anastomosis, posiblemente en relación con el uso de suturas mecánicas y la dificultad de la técnica quirúrgica. Otro considerable grupo incluía fístulas en el postoperatorio de hemicolectomías izquierdas o en reconstrucciones del tránsito intestinal de pacientes con Hartmann.
El tratamiento estándar de las fístulas gastrointestinales incluye: reposo intestinal con corrección de los desequilibrios electrolíticos, nutrición parenteral, medidas apropiadas para proteger la piel alrededor del orificio fistuloso, y prevención y tratamiento de las complicaciones sépticas locales o sistémicas relacionadas21,22. La tasa de curación espontánea de las fístulas con estas medidas es del 24-72%, con un tiempo estimado para el cierre de la fístula de 27 a 39 días18,21-24. La evolución espontánea de las fístulas es difícil de prever, si bien algunos autores refieren que el 56% de los casos evolucionan a largo plazo hacia la curación (5 años)17,25.
La eficacia de la somatostatina y la octreotida añadidas al tratamiento estándar conservador son de una utilidad discutible26-31, ya que no parece que modifiquen demasiado las tasas de curación ni la estancia hospitalaria ni que se reduzca la mortalidad21,30. A pesar de ello, en la actualidad el tratamiento estándar siempre incluye la utilización de la somatostatina o sus análogos.
Con las fístulas resistentes al tratamiento conservador con somatostatina, como en los pacientes de nuestro estudio, la única alternativa terapéutica factible ha sido generalmente la cirugía. Todas las fístulas de nuestro estudio eran benignas, ninguna secundarias a enfermedad inflamatoria intestinal32, por lo que no hemos utilizado infliximab, y ninguna tributaria de tratamiento con prótesis metálicas autoexpandibles, excepcionalmente utilizadas en este contexto según la literatura33, y siempre reservadas al tratamiento paliativo o no de procesos neoplásicos no operados.
En nuestra experiencia inicial, obtuvimos una tasa de curación del 85% en un tiempo medio de 16 días para conseguir la cicatrización completa34. En este estudio analizamos los resultados de todos los pacientes tratados hasta el momento actual.
El sellado endoscópico de las fístulas gastrointestinales es un procedimiento barato, técnicamente sencillo, y con escasos riesgos descritos para el paciente. Basándonos en nuestros resultados iniciales, decidimos adelantar el comienzo del tratamiento endoscópico. Acortamos el tiempo de tratamiento conservador al mínimo necesario para conseguir la estabilización de las suturas, particularmente en las fístulas de aparición precoz, muchas de las cuales son secundarias a deficiencias en las técnicas quirúrgicas, como las secundarias a decúbitos de los sistemas de drenaje colocados muy próximos a las anastomosis. Sin embargo, no siempre fue posible el inicio precoz del sellado endoscópico, ya que algunos pacientes nos fueron remitidos después de largos períodos de tratamiento médico.
En 1975, se publicaron las primeras series endoscópicas de tratamiento de fístulas gastrointestinales con pegamentos tisulares (cianoacrilato), con resultados esperanzadores1,35,36. Posteriormente, se introdujeron otros tipos distintos de pegamentos tisulares biológicos (soluciones de aminoácidos37, de fibrina y trombina1-3), inicialmente utilizados para asegurar las suturas durante las intervenciones quirúrgicas. Con la aparición de catéteres de doble luz en 1984, los pegamentos de fibrina (Tissucol®) se incorporaron a la terapia endoscópica, incluidas las fístulas enterocutáneas del tracto gastrointestinal superior e inferior7,9,11,38-40.
La endoscopia permite localizar y aplicar el pegamento de fibrina selectivamente en la vertiente intestinal del orificio fistuloso. La mezcla de los 2 componentes del Tissucol® (fibrinógeno y trombina) en el tracto fistuloso reproduce la cascada de la coagulación, y se forma inicialmente una matriz de fibrina que estimula el proceso de cicatrización, con activación de los fibroblastos. La fibrina será reemplazada por colágeno en unas 4 semanas, con reepitelización final del trayecto1-3,41,42 facilitada porque cesa el paso de secreciones por él.
El Tissucol® fue inyectado libremente en el interior del tracto fistuloso en la vertiente intestinal, sin inyección submucosa, porque consideramos que implica aumento del riesgo del daño tisular en las proximidades del orificio fistuloso, que en algunas ocasiones se puede situar en las proximidades del mediastino.
No tenemos ninguna experiencia en fistuloscopias con sellado del tracto fistuloso desde su vertiente cutánea utilizando endoscopios pediátricos o broncoscopios11,12,39,43,44. Para una perfecta adherencia del pegamento biológico a los bordes del orificio fistuloso y al tracto fistuloso, creemos que es útil cepillarlos por la consiguiente erosión, sobre todo en las fístulas viejas reepitelizadas en las que ya no existe tejido de granulación. Además conviene la inmovilización del área sellada durante 24-48 h y evitar el funcionamiento de drenajes aspirativos que pueden movilizar el pegamento biológico introducido.
Dejamos un margen entre sesiones de 5-7 días para poder evaluar la respuesta clínica. El número de sesiones requeridas para el sellado de las fístulas, cuando se tuvo éxito, fue de 2,3 sesiones, por lo que la posibilidad de cierre después de 5 sesiones es escasa.
La tasa de éxitos global en el sellado endoscópico de las fístulas postoperatorarias en nuestro estudio fue del 73,3%, muy similar a las referidas en la literatura del 72-83%, con un claro acortamiento de la estancia media y presumiblemente de los costes y la morbimortalidad esperables con tratamientos conservadores o quirúrgicos12,45.
La tasa de éxito en el sellado de las fístulas de alto débito y fístulas internas es baja, del 25 y el 55% respectivamente, pero similar a las tasas referidas en la literatura12,18,19, con una alta tasa de éxitos en el sellado de las fístulas de bajo débito (80%), que por otra parte son las más frecuentes.
En nuestra experiencia, las posibilidades de sellado de fístulas gastrointestinales de largo tiempo de evolución es escasa, quizá en relación con el grado de fibrosis establecido en el tracto fistuloso.
Durante el seguimiento de 6-72 meses tan sólo hemos tenido una recidiva de una fístula, que se controló con un nuevo sellado endoscópico.
Las complicaciones de las fístulas gastrointestinales dependen de su localización anatómica, la cuantía, el tipo de débito, la etiología y las enfermedades concomitantes del paciente9,12,18,19,21.
La mortalidad se relaciona preferentemente con la edad y con el desarrollo de cuadros sépticos12,17,19, habiendo disminuido del 44% en los años 40, a un 5-21% actual que se mantiene estable19,24 debido a la mejoría de las técnicas quirúrgicas y de los cuidados del enfermo, sobre todo en lo que respecta al desarrollo de la nutrición parenteral y de la mejora en las terapéuticas antibióticas17-19,25. Las fístulas de alto débito tienen mortalidades más altas25.
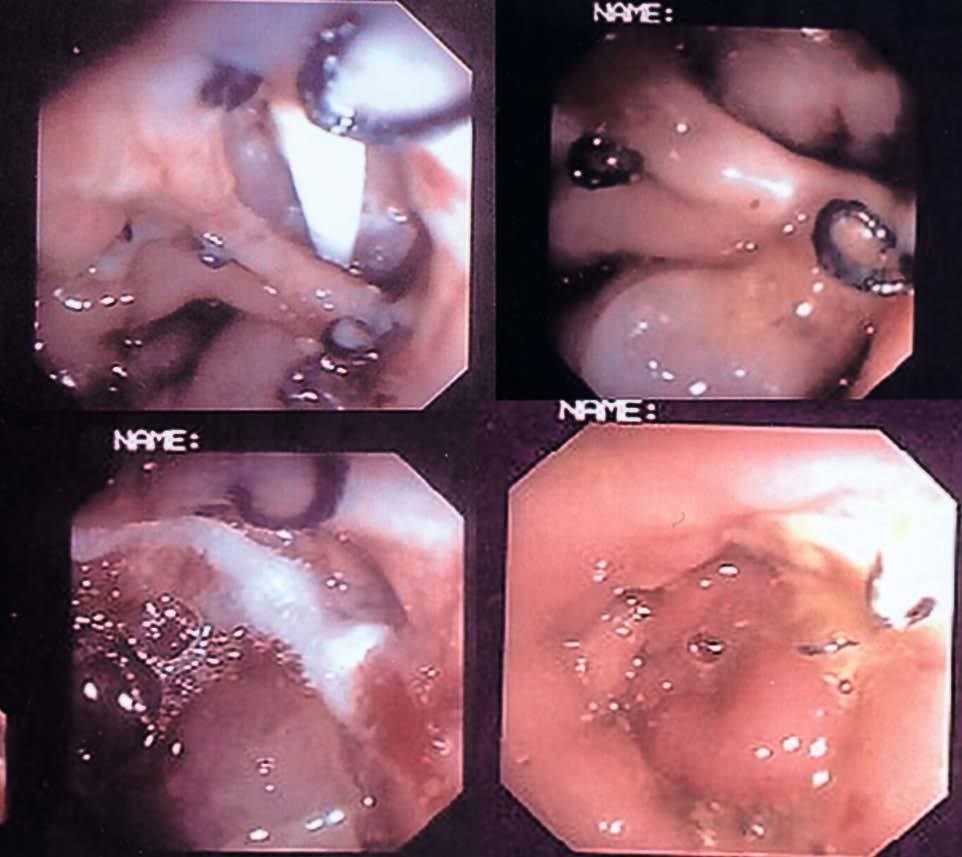
En nuestra experiencia, las fístulas que pueden ser tratadas endoscópicamente son las posquirúrgicas precoces con orificios fistulosos internos de gran tamaño que producen cuadros sépticos o de abdomen agudo, no son candidatas al tratamiento endoscópico y requieren una reintervención quirúrgica. Un requisito absolutamente necesario para el tratamiento de la fístula es la localización endoscópica de su origen en la vertiente intestinal, con diámetros pequeños de entre 5 y 7 mm. Cuando el diámetro del orifico fistuloso fue mayor de 1 cm, las posibilidades de sellado fueron escasas, lo que correspondió con algunos de los fracasos terapéuticos obtenidos. La excepción se encuentra en algunas fístulas precoces secundarias a decúbito de drenajes quirúrgicos, en los que la dehiscencia de suturas puede dar una imagen endoscópica de una aparente fístula gigante, cuando realmente el tracto fistuloso se esconde en su interior, de un tamaño de varios milímetros (fig. 3). En estos casos, la retirada del drenaje y el sellado con Tissucol® suelen ser muy efectivos.
Fig. 3. Paciente 9. A: orificio fistuloso en la anastomosis colorrectal en una hemicolectomía izquierda con el drenaje J-P, visible a través de él. B: visión endoscópica una vez retirado el drenaje J-P. C: imagen del orificio fistuloso después de la aplicación del pegamento de fibrina. D: imagen del orificio fistuloso cerrado completamente una semana más tarde.
Creemos que los factores que dificultan o impiden el cierre completo de las fístulas, y que pudieran en el futuro ser objeto de adecuados análisis multivariable, son: a) el tamaño del orificio fistuloso (> 1 cm); b) las fístulas de alto débito (> 500 ml/día); c) la presencia de estenosis distales a la fístula no resueltas; d) las fístulas internas; e) la infección del trayecto fistuloso o la comunicación con abscesos no drenados, y f) la etiología tumoral, radioterápica o secundaria a enfermedad de Crohn2,8,17.
En la literatura no existe una respuesta sobre el tiempo de espera necesario con tratamiento conservador antes de iniciar el tratamiento endoscópico. Si consideramos que la curación espontánea de la fístula después de 6 semanas de tratamiento conservador es improbable17 y que se necesita un mínimo de 10-14 días para conseguir la estabilidad de las suturas, algunos autores han esperado de 2 a 4 semanas para iniciar el tratamiento38. Con estas consideraciones creemos que el tratamiento endoscópico no debería demorarse más allá de 10-14 días. En nuestra serie la media de espera previa al tratamiento endoscópico fue de 29,8 (5-90) días, debido a la inclusión de al menos 3 pacientes con fístulas crónicas antiguas no curadas, en los que se intentó un tratamiento endoscópico de rescate.
La tasa de cirugías necesarias para completar el cierre de la fístula fue del 13,3%, menor que las publicadas con pacientes tratados de forma conservadora17. La mortalidad en nuestra serie fue baja, del 10% (3/30), y muy similar a la referida en las series con menor mortalidad17,24.
El seguimiento de las fístulas tratadas debe ser fundamentalmente clínico, evitando manipulaciones diagnósticas precoces e intempestivas que puedan desprender el coágulo de fibrina formado antes de que se produzca el cierre definitivo del trayecto. La observación de la disminución de la cuantía o el cese del débito es el mejor indicador de su curación.
El tratamiento endoscópico de las fístulas es una técnica muy segura en la que apenas se han descrito complicaciones graves, salvo alguna reacción alérgica a la aprotinina bovina42,46 y alguna comunicación aislada de embolia pulmonar aérea en fistuloscopias externas realizadas con endoscopios pediátricos, con posibilidad de inyección del Tissucol® y de aire a presión1,12.
Debido al alto coste del tratamiento conservador, la alta tasa de fracasos terapéuticos y el largo tiempo necesario para conseguir la curación de las fístulas, creemos que el sellado endoscópico debe ser siempre una alternativa terapéutica precoz, que permite conocer la etiología e iniciar un tratamiento que puede ser efectivo en el 75% de los casos; y si la técnica fracasa, facilita la utilización de las alternativas quirúrgicas sin dilación.