La trombosis del eje esplenoportal no asociada a cirrosis hepática o a enfermedad tumoral es la segunda causa de hipertensión portal en el mundo occidental. Hasta en un 60% de los casos es posible identificar un trastorno protrombótico sistémico subyacente como factor etiológico. Los factores locales son los causantes de un tercio de los casos, y no es infrecuente la coexistencia de varias entidades. Por eso, en estos pacientes es de vital importancia el diagnóstico etiológico. El inicio de una anticoagulación precoz en la fase aguda de la trombosis venosa portal (TVP) incidirá de manera significativa en la probabilidad de recanalización y, por tanto, en el pronóstico de estos pacientes. En la fase crónica de la TVP (o cavernomatosis portal), la sintomatología y la morbilidad vienen dadas por las complicaciones de la hipertensión portal desarrolladas. Hasta la fecha, la anticoagulación en estos casos se reserva a los pacientes en los que se haya demostrado un trastorno protrombótico subyacente.
Thrombosis of the splenoportal axis not associated with liver cirrhosis or tumoral disease is the second cause of portal hypertension in the western world. In up to 60% of cases, an underlying systemic prothrombotic disorder can be identified as an etiological factor. One third of cases are caused by local factors and the coexistence of several entities is not unusual. Therefore, an etiologic diagnosis is essential in these patients. Early anticoagulation therapy in the acute phase of thrombosis of the splenoportal axis significantly affects the probability of recanalization and consequently the prognosis of these patients. In the chronic phase of splenoportal thrombosis (or portal cavernoma), the symptoms are caused by the complications of established portal hypertension. To date, anticoagulation therapy is limited to patients in whom an underlying prothrombotic disorder has been demonstrated.
El término trombosis venosa portal (TVP) debería hacer referencia a la trombosis que afecta únicamente al tronco portal extendiéndose o no a las ramas portales intrahepáticas. Por tanto, el término de trombosis del eje esplenoportal debería ser empleado cuando la trombosis se extiende a la vena esplénica, a la vena mesentérica superior o a la vena mesentérica inferior1–3. Esta revisión hace referencia a la trombosis venosa del eje esplenoportal no asociada a enfermedades hepáticas crónicas ni a neoplasias.
EpidemiologíaLa trombosis portal se encuentra aproximadamente en el 1% de las autopsias. En la mayoría de las ocasiones esta trombosis se relaciona con cirrosis o neoplasias hepáticas y en tan sólo un tercio de los casos es atribuible a un origen no cirrótico y no tumoral3.
La trombosis del eje esplenoportal no asociada a cirrosis o neoplasias cumple los criterios de enfermedad rara de la OMS, ya que tiene una prevalencia inferior a 5 por cada 10.000 habitantes. No obstante, es la segunda causa de hipertensión portal en el mundo occidental3,4. En Asia, la trombosis portal extrahepática es una causa común de hipertensión portal, que explica el 30% de todos los casos de hemorragia digestiva por varices y es la principal causa en niños5.
EtiologíaSi se realiza un estudio exhaustivo, hasta en un 70% de los pacientes se logra identificar un factor etiológico causante de la TVP. De éstos, hasta en un 60% de los casos se identifican factores trombogénicos sistémicos, y hasta en un 30 a un 40% se identifican factores locales predisponentes6–9(tabla 1). En más del 15% de los pacientes coexisten factores etiológicos múltiples, lo que apoya la teoría que considera la TVP como una enfermedad multifactorial10. Debido a la posible y frecuente asociación entre varios factores trombofílicos sistémicos y locales, ante todo paciente con TVP siempre debe realizarse un estudio minucioso de todos los factores etiológicos conocidos. A pesar de todo esto, hasta en un 30% de los pacientes la causa no llega a identificarse y permanece como de causa idiopática.
Prevalencia publicada de los diferentes factores etiológicos en pacientes con trombosis venosa portal no cirrótica, no tumoral
| Factor causal | Prevalencia (%) | Referencias |
| Trastornos trombofílicos adquiridos | ||
| Síndromes mieloproliferativos primarios | ||
| Sin análisis de la mutación del gen JAK 2 | 8–35 | 7–9,22,25,60 |
| Con análisis de la mutación del gen JAK 2 | 17–53 | 15,26 |
| Síndrome antifosfolípido | 1–23 | 6–7,9,12,22–23,25,60 |
| Hemoglobinuria paroxística nocturna | 0–9 | 7,15,22,60 |
| Hiperhomocisteinemia | 11–15 | 7,9,15,23,26 |
| Trastornos trombofílicos hereditarios | ||
| Mutación del factor V de Leiden | 3–20 | 6–9,12,15,22–23,26,60 |
| Mutación del gen del factor II | 2–22 | 6–9,12,15,23,26,60 |
| Déficit de la proteína C | 1–9 | 6–8,15,23,26 |
| Déficit de la proteína S | 0–30 | 6–8,12,15,23,26 |
| Déficit de antitrombina | 1–4 | 6,8–9,12,15,26,60 |
| Factores locales | ||
| Lesiones inflamatorias focales (onfalitis, pancreatitis, diverticulitis, colecistitis, etc.) | 7–34 | 22–23,25,26,60 |
| Lesión del eje portal (esplenectomía, colecistectomía, colectomía) | 3–45 | 9,15,22,26,60 |
| Otros | ||
| Embarazo | 0–4 | 9,12,22,60 |
| Anticonceptivos orales | 7–48 | 9,12,15,22,26,60 |
| Idiopática | 16–22 | 12 |
Adaptada de García-Pagán et al, Sem Liv Dis. 2008.
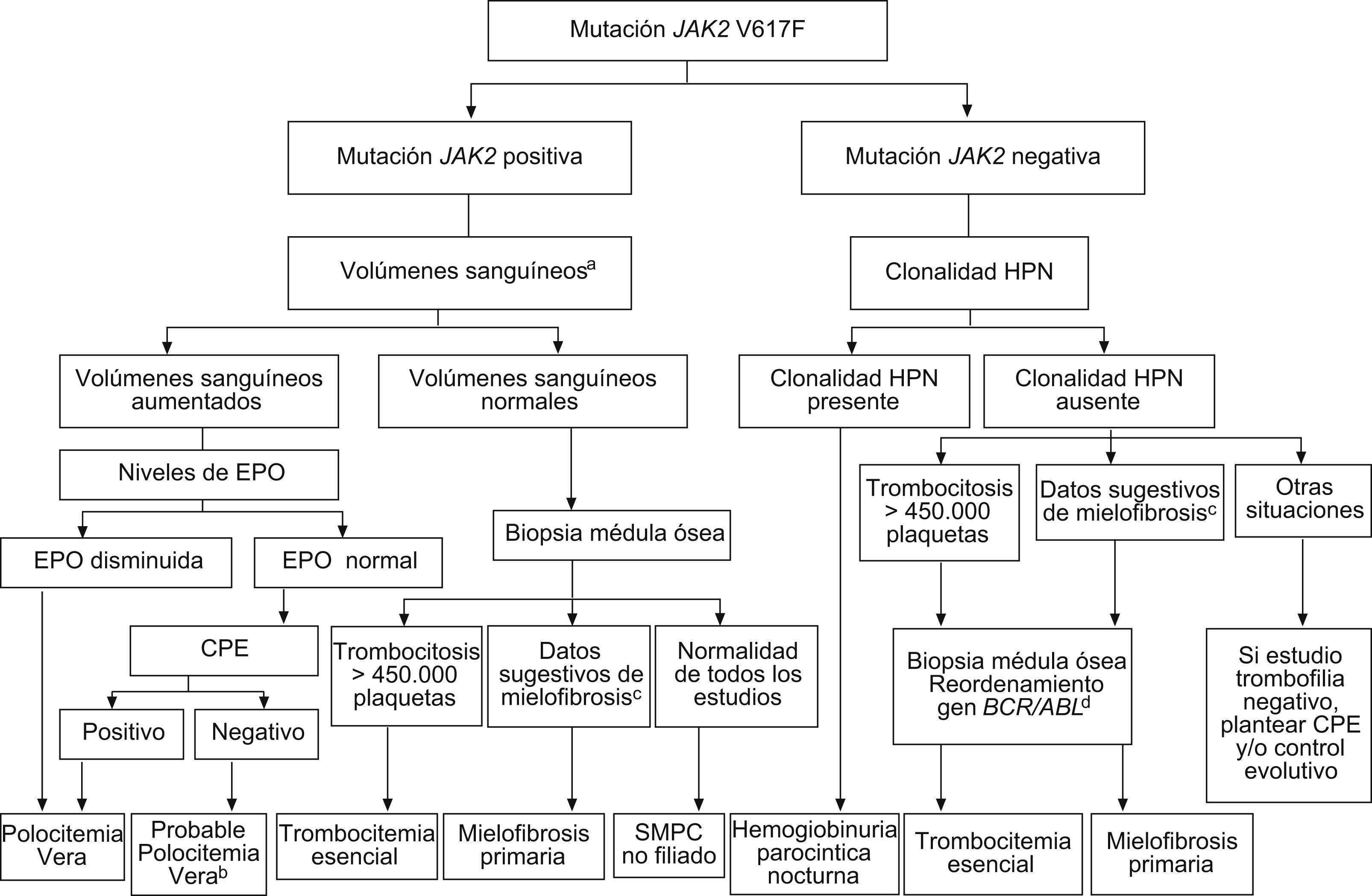
Los síndromes mieloproliferativos (SMP) primarios son la principal causa de TVP3,8. La hemodilución y el hiperesplenismo secundarios a la hipertensión portal pueden dificultar su diagnóstico al enmascarar las características típicas de la sangre (hiperglobulia, leucocitosis, trombofilia) de los pacientes con SMP que no tienen hipertensión portal6. Por eso es de vital importancia investigar siempre la presencia de formas ocultas de estos síndromes. Así, Valla et al mostraron que un 50% de pacientes con TVP supuestamente idiopática tenía un SMP primario, que tan sólo era puesto de manifiesto por el crecimiento de colonias eritroides en medios de cultivo pobres en eritropoyetina11. Recientemente, se ha identificado que la mutación adquirida del gen Janus Kinase 2 (JAK2 V617F) se presenta en un 90% en los casos de policitemia vera, en un 50 a un 70% de los casos de trombocitemia esencial y en un 40 a un 50% de los casos de mielofibrosis idiopática6,12. Por esto, el análisis de la mutación del gen JAK2 ha permitido alcanzar altas tasas de diagnóstico etiológico en pacientes con TVP13. De hecho, las investigaciones llevadas a cabo en pacientes con trombosis venosa del territorio esplácnico14,15 o síndrome de Budd-Chiari (SBC)14 muestran que el añadir la determinación de la mutación V617F del gen JAK2 al estudio etiológico aumenta en un 20% la probabilidad de diagnosticar un SMP subyacente. Tal ha sido su impacto en el tratamiento de los SMP, que es uno de los criterios diagnósticos de cada uno de los diferentes SMP según las guías de la OMS publicadas recientemente16. Sin embargo, la presencia de la mutación del gen JAK2 no permite definir el fenotipo del SMP, por lo que es imprescindible un estudio hematológico completo, incluido el análisis morfológico de médula ósea. La figura 1 muestra el algoritmo diagnóstico propuesto de los SMP.
Algoritmo diagnóstico de los síndromes mieloproliferativos crónicos en la trombosis portal (con la colaboración del Dr. Cervantes y del Dr. Reverter).
aSi Hb > 18,5 g/dl en hombres y > 16,5 g/dl en mujeres se considera que el volumen eritrocitario está aumentado y no es necesario determinarlo mediante métodos isotópicos.
bPV altamente probable: valorar si realizar biopsia de médula para completar los criterios de la OMS.
cCitopenias, síndrome leucoeritroblástico y/o dacriocitos en sangre periférica a LDH elevada.
dReordenamiento del gen BCR/ABL debe ser negativo.
CPE: cultivo de progenitores eritroides de sangre periférica; EPO: eritropoyetina sérica; HPN: hemoglobinuria paroxística nocturna; SMPC: síndrome mieloproliferativo crónico.
Otras enfermedades adquiridas mucho menos frecuentes son el síndrome antifosfolípido y la hemoglobinuria paroxística nocturna. También se han identificado otros trastornos protrombóticos hereditarios, como la mutación del factor II, la deficiencia de las proteínas C, S o antitrombina III y, menos frecuentemente, la mutación del factor V de Leiden7,8. La hiperhomocisteinemia es un factor de riesgo relativamente pobre de trombosis6. Únicamente los valores altos de homocisteína se aceptan como un factor de riesgo de trombosis, pero se encuentran altamente influenciados por la dieta. Paralelamente, los polimorfismos de la metilenotetrahidrofolato reductasa presentan una alta prevalencia en la población general. Por todos estos motivos, estas determinaciones no son imprescindibles en el algoritmo diagnóstico de la TVP. Recientemente se ha descrito una variación genética en el gen inhibidor de la fibrinólisis activable por trombina (TAFI) como factor etiológico asociado a la TVP17. El TAFI es una molécula que regula el equilibrio entre el sistema de coagulación y el sistema de fibrinolisis, por lo que su alteración conlleva un riesgo incrementado de episodios trombóticos. Sus concentraciones séricas presentan una alta variabilidad, sobre todo en casos de enfermedad hepática crónica. Debido a esta variabilidad, en el único estudio publicado hasta la fecha en TVP y SBC, las alteraciones del TAFI se evaluaron a nivel genético (single nucleotide polymorphism -SNP- y haplotipos) en lugar de determinar sus concentraciones plasmáticas17. Son necesarios más estudios que evalúen el posible papel etiológico del TAFI antes de ser incluido en el algoritmo diagnóstico rutinario de TVP.
El embarazo y el uso de anticonceptivos orales son factores extremadamente raros asociados a la TVP. La mayoría de los estudios publicados sobre gestación y TVP se limitan a series de casos y afirman que esta relación causal no tiene lugar si no hay un factor local o protrombótico subyacente18. Estudios descriptivos y de casos y controles realizados en diferentes países europeos demuestran que la prevalencia de TVP en consumidoras de anticonceptivos orales (ACO) es similar a la prevalencia hallada en la población general. Las mujeres consumidoras de ACO presentan una odds ratio de tener TVP de sólo 0,8 en comparación con un 3,3 de presentar trombosis venosa profunda de las extremidades inferiores18. Todo esto hace sospechar que estos dos factores hormonales por sí solos no son suficientes en ausencia de un factor protrombótico subyacente, pero parece probable que pueda ejercer un papel desencadenante de trombosis en estos casos. Por eso deberían considerarse como factores de riesgo trombóticos pero no como enfermedades protrombóticas18.
Otras situaciones protrombóticas relacionadas con la TVP son los factores locales. Éstos hacen referencia tanto a enfermedades infecciosas e inflamatorias (pancreatitis, colecistitis, colangitis y apendicitis) como a lesiones del eje venoso portal (esplenectomía, shunt portocava y otros procedimientos quirúrgicos)3. Como se ha mencionado previamente, la presencia de un factor local no excluye la presencia de uno o varios trastornos trombofílicos, por lo que es precisa la realización de una completa evaluación de todos los factores etiológicos19. En niños con TVP es frecuente encontrar una historia de onfalitis o cateterización de la vena umbilical, no necesariamente asociada a la presencia de un estado protrombótico20.
Otras enfermedades vasculares hepáticas, como el SBC y la hipertensión portal idiopática, se han asociado al desarrollo de TVP21. La presencia de una resistencia del flujo sanguíneo intrahepático con el consiguiente enlentecimiento del flujo portal que, frecuentemente unido a un factor protrombótico de base, podría favorecer el desarrollo de la TVP22.
En la tabla 2 se muestran los estudios etiológicos que deben realizarse en pacientes con trombosis portal.
Estudios etiológicos para realizar en pacientes con trombosis venosa portal
| Factores etiológicos | Estudios recomendados |
| Trastornos trombofílicos adquiridos | |
| Hemoglobinuria paroxística nocturna | Citometría de flujo que evalúa la ausencia de los antígenos CD55 y CD59 en eritrocitos y leucocitos |
| Síndromes mieloproliferativos | Biopsia de medula ósea, mutación del gen JAK 2, volumen eritrocítico total y eritropoyetina sérica después de corregir una posible deficiencia de hierro; crecimiento espontáneo de colonias eritroides |
| Síndrome antifosfolípido | Anticardiolipina por ELISA; anticoagulante lúpico |
| Enfermedad de Behçet | Diagnóstico clínico |
| Colitis ulcerosa | Diagnóstico clínico, colonoscopia y toma de biopsias |
| Enfermedad de Crohn | Diagnóstico clínico, ileocolonoscopia y toma de biopsias |
| Enfermedad celíaca | Anticuerpos antiendomisio, antigliadina y antitransglutaminasa. Biopsias duodenales |
| Hiperhomocisteinemia | No hay datos suficientes para incluirlos en la práctica clínica |
| Trastornos trombofílicos hereditarios | |
| Deficiencias de antitrombina, proteína C y proteína S | Relación con valores de factor II, V, VII o X tras corregir un posible déficit de vitamina K. Si hay dudas, realizar estudios familiares |
| Factor V Leiden | Resistencia a la proteína C activada. Si se encuentra presente, realizar estudio molecular del polimorfismo G1691A |
| Mutación del gen de la protrombina | Estudio molecular del polimorfismo G20210A |
| TAFI | No hay datos suficientes para incluirlos en la práctica clínica |
| Mutación MTHFR | No hay datos suficientes para incluirlos en la práctica clínica |
TAFI: gen inhibidor de la fibrinólisis activable por trombina.
Las manifestaciones clínicas en el momento del diagnóstico dependen del momento evolutivo en el que se encuentre la TVP. La trombosis portal puede diagnosticarse en el momento en que se produce la trombosis portal aguda. Puede ocurrir que este episodio inicial pase desapercibido y la trombosis portal se diagnostique en fase crónica. En ocasiones, va a ser imposible diferenciar si nos encontramos ante una TVP aguda o ante una retrombosis en un paciente que ya tenía una cavernomatosis portal que no se había detectado previamente.
Fase aguda de la trombosis portalLa presencia y gravedad de los síntomas en la trombosis portal aguda se atribuye a la velocidad en la instauración de la trombosis y la extensión de ésta. Los pacientes presentan dolor abdominal, fiebre y respuesta inflamatoria sistémica. En otras ocasiones aparece fiebre sin un foco aparente. En el 80% de los casos el dolor se asocia a síntomas dispépticos inespecíficos (náusea, plenitud posprandial) y malestar general. En muchos de estos casos, estas manifestaciones se solapan con las del factor desencadenante, como puede ser la cirugía reciente o la pancreatitis aguda. En los casos en los que la trombosis afecta a los pequeños arcos mesentéricos o en los que el diagnóstico y el tratamiento se retrasan pueden aparecer síntomas de isquemia intestinal. La presencia de necrosis isquémica intestinal debe sospecharse cuando el cuadro se acompaña de hematoquecia, defensa abdominal, líquido libre intraabdominal o acidosis metabólica con insuficiencia renal o pulmonar. La aparición de una estenosis intestinal puede ser la secuela tardía de la isquemia venosa mesentérica. Las consecuencias que la TVP aguda tiene sobre un hígado sano son mínimas o inexistentes.
La trombosis aislada de una rama intrahepática portal de gran tamaño (lobular o segmentaria) es una situación especial que frecuentemente se detecta de forma incidental en el transcurso de la realización de una prueba de imagen habitual postintervención quirúrgica, y se acompaña de un incremento moderado y transitorio de las transaminasas. Posteriormente, puede tener lugar una atrofia del territorio hepático afectado con una hipertrofia del resto del parénquima. A diferencia de cuando se trombosa el tronco, no hay desarrollo de hipertensión portal ni de venas colaterales. Los parámetros analíticos de función hepática rápidamente se normalizan.
La obstrucción de la vena esplénica o de las venas mesentéricas superior e inferior condiciona una clínica similar a la descrita para la trombosis del tronco portal, con la formación de colaterales con flujo hepatopetal, que rodean el territorio afectado. Ocasionalmente, también se desarrollarán colaterales portosistémicas con flujo hepatofugal. Ambas serán el origen de varices potencialmente sangrantes.
Un estudio reciente multicéntrico prospectivo que incluyó a 101 pacientes con TVP aguda, demuestra una baja tasa de complicaciones en esta entidad. Únicamente 9 pacientes presentaron hemorragia de cualquier origen (5 de ellos gastrointestinal), 2 pacientes presentaron infarto intestinal (con buena evolución tras resección del tramo afectado) y 2 pacientes fallecieron, uno debido a un colangiocarcinoma y otro a raíz de una sepsis23.
Fase crónica de la trombosis portal. Cavernomatosis portalCon frecuencia, el episodio agudo de la TVP es asintomático u oligosintomático, por lo que no se diagnostica hasta el desarrollo de complicaciones secundarias a la hipertensión portal (trombocitopenia, esplenomegalia, hemorragia digestiva por varices e ictericia) o de modo casual durante la realización de pruebas de imagen realizadas en otro contexto19. Este modo de presentación está probablemente en relación con una instauración progresiva de la trombosis, lo que da tiempo a que se pongan en marcha mecanismos compensadores. Uno de estos mecanismos de regulación consiste en la inmediata vasodilatación del territorio arterial hepático en respuesta a un descenso del flujo venoso portal24. Otro mecanismo es el rápido desarrollo de colaterales que superan el territorio trombosado. Estas colaterales se forman en pocos días y se estabilizan en el conocido cavernoma en el plazo de 3 a 5 semanas24. La puesta en marcha de estos mecanismos permite que el flujo hepático total permanezca estable o con un mínimo descenso. Sin embargo, la presión portal se incrementa.
Las complicaciones de la hipertensión portal son las principales manifestaciones clínicas de la cavernomatosis portal. La endoscopia digestiva alta muestra varices en el 20 al 55% de los casos, generalmente de gran tamaño25–27. En nuestra experiencia en pacientes con TVP aguda, las varices gastroesofágicas pueden desarrollarse tan precozmente como en el primer mes desde el inicio de los síntomas. No obstante, en otros pacientes la aparición de éstas puede retrasarse unos meses y ya manifestarse en forma de hemorragia variceal. Por esto, en pacientes con TVP aguda creemos recomendable la realización de una endoscopia para el cribado precoz de varices a los 2 o 3 meses del episodio agudo y repetirla nuevamente a los 6 a 9 meses en los casos en los que las varices no estén presentes en la endoscopia inicial. No existen datos que permitan recomendar una pauta específica de cribado de varices en aquellos pacientes en los que en esta segunda endoscopia no se observe la presencia de varices. No obstante, es posible que una vez formado y «estabilizado» el cavernoma, el riesgo de que se desarrollen varices en aquellos pacientes en los que no se han desarrollado en los primeros años sea menor. No obstante, este hecho debe investigarse, y por eso en la actualidad se recomienda la misma práctica establecida en pacientes cirróticos, la realización de una endoscopia cada 2 o 3 años19. A diferencia de lo que ocurre con la cirrosis hepática, la presencia de varices ectópicas en duodeno, región anorrectal o lecho vesicular son más frecuentes en las TVP2. Sin embargo, la gastropatía por hipertensión portal es rara en esta entidad2,24.
La hemorragia digestiva por varices esofágicas es la manifestación clínica más frecuente, tanto en niños como en adultos28,29, con una incidencia en pacientes sin tratamiento de 25 por cada 100 pacientes al año. Los factores predictivos de la hemorragia por varices son el tamaño de éstas y el antecedente de hemorragia previa. Si bien la gravedad y los requerimientos transfusionales pueden ser muy elevados, la mortalidad asociada a estos episodios de hemorragia es muy baja, probablemente en relación con la presencia de una función hepática conservada26,30,31.
En más del 80% de los pacientes con obstrucción crónica de la vena porta se identifican mediante técnicas de imagen colangiográficas32,33, anormalidades de la vesícula y vías biliares, intrahepáticas y extrahepáticas (lo que se define como colangiopatía portal)2,34. Esta entidad, también descrita en niños35, se ha atribuido a la posible lesión isquémica secundaria a la TVP pero más probablemente a la compresión biliar por las colaterales periportales que componen el cavernoma32,33,36. A pesar de la alta frecuencia de alteraciones biliares en las pruebas de imagen (principalmente estenosis, dilataciones, angulaciones e irregularidad del conducto biliar), las repercusiones clínicas, como la colecistitis, la colangitis y la ictericia obstructiva, son mucho menos frecuentes y pueden ocurrir entre un 5 y un 35% de los pacientes según diferentes series32,33,37. El aumento de fosfatasa alcalina y de gammaglutamil-transferasa son las alteraciones más frecuentes.
Otros síntomas, como la saciedad precoz, el malestar abdominal y la plenitud se encuentran relacionados con la esplenomegalia gigante. La ascitis se considera una manifestación tardía y suele estar asociada a un episodio desencadenante, como puede ser la hemorragia digestiva o la infección. En nuestra experiencia, la probabilidad actuarial de desarrollo de ascitis a los 2 años de un episodio de TVP aguda no repermeabilizada es del 16%25, y ésta suele controlarse bien con tratamiento médico. En caso contrario, deben descartarse otras causas de ascitis. Contrariamente a lo que se ha indicado previamente, estos pacientes presentan una función hepática preservada.
Aunque la encefalopatía manifiesta es rara, en la mitad de los pacientes con TVP no cirrótica, no tumoral, se desarrollan alteraciones neurológicas subclínicas comparables a la encefalopatía subclínica que se desarrolla en los pacientes cirróticos38. El impacto clínico que supone esta alteración cognitiva en la calidad de vida de estos pacientes requiere todavía mayor investigación.
Otra complicación es la trombosis recurrente (incidencia sin tratamiento anticoagulante de 6,5 por 100 pacientes al año) cuyo principal factor predictivo es la presencia de una enfermedad procoagulante subyacente.
Es frecuente la asociación de una leve elevación de transaminasas a una tasa baja de protrombina y de otros parámetros de la coagulación (factor V, factor VII, proteínas C, S y antitrombina)39. El motivo por el que se producen estas alteraciones no es bien conocido y se han atribuido tanto a fenómenos de consumo como de déficit de producción. De hecho, la restauración del flujo sanguíneo hepático ha demostrado revertir la alteración de estos parámetros de coagulación. Sin embargo, el impacto real de estas alteraciones en el curso clínico es desconocido.
DiagnósticoEl diagnóstico de TVP aguda debe sospecharse en todo paciente con dolor abdominal de reciente aparición; especialmente si se conoce portador de una enfermedad protrombótica subyacente. Asimismo, en todo paciente con hipertensión portal debe descartarse una TVP crónica.
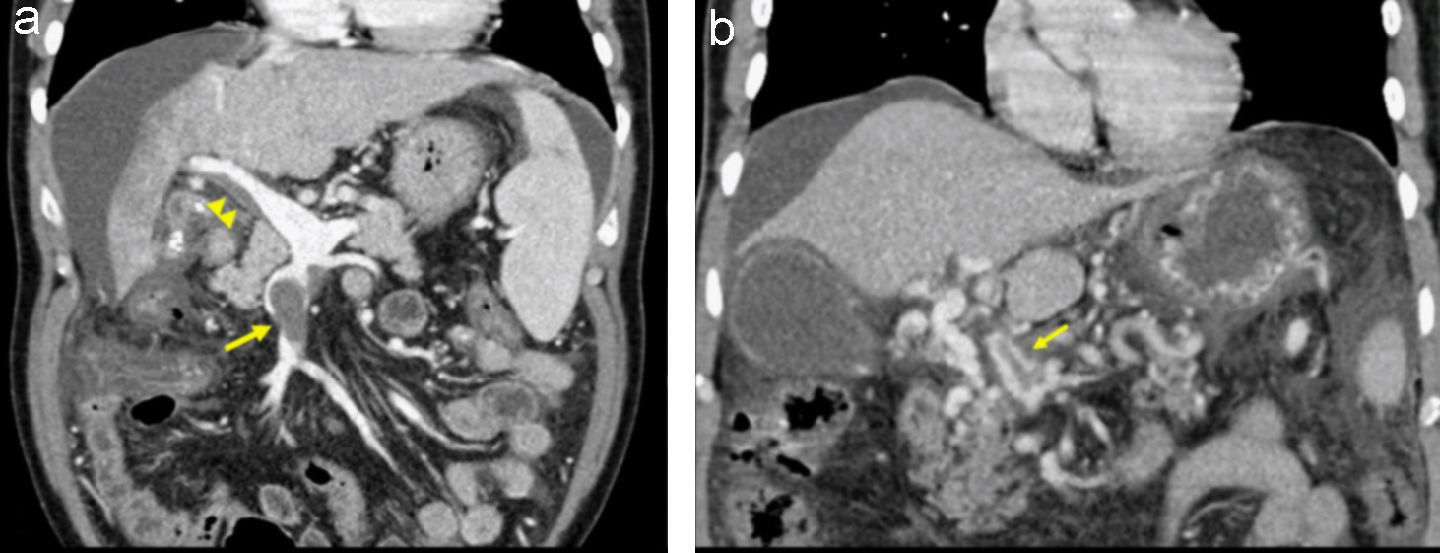
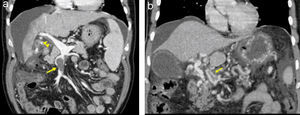
Son varias las pruebas de imagen disponibles para el estudio de la TVP. La ecografía Doppler abdominal que lleva a cabo un facultativo con experiencia e informado sobre la sospecha del cuadro es la técnica de elección por su alta sensibilidad y ausencia de efectos secundarios40. El diagnóstico queda demostrado por la ausencia, estasis, turbulencia, inversión del flujo o presencia de material ecogénico sólido en el interior de la vena porta. Además, permite valorar la existencia de vasos colaterales y esplenomegalia. La tomografía computarizada (TC) y la resonancia magnética (RM) pueden ayudar a establecer la extensión y a identificar el momento evolutivo de la trombosis. Los datos que orientan ante una TVP aguda (fig. 2a) son la existencia de una mayor densidad endoluminal previa a la administración del contraste intravenoso y la ausencia de colaterales de gran tamaño portoportales o portosistémicas. No obstante, en ocasiones será imposible diferenciar si nos encontramos ante una TVP aguda o bien ante un fenómeno de retrombosis en un paciente con cavernomatosis portal. Además, estas técnicas permiten identificar la presencia de alteraciones asociadas a la TVP, como abscesos, neoplasias, procesos inflamatorios intestinales, pancreáticos, etc41. Con la utilización de forma combinada de todas estas técnicas tan sólo permanecerá sin diagnóstico una minoría de casos. La biopsia hepática no tiene valor diagnóstico, aunque puede mostrar proceso trombótico de pequeño vaso venoso portal.
a) En este corte coronal de tomografía computarizada (TC) se puede observar la presencia de un material de alta densidad en el interior de la vena mesentérica superior (flecha) que corresponde a una trombosis total. A nivel de la vena porta se observa otro defecto de repleción que no afecta a la totalidad de la luz, que corresponde a una trombosis parcial de la vena porta (cabeza de flecha). La ausencia de colaterales sugiere que nos encontramos ante un episodio agudo de TVP. (cortesía de la Dra. García-Criado, Servicio de Radiología, Hospital Clínic). b) Corte coronal de TC que muestra la transformación cavernomatosa de la vena porta. En él se puede observar la presencia de múltiples vasos tortuosos que superan la zona trombosada. También se aprecia una imagen de retrombosis en el interior de uno de los vasos que forman el cavernoma (flecha) (cortesía de la Dra. García-Criado, Servicio de Radiología, Hospital Clínic).
En la fase crónica, las técnicas de imagen muestran la presencia de un cavernoma40 (fig. 2b). En formas evolucionadas no es infrecuente que las pruebas de imagen pongan de manifiesto un hígado con alteración de la arquitectura (zonas de atrofia e hipertrofia) e incluso imágenes nodulares correspondientes a áreas de hiperplasia nodular regenerativa en relación con la alteración de la perfusión hepática, que podría hacer pensar en la existencia de un hepatocarcinoma. En estos casos es importante establecer el diagnóstico diferencial de cirrosis con trombosis portal asociada. En estos estadios, la biopsia permite descartar enfermedades hepáticas crónicas. Sobre la base de la experiencia, la presencia de un valor normal en la elastografía de transición (FibroScan®) puede ayudar en el diagnóstico diferencial entre la TVP cirrótica y la TVP no cirrótica. La RM permite, además, evaluar la colangiopatía secundaria a compresión por circulación colateral32,42. La colangiopancreatografía retrógrada endoscópica (CPRE) debe reservarse para los casos sintomáticos que requieran la realización de terapéutica.
TratamientoTrombosis venosa portal agudaAnticoagulaciónTras el diagnóstico de TVP aguda debe iniciarse la anticoagulación lo más precozmente posible19,29. La recomendación de la anticoagulación se basa en la observación de que la recanalización espontánea es extremadamente infrecuente o nula25. En contraste, se observa una recanalización parcial o completa en una proporción considerable de pacientes, que oscila en torno al 40%, en series publicadas recientemente25. La repermeabilización del tronco venoso portal o de una de sus ramas evita el desarrollo de hipertensión portal (y como consecuencia, de ascitis, varices esofágicas y hemorragia digestiva varicosa), con el consiguiente impacto en el pronóstico de estos pacientes25. El retraso en el inicio de la anticoagulación parece vital. En un estudio reciente, la tasa de recanalización (parcial o completa) fue del 60% en los casos en que la anticoagulación se inició en la primera semana desde el inicio de los síntomas, y sólo de un 20% cuando ésta se inició más tarde (dentro de los primeros 30 días)25. Este mismo estudio mostró que la probabilidad de lograr la repermeabilización es menor cuando hay más de un factor protrombótico. Estos datos refuerzan la idea de que un estudio etiológico exhaustivo es mandatario cuando se diagnostica la TVP, y es necesario iniciar la anticoagulación lo más precozmente posible. Un amplio estudio prospectivo multicéntrico europeo identificó la existencia de líquido libre abdominal (incluso detectado por ecografía) y la extensión de la trombosis a la vena esplénica como factores predictivos de ausencia de repermeabilización, a pesar de emplear un tratamiento anticoagulante precoz23. Estos criterios podrían ayudar a seleccionar subpoblaciones de pacientes con TVP aguda que presentan baja probabilidad de recanalización y, por tanto, ser candidatos para probar otras intervenciones terapéuticas más agresivas.
La repermeabilización puede tener lugar hasta después de 4-6 meses tras el inicio de la anticoagulación26,27. Por tanto, es recomendable mantener a los pacientes con anticoagulación al menos durante 6 meses19,29, y actualmente, de acuerdo con las recomendaciones vigentes (comité de expertos), se aconseja un año, ya que las trombosis del territorio esplácnico se consideran trombosis de riesgo vital. La anticoagulación permanente parece razonable en los casos en los que se identifica un trastorno protrombótico, haya antecedentes personales o familiares de trombosis venosa profunda o historia previa de dolor abdominal sospechoso de ser isquémico.
En la fase aguda de la TVP, la anticoagulación debe iniciarse con heparina debido a su rapidez de acción, y debe mantenerse al menos durante 2-3 semanas, tras lo que puede sustituirse por anticoagulantes orales, tratando de mantener un cociente internacional normalizado entre 2 y 3. La heparina de bajo peso molecular (HBPM) es tan efectiva y segura como la heparina intravenosa43. Las HBPM son las más empleadas, ya que presentan una dosis-respuesta más predecible, lo que hace innecesaria su monitorización y le confiere menor riesgo de hemorragia o trombocitopenia alérgica.
La seguridad y eficacia de la anticoagulación a largo plazo en pacientes con TVP se ha evaluado en escasos estudios publicados hasta la fecha. En ellos se constata la gran seguridad de la anticoagulación, ya que no han demostrado que aumente el número ni la gravedad de los episodios de hemorragia digestiva o trombocitopenia30, siempre que se adopten las medidas pertinentes de profilaxis primaria o secundaria de hemorragia digestiva previas al inicio de ésta30. Por tanto, la anticoagulación puede administrarse en presencia de enfermedades subyacentes graves, incluso trombocitopenia, ya que los efectos adversos durante ésta son infrecuentes23,25.
En ausencia de daño isquémico intestinal grave, el dolor abdominal remite en el plazo de una a dos semanas. Cuando se sospeche afectación isquémica intestinal se debe realizar seguimiento con TC. La evolución satisfactoria del cuadro clínico sin recurrencia de signos ni síntomas permitirá llevar a cabo el seguimiento del paciente mediante la realización de ecografías Doppler al tercer y sexto mes del diagnóstico. La aparición tardía (durante el seguimiento) de dolor abdominal indica la presencia de estenosis intestinal como secuela.
Otras medidas terapéuticasLa indicación de tratamientos intensivos, como la administración de fármacos trombolíticos (por vía sistémica o a nivel arterial mesentérico, o bien su administración in situ mediante acceso venoso transyugular o percutáneo transhepático) es controvertida. Por esto, debido a la alta tasa de complicaciones graves, este tratamiento debe reservarse para pacientes que no hayan respondido a la anticoagulación44. Se ha propuesto la colocación de un shunt portosistémico transyugular intrahepático (TIPS) para asegurar un buen flujo portal, en especial en pacientes con SBC asociado22,45,46. Sin embargo, no hay suficientes datos que hayan evaluado el riesgo-beneficio de esta maniobra en comparación con la anticoagulación precoz. Existe un amplio consenso para no indicar la trombectomía quirúrgica, ya que la recurrencia es la norma si no se administra tratamiento anticoagulante de forma simultánea.
Cavernomatosis portalAnticoagulaciónEn pacientes con cavernomatosis portal, la anticoagulación no pretende lograr la repermeabilización, sino prevenir la progresión y la recurrencia de la trombosis30. Estos efectos beneficiosos se han observado sin un aumento en el riesgo o gravedad de la hemorragia gastrointestinal, siempre que se adopten medidas profilácticas adecuadas de prevención de sangrado o resangrado variceal antes de iniciar la anticoagulación30. En pacientes con cavernomatosis portal se recomienda la anticoagulación si existe una enfermedad protrombótica subyacente. Los anticonceptivos orales deben suspenderse.
Profilaxis primaria y secundaria de la hemorragia digestivaNo existen datos suficientes respecto al tratamiento de elección (farmacológico o endoscópico) en la profilaxis primaria, aunque los expertos coinciden en que la prevención debe recomendarse siempre en pacientes con varices grandes19. En nuestra unidad se manejan las mismas guías de profilaxis primaria que las utilizadas en pacientes cirróticos. Se emplean los betabloqueantes como primera opción y se reserva la ligadura endoscópica para pacientes con varices grandes o de riesgo e intolerancia o contraindicación a betabloqueantes.
El tratamiento endoscópico ha mostrado ser eficaz en la profilaxis secundaria47,48. Un estudio prospectivo presentado en forma de resumen por Kumar et al (comunicación personal) evalúa la eficacia en la profilaxis secundaria de los betabloqueantes y la ligadura endoscópica de varices. Ambos tratamientos son similares en cuanto a tasa de resangrado y no hay diferencias significativas en porcentaje o gravedad de los efectos secundarios. De forma similar al manejo de pacientes con cirrosis hepática, a pesar de no haber estudios en esta población, nosotros recomendamos la utilización combinada de la ligadura endoscópica y el tratamiento con betabloqueantesen en la prevención de la recidiva hemorrágica30,48. Son necesarios estudios aleatorizados prospectivos antes de poder realizar recomendaciones sólidas en esta área19.
Tratamiento del episodio agudo de la hemorragia digestivaNo hay estudios que evalúen cuál es el mejor tratamiento para la hemorragia por varices gastroesofágicas. Por tanto, parece razonable aplicar las mismas recomendaciones que para enfermos cirróticos con uso de agentes vasoconstrictores y/o tratamientos endoscópicos19. Con respecto al uso de fármacos (p. ej. somatostatina y terlipresina), existe el riesgo teórico de progresión del trombo debido a la disminución del flujo sanguíneo esplácnico. Sin embargo, no hay datos consistentes a este respecto y se recomienda iniciar el tratamiento farmacológico de forma precoz para controlar la hemorragia48. El dolor abdominal que aparece durante la administración de fármacos vasoconstrictores debería hacer descartar fenómenos de retrombosis del eje esplenomesentericoportal, a los que favorece la reducción del flujo venoso portal.
Otras opciones terapéuticasSe han publicado casos anecdóticos de tratamiento de estos pacientes mediante TIPS49. No obstante, esto es muy difícil o imposible en casos de trombosis portal completa sustituida por vasos colaterales.
La cirugía derivativa debe reservarse para los casos de fallo del tratamiento farmacológico y endoscópico50 y, en cada caso, el tipo de cirugía derivativa debe individualizarse. Para ello se debe conocer si hay vasos permeables potencialmente derivables, y si la variz causante de la hemorragia drenaría a este vaso. En nuestra experiencia, más de un tercio (37%) de los pacientes con TVP presenta, a su vez, trombosis esplénica y de la vena mesentérica superior, por lo que no son candidatos a las técnicas derivativas convencionales. Otros procedimientos, como la transección esofágica o la esplenectomía (en el caso de una hipertensión portal segmentaria por trombosis de vena esplénica) son menos eficaces debido a la alta frecuencia de resangrado por recidiva de varices. A la hora de considerar la posible realización de una anastomosis derivativa, también se debe tener en cuenta el posible riesgo de trombosis del shunt, dada la existencia frecuente de enfermedades trombofílicas en estos pacientes.
Las nuevas técnicas quirúrgicas, como el bypass desde la vena mesentérica a la rama portal izquierda (Rex-shunt), muestran unos resultados excelentes en niños con TVP sintomática. Con esta técnica se obtiene la resolución de los síntomas, el cese de los episodios de hemorragia digestiva, la normalización del tamaño del bazo, del hemograma y de los parámetros de coagulación (incluidos los factores II, V, VII), preservando así el flujo hepático de una forma fisiológica12,51,52. La experiencia de esta técnica en adultos se reduce a escasos casos clínicos, pero con resultados alentadores51,53. Recientemente se ha publicado un caso de realización de bypass de la vena esplénica a la rama portal izquierda en un adulto, que alcanzó resolución de la hipertensión portal y restitución del flujo portal54. Por el momento, la aplicabilidad de estas técnicas en adultos requiere validación.
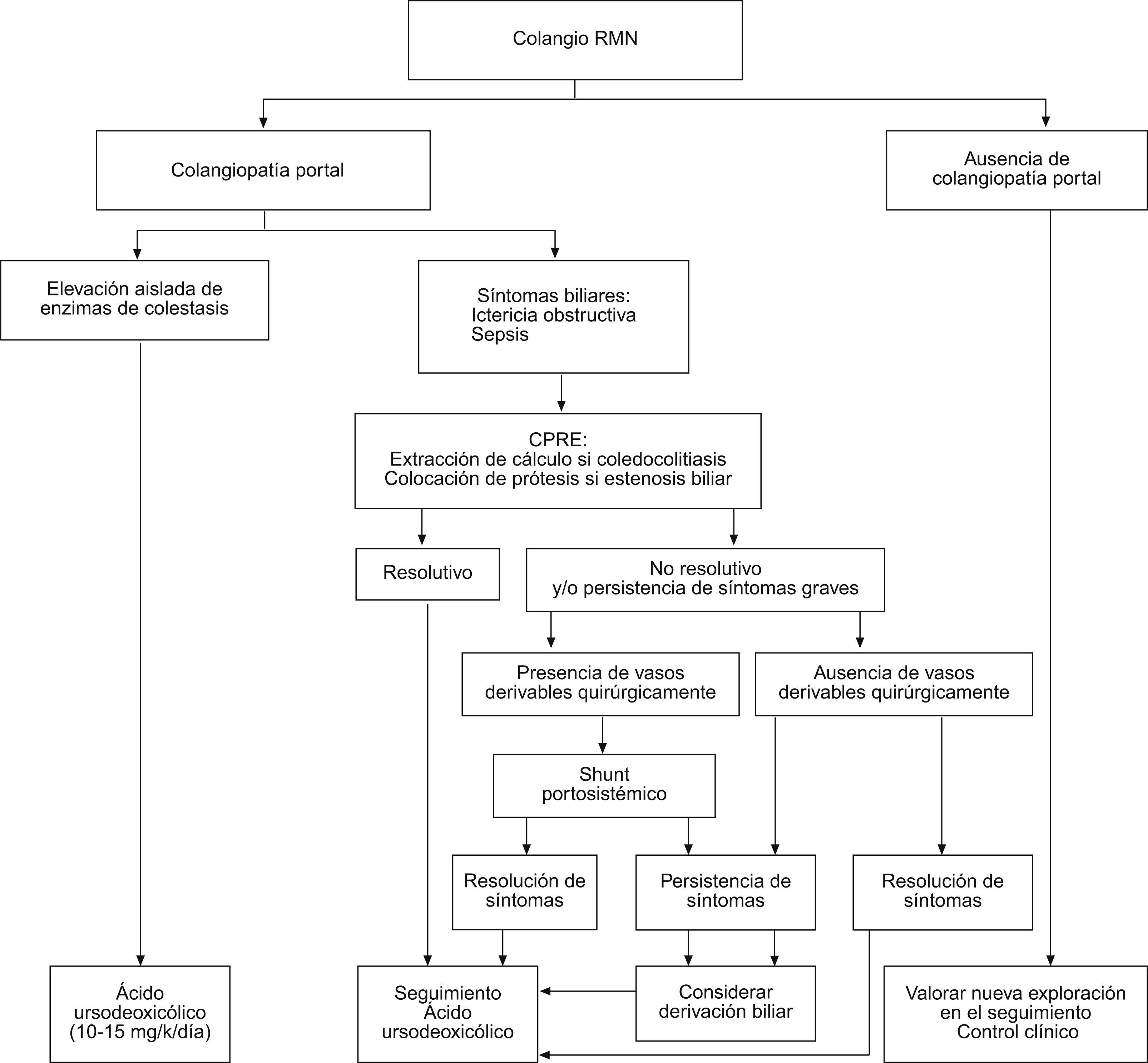
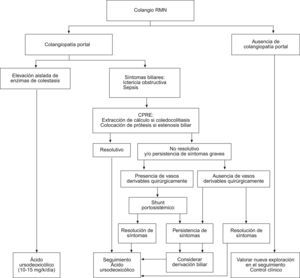
Tratamiento de la colangiopatía portalNo existe estudios que hayan evaluado de forma prospectiva de las siguientes recomendaciones de tratamiento de la colangiopatía portal, que se basan en la experiencia personal y en la revisión de la escasa literatura médica disponible55,56. La administración de ácido ursodesoxicólico (en dosis de 10 a 15mg/kg/día) debe iniciarse en todo paciente con colangiopatía portal sintomática32.
En aquellas ocasiones en las que haya coledocolitiasis como complicación de una estenosis biliar debe realizarse una esfinterotomía y extracción del cálculo por CPRE. La esfinterotomía no suele ser eficaz si no existe litiasis coledocal57. En caso de persistir la sintomatología debe considerarse la colocación de una prótesis biliar. Debe programarse de forma periódica el recambio de la prótesis, con el fin de evitar la previsible obstrucción de ésta. Cuando haya vasos subsidiarios de descompresión, al descomprimir el sistema venoso portal la derivación quirúrgica del eje esplenoportal58 podría disminuir la compresión del cavernoma sobre la vía biliar. Por ello se ha sugerido que ésta sería una alternativa eficaz que algunos autores prefieren utilizar antes que la colocación de prótesis biliares. Las derivaciones bilioentéricas se asocian a un elevado riesgo quirúrgico y, por esto, sólo deben plantearse cuando no hay otras alternativas32. Se ha sugerido que el tratamiento con betabloqueantes no selectivos, al reducir el flujo portal, podría ser también beneficioso. Sin embargo, este hecho no se ha demostrado. Se han publicado casos anecdóticos de trasplante hepático en pacientes con complicaciones biliares y cavernoma59.
La figura 3 resume el algoritmo terapéutico de la colangiopatía portal.
Trombosis portal y embarazoTratamiento de la trombosis venosa portal establecida previa al embarazoEl tratamiento de estas pacientes es triple: a) prevención del posible empeoramiento de la TVP por el estado protrombótico característico del embarazo; b) tratamiento de la enfermedad protrombótica de base, y c) prevención y tratamiento de las complicaciones de la hipertensión portal. La anticoagulación debe mantenerse si hay un factor protrombótico subyacente. Los anticoagulantes orales presentan un elevado riesgo de abortos (14,6-56%) y malformaciones congénitas (30%), por lo que se recomienda el uso de HBPM. Éstas deben iniciarse lo más precozmente posible.
Apenas hay datos del tratamiento de la hipertensión portal durante el embarazo, por lo que parece razonable aplicar las mismas medidas preventivas y terapéuticas de la cirrosis hepática. Se recomienda la realización de una endoscopia digestiva antes de finalizar el segundo trimestre para evaluar el tamaño de las varices, incluso en aquellas pacientes en las que éstas no estuviesen presentes previamente. Los betabloqueantes, a pesar de su riesgo (aunque ocasional) de retardo de crecimiento intrauterino y bradicardia fetal, deben considerarse como la primera línea en la profilaxis primaria. La ligadura endoscópica asociada a betabloqueantes sería una alternativa adecuada en la profilaxis secundaria. El embarazo en estas pacientes suele seguir un curso normal y el parto vaginal es el recomendado ante el elevado riesgo asociado a la cesárea por la posible presencia de várices pélvicas. En caso de hemorragia digestiva por varices, el pronóstico materno es bueno, pero no así el fetal. La incidencia de aborto, fetos pequeños para la edad gestacional y muerte perinatal es mayor en estas mujeres5,18. En caso de que exista una enfermedad protrombótica subyacente específica, también deberá valorarse el posible impacto de ésta sobre el embarazo. Toda paciente con TVP que desee quedarse embarazada debe ser informada adecuadamente y el embarazo debe considerarse como de alto riesgo.
Tratamiento de la trombosis venosa portal intercurrenteEl tratamiento no difiere del de las no gestantes y se recomienda el uso de HBPM, que pueden alcanzar unas tasas de recanalización parcial o completa en el 75% de los casos.
Evolución y pronósticoEstudios recientes reflejan que la trombosis portal tiene un buen pronóstico, y la tasa de supervivencia se sitúa en el 85% a los 5 años y en el 81% a los 10 años12,60. En estadios precoces, la necrosis intestinal es la complicación más grave, con una mortalidad entre el 20 y el 50%, incluso con la resección quirúrgica del segmento afectado3. La mortalidad en estos pacientes se debe principalmente a las enfermedades asociadas más que a las complicaciones de la hipertensión portal19. En más del 50% de los casos (fundamentalmente en pacientes con más de 60 años de edad), la causa de la muerte no guarda relación directa con la TVP. En la mitad de los fallecidos como consecuencia directa de la TVP lo hacen por hemorragia digestiva y el resto (el 25%) por trombosis extensa o recurrente30. Los factores predictivos de supervivencia no se han estudiado convenientemente, aunque parece que el principal determinante es la edad.
Al los Dres. Cervantes, Reverter y García-Criado por su inestimable colaboración.
Susana Seijo-Ríos recibe una beca «Río Hortega» del Instituto de Salud Carlos III (CM08/00161). El CIBERehd está financiado por el Instituto de Salud Carlos III.