Ustekinumab (UST) es un anticuerpo monoclonal frente a IL-12/23 aprobado en España (2017) para tratar el brote moderado/grave de enfermedad de Crohn.
ObjetivoEvaluar la efectividad y seguridad en práctica clínica real en los pacientes tratados con UST en nuestro centro.
MétodosEstudio prospectivo observacional unicéntrico incluyendo los pacientes que iniciaron UST desde el 1/08/2017 hasta el 28/02/2019 con seguimiento hasta esa fecha. Analizamos respuesta y remisión en semanas 16, 24 y 52, utilizando «Crohn's Disease Activity Index» (respuesta si descenso de 100 puntos y remisión si <150) y la «Valoración Global del especialista» traducción del «Physician's Global Assessment».
ResultadosIncluimos 61 pacientes con una mediana de duración de enfermedad de Crohn de 14,6 años (0-36). El 83,6% sin esteroides y el 73,8% sin inmunosupresores asociados. Previamente todos habían recibido anti-TNF y el 14,8%, además, vedolizumab.
Observamos buena correlación entre Crohn's Disease Activity Index y Valoración Global del especialista (r = 0,89, p < 0,001). En la semana 16 (n = 45) un 75,6% de respuesta (57,8% remisión), en semana 24 (n = 35) 69,9% respuesta (45,7% remisión) y en semana 52 (n = 12) 75% respuesta (58,3% remisión). No se obtuvieron diferencias estadísticamente significativas en la tasa de respuesta/remisión en semana 16 ni 24 en función del motivo de inicio de UST o el número de biológicos previos. En 2 pacientes se retiró por toxicidad (artralgias/mialgias).
ConclusiónUST es un fármaco eficaz y seguro en práctica clínica real con altas tasas de remisión clínica en semana 16, 24 y 52 independientemente del orden de biológico utilizado y del motivo de inicio de UST.
Ustekinumab (UST) is a monoclonal antibody against IL-12/23 approved in Spain (2017) to treat moderate / severe Crohn's disease.
ObjectiveTo evaluate the effectiveness and safety in real clinical practice in patients treated with UST in our center.
MethodsThis is a prospective observational study including patients who started UST from 08/01/2017 to 02/28/2019 with follow-up up to that date. We analyze response and remission in weeks 16, 24 and 52, using “Crohn's Disease Activity Index” (response if 100 point decrease and remission if <150) and Physician's Global Assessment.
ResultsWe included 61 patients with a median duration of Crohn's disease of 14,6 years (0-36). The 83,6% of patients without steroids and 73,8% without associated immunosuppressors. Previously all patients had received anti-TNF and 14,8%, in addition, vedolizumab.
We observed a good correlation between Crohn's Disease Activity Index and Physician's Global Assessment (r = 0,89, p <.001). In week 16 (n = 45) 75,6% response (57,8% remission), in week 24 (n = 35) 69,9% response (45,7% remission) and in week 52 (n = 12) 75% response (58.3% remission). There were no statistically significant differences in the response/remission rates at week 16 or 24 depending on the reason for the onset of UST or the number of previous biologics. In 2 patients it was withdrawn due to toxicity (arthralgia / myalgia).
ConclusionUST is an effective and safe treatment in real clinical practice with high rates of clinical remission at week 16, 24 and 52 regardless of the order of biological used and the reason for starting UST.
El desarrollo de anti-TNF ha supuesto una revolución en el tratamiento y calidad de vida de pacientes con enfermedad inflamatoria intestinal1,2. Sin embargo, aproximadamente un tercio de los enfermos no responden inicialmente a anti-TNF, y un porcentaje acaban perdiendo eficacia o presenta efectos adversos o intolerancia precisando su retirada2. Además su eficacia disminuye usando un segundo anti-TNF tanto en no respondedores primarios como fallo secundario.
Los avances en el conocimiento de vías inflamatorias han permitido desarrollar fármacos con mecanismos de acción distintos del bloqueo TNF-alfa diversificando el arsenal terapéutico en EC. En 2015 la «European Medicines Agency» (EMA) aprobaba el vedolizumab, fármaco antiintegrina en EC moderada/grave y en 2016 ocurría lo mismo con el ustekinumab (UST)12 estando disponible en España desde 2017.
UST es un anticuerpo monoclonal frente a la subunidad p40, que forma parte de IL-12 e IL-23. Está indicado para la EC activa moderada/grave, con respuesta inadecuada, pérdida de respuesta, intolerancia o contraindicación al tratamiento convencional o anti-TNF. Previamente UST había sido aprobado en otras indicaciones (psoriasis en placas y artritis psoriásica3), aunque la EC es la única entidad en la que se autoriza la inducción endovenosa (ev).
Su eficacia y seguridad en la inducción se demuestra en los ensayos clínicos fase 3 UNITI-1 y UNITI-2, aleatorizados, doble ciego y controlados con placebo. Se incluyeron pacientes mayores de edad con EC moderada/grave (CDAI 220-450), diagnosticada al menos 3 meses antes, y que habían recibido previamente tratamiento con anti-TNF (UNITI-1) o tratamiento convencional (UNITI-2), y o bien habían fracasado a este (pérdida de respuesta primaria o secundaria) presentaban intolerancia o reacciones adversas a la medicación.
La eficacia y seguridad de UST en el mantenimiento de la respuesta se demuestra en el ensayo clínico fase 3 IM-UNITI4.
Sin embargo, la evidencia de UST, utilizando la inducción ev en práctica clínica es aún escasa. La mayoría de los estudios publicados son previos a la aprobación de la formulación ev y presentan diferencias en diseño, número limitado de pacientes, distintas posologías y forma de administración de UST. Además, los enfermos en práctica clínica real difieren la mayoría de las veces de los incluidos en ensayos clínicos por sus criterios de inclusión estrictos5–9.
Por ello, presentamos este estudio de práctica clínica real, en el que analizamos las características de todos los pacientes con EC que inician tratamiento con UST (inducción ev) en nuestro centro, evaluando la eficacia y seguridad en inducción y mantenimiento.
Material y métodosDiseño del estudio y pacientesRealizamos un estudio observacional prospectivo unicéntrico, incluyendo a todos los pacientes con EC tratados con UST en el Complejo Hospitalario de Navarra desde agosto de 2017 hasta febrero de 2019, finalizando el seguimiento en esa fecha. En todos ellos la inducción se hizo con UST ev.
MétodoLa dosis de UST fue la indicada en ficha técnica. La inducción consistió en una dosis inicial única ev calculada según peso: < 55kg: 260mg, 55-85kg: 390mg, > 85kg: 520mg; seguida de una dosis de 90mg de UST subcutáneo (sc) en la semana 83.
La respuesta a la inducción se evaluó en la semana 16 administrando 90mg sc de mantenimiento cada 8 semanas. La decisión de intensificar reduciendo el intervalo entre dosis (cada 4- 6 semanas) se dejó a criterio del médico especialista responsable. En ningún caso se planteó reinducción con nueva dosis ev del fármaco.
Analizamos variables demográficas, descriptivas, tratamientos y motivo para iniciar UST. Se revisaron en consulta todos los pacientes al menos en la semana 16, 24 y 52. Se calcularon índices clínicos de actividad: «Crohn's Disease Activity Index» (CDAI) y Harvey-Bradshaw Index (HBI), y marcadores de inflamación como la proteína C reactiva (PCR) y la calprotectina fecal (CF). Se realizó una valoración global por el especialista (VGE, sinónimo del inglés «Physician's Global Assessment») que integraba anamnesis, exploración y parámetros analíticos.
Se definió respuesta según la VGE que clasifica en no respuesta, respuesta (RP) o remisión y CDAI considerando RP una disminución de 100 puntos frente al basal y remisión puntuación < 150 puntos.
Análisis estadísticoPara el análisis estadístico utilizamos el programa SPSS versión 20. Realizamos inicialmente análisis descriptivo epidemiológico y de la enfermedad hasta el inicio del tratamiento. En las variables categóricas se utilizó la proporción y en cuantitativas, media y desviación estándar o mediana y el rango intercuartílico según correspondiese.
Posteriormente analizamos la respuesta utilizando dos de los criterios previamente mencionados (CDAI y VGE) y los parámetros analíticos en semana 16, 24 y 52.
Realizamos análisis estratificado en función del motivo de inicio de UST y del número de biológicos previos. Analizamos la comparabilidad de los grupos mediante chi cuadrado o test exacto de Fisher, según correspondiese en variables cualitativas y mediante t de student para muestras independientes o test de Wilcoxon para las variables cuantitativas.
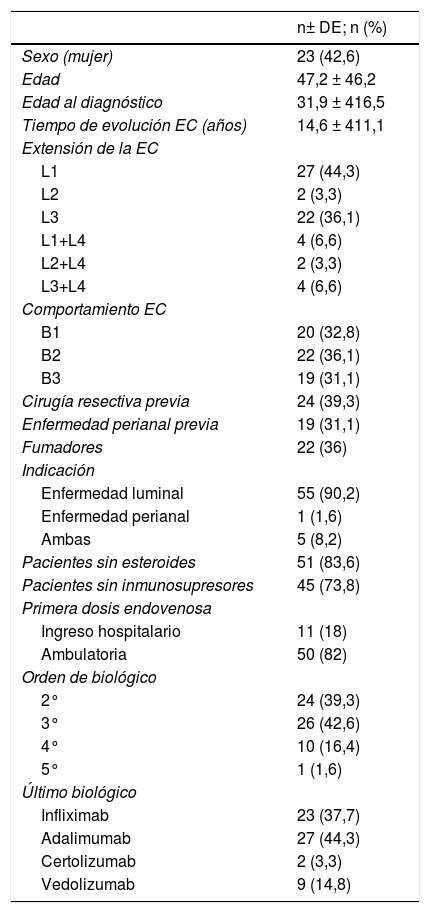
ResultadosSe incluyeron 61 pacientes cuyas características basales se muestran en la tabla 1. Destacamos que, si bien el 31,1% (n = 19) tenían enfermedad perianal, la indicación de UST fue enfermedad luminal activa en el 90,2% (n = 55), enfermedad luminal y perianal activa en el 8,2% (n = 5) y solo en un paciente (1,6%) la indicación fue exclusivamente enfermedad perianal activa. En el momento de la inducción con UST ev el 83,6% de los pacientes no recibían esteroides y un 73,8% sin inmunosupresores asociados. Además el 39,2% tenían antecedentes de cirugía resectiva previa.
Características basales demográficas de los pacientes
| n± DE; n (%) | |
|---|---|
| Sexo (mujer) | 23 (42,6) |
| Edad | 47,2 ± 46,2 |
| Edad al diagnóstico | 31,9 ± 416,5 |
| Tiempo de evolución EC (años) | 14,6 ± 411,1 |
| Extensión de la EC | |
| L1 | 27 (44,3) |
| L2 | 2 (3,3) |
| L3 | 22 (36,1) |
| L1+L4 | 4 (6,6) |
| L2+L4 | 2 (3,3) |
| L3+L4 | 4 (6,6) |
| Comportamiento EC | |
| B1 | 20 (32,8) |
| B2 | 22 (36,1) |
| B3 | 19 (31,1) |
| Cirugía resectiva previa | 24 (39,3) |
| Enfermedad perianal previa | 19 (31,1) |
| Fumadores | 22 (36) |
| Indicación | |
| Enfermedad luminal | 55 (90,2) |
| Enfermedad perianal | 1 (1,6) |
| Ambas | 5 (8,2) |
| Pacientes sin esteroides | 51 (83,6) |
| Pacientes sin inmunosupresores | 45 (73,8) |
| Primera dosis endovenosa | |
| Ingreso hospitalario | 11 (18) |
| Ambulatoria | 50 (82) |
| Orden de biológico | |
| 2° | 24 (39,3) |
| 3° | 26 (42,6) |
| 4° | 10 (16,4) |
| 5° | 1 (1,6) |
| Último biológico | |
| Infliximab | 23 (37,7) |
| Adalimumab | 27 (44,3) |
| Certolizumab | 2 (3,3) |
| Vedolizumab | 9 (14,8) |
DE: desviacón estándar; EC: enfermedad de Crohn.
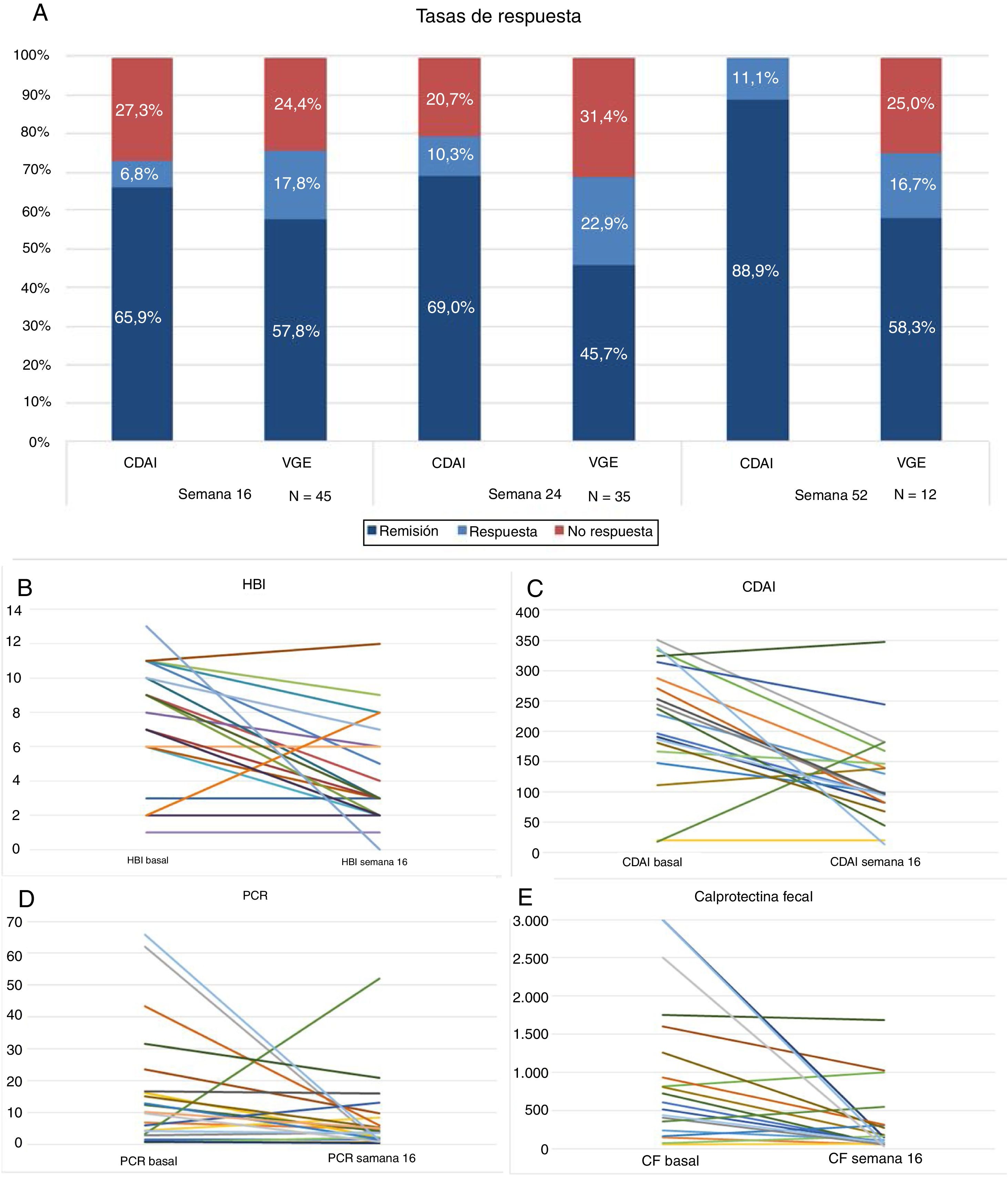
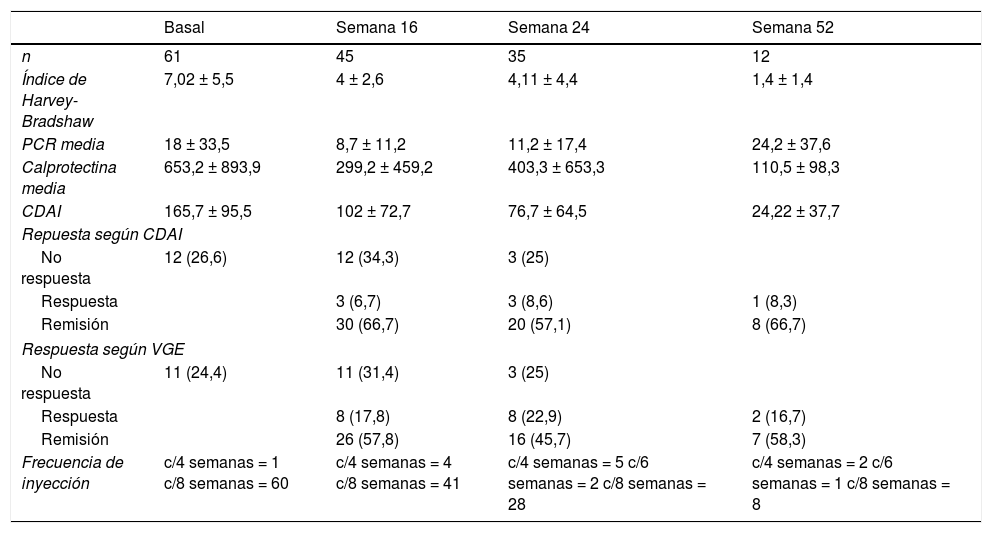
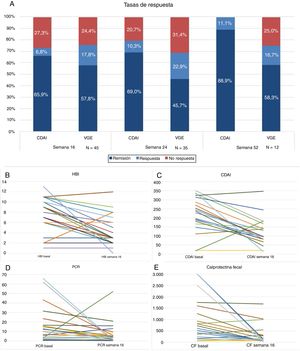
Cuarenta y cinco pacientes llegan a la semana 16 en el periodo del estudio. En este momento, según la VGE el 57,8% (n = 26) estaban en remisión libre de esteroides, el 17,8% (n = 8) en respuesta y el 24,4% (n = 11) no habían respondido al fármaco (fig. 1A). La mayoría se administraban el fármaco cada 8 semanas, solo 4 (8,8%) estaban intensificados y se administraban UST (90mg sc) cada 4 semanas. La diferencia de medianas entre la primera infusión ev y la semana 16 fue estadísticamente significativa para el HBI (p < 0,001), el CDAI (p < 0,001), la PCR (p = 0,026) y la CF (p = 0,001) (fig. 1B-E).
A) Tasas de respuesta, remisión o no respuesta en semana 16, 24 y 52. CDAI: Crohńs Disease Activity Index; VGE: valoración global del especialista.
B) Variación de índice Harvey-Bradshaw Index (HBI) entre la situación basal y semana 16. C) Variación del CDAI entre situación basal y semana 16. D) Variación de proteína C reactiva (PCR) entre situación basal y semana 16. E) Variación de calprotectina fecal (CF) entre situación basal y semana 16.
Treinta y cinco pacientes llegaron a la semana 24, de los cuales un 45,7% (n = 16) estaban en remisión libre de esteroides, el 22,9% (n = 8) en respuesta y un 31,4% (n = 11) no habían respondido. El 17% (n = 6) estaba intensificado: 4 recibían UST (90mg sc) cada 4 semanas y 2 cada 6 semanas. La diferencia de medianas entre la primera infusión ev y la semana 24 fue estadísticamente significativa para el HBI (p = 0,01), el CDAI (p = 0,001) y la CF (p = 0,006). Las diferencias no fueron estadísticamente significativas para la PCR (p = 0,13).
Doce pacientes llegaron a la semana 52. De ellos, un 58,3% (n = 7) mantenían la remisión libre de esteroides, un 16,7% (n = 2) seguían en respuesta y el 25% (n = 3) habían fracasado.
La diferencia de medianas entre la primera infusión ev y la semana 52 fue estadísticamente significativa para el HBI (p = 0,007), el CDAI (p = 0,01) pero no para la CF (p = 0,6) ni para la PCR (p = 0,5).
Los parámetros inflamatorios, tasas globales de respuesta y la frecuencia de inyección se muestran en la tabla 2.
Características basales clínicas de actividad y parámetros bioquímicos
| Basal | Semana 16 | Semana 24 | Semana 52 | |
|---|---|---|---|---|
| n | 61 | 45 | 35 | 12 |
| Índice de Harvey-Bradshaw | 7,02 ± 5,5 | 4 ± 2,6 | 4,11 ± 4,4 | 1,4 ± 1,4 |
| PCR media | 18 ± 33,5 | 8,7 ± 11,2 | 11,2 ± 17,4 | 24,2 ± 37,6 |
| Calprotectina media | 653,2 ± 893,9 | 299,2 ± 459,2 | 403,3 ± 653,3 | 110,5 ± 98,3 |
| CDAI | 165,7 ± 95,5 | 102 ± 72,7 | 76,7 ± 64,5 | 24,22 ± 37,7 |
| Repuesta según CDAI | ||||
| No respuesta | 12 (26,6) | 12 (34,3) | 3 (25) | |
| Respuesta | 3 (6,7) | 3 (8,6) | 1 (8,3) | |
| Remisión | 30 (66,7) | 20 (57,1) | 8 (66,7) | |
| Respuesta según VGE | ||||
| No respuesta | 11 (24,4) | 11 (31,4) | 3 (25) | |
| Respuesta | 8 (17,8) | 8 (22,9) | 2 (16,7) | |
| Remisión | 26 (57,8) | 16 (45,7) | 7 (58,3) | |
| Frecuencia de inyección | c/4 semanas = 1 c/8 semanas = 60 | c/4 semanas = 4 c/8 semanas = 41 | c/4 semanas = 5 c/6 semanas = 2 c/8 semanas = 28 | c/4 semanas = 2 c/6 semanas = 1 c/8 semanas = 8 |
CDAI: Crohn's Disease Activity Index; PCR: proteína C reactiva; VGE: valoración global del especialista.
Hubo una excelente correlación entre la puntuación CDAI y la VGE, con un coeficiente de Pearson r = 0,898 que fue estadísticamente significativo (p < 0,001).
En nuestra serie, en 2 pacientes (3,27%) hubo que retirar el fármaco por reacciones adversas, ambos por artralgias y mialgias y en 4 (6,55%) por ineficacia. Durante el seguimiento, precisaron ingreso 11 de los 61 pacientes (18%): 6 por cirugía programada (54,5%), 2 (18,2%) por actividad inflamatoria, 2 por cuadros de suboclusión/obstrucción intestinal y un caso (9,1%) por infección severa tratándose de una sepsis urinaria.
De los 6 pacientes operados, 4 reinician posteriormente UST para prevención de la recurrencia posquirúrgica, uno de ellos además por patología reumatológica asociada. En los otros dos se indicó anti-TNF como prevención de recurrencia.
Análisis estratificadoTodos los pacientes habían recibido previamente anti-TNF; el 39,3% (24) solo un biológico, el 42,6% dos biológicos y el 18% tres o más biológicos previos al inicio de UST.
Nueve (14,7%) por fracaso previo a anti-TNF y además a un fármaco antiintegrina.
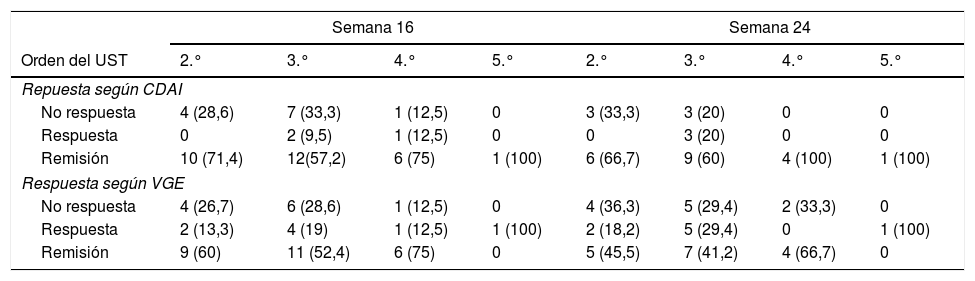
El análisis estratificado según el número de biológicos previos se muestra en la tabla 3; no se observaron diferencias estadísticamente significativas en la tasa de respuesta o remisión en la semana 16 ni en la semana 24.
Tasas de respuestas según ustekinumab fuera el segundo, tercer, cuarto o quinto biológico
| Semana 16 | Semana 24 | |||||||
|---|---|---|---|---|---|---|---|---|
| Orden del UST | 2.° | 3.° | 4.° | 5.° | 2.° | 3.° | 4.° | 5.° |
| Repuesta según CDAI | ||||||||
| No respuesta | 4 (28,6) | 7 (33,3) | 1 (12,5) | 0 | 3 (33,3) | 3 (20) | 0 | 0 |
| Respuesta | 0 | 2 (9,5) | 1 (12,5) | 0 | 0 | 3 (20) | 0 | 0 |
| Remisión | 10 (71,4) | 12(57,2) | 6 (75) | 1 (100) | 6 (66,7) | 9 (60) | 4 (100) | 1 (100) |
| Respuesta según VGE | ||||||||
| No respuesta | 4 (26,7) | 6 (28,6) | 1 (12,5) | 0 | 4 (36,3) | 5 (29,4) | 2 (33,3) | 0 |
| Respuesta | 2 (13,3) | 4 (19) | 1 (12,5) | 1 (100) | 2 (18,2) | 5 (29,4) | 0 | 1 (100) |
| Remisión | 9 (60) | 11 (52,4) | 6 (75) | 0 | 5 (45,5) | 7 (41,2) | 4 (66,7) | 0 |
CDAI: Crohn's Disease Activity Index; VGE: valoración global del especialista.
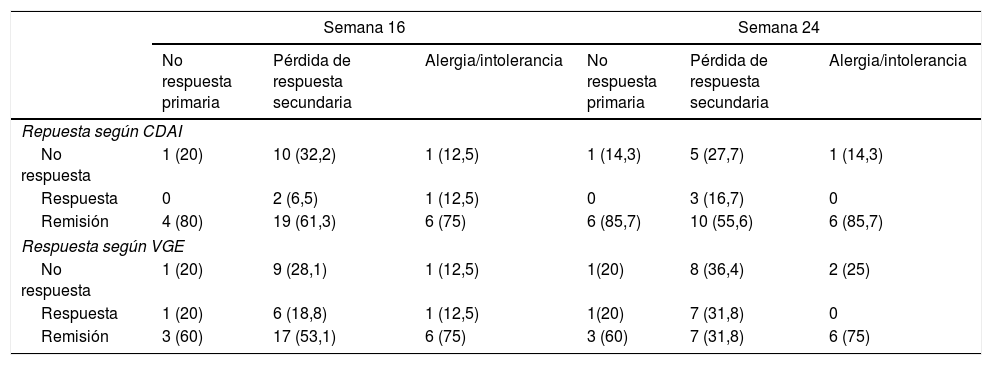
El análisis estratificado por motivo de retirada del anti-TNF (fallo primario, secundario o toxicidad) se muestra en la tabla 4. No se observaron diferencias estadísticamente significativas en tasas de respuesta o remisión tanto en la semana 16 como en la semana 24.
Tasas de respuestas según el motivo de indicación de ustekinumab (no respuesta primaria, pérdida de respuesta secundaria o alergia/intolerancia al biológico previo)
| Semana 16 | Semana 24 | |||||
|---|---|---|---|---|---|---|
| No respuesta primaria | Pérdida de respuesta secundaria | Alergia/intolerancia | No respuesta primaria | Pérdida de respuesta secundaria | Alergia/intolerancia | |
| Repuesta según CDAI | ||||||
| No respuesta | 1 (20) | 10 (32,2) | 1 (12,5) | 1 (14,3) | 5 (27,7) | 1 (14,3) |
| Respuesta | 0 | 2 (6,5) | 1 (12,5) | 0 | 3 (16,7) | 0 |
| Remisión | 4 (80) | 19 (61,3) | 6 (75) | 6 (85,7) | 10 (55,6) | 6 (85,7) |
| Respuesta según VGE | ||||||
| No respuesta | 1 (20) | 9 (28,1) | 1 (12,5) | 1(20) | 8 (36,4) | 2 (25) |
| Respuesta | 1 (20) | 6 (18,8) | 1 (12,5) | 1(20) | 7 (31,8) | 0 |
| Remisión | 3 (60) | 17 (53,1) | 6 (75) | 3 (60) | 7 (31,8) | 6 (75) |
CDAI: Crohn's Disease Activity Index; VGE: valoración global del especialista.
En los ensayos clínicos UNITI-1 y UNITI-2 el objetivo primario evaluaba respuesta clínica en la semana 6 con dosis ev de 6mg/kg. En la semana 6, el 34% de los pacientes en el UNITI-1 y el 55% en el UNITI-2 estaban en remisión (CDAI < 100), siendo estas cifras del 38% y 58%, respectivamente, en la semana 84,10.
En cuanto al mantenimiento, en el estudio IM-UNITI usaron dosis de 90mg sc cada 8 o 12 semanas. El porcentaje de remisión clínica (CDAI < 150) en la semana 44 fue significativamente superior a placebo (48,8% cada 12 semanas y 53,1% cada 8 semanas). Aunque las tasas de respuesta con pauta cada 8 semanas eran superiores no se objetivaron diferencias estadísticamente significativas4,10.
Las dosis de inducción y mantenimiento en nuestros pacientes son las mismas indicadas en ficha técnica y estudios UNITI: 6mg/kg ev para la inducción y 90mg sc (cada 8 o 12 semanas) en el mantenimiento.
Por otro lado, como se expone en el estudio EFIFECT sobre tratamiento con anti-TNF, hasta la mitad de los pacientes con EII tratados en práctica clínica real no están representados en los ensayos clínicos. Esto explica, al menos en parte, que los resultados en los ensayos clínicos, habitualmente infraestimen la respuesta observada en práctica clínica real11. Analizando los criterios de inclusión del UNITI-1 únicamente el 29,5% de nuestros pacientes habrían sido incluidos y un 0% en el UNITI-2.
En nuestra serie observamos falta de respuesta en el 27,3% en la semana 16, dato muy inferior al porcentaje de no respuesta en el estudio UNITI que corresponde con un 52,6% (según el CDAI). Si analizamos el estudio IM-UNITI en la semana 52 frente a nuestros datos, las tasas de no respuesta fueron del 40,6% y el 25%, respectivamente. Si analizamos el porcentaje de remisión en la semana 52 no encontramos una diferencia tan marcada, observando un 53,1% en el IM-UNITI y un 58,3% en nuestro estudio4.
Existen diversos estudios en práctica clínica real publicados con anterioridad a la aprobación del fármaco (5-9), la mayoría son poblaciones heterogéneas con diferencias en las pautas de inducción subcutánea.
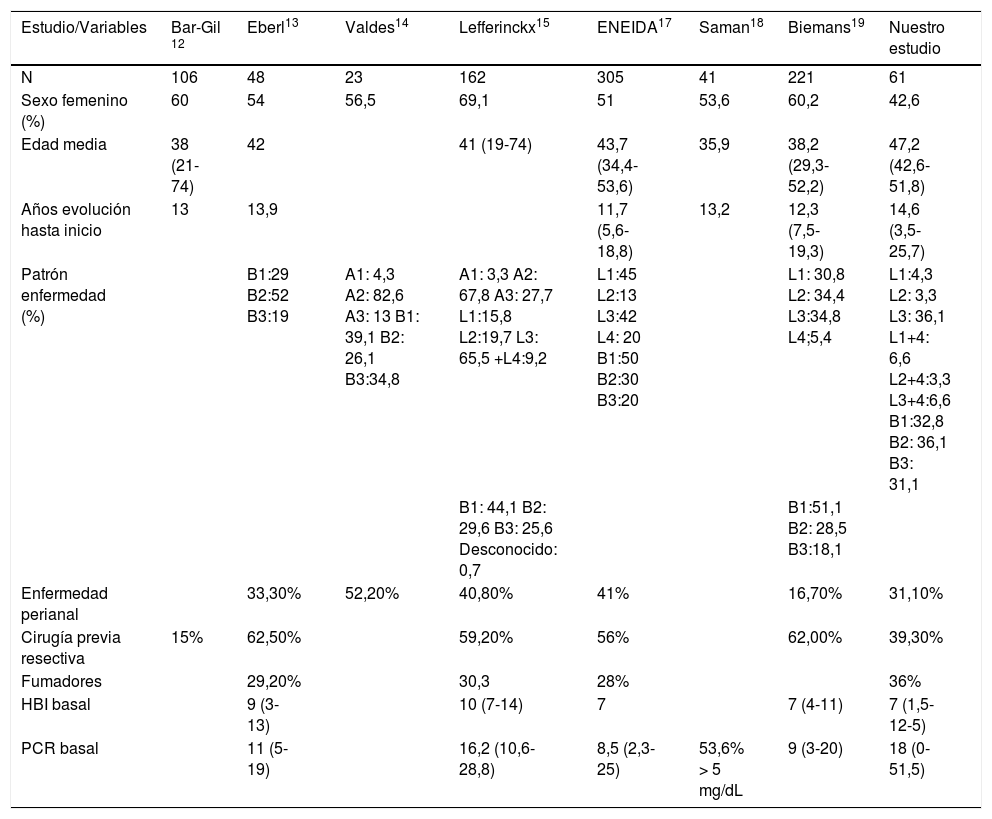
Centrándonos en estudios con inducción de UST ev, existen varios artículos que evalúan su eficacia en práctica clínica. Parte de la evidencia se trata de estudios presentados en reuniones internacionales como European Crohn's and Colitis Organization, United European Gastroenterology, y otros han sido recientemente publicados. Todos incluyen pacientes con EC activa y pauta de inducción ev ajustada a peso, seguida de dosis de 90mg sc en la semana 8. Las características basales de todos ellos se muestran en la tabla 5.
Resumen de características basales de los diferentes estudios de práctica clínica
| Estudio/Variables | Bar-Gil 12 | Eberl13 | Valdes14 | Lefferinckx15 | ENEIDA17 | Saman18 | Biemans19 | Nuestro estudio |
|---|---|---|---|---|---|---|---|---|
| N | 106 | 48 | 23 | 162 | 305 | 41 | 221 | 61 |
| Sexo femenino (%) | 60 | 54 | 56,5 | 69,1 | 51 | 53,6 | 60,2 | 42,6 |
| Edad media | 38 (21-74) | 42 | 41 (19-74) | 43,7 (34,4-53,6) | 35,9 | 38,2 (29,3-52,2) | 47,2 (42,6-51,8) | |
| Años evolución hasta inicio | 13 | 13,9 | 11,7 (5,6-18,8) | 13,2 | 12,3 (7,5-19,3) | 14,6 (3,5-25,7) | ||
| Patrón enfermedad (%) | B1:29 B2:52 B3:19 | A1: 4,3 A2: 82,6 A3: 13 B1: 39,1 B2: 26,1 B3:34,8 | A1: 3,3 A2: 67,8 A3: 27,7 L1:15,8 L2:19,7 L3: 65,5 +L4:9,2 | L1:45 L2:13 L3:42 L4: 20 B1:50 B2:30 B3:20 | L1: 30,8 L2: 34,4 L3:34,8 L4;5,4 | L1:4,3 L2: 3,3 L3: 36,1 L1+4: 6,6 L2+4:3,3 L3+4:6,6 B1:32,8 B2: 36,1 B3: 31,1 | ||
| B1: 44,1 B2: 29,6 B3: 25,6 Desconocido: 0,7 | B1:51,1 B2: 28,5 B3:18,1 | |||||||
| Enfermedad perianal | 33,30% | 52,20% | 40,80% | 41% | 16,70% | 31,10% | ||
| Cirugía previa resectiva | 15% | 62,50% | 59,20% | 56% | 62,00% | 39,30% | ||
| Fumadores | 29,20% | 30,3 | 28% | 36% | ||||
| HBI basal | 9 (3-13) | 10 (7-14) | 7 | 7 (4-11) | 7 (1,5-12-5) | |||
| PCR basal | 11 (5-19) | 16,2 (10,6-28,8) | 8,5 (2,3-25) | 53,6% > 5 mg/dL | 9 (3-20) | 18 (0-51,5) |
HBI: Harvey Bradshaw Index; PCR: proteína C reactiva.
El estudio de Bar- Gil12 et al. incluye 106 pacientes de centros israelíes con seguimiento medio de 24 semanas. La variable principal fue remisión clínica libre de esteroides en la semana 24. El 80% de los pacientes provenían de fracaso a dos fármacos biológicos (incluyendo anti-TNF y antiintegrinas). Diez de los pacientes (9,4%) suspendieron tratamiento por no respuesta y 4 (3,7%) por efectos secundarios. Del total de la cohorte, 91 pacientes llegan a semana 24: 38 con respuesta clínica (41,7%) de ellos 21 pacientes (23%) consiguen remisión clínica libre de esteroides en la semana 24.
En la cohorte finlandesa de Eberl13 incluyeron 48 pacientes, de ellos 46 (96%) habían fracasado a un fármaco biológico previamente y 34 (71%) a 2 o 3 biológicos. El 73% llevaban tratamiento asociado (48% corticosteroides). La principal indicación de UST fueron no respondedores a tratamiento previo (90%). Otros motivos fueron por efectos secundarios a los tratamientos previos (30%) o ineficacia de inmunomoduladores (40%).
Cuarenta y dos pacientes llegan a la semana 16 con pauta de mantenimiento cada 8 semanas (69%) y cada 12 (31%). Se evaluó la actividad clínica y endoscópica en la semana 16 así como el «beneficio clínico» entendido como proporción de pacientes en remisión/respuesta. No se dispone de datos de HBI o endoscopia de todos los pacientes.
En la semana 16, el 63% de pacientes estaban en remisión clínica y del 55% al final del seguimiento. El beneficio clínico fue del 83% en semana 16 y 76% al final del seguimiento. El 88% consigue estar libre de esteroides.
En el seguimiento 8 pacientes suspenden tratamiento por falta de respuesta.
Valdés14 et al. incluyen 23 pacientes con fracaso a dos fármacos biológicos (sin especificar si eran anti-TNF o antiintegrina) evaluando la respuesta en semana 12 y 24 como disminución del valor medio del CDAI y HBI. Únicamente 11 pacientes llegan a la semana 24.
La cohorte belga de Lieffericckx15 incluye al inicio 163 pacientes. Se evaluaron los pacientes en la semana 8, 16 y 52. La actividad se evaluó mediante HBI y la bioquímica mediante PCR. Se incluyeron finalmente 152 pacientes (dentro de los excluidos son aquellos con HBI < 4). Todos los pacientes menos uno (por antecedente oncológico) habían recibido previamente anti-TNF, el 82% a 2 anti-TNF. Al inicio el 70% llevaban corticoides sistémicos y el 44,7% budesonida o similar.
En la semana 8 el 59,2% presentaban respuesta clínica incluyendo el 28,2% en remisión. Libres de esteroides fueron respectivamente 38,2% y 19,7%.
En la semana 16: 51,9% respuesta y 30,9% (30,9% RE) siendo libres de esteroides 45,4% y 26,9%. De los 62 pacientes sin respuesta clínica inicial (semana 8) el 24,2% la obtuvieron de manera tardía en la semana 16. Al año de seguimiento: respuesta 42,1% (25,7% RE) y sin esteroides 38,8% (24,3% RE). Se realizó un subanálisis de variables asociadas a respuesta y remisión al año de tratamiento siendo la única estadísticamente significativa la enfermedad colónica y el IMC bajo un factor de no remisión.
Además 17 pacientes (10%) precisaron cirugía durante el seguimiento por complicaciones relacionadas con la enfermedad siendo la indicación más frecuente (6 pacientes) la resección intestinal.
Santoni et al.16 incluyen 100 pacientes franceses desde 2014 a 2017 evaluando respuesta en la semana 8. El 74% consiguen RP y 50% RE.
Disponemos de la serie española de ENEIDA17. Se trata de un estudio retrospectivo multicéntrico que incluye 305 pacientes de 42 hospitales españoles participantes en el registro del Estudio Nacional en Enfermedad Inflamatoria Intestinal sobre Determinantes Genéticos y Ambientales (ENEIDA). Incluye pacientes con EC activa (HBI > 4 o actividad endoscópica asociada a PCR > 3mg/l y/o CF > 250 mcg/g) cuyas características basales se incluyen en la tabla 5. Se evaluó RE y RP en semanas 8 y 14. Se excluyen aquellos que no han recibido las dos primeras dosis de UST y aquellos cuya indicación era enfermedad perianal, prevención de recurrencia o afectación extraintestinal.
El 64% de los pacientes provenían de fracaso a 2 anti-TNF y el 29% de fallo a vedolizumab. El 36% asociaban corticoides en la inducción y el 40% inmunosupresores.
Para el análisis de resultados se consideran dos grupos de pacientes: 88 pacientes (28,8%) tenían un HBI ≤ 4. En ellos, la remisión se consiguió en 83 pacientes (94%) en semana 8 y en 80 pacientes (90%) en semana 14. Los 217 pacientes restantes (72%) tenían un HBI > 4. En ellos la remisión se consiguió en 101 pacientes (47%) en semana 8 y en 126 pacientes (58%) en semana 14.
De los 109 pacientes con corticoides iniciales, el 48% fueron libres de corticoides en semana 14 y de los 11 pacientes naïves a anti-TNF 9 consiguen remisión clínica.
Se consideran predictores de respuesta clínica en semana 14 la intolerancia a fármacos previos (21% de los pacientes) como un factor de buena respuesta mientras que el número de anti-TNF previos o la severidad en la endoscopia como malos predictores, de manera estadísticamente significativa.
Saman18 incluye 41 pacientes evaluando la respuesta clínica como descenso en 100 puntos del CDAI, descenso de deposiciones o mejoría clínica o por VGE. La remisión se consideró con CDAI < 150.
Tres pacientes fueron tratados con CDA < 150 por pérdida de respuesta a los tratamientos precios o intolerancia.
Se valoran dos grupos: uno con CDAI < 150 y enfermedad leve y en otro grupo EC moderada-severa. Aportamos los datos agrupados ambos en la tabla 5. De los 41 pacientes incluidos el 92,7% habían recibido previamente inmunomodulador y el 68,3% al menos un anti-TNF. Al inicio de UST el 36,6% llevaban corticoides concomitantes.
Catorce de los 41 (34,1%) fueron no respondedores y en 3 de los respondedores iniciales cambiaron a no respondedores por empeoramiento de la diarrea.
El 58,5% respondieron tras las 3 primeras dosis de UST: 34,1% del total con remisión y 24,4% respuesta. En el estudio se realizan varios análisis secundarios en función de los niveles de PCR, del fracaso previo a antiintegrinas y de los anti-TNF. Del total de pacientes que provenían de fracaso a anti-TNF (37), 17 eran no respondedores primarios, 10 de esos 17 (59%) respondieron a UST sin perder la respuesta. De los que provenían de pérdida de respuesta a anti TNF (20/37), 11 (55%) respondieron y 3 (15%) perdieron respuesta. El estudio concluye que el fallo primario a anti TNF no parece un factor predictor de mala respuesta a UST.
Analizan también qué pacientes hubiesen cumplido los criterios de inclusión de los ensayos clínicos fase II/III para UST no siendo aplicables en el 39% de los pacientes sobre todo por CDAI inferiores a 220 (sobre todo se asume que a este subgrupo de pacientes corresponde a aquellos con intolerancia o contraindicación a anti-TNF previos).
Biemans19 incluye 221 pacientes. Para valorar la efectividad solamente se contaron con pacientes con HBI > de 4.
El objetivo primario fue la remisión clínica libre de esteroides en la semana 52. Se consideró remisión clínica HBI < 4 y respuesta el descenso de 3 puntos del HBI respecto basal. Remisión biológica PCR < 5mg/l y CTF < 200mg/l.
El 97,7% de los pacientes habían recibido previamente inmunomoduladores y el 98,6% un anti-TNF (73,3% a dos anti-TNF). El 59,5% iniciaron UST en monoterapia. Sesenta y ocho pacientes presentaban HBI < 5 de ellos el 86,8% presentaban datos de actividad según biomarcadores, fístula, endoscopia o radiología. Estos pacientes no se incluyen en los datos de efectividad.
Datos de respuesta/remisión/remisión libre de esteroides respectivamente: semana 12 (47,7%/30,7%/24,2%), semana 24 (46,1%/ 40,1%/ 38,2%) y semana 52 (42,4%/ 39,4%/ 37,1%).
Respecto a factores clínicos asociados a remisión libre de esteroides, solamente el IMC < 18 aparece como factor de peor respuesta de manera estadísticamente significativa. Ser naïve a anti-TNF no parece un factor predictor de buena respuesta. Del total 46 pacientes precisan ingreso, 6 para inducción, 14 precisan cirugía de los cuales con datos de seguimiento 9 continúan tratamiento de los cuales 5 consiguen remisión libre de esteroides.
En la práctica clínica real el uso del CDAI suele ser poco aplicable y es probable que la VGE reproduzca mejor nuestra forma de actuar en la consulta. En nuestro caso, la VGE además de la anamnesis, incluía datos de exploración física y parámetros analíticos. De esta forma hemos conseguido una excelente correlación entra ambos índices (r = 0,898).
En los estudios publicados previamente no se han evaluado de forma estratificada los resultados en función del motivo de indicación de UST (fracaso primario, secundario o toxicidad), aspecto relevante ya que se trata de escenarios clínicos diferentes. De hecho este grupo de pacientes constituyen la población incluida en el UNITI-1 no habiéndose comunicado resultados específicos para cada uno de los grupos. En nuestra serie no se han identificado diferencias estadísticamente significativas estratificando los resultados por este motivo, sin embargo las tasas de respuesta y remisión en los pacientes que iniciaron UST por toxicidad a anti-TNF han sido superiores a las otras indicaciones (tabla 4).
Otro aspecto a destacar es que de los 6 pacientes intervenidos 4 reinician UST como prevención de la recurrencia posquirúrgica, en los otros dos se utilizó adalimumab teniendo en cuenta la historia natural de la enfermedad en cada paciente y la respuesta a anteriores tratamientos.
En cuanto a los efectos adversos, en el informe de posicionamiento del UST en EC no se describen reacciones anafilácticas. Describen riesgo de trombosis sin poder confirmar la causalidad. Los principales efectos adversos descritos fueron astenia y mialgias3.
Según los resultados de los estudios UNITI se han documentado 3 infecciones severas: una Listeria meningitidis y dos candidiasis esofágicas. Además un caso de tuberculosis pulmonar activa. En relación con las neoplasias se comunicaron un caso de mieloma múltiple y un adenocarcinoma metastático en intestino delgado en el grupo de UST y un carcinoma basocelular en el grupo placebo3,4.
En los estudios previos a la aprobación de UST ev. Khorrami describe efectos adversos en 11 pacientes (9,5%): destacan dos eventos coronarios y tres infecciones7. En la serie de Wils5 20 pacientes (16%) principalmente mialgias (3%), infecciones (7%) y precisando la retirada en 4 (una por reacción alérgica). En el seguimiento6 destacar la presencia de un adenocarcinoma anal.
En la cohorte de Ma8 se registraron 53 efectos adversos (31,1%) principalmente infecciones y artralgias. En la serie de Battat9, el 50% presentaron reacciones adversas menores y un 4,8% reacciones adversas mayores.
En los datos presentados de práctica clínica real mencionados anteriormente destacamos en los efectos adversos:
- -
Bar-Gil: 12 pacientes (11,3%) principalmente artralgias, debilidad y lesiones cutáneas12.
- -
Eberl: 4 casos; dos leves (rash, molestias bucales) y dos graves (absceso y posible reacción alérgica) en los que se retiró UST13.
- -
Lieffericckx: 11 pacientes (6,75%) incluyendo una suspensión por artralgias, una reacción alérgica y un aborto espontáneo15.
- -
Santoni: 11 pacientes (11%) y un paciente falleció a los 5 meses por efecto adverso grave16.
- -
Estudio ENEIDA: 38 pacientes (12%) la mayoría infecciones sistémicas o abscesos locales. Cuarenta pacientes precisaron ingreso (13%), 7 de ellos por reacciones adversas: dos por infecciones severas, tres por obstrucción, uno por un shock séptico abdominal y uno por absceso en el psoas17.
- -
Saman: dos pacientes (4,9%) artralgias y lesiones cutáneas18.
- -
Biemans: 118 pacientes (60%) en 8 se retira por efectos graves (4 artralgias, una reacción infusional, una vasculitis, cefalea severa y uno por infecciones recurrentes. Además 6 infecciones severas, 4 de ellas gastrointestinales19.
Entre las limitaciones de nuestro estudio cabe destacar que el número de pacientes que llegan a la semana 52 es todavía bajo y que una cohorte refractaria, que provienen de fracaso a dos o más fármacos anti-TNF. Por ello resultados actuales deben interpretarse en dicho contexto y pueden no ser extrapolables a cohortes de pacientes naïve a biológicos.
Aunque existen series más amplias de pacientes la mayoría incluye estudios multicéntricos, nuestro estudio incluye a todos los pacientes que iniciaron UST (prospectivo) con una homogeneidad en los criterios clínicos y en la posología aspecto que creemos relevante a la hora de interpretar los resultados. El análisis estratificado en función del motivo de inicio de UST ofrece una valoración más precisa de los distintos escenarios de la efectividad a los que nos enfrentamos en la práctica real.
Teniendo en cuenta los resultados de nuestra serie podemos concluir que UST es un fármaco eficaz en práctica clínica real con un buen perfil de seguridad y que los pacientes presentan tasas altas de remisión clínica en semana 16, 24 y 52 con independencia del orden de biológico utilizado. Además, consideramos que la estratificación de resultados en función del motivo de inicio puede ayudarnos a identificar escenarios en los que el fármaco sea más eficaz.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.