A pesar de la introducción de los inhibidores de la proteasa (IP) en el tratamiento de la hepatitis C, la sensibilidad al IFN continúa siendo fundamental para alcanzar la respuesta virológica (RVS) y erradicar la infección viral. En la actualidad, el interferón pegilado (IFNpeg) y la ribavirina (RBV) son necesarios para evitar la selección de mutantes resistentes a los IP. La probabilidad de obtener la RVS con biterapia en pacientes naives infectados con genotipo 1 varía entre el 40-50%. Es decir, en casi la mitad de este grupo de pacientes no sería preciso introducir un IP, evitando así los efectos adversos del mismo y disminuyendo considerablemente el coste del tratamiento. Identificar a estos potenciales respondedores a la doble terapia es uno de los mayores retos en la práctica clínica. La variabilidad genética del huésped constituye uno de los factores fundamentales en la sensibilidad al IFNpeg y, por tanto, en la respuesta al tratamiento actual. Otros factores basales relacionados con el huésped, con el virus y, sobre todo, los factores intratratamiento como la respuesta virológica rápida (RVR), se relacionan fuertemente con la probabilidad de alcanzar la RVS. La evidencia sobre la decisión de tratar con doble o triple terapia en función de los factores predictores de respuesta se basa en estudios retrospectivos o análisis posthoc de los estudios pivotales de los IP. El estudio de los polimorfismos del gen de IFNL3 (IL28B), ITPA, genes estimulados por IFN (ISG), TT/ΔG (ss469415590; IFNL4) y de transportadores de RBV son factores genéticos importantes que nos pueden ayudar a tomar la decisión de tratar con doble o triple terapia en pacientes naives.
Despite the introduction of protease inhibitors (PI) in the treatment of hepatitis C, the sensitivity of interferon continues to be essential to achieve a sustained virological response (SVR) and to eradicate the viral infection. Currently, pegylated interferon (PEG-IFN) and ribavirin (RBV) are required to avoid selection of PI-resistance mutations. The likelihood of obtaining an SVR with dual therapy in treatment-naïve patients with genotype 1 infection varies from 40% to 50%. That is, almost half of these patients would not require a PI, thus avoiding their adverse effects and considerably reducing the cost of the treatment. Identifying which patients could potentially respond to dual therapy is one of the main challenges in clinical practice. The genetic variability of the host is one of the main factors affecting the sensitivity of PEG-IFN and therefore in the response to current treatment. Other baseline factors related to the host, the virus and, especially, to intratreatment factors such as rapid virological response (RVR) are strongly associated with the probability of achieving an SVR. The evidence on the decision to prescribe dual or triple therapy according to the factors predictive of response is based on retrospective studies or post-hoc analyses of pivotal studies on PI. Study of the polymorphisms of the IFNL3 gene (IL28B), ITPA, IFN-stimulated genes (ISGs), TT/ΔG (ss469415590; IFNL4)) and RBV transporters could help in the decision to prescribe dual or triple therapy in treatment naïve patients.
Alrededor de 150 millones de personas en el mundo están infectadas por el virus de la hepatitis C (VHC). Aproximadamente el 20-30% de las personas que se infectan aclaran espontáneamente el virus. Sin embargo, la infección aguda por VHC suele ser asintomática por lo que su diagnóstico es difícil, evolucionando a la cronicidad en el 70-80% de los casos1. El interferon pegilado (IFNpeg) y ribavirina (RBV) ha sido el tratamiento recomendado para los pacientes con hepatitis crónica C (HCC) hasta el año 2011, alcanzando tasas de curación próximas al 50% en genotipos 1 y 4 del VHC y superiores al 70% en genotipos 2 y 32. El desarrollo de nuevas moléculas antivirales de acción directa (AAD) ha revolucionado el tratamiento de los pacientes genotipo 1 con tasas de respuesta virológica alrededor del 75%. Los primeros fármacos AAD en el mercado son los inhibidores de la proteasa (IP), boceprevir (BOC) y telaprevir (TVR)3,4. Tanto la eficacia de la biterapia (IFNpeg/RBV) como de la triple terapia (BOC o TVR + IFNpeg/RBV) está fuertemente influenciada por el efecto combinado de diversas variantes genéticas.
El análisis de una variación genética (polimorfismos de un único nucleótido, SNP) a lo largo de todo el genoma humano, con el objetivo de identificar su asociación con una enfermedad o con la respuesta al tratamiento empleado (estudio de asociación del genoma completo, GWAS), ha abierto un amplio campo en el estudio de diversas enfermedades, como en la infección del VHC. Estos SNP pueden ser usados como marcadores genéticos predictores de la respuesta al tratamiento antiviral.
Con respecto a la HCC, ha habido 2 grandes descubrimientos en la era GWAS: primero, la asociación entre polimorfismos de la interleuquina 28B (IL28B; llamado actualmente IFNL3) con el aclaramiento viral espontáneo del VHC y con la respuesta al tratamiento combinado (IFNpeg/RBV) en pacientes con genotipo 1; y segundo, la asociación entre las variantes de la inosinatrifosfatopirofosfatasa (ITPA) y la anemia hemolítica producida por la RBV.
Entre finales de 2009 y principios de 2010, 4 grupos de investigación5–8 identificaron una serie de SNP en el cromosoma 19 cerca de la región que codifica para el IFNL3, que predecían la respuesta al tratamiento combinado en pacientes con VHC genotipo 1, de manera que aquellos pacientes que portaban la variante de buena respuesta tenían aproximadamente 2 veces más probabilidad de alcanzar una respuesta virológica sostenida (RVS), aunque esta asociación era más evidente en unas razas que en otras (asiáticos>caucásicos>hispanos>afroamericanos). Este gen también se ha asociado con el aclaramiento viral espontaneo9–11, con la respuesta al tratamiento en pacientes coinfectados con VIH12, con la cinética viral13, con pacientes tratados después de trasplante hepático14,15, con genotipos virales no-116–19, con pacientes con distintos estadios de la enfermedad y con la transmisión vertical madre-hijo del VHC20,21. En la era de la triple terapia, también se ha encontrado asociación entre el gen del IFNL3 y la respuesta al tratamiento antiviral22–24, aunque la percepción es distinta, probablemente debido a la mayor tasa de RVS. En la era de los AAD, el IFNL3 está siendo utilizado como un marcador pretratamiento para tomar decisiones sobre qué estrategia seguir con los IP.
La asociación encontrada entre 2 variantes genómicas del gen ITPA y la anemia hemolítica producida por la RBV25, mediante análisis GWAS, ha sido muy útil para conocer qué pacientes tenían más riesgo de padecer anemia durante el tratamiento antiviral (tanto con biterapia como con triple terapia), pero su utilidad clínica realmente es desconocida y de momento es más una herramienta de investigación, siendo su interés escasoen la práctica clínica. Se sabe que durante el tratamiento con IP (BOC y TVR), se presenta una anemia más severa que con la biterapia3, llegando a ser una de las principales complicaciones en la triple terapia26.
En la biterapia (IFNpeg/RBV) han sido descritos otros genes como predictores de respuesta virológica, como son: genes estimulados por IFN (ISG), el polimorfismo TT/ΔG (ss469415590) (IFNL4) y genes relacionados con transportadores de la RBV. Sin embargo, en la era de la triple terapia estos son desconocidos.
La evidencia sobre la decisión de tratar con doble o triple terapia en función de los factores predictores de respuesta se basa en estudios retrospectivos o análisis posthoc de los estudios pivotales de los IP. Hasta el momento, solo se ha publicado un estudio prospectivo aleatorizado diseñado específicamente para investigar la respuesta con doble o triple terapia en pacientes con baja carga viral basal y respuesta virológica rápida (RVR, ARN indetectable a las 4 semanas de tratamiento de IFNpeg y RBV)27. Los polimorfismos del gen del IFNL3 y la RVR son los 2 factores predictivos que nos pueden ayudar a tomar la decisión de tratar con doble o triple terapia en pacientes naive.
En la presente revisión, tratamos de evaluar el papel que juegan todos estos genes en la era de la triple terapia.
Genotipado del IFNL3 en la era de la triple terapia del VHCIFNL3 y su valor predictivo de respuesta al interferón pegilado y ribavirinaEl IFNL3 que codifica para la IL28B es un miembro de la familia de los IFN-lambda o tipo III, cuyos genes se encuentran agrupados en un cluster en el brazo largo del cromosoma 19 (19q13). A su vez también codifican para la IL28A (IFNL2) e IL29 (IFNL1). Los IFN tipo III se inducen por mecanismos similares y probablemente sinérgicos con los IFN tipo I, como es el IFN-α, a través de la unión a sus receptores de membrana, que desencadenan la activación de las rutas de las JAK-STAT y de las MAP-cinasas, activando la expresión de los genes ISG e induciendo la respuesta antiviral, antiproliferativa, antitumoral e inmume28. Sus receptores de membrana se localizan en las células presentadoras de antígenos y contribuyen a la defensa del hospedador frente a virus hepatotrópicos como el VHC en humanos29. Como ya hemos comentado, a finales del año 2009 y principios del 2010, 4 grupos independientes publicaron los resultados de sus estudios GWAS, demostrando una fuerte asociación entre la variabilidad genética de la región que codifica el IFNL3 con la respuesta al tratamiento estándar de IFNpeg y RBV en pacientes con HCC genotipo 15–8. El polimorfismo rs12979860, localizado 3kb upstream del gen que codifica IFNL3, fue asociado con la respuesta al tratamiento, presentando los pacientes portadores del genotipo favorable o CC 2 veces más posibilidades de alcanzar la RVS que los que presentaban los genotipos desfavorables o no-CC, es decir, CT o TT.
En un primer estudio, Ge et al.7 demostraron la asociación entre el polimorfismo del IFNL3 y la RVS en una cohorte de 1.671 pacientes del estudio Individualized Dosing to Assess Optimal Pegylated Interferon Therapy (IDEAL) de diferentes orígenes étnicos7. En todos los grupos de población se demostró una fuerte asociación entre los genotipos CC y la RVS, definida como niveles de ARN viral indetectable a las 24 semanas postratamiento, independientemente de otros factores como la carga viral basal, fibrosis basal y origen étnico. Las diferencias existentes entre las poblaciones geográficas y las tasas de RVS al tratamiento estándar se podrían explicar por las diferencias en la frecuencia de aparición del alelo C, siendo mayor en los de origen asiático, seguido por los caucásicos, hispanos y finalmente afroamericanos7,9. Esto revelaría que las poblaciones de Asia del este, con mayor frecuencia de aparición del genotipo CC, presentan las mayores tasas de RVS. Por el contrario, las poblaciones de origen africano, con menor frecuencia de aparición del genotipo favorable CC, son los que peor responden al tratamiento frente al VHC. Mediante un modelo de regresión logística, relacionando todos los predictores clínicos con la tasa de RVS, el genotipo CC del rs12979860 resultó ser el mejor factor predictivo de respuesta, siendo esto corroborado en estudios posteriores30. Este genotipo favorable también se asoció con una mayor tasa de aclaramiento viral espontáneo del VHC7. De este modo, los pacientes genotipo CC presentan 3 veces más posibilidad de aclarar espontáneamente el virus que el no-CC, independientemente del origen étnico de la población9.
Todos estos resultados fueron confirmados por otros estudios GWAS realizados por otros grupos. En los trabajos de Tanakaet al.5, Suppiahet al.6 y Rauchet al.8 se identificó la variante rs8099917, localizado 8kb upstream del gen que codifica IFNL3, y su asociación con la RVS y el aclaramiento viral espontáneo en cohortes japonesas, australiano-europeas y caucásicas. El alelo G del SNP rs8099917 está asociado con la respuesta al tratamiento con IFNpeg y RBV en pacientes con HCC genotipo 1 como alelo predictivo de no respuesta5,8. Tanaka et al.5 demostraron que el genotipo homozigoto para el alelo G se encontraba únicamente en el grupo de no respuesta virológica (NRV). Así, en un modelo de regresión logística, el factor más significativo para predecir la NRV fue el alelo G en rs8099917 seguido por el género5. Por otro lado, los portadores del alelo G presentaban menor expresión de los genes IFNL2/3, afectando el alelo desfavorable a la expresión génica de los IFN-lambda tipo III y disminuyendo sus niveles de ARNm en células mononucleares de sangre periférica, hecho verificado en individuos sanos portadores del rs80999175,6,9,31. Por último, el alelo G se asoció con un incremento del riesgo de cronificación del VHC, efecto que es similar en una cohorte de pacientes monoinfectados o coinfectados con VIH, independientemente del genotipo del VHC8.
En un principio, los estudios GWAS de asociación de los SNP rs12979860 y rs8099917 con la respuesta al tratamiento y al aclaramiento viral espontáneo fueron determinados en poblaciones de pacientes con HCC infectados por VHC genotipo 1, que tienen menores tasas de RVS. Para analizar la asociación de los polimorfismos del IFNL3 con el genotipo viral, las poblaciones analizadas fueron estratificadas en varios estudios en 2 grupos, aquellos que presentaban los genotipos 1 o 4, considerados los más difíciles de tratar, y los que presentaban los genotipos 2 o 3, con mayores tasas de RVS31. Los resultados mostraron que no existe una asociación significativa entre el SNP rs12979860 y la respuesta al tratamiento en los individuos infectados por los genotipos 2 o 3, lo que indicaría que el valor predictivo de respuesta del polimorfismo está delimitado en aquellos individuos infectados por genotipo 1 o 4. En cambio, en un estudio italiano se observó que el SNP rs12979860 se asociaba con la RVS en pacientes con genotipo 2 o 3, aunque solo en los que tenían una RVR19. En la mayoría de los estudios se ha observado una clara relación entre el genotipo del IFNL3 y la RVR13,19,32. En los diferentes modelos de regresión logística la RVR resulta ser un fuerte predictor durante el tratamiento de RVS independientemente del tipo de genotipo del IFNL3 en pacientes infectados por genotipo 1. Los portadores del alelo favorable C del rs12979860 presentan un descenso mayor de la carga viral y mayor probabilidad de alcanzar la RVR; mientras que los pacientes sin RVR y genotipo CC presentan mayor probabilidad de alcanzar la RVS que los no-CC. Es evidente que los pacientes con genotipo 1 del VHC y RVR tienen mayor probabilidad de alcanzar la RVS independientemente del IFNL313. En los pacientes infectados por genotipo 2/3 que no alcanzan la RVR, el polimorfismo del IFNL3 está asociado con la RVS; mientras que los que tienen RVR, el IFNL3 no se asocia con la RVS31. Por tanto, el valor predictivo de RVS al tratamiento estándar del rs12979860 tiene más relevancia en los pacientes difíciles de tratar, es decir, aquellos infectados por genotipo 1 o 4 sin RVR.
El mecanismo por el cual los polimorfismos del IFNL3 influyen en el descenso de la carga viral y en la respuesta al tratamiento sigue siendo incierto. Tanto en estudios in vitro como in vivo se ha observado la actividad antiviral de los IFN tipo III, sin embargo, se ha comprobado in vitro que el IFN-lambda induce una menor expresión de los genes ISG comparado con el IFN-α33. Estos resultados podrían revelar la importancia de los IFN-lambda en la infección por VHC, pero no explican la asociación de los polimorfismos identificados en el locus de la IFNL3 y su asociación con la respuesta al tratamiento y el aclaramiento viral espontáneo del VHC. Los SNP rs12979860 y rs8099917, se encuentran separados por 4.378 bases, en fuerte desequilibrio de ligamiento34,35 y a 3Kb y 8Kb upstream respectivamente del gen que codifica el IFNL3. Independientemente de estos SNP, puede posteriormente codificar una proteína funcional, es más, se ha observado una fuerte asociación entre estos polimorfismos con patrones de expresión intrahepática de los genes ISG36,37. Los bajos niveles de expresión hepática de los genes IGS han sido asociados fuertemente con la respuesta al tratamiento de IFNpeg y RBV. El genotipo favorable del IFNL3 se correlaciona con bajos niveles de expresión intrahepática de ISG, lo que podría explicar su asociación con la RVS.
IFNL3 y su valor predictivo de respuesta en la triple terapiaEl valor predictivo de respuesta del IFNL3 a la doble terapia de IFNpeg/RBV ha permitido el desarrollo de guías prácticas para identificar precozmente aquellos pacientes que presentan una predisposición genética para alcanzar la RVS y también acortar la duración del tratamiento, principalmente en los pacientes con genotipo 1 o 4. En el año 2011 se incorporó al tratamiento del VHC la primera generación de IP, BOC y TVR, en combinación con el IFNpeg/RBV en los pacientes con HCC genotipo 1. Estos IP pueden atenuar el valor predictivo del IFNL3, debido a su potente efecto directo antiviral. Por otro lado, el IFNpeg y la RBV continúan siendo imprescindibles para evitar la selección de mutantes resistentes al BOC y TVR y para alcanzar la erradicación viral. Numerosos estudios retrospectivos han analizado la importancia del genotipado del IFNL3 y la respuesta al tratamiento de triple terapia. En el caso del BOC, en el estudio SPRINT-23, en pacientes con HCC genotipo 1 naive, los portadores del genotipo CC del rs12979860 alcanzaron tasas de RVS similares a la doble terapia (82 vs. 78%). En cambio, en los portadores no-CC sí se demostraron diferencias importantes. De este modo los pacientes con genotipo CT alcanzaron tasas de RVS del 71% con triple terapia (BOC) frente al 28% con la doble terapia. Asimismo, entre los pacientes con genotipo TT, las tasas de RVS fueron del 59% con triple terapia (BOC) frente al 27% con IFNpeg/RBV. Los factores predictivos de RVS para los pacientes naive que van a ser tratados con BOC son baja carga viral (< 400.000UI/mL), IFNL3 rs12979860 CC vs. no-CC, ausencia de cirrosis, subtipo 1b y raza no-negra38. Estos pacientes podrían ser seleccionados como candidatos para acortar la duración del tratamiento. Por otro lado, en el estudio RESPOND-23 (BOC en no respondedores a un tratamiento previo de IFNpeg/RBV), se demostró que la utilización del genotipado del IFNL3 no era un factor predictivo de RVS. En resumen, en pacientes naive tratados con BOC la tasa de RVS en pacientes con genotipo CC del IFNL3 es parecida a la doble terapia.
Respecto al TVR, en el estudio ADVANCE4, pacientes con HCC genotipo 1 naive sometidos a triple terapia, el grupo con TVR presentó una tasa más alta de RVS tanto en pacientes CC como no-CC. Es decir, en cualquier situación es más efectivo tratar con triple terapia-TVR que con doble terapia. Por otro lado, la determinación del genotipo del IFNL3 podría ser útil en los pacientes que no alcanzaron la RVRe (respuesta virológica rápida extendida, ARN indetectable a las 4 y 12 semanas de tratamiento). En los pacientes CC que no presentaron una RVRe, la RVS fue del 67% frente al 38% de los no-CC. El estudio PROVE339 participaron pacientes con HCC genotipo 1 previamente tratados con IFNpeg y RBV, sometidos a 2 brazos de tratamiento, T12+PR24 (un total de 24 semanas de tratamiento) y T24+PR48 (un total de 48 semanas de tratamiento), con tasas de RVS de 51 y 53% respectivamente. La RVS fue mayor en los pacientes respondedores recidivantes que en los no respondedores. En un subanálisis retrospectivo del estudio PROVE-240, TVR en pacientes naive con HCC genotipo 1 no cirróticos, el 100% de los pacientes CC sometidos a 12 semanas de triple terapia alcanzaron la RVS y el 94% de los pacientes CC sometidos a 12 semanas de triple terapia más 12 semanas adicionales de doble terapia también alcanzaron la RVS, manifestando de nuevo la posibilidad de acortar el tratamiento en estos pacientes. Para evaluar la eficacia y seguridad de un régimen de triple terapia con TVR de menor duración, el estudio CONCISE ha demostrado que los pacientes genotipo CC naive y recaedores presentaban una tasa de RVS (12 semanas después de finalizar el tratamiento) del 87% si eran tratados durante 12 semanas frente al 97% si eran tratados durante 24 semanas; aunque los resultados son similares, la tasa de RVS es algo superior en el tratamiento más prolongado41. En los pacientes CC, la RVS no cambia según el grado de fibrosis hepática. Por el contrario, en los no-CC se ha demostrado que la tasa de RVS es mayor en los pacientes con fibrosis F0-F2 que los F3-F442. En un subanálisis del estudio REALIZE43, se estudia el impacto de la IFNL3 en pacientes tratados con TVR que habían fracasado a la doble terapia, es decir, recaedores, respondedores parciales o nulos: solo en los casos de respuesta previa nula, los pacientes CC presentaron mayores tasas de RVS que los no-CC. Estos resultados sugieren que en pacientes previamente tratados, el genotipado del IFNL3 tiene un impacto predictivo de RVS limitado. Es evidente que los resultados del IFNL3 no son determinantes en la triple terapia, como concluye la reciente guía europea44 que indica que el genotipaje del IFNL3 no es un prerrequisito para tratar a la hepatitis C (recomendación B2).
La respuesta virológica rápida: factor clave para predecir la respuestaLos pacientes que presentan indetectabilidad de la carga viral tras 4 semanas de tratamiento con IFNpeg/RBV tienen elevadas tasas de RVS, superponibles a las que se obtienen con triple terapia3,4,45. En un reciente metaanálisis que incluye más de 13.000 pacientes genotipo 1 tratados con biterapia se obtiene una RVR en el 19,6%46. En este grupo de pacientes, cuando la carga viral basal es baja (≤400.000UI/ml), la RVS es similar en los tratados durante 24 o 48 semanas47.
La coexistencia en un mismo paciente de varios factores favorables de respuesta puede aumentar el éxito del tratamiento. Así, Andriulliet al.48 estudian retrospectivamente más de 1.000 pacientes tratados con IFNpeg/RBV, comparando 2 estrategias alternativas para predecir la respuesta al tratamiento: en la primera, evaluaron solo variables basales asociadas con la RVS y en la segunda también incluyeron la RVR. El objetivo del estudio es identificar a los pacientes con una probabilidad de alcanzar RVS similar a la que se obtendría con triple terapia, y que estiman en un 80% en función de estas variables predictoras. Con la primera estrategia, se relacionaron de forma independiente la RVS con el genotipo CC del IFNL3, la viremia baja (<400.000UI/ml), la fibrosis F0-F2 y la ausencia de diabetes tipo II. Aunque la coexistencia de 3 variables podría anticipar una probabilidad de RVS >80%, esto sólo ocurría en un 6,3% de los pacientes. Al incluir en el análisis la variable de RVR, hasta en un 19,1% de los casos se podía prever una probabilidad de RVS>80%: al presentar un mismo paciente RVR y otro factor predictor de RVS, carga viral basal baja y/o genotipo IFNL3 CC. Por tanto, los autores recomiendan iniciar el tratamiento con doble terapia en todos los pacientes naive, continuando con dicha pauta en aquellos casos con RVR y otro factor predictivo favorable48.
Esta misma estrategia terapéutica ha sido explorada en el único estudio publicado que evalúa de forma prospectiva la decisión de elección de doble o triple terapia en función de los factores predictivos de respuesta. Se incluyeron prospectivamente 233 pacientes naive no cirróticos con HCC genotipo 1 y carga viral basal baja (considerando el límite<600.000UI/ml). El 48% presentaron RVR, siendo entonces aleatorizados para continuar con biterapia 20 semanas más (24 semanas de tratamiento total) o triple terapia con BOC durante 24 semanas (duración total del tratamiento 28 semanas). Tras finalizar el periodo de seguimiento no encontraron diferencias estadísticamente significativas en las tasas de RVS obtenidas en ambos grupos (88 vs. 90%, respectivamente). Los resultados de este estudio confirman el valor predictivo de respuesta de la RVR en pacientes con baja carga viral basal27. En cualquier caso, no podemos generalizar estos resultados a pacientes con otras características, como carga viral basal alta, cirróticos o que reciban tratamiento con TVR, por lo que se precisan más estudios que incluyan mayor número de pacientes con estas características.
Como resumen, en la era de los nuevos fármacos antivirales para el tratamiento de la HCC, la doble terapia con IFNpeg/RBV puede ser una opción adecuada en un grupo de pacientes naive con genotipo 1, siempre que se pueda prever una eficacia similar a la de la triple terapia, evitando así efectos adversos y costes innecesarios de los IP. El estudio de los polimorfismos del IFNL3 representa una valiosa herramienta para la valoración basal de los pacientes naive, aunque insuficiente para poder identificar los potenciales candidatos a ser tratados con biterapia. La combinación con otros factores basales, pero sobre todo RVR al tratamiento, es fundamental para elegir con seguridad la mejor estrategia terapéutica. Son necesarios estudios que evalúen de forma prospectiva los distintos esquemas de tratamiento en función de los factores predictivos de respuesta para poder elegir la mejor opción terapéutica.
ITPA: anemia y variabilidad genética en pacientes con hepatitis crónica CLa enzima ITPA está compuesta por 194 aminoácidos y ejerce su acción a nivel del citosol intracelular, formando parte de un complejo mecanismo cuya actividad ITPasa desarrolla un papel fundamental de equilibrio entre el anabolismo y catabolismo de las bases púricas (derivadas de la estructura de la pirimidina). La timina y la citosinason sintetizadas y degradadas fundamentalmente en el hígado, como metabolito final se forma el ácido úrico que es insoluble y se excreta a través de la orina.
La variabilidad genética de la ITPA se ha identificado como un factor esencial regulador de la anemia producida por la RBV en pacientes con VHC26. Concretamente, las variantes genéticas de ITPA, cuyo gen está localizado en el cromosoma 20 (región 20p13), permiten que una deficiencia o una baja actividad de la enzima ITPA tengan un enorme impacto sobre la protección frente a la anemia hemolítica inducida por RBV y en consecuencia lareducción de la dosis de RBV durante el tratamientosea menor49.
La RBV es un componente principal de los tratamientos antivirales disponibles para la HCC y el mantenimiento de la dosis durante el tratamiento es determinante para alcanzar la RVS. En los estudios de hepatitis C se considera anemia cuando los valores de hemoglobina (Hb) son menores de 10g/dL. La anemia esuno de los principales efectos adversos que pueden aparecer tanto con la doble como con la triple terapia. El mecanismo en pacientes tratados con doble terapia se basa fundamentalmente en el carácter hemolítico de la RBV. Esta reduce los niveles de ATP en los eritrocitos humanos por depleción de GTP y permite la inhibición del metabolismo oxidativo dependiente de ATP50,51, actuando sobre la membrana eritrocitaria. A veces y en menor medida la anemia se origina por la disminución de la hematopoyesis de la médula ósea inducida por el IFN52. Sin embargo, el mecanismo de generación de anemia con la triple terapia es aún desconocido53.
La predicción de la anemia y su impacto en los resultados es el mayor desafío clínico en el tratamiento de la HCC, ya que su aparición durante el mismo puede deteriorar seriamente la calidad de vida del paciente durante el tratamiento. A pesar de que la inclusión de los AAD representan hoy en día el tratamiento estándar en pacientes con genotipo 1, el IFNpeg/RBV sigue siendo el único tratamiento disponible en muchas partes del mundo, incluyendo a los pacientes con genotipo 2 y 354. La primera línea de actuación en los pacientes que presentan anemia es la disminución de los niveles de RBV53,55,56. Varios son los factores predictivos tanto clínicos como demográficos que se han asociado con el incremento del riesgo de padecer anemia en pacientes tratados con doble o triple terapia: edad, sexo, índice de masa corporal, uso de estatinas, niveles basales de Hb, estado de la enfermedad, disfunción renal, dosis de RBV y polimorfismos de la ITPA57–59.
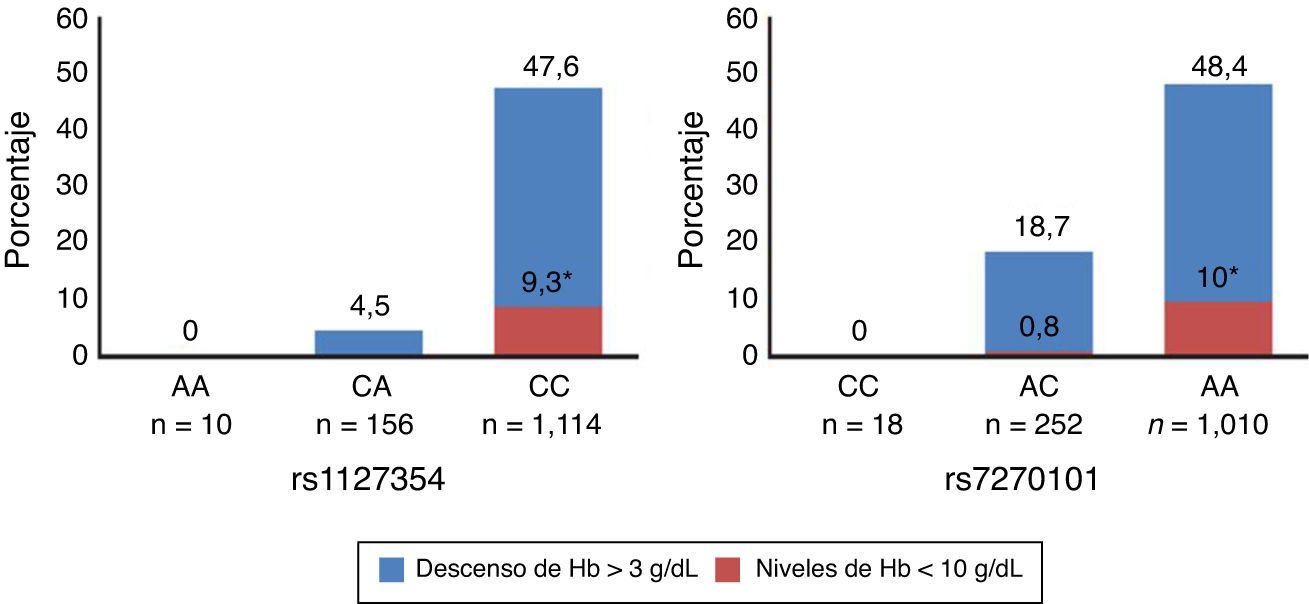
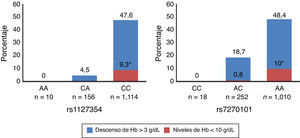
En 2010 se realizó un estudio GWAS25 en 1.602 pacientes infectados con VHC-genotipo 1. En un principio estaba enfocado a la cuantificación entre los niveles basales de Hb hasta la semana 4 de tratamiento, debido a que este suele ser el momento de la administración de eritropoyetina (EPO) para estimular la producción de glóbulos rojos. Se identificaron varios SNP en el cromosoma 20 (20p13), que se encuentran asociados con la anemia inducida por el tratamiento en pacientes que habían cumplido >80% del tratamiento con IFNpeg/RBV. En individuos europeos y americanos se detectó una fuerte asociación estadística del SNP rs6051702 con la anemia a la semana 4 (p<1,1×10−45), observándose la misma tendencia en afroamericanos e hispanos aunque con una significación menor. Cuando se genotiparon las variantes funcionales conocidas del gen de la ITPA (rs1127354 y la rs7270101), que hacen que disminuya la actividad de esta enzima, encontraron que también son las responsables de la protección frente a la anemia hemolítica inducida por la RBV. Pacientes infectados con genotipo CC en rs1127354 eran más propensos a desarrollar anemia que aquellos con CA o AA durante la terapia combinada, y el descenso de Hb era mayor en pacientes con genotipo AA que con AC o CCen el SNP rs7270101 (fig. 1 adaptada de25).
La deficiencia de ITPA protege contra el descenso de la concentración de Hb inducida por el tratamiento antiviral del VHC. Se representa el porcentaje de sujetos tratados, que han presentado un descenso de Hb >3g/dL o concentraciones<10g/dL a la semana 4 del tratamiento para las 2 variantes que disminuyen la función del ITPA (rs1127354 y rs7270101). Adaptada de Fellayet al.25.
Esto además de tener un gran valor en el diagnóstico farmacogenético, abre las puertas a un posible estudio sobre la biología celular de los glóbulos rojos y a todos los procesos que gobiernan su lisis25.
Scherzeret al.60 recogen los datos de pacientes de varios ensayos austriacos, confirmando de nuevo la relación entre los polimorfismos de la ITPA y la inducción o protección frente a la anemia en la semana 4 de tratamiento debido al efecto de la RBV en función del sexo. En una cohorte de 308 pacientes con genotipo 1 estudiaron los SNP rs6051702 (AA, AC y CC), rs1127354 (CC, AC y CC) y el rs7270101 (AA y AC y CC)60. También estudiaron los polimorfismos del IFNL3 rs12979860 (CC y TC y TT). No encontraron diferencias significativas en ninguno de los alelos respecto a la Hb basal, pero al estratificar por sexos observaron que los niveles de las mujeres eran más bajos que los de los hombres, independientemente de su genotipo. Además, en las mujeres era menor entre las premenopaúsicas que en las posmenopáusicas (p<0,001), aunque lo lógico fuera esperar lo contrario. A las 4 semanas de tratamiento la Hb disminuyó de forma drástica y estadísticamente significativa y el descenso fue mayor en aquellos pacientes que presentaban homozigosis del alelo mayoritario en comparación con los minoritarios. Además el descenso fue mayor en hombres que en mujeres (p<0,001), como consecuencia de ello fue necesario reducir más la dosis de RBV o bien utilizar EPO. En el análisis multivariante determinaron que las mutaciones de ITPA eran un factor independiente relacionado con la disminución de Hb en la población total, no ocurriendo así al separar por género o por menopausia. Por tanto, aquellas mujeres premenopaúsicas, que además posean un alelo minoritario de la ITPA, parecen estar protegidas frente a la anemia durante las 4 primeras semanas del tratamiento con IFNpeg/RBV60.
También existen estudios de doble terapia relacionados con los polimorfismos de la ITPA en pacientes con genotipo 2 y 3. Thompson et al.51 genotiparon el rs1127354 y rs7270101 y demostraron que la deficiencia en la actividad ITPasa está independientemente asociada con la reducción cuantitativa de la Hb a la semana 4 de tratamiento, no observando esta asociación en los valores basales y, por tanto, siendo protectora nuevamente frente a la anemia. Como los pacientes toleraron mejor las dosis de RBV, tanto si tenían una actividad ITPasa normal o deficiente, no queda claro el potencial clínico del genotipaje de la ITPA para pacientes con genotipo 2 y 3. Sería interesante la determinación de estos SNP en aquellos individuos en los cuales a priori sea conocido el hecho de tener un alto riesgo de padecer anemia según sus antecedentes clínicos, como es el caso de la insuficiencia renal crónica o las hemoglobinopatías51. Seto et al.61 realizaron el mismo tipo de estudio incluyendo tanto los genotipos de ITPA como los del IFNL3 en una población de 60 pacientes con HCC genotipo 6 llegando a las mismas conclusiones.
Respecto al tratamiento de pacientes con HCC con la triple terapia no existe aún una bibliografía amplia respecto a la genética de la ITPA. Sí es conocido que la anemia es el efecto adverso más común cuando el paciente es tratado con TVR y BOC. Y además tiene una mayor incidencia que con la doble terapia administrada de forma tradicional. A pesar de que la disponibilidad de los IP ha cambiado profundamente el tratamiento de la HCC, los efectos adversos son mucho más frecuentes que con la doble terapia.
Suzuki et al.62 estudiaron a 61 pacientes tratados con TVR. De ellos, 49 tenían genotipo CC al que denominan RBV-sensible y los otros 12 eran no-CC (CA/AA) o RBV-resistente. La dosis de RBV tuvo que ser reducida en mayor cantidad en pacientes con genotipo CC que en los no-CC. En ambos grupos de pacientes las mayores diferencias de valores de Hb se observaron en la semana 4 de tratamiento. Finalmente concluyen que los polimorfismos de la ITPA influyen sobre los niveles de Hb durante la triple terapia, y concretamente en las primeras 12 semanas en las que se les administra el TVR, durante las cuales los niveles de Hb podían alcanzar hasta valores de 4g/dL, aunque estos valores se incrementaban una vez terminado el tratamiento. Por tanto, la triple terapia se puede aplicar con una alta eficacia mediante un control estricto de la Hb y la modificación puntual de las dosis de RBV.
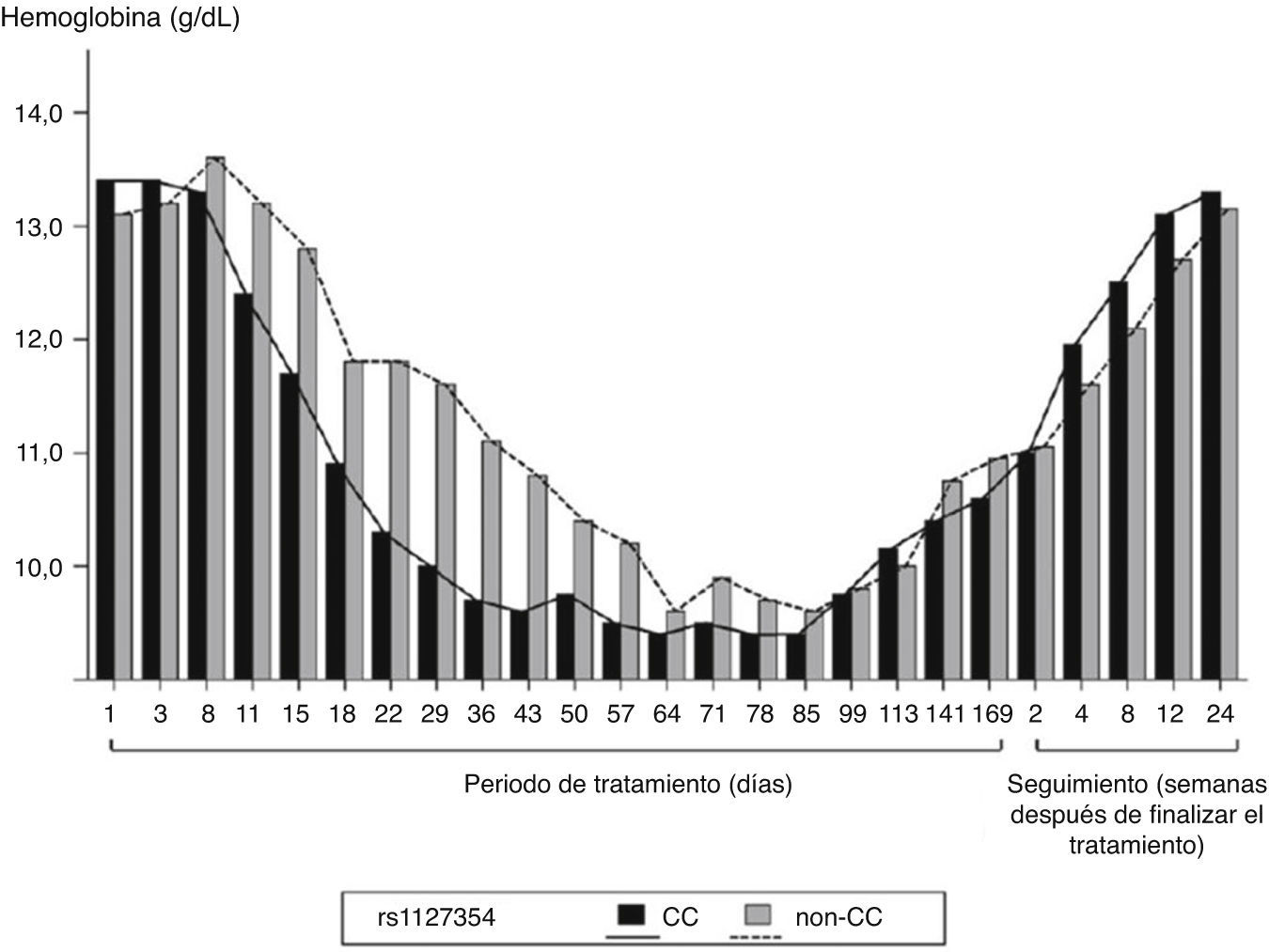
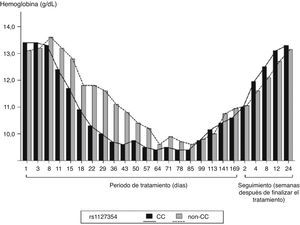
Otro estudio con resultados similares fue el realizado por Chayamaet al.63. Incluyeron a 94 pacientes tratados con IFNpeg-α-2b/RBV y TVR. La triple terapia también generó pérdida de Hb en todos los pacientes, pero el patrón fue diferente según el genotipo de ITPA rs1127354. Aquellos que eran CC presentaron un mayor descenso de Hb que los que eran no-CC, al finalizar el tratamiento los niveles de Hb volvieron a los valores normales (fig. 2, adaptada de63).
Cambios en los niveles de Hb en función del polimorfismo de ITPA durante la triple terapia. Adaptado de Chayama et al.63.
No obstante, el tiempo de reducción de RBV fue menor en los pacientes CC que en los no-CC: 18 días frente a 29 días, respectivamente. También estudiaron la RVS en función del genotipo rs1127354, pero la RVS no estaba asociaba a este polimorfismo y tampoco se ve afectada por la reducción de la dosis de RBV, confirmando de nuevo que los polimorfismos de ITPA predicen la anemia inducida por la RBV pero no están asociados con la RVS63.
Ogawaet al.64 basaron su trabajo en 292 pacientes infectados con VHC-genotipo 1, que habían sido tratados con TVR, para evaluar la predicción de la anemia severa en esta población. Entre los diversos factores incluidos en el análisis, los niveles de Hb basales y el genotipo CC (rs1127354) de la ITPA estaban asociados independientemente con una anemia severa. El desarrollo más grave de la anemia comenzaba a las 3 semanas de tratamiento presentando un pico a la semana 12. En concordancia con otros trabajos, el 40% de los pacientes presentaron también anemia severa y se correspondían con los pacientes que tenían genotipo CC de la ITPA, los cuales además sufrieron mayores descensos de Hb que aquellos con genotipo CA/AA (el 17% presentó anemia severa). No obstante, este grupo plantea la idea de que este tipo de anemia no se debe tanto a la dosis de RBV sino al TVR, por lo que proponen un número mayor de estudios que puedan aclarar la relación entre los resultados del tratamiento y la adherencia del TVR.
Recientemente, se ha publicado un estudio aleatorizado japonés condos grupos de 60 pacientes controlados por edad, sexo y otros antecedentes. A cada grupo se les administró una dosis diferente de TVR. En un caso fue de 2.250mg/día y en el otro de 1.500mg/día. Las tasas de RVS fueron similares, sin embargo, los niveles de Hb disminuyeron en mayor medida en los pacientes tratados con 2.250mg/día65. Este estudio podría corroborar en parte, la idea inicial de Ogawaet al.64, que relaciona la dosis de TVR suministrada con la anemia.
Otros marcadores genéticosGenes estimulados por IFN (ISG)En el año 2005 Chenet al.66 encontraron que en los pacientes que no respondían al tratamiento con IFNpeg/RBV tenían una sobreexpresión de un grupo de 18 genes ISG antes de comenzar el tratamiento antiviral, concluyendo que la preactivación de estos genes limitaba el efecto del IFN durante el tratamiento antiviral, siendo considerados como un grupo de genes predictores de respuesta. Posteriormente, se ha intentado asociar el efecto de los ISG con el IFNL3, encontrando resultados discordantes37,67,68. Así, Honda et al.37 en 91 pacientes, demuestran una fuerte asociación entre los polimorfismos del IFNL3 y la expresión de genes ISG, de manera que los pacientes con genotipo CT/TT del IFNL3 presentaban una sobreexpresión de ISG antes de comenzar el tratamiento que no se observaba en los pacientes CC. Sin embargo, López-Rodríguez et al.68 genotiparon un total de 63 SNP de IPG y ISG en 285 pacientes tratados con IFNpeg/RBV.Encontraron 2 polimorfismos de ISG-OASL rs12819210 (odds ratio [OR]=2,1, p=0,03) eI FIT1 rs304478 (OR=2,5, p=0,01), que se asociaban con la RVS, siendo el efecto de estos genes independiente del IFNL3. Sin embargo, observanun fuerte sinergia entre ellos, particularmente en pacientes con peor pronóstico de respuesta virológica68.
Polimorfismo TT/ΔG (ss469415590)Muy recientemente, se ha identificado un nuevo marcador genético relacionado con el aclaramiento viral espontáneo y la respuesta al tratamiento antiviral: el polimorfismo TT/ΔG (ss469415590)69. Este SNP crea un nuevo marcador genético dentro de los IFN-lambda denominado IFN-lambda4 (IFNL4). Se ha visto, tanto en pacientes afroamericanos como caucásicos, que este es el mejor predictor de aclaramiento viral y de RVS, más que el SNP rs12979860 del IFNL370,71. También en pacientes coinfectados (VHC/VIH) se ha asociado este SNP con la RVS72. Sin embargo, en un estudio realizado con 206 pacientes coinfectados, comparándolos con un grupo de 162 pacientes monoinfectados VHC, este SNP solo se asociaba con la respuesta al tratamiento antiviral en los pacientes monoinfectados73.
Recientemente, Fujinoet al.74 estudian el papel que juega el IFNL4 (ss469415590) en la respuesta al tratamiento con TVR/IFNpeg/RBV en pacientes japoneses genotipo 1, mayores de 65 años (n=87). Concluyen que dicho SNP es un marcador genético predictivo de respuesta en los de mayor edad, de manera que los pacientes con genotipo TT/TT presentaban el doble de tasa de respuesta virológica que los pacientes con genotipo TT/ΔG o ΔG/ΔG (82 y 43%, respectivamente).
Transportadores de ribavirinaLa RBV juega un papel fundamental en la triple terapia, de ahí que aquellos genes relacionados con su actividad antiviral sean objeto de estudio en esta revisión. Se sabe que la RBV es transportada al interior celular por medio de una serie de transportadores de nucleósidos tales como ENT1, ENT2, CNT2 y CNT3. Estudios recientes han encontrado una asociación entre la anemia inducida por este fármaco, la respuesta al tratamiento antiviral y los polimorfismos genéticos de determinados trasportadores de nucleósidos, como el CNT2 y CNT3. Así, D’avolio et al.75 analizaron diferentes variantes genómicas de CNT2 (SLC28A2) en 115 pacientes con HCC tratados con IFNpeg/RBV, demostrando que el SNP rs11854484 (de la región codificante de este gen) era el mejor factor predictivo de RVS. Este mismo grupo de investigación, en el año 201376, hace un estudio más amplio analizando los siguientes polimorfismos: SLC28A2rs11854484, SLC28A3 rs56350726, y SLC28A3 rs10868138. Concluyen que los pacientes con el genotipo TT de SLC28A2 rs11854484 tenían mayores niveles de RBV en suero que aquellos que presentaban el genotipo TC o TT (p=0,02 y p=0,06 en semana 4 y 8, respectivamente). También observaron que SLC28A3 rs56350726 se asociaba con la RVS en los pacientes genotipo 1 (RR=2,2; 95% CI 1,1-4,3). Otro transportador asociado con la respuesta al tratamiento ha sido el ENT1 (SLC29A1) rs693234577, que mediante análisis multivariante fue un factor independiente predictivo de respuesta a la biterapia (p=0,030, OR=1,85).
La importancia de todos estos genes, ampliamente estudiados en la terapia con IFNpeg/RBV, no es tan relevante como factores predictivos de respuesta a la triple terapia. No obstante, ayudarán a tomar decisiones clínicas sobre qué estrategia a seguir con los distintos AAD, con el consiguiente avance en los tratamientos personalizados de la HCC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.