Los agentes anti-factor de necrosis tumoral (anti-TNF) son fármacos de uso común en los pacientes con enfermedad inflamatoria crónica intestinal (EICI) y han demostrado ser efectivos en inducción y mantenimiento en enfermedad de Crohn y colitis ulcerosa, así como en pacientes con afectación fistulizante perianal. Sin embargo, la evidencia relativa al uso de estos fármacos en otros escenarios dentro de EICI es menos sólida. Es el caso de la enfermedad de Crohn con afectación estenosante, penetrante o perianal no fistulizante, de las manifestaciones extraintestinales de la EICI y de las complicaciones del reservorio ileoanal. El objetivo de esta revisión fue realizar un análisis de la literatura disponible y determinar el papel de los anti-TNF en la práctica clínica en pacientes afectos por estas complicaciones.
Anti-tumor necrosis factor agents (anti-TNF) drugs are commonly used in patients with inflammatory bowel disease (IBD) and have proven effective in both induction and maintenance therapy in luminal Crohn's disease and ulcerative colitis. Their efficacy has also been proven in fistulising perianal Crohn's disease. However, the evidence in other scenarios, such as stricturing, penetrating and non-fistulising perianal Crohn's disease, extraintestinal IBD manifestations and ileoanal reservoir complications, is not as robust. The aim of this review was to perform an analysis of the available literature and to determine the role of anti-TNF drugs in common clinical practice in patients affected by these complications.
Los principales anti-TNF disponibles en el mercado son el infliximab, el adalimumab, el golimumab, el certolizumab pegol y el etanercept. A pesar de poseer distintas estructuras moleculares, no parecen existir diferencias entre ellos en cuanto a la capacidad de neutralización del factor de necrosis tumoral o de la modulación de la apoptosis de linfocitos1.
El uso de anti-TNF está aprobado en numerosas enfermedades autoinmunes. Dentro de la enfermedad inflamatoria crónica intestinal (EICI), etanercept no ha demostrado efectividad, si bien algunos autores asocian los resultados negativos obtenidos en algunos estudios con su utilización a dosis insuficientes2. En otros casos, además, el uso de etanercept se ha implicado en el desarrollo de EICI como efecto paradójico, especialmente en pacientes tratados por espondiloartritis: esta asociación ocurre más frecuentemente que con otros anti-TNF3. Infliximab, adalimumab y golimumab están aprobados tanto por la US Food & Drug Administration como por la European Medicines Agency (EMA) en colitis ulcerosa (CU). En enfermedad de Crohn (EC), el uso de infliximab y adalimumab está aprobado tanto en América como en Europa; certolizumab pegol, únicamente en América4,5.
La aprobación de estos fármacos fue consecuencia de la demostración de efectividad en diferentes estudios de calidad. En CU, infliximab, adalimumab y golimumab demostraron ser más efectivos que el placebo en los estudios ACT, ULTRA y PURSUIT, respectivamente6. Además, en colitis aguda grave secundaria a CU, no parecen existir diferencias estadísticamente significativas entre el tratamiento con infliximab y con ciclosporina7. En cuanto a la EC, infliximab, adalimumab y certolizumab pegol han demostrado superioridad al placebo8, e infliximab también lo ha hecho en enfermedad fistulizante perianal9. Algunos estudios muestran también datos de efectividad de adalimumab en este contexto10.
Sin embargo, la EICI es una enfermedad crónica y, dada la edad temprana de su aparición, generalmente de larga evolución. En el caso concreto de la EC, si bien el cambio en la localización de la enfermedad es infrecuente, no lo es tanto el cambio en su patrón de comportamiento. Se estima que hasta un 50% de los pacientes afectos presentará algún tipo de complicación estenosante o penetrante a los 20 años del diagnóstico11. Actualmente, la clasificación del comportamiento de la enfermedad en inflamatoria, estenosante o penetrante se considera demasiado estática y está adquiriendo popularidad el concepto de daño intestinal crónico acumulado12. El daño intestinal continúa siendo la principal indicación de cirugía en los pacientes con EC y, a pesar de que la frecuencia de cirugía parece estar reduciéndose en las últimas décadas13, el riesgo aún se estima en un 40-71% a los 10 años del diagnóstico. La cirugía no cura la enfermedad definitivamente y la recurrencia es la norma, por lo que son necesarias en ocasiones nuevas intervenciones. Dentro de la EICI, otros escenarios pueden también llevar al paciente a precisar una intervención quirúrgica, como una afectación perianal no fistulizante agresiva, que resulta en la realización de proctocolectomía hasta en el 43% de los casos14. El fracaso del reservorio en pacientes colectomizados se estima que ocurre en el 15% de los casos a los 10 años de su realización, y su escisión se ha asociado a una alta morbilidad15.
Por otro lado, la EICI puede dar lugar a daño de otros órganos como consecuencia de las manifestaciones extraintestinales, que además pueden mermar significativamente la calidad de vida.
Por todo ello, parece importante encontrar un tratamiento médico efectivo en los escenarios descritos que permita evitar la cirugía y mejore la calidad de vida en esta población. Puesto que el proceso que subyace a estas manifestaciones es derivado de la inflamación local, se ha postulado que los anti-TNF podrían ser útiles en su tratamiento.
El objetivo de esta revisión es sintetizar los resultados de los diferentes estudios publicados en los que se ha analizado el papel de los anti-TNF en EICI complicada, excluyendo la enfermedad luminal y la enfermedad fistulizante perianal, escenarios en los que ya existe una evidencia de calidad favorable a su uso.
Anti-TNF en enfermedad estenosanteAproximadamente el 10% de los pacientes presenta ya una EC complicada con estenosis al diagnóstico y, de los que presentan un comportamiento no estenosante ni penetrante inicialmente, hasta un 25% desarrollará alguna estenosis a los 5 años del diagnóstico. Además, los síntomas obstructivos que pueden resultar de ello suponen el 40% de las indicaciones de cirugía mayor en esta población16.
Al hablar de enfermedad estenosante, no se puede dejar de mencionar el proceso de fibrogénesis que, si bien aún no se conoce con exactitud, está siendo ampliamente investigado en la actualidad. La inflamación parece ser el desencadenante de la fibrosis, cuyo principal mediador inflamatorio implicado es el factor de crecimiento tumoral. Sin embargo, con posterioridad, parece que la fibrosis podría progresar de forma independiente a la inflamación, debido a la presencia de fibroblastos permanentemente activados en respuesta al daño tisular previo, productores de matriz extracelular en cantidades superiores a las fisiológicas, junto a un desequilibrio de las proteínas reguladoras de la matriz extracelular que condicionaría que su degradación se viera disminuida17. Por otro lado, aunque tradicionalmente se han clasificado las estenosis como inflamatorias o fibróticas, parece que ambos componentes están presentes en ellas en diferentes grados. La implicación de cada componente va a determinar la decisión terapéutica, de forma que en estenosis con predominio inflamatorio valoraremos la utilización de tratamiento médico antiinflamatorio y en las estenosis predominantemente fibróticas optaremos por un tratamiento endoscópico o quirúrgico con una mayor probabilidad. La utilización de un tratamiento médico antifibrótico podría ser una opción en este escenario en el futuro. Sin embargo, estos fármacos se encuentran por el momento en fases muy iniciales de investigación.
Teniendo en cuenta la importancia de la naturaleza de las estenosis, será necesario contar con pruebas de imagen que permitan clasificarla; aunque en la actualidad no existe una técnica óptima, se han publicado resultados prometedores con algunas secuencias especiales de resonancia magnética (RM)18.
A pesar de que los anti-TNF utilizados en un estadio precoz de la EC parecen prevenir el desarrollo de estenosis, en los años 2000 saltó la alarma tras la publicación de series, en su mayoría retrospectivas, de pacientes con EC tratados con anti-TNF que desarrollaron complicaciones estenóticas u obstructivas19. En ese momento se planteó la hipótesis de que la rápida cicatrización conseguida con los anti-TNF podría resultar en el desarrollo de estenosis.
Sin embargo, análisis posteriores de cohortes amplias de pacientes tratados con infliximab, como las cohortes TREAT o ACCENT, mostraron que ni el uso de infliximab ni la consecución de curación mucosa rápida con este fármaco estaban asociados a un mayor riesgo de estenosis o síntomas obstructivos20.
Una vez resueltas las dudas iniciales, se comenzó a estudiar la efectividad de los anti-TNF en el tratamiento de pacientes con EC complicada con estenosis. En el estudio de Pallotta et al.21, de los 15 pacientes con complicaciones estenosantes tratados con infliximab por otras indicaciones, ninguno presentó un empeoramiento de las lesiones estenóticas y, lo que es más interesante, el 60% experimentó una remisión de las mismas.
Adalimumab también ha sido estudiado en este contexto. Recientemente se han publicado los resultados del estudio multicéntrico y prospectivo CREOLE22, en el que se administró el fármaco a pacientes con EC estenosante de intestino delgado. Tras 6meses, 2/3 de la cohorte presentaron respuesta, definida como mantenimiento de adalimumab sin necesidad de esteroides o cambio de anti-TNF, cirugía o dilatación endoscópica, y la mitad de los respondedores la mantuvo a los 4 años de seguimiento. Además, más del 50% de los pacientes de la cohorte total no habían precisado cirugía a los 4 años del inicio del estudio. A pesar de estos resultados positivos, llama la atención el alto porcentaje de complicaciones comunicadas (72%), si bien en esta proporción se incluyen la necesidad de cirugía, dilatación u hospitalización, que podrían considerarse más como fallos del tratamiento que como verdaderos eventos adversos. Por otro lado, cabe resaltar que en la evaluación de la respuesta al tratamiento no se tuvieron en cuenta criterios clínicos y no se menciona si los pacientes presentaron una mejoría significativa en la puntuación clínica de obstrucción ideada por los autores tras el tratamiento.
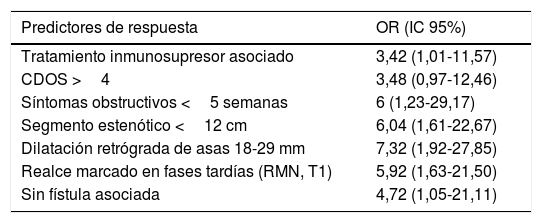
En este estudio se evaluaron también predictores de buena respuesta al tratamiento (tabla 1) y se hallaron mejores resultados en pacientes tratados con adalimumab asociado a inmunosupresor, estenosis cortas, sintomatología obstructiva marcada y de corta duración y dilatación moderada retrógrada de asas. Además, la captación intensa en secuencias tardías en T1 en RM también se asoció a buena respuesta. Aunque el significado de esta captación no está del todo claro, parece que podría corresponder con la presencia de inflamación grave. Por último, en la estratificación de la cohorte según los predictores de buena respuesta, los autores hallaron que aquellos con 4 o más respondieron en una proporción mucho mayor que aquellos con 2 o menos (89 frente al 6%, respectivamente).
Predictores de buena respuesta al tratamiento con anti-TNF en pacientes con enfermedad de Crohn estenosante (resultados del estudio CREOLE)
| Predictores de respuesta | OR (IC 95%) |
|---|---|
| Tratamiento inmunosupresor asociado | 3,42 (1,01-11,57) |
| CDOS >4 | 3,48 (0,97-12,46) |
| Síntomas obstructivos <5 semanas | 6 (1,23-29,17) |
| Segmento estenótico <12 cm | 6,04 (1,61-22,67) |
| Dilatación retrógrada de asas 18-29 mm | 7,32 (1,92-27,85) |
| Realce marcado en fases tardías (RMN, T1) | 5,92 (1,63-21,50) |
| Sin fístula asociada | 4,72 (1,05-21,11) |
CDOS: Crohn disease obstructive score; RMN: resonancia magnética nuclear.
La probabilidad de los pacientes con EC de desarrollar cualquier tipo de fístula es del 20-40%23. Las fístulas suelen clasificarse en internas, que incluyen las enteroentéricas, enterourinarias y rectovaginales; y externas, entre las que se encontrarían las perianales, enterocutáneas y periestomales.
Esta clasificación parece tener relevancia terapéutica, ya que se ha visto que las fístulas externas presentan una mejor respuesta al infliximab que las internas. Parece que esta respuesta es a expensas de las fístulas perianales, que responden mejor que las enterocutáneas cuando se desglosan las fístulas externas. Además, se ha visto que las fístulas perianales responden mucho mejor cuando se encuentran de forma aislada que cuando se asocian a otro tipo de fístulas. Ello podría indicar que la enfermedad fistulizante no perianal traduce un fenotipo más agresivo de enfermedad24.
Al hablar de efectividad de los anti-TNF en enfermedad fistulizante no perianal, es importante mencionar en primer lugar que la evidencia existente es de baja calidad y proviene de estudios retrospectivos, series de casos y análisis de subgrupos.
En el caso de las fístulas enterocutáneas, algunos estudios han evaluado las fístulas externas en conjunto, incluyendo enfermedad perianal. Entre estos estudios cabe destacar varios análisis de subgrupos de ensayos clínicos de adalimumab frente a placebo, de los que muestra resultados favorables a adalimumab únicamente uno de ellos, con un porcentaje de respuesta del 33% al año de seguimiento25. Son escasos los estudios específicos de fístulas enterocutáneas. La cohorte más amplia es la analizada en un estudio retrospectivo francés que incluyó 48 pacientes26, en la que se observó cierre de la fístula en 1/3 de los pacientes a los 3 meses de tratamiento con anti-TNF, que descendió al 17% a los 3 años, y en la que respondieron mejor los pacientes sin estenosis asociada y aquellos con un único tracto fistuloso. De este estudio llama la atención que casi 1/3 de los pacientes presentó abscesos tras el inicio de tratamiento con anti-TNF, si bien en la cohorte se incluyó inicialmente a pacientes con abscesos previamente tratados mediante antibioterapia y drenaje. Los resultados de un estudio retrospectivo español de 24 pacientes con fístulas enterocutáneas tratados con anti-TNF en los que el 67% presentó respuesta indican que las fístulas postoperatorias responden mejor que las espontáneas y que la respuesta se correlaciona con la de las fístulas perianales en caso de estar asociadas27.
La efectividad de los anti-TNF en fístulas enterourinarias se ha analizado solo de forma retrospectiva. Una de las series más amplias es la española de Taxonera et al.28, en la que se evaluaron diferentes opciones terapéuticas en 97 pacientes con fístula enterourinaria. El único tratamiento que logró evitar la cirugía fueron los anti-TNF (33 pacientes), con una respuesta mantenida a los 3 años en el 45%. Además, en el grupo de pacientes que finalmente requirieron cirugía, el uso previo de anti-TNF no se asoció a un mayor riesgo de complicaciones posquirúrgicas. Aunque no se evaluaron factores asociados a fracaso del tratamiento con anti-TNF, llama la atención que en este subgrupo de pacientes coexistían complicaciones (21,5% abscesos; 39,2% flemones y 30,4% otras fístulas), por lo que parece importante realizar una cuidadosa selección de los casos.
En cuanto a las fístulas enterogenitales, los datos provienen de análisis de subgrupos y series retrospectivas, y los porcentajes de respuesta a anti-TNF oscilan entre el 16 y el 45%. El más estudiado en este subgrupo de pacientes ha sido el infliximab. En la serie de De la Poza29 se incluyó a 34 pacientes con fístulas enterogenitales tratados con anti-TNF (infliximab en 30/34), con tasas de respuesta y remisión del 30 y del 16,7%, respectivamente.
Al hablar del uso de anti-TNF en enfermedad fistulizante es importante mencionar la seguridad ya que, como se ha mencionado anteriormente, se ha comunicado en algunas series un alto porcentaje de casos con desarrollo de abscesos tras el inicio del tratamiento biológico. Por otro lado, en 2003 se publicó un estudio que incluyó a pacientes con enfermedad perianal en el que se detectó que, a pesar del cierre del orificio fistuloso, la mitad de los pacientes presentaba tractos fistulosos inflamatorios en RM a largo plazo, lo cual podría derivar en recurrencia de la fístula o formación de abscesos30. Estos hallazgos podrían ser extensibles a la enfermedad fistulizante en general. Sin embargo, en el análisis de la cohorte ACCENT II de aquellos pacientes con enfermedad fistulizante y tratamiento con anti-TNF, estos no desarrollaron más abscesos que los pacientes tratados con placebo, con lo que se determinó que el riesgo de abscesos podría estar más en relación con el propio comportamiento fistulizante de la enfermedad que con el uso de anti-TNF31.
Por otro lado, Cullen et al. publicaron en 2012 los resultados del análisis retrospectivo de 13 pacientes con flemones32, en su mayoría con abscesos asociados (12 de ellos), tratados con anti-TNF. Tras el control del absceso con antibiótico en todos los casos y drenaje en aquellos abscesos de gran tamaño, el 80% se encontraba en remisión con anti-TNF a los 2 años del inicio del tratamiento, sin reaparición de complicaciones penetrantes. Estos resultados contribuyen a demostrar no solo seguridad, sino también efectividad en el uso de estos biológicos en algunos pacientes con flemones y abscesos. En esa selección de pacientes se subraya la necesidad de control previo de la posible infección con antibiótico y drenaje en el caso de abscesos de gran tamaño. Nuevamente se desconocen los factores que se asocian a la respuesta o al fracaso del tratamiento en este escenario y que podrían dirigir a los pacientes hacia el tratamiento médico o quirúrgico.
Anti-TNF en enfermedad perianal no fistulizanteAdemás de las fístulas perianales, otras lesiones de la región perianal como fisuras, úlceras cavitadas y estenosis anorrectales pueden conllevar también un riesgo de destrucción tisular y mermar la calidad de vida de los pacientes con EICI, especialmente en el caso de las úlceras cavitadas dolorosas o en aquellos pacientes que desarrollan incontinencia fecal33.
La mejor evidencia del tratamiento de estas lesiones perianales no fistulizantes con anti-TNF proviene del estudio retrospectivo de Bouguen et al.34. El 72% de los pacientes con úlceras perianales presentó respuesta a infliximab a largo plazo, con una mediana de seguimiento de 3,2 años e independientemente de la presencia de fístula asociada. Cabe destacar que el 94% de los respondedores iniciales mantuvo la respuesta a largo plazo, y que parece existir un beneficio de la terapia combinada con tiopurinas en el caso de las úlceras cavitadas (OR 0,13). Otro aspecto a tener en cuenta es que la efectividad de infliximab se asoció a una rápida mejoría sintomática, mantenida en el tiempo.
En cuanto a las estenosis anorrectales, los resultados de este estudio son más difíciles de interpretar. Si bien se reportó una respuesta a largo plazo en aproximadamente la mitad de los casos, a 6 de los 12 pacientes incluidos se les realizaron dilataciones anales durante el tratamiento con anti-TNF, lo que pudo actuar como factor de confusión. Se concluyó en cualquier caso que la presencia de este tipo de estenosis no contraindica el tratamiento con anti-TNF.
Anti-TNF en complicaciones del reservorioSegún las series, hasta un 30% de los pacientes con CU va a requerir colectomía en algún momento de su evolución35. De aquellos con reservorio ileal, más de la mitad va a presentar reservoritis, que será refractaria a los tratamientos habituales en un 10% de los casos. Por otro lado, en el seguimiento de los pacientes intervenidos, el diagnóstico puede cambiar a EC, o aparecer lesiones sugestivas de ella, en un porcentaje apreciable, que oscila entre el 2,7 y el 13%, según las series36.
La mejor evidencia de tratamiento con anti-TNF en pacientes con complicaciones del reservorio procede de la revisión sistemática de Huguet et al.37. Resulta interesante la clasificación que realizan los autores de los pacientes en 2subgrupos: aquellos con reservoritis crónica refractaria, cuando la inflamación se limita al reservorio y aquellos con complicaciones «tipo Crohn», entre los que se incluyen pacientes con fístulas o estenosis no anastomóticas, así como ileítis prerreservorio significativa. De los 313 pacientes incluidos en la cohorte completa, la mitad respondió a la octava semana y este porcentaje se mantuvo al año, sin detectarse diferencias significativas entre infliximab y adalimumab. Sin embargo, llama la atención que, al diferenciar entre los 2subgrupos de pacientes, en la semana 8 respondió un porcentaje mucho mayor de los pacientes con complicaciones «tipo Crohn» que de aquellos con reservoritis crónica refractaria (64 vs. 10%), diferencias que desaparecieron a largo plazo. De ello se deduce que los pacientes con complicaciones «tipo Crohn» podrían presentar una respuesta más rápida, lo que puede incluso interpretarse como que se tratara de una EC en sí misma, y la diferenciación entre estas entidades sería un aspecto a tener en cuenta a la hora de valorar el tratamiento con anti-TNF.
Anti-TNF en manifestaciones extraintestinalesUn alto porcentaje de los pacientes van a desarrollar manifestaciones extraintestinales a lo largo de la evolución de su enfermedad. Los pacientes con EICI y manifestaciones extraintestinales son tratados más frecuentemente con anti-TNF que aquellos sin ellas (58 vs. 21%), según los resultados de una cohorte suiza de 1.249 pacientes38. Y, en ocasiones, las propias manifestaciones extraintestinales son la indicación del tratamiento (43%). Por ello, llama la atención la escasez de estudios que han analizado la efectividad de los fármacos anti-TNF en esta indicación, especialmente en CU.
Los resultados del estudio CARE39 mostraron una reducción de la prevalencia del global de las manifestaciones extraintestinales a las 20 semanas de tratamiento con adalimumab, que disminuyó de un 53 a un 30%, asociándose la remisión de las manifestaciones extraintestinales a la remisión de la actividad de la enfermedad según el índice de Harvey-Bradshaw. Sin embargo, en este análisis se permitió el uso de otros tratamientos asociados, como inmunosupresores y corticoides, que podrían haber influido también en la respuesta. Por otro lado, la evaluación de respuesta se realizó teniendo en cuenta criterios solo clínicos, cuando en algunas manifestaciones como las articulares es relevante también la información aportada por las pruebas de imagen.
De la revisión sistemática de Peyrin-Biroulet et al.40 se extrae que los anti-TNF podrían ser efectivos en el tratamiento de las manifestaciones articulares, con tasas de respuesta reportadas, en general, superiores al 60%, tanto con infliximab como con adalimumab y tanto en artritis periférica como axial. Sin embargo, no se dispone de ningún ensayo clínico que compare los resultados de estos fármacos frente a placebo.
Dentro del global de las manifestaciones extraintestinales, solo disponemos de un ensayo clínico que compare anti-TNF con placebo41, e incluyó solo a pacientes con pioderma gangrenoso. La respuesta a infliximab fue significativamente mayor que a placebo (46 vs. 6%; p<0,05). Otros estudios de menor calidad también han mostrado buenos resultados en pioderma gangrenoso, tanto con infliximab como con adalimumab42-44. Los análisis de anti-TNF en otro tipo de manifestaciones cutáneas son escasos.
Los escasos estudios que han analizado la respuesta de manifestaciones oculares a los anti-TNF también han mostrado buenos resultados, con tasas de respuesta llamativamente altas, por encima del 88%, si bien el bajo número de pacientes incluidos no permite sacar conclusiones definitivas45.
Parece que los anti-TNF podrían tener un efecto beneficioso también en la enfermedad ósea asociada a la EICI, aunque por lo general este efecto se ha estudiado en los marcadores de formación ósea, demostrándose en algunos casos un incremento en ellos46. Parece que la anemia asociada a la EICI también podría mejorar con el tratamiento con anti-TNF. Sin embargo, se ha señalado que este efecto podría estar en relación con el control de la inflamación intestinal47.
Conclusiones sobre el uso de anti-TNF en enfermedad no luminal: lugar en la práctica clínicaLos anti-TNF han demostrado una mejoría de la calidad de vida, una reducción en las hospitalizaciones y en la necesidad de cirugía en pacientes con enfermedad, por así decir, «no complicada». Sin embargo, la utilidad de estos fármacos en otros escenarios dentro de la EICI está más cuestionada y, como se ha mencionado, la evidencia disponible es escasa y de bajo nivel.
La cirugía sigue siendo necesaria y puede ser primer escalón terapéutico en muchos pacientes con enfermedad «complicada». Sin embargo, los anti-TNF podrían evitar o retrasar la cirugía en algunos casos seleccionados. Esta selección debe hacerse teniendo en cuenta los riesgos asociados al tratamiento y a los predictores de respuesta. No debemos olvidar que es primordial consensuar el tratamiento con los diferentes especialistas implicados y con el propio paciente. Podríamos decir que el tratamiento con anti-TNF:
- 1)
En enfermedad estenosante: podría evitar la cirugía en un porcentaje considerable de pacientes, especialmente en aquellos con estenosis cortas, con componente inflamatorio, sintomatología obstructiva de corta evolución y sin fístula asociada.
- 2)
En enfermedad fistulizante: en las fístulas enterocutáneas, las guías de la ECCO48 refieren que podría valorarse el uso de anti-TNF en aquellas con bajo débito y no asociadas a estenosis o abscesos. En fístulas enterourinarias, el tratamiento con anti-TNF es una opción que puede evitar la cirugía a medio-largo plazo. Probablemente la ausencia de complicaciones asociadas (abscesos, estenosis…) sea un mejor escenario para la eficacia y seguridad del tratamiento biológico; se recomienda la asociación con antibioterapia49 y monitorización estrecha por el riesgo de complicaciones infecciosas. Infliximab y adalimumab podrían tener un papel en fístulas enterogenitales, aunque la necesidad de tratamiento quirúrgico es elevada.
- 3)
En enfermedad perforante, flemones y abscesos: el tratamiento con anti-TNF puede ser una opción en casos seleccionados y siempre con un control previo de la infección con antibiótico concomitante y drenaje, si es necesario. Se necesitan estudios que apoyen el uso de terapia biológica en este escenario y determinar qué factores pudieran afectar a su eficacia y seguridad.
- 4)
En manifestaciones extraintestinales: la guía europea50 recomienda valorar el uso de los anti-TNF en los pacientes con espondiloartritis no respondedores o intolerantes a AINE, y en aquellos con artritis periférica persistente que afecte a su calidad de vida. En pioderma gangrenoso, se puede considerar iniciar infliximab cuando no exista una respuesta rápida a corticoides o si se localiza en áreas con implicaciones estéticas. Adalimumab es una alternativa. Los anti-TNF pueden ser de utilidad también en casos de eritema nudoso recurrente o persistente. Dentro de las manifestaciones oculares, se puede considerar el uso de anti-TNF, especialmente en casos de uveítis posterior y escleritis.
- 5)
En reservoritis: los anti-TNF estarían indicados en reservoritis crónica refractaria al tratamiento habitual (antibiótico, budesonida…)51. En el caso de las complicaciones que los autores definen como «tipo Crohn», los anti-TNF se encuentran en los primeros escalones terapéuticos, y la respuesta parece ser más rápida que en la reservoritis.
- 6)
En enfermedad anal: infliximab está indicado en el caso de úlceras perianales graves, por el riesgo de incontinencia e ileostomía. En caso de respuesta, produce un alivio sintomático rápido. La efectividad de los anti-TNF en estenosis anorrectales no está clara, pero su presencia no contraindica el tratamiento cuando está indicado por otros motivos.
Aunque la escasa de evidencia no permite establecer recomendaciones sólidas, el uso de anti-TNF en pacientes seleccionados con EICI complicada podría evitar la necesidad de tratamientos más agresivos como la cirugía y mejorar la calidad de vida de los pacientes. Una vez más, el abordaje multidisciplinar en estos escenarios es primordial. Deben valorarse conjuntamente los riesgos y beneficios del tratamiento anti-TNF y considerar que su uso no debe retrasar una intervención quirúrgica cuando la indicación es clara.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.