Describir las características de la composición corporal y del ángulo de fase (AF) en pacientes con MAFLD de acuerdo con fibrosis y esteatosis hepática.
Pacientes y métodosEstudio transversal, observacional y descriptivo en una cohorte de 585 voluntarios de nuestro centro con criterios de MAFLD. El riesgo de fibrosis hepática se determinó por APRI, NAFLD score y FIB-4; en riesgo indeterminado y elevado de fibrosis se realizó elastografía hepática de transición (ET) con Fibroscan®. Se realizó análisis de la composición corporal por bioimpedancia (SECA®). Se incluyeron pacientes con registro de ET y SECA®.
ResultadosSe evaluaron 125 participantes (21,4%), edad 53,9±13,9 años, 62,1% mujeres, IMC 33,2±5,8kg/m2. El análisis SECA® mostró media de masa grasa de 42%±7,32 y masa muscular de 21,18kg±6,6. El AF fue 5,1±0,69; en mujeres 4,92±0,62 y en hombres 5,41±0,70. El AF en pacientes sin fibrosis fue de 5,091 vs con fibrosis 5,121 (p=0,813). En fibrosis avanzada se reportó valor bajo en comparación con el resto de los grupos (p=0,031). El AF en S3 fue mayor en comparación con S1 y S2 (5,3 vs 4,82, 4,81) (p=0,027).
ConclusionesEn MAFLD el AF fue menor vs población sana mexicana. En pacientes sin fibrosis y esteatosis severa el AF se eleva proporcional al incremento de masa grasa e del IMC, y en fibrosis hepática avanzada el AF disminuye.
To describe the characteristics of the body components and phase angle (PhA) of patients with MAFLD according to those different to fibrosis and hepatic steatosis.
Material and methodsObservational and descriptive study in a cohort of 585 volunteers from our center with MAFLD criteria. The risk of liver fibrosis was determined by APRI, NAFLD score and FIB-4; at an indeterminate and high risk of fibrosis, a transient elastography (Fibroscan®) were realized. Bioimpedance body composition analysis (SECA®) was performed. Patients with ET and SECA® registry were included. Bioimpedance body composition analysis (SECA®) was performed. Patients with ET and SECA® registry were included.
Results125 participants (21.4%) were evaluated, age 53.9±13.9 years, 62.1% women, BMI 33.2±5.8kg/m2. The SECA® analysis showed mean fat mass of 42%±7.32 and muscle mass 21.18kg±6.6. The PhA was 5.1±0.69, in women 4.92±0.62 and men 5.41±0.70. PhA in patients without fibrosis was 5.091 vs with fibrosis 5.121 (P=.813). In advanced fibrosis, it reported a low value compared to the rest of the groups (P=.031). The PhA in S3 was higher compared to S1 and S2 (5.3 vs 4.82, 4.81) (P=.027).
ConclusionsIn MAFLD, the PhA was lower than the healthy Mexican population. In patients without fibrosis and severe steatosis, PhA rises proportionally to the increase in fat mass and BMI and in advanced liver fibrosis, PhA decreases.
A partir de sus primeras descripciones, la enfermedad por hígado graso ha cobrado especial interés en el área de la gastroenterología debido a su estrecha relación con alteraciones metabólicas, riesgo de progresión a cirrosis y desarrollo de carcinoma hepatocelular1. Es por ello que se han sumado esfuerzos para estandarizar los criterios diagnósticos, surgiendo en el año 2020 el término de enfermedad por hígado graso asociado a disfunción metabólica (metabolic associated fatty liver disease [MAFLD]). A partir de entonces, MAFLD se define como la presencia de esteatosis hepática evidenciada por estudio de imagen, biomarcadores o biopsia más la evidencia de al menos uno de los siguientes: sobrepeso u obesidad, diabetes tipo2, y en el contexto de pacientes con índice de masa corporal (IMC) normal, la evidencia de desregulación metabólica2.
Se han implementado diversos métodos de medición de composición corporal para la evaluación clínica integral de los pacientes con MAFLD, como la absorciometría con rayosX de energía dual (DXA), resonancia magnética y tomografía axial computarizada. Estas evaluaciones nos permiten la medición de la masa muscular y la identificación de sarcopenia, la cual ha demostrado ser un factor de vital importancia en el curso clínico y en el desenlace de la MAFLD, así como establecer la relación entre la masa grasa y el síndrome metabólico3. Una de las técnicas que ha mostrado auge por su practicidad y su accesibilidad es la espectroscopia por bioimpedancia (BI). Se caracteriza por ser un procedimiento no invasivo, indoloro, fácil y económico que permite determinar las características eléctricas pasivas de los tejidos mediante la aplicación de una corriente eléctrica alterna de intensidad baja e imperceptible por el paciente; se basa en el comportamiento diferente de la estructura celular en respuesta a la corriente eléctrica aplicada, logrando con ello discriminar los diferentes compartimentos corporales. Se aplica corriente eléctrica de baja amplitud a través de electrodos en contacto con la piel, los cuales registran niveles de impedancia (Z) a diferentes frecuencias (Hz) del tejido evaluado para calcular su resistencia (R), su reactancia (Xc) y, con ello, calcular matemáticamente el ángulo de fase (AF), a la par que el porcentaje de masa magra, de masa grasa y muscular4,5. El AF es el valor en grados de la curva que resulta del registro de impedancia a diferentes frecuencias. Al ser directamente proporcional a la reactancia y la resistencia de un sistema, consecuentemente, cualquier alteración a nivel tisular que repercuta en tales propiedades eléctricas se reflejará directamente en el AF. Las alteraciones patológicas tienden a disminuir el valor del AF, y por este motivo es un buen predictor del pronóstico y de la mortalidad en pacientes con hemodiálisis, cáncer, infección por VIH, enfermedades pulmonares, pacientes posquirúrgicos, enfermedades hepáticas crónicas, insuficiencia cardiaca congestiva, entre otras6. Savegnago et al.4 describieron las aplicaciones de la BI para la monitorización de las enfermedades crónicas, destacando al AF como el parámetro con mejor aplicabilidad clínica, ya que observaron desviación de los niveles normales en diferentes patologías7-9.
La fibrosis y la posterior cirrosis representan el resultado final de las enfermedades hepáticas crónicas. Se ha observado que en los estadios iniciales de fibrosis el AF muestra tendencia a registrar determinaciones por debajo del límite de la normalidad10. Sin embargo, en pacientes con hígado graso no se han encontrado tendencias claras y los resultados siguen siendo controversiales11. Es importante destacar que en la enfermedad hepática crónica las desviaciones en el AF pueden estar presentes incluso antes de la aparición de las alteraciones de otros marcadores de desnutrición. Ante esta aseveración, y considerando que las alteraciones del estado nutricional están estrechamente relacionadas con la sobrevida, las guías europeas de nutrición en pacientes con enfermedad hepática recomiendan la determinación de BI de manera cotidiana con énfasis en la medición de masa muscular. Debido a que la presencia de ascitis y edema son alteraciones comunes en la enfermedad hepática avanzada, limitan la confiabilidad de los diferentes métodos antropométricos para el seguimiento del estado nutricional; la evaluación con BI y el AF poseen potencial como herramienta cotidiana en la evaluación clínica12.
Es por ello que el objetivo de nuestro trabajo de investigación fue describir las características de los componentes corporales (masa grasa, magra y muscular) de los pacientes con MAFLD, así como las características del AF de acuerdo con los diferentes grados de fibrosis y esteatosis hepática.
Pacientes y métodosEstudio transversal, observacional y descriptivo realizado en una cohorte de 585 pacientes evaluados en el Instituto de Investigaciones Médico-Biológicas de la Universidad Veracruzana y el Centro de Servicios en Salud (CESS) durante el periodo de febrero a marzo de 2020. Tras un muestreo dirigido, se reclutó una cohorte de sujetos residentes de los municipios de Veracruz y Boca del Río, en el estado de Veracruz, a quienes se les realizó, previo consentimiento informado, una evaluación médica integral que consistió en antropometría (peso, talla, IMC), toma de perfil bioquímico (biometría hemática, glucosa, creatinina, perfil de lípidos, aspartato aminotransferasa [AST], alanina aminotransferasa [ALT], fosfatasa alcalina [FA], bilirrubinas, albúmina), el índice de insulinorresistencia HOMA-IR, ultrasonido hepático y análisis de la composición corporal por BI (SECA®), la cual consistió en determinación de masa muscular, masa magra, masa grasa y AF, interpretándose este último como bajo, normal y elevado, de acuerdo al valor correspondiente para la edad y el IMC de cada paciente. Posteriormente se calcularon los índices NAFLD fibrosis score, APRI y FIB-4, y en pacientes con alto riesgo de fibrosis significativa se realizó ET con Fibroscan®.
Se incluyó a sujetos entre 18 y 85años que cumplieron con los criterios diagnósticos de MAFLD que contaran con registro SECA® completo y elastografía de transición (ET) con Fibroscan®. Se excluyó a pacientes con diagnóstico de cáncer, alguna enfermedad terminal y mujeres embarazadas.
El análisis de los resultados se realizó con el programa IBM SPSS® Statistics versión 22.0, de acuerdo con el análisis de la distribución muestral mediante análisis con la prueba de Kolmogorov-Smirnoff, corroborándose posteriormente con la de Shapiro-Wilk. Se calcularon la media y la desviación estándar para las variables nominales. Se utilizó la Rho de Spearman para reportar las asociaciones monótonas y la p de Pearson en caso de correlación lineal. Se consideró significación estadística el valor de p<0,05.
El proyecto se realizó apegado a los principios de buenas prácticas clínicas y previa aprobación del Comité de ética e investigación del Instituto de Investigaciones Médico-Biológicas de la Universidad Veracruzana con número IIMB-UV 2021/02.
ResultadosCaracterísticas de la poblaciónDe la cohorte epidemiológica, que incluyó 585 sujetos, 271 (46%) voluntarios cumplieron con criterios diagnósticos de MAFLD; se excluyeron 139 pacientes por no contar con reportes completos de ET y/o SECA®. En total evaluamos a 125 pacientes (22,5%) que cumplieron con los criterios de inclusión, de los cuales 82 (62,12%) fueron mujeres y 50 (37,8%) hombres, con una razón M:H de 1,64:1. Edad media de 53,9±13,9 años. El IMC medio fue de 33,2±5,8kg/m2. Se encontró un mayor número de pacientes con obesidad grado1, siendo 51 en total (39,3%), 23 (17,4%) con obesidad grado2, 16 (12,1%) con obesidad grado3, 37 (28%) con sobrepeso y 4 (3%) con peso normal. Respecto a las comorbilidades relacionadas con desregulación metabólica, se encontró diabetes tipo2 en 18 (13,7%) pacientes, hipertensión arterial sistémica en 42 (32%) y dislipidemia (hipercolesterolemia y/o hipertrigliceridemia) en 57 (43,1%) pacientes. Los valores del análisis bioquímico de acuerdo a severidad de la fibrosis por ET se detallan en la tabla 1.
Características generales de pacientes con MAFLD y su relación con el grado de fibrosis hepática por ET (n=132
| Grado de fibrosis por ET | Correlación | ||||||
|---|---|---|---|---|---|---|---|
| Variables | n=132 (%) | 0n=43 (%) | 1n=29 (%) | 2n=19 (%) | 3n=19 (%) | 4n=22 (%) | R Spearman p |
| Sexo | |||||||
| Masculino | 50 (37,8) | 17 (12,9) | 11 (8,3) | 5 (3,8) | 8 (6,1) | 9 (6,8) | SC |
| Femenino | 82 (62,12) | 26 (19,7) | 18 (13,6) | 14 (10,6) | 11 (8,3) | 13 (9,8) | SC |
| Edad (años) | 53,9±13,9 | 52±14 | 53±14 | 52±13 | 55±11 | 61±11 | R: 0,19; p=0,029 |
| IMC (kg/m2) | 33,2±5,8 | 31,3±3,9 | 34,2±7,3 | 32,3±4,3 | 36±6,7 | 34,4±6,1 | R: 0,23; p=0,007 |
| Peso normal | 4 (3,03) | 2 (1,5) | 1 (0,8) | 1 (0,8) | 0 | 0 | |
| Sobrepeso | 37 (28) | 14 (10,6) | 9 (6,8) | 4 (3,0) | 5 (3,8) | 5 (3,8) | |
| Obesidad G1 | 52 (39,3) | 22 (16,7) | 8 (6,1) | 11 (8,3) | 4 (3,0) | 7 (5,3) | |
| Obesidad G2 | 23 (17,4) | 4 (3,0) | 5 (3,8) | 2 (1,5) | 4 (3,0) | 8 (6,1) | |
| Obesidad G3 | 16 (12,1) | 1 (0,8) | 6 (4,5) | 1 (0,8) | 6 (4,5) | 2 (1,5) | |
| Comorbilidades | |||||||
| DM2 | 18 (13,7) | 6 (4,6) | 2 (1,5) | 3 (2,3) | 3 (2,3) | 4 (3,1) | SC |
| HAS | 42 (32) | 15 (11,5) | 8 (6,1) | 6 (4,6) | 2 (1,5) | 11 (8,4) | SC |
| Hipercolesterolemia | 28 (21,1) | 8 (6,1) | 5 (3,8) | 5 (3,8) | 5 (3,8) | 5 (3,8) | SC |
| Hipertrigliceridemia | 29 (22) | 4 (3,0) | 5 (3,8) | 5 (3,8) | 9 (6,8) | 6 (4,5) | R: 0,246; p=0,004 |
| Laboratorio | |||||||
| PLQ (×103/mm3) | 220±62 | 239±61 | 214±47 | 230±64 | 224±65 | 184±67 | R: −0,204; p=0,019 |
| Glucosa (mg/dl) | 113±51 | 107±42 | 108±48 | 115±55 | 105±44 | 142±67 | R: 0,173; p=0,047 |
| BT (mg/dl) | 0,73±0,36 | 0,64±0,20 | 0,70±0,42 | 0,74±0,25 | 0,76±0,3 | 0,92±0,59 | R: 0,186; p=0,032 |
| BI (mg/dl) | 0,62±0,30 | 0,55±0,18 | 0,59±0,36 | 0,63±0,21 | 0,63±0,21 | 0,78±0,47 | R: 0,201; p=0,021 |
| BD (mg/dl) | 0,11±0,12 | 0,11±0,14 | 0,10±0,09 | 0,11±0,06 | 0,13±0,18 | 0,13±0,13 | SC |
| AST (UI) | 40,4±20,4 | 31,2±11,7 | 37,1±17,3 | 44±21,1 | 48,8±25,2 | 52,6±24,1 | R: 0,474; p<0,001 |
| ALT (UI) | 45,8±34,5 | 30,5±15,5 | 45,3±29,4 | 58,1±42,6 | 65,5±54,5 | 48,8±27,3 | R: 0,42; p<0,001 |
| Albúmina | 4±0,29 | 4,1±0,26 | 4±0,2 | 4,1±0,2 | 4,0±0,2 | 3,8±0,04 | SC |
| LDL (mg/dl) | 112±33,2 | 117,9±27,2 | 112,6±38 | 120,4±37,3 | 105,4±31,1 | 98,2±32,7 | SC |
| HDL (mg/dl) | 52,4±15,6 | 51,8±20,1 | 53,4±11,3 | 52,7±11,2 | 53,1±11,9 | 51,5±17,4 | SC |
| TG (mg/dl) | 186,6±83,5 | 179,8±89,9 | 211,3±102 | 192±60,8 | 172,4±59,7 | 175±75,95 | SC |
| HOMA-IR | 3,5±8,8 | 2,7±3,9 | 2,4±1,8 | 2,2±1,4 | 4,22±7,12 | 7,31±19,5 | SC |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; BD: bilirrubina directa; BI: bilirrubina indirecta; BT: bilirrubina total; DM2: diabetes mellitus tipo2; G: grado; HAS: hipertensión arterial sistémica; HDL: lipoproteínas de alta densidad; IMC: índice de masa corporal; LDL: lipoproteínas de baja densidad; PLQ: plaquetas; SC: sin correlación; TG: triglicéridos.
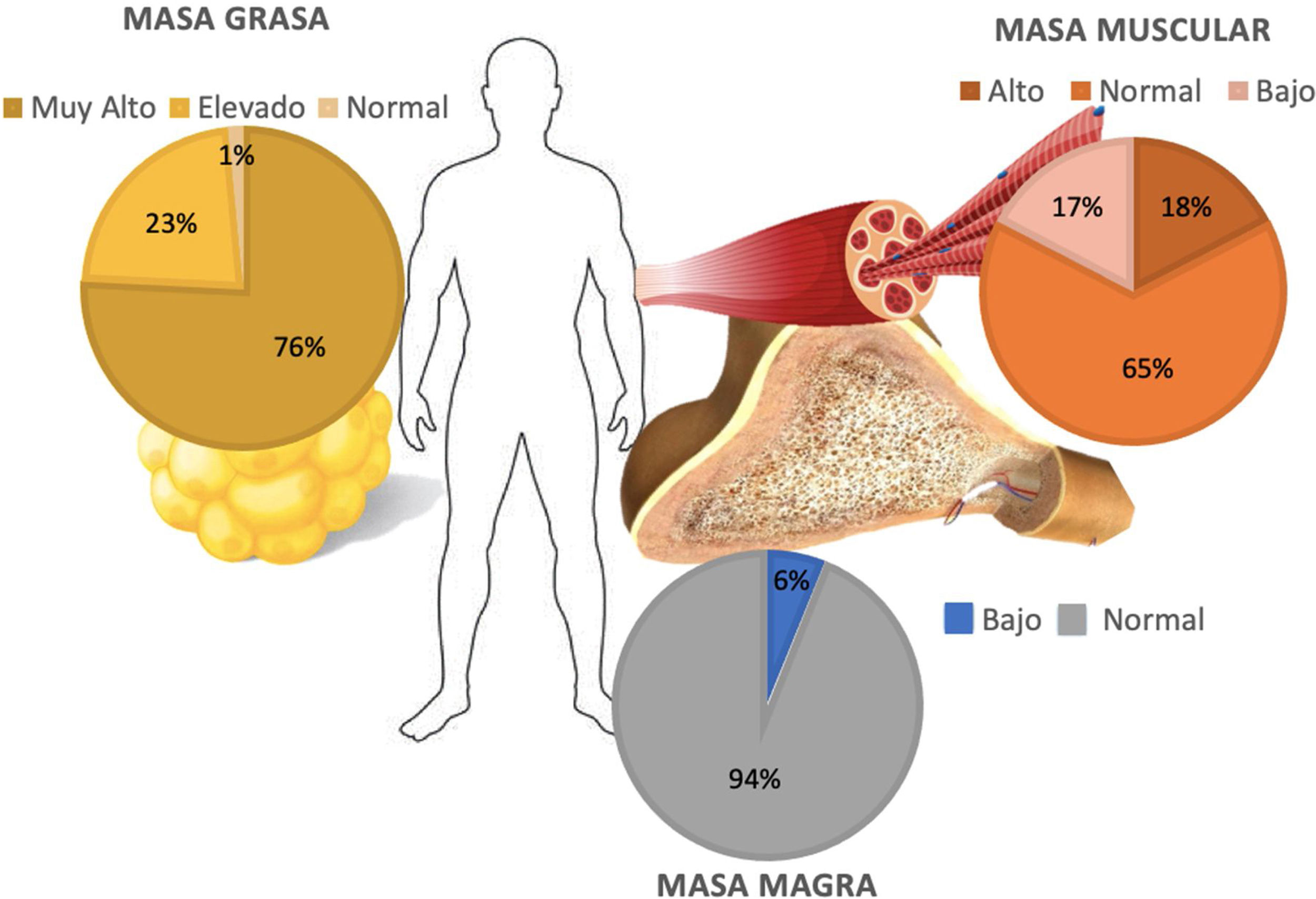
La evaluación de BI mostró una media del porcentaje de masa grasa del 42,6%±7,32. Cien pacientes (75,7%) se clasificaron con grado muy alto de masa grasa para su IMC, 30 (22,7%) con grado elevado, y los 2 pacientes restantes (1,5%) tuvieron porcentajes de masa grasa normal.
La masa muscular tuvo un valor medio de 21,18kg±6,6. Solo 23 pacientes (17,4%) presentaron porcentaje de masa muscular debajo del rango de acuerdo con su edad, 86 (65,1%) se encontraron dentro del límite normal, mientras que 23 (17,4%) puntuaron por arriba el límite normal. Por otro lado, en el análisis de masa magra se contabilizaron 8 pacientes (6%) por debajo del límite normal correspondiente a su IMC, mientras que los 124 pacientes restantes (93,9%) se hallaban en valores normales (fig. 1). En el análisis de AF se obtuvo una media de 5,1±0,69: en mujeres 4,92±0,62 y en hombres 5,41±0,70. Se observaron valores de AF debajo de los rangos correspondientes a su edad en 31 casos (23,4%) del total de la población estudiada.
Evaluación por elastografía de transición con Fibroscan®El análisis de ET reportó fibrosis en 89 pacientes (67,4%), distribuidos de la siguiente manera: F1 en 29 (21,9%), F2 en 19 (14,3%), F3 en 19 (14,3%) y F4 en 22 (16,6%). Por otro lado, en 43 pacientes (32,5%) se descartó fibrosis (F0). En cuanto al análisis de infiltración grasa hepática de acuerdo con CAP (parámetro de atenuación controlada), se reportó que 114 (86,3%) pacientes tenían infiltración grasa estimada mayor del 5% (grado S1 o mayor por ET), los cuales se distribuyeron de la siguiente forma: 17 sujetos en S1 (12,8%), 11 (8,3%) en S2 y 86 (65,1%) en S3.
Se observó correlación positiva entre la edad y el grado de fibrosis (Rho 0,19; p=0,029). De manera similar, el grado de fibrosis se incrementó directamente proporcional con el IMC (Rho 0,23; p=0,007). Se encontró correlación estadísticamente significativa entre el antecedente personal de hipertrigliceridemia con la severidad de la fibrosis (Rho 0,24; p=0,004). El análisis de ambas variables por χ2 descarta tal relación como efecto del azar. Valor de χ2: 12,12; p=0,016.
En cuanto a los resultados de laboratorio, se observó una relación inversa entre el recuento plaquetario (R −0,204; p=0,019) y grado de fibrosis. Por otro lado, se encontró relación directamente proporcional entre el grado de fibrosis y las siguientes variables: glucosa, BI, BD, AST y ALT. En todos los casos con significación estadística (p<0,05) (tabla 1).
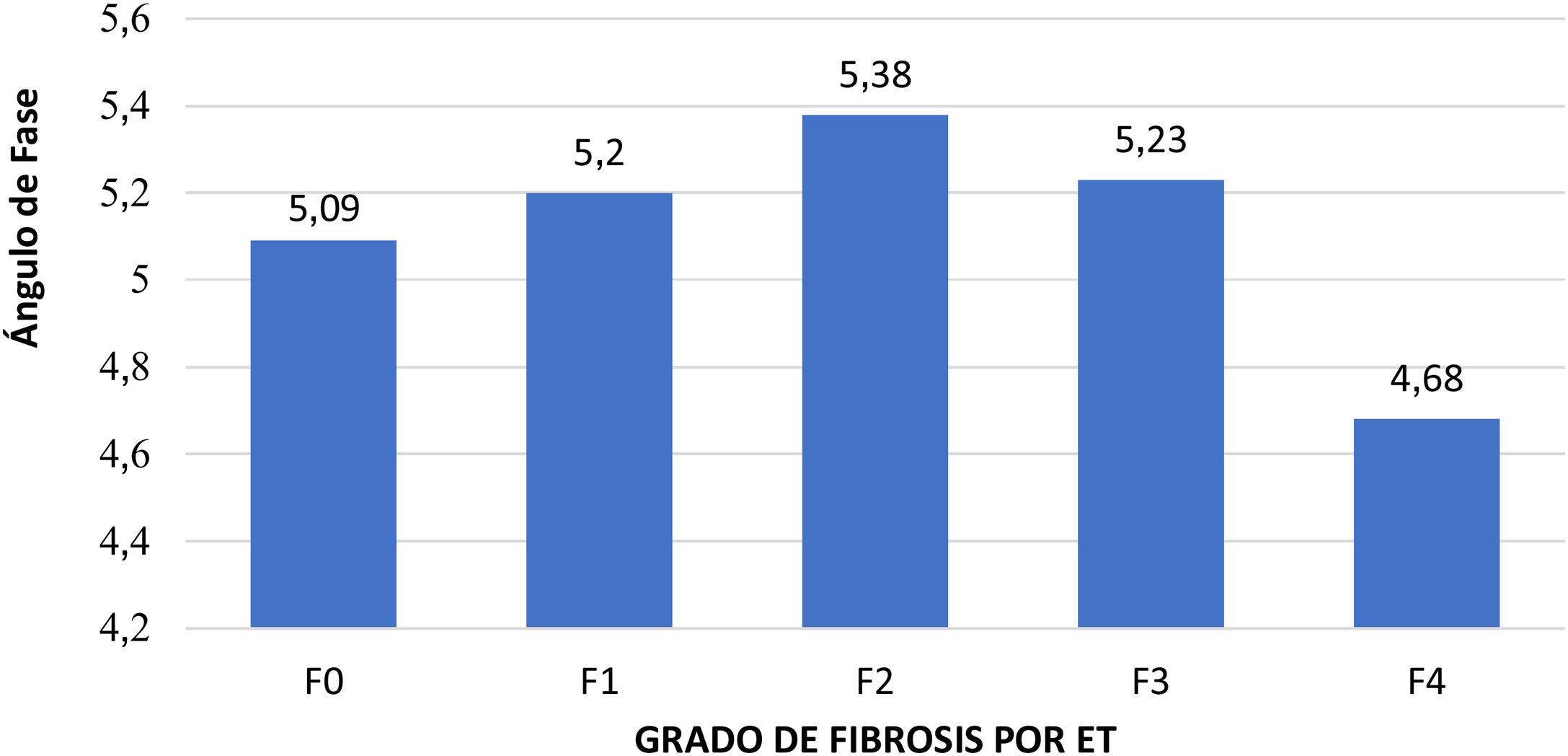
Correlación entre análisis SECA® y ETLa media del AF en los pacientes sin fibrosis (F0) fue de 5,091 vs pacientes con fibrosis 5,121, sin diferencias significativas (p=0,813). Sin embargo, se observó que los pacientes con fibrosis avanzada obtuvieron valores bajos de AF en comparación con el resto de los grupos, dando diferencia significativa (p=0,031), ver figura 2. La correlación entre AF y fibrosis (kPa), mostró proporcionalidad inversa con coeficiente de correlación Pearson −0,27 p=0,001.
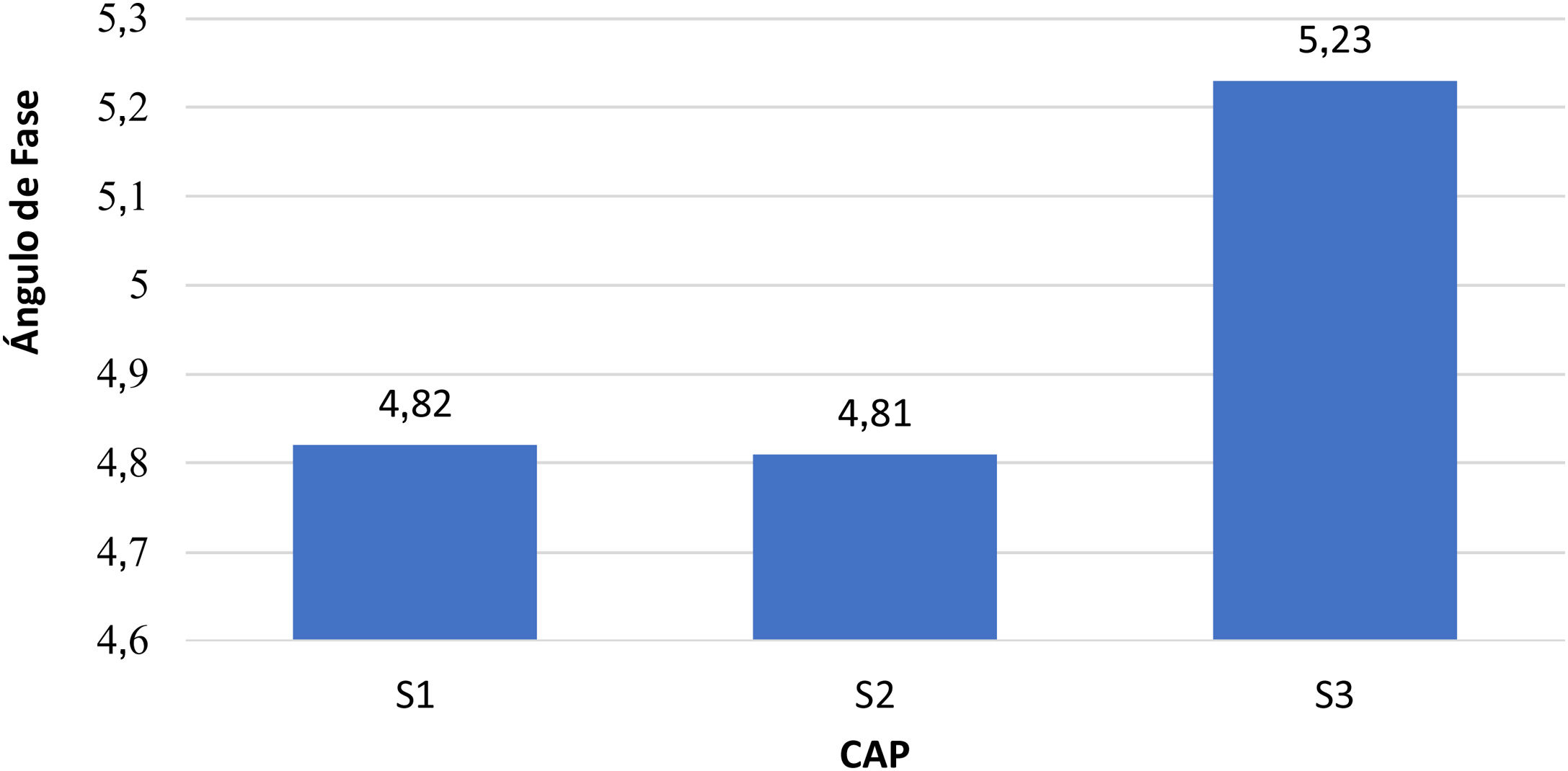
La media de AF en los pacientes con S3 fue mayor en comparación con S1 y S2 (5,3 vs 4,82): 4,81 (p=0,027). En la figura 3 se observa el valor medio de AF en relación con CAP (p=0,001). Se encontró correlación positiva, con un coeficiente de Spearman con valor de 0,285 (p<0,001).
Al considerar los percentiles de AF observamos que de los pacientes con AF clasificados como «debajo del rango normal» para su IMC y edad, 15 (13,9%) sujetos tenían fibrosis hepática por ET. No se demostró diferencia significativa entre la distribución por percentiles y la presencia de fibrosis significativa (F3, F4) (p=0,862). En la tabla 2 se muestra la distribución de los pacientes con MAFLD por percentiles de acuerdo con la presencia de fibrosis y su severidad (p=0,582).
Distribución por percentiles de AF en pacientes con MAFLD y su relación con la presencia de fibrosis hepática por ET
| Grados de fibrosis por ET | |||||
|---|---|---|---|---|---|
| Percentil | F0 | F1 | F2 | F3 | F4 |
| 1 a 5 | 8 | 4 | 1 | 0 | 4 |
| 6 a 10 | 3 | 2 | 0 | 2 | 1 |
| 11 a 25 | 7 | 3 | 3 | 5 | 3 |
| 26 a 50 | 7 | 7 | 2 | 3 | 4 |
| 55 a 75 | 5 | 5 | 3 | 4 | 2 |
| 76 a 90 | 2 | 3 | 4 | 3 | 0 |
| 91 a 100 | 3 | 1 | 3 | 0 | 1 |
| Total | 35 | 25 | 16 | 17 | 15 |
El hígado graso asociado a disfunción metabólica es la enfermedad hepática más frecuente a nivel mundial, con una prevalencia estimada entre el 25 y el 30% en la población mundial13,14. Se ha demostrado que la presencia de fibrosis hepática es el principal factor pronóstico de esta patología, independientemente de la severidad de la infiltración grasa15. En nuestro estudio, realizado en población mexicana y considerando los nuevos criterios de MAFLD, se encontró que el 22,5% de los voluntarios sanos cumplen con criterios diagnósticos para enfermedad por hígado graso, resaltando que, de estos, el 30,9% tuvieron estadios de fibrosis avanzada (F3, F4). Es decir, hasta una sexta parte de los pacientes con MAFLD presentan algún grado de fibrosis, de los cuales 2 de cada 10 serán grado F4, equivalente a cirrosis por METAVIR.
La definición actual de MAFLD considera la evidencia de esteatosis más obesidad o diabetes, y en pacientes con peso normal la evidencia de disfunción metabólica. Bajo estas consideraciones nos encontramos ante población con alteraciones metabólicas que requieren evaluación clínica integral. Es por ello que se considera de gran utilidad la evaluación mediante BI eléctrica para el análisis de la composición corporal, ya que se basa en los principios de reactancia y conductancia celular. La BI registra el cambio en el voltaje de la corriente aplicada, la conductancia retrasa la velocidad de la conducción con respecto al voltaje, lo que resulta en el cambio de fase que se cuantifica geométricamente como AF. Nos permite la evaluación del estado nutricional del individuo y puede darnos información pronóstica en diversas patologías, como el cáncer, enfermedades pulmonares y cirrosis, entre otras. En nuestra cohorte encontramos al 13,7% de la población con antecedente de diabetes mellitus, similar a la prevalencia observada en población general mexicana, estimada en el 13,4% de acuerdo con la última Encuesta Nacional de Salud y Nutrición (ENSANUT). Esto difiere de lo encontrado en otras cohortes de pacientes con MAFLD, donde se reportó una prevalencia entre el 70 y el 90%, lo que probablemente fue debido al método de selección de nuestra población16.
La gran mayoría de los pacientes con MAFLD tienen sobrepeso u obesidad por IMC, lo cual se vio claramente reflejado en nuestra cohorte de pacientes, donde observamos una media de IMC de 33,2±5,8kg/m2, correspondiente a obesidad. Se observó que únicamente el 3% de la población estudiada con MAFLD tuvo peso normal, lo cual se ha nombrado como enfermedad por hígado graso en pacientes delgados y hace referencia a pacientes con enfermedad metabólica en el contexto de IMC normal pero con incremento de la adiposidad visceral y resistencia a la insulina; su frecuencia se estima entre el 5 y el 45%, dependiendo de la población estudiada17. Es alarmante que el 75,6% de los pacientes evaluados tuvieran niveles muy altos de masa grasa para su IMC evaluados por análisis SECA, y destacó que solamente el 1,5% se encontraron con niveles normales de masa grasa. Estudios previos han evidenciado que en pacientes con IMC elevado el valor del AF por BI se eleva proporcionalmente al incremento en la masa magra y masa grasa, lo cual se replicó en nuestros pacientes con IMC sobrepeso/obesidad de manera significativa (p=0,001); se debe considerar que en nuestros pacientes con IMC normal estos resultados no pueden replicarse y deben considerarse como una población diferente18. Además, encontramos asociación significativa entre el valor de AF y los grados de CAP (p=0,001), lo cual sugiere que estos valores podrían ser tomados como parte del seguimiento en el manejo de los pacientes con MAFLD y sobrepeso, especialmente en pacientes con S3 y AF medio mayor a 5,2319.
En algunos estudios se ha reportado que la BI tiende a sobreestimar la masa magra en pacientes con obesidad debido a que el tejido graso se asume como libre de agua y el cálculo de masa magra se obtiene restando el valor de la masa grasa al total del peso corporal. Esto pasa en pacientes con obesidad debido a que tienen mayor cantidad de agua libre extracelular, que se reporta como masa magra20. En la evaluación de la masa muscular observamos que el 6% de los pacientes evaluados mostraron puntuaciones por debajo del límite superior normal; sin embargo, cuando se realizó la comparativa por estadios de fibrosis no se encontró diferencia significativa en pacientes con y sin fibrosis. Aunque se ha determinado que las alteraciones en el AF y la presencia de sarcopenia en pacientes con cirrosis son determinantes del pronóstico, en nuestros pacientes no encontramos diferencias significativas en la disminución de la masa muscular con la presencia de fibrosis avanzada, lo cual puede ser explicado por la selección de la población. La fibrosis avanzada fue un hallazgo incidental y los pacientes se encontraron con enfermedad hepática avanzada compensada, pues ninguno había presentado complicaciones de la cirrosis, ni se evidenció por ultrasonido la presencia de ascitis. Por lo cual, esta disminución en la masa muscular puede estar dada por factores externos más que ser resultado de enfermedad hepática avanzada21.
El valor normal de AF se determina individualmente por cada paciente, de acuerdo con su IMC y grupo de edad. Se ha tratado de establecer puntos de corte de acuerdo a las características de la población estudiada. Bosy-Westphal et al.22 reportaron como valor normal para población sana valores entre 6° y 7°. En población mexicana contamos con pocos estudios sobre valores normales de AF. Espinosa-Cuevas et al.23 realizaron un análisis de BI en 439 sujetos sanos con IMC >18 y <31kg/m2 en el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán que mostró un AF medio de 7,3±0,9 en hombres y de 6,4±1,0 en mujeres. Por otro lado, Topete-Reyes et al.24 valoraron la relación entre el AF y el riesgo de desnutrición en pacientes con enfermedad renal crónica, y reportaron que en estado nutricional normal de esta población el valor del AF es de 5,2±1,0, y con deficiencia nutricional el valor es de 4,4±1,2 (p=0,002). Se cuenta con un estudio realizado en población china que en pacientes con NAFLD y sobrepeso reportó un AF de 5,53±0,66, vs 5,43±0,60 en pacientes sin NAFLD (p=0,04)11. En Brazil, Teixeira et al.25 analizaron 379 pacientes con NAFLD sometidos a cirugía bariátrica y reportaron un valor medio de AF de 5,89±0,62. En nuestra población con MAFLD se encontró una media de AF de 5,1±0,69 (en mujeres 4,92±0,62 y en hombres 5,41±0,70), sentando precedentes para poder establecer los valores de referencia del AF en este tipo de pacientes, ya que podemos observar importantes variaciones al compararlos con los establecidos en población sana mexicana. Otra de las recomendaciones es la de, debido a la variación observada entre los diferentes tipos de población, apoyarnos en los percentiles por edad e IMC.
Actualmente, la evidencia sigue apuntando a la dieta y al ejercicio como la piedra angular en el tratamiento de MAFLD. Cuando se establece un plan de tratamiento se debe considerar el equilibrio en la homeostasis corporal considerando los componentes que hemos evaluado en nuestros pacientes, que claramente están alterados en todo paciente con MAFLD, y es aquí donde la BI, con el análisis de los componentes corporales y el AF, cobra importancia en estadios tempranos de la enfermedad. Se han reportado diversas series en pacientes con NAFLD posterior a cirugía bariátrica que demuestran correlación directa con pérdida de peso, cambios en la composición corporal y disminución del AF26,27.
Es importante mencionar que la evaluación del AF por BI es una herramienta útil en la valoración nutricional de los pacientes con MAFLD. Sin embargo, tenemos que reconocer que nuestro estudio tiene como debilidades que no se contó con la medición de la circunferencia del brazo, del grosor del pliegue cutáneo del tríceps y de la circunferencia muscular del brazo medio para el completo análisis clínico, ni con un grupo control. Aunado a ello, se trata de una cohorte de pacientes con MAFLD de una región del estado de Veracruz, por lo que no es una población que pueda considerarse representativa nacional. Debemos recordar que el estándar de oro en la valoración de la presencia y de la severidad de la fibrosis y de la esteatosis en MAFLD es la biopsia hepática, lo cual no se realizó en nuestros pacientes, limitando la correlación de la elastografía con los hallazgos histológicos.
ConclusiónNuestros resultados muestran que los pacientes con MAFLD tienen valores de AF más bajos que los reportados previamente en población sana mexicana. En los pacientes sin fibrosis y con esteatosis severa por CAP se reportó una media del AF elevado de manera proporcional al incremento en la masa grasa y el IMC. Por otro lado, en presencia de fibrosis hepática el valor medio del AF disminuyó de manera significativa en estadios avanzados de fibrosis. Es por ello que se considera al AF como un marcador clínico alternativo en pacientes con MAFLD.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.