Colitis microscópica es un término genérico que incluye 2 formas principales, colitis colágena y colitis linfocítica, que describe una forma de enfermedad inflamatoria intestinal con curso crónico y recidivante. La incidencia de colitis microscópica es entre 2 y 8 veces más alta en mujeres que en hombres; sin embargo, la edad contribuye más que el sexo en el riesgo de colitis colágena (OR 8,3 para edad ≥65 vs. <65años y OR 2,8 para sexo femenino). El síntoma principal es la diarrea crónica acuosa, no sanguinolenta. Otros síntomas frecuentes incluyen el dolor abdominal (50-70%), lo que hace que muchos pacientes con colitis microscópica cumplan criterios de síndrome de intestino irritable. Hoy en día se recomienda la realización de una colonoscopia, con toma de biopsias escalonadas en todos estos pacientes, ya que el diagnóstico es principalmente histológico. La mucosa colónica suele ser macroscópicamente normal, aunque se han descrito alteraciones endoscópicas mínimas.
Microscopic colitis is a generic term that includes 2 main forms, collagenous colitis and lymphocytic colitis, and describes a form of inflammatory bowel disease with a chronic and relapsing course. The incidence of microscopic colitis is between 2 and 8 times higher in women than in men, although age, more than sex, increases the risk of collagenous colitis (odds ratio [OR] 8.3 for age ≥65 vs. <65 and OR 2.8 for women). The main symptom is chronic non-bloody watery diarrhoea. Other common symptoms include abdominal pain (50%-70%), with the result that many patients with microscopic colitis meet criteria for irritable bowel syndrome. Colonoscopy with multiple colonic biopsies is currently recommended, as histological changes are the main characteristic feature. The colonic mucosa is macroscopically normal, although certain minimal endoscopic abnormalities have been described.
Colitis microscópica (CM) es un término genérico que incluye 2 formas principales, colitis colágena (CC) y colitis linfocítica (CL), que describe una forma de enfermedad inflamatoria intestinal caracterizada por la triada:
- 1.
Diarrea acuosa sin sangre, crónica o intermitente.
- 2.
Mucosa de colon valorada por colonoscopia macroscópicamente normal o casi normal.
- 3.
Hallazgos histopatológicos característicos.
En 1993, un grupo de investigación francés y otro estadounidense sugirieron el uso de CM como un término genérico para cubrir cualquier tipo de colitis en la que existan alteraciones histológicas pero no endoscópicas o radiológicas. Más tarde se convirtió en el término genérico para las 2 principales entidades, conocidas como CC y CL1, que se caracterizan clínicamente por diarrea acuosa crónica sin sangre. De todas maneras, hay autores que consideran que la CC y la CL deberían considerarse como subtipos histológicos de una misma enfermedad y no como entidades diferenciadas2; este aspecto es aún motivo de controversia3.
Existen pocos datos sobre el curso clínico de los pacientes con CM, pero se considera que se caracteriza por diarrea crónica o intermitente y síntomas recurrentes. En la mayoría de los pacientes la mucosa colónica es macroscópicamente normal, pero pueden presentarse edema y eritema leves. Además, se han descrito ocasionalmente desgarros o fractura de la mucosa y alteración del patrón vascular, sobre todo en pacientes con CC. La CM se caracteriza por presentar hallazgos microscópicos diferenciados para CC y CL, específicos de cada entidad. Todos estos aspectos se comentan en detalle en los apartados siguientes.
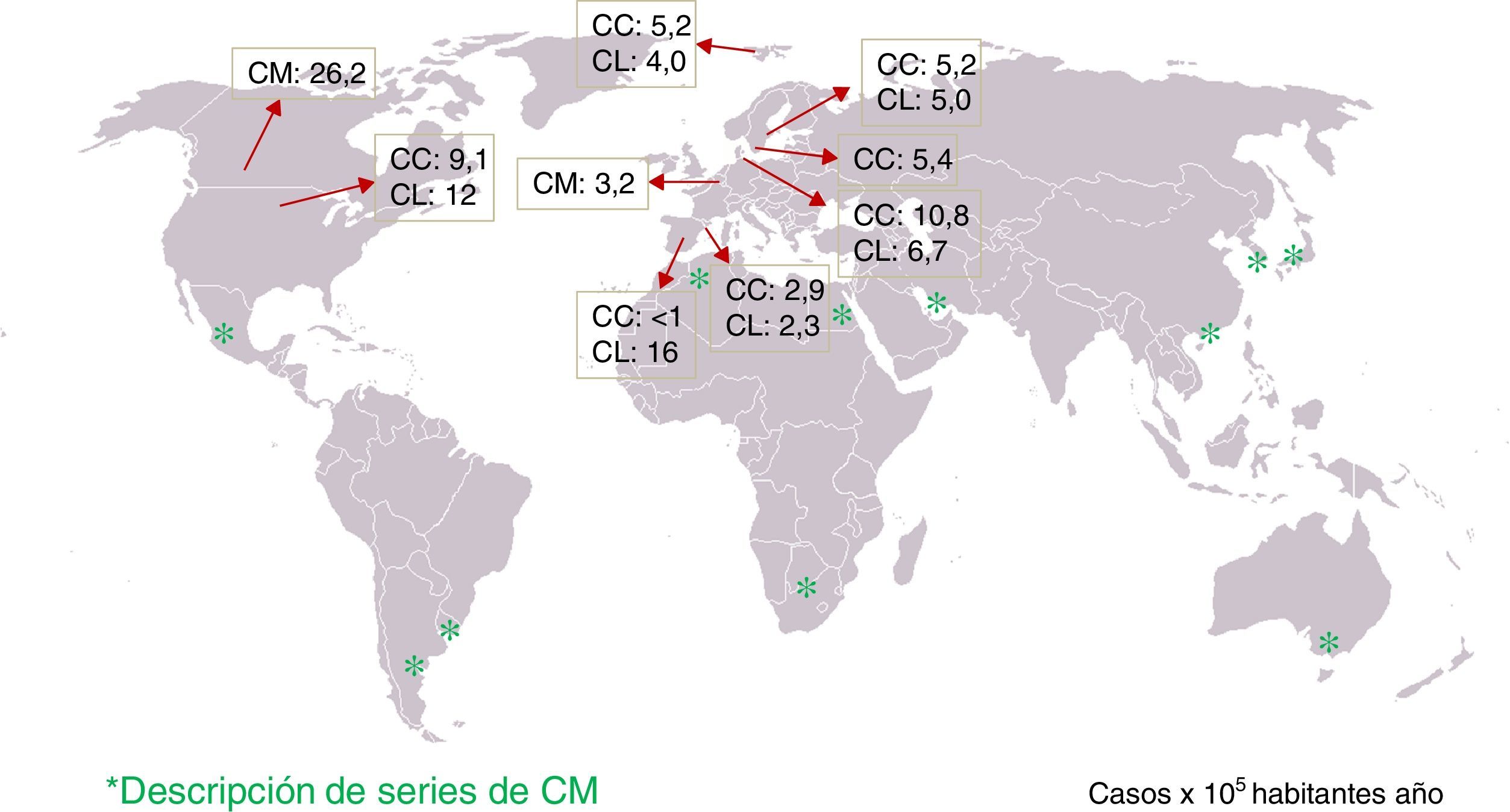
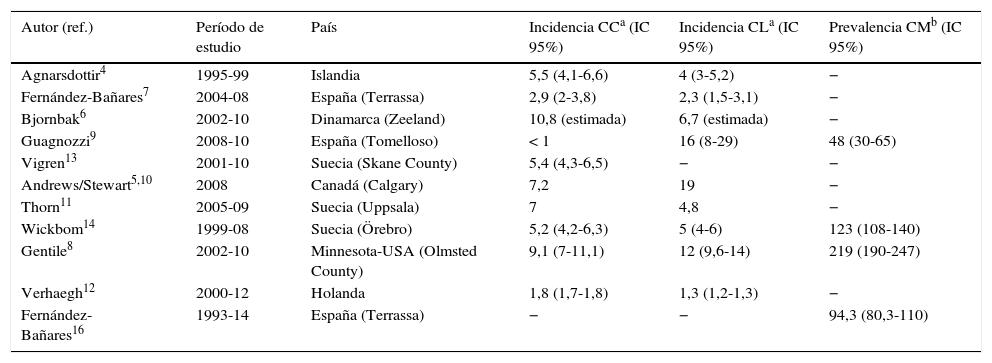
Epidemiología: incidencia de colitis microscópica y frecuencia en pacientes con diarrea crónicaSe han publicado 10 estudios de incidencia de CC y/o CL de base poblacional, realizados en 5 países europeos (Suecia, Islandia, Dinamarca, Holanda y España) y en 2 países de América del Norte (Estados Unidos y Canadá)4-14 (tabla 1). En cuatro de estos estudios se ha descrito la evolución de la incidencia a lo largo de varias décadas15-19. La incidencia de CC en el norte de Europa y América del Norte oscila de 5,2 a 10,8 (×100.000 habitantes año), mientras que en España es de <1 a 2,9. Lamentablemente, no existen más estudios efectuados en otros países del sur de Europa para mostrar que existen diferencias de incidencia norte-sur. Las cifras de incidencia de CL oscilan de 4 a 19 (×100.000 habitantes año) en el norte de Europa y América del Norte, y de 2,3 a 16 en España.
Estudios de incidencia y prevalencia de colitis colágena y colitis linfocítica de base poblacional. Se proporcionan solo los datos más recientes en los estudios que valoran la evolución de la incidencia7,8,10,14
| Autor (ref.) | Período de estudio | País | Incidencia CCa (IC 95%) | Incidencia CLa (IC 95%) | Prevalencia CMb (IC 95%) |
|---|---|---|---|---|---|
| Agnarsdottir4 | 1995-99 | Islandia | 5,5 (4,1-6,6) | 4 (3-5,2) | − |
| Fernández-Bañares7 | 2004-08 | España (Terrassa) | 2,9 (2-3,8) | 2,3 (1,5-3,1) | − |
| Bjornbak6 | 2002-10 | Dinamarca (Zeeland) | 10,8 (estimada) | 6,7 (estimada) | − |
| Guagnozzi9 | 2008-10 | España (Tomelloso) | < 1 | 16 (8-29) | 48 (30-65) |
| Vigren13 | 2001-10 | Suecia (Skane County) | 5,4 (4,3-6,5) | − | − |
| Andrews/Stewart5,10 | 2008 | Canadá (Calgary) | 7,2 | 19 | − |
| Thorn11 | 2005-09 | Suecia (Uppsala) | 7 | 4,8 | − |
| Wickbom14 | 1999-08 | Suecia (Örebro) | 5,2 (4,2-6,3) | 5 (4-6) | 123 (108-140) |
| Gentile8 | 2002-10 | Minnesota-USA (Olmsted County) | 9,1 (7-11,1) | 12 (9,6-14) | 219 (190-247) |
| Verhaegh12 | 2000-12 | Holanda | 1,8 (1,7-1,8) | 1,3 (1,2-1,3) | − |
| Fernández-Bañares16 | 1993-14 | España (Terrassa) | − | − | 94,3 (80,3-110) |
En los estudios que han valorado la evolución de la incidencia de CM se observa un aumento creciente de la frecuencia, tanto de CC como de CL, en las últimas décadas7,8,10,14. Esta observación podría ser debida tanto a un aumento real de incidencia como a un mayor conocimiento de la enfermedad20.
Diversos estudios epidemiológicos han demostrado que la incidencia de CM es entre 2 y 8 veces más alta en mujeres que en hombres4,7,14,19,21. Por otro lado, la CM es una enfermedad que se puede diagnosticar a cualquier edad, pero se ha observado de forma más frecuente en pacientes de edad avanzada4,6-19. Se ha sugerido que la edad contribuye más que el sexo en el riesgo de CC (OR8,3 para edad ≥65 vs. <65años y OR2,8 para sexo femenino)13 y que una edad ≥65años aumenta el riesgo de desarrollar CC/CL 4,1 veces (IC95%: 3,9-4,4 para CC e IC95%: 3,8-4,4 para CL)12. Por último, se ha descrito que el 25% de los pacientes con CC tienen menos de 45años de edad al diagnóstico15, y se han descrito casos de CM en población pediátrica22-26.
Por otro lado, diferentes estudios han determinado la frecuencia del diagnóstico de CM en los pacientes con historia de diarrea crónica o intermitente acuosa sin sangre y colonoscopia normal en los que se hayan excluido otras causas de la misma, observándose CM en un 4-29% de los casos7,9,16-18,27-36. Sin embargo, los protocolos diagnósticos antes de realizar la colonoscopia con toma de biopsias no están descritos en la mayoría de los estudios y, por tanto, estos pueden no ser comparables. Asimismo, las causas de diarrea crónica pueden ser distintas según las áreas geográficas. Sin embargo, es de destacar que se han descrito casos de CM en prácticamente todas las zonas del mundo (fig. 1). La frecuencia de CM en pacientes con diarrea crónica acuosa aumenta al aumentar la edad del paciente; así, la frecuencia de CM en hombres de más de 70años o en mujeres de más de 50años es de alrededor del 20% en 2 estudios, con frecuencias de CM del 9,5 y del 13,7% si consideramos toda la franja de edad9,17.
Avances en el diagnósticoDiagnóstico clínicoCuadro clínico: síntoma guíaComo se ha comentado, el síntoma principal de la CM es la diarrea crónica acuosa, no sanguinolenta y que puede ser recurrente o intermitente. Otros síntomas frecuentes incluyen dolor abdominal (50-70%), diarrea nocturna (25-50%), meteorismo, urgencia defecatoria (70%), incontinencia (40%), pérdida de peso (hasta un 50%) y fatiga (50-60%)37-39. La clínica puede aparecer meses antes de que se establezca el diagnóstico, dado su similitud con un cuadro funcional (ver más adelante). En un 40% de los pacientes el cuadro es de inicio agudo40. No existe un síntoma específico que discrimine entre CL y CC, por lo que su caracterización es puramente histológica.
Evolución clínicaLa evolución clínica de la CM es benigna, con brotes intermitentes de diarrea en la mayoría de casos. Únicamente un 10-15% de los pacientes presentan diarrea crónica diaria persistente, si bien esto se conoce a partir de estudios con un seguimiento limitado o un tamaño muestral reducido41-43. Se sugiere que la CL tiene un curso más leve y con mayor tendencia a la remisión espontánea en comparación con la CC44. Aunque la CM es una enfermedad benigna, se han descrito infrecuentes casos de perforación colónica, tanto espontánea como tras la colonoscopia, que podrían guardar relación con la presencia de desgarros o fracturas mucosas que pueden observarse durante la colonoscopia (ver más adelante)45-48. Por otra parte, la CM no presenta mayor riesgo de cáncer colorrectal, por lo que no se requiere cribado específico en estos pacientes35,49-51.
La CM se asocia con determinadas enfermedades autoinmunes hasta en un 50%38. La enfermedad más habitual como comorbilidad en la CM es la celiaquía, presente hasta en un 20%, y siendo hasta 50 veces más probable de encontrar en pacientes con CM que en la población general11. Esto se tendría que tener en cuenta en pacientes con CM y respuesta inadecuada al tratamiento específico. Otras enfermedades que son más prevalentes en la CM que en la población general son diabetes mellitus tipo1, tiroiditis autoinmune, artritis reumatoide, síndrome de Sjögren, síndrome de Raynaud o psoriasis52.
Diagnóstico endoscópicoEn la CM la apariencia del colon es normal, como su propio nombre indica, pero ocasionalmente se pueden visualizar cambios leves de la mucosa como eritema, edema o un patrón vascular alterado. No se puede realizar un diagnóstico por los hallazgos endoscópicos, aunque se están describiendo de forma cada vez más frecuente alteraciones mucosas típicas de esta entidad.
A un paciente con diarrea crónica acuosa sin sangre se le debe realizar idealmente una colonoscopia completa con intubación de íleon terminal. Si la exploración es normal se deben realizar biopsias múltiples de los diferentes segmentos del colon. Aunque algún estudio ha demostrado que la mayoría de pacientes con CM se pueden identificar a partir de muestras de colon distal27, otros han demostrado que la afectación puede ser parcheada y podríamos dejar de diagnosticar a pacientes con alteración predominante a nivel de colon proximal53-55. Los cambios detectados sobre todo en la CC suelen ser más intensos en el colon derecho, y además puede haber solapamiento entre ambas formas de CM. Asimismo, la histología normal del colon derecho es diferente del colon izquierdo56. Todo esto apoya la estrategia diagnóstica de toma de biopsias de diferentes segmentos del colon y el etiquetado de las muestras de forma separada37. Se recomienda obtener un mínimo de 8 biopsias a lo largo de todo el colon (al menos 4 biopsias de colon proximal y otras 4 biopsias de sigma descendente)57-59.
En la CM no se recomienda la realización de endoscopias de seguimiento. Únicamente estaría indicada su realización en pacientes con una enfermedad refractaria para poder excluir otras causas de diarrea crónica60.
Hallazgos endoscópicosA pesar de ser una causa frecuente de diarrea crónica, hay pocos artículos que traten sobre los hallazgos macroscópicos que podemos encontrar en la colonoscopia. En los últimos años se han publicado algunos artículos que muestran alteraciones características o patognomónicas de la CM, en especial de la CC. Los hallazgos típicos de la CC son la alteración del patrón vascular, la nodularidad de la mucosa y una secuencia de cambios que van desde defectos mucosos hasta lesiones cicatriciales. En una revisión sistemática se ha propuesto la categorización de estas lesiones para homogeneizar su descripción en futuros artículos61. Se han descrito 4 categorías:
- 1.
Pseudomembranas.
- 2.
Alteración del patrón vascular de la mucosa en un grado variable, que va desde la amputación de vasos hasta un patrón vascular aumentado con una red de capilares tortuosos.
- 3.
Anormalidades de la mucosa: manchas rojas, nodularidad de la mucosa, alteración de la textura, que pueden ser evidentes con o sin cromoendoscopia. El patrón en mosaico o mucosa nodular (mucosa en panal de abeja) presenta un OR de 19,4, con una especificidad >99% para el diagnóstico de CC.
- 4.
Defectos de la mucosa:
- -
Laceraciones mucosas longitudinales, superficiales (cat scratch colon) o profundas, que son frescas, hemorrágicas.
- -
Fracturas mucosas (profundas ocasionalmente con exposición de la muscularis mucosa).Los defectos mucosos en la CM presentan unos márgenes abruptos que permiten diferenciar estas lesiones de la colitis isquémica. Estos defectos se ven de forma más frecuente en el colon ascendente como resultado de una agresión como es la instrumentación o la insuflación de aire, debido a la presencia de una capa gruesa disfuncionante de colágeno tipoiii asociado a un diámetro del colon aumentado en este segmento. Estos hallazgos no son específicos de la CC y se han descrito en el colon normal atribuyéndose a barotrauma por insuflación excesiva, en la colitis por exclusión e incluso en pacientes con colestasis crónica. Cuando se observan estas lesiones, el riesgo de perforación durante la colonoscopia es más elevado y se produce de forma preferente en el colon ascendente47,48.
- -
Lesiones cicatriciales de la mucosa, que han sido vistas tanto en la colonoscopia índice como en el seguimiento. Se han descrito tanto cicatrices hipertróficas como líneas finas.
- -
Se desconoce cuál es la prevalencia real de las alteraciones visualizadas en la endoscopia, ya que se estima una prevalencia del 1% para las lesiones más importantes, pero seguramente es mayor. La presencia de edema, de eritema y un patrón vascular alterado se han descrito con una prevalencia de hasta el 30%. La presencia de úlceras lineales en el colon se ha asociado de forma independiente con el uso de AINE y el grosor de la banda colágena; también se han descrito de forma más frecuente en pacientes con antecedente de ingesta de lansoprazol62.
A pesar de que las lesiones macroscópicas son más frecuentes en la CC, recientemente se ha publicado un estudio de 14 casos de CL en el que hallaban alteraciones macroscópicas en 7 pacientes (hipervascularización en 6 pacientes, hemorragia exudativa en 3 pacientes y un paciente con edema de la mucosa y pérdida del patrón vascular). Además estos pacientes con alteraciones en la endoscopia tenían una diarrea más grave y el antecedente de tratamiento con AAS o inhibidores de la bomba de protones63.
Dado que en la mayor parte de casos no se encuentran alteraciones, o estas son poco evidentes, los endoscopistas deberían buscar activamente cambios en la mucosa para dirigir sus biopsias. Los nuevos colonoscopios de alta definición, que permiten ver imágenes más nítidas y que tienen capacidad de zoom, nos permitirían la visión de estas alteraciones64. Disponemos de datos escasos sobre si el uso de cromoendoscopia con índigo carmín para identificar cambios de la mucosa en la CM aporta ventajas a la visión directa. Se ha utilizado la tinción con índigo carmín en algunos casos para mejorar la identificación de lesiones, y parece útil en el contexto de cambios sutiles de la mucosa o en la visualización de un patrón vascular alterado. Con esta técnica se puede visualizar un patrón en mosaico en la CL y un patrón nodular, con surcos en la CC, por lo que hipotéticamente podrían aumentar el rendimiento diagnóstico de la endoscopia al poder realizar biopsias dirigidas65,66. En el momento actual su utilidad parece limitada, dado que alarga el tiempo de la exploración y existe poca experiencia.
La endomicroscopia es una técnica que combina la endoscopia normal con luz blanca con un microscopio confocal que permite el examen microscópico de la superficie del epitelio y así poder realizar el diagnóstico in vivo en algunas patologías. Se ha utilizado en el diagnóstico del epitelio de Barrett, la celiaquía, la enfermedad inflamatoria intestinal y también en la CM. En la CM permite la localización y medición de la banda de colágeno, posibilitando la toma de biopsias dirigidas67,68; en la CL se puede observar el aumento del infiltrado de linfocitos en la lámina propia. No sabemos qué papel pueden tener estas técnicas en el futuro, dado que su uso no está extendido y actualmente se limitan a la investigación.
Diagnóstico histológicoLa CC y la CL son 2 entidades clinicopatológicas definidas mediante criterios histológicos que se caracterizan básicamente por la existencia de lesiones en la interfase estroma-epitelio. A continuación se comentan los criterios morfológicos para el diagnóstico de las 2 formas de CM, que se encuentran resumidos en la tabla 21,16,38,60,69-75.
Hallazgos histológicos clave en la colitis colágena y la colitis linfocítica87
| Parámetro | Colitis colágena | Colitis linfocítica |
|---|---|---|
| Linfocitos intraepiteliales | < o >20 por 100 células epiteliales | > 20 por 100 células epiteliales |
| Epitelio de superficie | Alteración marcada (aplanamiento, desprendimiento) | Alteración leve (vacuolización, aplanamiento y depleción de mucina) |
| Banda colágena subepitelial | Engrosamiento (≥ 10 micras) (más prominente en colon derecho; en rectosigma puede ser normal) | Puede existir un engrosamiento (< 10 micras) |
| Infiltrado inflamatorio en lámina propia | Aumento del infiltrado (linfocitos y células plasmáticas) (con distribución homogénea a lo largo del colon) | |
| Arquitectura de las criptas | Ausencia o escasa distorsión | |
| Cambios focales tipo EII | Ocasional criptitis y metaplasia de células de Paneth | |
EII: enfermedad inflamatoria intestinal.
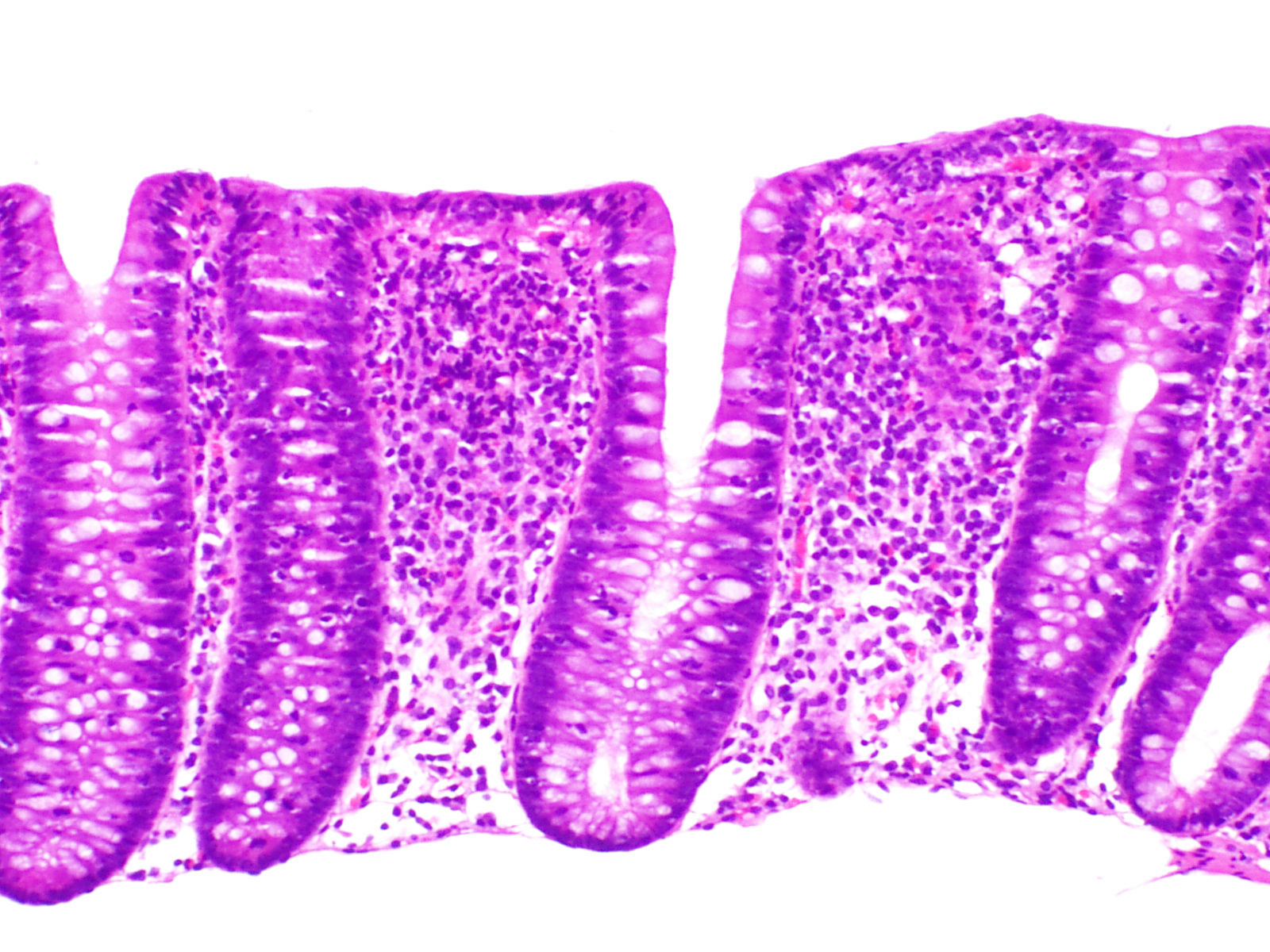
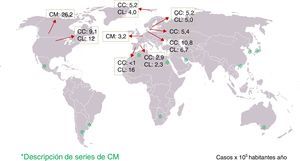
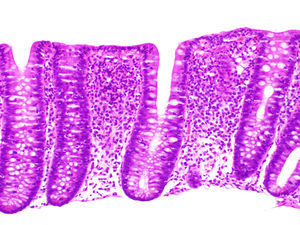
El hallazgo histológico indispensable para el diagnóstico es el aumento de linfocitos intraepiteliales. La mayoría de autores establecen un mínimo de 20 linfocitos por 100 células epiteliales (normal <5%), aunque en la mayor parte de los casos se supera ampliamente esta cifra. Esta cifra ha sido adoptada recientemente en el Consenso Europeo en Histopatología de Enfermedad Inflamatoria Intestinal1. En secciones teñidas con hematoxilina-eosina los linfocitos intraepiteliales se caracterizan por un núcleo redondeado de cromatina densa y halo claro perinuclear (fig. 2).
El recuento de linfocitos debe hacerse en secciones bien orientadas y en espacios entre criptas, sin valorar el epitelio de la desembocadura de las criptas1,37. Los linfocitos intraepiteliales, tanto en la CC como en la CL, son T CD8+ y expresan los receptores habituales de los linfocitosT periféricos, mostrando el mismo inmunofenotipo que los linfocitos intraepiteliales de la mucosa normal76. Por tanto, aunque no suele ser necesario, una tinción inmunohistoquímica para CD3, que es un marcador genérico de linfocitosT, puede ser útil para facilitar el recuento de los linfocitos intraepiteliales en la CM.
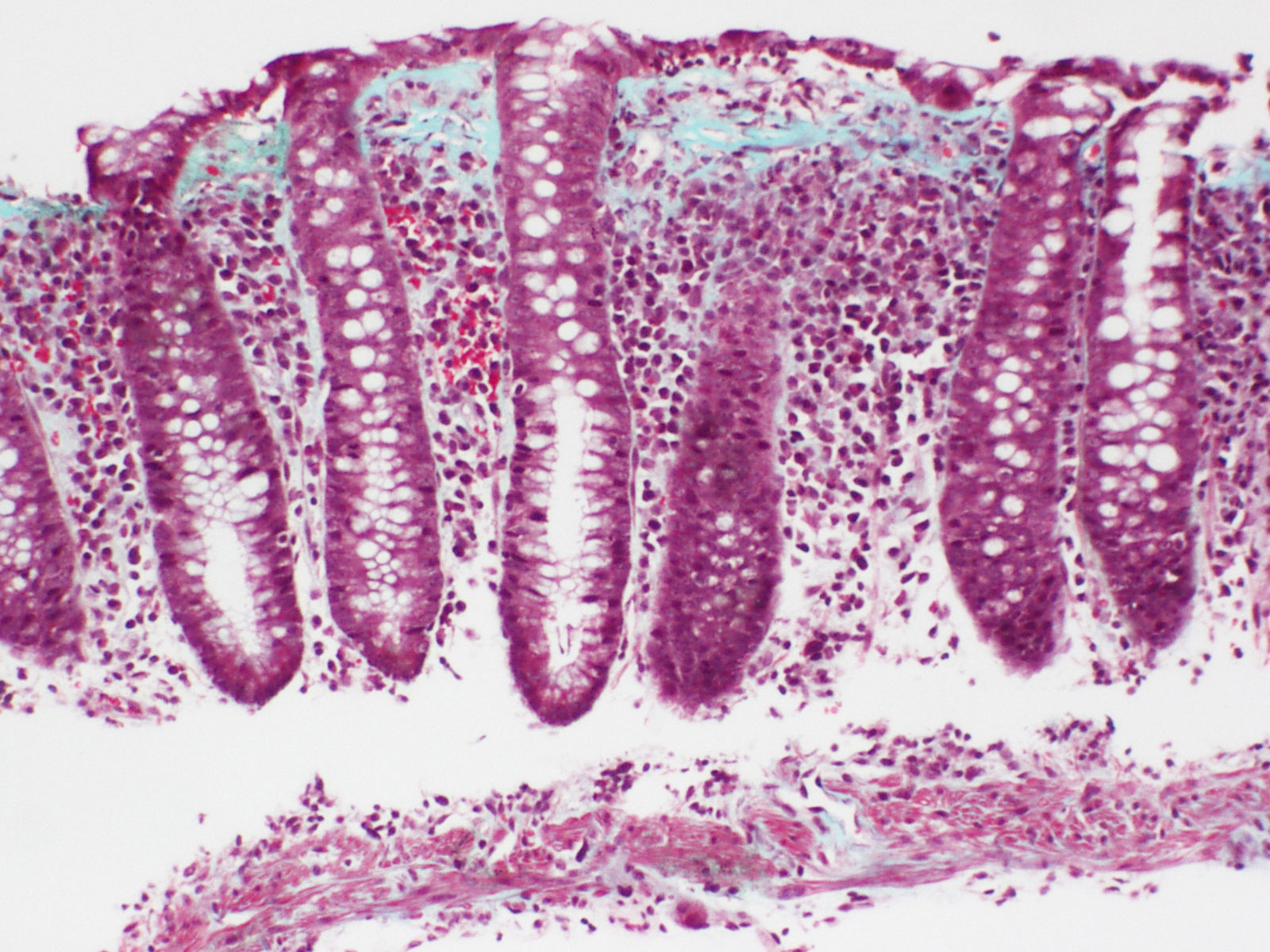
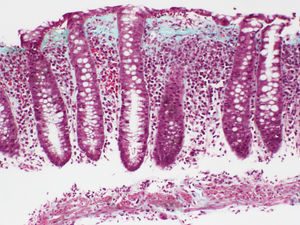
Colitis colágenaEl hallazgo histológico indispensable para el diagnóstico es la presencia de un depósito irregular de colágeno, formando una banda inmediatamente por debajo del epitelio de superficie de la mucosa, subyacente a la membrana basal, con un grosor igual o superior a 10μm (normal <3μm), según el Consenso Europeo en Histopatología de Enfermedad Inflamatoria Intestinal1 (fig. 3).
Habitualmente supera las 10μm, pudiendo alcanzar en algunos casos un grosor de más de 50μm. Usualmente no se extiende alrededor de las criptas y tiene una apariencia irregular, desflecada en su borde profundo, y puede contener capilares atrapados, células sanguíneas y células inflamatorias, a diferencia del límite neto y rectilíneo de la membrana basal en el colon normal. Esta alteración cualitativa del depósito de colágeno subepitelial ha sido considerada, por algunos autores, más importante para el diagnóstico que el propio espesor de la banda69. En la mayoría de los casos, el diagnóstico puede establecerse sin problemas con tinciones con hematoxilina-eosina. En casos borderline, tinciones adicionales del colágeno (p.ej., tricrómico) o inmunotinciones con tenascina pueden ser de gran ayuda en el diagnóstico.
Con técnicas de inmunohistoquímica esta banda contiene colágeno tipoi, iii y vi, así como tenascina. Tinciones para componentes de membrana basal, tales como colágeno tipoiv y laminina, no muestran tinción, confirmando que no se trata de una membrana basal gruesa sino de un depósito anormal por debajo de la membrana basal.
Es muy importante tener en cuenta que el grosor de la banda solo se puede medir en secciones bien orientadas, perpendicularmente a la superficie de la mucosa (conteniendo criptas seccionadas longitudinalmente), ya que en cortes mal orientados se puede interpretar erróneamente como engrosamiento una sección tangencial de la membrana basal69. El grosor es variable y su distribución no es homogénea a lo largo del colon en un mismo paciente, siendo habitualmente más manifiesta en el colon derecho, pudiendo disminuir o llegar a faltar en las porciones distales55,77,78. Esta circunstancia obliga a practicar múltiples biopsias escalonadas del colon para descartar una CC. Esta heterogeneidad en la distribución de las lesiones en la CC, con predominio en el colon derecho, no se manifiesta en la CL, en la que los cambios inflamatorios se distribuyen habitualmente de forma uniforme a lo largo de todo el colon1,16,38,70.
Asimismo, se observa un aumento del número de linfocitos intraepiteliales, aunque no tan elevado como en la CL, y no es esencial para el diagnóstico.
Aspectos histológicos comunesEl número de linfocitos intraepiteliales suele estar aumentado por encima del 20% en la CC, de forma similar a la CL73,79. Algunos autores consideran que, si se cumplen todos los otros criterios, se puede hacer el diagnóstico de CC incluso con cifras de linfocitos intraepiteliales inferiores al 10%73.
La celularidad de la lámina propia se halla aumentada difusamente. El infiltrado inflamatorio está formado mayoritariamente por linfocitos, células plasmáticas y eosinófilos. Algunos autores han descrito mayor presencia de eosinófilos en la CC que en la CL69,79, pero existe gran variabilidad, por lo que la mayor o menor cantidad de eosinófilos en la mucosa no es un criterio útil de diagnóstico diferencial. La presencia de algunos neutrófilos no excluye el diagnóstico, pero cuando existe atrofia o distorsión glandular y se observan neutrófilos lesionando el epitelio de las criptas, hay que considerar la posibilidad de una enfermedad inflamatoria intestinal, incluso en ausencia de manifestaciones endoscópicas y radiológicas.
El epitelio de superficie muestra cambios degenerativos y/o regenerativos, como vacuolización, aplanamiento y pérdida de mucina. El daño del epitelio de superficie, necesario para el diagnóstico de las 2 entidades, puede variar de intensidad en diferentes casos e incluso entre distintas zonas del colon en un mismo paciente. El daño epitelial suele ser más difuso en la CL; sin embargo, el desprendimiento del epitelio es más frecuente en la CC, no siendo raro encontrar algunas muestras en las que el epitelio de superficie está totalmente denudado, dejando expuesta la banda de colágeno69-71.
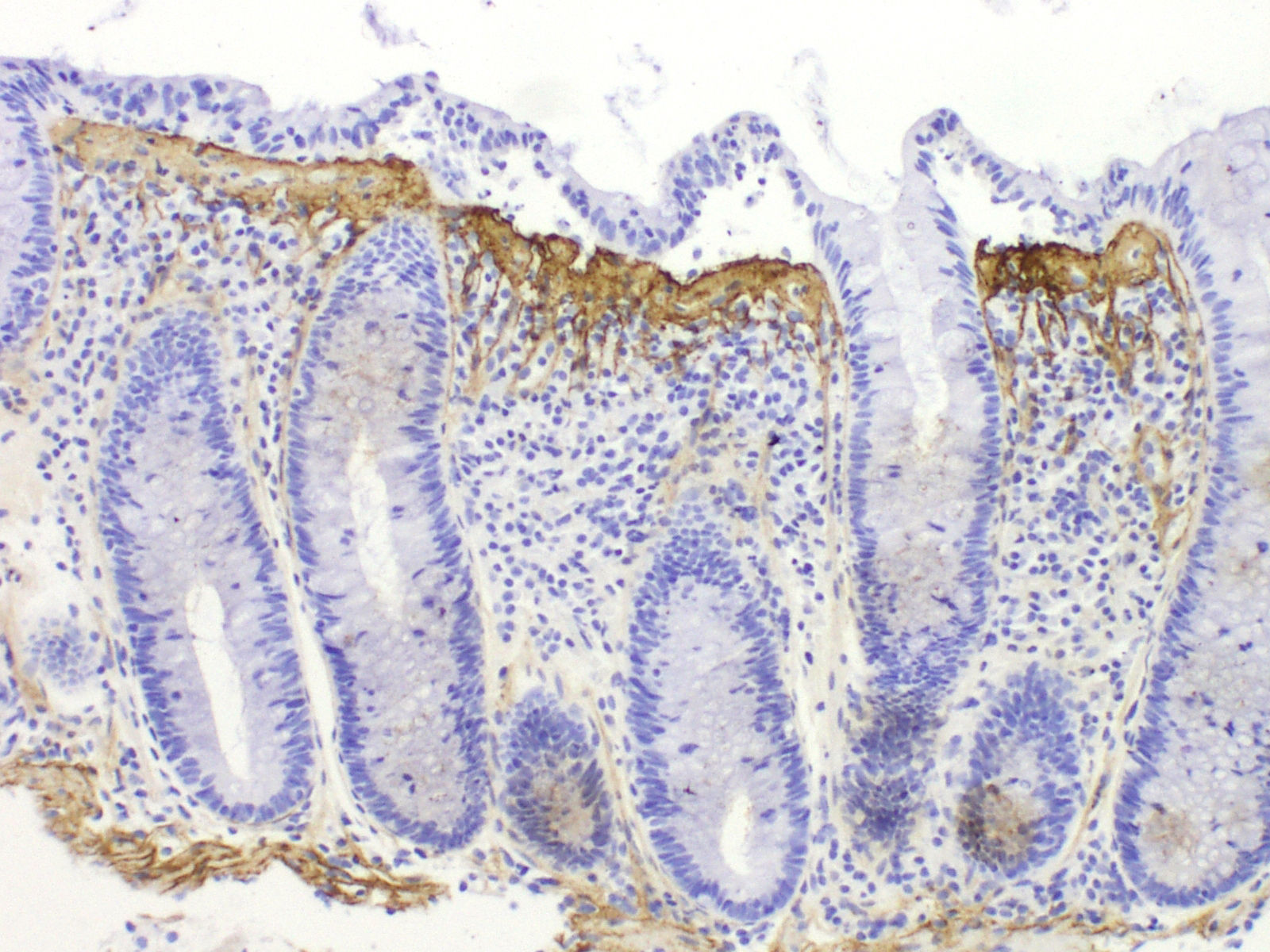
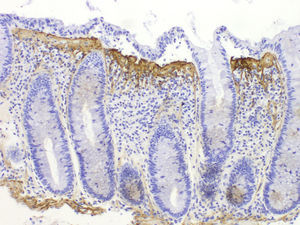
Diagnóstico histológico diferencialLa banda de colágeno subepitelial, aunque necesaria para el diagnóstico, no es criterio suficiente, ya que se puede observar engrosamiento de la capa de colágeno subepitelial en otras circunstancias, como en casos de megacolon, diverticulosis, pólipos hiperplásicos o mucosa no neoplásica en pacientes con carcinoma de colon. Por tanto, es imprescindible para el diagnóstico la presencia de la banda de colágeno junto con los otros criterios de inflamación crónica y un adecuado contexto clínico. La inmunotinción para tenascina puede ser útil en casos dudosos37,80 (fig. 4). Se ha sugerido que la acumulación de tenascina selectiva en la zona subepitelial se observa exclusivamente en la CC, mientras que en otras formas de colitis puede haber depósitos de tenascina en la matriz intercriptal81. La única entidad que presentó depósitos de tenascina subepitelial en el límite de la normalidad o algo engrosados fue la colitis isquémica, pero a diferencia de la CC estos casos presentaban depósitos también en la zona intercriptal (fibrosis de lámina propia).
Para poder valorar adecuadamente la banda subepitelial siempre es obligada la tinción de rojo Congo para descartar una acumulación subepitelial de sustancia amiloide, que en las tinciones de rutina tiene un aspecto similar al de la banda de CC.
En la CM, tanto en CC como CL, puede existir inflamación activa en las criptas con ocasionales abscesos de criptas, pero de forma focal y leve, y no predominar en el infiltrado inflamatorio. El contexto clínico y endoscópico es de gran ayuda para diferenciar la CM de la enfermedad inflamatoria intestinal.
Formas incompletas y atípicas de colitis microscópicaEl término de CM incompleta (CMi) se ha utilizado para describir aquellos pacientes con una presentación clínica similar a la CM clásica pero que no alcanzan a cumplir los criterios histológicos de CC o CL (tabla 3). Este concepto es nuevo y está sujeto a controversia. Hay estudios en marcha que están reevaluando esta entidad y la respuesta al tratamiento.
Variantes incompletas y atípicas de las colitis microscópicas
| Colitis microscópicas incompletas |
| Colitis linfocítica incompleta (sinónimos, colitis linfocítica paucicelular, colitis microscópica NOS) Aumento de linfocitos intraepiteliales (> 5 y < 20%) Infiltrado inflamatorio crónico en lámina propia |
| Colitis colágena incompleta Banda colágena subepitelial (> 5 y < 10μm) Infiltrado inflamatorio crónico en lámina propia |
| Variantes atípicas de colitis microscópica: |
| Colitis linfocítica criptal |
| Colitis linfocítica con células gigantes |
| Colitis colágena con células gigantes |
| Colitis colágena con pseudomembranas |
En los últimos años se han descrito nuevas entidades que se han denominado formas atípicas de CM82 (tabla 3). Muchas de ellas son variantes de las formas clásicas de CC y CL, como la variante criptal de la CL83 con exocitosis linfocitaria en las criptas y no en el epitelio de superficie, la CC pseudomembranosa84,85 y la CC con células gigantes86. Hay que destacar que estas formas son extremadamente raras y que es poco probable que constituyan entidades específicas.
Variabilidad inter e intraobservador de los criterios histológicosLa utilidad de los criterios diagnósticos de CM utilizando hematoxilina-eosina se ha evaluado en 2 estudios que miden la variabilidad intra e interobservador. En uno se analizó la variabilidad interobservador a partir de biopsias de 90 pacientes (20 CC, 20 CL, 20 EII y 30 normales). Cuatro patólogos especializados en gastroenterología clasificaron a ciegas y de forma independiente las 90 biopsias como CC, CL, colitis crónica, colitis activa focal, mucosa normal y otras. El grado de concordancia interobservador para las 6 categorías fue aceptable (k=0,68 a 0,78). Considerando las CM frente a las otros tipos de colitis el grado de concordancia fue muy bueno (k=0,80-0,95). El acuerdo intraobservador fue también bueno para las 6 categorías (k=0,75-0,79) y mejor al diferenciar las CM de las otras colitis (k=0,84-0,91)87. En el otro estudio se incluyeron biopsias de 125 pacientes con diagnósticos de CC, CL, CMi, colitis inespecífica/EII y biopsias normales. El acuerdo interobservador entre 3 patólogos con diferente experiencia para diferenciar CM (CC, CL y CMi) de formas inespecíficas/EII y biopsias normales fue bueno (k=0,81-0,89). La diferenciación entre CC, CL y CMi supuso menor grado de concordancia interobservador (k=0,60-0,75), fundamentalmente debido a una concordancia entre las 2 evaluaciones peor en los pacientes con CMi88.
Diagnóstico con marcadores biológicosLos marcadores fecales han demostrado ser de utilidad para detectar organicidad en el estudio de pacientes con diarrea crónica, dado que determinan la presencia de inflamación de forma precisa89,90. Con esta premisa, diversos estudios han valorado el beneficio del uso de marcadores fecales para el cribado de CM89-91. El marcador más utilizado ha sido la calprotectina fecal, aunque las diversas series que lo han estudiado incluyen un número muy escaso de pacientes y, por otro lado, los métodos y los puntos de corte utilizados son diferentes, lo que es una limitación de la calprotectina de forma general. Existen además resultados contradictorios. Así, mientras que hay estudios en que un 60-75% de los pacientes con CC activa muestran niveles elevados de calprotectina fecal89,92-94, en otro estudio no se encuentran diferencias entre CC activa y un grupo control con diarrea crónica acuosa91.
Ante estos resultados poco alentadores se han estudiado otros marcadores fecales que resultan prometedores. En este sentido, se sugiere que la proteína catiónica fecal de eosinófilos (EPC) podría discriminar mejor la actividad clínica que la calprotectina fecal93. La triptasa, la proteínaX eosinofílica y la mieloperoxidasa también podrían diferenciar la CM (sobre todo la CC) del SII95. De todas formas, faltan estudios prospectivos, incluyendo la CL, y con mayor número de pacientes evaluados para poder intentar que los marcadores fecales sean añadidos en el estudio rutinario de diarrea crónica ante la sospecha clínica de CM. Otro punto relevante y que no ha sido demostrado es la utilidad de los marcadores fecales en el seguimiento de estos pacientes.
Diagnóstico diferencial en el paciente con diarrea crónica acuosa sin sangreLa diarrea crónica acuosa sin sangre es el síntoma principal de la CM, que, como hemos mencionado, puede asociarse a dolor abdominal hasta en un 50-70% de los pacientes. Este cuadro clínico puede ser indistinguible del que presentan los pacientes con síndrome de intestino irritable (SII) con predominio de diarrea (SII-D)37-39. De hecho, el 38-58% de los pacientes con CM pueden cumplir criterios de SII96. La presencia de diarrea nocturna raramente aparece en el SII-D, lo que puede ser de utilidad a la hora de distinguir entre estas entidades. De todas maneras, la diarrea debida a trastornos funcionales (SII-D y diarrea funcional) es hasta 100 veces más frecuente que la secundaria a CM97. Esto hace que el diagnóstico de CM deba basarse en parámetros histológicos y no tan solo clínicos, siendo obligada la realización de una colonoscopia con toma de biopsias en todos los pacientes que se presenten como SII-D o diarrea funcional, para descartar la presencia de CM, para la cual disponemos de un tratamiento eficaz91. Es por esto que se han intentado encontrar factores clínicos asociados a la presencia de CM que sirvan como factores predictivos y justifiquen la realización de un estudio completo mediante colonoscopia y biopsias. Con este objetivo se han llevado a cabo 2 estudios, uno prospectivo multicéntrico francés98 y otro retrospectivo inglés99. En ambos estudios se sugiere que la presencia de una edad mayor de 50años, la pérdida de peso y la reciente introducción de nueva medicación (predominantemente inhibidores de la bomba de protones y fármacos para el tratamiento de la enfermedad de Parkinson) se asocia con un mayor riesgo de CM. El estudio prospectivo multicéntrico francés además añade la presencia de diarrea nocturna y de comorbilidades autoinmunes98. Los autores del estudio inglés elaboran un score diagnóstico con el objetivo de reducir costes innecesarios en pacientes con bajo riesgo de CM99. De todas formas, este score se basa en los hallazgos de un estudio retrospectivo y no ha sido comprobado en cohortes prospectivas, lo que limita su utilidad100. A pesar de ello, si la sospecha clínica de CM es alta, por la presencia de los factores de riesgo mencionados, o no existe una adecuada respuesta al tratamiento sintomático de un cuadro catalogado como SII-D, estaría justificada la realización de una colonoscopia con toma de biopsias escalonadas.
ConclusionesLa CM es una enfermedad frecuente en pacientes con edad avanzada que está infradiagnosticada en nuestro medio. El síntoma principal de la CM es la diarrea crónica acuosa, no sanguinolenta, que con frecuencia se asocia a una alteración importante de la calidad de vida el paciente. Hoy en día, el diagnóstico de la CM se efectúa histológicamente a partir de biopsias de la mucosa colónica. Por ello, es imprescindible realizar una colonoscopia hasta el ciego con toma de biopsias escalonadas en todos los pacientes con diarrea crónica acuosa, a pesar de que tengan características que sugieran funcionalidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.