Infliximab biosimilar (CT-P13) ha sido aprobado para las mismas indicaciones que infliximab original (Remicade®); sin embargo, hay pocos datos clínicos sobre el intercambio en la enfermedad inflamatoria intestinal (EII). El objetivo del estudio fue evaluar la eficacia, la seguridad, el perfil de biodisponibilidad y los factores asociados a la recidiva tras el intercambio a infliximab biosimilar en pacientes con EII en remisión clínica.
Material y métodosEstudio observacional con pacientes con EII tratados con Remicade® durante al menos 6 meses y en remisión clínica durante al menos 3 meses, a los que se realizó el intercambio a infliximab biosimilar. Se evaluó la incidencia de recidiva, los efectos adversos y los cambios en la biodisponibilidad del fármaco (niveles y anticuerpos).
ResultadosSe incluyeron 36 pacientes (63,9% EC), con una media de seguimiento de 8,4 meses (±3,5). El 13,9% presentaron recidiva clínica. El mayor tiempo de remisión clínica previo al intercambio (HR=0,54; IC 95%=0,29-0,98; p=0,04) y niveles de infliximab detectables en el momento del intercambio (HR=0,03; IC 95%=0,001-0,89; p=0,04) se asociaron a menor riesgo de recidiva. No hubo diferencias entre niveles de infliximab en el momento del intercambio y en las semanas 8 y 16 (p=0,94). El 8,3% presentaron algún efecto adverso, requiriendo suspensión del fármaco en un paciente por neumonía grave.
ConclusiónEl intercambio a infliximab biosimilar en una cohorte de vida real de pacientes con EII en remisión clínica no parece tener un impacto significativo en los resultados clínicos a corto plazo. Los factores asociados con la recidiva fueron similares a los esperados en pacientes que continúan con Remicade®.
The biosimilar of infliximab (CT-P13) has been approved for the same indications held by the infliximab reference product (Remicade®); however, there are few clinical data on switching in inflammatory bowel disease (IBD). The aim of this study was to assess the efficacy, safety, bioavailability profile and factors associated with relapse after switching to biosimilar infliximab in IBD patients in clinical remission.
Material and methodObservational study with IBD patients treated with Remicade® for at least 6 months and in clinical remission for at least 3 months who switched to infliximab biosimilar. The incidence of relapse, adverse effects and possible changes in drug bioavailability (trough level and antidrug antibodies) were evaluated.
ResultsThirty six patients were included (63.9% CD) with a mean follow-up of 8.4 months (SD±3.5). The 13.9% had clinical relapse. The longer clinical remission time before switching (HR=0.54, 95% CI=0.29-0.98, P=.04) and detectable infliximab levels at the time of switching (HR=0.03, 95% CI=0.001-0.89, P=.04) were associated with a lower risk of relapse. No differences were found between infliximab levels at the time of switching and at weeks 8 and 16 (P=.94); 8.3% of the patients had some adverse event, requiring the suspension of biosimilar in one patient for severe pneumonia.
ConclusionSwitching to biosimilar infliximab in a real-life cohort of IBD patients in clinical remission did not have a significant impact on short-term clinical outcomes. The factors associated with relapse were similar to those expected in patients continuing with Remicade®.
La enfermedad inflamatoria intestinal (EII) y sus dos principales formas clinicopatológicas, la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), se caracterizan por la inflamación crónica del tracto gastrointestinal en la que alternan periodos imprevisibles de actividad con otros periodos de remisión1. El factor de necrosis tumoral (TNF) juega un papel importante en la patogenia de ambas enfermedades y sus niveles séricos se incrementan cuando existe actividad2. Su bloqueo mediante fármacos anti-TNF ha supuesto un antes y un después en el pronóstico de los pacientes con EII. Infliximab (Remicade®) fue el primer anti-TNF aprobado para su uso clínico y existe evidencia que demuestra su seguridad y eficacia para inducir y mantener la remisión en pacientes con EII3,4. Remicade® ha mejorado el pronóstico de estos pacientes, disminuyendo la progresión del daño estructural, el riesgo de complicaciones y la necesidad de cirugía y hospitalización5. Aproximadamente, dos tercios de los pacientes con EC responden inicialmente al tratamiento con anti-TNF. Sin embargo, la eficacia no se mantiene constante a lo largo del tiempo y se ha estimado que entre el 10 y el 50% de los pacientes con EII que presentan respuesta inicial a Remicade® la pierden posteriormente, precisando un cambio de terapia o un ajuste de dosis. El riesgo anual de pérdida de respuesta estimado es, aproximadamente, de un 13% por paciente-año de tratamiento6,7.
Los fármacos biológicos son productos de alto coste, muy superior a los fármacos convencionales, lo que debido al número cada vez mayor de pacientes tratados ha supuesto una considerable carga financiera para los sistemas sanitarios públicos1.
La introducción de los fármacos biosimilares ha supuesto una gran ayuda para mantener la sostenibilidad del sistema sanitario gracias al ahorro económico que conllevan8-11. El infliximab biosimilar ha demostrado, mediante un ejercicio de comparabilidad muy exigente, ser altamente similar al producto de referencia en cuanto a calidad, seguridad y eficacia1.
CT-P13 (Remsima®, Inflectra®) es un biosimilar del infliximab de referencia (Remicade®), cuyo uso en el tratamiento de las enfermedades reumáticas se evaluó en dos ensayos clínicos pivotales, PLANETAS y PLANETRA12,13. Estos estudios aleatorizados demostraron la equivalencia de farmacocinética, eficacia y perfil de seguridad del infliximab biosimilar y su fármaco de referencia en la espondilitis anquilosante (EA) y la artritis reumatoide (AR), respectivamente1. De esta manera, el CT-P13 ha sido el primer anticuerpo monoclonal biosimilar en ser aprobado por la EMA. Además, tras demostrar su eficacia y seguridad en pacientes con enfermedades reumatológicas, la agencia reguladora europea permitió extrapolar estos datos y aprobar su uso para el manejo de pacientes con EII. En estudios posteriores, infliximab biosimilar se emplea para el tratamiento de pacientes con EC y CU moderada-grave con eficacia clínica demostrada para inducir y mantener la remisión14-17.
El concepto intercambio hace referencia a la dispensación de un fármaco «biosimilar» en lugar del original. Aunque las decisiones sobre la capacidad de intercambio a un fármaco biosimilar no se incluyen entre las competencias de las agencias reguladoras, se dispone de evidencia en enfermedad reumatológica de que el intercambio es eficaz y seguro y no hay diferencias en cuanto a inmunogenicidad12,13. La experiencia del intercambio en pacientes con EII es limitada. La mayoría de estudios comunicados incluyen un número bajo de pacientes y tienen un seguimiento muy limitado18-20. Además, los datos sobre farmacocinética e inmunogenicidad, incluyendo las enfermedades reumatológicas, también son escasos.
El objetivo de este estudio es evaluar la pérdida de eficacia, seguridad y los factores asociados a la recidiva tras el intercambio de Remicade® a infliximab biosimilar en pacientes con EII en remisión clínica en nuestro medio, así como detectar posibles cambios en la biodisponibilidad tras el intercambio.
Materiales y métodosDiseño de estudio y pacientesSe trata de un estudio observacional, retrospectivo y unicéntrico, de una única cohorte, constituida por pacientes con EC y CU a los que se ha realizado el intercambio de infliximab de referencia (Remicade®) a biosimilar de infliximab (Remsima®) desde noviembre de 2015 hasta agosto de 2016 en el Hospital Reina Sofía, Córdoba, España. La información se obtuvo mediante la evaluación retrospectiva de los pacientes revisando su historia clínica electrónica. La dosis y el intervalo de administración permanecieron sin cambios tras el intercambio. CT-P13 (Remsima®) fue administrado en la mayoría de los paciente a una dosis de 5mg/kg cada 8 semanas, salvo en 5 pacientes a quienes se había intensificado Remicade® previo al intercambio, en los que se continuó el tratamiento con infliximab biosimilar a las mismas dosis de intensificación pautadas.
Se incluyeron pacientes que habían recibido al menos 6 meses tratamiento de mantenimiento con el fármaco de referencia (Remicade®) y que estaban en remisión clínica libre de corticoides al menos 3 meses. Se definió la remisión clínica como una puntuación ≤4 puntos en el índice de Harvey-Bradshaw en el caso de EC luminal, el cese del drenaje de las fístulas de forma espontánea o bajo compresión manual suave en el caso de enfermedad perianal, y una puntuación<2 puntos en el índice parcial de Mayo en el caso de la CU21,22. Se consideraron como criterios de exclusión la edad menor de 18 años y el tratamiento con infliximab de referencia por otra indicación distinta a la EII.
El estudio se llevó a cabo siguiendo las recomendaciones éticas internacionales para la investigación y estudios clínicos en humanos recogidas en la Declaración de Helsinki de 1964 y sus sucesivas actualizaciones, y siguiendo las recomendaciones del Ministerio de Sanidad en materia de estudios clínicos. El protocolo del estudio fue aprobado por el Comité de Ética de la Investigación de Córdoba. Todos los pacientes recibieron una hoja de información y otorgaron su consentimiento por escrito para participar en el estudio.
Características basalesSe registraron, mediante revisión de la historia clínica electrónica de cada uno de los pacientes, los datos demográficos y clínicos, incluyendo antecedentes familiares, antecedentes de tabaquismo, tipo y localización de la EII, patrón de la EC, duración de la enfermedad, resecciones quirúrgicas o cirugía perianal, así como la historia previa de tratamiento con inmunosupresores o fármacos biológicos, incluido el tratamiento previo con infliximab. Se registraron además datos como la remisión biológica, definida como una PCR<5mg/l, la indicación para el tratamiento con Remicade®, el tiempo de tratamiento y la necesidad de intensificación de Remicade® previo al intercambio, el tratamiento concomitante con inmunosupresores y el tiempo de remisión clínica previo al intercambio a Remsima®.
EvaluacionesRecidiva o pérdida de respuestaEl criterio principal de valoración fue la recidiva o pérdida de respuesta al tratamiento tras el intercambio, definida como el incremento de la actividad evaluada por la clínica, hallazgos de laboratorio, radiología o endoscopia que hubiesen motivado un cambio en el tratamiento del paciente para el control de su enfermedad.
Antes de cada infusión, los pacientes se realizaron una analítica y se evaluó la actividad clínica de la enfermedad mediante el índice de Harvey-Bradshaw en el caso de EC y el índice parcial de Mayo para la CU. También se realizaron analíticas y se evaluó la actividad ante cualquier síntoma o signo que sugería la pérdida de respuesta al tratamiento.
Biodisponibilidad e inmunogenicidadA todos los pacientes se les determinaron niveles de infliximab y ATI (antibodies to infliximab), previo a la administración de cada infusión de Remicade®, así como del biosimilar CT-P13 tras el intercambio. Para ello se usó, Promonitor®-IFX y Promonitor®-Anti-IFX (Progenika Biopharma S.A., Vizcaya, España)23,24, que son dos inmunoanálisis ELISA (Enzyme-Linked Immunosorbent Assay), que miden tanto niveles de Remicade® y Remsima® como anticuerpos frente a ambos fármacos, respectivamente.
SeguridadSe recogieron los datos relativos a la seguridad registrados en el momento de cada infusión y durante el periodo de tiempo previo a la siguiente dosis del fármaco, describiéndose como efecto adverso cualquier acontecimiento médico nocivo, no intencionado o desfavorable que se producía o empeoraba en un paciente en el transcurso de la evolución, reportados en la hoja de registro de enfermería o historia clínica electrónica del paciente. Se definió el tipo de efecto adverso, su gravedad y si fue necesaria la suspensión de Remsima®.
Análisis estadísticoEl análisis estadístico se realizó usando SPSS® software versión 20.0 (Chicago, EE.UU.). Las variables se presentaron en tablas de frecuencia o se expresaron como medias y desviaciones estándar, excepto para aquellas con distribución asimétrica, en las cuales se utilizaron la mediana y el rango intercuartílico. La prueba de Chi cuadrado (o test exacto de Fisher cuando era necesario) se utilizó para las frecuencias, t de Student o ANOVA para las variables cuantitativas y U de Mann-Whitney o Kruskal-Wallis para distribuciones asimétricas.
Se empleó el método de Kaplan-Meier para estimar el impacto del intercambio a biosimilar CT-P13 en la supervivencia libre de recidiva y se evaluó las diferencias entre las curvas mediante el test de log-rank. Finalmente, se realizó un análisis multivariante mediante una regresión de Cox para valorar la influencia de los diversos factores pronósticos en la supervivencia libre de recidiva tras el intercambio. Se consideró nivel de significación una p<0,05. El modelo de Cox mayor fue compuesto por aquellas variables con p<0,25. También se incluyeron variables clínicamente significativas identificadas en estudios previos con independencia de su significación en el análisis univariante. La eliminación de covariables del modelo de Cox mayor se realizó mediante un proceso de paso a paso, eliminando una a una todas aquellas variables con una p>0,15, empezando por las que tenían una p mayor. Las restantes covariables formaron el modelo menor. Las variables con un valor de p entre 0,05 y 0,15 se seleccionaron para identificar factores de confusión potenciales y se eliminaron del modelo si no se comportaron como tales.
ResultadosCaracterísticas clínicas y basales de los pacientesUn total de 36 pacientes con EII (13 con CU, 23 con EC) fueron incluidos en el estudio. La edad media de los pacientes fue de 41,3 años (±15,7), siendo el 58,3% mujeres. Entre los pacientes con EC, el 43,5% eran de localización ileocólica y el 73,9% de patrón inflamatorio. De entre los pacientes con CU, el 61,5% tenían colitis extensa. La mediana de la duración de la enfermedad era de 10,5 años (6,7-11,9). El 16,7% de los pacientes presentaban alguna manifestación extraintestinal. Del global de pacientes con EC y CU, 15 (41,7%) habían sido intervenidos mediante cirugía previa (6 pacientes precisaron cirugía de resección intestinal, 6 cirugía perianal y 3 ambas intervenciones quirúrgicas). Todos los pacientes que fueron intervenidos con resección intestinal tenían EC, indicándose tratamiento con infliximab ante la refractariedad a inmunosupresores tras la recurrencia posquirúrgica. Así mismo, 16 pacientes tenían antecedente de exposición a tratamiento con anti-TNF previo: 9 habían recibido adalimumab (Humira®), 4 Remicade®, 2 habían usado ambos agentes y un paciente había recibido golimumab (Simponi®). La indicación más frecuente para el tratamiento con infliximab fue la refractariedad o pérdida de respuesta a inmunosupresores o a otros fármacos biológicos. La mediana de la duración del tratamiento con Remicade® fue de 33,5 meses (17,25-63,75). Diez pacientes habían necesitado intensificación de Remicade® y 5 de estos, aún mantenían el tratamiento intensificado previo al intercambio.
En el momento del intercambio, todos los pacientes estaban en remisión clínica, con una mediana de 10 meses (6-19). El 69,4% de los pacientes tenían tratamiento inmunosupresor concomitante en el momento del intercambio. El 83,3% estaban en remisión biológica y el 90,3% tenían niveles de infliximab detectables. En 7 pacientes se determinó ATI previos al intercambio, siendo en 6 (85,7%) pacientes no detectables. Entre los pacientes a los que se determinó ATI, 3 tenían niveles de infliximab no detectables, incluido el paciente con ATI detectable.
Las características basales de los pacientes incluidos se resumen en la tabla 1.
Características basales y demográficas
| Características basales y demográficas | |
|---|---|
| Variables | n=36 |
| Edad, media (DE) | 41,3 (±15,7) |
| Género (♀), n (%) | 21 (58,3) |
| Fumadores, n (%) | 10 (27,8) |
| Tipo de EII, n (%) | |
| Colitis ulcerosa | 13 (36,1) |
| Enfermedad de Crohn | 23 (63,9) |
| Duración de la enfermedad, años, mediana (RI) | 10,5 (6,7-11,9) |
| Historia familiar, n (%) | 5 (13,9) |
| Localización de CU, n (%) | |
| Proctitis | 1 (7,7) |
| Colitis izquierda | 4 (30,8) |
| Colitis extensa/pancolitis | 8 (61,5) |
| Localización de EC, n (%) | |
| Ileal | 6 (26,1) |
| Cólica | 7 (30,4) |
| Ileocólica | 10 (43,5) |
| Afectación TDS EC, n (%) | 1 (4,3) |
| Patrón de EC, n (%) | |
| Inflamatorio | 17 (73,9) |
| Estenosante | 1 (4,3) |
| Fistulizante | 5 (21,7) |
| Enfermedad perianal, n (%) | 11 (30,6) |
| Manifestación extraintestinal, n (%) | 6 (16,7) |
| Cirugía previa, n (%) | 15 (41,7) |
| Resección intestinal, n (%) | 9 (60) |
| Tratamiento previo con tiopurinas, n (%) | 36 (100) |
| Tratamiento previo con ADA, n (%) | 11 (30,6) |
| Tratamiento previo con IFX, n (%) | 6 (16,7) |
| Indicación de tratamiento con Remicade®, n (%) | |
| Refractariedad | 31 (86,1) |
| EC perianal | 4 (11,1) |
| Prevención recurrencia posquirúrgica en EC | 1 (2,8) |
| Duración de tratamiento con Remicade®, meses, mediana (RI) | 33,5 (17,25-63,75) |
| Intensificación de Remicade®, n (%) | 10 (27,8) |
| Tratamiento IS concomitante en el momento del intercambio, n (%) | 25 (69,4) |
| Remisión biológica en el momento del intercambio, n (%) | 30 (83,3) |
| Tiempo en remisión clínica, meses, mediana (RI) | 10 (6-19) |
| Niveles de IFX en el momento del intercambio, n (%) | |
| Detectables | 28 (90,3) |
| No detectable | 3 (9,7) |
| Ac contra IFX en el momento del intercambio, n (%) | |
| Detectables | 1 (14,3) |
| No detectable | 6 (85,7) |
| Niveles de IFX en el momento de intercambio, μg/ml, mediana (RI) | 3,4 (1,2-7,2) |
| Hb en el momento de intercambio, g/dl, mediana (RI) | 13,9 (13,2-14,6) |
| PCR en el momento de intercambio, mg/l, mediana (RI) | 2,75 (0,9-5,4) |
Ac: anticuerpo; ADA: adalimumab; CU: colitis ulcerosa; DE: desviación estándar; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; Hb: hemoglobina; IFX: infliximab; IS: inmunosupresor; PCR: proteína C reactiva; RI: rango intercuartílico; TDS: tubo digestivo superior.
La media de seguimiento de los pacientes fue de 8,4 meses (±3,5). Cinco pacientes (13,9%) presentaron pérdida de respuesta durante el seguimiento (2 con CU y 3 con EC), con un tiempo medio hasta la recidiva de 2,4 meses (±1,9). La media de PCR en el momento de la recidiva fue de 13,77mg/dl (±19) y la media de niveles de infliximab, de 0,11μg/ml (±0,12). De los 5 pacientes que recidivaron, a 3 se les intensificó el tratamiento con infliximab biosimilar, un paciente recibió tratamiento con corticoides y otro fue intervenido mediante cirugía perianal, entrando todos ellos nuevamente en remisión clínica.
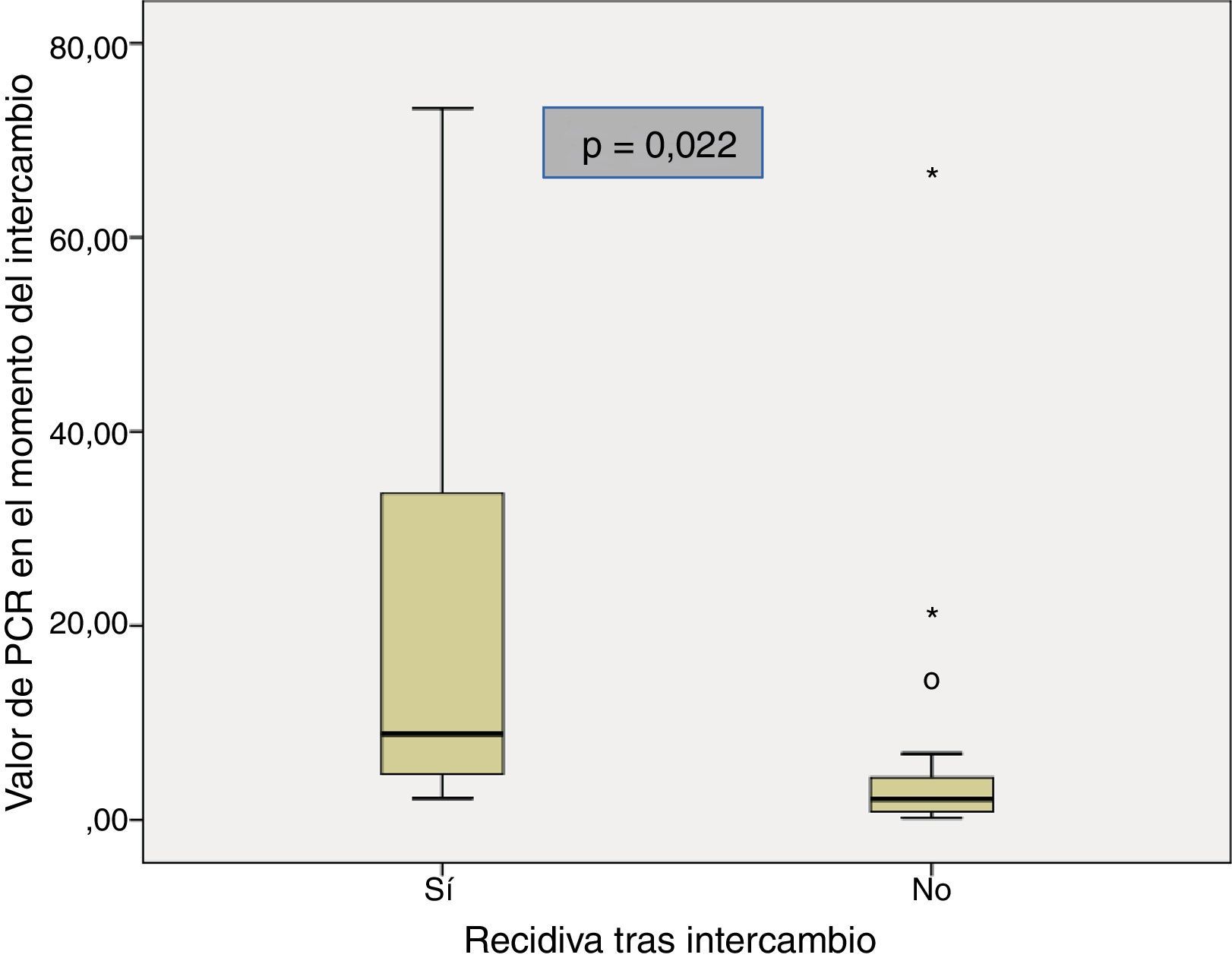
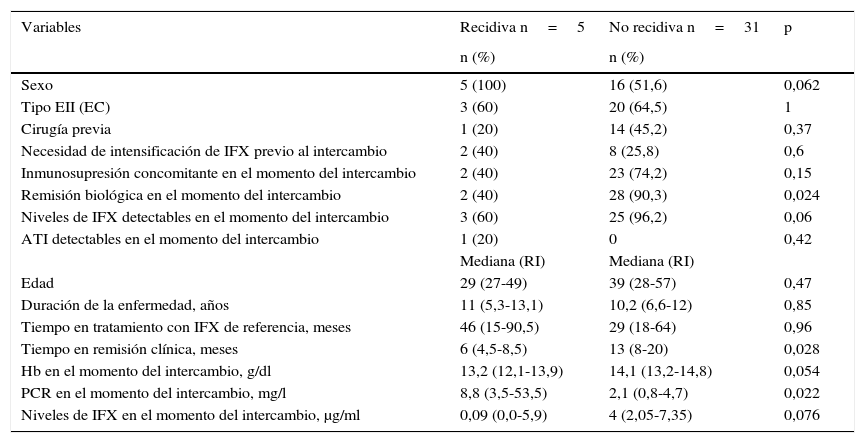
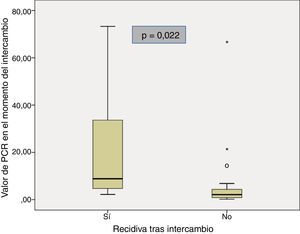
Las características basales de los pacientes que recidivaron y de los que se mantuvieron en remisión tras el intercambio se muestran en la tabla 2. La mediana del tiempo de duración de la enfermedad fue similar en los pacientes que recidivaron comparados con el grupo que se mantuvo en remisión (11 años [5,3-13,1] vs. 10,2 [6,6-12]; p=0,85). La mediana del tiempo en remisión clínica previo al intercambio en los pacientes que continuaron en remisión fue mayor que en aquellos que recidivaron (13 meses [8-20] vs. 6 meses [4,5-8,5]; p=0,028). Hubo una menor prevalencia de remisión biológica en el momento del intercambio en el grupo de pacientes que recidivaron en comparación con los que continuaron en remisión (40% vs. 90,3%; p=0,024). La mediana de PCR en el momento del intercambio en los pacientes que recidivaron fue mayor que en aquellos que continuaron en remisión (8,8mg/l [3,5-53,5] vs. 2,1mg/l [0,8-4,7]; p=0,022) (fig. 1). A pesar de que no se encontraron diferencias significativas, la tendencia fue a una menor prevalencia de niveles de infliximab detectables en el momento del intercambio en el grupo de pacientes que recidivaron en comparación con los que se mantuvieron en remisión (60% vs. 96,2%; p=0,06). También se observó una tendencia a valores menores de niveles de infliximab en el momento de intercambio (0,09μg/ml [0,0-5,9] vs. 4μg/ml [2,05-7,35]; p=0,076) en el grupo de pacientes que recidivaron.
Características basales del grupo de recidiva y del grupo no recidiva tras el intercambio
| Variables | Recidiva n=5 | No recidiva n=31 | p |
|---|---|---|---|
| n (%) | n (%) | ||
| Sexo | 5 (100) | 16 (51,6) | 0,062 |
| Tipo EII (EC) | 3 (60) | 20 (64,5) | 1 |
| Cirugía previa | 1 (20) | 14 (45,2) | 0,37 |
| Necesidad de intensificación de IFX previo al intercambio | 2 (40) | 8 (25,8) | 0,6 |
| Inmunosupresión concomitante en el momento del intercambio | 2 (40) | 23 (74,2) | 0,15 |
| Remisión biológica en el momento del intercambio | 2 (40) | 28 (90,3) | 0,024 |
| Niveles de IFX detectables en el momento del intercambio | 3 (60) | 25 (96,2) | 0,06 |
| ATI detectables en el momento del intercambio | 1 (20) | 0 | 0,42 |
| Mediana (RI) | Mediana (RI) | ||
| Edad | 29 (27-49) | 39 (28-57) | 0,47 |
| Duración de la enfermedad, años | 11 (5,3-13,1) | 10,2 (6,6-12) | 0,85 |
| Tiempo en tratamiento con IFX de referencia, meses | 46 (15-90,5) | 29 (18-64) | 0,96 |
| Tiempo en remisión clínica, meses | 6 (4,5-8,5) | 13 (8-20) | 0,028 |
| Hb en el momento del intercambio, g/dl | 13,2 (12,1-13,9) | 14,1 (13,2-14,8) | 0,054 |
| PCR en el momento del intercambio, mg/l | 8,8 (3,5-53,5) | 2,1 (0,8-4,7) | 0,022 |
| Niveles de IFX en el momento del intercambio, μg/ml | 0,09 (0,0-5,9) | 4 (2,05-7,35) | 0,076 |
ATI: anticuerpos contra infliximab; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; Hb: hemoglobina; IFX: infliximab; PCR: proteína C reactiva; RI: rango intercuartílico.
El 40% de los pacientes que recidivaron tenían un tratamiento inmunosupresor concomitante en comparación con el 74,2% de los que se mantuvieron en remisión (p=0,15).
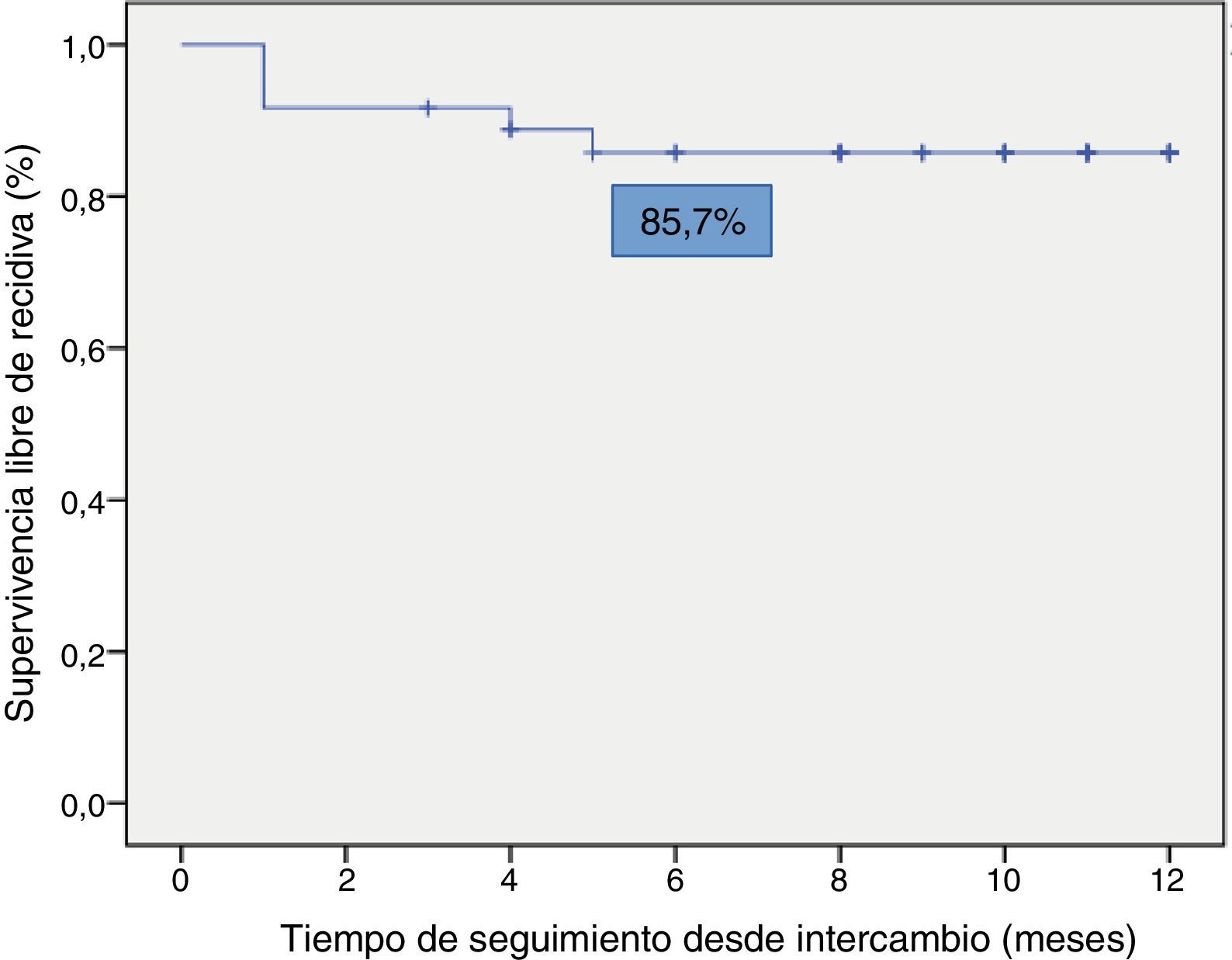
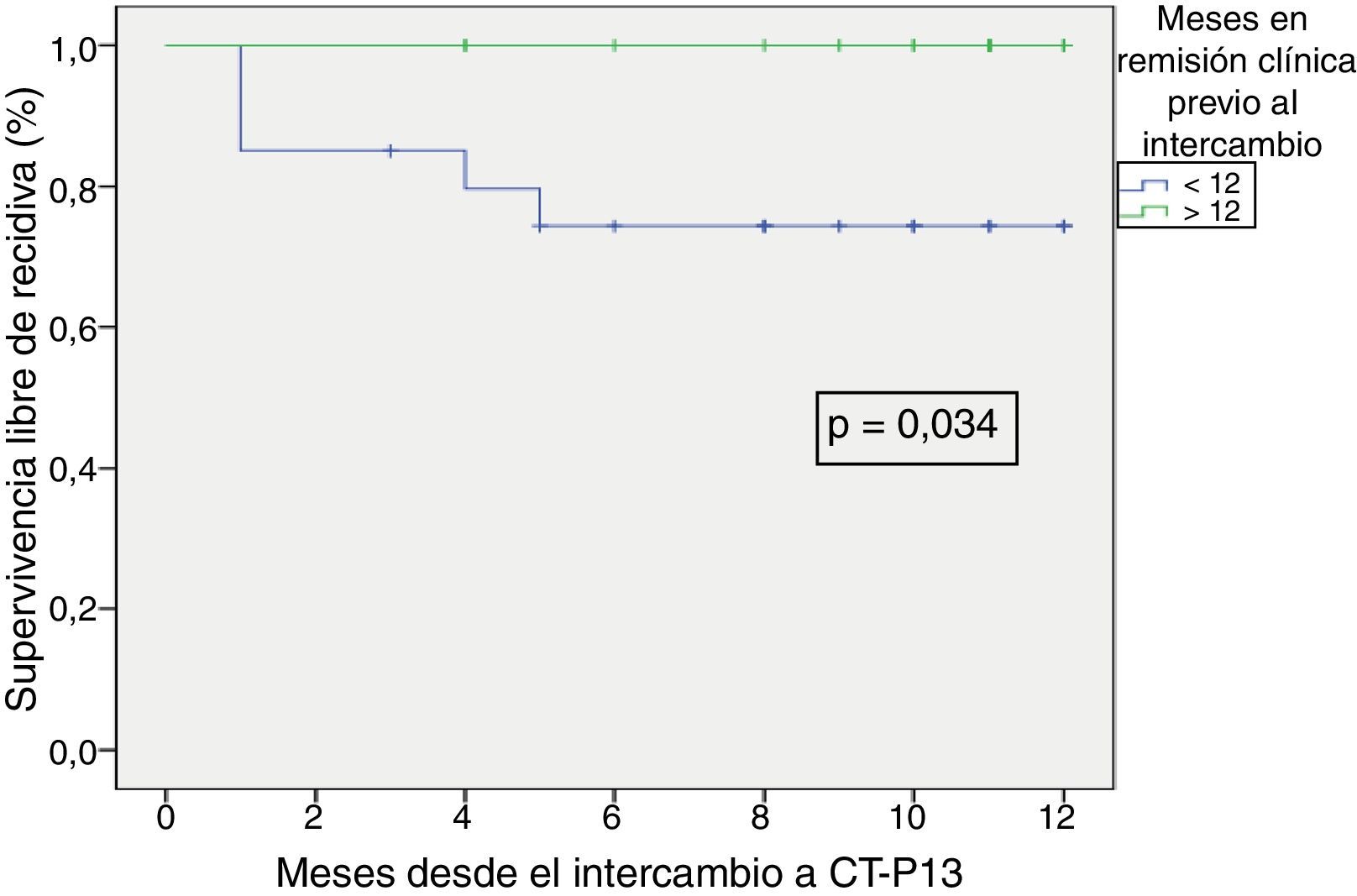
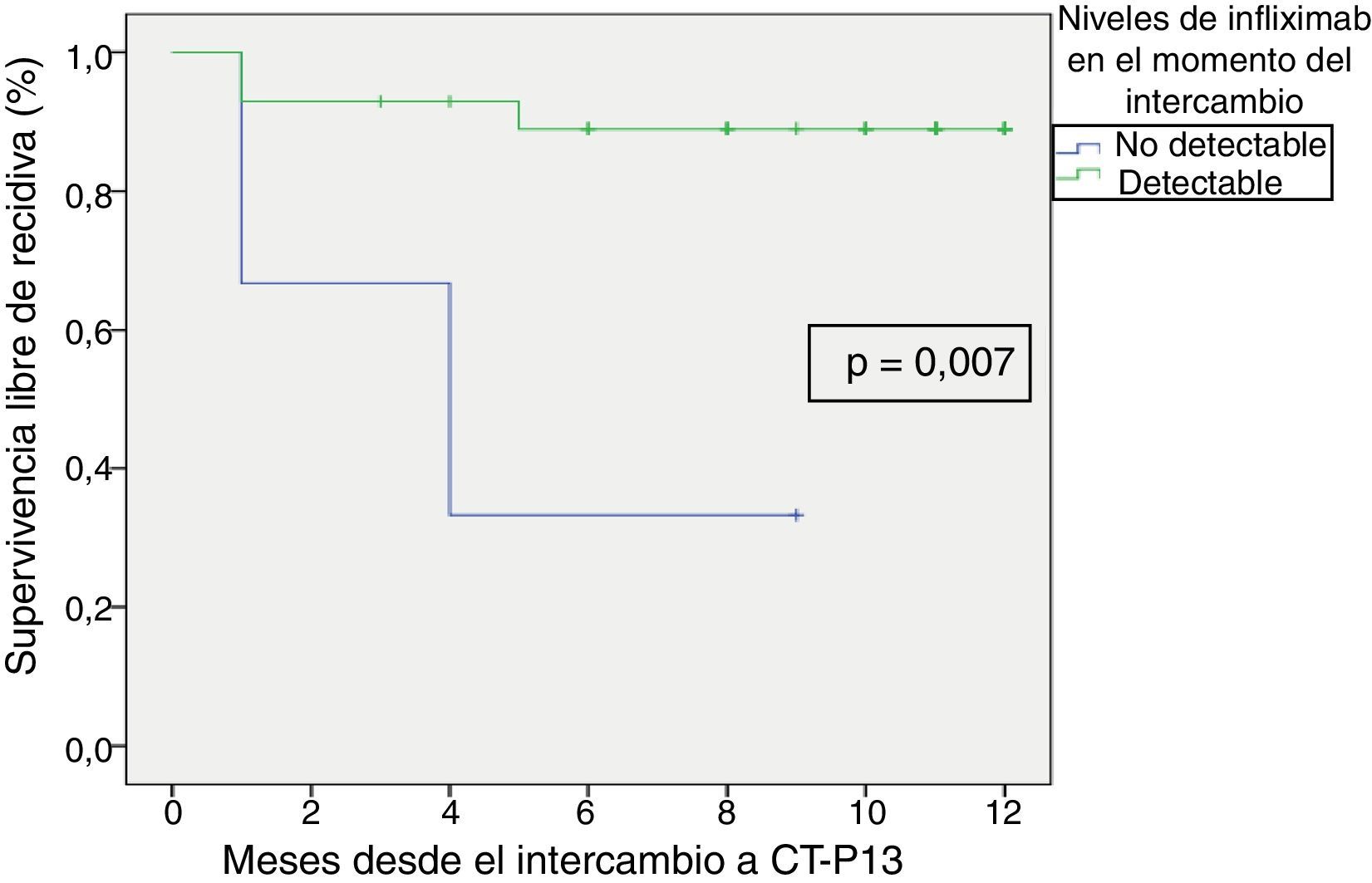
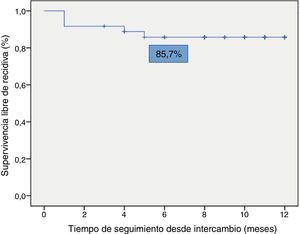
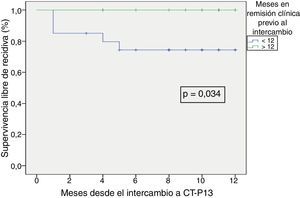
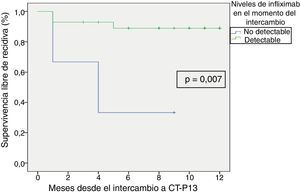
La supervivencia libre de recidiva a los 6 meses de seguimiento fue del 85,7% (fig. 2), siendo esta significativamente menor en los pacientes que estuvieron en remisión clínica durante menos de 12 meses previos al intercambio, en comparación con los que habían estado más de 12 meses en remisión (74,4% vs. 100%; p=0,034) (fig. 3). Así mismo, la supervivencia libre de recidiva a los 6 meses fue menor en los pacientes con niveles de infliximab no detectables en el momento del intercambio en comparación con los pacientes que tenían niveles del fármaco detectables (33,3% vs. 89%; p=0,007) (fig. 4).
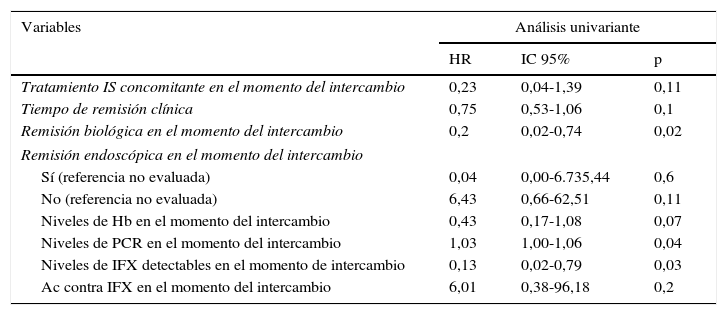
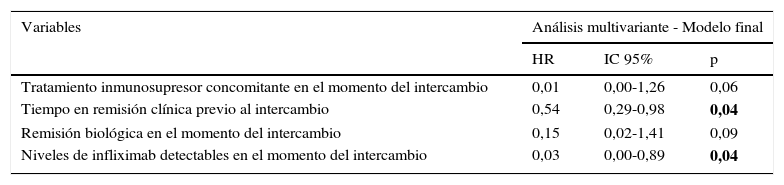
En el análisis multivariante de regresión de Cox, el tiempo de remisión clínica previo al intercambio (HR=0,54; IC 95%=0,29-0,98; p=0,043) y los niveles de infliximab detectables (HR=0,03; IC 95%=0,00-0,89; p=0,043) estaban relacionados con un menor riesgo de recidiva. El tratamiento inmunosupresor concomitante (HR=0,015; IC 95%=0,00-1,26; p=0,06) y la remisión biológica (HR=0,15; IC 95%=0,02-1,41; p=0,09) permanecieron en el modelo de Cox final, al ser identificados como factores de confusión. La regresión de Cox univariante se muestra en la tabla 3 y el modelo final se resume en la tabla 4. Ni la edad, tipo de EII, cirugía previa, duración de la enfermedad, tiempo en tratamiento con infliximab de referencia, necesidad de intensificación previa o la presencia de ATI estuvieron asociados al riesgo de recidiva.
Regresión de Cox univariante
| Variables | Análisis univariante | ||
|---|---|---|---|
| HR | IC 95% | p | |
| Tratamiento IS concomitante en el momento del intercambio | 0,23 | 0,04-1,39 | 0,11 |
| Tiempo de remisión clínica | 0,75 | 0,53-1,06 | 0,1 |
| Remisión biológica en el momento del intercambio | 0,2 | 0,02-0,74 | 0,02 |
| Remisión endoscópica en el momento del intercambio | |||
| Sí (referencia no evaluada) | 0,04 | 0,00-6.735,44 | 0,6 |
| No (referencia no evaluada) | 6,43 | 0,66-62,51 | 0,11 |
| Niveles de Hb en el momento del intercambio | 0,43 | 0,17-1,08 | 0,07 |
| Niveles de PCR en el momento del intercambio | 1,03 | 1,00-1,06 | 0,04 |
| Niveles de IFX detectables en el momento de intercambio | 0,13 | 0,02-0,79 | 0,03 |
| Ac contra IFX en el momento del intercambio | 6,01 | 0,38-96,18 | 0,2 |
Ac: anticuerpo; Hb: hemoglobina; IFX: infliximab; IS: inmunosupresor; PCR: proteína C reactiva.
Regresión de Cox multivariante mostrando los factores predictores de supervivencia libre de recidiva después del intercambio a infliximab biosimilar
| Variables | Análisis multivariante - Modelo final | ||
|---|---|---|---|
| HR | IC 95% | p | |
| Tratamiento inmunosupresor concomitante en el momento del intercambio | 0,01 | 0,00-1,26 | 0,06 |
| Tiempo en remisión clínica previo al intercambio | 0,54 | 0,29-0,98 | 0,04 |
| Remisión biológica en el momento del intercambio | 0,15 | 0,02-1,41 | 0,09 |
| Niveles de infliximab detectables en el momento del intercambio | 0,03 | 0,00-0,89 | 0,04 |
En negrita, significativo p < 0,05.
Solo un paciente presentó ATI detectables transitorios previamente al intercambio de Remicade® a CT-P13 (Remsima®), sin confirmarse anticuerpos en posteriores controles analíticos tras el intercambio y continuando el paciente en remisión clínica sin necesidad de intensificación del tratamiento con biosimilar.
En relación con los niveles de infliximab, no se encontraron diferencias entre los niveles previos al intercambio y los medidos a las semanas 8 y 16 durante el seguimiento (6,27μg/ml [±4,53] vs. 6,42μg/ml [±4,78] vs. 6,3μg/ml [±4,86]; p=0,94).
SeguridadDurante el seguimiento, 3 pacientes (8,3%) presentaron algún efecto adverso, todos ellos tenían una EC. Se observaron un total de 4 efectos adversos: 2 infecciones respiratorias de vías altas, una infección odontógena y una neumonía, siendo esta última el único efecto adverso grave observado que motivó la suspensión de Remsima®. La mayoría de los efectos adversos ocurrieron entre el segundo y el tercer mes tras el intercambio. En 3 pacientes se ha suspendido infliximab biosimilar durante el seguimiento por remisión prolongada, entre el cuarto y el sexto mes después del intercambio.
No se reportaron casos de reacciones infusionales, neoplasia o muerte durante el seguimiento.
DiscusiónEl biosimilar de infliximab CT-P13 fue aprobado por la EMA para las mismas indicaciones que el infliximab de referencia (Remicade®), siendo hoy día empleado con eficacia para inducir la respuesta y remisión en pacientes con EC y CU moderada-grave. Sin embargo, datos clínicos sobre el intercambio de Remicade® a CT-P13 en EII son escasos.
Este estudio observacional, retrospectivo, recoge la experiencia clínica del intercambio de infliximab de referencia (Remicade®) a CT-P13 (Remsima®), en pacientes con EII, en un solo centro. La mayor parte de los pacientes (86,1%) continuaron en remisión clínica durante el seguimiento y se reportaron pocos efectos adversos relacionados con el tratamiento. No se detectaron cambios en la biodisponibilidad de infliximab ni en la aparición de ATI durante el seguimiento tras el intercambio.
En este estudio, el 13,9% de los pacientes presentaron recidiva o pérdida de eficacia al tratamiento con anti-TNF tras el intercambio, lográndose, mediante diferentes estrategias (intensificación, tratamiento con corticoides, cirugía), nuevamente la remisión clínica en todos ellos. Los hallazgos de este trabajo están en línea con los resultados comunicados por otros investigadores. Un estudio poscomercialización de Corea del Sur, que incluyó 173 pacientes, clasificados en un grupo al que se realizó el intercambio a infliximab biosimilar y otro grupo que incluía pacientes que no habían recibido dosis previa de infliximab de referencia, informó datos de la semana 30 después del intercambio en 46 pacientes (35 con EC y 11 con CU), y mostró que el 82,8% de los pacientes con EC y el 100% de los pacientes con CU no experimentaron empeoramiento de la enfermedad2. Se ha realizado un estudio aleatorizado, doble ciego, de no inferioridad, en faseIV, financiado por el gobierno noruego (NOR-SWITCH study), cuyo objetivo fue evaluar la eficacia, seguridad e inmunogenicidad del intercambio a biosimilar CT-P13 comparado con el tratamiento continuado con infliximab de referencia (Remicade®) en varias indicaciones, incluyendo EC y CU (ClinicalTrials.gov identificador: NCT02148640)25. Los datos publicados en el estudio NOR-SWITCH que incluían 481 pacientes (Remicade®: 241 e intercambio a CT-P13: 240): 155 con EC y 93 con CU, seguidos durante 52 semanas, demuestran que el empeoramiento de la enfermedad se produjo en el 21,2 y 36,5% de pacientes con EC y en el 9,1 y 11,9% de pacientes con CU en el grupo de infliximab de referencia y CT-P13, respectivamente. Los resultados de este estudio desvelan que el intercambio al biosimilar CT-P13 no es inferior al tratamiento continuado con infliximab de referencia. El estudio NOR-SWITCH, a diferencia de nuestro estudio, presenta un grupo control de pacientes que continúan con Remicade® y un seguimiento más prolongado; sin embargo, los datos de pérdida de eficacia en el grupo de pacientes con CU en tratamiento con CT-P13 (Remsima®) son similares a los de nuestro estudio, a diferencia del grupo con EC en el cual el porcentaje de empeoramiento de la enfermedad es mayor. Resultados similares a los obtenidos en nuestro estudio también se han publicado en un estudio observacional prospectivo de 83 pacientes con EII a quienes se realizó el intercambio a CT-P13, en el que se observó que el 80% (EC) y el 84% (CU) de los pacientes mantuvieron la remisión durante el seguimiento26. Así mismo, en otro estudio prospectivo abierto de 143 pacientes a los cuales se realizó el intercambio a Remsima®, el 70% (EC) y el 73% (CU) se mantuvieron en remisión durante el seguimiento27.
En relación con los factores predictivos de recidiva, el mayor tiempo de remisión clínica previo al intercambio y los niveles de infliximab detectables en el momento del intercambio fueron identificados como factores asociados a un menor riesgo de recidiva tras el intercambio. En ningún estudio publicado hasta el momento se han revisado los factores asociados al riesgo de recidiva tras el intercambio a infliximab biosimilar, pero recientemente se publicó una revisión sistemática sobre los factores que predicen la pérdida de respuesta a infliximab, como son la duración y localización de la enfermedad, la presencia de ATI y niveles de infliximab indetectables28. Así, existen algunos estudios que muestran que los niveles de infliximab predicen el pronóstico a largo plazo de los pacientes con EC y CU, lo cual respalda lo observado en el presente estudio. En un estudio de 105 pacientes con EC tratados con infliximab, las tasas de remisión clínica fueron mayores en los pacientes con niveles de infliximab detectables en comparación con aquellos en quienes los niveles de infliximab fueron indetectables, incluyendo aquellos sin ATI (82% vs. 6%; p<0,001)28,29. En apoyo a estos datos, un análisis post hoc de ACCENT-1 identificó que un nivel de infliximab en la semana 14 ≥3,5μg/ml fue predictivo de remisión sostenida a las 54 semanas, con una OR de 3,528. También en una cohorte de 115 pacientes con CU se observó que los niveles de infliximab detectables se asocian a mayores tasas de remisión (69% vs. 15%; p<0,001) y mejoría endoscópica (76% vs. 28%, p<0,001)30.
El presente estudio recoge 4 efectos adversos relacionados con el tratamiento en 3 (8,3%) pacientes, ocurriendo un solo efecto adverso grave (neumonía) que motivó la suspensión de Remsima®. En el estudio PLANETAS los eventos adversos relacionados con el tratamiento durante el estudio de extensión fueron reportados en 33 (39,3%) pacientes en el grupo de intercambio13. CT-P13 fue bien tolerado, mostrando un perfil de seguridad a largo plazo que era consistente con el perfil del infliximab de referencia. En el estudio PLANETRA los eventos adversos relacionados con el tratamiento durante el estudio de extensión fueron reportados en 27 (18,9%) pacientes en el grupo de intercambio12, produciéndose reacciones adversas graves relacionadas con el tratamiento en 4 (2,8%) pacientes de este grupo. En el estudio de poscomercialización de Corea del Sur, en la cohorte de 60 pacientes (grupo de intercambio a CT-P13), se observaron 6 efectos adversos relacionados con el tratamiento, entre ellos una reacción severa relacionada con la infusión, un absceso pulmonar y una reacción anafiláctica, que condujeron a los pacientes a interrumpir CT-P132. Los efectos adversos observados en el estudio NOR-SWITCH, incluyendo reacciones a la infusión, eran similares en el grupo de infliximab de referencia y CT-P13 (69,7% y 68,3% respectivamente), observándose algún efecto adverso severo en el 10 y 8,8% de los pacientes; sin embargo, los datos mostrados son globales y no se ha reportado aún la frecuencia de efectos adversos por diagnóstico25.
En el actual estudio no se encontraron diferencias entre los niveles de infliximab previos al intercambio y los medidos a las semanas 8 y 16 de seguimiento. Resultados similares se han reportado en recientes estudios, incluido el estudio prospectivo abierto de 143 pacientes con EII, a quienes se realizó intercambio a Remsima®, en el cual no se detectó ningún cambio en los niveles de infliximab durante el seguimiento (6,7μg/ml en momento de intercambio y 8μg/ml en el tercer mes en los pacientes con EC, 8,2μg/ml en momento de intercambio y 8,3μg/ml en el tercer mes en los pacientes con CU; p=0,54)27. Así mismo, en el estudio NOR-SWITCH se observó que los niveles del fármaco fueron similares en el grupo de Remicade® y de CT-P13, durante el seguimiento25. Sin embargo, un estudio de cohorte observacional prospectivo, que incluyó 83 pacientes a quienes se realizó el intercambio a CT-P13, estableció que la mediana de niveles de infliximab aumentó de 3,5μg/ml (0-18) a 4,2μg/ml (0-21) en la semana 16 (p=0,010)26.
El presente estudio tiene ciertas limitaciones, como son el bajo tamaño de la muestra, el corto tiempo de seguimiento y la naturaleza retrospectiva, que podrían haber introducido sesgos y heterogeneidad. Además, los datos se recopilaron a partir de un único centro y el diseño del estudio no incluye un grupo control de pacientes que continúen en tratamiento con infliximab de referencia (Remicade®), lo cual puede haber debilitado algunos análisis, al ser difícil interpretar si los cambios en la eficacia, la seguridad y la farmacocinética pueden ser debidos al intercambio a CT-P13 (Remsima®) o pueden ser coincidentes con el curso natural. No obstante, este estudio se basa en la práctica clínica habitual, reduciendo así al mínimo el sesgo de selección, y a pesar de las limitaciones mencionadas, nuestros resultados son acordes con datos esperables.
En conclusión, el intercambio a infliximab biosimilar en una cohorte de vida real de pacientes con EII en remisión clínica no parece tener un impacto significativo en los resultados clínicos a corto plazo. Los factores asociados con la recidiva fueron similares a los esperados durante el seguimiento en pacientes que continuaron con el producto de referencia. Sin embargo, hasta que se disponga de datos prospectivos y controlados, esta práctica clínica debe evaluarse con cautela.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.