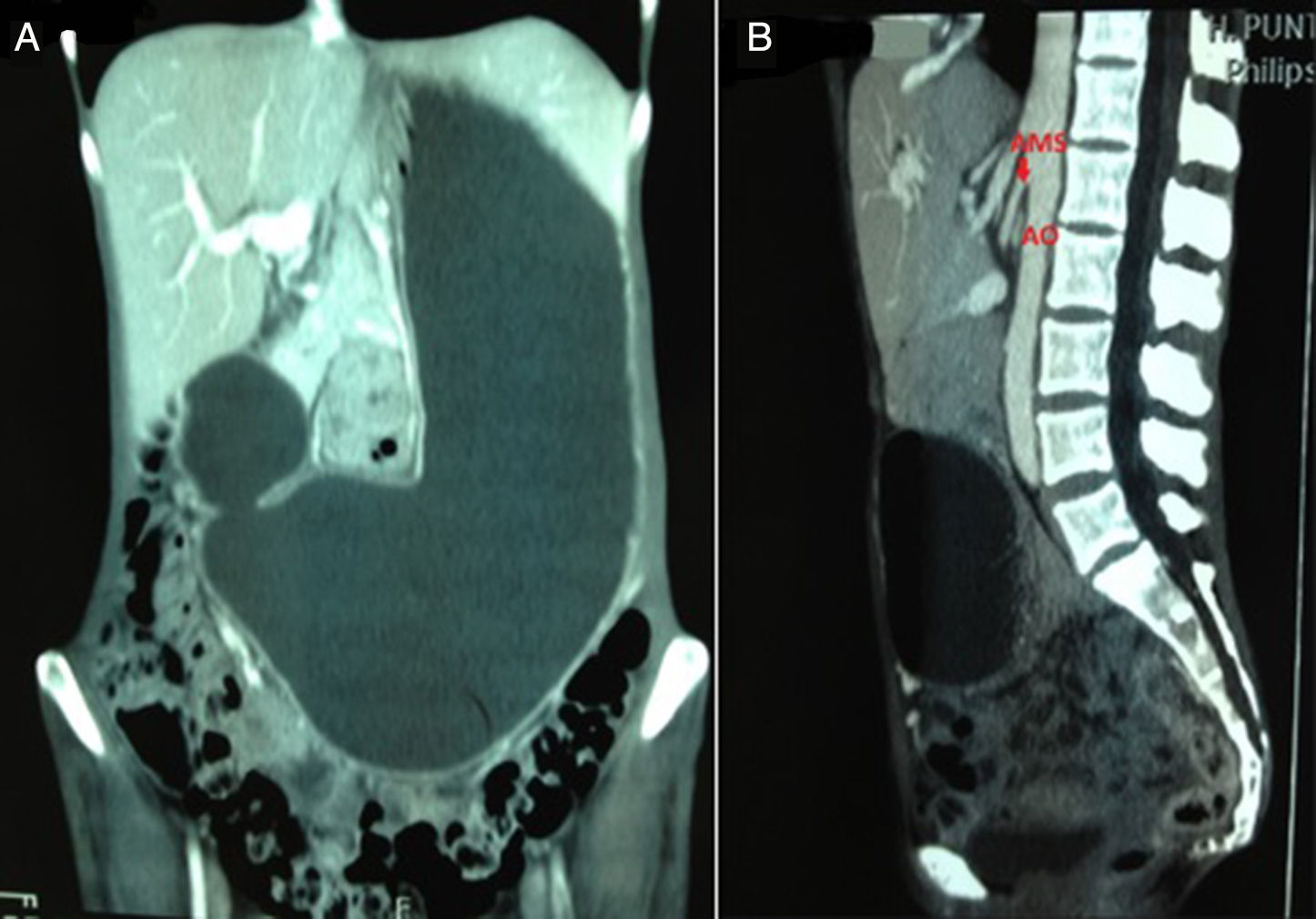
Presentamos el caso de una mujer de 43 años con antecedentes de neurofibromatosis que consultó por un cuadro de dolor abdominal, pérdida de 15kg de peso, distensión abdominal y vómitos de varios meses de evolución. En la exploración física destacaba caquexia y distensión abdominal difusa. La tomografía computarizada (TC) realizada informó de una gran distensión gástrica con obstrucción de la tercera porción duodenal (fig. 1A), en relación a una disminución del espacio entre las arterias aorta y mesentérica superior, con un ángulo de salida de esta última de menos de 25° respecto a la aorta mesentérica (fig. 1B), datos muy sugestivos de síndrome de la arteria mesentérica superior (SAMS). Se introdujo una sonda nasogástrica, que presentó un gran débito. La gastroscopia describió esofagitis y estómago con abundante contenido que, al aspirarse, dejó ver una mucosa muy eritematosa en relación al estasis gástrico. Se inició tratamiento conservador con suplementos nutricionales vía enteral y parenteral, así como colocación de la paciente en posición de decúbito lateral izquierdo, sin conseguirse mejoría, por lo que finalmente se procedió a la realización de gastroyeyunostomía. Tras la cirugía la enferma evolucionó bien, cediendo los vómitos y ganando unos 7kg de peso en los primeros 4 meses y 12kg en el primer año.
El SAMS fue descrito por Rokitanski en 18611 y nombrado como tal por Wilkie en 1927, conociéndose desde entonces como síndrome de Wilkie2. Su frecuencia es muy baja, encontrándose una incidencia del 0,2% en 6.000 estudios radiológicos1. Su incidencia es mayor en mujeres adolescentes y adultos jóvenes, aunque se puede dar a cualquier edad3.
Su origen se encuentra en la compresión duodenal causada por la arteria mesentérica superior (AMS) y la aorta abdominal (AO). En la anatomía normal, la tercera porción duodenal pasa anteriormente a la AO y posteriormente a la AMS a nivel de la tercera vértebra lumbar. Estas 3 estructuras, junto con la vena renal izquierda, están rodeadas por almohadillas de grasa mesentérica y ganglios linfáticos. En los pacientes con SAMS, el ángulo aortomesentérico es menor de 25° (valor normal: 38-65°), y la distancia entre ambas arterias es menor a 8mm (valor normal: 10-28mm)3-5. En ocasiones este síndrome también asocia la compresión de la vena renal izquierda, ocasionando lo que se conoce como síndrome de cascanueces (hematuria y proteinuria grave)3.
El desencadenante común de esta enfermedad está en la pérdida de peso por diferentes motivos, que podemos clasificar en3,6: síndromes consuntivos (sida, cáncer, grandes quemados, endocrinopatías, malabsorción intestinal); trastornos de la alimentación (anorexia nerviosa); grandes postoperatorios (incluyendo la cirugía bariátrica); traumatismos severos (craneoencefálicos, politraumatismos) y enfermedad de la columna (deformidades)6,7.
Los pacientes pueden quejarse de reflujo, con demostración en el estudio endoscópico de esofagitis y/o gastritis de retención, distensión abdominal posprandial precoz, vómitos biliosos, náuseas e hiporexia. Pueden referir gran pérdida de peso reciente o la mejoría de los síntomas al colocarse en decúbito izquierdo o al aproximar las rodillas al pecho, ya que estas posturas alivian la tensión entre la AO y la AMS. Los hallazgos analíticos son inespecíficos, aunque puede haber alteraciones hidroelectrolíticas acordes con la severidad del cuadro6,8.
El diagnóstico diferencial del SAMS incluye otras causas de dolor abdominal agudo como obstrucciones intestinales de otros orígenes, isquemia mesentérica y enfermedad por reflujo gastroesofágico. Es difícil diferenciar este cuadro de otros tipos de obstrucción intestinal ya que la presentación y los datos de laboratorio son idénticos. Podemos orientar hacia otro origen de obstrucción intestinal cuando existen antecedentes de neoplasia, radioterapia, enfermedad inflamatoria intestinal o cirugías abdominales previas.
El diagnóstico se establece mediante técnicas de imagen. Así, la obstrucción duodenal por estenosis abrupta de la tercera porción con distensión proximal de duodeno y cavidad gástrica se puede identificar en estudio baritado. El diagnóstico definitivo del SAMS se consigue mediante la visualización directa en la TC, resonancia magnética, ecografía o angiografía convencional de la disminución del ángulo aortomesentérico según los parámetros previamente descritos6,8.
El tratamiento del SAMS es generalmente conservador, mediante la reposición hidroelectrolítica, dieta parenteral, enteral o combinada8. Además se recomienda colocar al paciente en posición ventrolateral izquierda para facilitar el vaciamiento gástrico. El apoyo psicológico es importante en determinados casos como los motivados por anorexia nerviosa. Los episodios agudos suelen responder a tratamiento conservador, pero en los cuadros crónicos la necesidad de tratamiento quirúrgico es frecuente. La cirugía estaría indicada tras fracaso del manejo conservador, casos crónicos con pérdida de peso progresiva y dilatación duodenal como sucedió en nuestro enfermo, y en los pacientes que desarrollan úlceras complicadas secundarias al estasis biliar y reflujo6,8.
Las intervenciones quirúrgicas propuestas para el tratamiento incluyen: la liberación del ligamento de Treitz (procedimiento de Strong), la gastroyeyunostomía y la duodenoyeyunostomía. El procedimiento de Strong mantiene la integridad del tracto gastrointestinal, pero tiene una tasa de fracaso del 25%. La gastroyeyunostomía permite la descompresión gástrica pero no alivia la compresión duodenal, por lo que pueden persistir los síntomas digestivos y llevar a la aparición de un síndrome de asa ciega o de úlceras pépticas recurrentes. La duodenoyeyunostomía es el procedimiento de elección, con un porcentaje de éxito superior al 90%. La gastroparesia después de la corrección quirúrgica es un problema frecuente, en relación con la atonía gástrica y duodenal. Aunque existe poca información sobre su manejo médico en la literatura, puede intentarse el tratamiento con procinéticos4,6,8,9.
La incidencia de complicaciones en relación con la obstrucción digestiva alta es elevada, destacando la neumonía aspirativa, perforación gástrica y el colapso cardiovascular, por lo que la difusión de la fisiopatología de esta entidad permitirá la existencia de un mayor índice de sospecha, consiguiéndose una mejor prevención, diagnóstico y tratamiento precoz4,6.