El impacto clínico de la elevación de la cabecera de la cama en pacientes con enfermedad por reflujo gastroesofágico es incierto, por inconsistencia y limitaciones metodológicas en estudios previos.
Pacientes y métodosEnsayo clínico controlado aleatorizado unicéntrico simple-ciego cruzado 2x2, en 39 pacientes con enfermedad por reflujo gastroesofágico tratados farmacológicamente. La intervención fue elevar la cabecera de la cama a 20cm de altura durante 6 semanas y luego a dormir sin inclinación otras 6 semanas, con un lavado de 2 semanas entre períodos. El desenlace primario fue el cambio ≥ 10% de la puntuación RDQ y los desenlaces secundarios fueron el cambio ≥ 10% de la puntuación SF-36, preferencia del paciente y frecuencia de eventos adversos.
Resultados27 (69,2%) pacientes que utilizaron la intervención cumplieron el desenlace primario, vs. 13 (33,3%) pacientes en el grupo control (RR: 2,08; IC95%: 1,19 - 3,61). No se encontró efecto en la puntuación SF-36 (RR: 1,11; IC95%: 0,47 - 2,60). La preferencia por la intervención fue del 77,1% y la proporción de eventos adversos fue del 54,0%.
ConclusiónLa elevación de la cabecera de la cama redujo los síntomas de reflujo, pero no tuvo efecto en la calidad de vida. Por un balance riesgo-beneficio no óptimo, se requieren estudios adicionales antes de recomendar esta intervención (IBELGA, identificador ClinicalTrials.gov NCT02706938).
The clinical impact of head-of-bed elevation in patients with gastro-oesophageal reflux disease is unclear, because of inconsistency and methodological limitations of previous studies.
Patients and methodsA randomised single-blind single-centre controlled clinical trial with a 2x2 cross-over design, in 39 pharmacologically treated patients with gastro-oesophageal reflux disease. Active intervention was to use a head-of-bed-elevation of 20cm for 6 weeks and then to sleep without inclination for 6 additional weeks, with a wash-out of 2 weeks between periods. The primary outcome was a change ≥10% in RDQ score and secondary outcomes were a change ≥10% in SF-36 score, patient preference and frequency of adverse events.
Results27 (69.2%) patients who used the intervention reached the primary outcome vs 13 (33.3%) patients in the control group (RR: 2.08; 95 CI%: 1.19 – 3.61). No effect was found in SF-36 score (RR: 1.11; 95% CI: 0.47 – 2.60). Preference favouring the intervention was 77.1% and adverse event proportion was 54.0%.
ConclusionHead-of-bed elevation improved reflux symptoms but there was no effect on quality of life. The finding of a non-optimal risk-benefit ratio warrants additional studies before this intervention can be recommended (IBELGA, ClinicalTrials.gov identifier NCT02706938).
La enfermedad por reflujo gastroesofágico (ERGE) se presenta cuando el contenido gástrico se devuelve hacía el esófago y causa complicaciones o síntomas molestos para el paciente1. Afecta al 13% de la población mundial2. En atención primaria representa el 4% de las consultas médicas3 y en Latinoamérica tiene una prevalencia de 12-31%4. Los síntomas nocturnos, se presentan en más del 70% de los pacientes y deterioran significativamente la calidad de vida5. La interferencia en el sueño debida a pirosis retroesternal nocturna se ha encontrado asociada a baja productividad laboral6, aun en pacientes tratados con inhibidores de bomba de protones7. Debido a varios factores fisiológicos como ausencia de percepción consciente de síntomas, menor salivación y menor frecuencia de degluciones nocturnas8, una duración significativamente mayor de la exposición al ácido durante la noche ha sido asociada al desarrollo de complicaciones como la esofagitis9,10, mayores síntomas extraesofágicos11 y otras enfermedades como el asma12.
En pacientes con ERGE erosivo, el estándar de oro del tratamiento es la supresión ácida con inhibidores de bomba de protones (IBP)13,14, los cuales administrados dos dosis al día, mejoran la calidad de sueño en los pacientes con síntomas nocturnos11 y producen una mejor supresión del ácido15. Las molestias nocturnas han estimulado otros diversos abordajes, incluyendo el baclofén, como un adyuvante para pacientes refractarios a los IBP16. Así mismo, para los síntomas nocturnos, tradicionalmente junto con los IBP, se han utilizado diversas intervenciones no farmacológicas, tales como medidas posturales y modificaciones del estilo de vida que incluyen la disminución del peso corporal, abandonar el tabaquismo y la abstención de la ingesta de alcohol, cafeína, comidas grasosas y ácidas, entre otras17. Sin embargo, la calidad de evidencia que apoya tales recomendaciones es baja y existe controversia sobre su aplicabilidad y eficacia18,19. En un análisis post hocde un estudio observacional posmarketing, se encontró que la recomendación de los cambios en el estilo de vida podría mejorar la calidad de vida de los pacientes, si se acompaña de la prescripción de IBP20. Dentro de las medidas posturales, la elevación de la cabecera de la cama es la que cuenta con mayor número de ensayos clínicos; no obstante, es una recomendación con bajo nivel de evidencia14,21–23 ya que los resultados de estudios aleatorizados son contradictorios y tienen limitaciones metodológicas y heterogeneidad en la medición de desenlaces18,24. Teniendo en cuenta lo anterior y la alta frecuencia con que se recomienda esta estrategia, incluyendo recientes guías de práctica clínica25 y recomendaciones de expertos17, se decidió realizar la presente investigación con el objetivo de determinar la eficacia de la elevación de la cabecera de la cama en el tratamiento de los síntomas de pacientes con ERGE y el impacto de dicha intervención en la calidad de vida de los pacientes.
Pacientes y métodosEl presente es un ensayo clínico controlado aleatorizado unicéntrico simple-ciego cruzado 2x2, en una muestra de pacientes con ERGE asistentes a la consulta externa o la sala de endoscopia en la Unidad de Gastroenterología y Endoscopia Digestiva de la Clínica Fundadores en la ciudad de Bogotá, Colombia. Los individuos fueron aleatorizados en dos brazos, en los cuales se administraron secuencias inversas de tratamiento durante dos períodos de 6 semanas, separados por un período de lavado de 2 semanas. La intervención fue elevar la cabecera de la cama mediante el uso de prismas estándar de 20cm de altura o dormir sin inclinación y todos los pacientes recibieron tratamiento farmacológico estándar durante todo el estudio, a criterio del gastroenterólogo tratante. Se proporcionó a cada paciente una pareja de prismas de madera para utilizar uno en cada pata de la cabecera de la cama, de tal manera que el ángulo de inclinación fue de aproximadamente 4,01° a 4,51°, dependiendo del largo de la cama. El protocolo y el consentimiento informado, fueron aprobados por los Comités de Ética e Investigación de las instituciones vinculadas. Todos los pacientes firmaron el consentimiento informado antes del inicio de la intervención.
Criterios de inclusiónSe incluyeron pacientes mayores de 18 años, que cumplieran todos los siguientes 4 criterios: 1) diagnóstico de ERGE y esofagitis erosiva, definida según el consenso de Montreal (erosiones esofágicas y síntomas típicos como pirosis y/o regurgitación con una frecuencia ≥ 2 veces/semana); 2) pirosis con duración ≥ 3 meses; 3) pirosis y/o regurgitación con una frecuencia ≥ 3 noches/semana y 4) presencia de alteración del sueño asociada a ERGE (insomnio de conciliación, insomnio de despertar, pobre calidad de sueño) con una frecuencia ≥ 3 noches/semana y con duración ≥ 1 mes. Se excluyeron del ensayo todos los pacientes con alguno de los siguientes criterios: ERGE sin erosiones esofágicas, úlcera péptica gástrica o duodenal, antecedente de cirugía gastrointestinal alta excepto colecistectomía, mujeres lactando o en estado de embarazo, trabajadores nocturnos (12 pm - 6am), síndrome de apnea-hipopnea obstructiva del sueño (con o sin uso de CPAP), enfermedad pulmonar obstructiva crónica, síndrome de piernas inquietas, ortopnea, necesidad de oxígeno nocturno (debido a comorbilidad cardiopulmonar), inicio o cambio reciente (< 3 meses) de fármacos para el sueño, tales como ansiolíticos, antihistamínicos o benzodiacepinas; consumo de más de 3 tazas (585mL) de café por día o aquellos que planeaban viajar a más de 3 zonas horarias durante el estudio.
Reclutamiento de pacientesLos pacientes fueron reclutados entre abril del 2016 y julio del 2017. Inicialmente se intentó incluir pacientes en tiempo real, procedentes de la consulta externa de gastroenterología. A causa de una baja tasa de reclutamiento con este método, se implementó un sistema de búsqueda activa de participantes mediante llamada telefónica, utilizando una base de datos de todas las endoscopias digestivas altas realizadas en la Unidad de Gastroenterología de la Clínica Fundadores en el período comprendido entre los años 2014 a 2016. Los pacientes fueron preseleccionados con base en el hallazgo endoscópico de esofagitis erosiva de cualquier grado en la endoscopia, el cual es uno de los criterios de inclusión del presente estudio. Para minimizar el sesgo de selección, 2 entrevistadores efectuaron las llamadas en orden consecutivo cronológico a todos los pacientes de la base de datos sin excepción y se utilizó en todos los casos el mismo formato estandarizado de llamada telefónica.
AleatorizaciónSe generó aleatoriamente una lista de 42 números con posterior transformación binomial, mediante el programa estadístico STATA SE 13.0 para Windows (StataCorp LP, Texas, EE. UU.) para asignar a los participantes en proporción 1:1 a cada uno de los brazos del estudio. Se marcó cada pareja de prismas de madera con un número de consecutivo del 1 al 42, y se almacenaron hasta su utilización manteniendo alejados dichos números de la vista del investigador encargado del reclutamiento de los pacientes. En el momento de reclutar al paciente, se verificó si existía una pareja de prismas marcada con el número de consecutivo asignado al paciente en orden de llegada, y se hizo entrega de los prismas de madera junto con instrucciones escritas y verbales para su uso durante el primer período. En caso de no existir una pareja de prismas de madera marcada con el consecutivo del paciente, el participante era asignado al otro brazo del estudio durante el primer período del ensayo clínico.
Ocultamiento de la asignaciónEl investigador encargado de aplicar los criterios de inclusión y exclusión, proporcionar el formato de consentimiento informado y diligenciar el formulario de datos básicos del paciente, no tuvo conocimiento de la secuencia aleatoria hasta que fueron diligenciados los documentos mencionados y el paciente fue asignado a un brazo del estudio mediante el número de consecutivo. En ese momento, otro miembro del equipo verificó la existencia de una pareja de prismas marcada con el mismo número de consecutivo asignado al paciente, y solo en ese momento se rompió el ocultamiento de la asignación.
CegamientoPor su naturaleza, la intervención no farmacológica no es susceptible de doble cegamiento; sin embargo, el investigador encargado del análisis estadístico y de la elaboración del reporte de resultados trabajó con códigos alfabéticos que enmascararon la intervención en cada uno de los períodos del estudio.
IntervencionesSe elaboraron 84 prismas de madera seca de pino con medidas 20x18x18cm a partir de 9 polines de 300x20x20cm en la planta de Aserrío San Ignacio Ltda. Ubicada en Soacha, Cundinamarca, Colombia. Se verificó la estabilidad de cada prisma de madera al apoyarlo sobre el suelo y se descartaron los productos inestables o con alturas atípicas resultantes del proceso industrial de corte y cepillado.
DesenlacesEn el desenlace primario se midió la efectividad mediante un cambio ≥ 0,6 puntos entre el cuestionario Reflux Disease Questionnaire (RDQ)26 basal y el administrado 6 semanas después del inicio de uso de la elevación de la cabecera de la cama (ECCA). Entre los desenlaces secundarios, se midió calidad de vida mediante el cambio ≥ 10 puntos entre el cuestionario Short Form-36 (SF-36)27 basal y el administrado 6 semanas después del inicio de la ECCA. Para ello, se utilizaron las versiones españolas tanto del RDQ28, como del SF-3629. La preferencia del paciente se midió como la proporción de pacientes que prefirieron la ECCA después de finalizadas las 14 semanas del estudio. Se evaluó la seguridad de la intervención mediante pregunta sistemática acerca de cualquier evento adverso durante las llamadas telefónicas de seguimiento en ambos brazos y períodos del estudio. Se definió como evento adverso grave a todo aquel que condujera a la suspensión de la ECCA.
Evaluación basal y seguimientoEl historial médico del paciente, consumo de medicamentos y otras variables basales, fueron registrados en un instrumento de recolección de datos diseñado para la investigación y la adherencia a la terapia farmacológica se midió según el test de Morisky-Green-Levine30. La información acerca de los síntomas fue evaluada al ingreso con el cuestionario RDQ y la evaluación de calidad de vida con el cuestionario SF-36. Después de la aleatorización a cada brazo del estudio, se realizó el seguimiento telefónico de acuerdo a un esquema dependiente de la asignación. Los pacientes que recibieron la ECCA, fueron seguidos semanalmente por dos semanas y luego quincenalmente por un mes, hasta finalizar las 6 semanas de cada período. Por su parte, los pacientes sin la ECCA fueron seguidos cada 3 semanas en cada período. Con el fin de verificar la adherencia a la ECCA y la correcta utilización de los prismas de madera, durante cada llamada telefónica se solicitó al paciente tomar un registro fotográfico de las patas delanteras de la cama y enviarlo por mensajería instantánea al número de celular o correo electrónico del investigador. Tanto al principio del estudio como al finalizar el primer período, se llenaron los cuestionarios autoadministrados RDQ y SF-36 y posteriormente se solicitó a los pacientes intervenidos devolver los prismas de madera para ser almacenados por los investigadores durante el período de lavado de 2 semanas. Transcurrido el período de lavado, se aplicaron de nuevo los cuestionarios RDQ y SF-36 con el fin de medir las condiciones basales del grupo que pasaría a utilizar la ECCA. A continuación, se entregó una pareja de prismas numerados a cada paciente que no había recibido la ECCA durante el primer período y se aplicó el mismo protocolo de seguimiento telefónico y fotográfico descrito para el primer período. Al finalizar el segundo período del estudio se diligenciaron nuevamente los cuestionarios autoadministrados RDQ y SF-36, pero además se preguntó la preferencia del paciente entre la ECCA y dormir sin inclinación alguna. No se realizó un seguimiento a los cambios del tratamiento farmacológico en cada brazo del estudio.
Cálculo del tamaño de la muestraSe trabajó una hipótesis nula de igualdad entre los cambios de puntuación RDQ y SF36 entre grupos y una hipótesis alternativa unidireccional de superioridad de la ECCA. El tamaño de la muestra se estimó basado en el supuesto de que la ECCA produciría una diferencia de al menos un 10% en las puntuaciones del cuestionario RDQ y SF-36. Se calculó un tamaño del efecto (d de Cohen) de 0,49 teniendo en cuenta una media y desviación estándar del RDQ de 3,3±1,0 previamente encontrada en población española con ERGE sintomático28 y una media y desviación estándar del SF-36 de 56,9±20,3 reportada en población italiana tratada médicamente con IBP31. La elección de la mínima diferencia importante fue basada en el supuesto de que cualquier diferencia menor al 10% no tendría relevancia clínica. Con base en estos datos, aproximadamente 14 pacientes por grupo proveerían un poder mayor al 80% para detectar la mínima diferencia importante mayor o igual a 0,6 puntos en el RDQ (rango: 1 a 6) y 10 puntos del SF-36 (rango: 0 a 100) al usar el estadístico pareado t de Student, como se describe en el plan de análisis estadístico. Dado que se planea realizar un análisis complementario del presente estudio cross-over mediante la prueba de homogeneidad marginal de McNemar, se recalculó el tamaño del efecto basado en los resultados de un ensayo clínico previo32, según el cual el 58,8% y el 28,6% de los pacientes tratados con placebo en la era preomeprazol mejoraron los síntomas de ERGE con y sin la ECCA, respectivamente. Con base en lo anterior, y manteniendo un poder estadístico del 80%, se ajustó el tamaño de muestra requerido a un total de 34 pacientes. Finalmente, el tamaño calculado de la muestra se incrementó en un 20% para evitar que eventuales pérdidas de seguimiento o abandonos afectaran el poder del estudio, de tal manera que el tamaño final de la muestra fue de 42 pacientes, 21 pacientes por grupo. En el material suplementario, se adjuntan las matrices para el cálculo de la muestra con base en el estudio citado y se presenta el resultado del cálculo de la muestra con el software G*Power 3.1.9.2 (Universität Düsseldorf, Düseldorf, Alemania)33.
Análisis estadísticoLas variables numéricas y categóricas recolectadas en el formato de datos básicos, cuestionarios RDQ y SF-36 y el cuestionario de preferencia del paciente, fueron digitadas en una base de datos en el programa Microsoft Excel 2007 (Microsoft Corp. EE. UU.) y los grupos de intervención fueron enmascarados con un código alfabético elaborado por un colaborador independiente que no intervino en el análisis estadístico ni elaboró el reporte de resultados. Para su análisis estadístico, la base de datos se importó al programa STATA SE 13.0 para Windows (StataCorp LP, Texas, EE. UU.) y se estudió la estadística descriptiva de cada variable. Se buscaron diferencias estadísticamente significativas entre variables categóricas mediante la prueba de Chi cuadrado o prueba exacta de Fisher y para las variables numéricas continuas se aplicó primero la prueba de normalidad de Shapiro-Wilk. Para las variables numéricas continuas de distribución normal se buscaron diferencias estadísticamente significativas con la prueba t de Student pareada. Alternativamente, para aquellas variables que no mostraron distribución normal, se utilizó la prueba U de Mann-Whitney. Para las variables de distribución no normal debida a datos atípicos, se excluyeron los valores que fuesen mayores o menores a la suma del percentil 50 y 1,5 veces el rango intercuartil. Como exploración complementaria del desenlace primario y del desenlace secundario calidad de vida, se transformó la diferencia de puntuación de los cuestionarios RDQ y SF-36 en variable binomial de acuerdo a si cumplieron o no con el criterio predeterminado de cada desenlace. Posteriormente, se aplicó a los datos transformados la prueba de homogeneidad marginal de McNemar y se utilizó McNemar mid-p si la suma de parejas discordantes era menor a 2534. Diferencias con p<0,05 a una cola para todas las pruebas con hipótesis unidireccional, se aceptaron como estadísticamente significativas. El análisis de subgrupos fue exploratorio y se buscaron diferencias estratificadas de acuerdo a grupo etario, sexo, raza, categoría de IMC, comorbilidades, tazas de café al día, adherencia farmacológica, grado de esofagitis y duración de los síntomas, entre otras 16 variables recolectadas al inicio del estudio. Se realizaron pruebas de interacción entre subgrupos con el estadístico Chi cuadrado o la prueba exacta de Fisher, de acuerdo al número de individuos analizado, y la magnitud del efecto se expresó mediante el riesgo relativo univariado de un modelo lineal generalizado de familia binomial. Como parte del control de calidad interno del ensayo clínico, se realizó una preprueba con el fin de demostrar la presunción de un efecto carry-over despreciable, siguiendo las recomendaciones de expertos evaluadores de publicaciones científicas35. Igualmente, se efectuó un análisis de varianza (ANOVA) para estudios cross-over, que buscó efectos significativos de secuencia, período y tratamiento, asumiendo un efecto carry-over despreciable. En el análisis por intención de tratar modificado, se incluyeron los participantes que violaron el protocolo al demostrar mala adherencia a la ECCA, pero no fue posible incluir en este análisis a los pacientes que se retiraron del estudio debido a que no se alcanzó a recolectar la información concerniente al desenlace primario y al desenlace secundario calidad de vida.
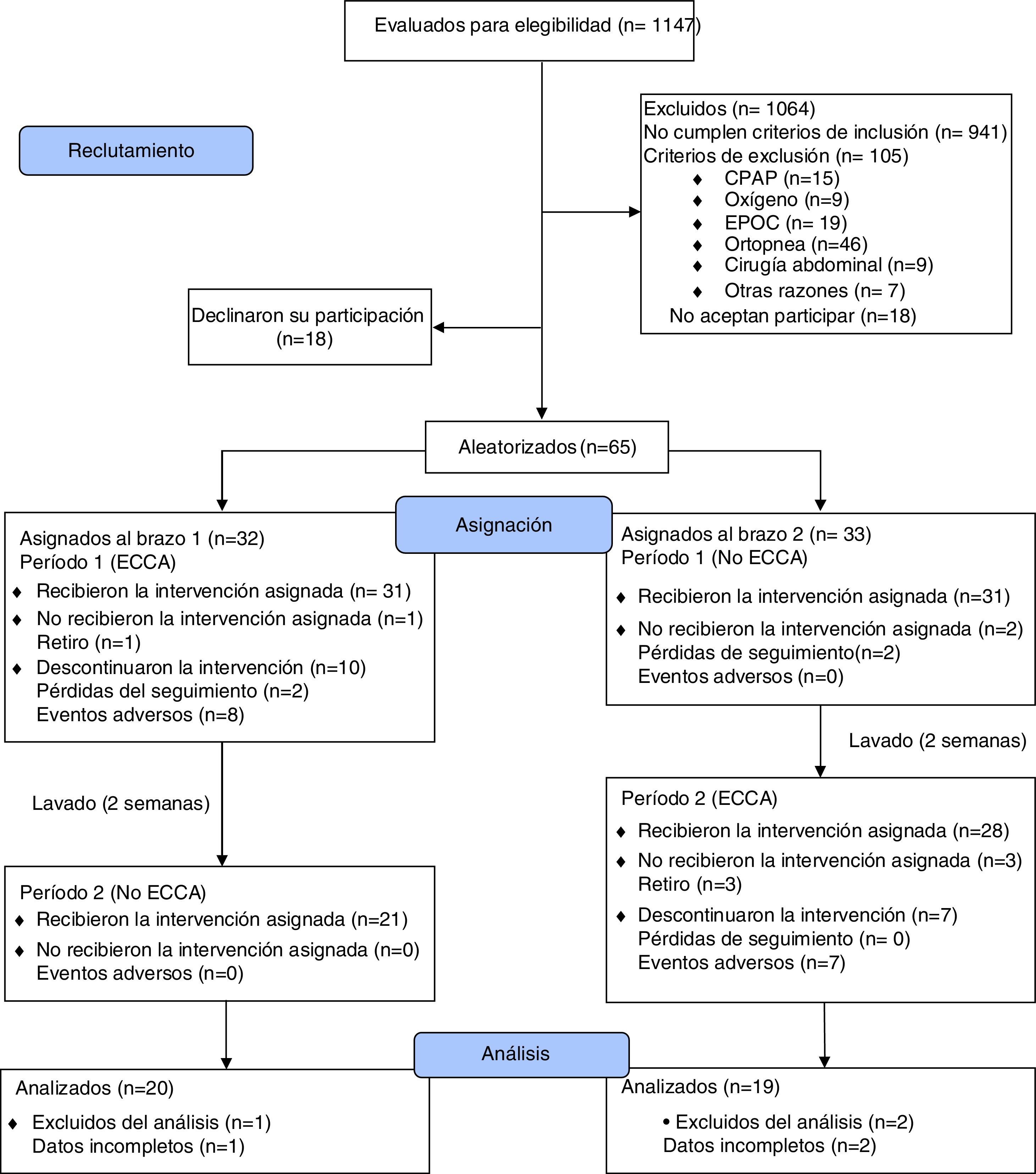
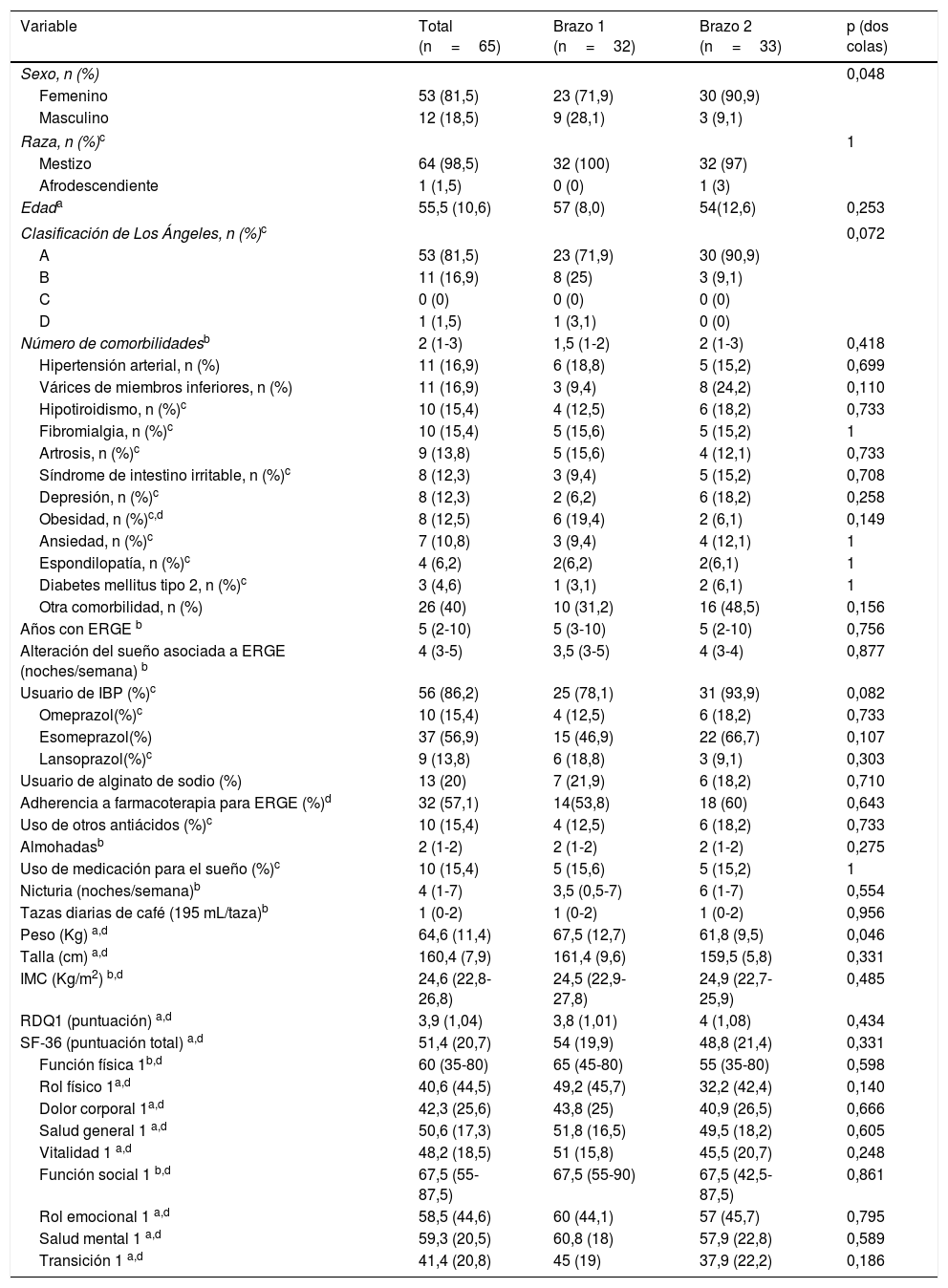
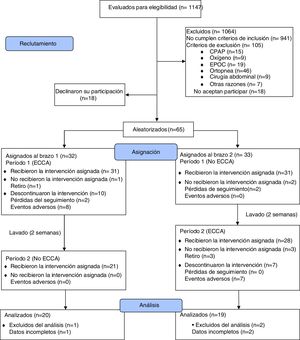
ResultadosEntre abril del 2016 y julio del 2017, se evaluaron 1147 pacientes potencialmente elegibles, de los cuales se excluyeron 1064 pacientes por no cumplimiento de los criterios de inclusión (n=941) o por la presencia de algún criterio de exclusión (n=105). Treinta y seis pacientes decidieron no participar antes de iniciar el ensayo clínico. En la figura 1, se muestra el diagrama de flujo de participantes de acuerdo con lo recomendado en la declaración CONSORT del año 201036. Finalmente, fueron aleatorizados 65 pacientes en 2 brazos de 33 y 32 participantes, y 39 pacientes (60%) completaron el estudio. Las características basales de los participantes en ambos brazos del estudio estuvieron balanceadas, excepto por un menor peso corporal medio en el brazo 2, el cual no generó diferencias en el IMC medio entre brazos. Se encontró asociación entre las variables sexo y brazo del estudio, debido a una mayor proporción de mujeres en cada uno de los brazos. Durante el ensayo clínico, el 86,2% de los pacientes del estudio recibieron terapia farmacológica estándar con IBP y/o alginato de sodio con una adherencia del 57,1% (IC95%: 44,2 a 70,1; Z: 1,07; p: 0,2850 a dos colas) (tabla 1). La adherencia a la ECCA, por su parte, fue del 70,6% (IC95%: 58,1 a 83,1; Z: 2,94; p: 0,0033 a dos colas).
Características basales de los pacientes reclutados
| Variable | Total (n=65) | Brazo 1 (n=32) | Brazo 2 (n=33) | p (dos colas) |
|---|---|---|---|---|
| Sexo, n (%) | 0,048 | |||
| Femenino | 53 (81,5) | 23 (71,9) | 30 (90,9) | |
| Masculino | 12 (18,5) | 9 (28,1) | 3 (9,1) | |
| Raza, n (%)c | 1 | |||
| Mestizo | 64 (98,5) | 32 (100) | 32 (97) | |
| Afrodescendiente | 1 (1,5) | 0 (0) | 1 (3) | |
| Edada | 55,5 (10,6) | 57 (8,0) | 54(12,6) | 0,253 |
| Clasificación de Los Ángeles, n (%)c | 0,072 | |||
| A | 53 (81,5) | 23 (71,9) | 30 (90,9) | |
| B | 11 (16,9) | 8 (25) | 3 (9,1) | |
| C | 0 (0) | 0 (0) | 0 (0) | |
| D | 1 (1,5) | 1 (3,1) | 0 (0) | |
| Número de comorbilidadesb | 2 (1-3) | 1,5 (1-2) | 2 (1-3) | 0,418 |
| Hipertensión arterial, n (%) | 11 (16,9) | 6 (18,8) | 5 (15,2) | 0,699 |
| Várices de miembros inferiores, n (%) | 11 (16,9) | 3 (9,4) | 8 (24,2) | 0,110 |
| Hipotiroidismo, n (%)c | 10 (15,4) | 4 (12,5) | 6 (18,2) | 0,733 |
| Fibromialgia, n (%)c | 10 (15,4) | 5 (15,6) | 5 (15,2) | 1 |
| Artrosis, n (%)c | 9 (13,8) | 5 (15,6) | 4 (12,1) | 0,733 |
| Síndrome de intestino irritable, n (%)c | 8 (12,3) | 3 (9,4) | 5 (15,2) | 0,708 |
| Depresión, n (%)c | 8 (12,3) | 2 (6,2) | 6 (18,2) | 0,258 |
| Obesidad, n (%)c,d | 8 (12,5) | 6 (19,4) | 2 (6,1) | 0,149 |
| Ansiedad, n (%)c | 7 (10,8) | 3 (9,4) | 4 (12,1) | 1 |
| Espondilopatía, n (%)c | 4 (6,2) | 2(6,2) | 2(6,1) | 1 |
| Diabetes mellitus tipo 2, n (%)c | 3 (4,6) | 1 (3,1) | 2 (6,1) | 1 |
| Otra comorbilidad, n (%) | 26 (40) | 10 (31,2) | 16 (48,5) | 0,156 |
| Años con ERGE b | 5 (2-10) | 5 (3-10) | 5 (2-10) | 0,756 |
| Alteración del sueño asociada a ERGE (noches/semana) b | 4 (3-5) | 3,5 (3-5) | 4 (3-4) | 0,877 |
| Usuario de IBP (%)c | 56 (86,2) | 25 (78,1) | 31 (93,9) | 0,082 |
| Omeprazol(%)c | 10 (15,4) | 4 (12,5) | 6 (18,2) | 0,733 |
| Esomeprazol(%) | 37 (56,9) | 15 (46,9) | 22 (66,7) | 0,107 |
| Lansoprazol(%)c | 9 (13,8) | 6 (18,8) | 3 (9,1) | 0,303 |
| Usuario de alginato de sodio (%) | 13 (20) | 7 (21,9) | 6 (18,2) | 0,710 |
| Adherencia a farmacoterapia para ERGE (%)d | 32 (57,1) | 14(53,8) | 18 (60) | 0,643 |
| Uso de otros antiácidos (%)c | 10 (15,4) | 4 (12,5) | 6 (18,2) | 0,733 |
| Almohadasb | 2 (1-2) | 2 (1-2) | 2 (1-2) | 0,275 |
| Uso de medicación para el sueño (%)c | 10 (15,4) | 5 (15,6) | 5 (15,2) | 1 |
| Nicturia (noches/semana)b | 4 (1-7) | 3,5 (0,5-7) | 6 (1-7) | 0,554 |
| Tazas diarias de café (195 mL/taza)b | 1 (0-2) | 1 (0-2) | 1 (0-2) | 0,956 |
| Peso (Kg) a,d | 64,6 (11,4) | 67,5 (12,7) | 61,8 (9,5) | 0,046 |
| Talla (cm) a,d | 160,4 (7,9) | 161,4 (9,6) | 159,5 (5,8) | 0,331 |
| IMC (Kg/m2) b,d | 24,6 (22,8-26,8) | 24,5 (22,9-27,8) | 24,9 (22,7-25,9) | 0,485 |
| RDQ1 (puntuación) a,d | 3,9 (1,04) | 3,8 (1,01) | 4 (1,08) | 0,434 |
| SF-36 (puntuación total) a,d | 51,4 (20,7) | 54 (19,9) | 48,8 (21,4) | 0,331 |
| Función física 1b,d | 60 (35-80) | 65 (45-80) | 55 (35-80) | 0,598 |
| Rol físico 1a,d | 40,6 (44,5) | 49,2 (45,7) | 32,2 (42,4) | 0,140 |
| Dolor corporal 1a,d | 42,3 (25,6) | 43,8 (25) | 40,9 (26,5) | 0,666 |
| Salud general 1 a,d | 50,6 (17,3) | 51,8 (16,5) | 49,5 (18,2) | 0,605 |
| Vitalidad 1 a,d | 48,2 (18,5) | 51 (15,8) | 45,5 (20,7) | 0,248 |
| Función social 1 b,d | 67,5 (55-87,5) | 67,5 (55-90) | 67,5 (42,5-87,5) | 0,861 |
| Rol emocional 1 a,d | 58,5 (44,6) | 60 (44,1) | 57 (45,7) | 0,795 |
| Salud mental 1 a,d | 59,3 (20,5) | 60,8 (18) | 57,9 (22,8) | 0,589 |
| Transición 1 a,d | 41,4 (20,8) | 45 (19) | 37,9 (22,2) | 0,186 |
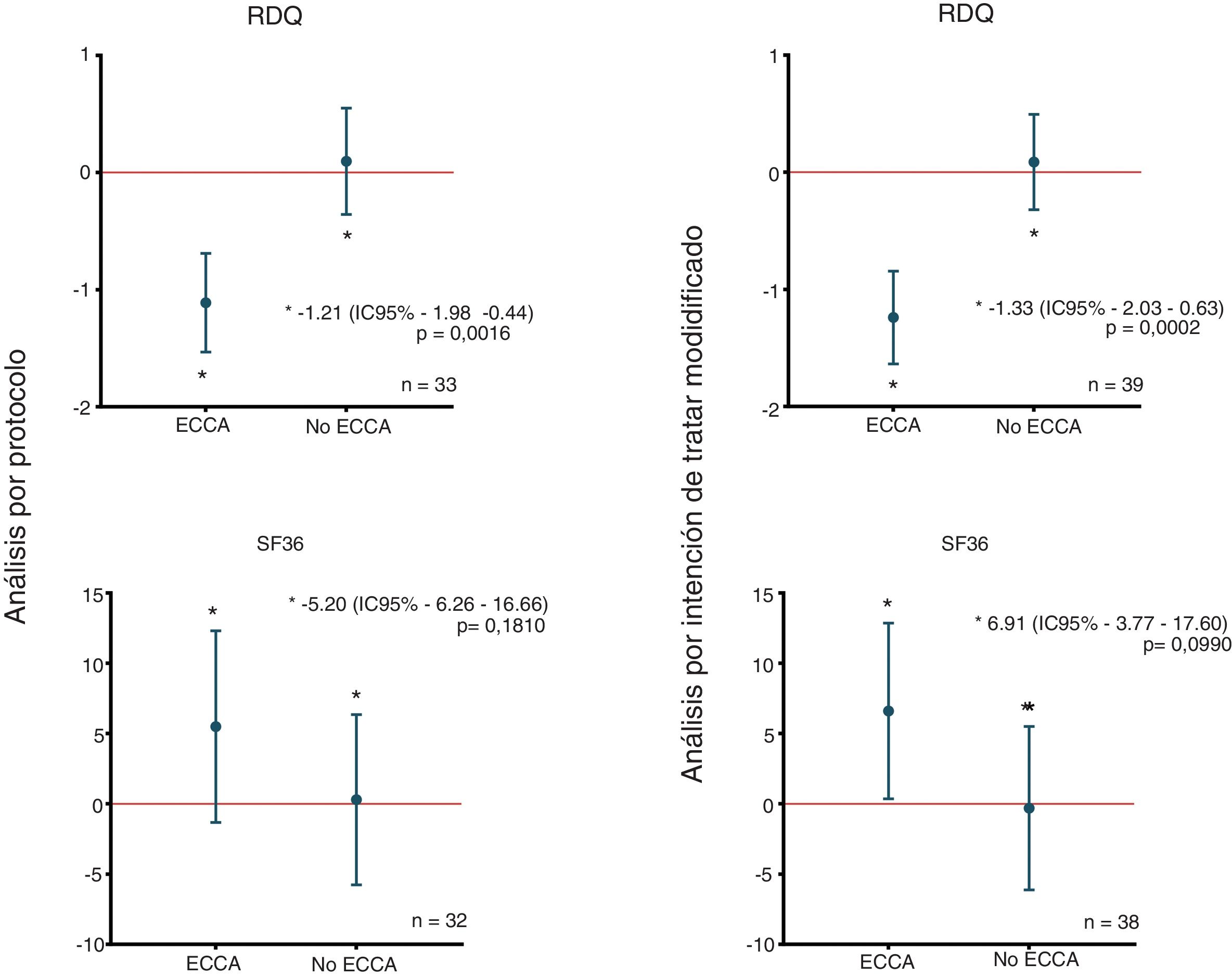
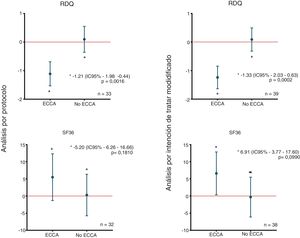
En el análisis por intención de tratar modificado, al aplicar la prueba de homogeneidad marginal de McNemar, se observó una disminución mayor o igual al 10% en la puntuación RDQ asociada al uso de la ECCA en 27 (69,2%) de los 39 pacientes que utilizaron la ECCA; hallazgo que fue consistente en el análisis por protocolo, como se muestra en la tabla 2. La disminución media de la puntuación RDQ fue de -1,24 (IC95% -1,64 a -0,84) cuando los pacientes recibieron la ECCA y de 0,09 (IC95% -0,32 a 0,49) cuando no la recibieron, y de igual manera, en el análisis por protocolo fueron obtenidos cambios de puntuación similares de -1,11 (IC95% -1,53 a -0,69) y 0,10 (IC95% -0,36 a 0,55) para ECCA y no ECCA, respectivamente (fig. 2). No se encontró un cambio significativo en las subpuntuaciones del RDQ para regurgitación ácida (-0,3 IC95% -1,38 a 0,78) y pirosis (0,3 IC95% -0,99 a 1,59) asociado al uso de la ECCA. De acuerdo con la prueba preliminar descrita por Wellek et al.35 no se encontró evidencia de un efecto carry-over relevante sobre el desenlace primario (t=-1,6735; df=37; p=0,1027). Con el fin de probar la posibilidad de efectos de secuencia (brazo) o período en el desenlace primario, se efectuó un análisis de varianza para estudios cruzados asumiendo un efecto carry-over despreciable, el cual solo arrojó resultados significativos para el efecto de la ECCA sobre el desenlace primario (tabla suplementaria 2 del anexo).
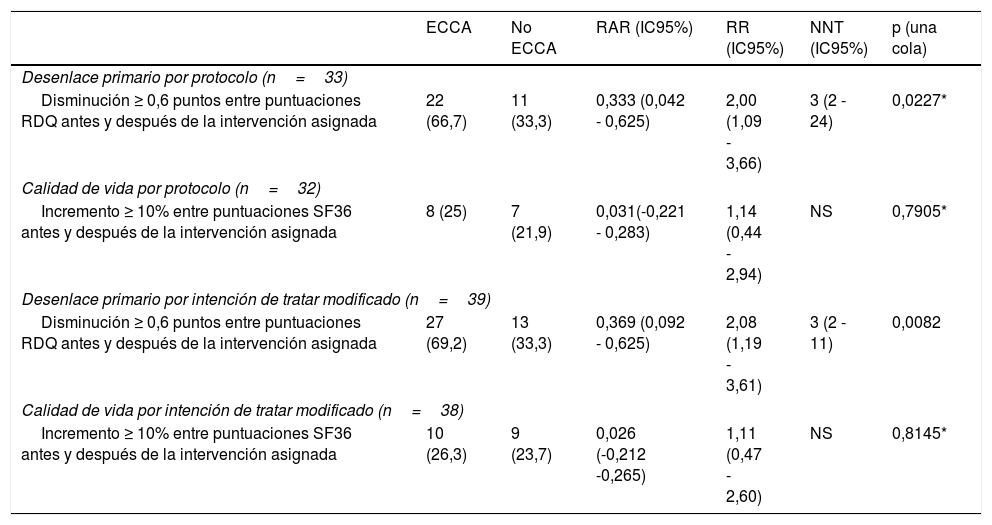
Desenlace primario y de calidad de vida
| ECCA | No ECCA | RAR (IC95%) | RR (IC95%) | NNT (IC95%) | p (una cola) | |
|---|---|---|---|---|---|---|
| Desenlace primario por protocolo (n=33) | ||||||
| Disminución ≥ 0,6 puntos entre puntuaciones RDQ antes y después de la intervención asignada | 22 (66,7) | 11 (33,3) | 0,333 (0,042 - 0,625) | 2,00 (1,09 - 3,66) | 3 (2 - 24) | 0,0227* |
| Calidad de vida por protocolo (n=32) | ||||||
| Incremento ≥ 10% entre puntuaciones SF36 antes y después de la intervención asignada | 8 (25) | 7 (21,9) | 0,031(-0,221 - 0,283) | 1,14 (0,44 - 2,94) | NS | 0,7905* |
| Desenlace primario por intención de tratar modificado (n=39) | ||||||
| Disminución ≥ 0,6 puntos entre puntuaciones RDQ antes y después de la intervención asignada | 27 (69,2) | 13 (33,3) | 0,369 (0,092 - 0,625) | 2,08 (1,19 - 3,61) | 3 (2 - 11) | 0,0082 |
| Calidad de vida por intención de tratar modificado (n=38) | ||||||
| Incremento ≥ 10% entre puntuaciones SF36 antes y después de la intervención asignada | 10 (26,3) | 9 (23,7) | 0,026 (-0,212 -0,265) | 1,11 (0,47 - 2,60) | NS | 0,8145* |
En la tabla, se observa la magnitud del efecto de la ECCA en el desenlace primario y la calidad de vida, de acuerdo al tipo de análisis del estudio.
ECCA: elevación de la cabecera de la cama; n: número de individuos; NNT: número necesario a tratar; RAR: reducción absoluta de riesgo; RR: riesgo relativo.
Diferencias en los cambios medios de puntuación RDQ y SF-36 de acuerdo a la asignación. En la figura se observan las diferencias en los cambios medios de puntuación entre grupos y de acuerdo al tipo de análisis del estudio, para los puntajes RDQ (arriba) y SF-36 (abajo). ECCA: elevación de la cabecera de la cama; n: número de pacientes; RDQ: Reflux Disease Questionnaire; SF36: Short Form 36.
No se encontraron cambios mayores o iguales al 10% en la puntuación SF-36 asociados al uso de la ECCA mediante la prueba de McNemar (tabla 2). En el análisis por intención de tratar modificado, el incremento medio de la puntuación SF-36 fue de 6,60 (IC95% 0,34 a 12,85) cuando los pacientes recibieron la ECCA y de -0,31 (IC95% -6,12 a 5,50) cuando no la recibieron. Del mismo modo, se obtuvieron cambios comparables de puntuación en el análisis por protocolo: 5,48 (IC95% -1,34 a 12,30) para ECCA y 0,29 (IC95% -5,77 a 6,34) para no ECCA (fig. 2). Al igual que para el desenlace primario, no se encontró evidencia de un efecto carry-over relevante sobre el desenlace calidad de vida (Z=0,409; p=0,6823). Finalmente, el ANOVA para estudios cruzados no mostró efectos significativos de secuencia, período o ECCA sobre el cambio en la puntuación SF-36 (tabla suplementaria 2 del anexo).
La preferencia de los participantes se encontró a favor de la ECCA en el análisis por protocolo (proporción: 77,1%; Z: 3,21; IC95%: 63,2 a 91,1; p=0,0007 a una cola) y mantuvo su significación en el análisis por intención de tratar modificado (proporción: 63,2%; Z: 1,99; IC95%: 50,6 a 75,7; p=0,0235 a una cola).
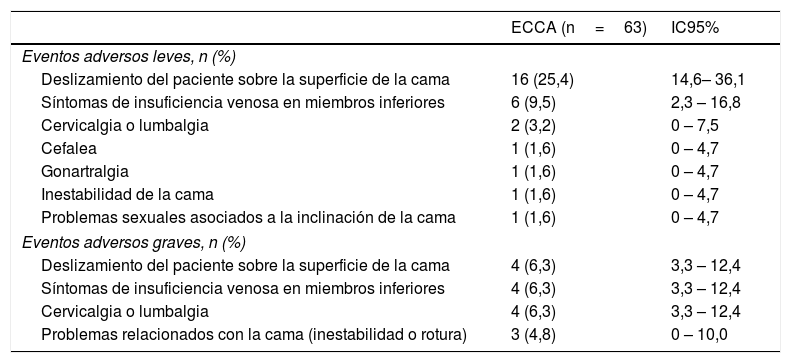
SeguridadLa población en riesgo de eventos adversos se definió como aquella que estaba presente al iniciar los períodos de intervención activa con la ECCA. Treinta y cuatro de estos 63 participantes reportaron algún efecto adverso durante el uso de la ECCA (proporción: 54,0%; IC95%: 41,7 a 66,3) y 15 de estos 34 pacientes tuvieron que suspender la ECCA debido a un efecto adverso de la intervención experimental (proporción: 23,8%; IC95%: 15,0 a 35,6); no obstante, ningún participante tuvo que buscar ayuda médica para resolver el efecto adverso asociado a la ECCA (tabla 3). Solo un paciente experimentó un evento adverso no relacionado con la ECCA que requirió hospitalización, debido a un síndrome de Stevens-Johnson asociado a la terapia farmacológica para una de sus comorbilidades. El tiempo medio de utilización de la ECCA, dentro del grupo de pacientes que suspendieron la intervención no farmacológica debido a efectos adversos, fue de 6±3 noches (media±DE).
Eventos adversos secundarios al uso de la ECCA
| ECCA (n=63) | IC95% | |
|---|---|---|
| Eventos adversos leves, n (%) | ||
| Deslizamiento del paciente sobre la superficie de la cama | 16 (25,4) | 14,6– 36,1 |
| Síntomas de insuficiencia venosa en miembros inferiores | 6 (9,5) | 2,3 – 16,8 |
| Cervicalgia o lumbalgia | 2 (3,2) | 0 – 7,5 |
| Cefalea | 1 (1,6) | 0 – 4,7 |
| Gonartralgia | 1 (1,6) | 0 – 4,7 |
| Inestabilidad de la cama | 1 (1,6) | 0 – 4,7 |
| Problemas sexuales asociados a la inclinación de la cama | 1 (1,6) | 0 – 4,7 |
| Eventos adversos graves, n (%) | ||
| Deslizamiento del paciente sobre la superficie de la cama | 4 (6,3) | 3,3 – 12,4 |
| Síntomas de insuficiencia venosa en miembros inferiores | 4 (6,3) | 3,3 – 12,4 |
| Cervicalgia o lumbalgia | 4 (6,3) | 3,3 – 12,4 |
| Problemas relacionados con la cama (inestabilidad o rotura) | 3 (4,8) | 0 – 10,0 |
En la tabla, se reportan las reacciones adversas autorreportadas secundarias al uso de la ECCA en la muestra estudiada. ECCA: elevación de la cabecera de la cama.
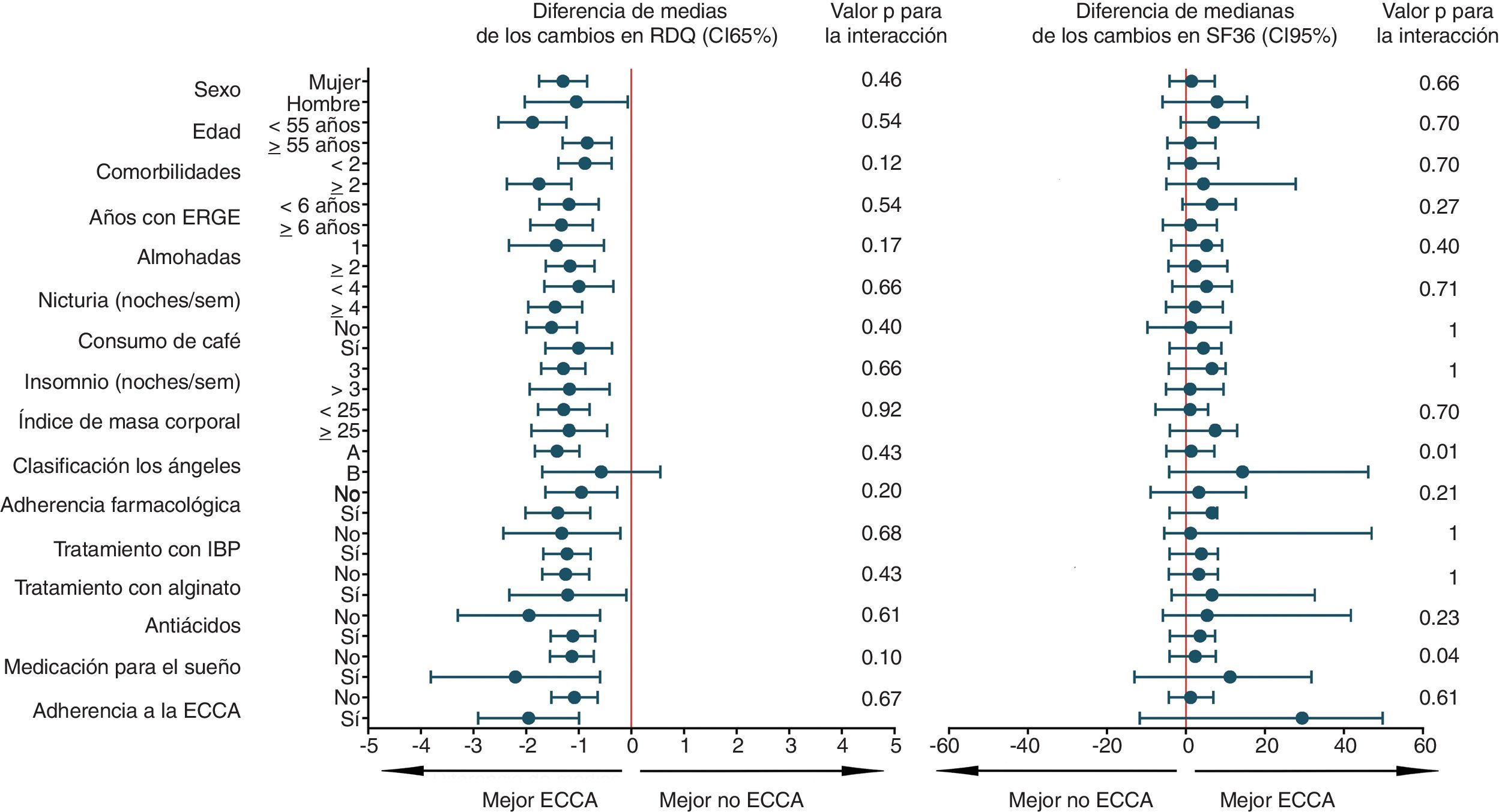
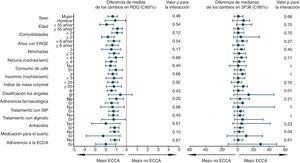
El análisis de subgrupos para el desenlace primario, calidad de vida, preferencia y cualquier reacción adversa fue de carácter univariado y exploratorio. Se incluyeron 16 variables y se construyeron diagramas de Forest para visualizar la heterogeneidad del efecto de la ECCA, junto con estadísticos de magnitud e interacción. En la figura 3 y figura suplementaria 5 del anexo se reportan todos los 64 análisis post hoc efectuados. Según este análisis, los pacientes con 2 o más comorbilidades y con IMC ≥ 25, es más probable que no prefieran ECCA después de probar ambas alternativas. Igualmente, ninguno de los factores que definen los subgrupos parece incrementar el riesgo de cualquier efecto adverso (figura suplementaria 5 del anexo). Con el fin de abordar el problema de la multiplicidad, no se ajustaron formalmente los valores de p, pero se estimó con base en el nivel de significación predeterminado y el número de análisis, que hasta 3 interacciones estadísticamente significativas (p<0,05) ocurrieron puramente por efecto del azar.
Análisis de subgrupos para el desenlace primario y calidad de vida.
En la figura se muestra el análisis de subgrupos exploratorio, en el cual se representan las diferencias aritméticas de media y mediana, para el desenlace primario y calidad de vida respectivamente. ECCA: elevación de la cabecera de la cama; ERGE: enfermedad por reflujo gastroesofágico; IBP: inhibidor de bomba de protones; RDQ: Reflux Disease Questionnaire; sem: semana; SF36: Short Form 36.
Como puede verse en la figura 1, de los 59 pacientes que utilizaron la ECCA 17 suspendieron la intervención y 15 de ellos lo hicieron por efectos adversos de la intervención no farmacológica. Dado que 14 de estos 15 pacientes no aportaron información de puntuaciones RDQ y SF36 en el seguimiento, no fue posible incluirlos desde el principio en el análisis por intención de tratar modificado. Ante la posibilidad de que esta información faltante afectara las conclusiones del ensayo clínico, se realizó de nuevo el análisis por intención de tratar modificado utilizando un modelo de máxima verosimilitud con información completa para datos faltantes. Para estimar el efecto que las puntuaciones faltantes tendrían en los desenlaces principales, se incluyeron en el modelo variables auxiliares que demostraron predecir tanto los puntajes observados como la ausencia de los mismos, de acuerdo con metodología publicada37,38. La figura suplementaria 6 del anexo muestra que la adición de la información faltante al análisis por intención de tratar modificado (n=53), no modifica ni la magnitud ni la dirección de los desenlaces de efectividad y calidad de vida.
DiscusiónEn el presente trabajo, se encontró que en pacientes con ERGE y síntomas nocturnos tratados ambulatoriamente con IBP, el uso de la ECCA durante 6 semanas redujo significativamente los síntomas de reflujo, comparado con dormir sin esa elevación. La magnitud del efecto superó la mínima diferencia clínicamente importante del 10% en la puntuación del RDQ, que había sido preespecificada antes del inicio del ensayo clínico, y fue consistente en el análisis por intención de tratar modificado, por protocolo y a lo largo de la mayoría de subgrupos relevantes. Del mismo modo, no se encontró evidencia de un efecto carry-over, de período o de secuencia que hubiese podido afectar la validez del desenlace primario.
El resultado en el desenlace primario contrasta con el de un estudio aleatorizado multicéntrico previo39, en el cual no se encontró mejoría de los síntomas de reflujo con el uso de la ECCA; sin embargo, la ausencia de un efecto de la ECCA sobre los síntomas podría explicarse por un corto período de seguimiento de 15 días y una magnitud de la ECCA de 15cm, que fue menor a la utilizada en el presente estudio. Por su parte, en el estudio de Harvey et al.32, en el cual se utilizó la misma altura de la ECCA e igual tiempo de intervención activa que en el presente ensayo clínico, se encontró mejoría sintomática y endoscópica con el uso de la ECCA en pacientes con esofagitis grado C-D, en una época en la que los IBP aún no se habían introducido en la práctica clínica40. Lo anterior muestra la consistencia del efecto de la ECCA en la mejoría de los síntomas de reflujo como terapia coadyuvante para pacientes ya tratados farmacológicamente, y se puede considerar como evidencia complementaria, dado que en la fase de reclutamiento del presente trabajo no se encontraron pacientes con esofagitis grado C-D que cumplieran con los criterios de inclusión. Igualmente, los estudios clínicos no aleatorizados hasta la fecha publicados, también han mostrado asociación entre el uso de la ECCA y la mejoría de los síntomas de ERGE41,42. Por otra parte, con base en el análisis de subgrupos exploratorio para el desenlace primario (fig. 3), se plantea el interrogante de si la ECCA es realmente efectiva en pacientes no tratados con IBP, el cual podría ser puesto a prueba en un futuro ensayo clínico.
La mejoría de la puntuación de calidad de vida SF-36 después del uso de la ECCA, no alcanzó la magnitud predeterminada como clínicamente relevante del 10% y, al igual que para el desenlace primario, se descartó que efectos carry-over, de período o de secuencia hubieran podido influir en el resultado. El análisis de subgrupos exploratorio mostró que el efecto fue en general homogéneo para este desenlace. No se descarta que el presente trabajo haya tenido un bajo poder para detectar diferencias en calidad de vida, dado que hasta la fecha no se disponía de ensayos clínicos previos que incluyeran este desenlace y la ECCA como intervención terapéutica, a partir de los cuales estimar datos importantes como la proporción de parejas discordantes. Esta información es necesaria para calcular el tamaño del efecto de la ECCA sobre la variable SF-36, y así ajustar el tamaño muestral para una prueba de homogeneidad marginal como McNemar; procedimiento que sí pudo efectuarse sin problema para el desenlace primario. Dicho esto, no se descarta un posible impacto estadísticamente significativo de la ECCA en la calidad de vida de los pacientes que pudiera ser demostrado en un ensayo clínico con mayor número de participantes.
Después de probar tanto dormir con la ECCA como dormir con la posición estándar, los participantes del presente ensayo clínico prefirieron significativamente la ECCA, lo cual es consistente con lo encontrado en el ensayo clínico cross-over de Hamilton et al. En el estudio citado, después de un corto período de exposición a las terapias experimentales de tan solo una noche y no haber reportado el período de lavado, 9 de 15 pacientes prefirieron la ECCA en términos de comodidad, cuando se comparó con dormir con una almohada en forma de cuña (proporción: 60%; IC95%: 35 a 85; p: 0,439 a dos colas)43. Es de anotar, que la preferencia hallada en el presente estudio se encuentra dentro de los límites del intervalo de confianza calculado para la preferencia encontrada en el estudio de Hamilton et al. Con base en el análisis de subgrupos exploratorio, podría plantearse la hipótesis de una relación entre una buena adherencia a la ECCA y un mayor éxito de esta intervención, debido quizá a un mejor uso de la terapia no farmacológica; lo cual pudo ocasionar una mayor preferencia por la ECCA en estos participantes (figura suplementaria 5 del anexo). De igual modo, podría existir una asociación entre la presencia de sobrepeso o de un mayor número de comorbilidades y mayores efectos adversos de la ECCA; lo cual pudo influir en que estos pacientes prefirieran menos la intervención no farmacológica. No obstante, estas presunciones no pueden ser probadas con la evidencia del presente estudio y se requiere un ensayo clínico con mayor número de participantes para evaluarlas.
En el presente ensayo clínico, más de la mitad de los pacientes experimentaron alguna reacción adversa secundaria al uso de la ECCA y cerca de una cuarta parte de los pacientes expuestos al tratamiento experimental tuvieron que suspender la ECCA debido a un evento adverso. Resulta interesante que en tan solo 2 de los 6 estudios clínicos publicados hasta la fecha, se haya hecho mención a algún efecto adverso asociado a la ECCA32,39,41–44. En el ensayo de Harvey et al. se reportó que 2 de los 32 pacientes expuestos a la ECCA tuvieron algún efecto adverso (deslizamiento, problemas sexuales), pero esto no determinó la suspensión de la intervención32. Por su parte, en el artículo publicado por Hamilton et al., solo se hace mención de que ningún paciente, de una muestra de 15 participantes, sufrió deslizamientos a causa de la ECCA43. El marcado contraste de estos hallazgos puede ser explicado por varias razones. En el presente trabajo se predefinió antes del reclutamiento de pacientes un desenlace específico de seguridad de la intervención y el tiempo de seguimiento fue de 14 semanas; mucho mayor que el de los otros estudios citados. Finalmente, cada paciente recibió por protocolo 6 llamadas telefónicas a lo largo del estudio (4 en el período de la ECCA y 2 en el período sin inclinación de la cama) durante las cuales se preguntó sistemáticamente por reacciones adversas. Los hallazgos del presente ensayo clínico ponen de manifiesto la pobre tolerancia a esta intervención no farmacológica, con el grado de inclinación puesto a prueba. Se desconoce si un menor grado de inclinación minimizaría los efectos adversos sin comprometer el beneficio sobre los síntomas de reflujo.
Dentro de las limitaciones de este ensayo clínico, se encuentra la posibilidad de que la medición de la adherencia a la ECCA mediante registro fotográfico seriado de los bloques de madera en posición, no sea suficiente para descartar un uso discontinuo de la intervención. Sin embargo, se consideró impráctico e inviable desde un punto de vista operativo, realizar visitas sorpresa a cada uno de los participantes para verificar la adherencia. Por otra parte, el hallazgo de una preferencia por la ECCA más marcada en pacientes adherentes a la intervención (análisis por protocolo) apunta a que el cumplimiento con el registro fotográfico pudo ser un buen predictor del adecuado uso de la ECCA durante el ensayo clínico. Existe la posibilidad de un sesgo no diferencial debido a que no se realizó un seguimiento de los cambios del tratamiento farmacológico de cada paciente a lo largo de los períodos de intervención activa y de lavado; sin embargo, la aleatorización y la naturaleza cruzada del diseño disminuyen la probabilidad de que un eventual sesgo de confusión distorsione el efecto terapéutico de la ECCA en una manera direccionada. Adicionalmente, la validez externa del presente estudio pudo haber disminuido debido a que en su mayoría se contó con participantes en la categoría A y B de la clasificación de Los Ángeles. No obstante, esto pudo resultar conveniente dado que ya se cuenta con evidencia de un efecto terapéutico de la ECCA en pacientes con esofagitis grado C-D32, no así para el grupo de pacientes con grados más leves de erosión de la mucosa esofágica. Con respecto a la significación clínica de los cambios de puntuación RDQ y SF-36 asociados al uso de la ECCA, la elección de un cambio ≥ 10% como diferencia mínima clínicamente relevante fue puramente empírica; no obstante, el desenlace preferencia del paciente sugiere que los cambios favorables en la puntuación RDQ sí se asocian a una mayor preferencia de la terapia por parte de los pacientes, por lo que el efecto en los síntomas percibido por los participantes pudo haber sido clínicamente significativo con este punto de corte. Por otro lado, se reconoce que la cronología del seguimiento telefónico es diferente en los 2 grupos (ECCA y no ECCA), como puede verse en la figura suplementaria 5 del anexo. No se consideró relevante un seguimiento telefónico estrecho en los pacientes que no se encontraban utilizando la ECCA, puesto que se encontraban durmiendo en una posición cotidiana, más cómoda y con menor probabilidad de efectos adversos. Esta diferencia en el seguimiento no afectó el desenlace de efectividad ni de calidad de vida que se midieron de forma presencial, pero sí pudo haber incrementado el reporte de efectos adversos en el grupo que utilizaba la ECCA debido a una mayor frecuencia de llamadas telefónicas. Finalmente, con respecto a la limitación por puntuaciones faltantes en el análisis por intención de tratar modificado, se resalta que las conclusiones del presente ensayo clínico permanecen invariables, aun después de ajustar los desenlaces con el modelo estadístico empleado.
En conclusión, la ECCA como terapia no farmacológica coadyuvante en el tratamiento de pacientes con ERGE y síntomas nocturnos tratados con IBP, demostró un efecto terapéutico en la reducción de síntomas de reflujo, cuya magnitud es clínica y estadísticamente significativa. A pesar de que no fue hallado un efecto significativo de la intervención en el desenlace de calidad de vida, la preferencia del paciente fue consistentemente a favor de la ECCA. No obstante, el inesperadamente elevado porcentaje de efectos adversos encontrado pone en duda si el balance riesgo-beneficio neto para el paciente es favorable, y podrían ser necesarios estudios adicionales con el fin de encontrar el menor grado de inclinación de la cama que conserve aun un efecto terapéutico, minimizando al mismo tiempo los efectos adversos de esta terapia no farmacológica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.