La insuficiencia hepática aguda grave es una enfermedad infrecuente de etiología diversa caracterizada por la rápida aparición de insuficiencia hepatocelular grave en individuos sin enfermedad hepática previa. El manejo inicial de esta enfermedad condiciona su evolución posterior. El primer contacto con el paciente afecto de insuficiencia hepática aguda grave suele realizarse en unidades de urgencias, consultas de aparato digestivo o, en casos más graves, unidades de cuidados intensivos. En todos estos casos resulta fundamental un abordaje multidisciplinario que incluya cirujanos y hepatólogos expertos en esta enfermedad, es decir, de centros hospitalarios que dispongan de programa de trasplante hepático.
El presente artículo revisa la evidencia actual en el manejo médico de la insuficiencia hepática aguda grave, desde la sospecha diagnóstica y el manejo inicial, hasta el tratamiento médico intensivo, incluyendo la necesidad de un trasplante hepático urgente. También se revisan las evidencias sobre el uso de sistemas de soporte hepático artificial en esta enfermedad.
Acute liver failure is an uncommon and severe disease characterised by a rapid onset of severe hepatocellular failure in individuals without previous liver disease. Initial management of this entity determines the outcome of the patient. Initial contact with the acute liver failure patients usually occurs in the emergency department, digestology clinic or, in more severe cases, intensive care units. The management of acute liver failure patients in all these cases must be multidisciplinary, involving surgeons and hepatologists who are experts in this condition, meaning those from hospitals with active liver transplant programmes.
This article reviews the current body of evidence concerning the medical management of acute liver failure patients, from the suspected diagnosis and initial management to intensive medical treatment, including the need for an emergency liver transplantation. Moreover, we also review the use of artificial liver support systems in this setting.
La insuficiencia hepática aguda grave (IHAG), también conocida como fracaso hepático agudo por su denominación inglesa («Acute Liver Failure»), o hepatitis fulminante, es un síndrome poco frecuente pero muy grave en todos los casos. Además, suele afectar a personas totalmente sanas hasta el momento de su aparición, lo que hace que el cuadro sea aún más dramático. La incidencia global en Occidente se calcula en menos de 10 casos por millón de habitantes y año1. En España, un estudio de 2007 mostró una incidencia aproximada de 1,4 casos por millón de habitantes y año2.
La baja incidencia del síndrome y su heterogeneidad, con diferentes patrones de presentación, gravedad y pronóstico, hace que la evidencia sobre su manejo sea limitada y, con frecuencia, extrapolada de enfermedades con afectaciones similares (fracasos orgánicos de otras causas). A pesar de ello, la supervivencia de los pacientes con IHAG ha mejorado de forma espectacular en los últimos años, tanto por los avances en el manejo de los pacientes críticos, como por su diagnóstico precoz y, en especial, por la realización de trasplantes hepáticos urgentes (THU).
El presente documento de posicionamiento de la Societat Catalana de Digestologia (SCD) es una actualización de las recomendaciones basadas en la evidencia sobre el manejo de la IHAG. Los grados de recomendación y evidencia utilizados siguen el sistema Grading of Recommendations Assessment Development and Evaluation (GRADE)3. Este sistema refleja la calidad de la evidencia científica. Los grados de recomendación se dividen en fuerte (1) o débil (2); y los de evidencia en: estudio aleatorizado controlado (i); estudio controlado sin aleatorización (ii-1); estudio de cohortes o caso-control (ii-2); series repetidas o estudios no controlados (ii-3); u opiniones de expertos o estudios observacionales (iii)3.
DefiniciónLa IHAG se define por la aparición de insuficiencia hepática en el contexto de una hepatopatía aguda, y potencialmente reversible, sobre un hígado previamente sano. No obstante, incluye también otras etiologías en las que el cuadro es la manifestación aguda de una hepatopatía crónica (enfermedad de Wilson, reactivación del VHB en un hígado no cirrótico, habitualmente en contexto de inmunosupresión inducida por quimioterapia, Budd-Chiari agudo y hepatitis autoinmune). La definición ha sufrido modificaciones en función de los autores, pero, en definitiva, los criterios diagnósticos aceptados son:
- •
Hepatopatía aguda.
- •
De menos de 28 semanas de evolución (24 según la definición de la International Association for the Study of the Liver de 1999)4.
- •
Aparición de encefalopatía hepática (EH) como signo clínico de insuficiencia hepática (no se considera imprescindible en pacientes pediátricos).
- •
Reducción de la tasa de protrombina por debajo del 40% o INR≥1,5 como signo biológico de insuficiencia hepática.
- •
Hígado previamente sano (con las excepciones mencionadas).
No incluye enfermedades como la hepatitis alcohólica aguda, la descompensación aguda de una hepatopatía crónica (Acute-on-Chronic Liver Failure o ACLF), traumatismo hepático o fracaso hepático poshepatectomía.
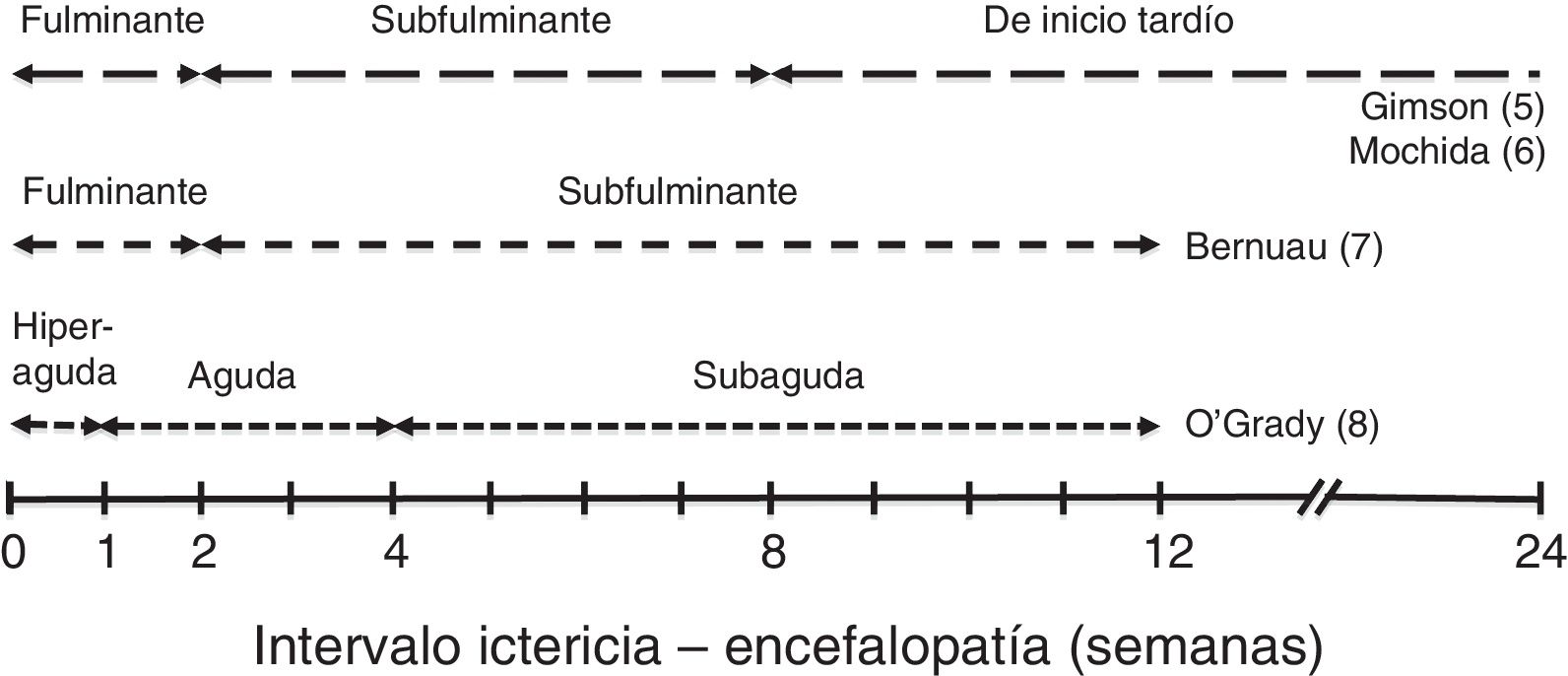
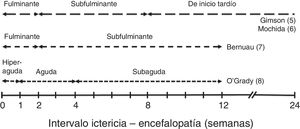
En función del tiempo entre la aparición de ictericia y de EH se describen diferentes cursos clínicos que se muestran en la figura 15–8.
Estos cursos clínicos obedecen a las distintas etiologías predominantes, que son las que condicionan la evolución, las complicaciones y el pronóstico del cuadro de IHAG. En líneas generales, los cuadros con curso evolutivo más rápido (hiperagudo y fulminante) tienden a presentar más edema cerebral, por lo que el enclavamiento cerebral es la causa más frecuente de muerte; pero su pronóstico es discretamente mejor, dado que incluye los casos de IHAG por paracetamol, con supervivencia espontánea entre el 20 y el 40%9. En las formas de curso más lento, las complicaciones sistémicas (infecciones, insuficiencia renal) que abocan al fracaso multiorgánico suelen ser la causa de muerte (supervivencia espontánea inferior al 10%). Además, en estos casos existe el riesgo añadido de confusión con una descompensación grave de una hepatopatía crónica.
Recomendaciones
- •
Se define IHAG como un síndrome caracterizado por marcadores de insuficiencia hepatocelular (ictericia e INR>1,5) que se acompañan de EH en cualquier grado (grado de evidencia II-2; grado de recomendación 1).
- •
A pesar de la existencia de lesiones hepáticas previas, los pacientes con presentación aguda de una enfermedad de Wilson, reactivación del VHB en un hígado no cirrótico, Budd-Chiari agudo y hepatitis crónica autoinmune, se consideran afectos de IHAG si desarrollan EH (grado de evidencia II-2; grado de recomendación 1).
- •
La aparición de EH leve es suficiente para establecer el diagnóstico de IHAG e iniciar el protocolo diagnóstico y terapéutico (grado de evidencia II-2; grado de recomendación 1).
- •
El diagnóstico de IHAG en pacientes pediátricos no depende de la aparición de EH (grado de evidencia II-3; grado de recomendación 1).
- •
Es crucial no catalogar como cirrosis hepática una IHAG de curso subagudo, pues perdemos la oportunidad de un THU si fuera necesario.
Las causas de IHAG se muestran en la tabla 1. Es posible que en nuestro medio puedan haber variado en el curso de los últimos años. Son:
- -
Víricas. Virus hepatotropos entre los que destaca el VHB, el más frecuente en nuestro medio2, los virus A y E (principal causa de hepatitis vírica en países no desarrollados)1 y otros menos frecuentes como herpes simple y herpes 6, citomegalovirus (CMV), virus Epstein-Barr y parvovirus. Las hepatitis por VHB pueden ser especialmente dramáticas en casos de reactivación del VHB en pacientes inmunosuprimidos por cáncer o quimioterapia.
- -
Tóxicas. La lesión hepática provocada por fármacos es la causa más prevalente de IHAG en los países del oeste de Europa y en Estados Unidos1. Las lesiones hepáticas provocadas por fármacos pueden ser dosis-dependientes, y por tanto previsibles, como el paracetamol; e idiosincráticas, independientes de la dosis, impredecibles y con peor pronóstico. Entre las causas tóxicas destaca, con mucho, la IHAG por sobredosis de paracetamol, en especial en casos de ingesta elevada y mantenida durante unos cuantos días (más que la ingesta puntual con ideación suicida), no intencionada (no consultan al centro médico hasta que aparece sintomatología clara), y en pacientes malnutridos y/o alcohólicos activos. Otras causas tóxicas en nuestro medio son la ingesta de Amanita phalloides (A. phalloides), antiinflamatorios no esteroideos, cocaína, éxtasis, tuberculostáticos, amoxicilina-clavulánico, anfetaminas, etc.
- -
Miscelánea. Esteatosis aguda del embarazo y síndrome HELLP («Hemolysis, Elevated Liver enzymes, and Low Platelet count»), síndrome de Budd-Chiari, golpe de calor, síndrome de Reye, hepatitis autoinmune, enfermedad de Wilson (supervivencia espontánea del 0%, por lo que el diagnóstico de sospecha es vital), infiltración neoplásica del hígado, hepatitis isquémica, asociada a sepsis±fracaso cardíaco, infecciones (malaria, dengue, etc.), síndrome hemofagocítico, etc. A destacar que las 5 últimas etiologías no deben tratarse con un THU.
- -
Criptogénica. Es decir, de causa no aclarada a pesar de una exhaustiva búsqueda etiológica. Puede representar entre un 20-30% de los casos y presenta una peor supervivencia espontánea que el resto2.
Prevalencia (%) de las distintas etiologías de insuficiencia hepática aguda grave en nuestro medio
| Etiología | 1992-20002 | 2001-201042 |
|---|---|---|
| Hepatitis vírica | 37 | 29 |
| Virus hepatitis A | 88 | 84 |
| Virus hepatitis B (±virus D) | 5 | 12 |
| Otras etiologías víricas | 7 | 4 |
| Hepatitis tóxica | 19 | 31 |
| Paracetamol | 12 | 30 |
| Otros (Amanita phalloides, AINE, difenilhidantoína, anestésicos halogenados, antidepresivos, anfetaminas, cocaína, éxtasis, etc.) | 88 | 70 |
| Miscelánea | 12 | 24 |
| Esteatosis aguda del embarazo | ||
| Síndrome de Budd-Chiari | ||
| Infiltración hepática | ||
| Hepatitis isquémica | ||
| Golpe de calor | ||
| Hepatitis autoinmune | ||
| Enfermedad de Wilson | ||
| Síndrome de Reye del adulto | ||
| Criptogenética | 32 | 16 |
En todos los casos se desconoce hasta qué punto la toma de paracetamol puede ser un cofactor en algunos casos, sobre todo en aquellos con aductos del paracetamol presentes.
Recomendaciones
- •
Las causas más frecuentes de IHAG en nuestro medio son víricas (en especial VHB) y tóxico-medicamentosas. En los últimos años parece ir en aumento la incidencia de IHAG por sobredosis de paracetamol, principal causa de IHAG en países anglosajones y del norte de Europa (grado de evidencia III; grado de recomendación 2).
- •
En todos los casos debe realizarse un screening toxicológico exhaustivo y, ante una duda razonable, niveles de paracetamol. Si esto no es posible, se iniciará N-acetil-cisteína (NAC) (grado de evidencia II-2; grado de recomendación 1).
- •
La búsqueda de posibles infecciones víricas causantes del cuadro es mandatoria (grado de evidencia II-2; grado de recomendación 1).
- •
Muchos casos de sospecha de hepatitis autoinmune requieren una biopsia hepática para su confirmación. Esta debe ser precoz ya que el tratamiento con corticoides podría resultar eficaz. Sin embargo, si a la semana del tratamiento con corticoides no se aprecia mejoría, debe plantearse el THU por el elevado riesgo de infecciones asociado al uso de corticoides (grado de evidencia II-2; grado de recomendación 1).
- •
Si existe sospecha de infiltración neoplásica hepática (historia previa de cáncer o hepatomegalia) deben realizarse estudios de imagen exhaustivos y/o biopsia hepática (grado de evidencia II-3; grado de recomendación 1).
A menudo el paciente no llega al primer centro de consulta con un cuadro de IHAG bien establecido, sino con un cuadro de hepatitis aguda, con poca sintomatología, inespecífica, y un aumento más o menos marcado de la cifra de transaminasas. En estos casos resulta fundamental hacer un seguimiento del paciente y derivarlo a un hospital con programa de trasplante hepático antes de la aparición de EH, que denota un grado de insuficiencia hepatocelular avanzada.
No se conoce con certeza qué hace que un paciente con hepatitis aguda grave, sin EH, evolucione a IHAG, pero sabemos que esta evolución ocurre con mayor frecuencia en determinados casos. Son precisamente estos pacientes de alto riesgo los que debemos derivar siempre a un hospital apto para realizar un THU o tratar casos con contraindicación al THU.
Criterios de riesgo para derivar pacientes con hepatitis aguda10
- Pacientes con índice de protrombina entre el 30 y el 50% y alguna de las siguientes condiciones:
- •
Niños<15 años
- •
Adultos>40 años con sospecha de etiología de mal pronóstico de supervivencia espontánea (p. ej. lesión hepática provocada por fármacos, enfermedad de Wilson, criptogenética)
- •
Fiebre>38°C
- •
Postoperatorio inmediato
- •
Embarazo
- •
Comorbilidades: diabetes mellitus, infección VIH, cáncer previo, malaria, insuficiencia renal aguda grave, acidosis metabólica
- •
Bilirrubina plasmática>250μmol/L (14mg/dL)
- Pacientes con índice de protrombina inferior al 30%:
- •
Cualquier paciente (en especial si es>40 años o con sospecha de etiología desfavorable)
Una vez establecido el diagnóstico de IHAG, es decir, tras desarrollar EH, e independientemente de la sospecha etiológica, el paciente debe ingresar en una UCI de un centro habilitado para THU.
Recomendaciones
- •
La derivación precoz de un paciente con hepatitis aguda grave, antes de la aparición de EH, a un centro con programa de trasplante hepático permite iniciar la valoración de un potencial THU a la vez que se le ofrecen mayores oportunidades de supervivencia espontánea o de llegar en condiciones al THU (grado de evidencia III; grado de recomendación 1).
- •
La derivación a un centro especializado es vital en casos de IHAG de curso subagudo dada la elevada incidencia de complicaciones que presenta, así como en casos de afectación extrahepática (grado de evidencia III; grado de recomendación 1).
El paciente quedará ingresado en la UCI mientras persista el cuadro de IHAG, y se monitorizará de forma convencional. Además, es preciso recoger:
Historia clínicaCon especial énfasis en la recogida de antecedentes en relación con:
- •
Antecedentes familiares y personales sugestivos de hepatopatía previa
- •
Otras enfermedades (en especial cáncer y enfermedad cardiorrespiratoria) y comorbilidades
- •
Exposición potencial reciente a virus (vía enteral, parenteral o sexual), viajes
- •
Estado de portador crónico (VHB)
- •
Ingesta de fármacos durante los últimos 6 meses (valorar exhaustivamente con el paciente y acompañantes, preguntar de manera repetida sobre la ingesta de paracetamol en sus diferentes formas comerciales, plantas, medicinas complementarias, etc.)
- •
Exposición a tóxicos y toxicomanías (incluyendo el consumo de alcohol)
- •
Antecedentes psiquiátricos (intentos de autolisis)
- •
Embarazo
- •
Antecedentes de enfermedades autoinmunes
- •
Tratamiento con inmunoterapia o quimioterapia
- •
Calidad de vida previa
- •
Forma de presentación (pródromos sugestivos de hepatopatía aguda vírica, síndrome gastroenterítico en la intoxicación por A. phalloides, etc.)
- •
Tiempo (intervalo ictericia-encefalopatía)
- •
Manifestaciones clínicas acompañantes
- •
Enfermedades previas o actuales (en especial las que puedan constituir una contraindicación a un eventual THU)
Dirigida a identificar criterios diagnósticos y signos orientativos de la etiología, descartar signos de hepatopatía crónica y detectar complicaciones, en especial infecciosas. Es de gran importancia la exploración neurológica continuada o muy frecuente incluyendo focalidades (que implicarían la necesidad de realizar una prueba de imagen cerebral), grado de EH, presencia de mioclonias o crisis comiciales, reflejos pupilares, etc. La exploración completa del paciente debe repetirse cada 12h como mínimo. Ante cualquier alteración neurológica cabe plantearse el diagnóstico diferencial con otras enfermedades como la abstinencia alcohólica o causas metabólicas.
Control de constantes vitalesDeben monitorizarse con frecuencia (cada 4h o menos) la presión arterial, la frecuencia cardíaca, la frecuencia respiratoria, la temperatura, la diuresis y otros parámetros según el caso. Dado que la hipoglucemia es una complicación muy frecuente, debería controlarse la glucemia cada 2h.
Exploraciones complementariasVan dirigidas a averiguar la etiología y la gravedad del cuadro, a valorar su pronóstico (criterios de THU) así como a identificar las posibles complicaciones o el riesgo de desarrollarlas.
Primero. Determinaciones analíticas
- •
Virus de la hepatitis: VHB (HBsAg, IgM-antiHBc, ADN-VHB en todos los casos dada la posibilidad, escasa pero real, de una mutante de escape para el HBsAg, que disminuye notablemente la sensibilidad de los tests diagnósticos), VHD si HBsAg+ (antígeno delta y antiVHD), VHA (IgM-VHA), VHC (IgG-VHC), VHE (IgM-VHE y ARN-VHE dado que los anticuerpos a veces resultan negativos).
- •
Otros virus menos frecuentes: IgM y PCR de herpes simple, herpes 6, varicela zóster, Epstein-Barr, parvovirus, y CMV.
- •
Cuando exista sospecha fundamentada: amanitinas en orina, niveles plasmáticos de paracetamol u otras determinaciones toxicológicas (cocaína, etanol, etc.).
- •
Test de embarazo tanto en casos de sospecha de esteatosis aguda del embarazo y síndrome HELLP, como en sospecha de embarazo en paciente con hepatitis aguda de cualquier etiología.
- •
Anticuerpos antitisulares, proteinograma y dosificación de inmunoglobulinas. Debemos recordar que la autoinmunidad puede participar en la patogenia de la IHAG sin ser claramente la causa. De hecho, un 50% de las IHAG criptogenéticas pueden presentar «scores» de probable hepatitis autoinmune, como algunas hepatitis víricas que cursan con aumento de IgM. Los casos no confirmados no suelen tratarse con corticoides11.
- •
En pacientes<40 años sin causa de IHAG conocida (una vez descartado el origen viral), cobre en sangre y orina de 24h (una cupruria elevada es altamente sugestiva de enfermedad de Wilson) y ceruloplasmina sérica. Examen oftalmológico con lámpara de hendidura para descartar anillo corneal de Kaiser-Fleischer. La sospecha de enfermedad de Wilson puede establecerse con elevada fiabilidad en casos con cociente fosfatasa alcalina/bilirrubina<4 y AST/ALT>2,212.
Segundo. Examen ultrasonográfico abdominal
A fin de descartar signos sugestivos de hepatopatía crónica (entidad clave con la que debe establecerse el diagnóstico diferencial), enfermedad infiltrativa hepática, trombosis de venas suprahepáticas (síndrome de Budd-Chiari), y demostrar permeabilidad portal y de la arteria hepática. En caso de duda, sobre todo por posible infiltración hepática o permeabilidad vascular, debería solicitarse una TC o RM.
Tercero. Biopsia hepática
La necesidad de obtener una biopsia hepática es controvertida, en especial por el balance riesgo/beneficio, dada la coagulopatía del paciente. No obstante, la supervivencia de los pacientes está en clara relación con la precocidad e idoneidad del tratamiento etiológico que, a menudo, solo puede establecerse tras la biopsia hepática. Además, disponemos de técnicas que permiten minimizar los riesgos de la biopsia hepática, como la biopsia hepática por vía transyugular13. La biopsia adquiere mayor relevancia en los casos de etiología incierta o sospecha de enfermedad hepática crónica o infiltrativa.
Parámetros con valor pronóstico y de valoración de potenciales complicacionesRecientemente se han descrito una serie de parámetros que pueden ayudar a perfilar el pronóstico del cuadro de IHAG y que deben utilizarse en combinación con los criterios clásicos de THU que veremos más adelante. Estos parámetros son:
- •
Función renal, incluyendo equilibrio ácido-base. De hecho, la presencia de acidosis es un criterio de THU en la sobredosis de paracetamol.
- •
Amoniemia arterial. Como veremos más adelante, la cifra de amonio sérico se correlaciona con el riesgo de presentar edema cerebral14.
- •
Lactato arterial. Traduce el fracaso tanto de la perfusión periférica como de la perfusión hepática, así como un déficit de su aclaramiento hepático. Se ha sugerido que el cambio en los valores de lactato arterial tras la resucitación inicial o en el seguimiento a las 12h tiene valor pronóstico15.
- •
Fósforo. La determinación de la cifra sérica de fósforo tiene valor pronóstico en múltiples modelos de IHAG16 y en pacientes con IHAG receptores de un injerto de donante vivo17. Asimismo, en un estudio en IHAG por sobredosis de paracetamol se observó que los pacientes que presentaban hiperfosfatemia eran los que tenían un peor pronóstico. En este caso la hiperfosfatemia podría ser debida tanto a la ausencia de regeneración hepática (que consume fósforo) como a la presencia de insuficiencia renal aguda18.
- •
A fin de descartar complicaciones potenciales también deberían determinarse amilasa y lipasa séricas (posible pancreatitis sobreañadida), gasometría arterial (complicaciones respiratorias y metabólicas), radiografía de tórax (infecciones, etc.), electro y ecocardiograma, cultivos seriados.
Recomendaciones
- •
Los pacientes con IHAG requieren un control exhaustivo que debe incluir, como mínimo: evaluación clínica cada 12h, examen diario de parámetros fisiológicos, analíticos y metabólicos (grado de evidencia III; grado de recomendación 1).
- •
El grado de EH debe ser valorado repetidamente de forma rutinaria (grado de evidencia III; grado de recomendación 1).
- •
La función renal debe monitorizarse tanto analítica (creatinina sérica) como clínicamente (diuresis horaria) (grado de evidencia III; grado de recomendación 1).
- •
La biopsia hepática, por vía transyugular, es una herramienta útil aunque no imprescindible. Su utilidad es mayor en casos de IHAG criptogenética y cuando existe sospecha de infiltración neoplásica, cirrosis hepática o hepatitis alcohólica (grado de evidencia II-3; grado de recomendación 1).
- •
Deben realizarse radiografías de tórax con cierta regularidad, en especial en pacientes intubados a fin de descartar la presencia de neumonía (grado de evidencia III; grado de recomendación 2).
Estas medidas, que debemos seguir a la vez que realizamos el estudio etiológico y pronóstico, son independientes de la etiología de la IHAG. Una primera e importante regla general es PARAR TODOS LOS FÁRMACOS que toma el paciente, excepto los tratamientos hormonales substitutivos.
NAC. La eficacia de la NAC viene determinada por su efecto antioxidante, incremento de óxido nítrico, acción antiinflamatoria a través del factor nuclear kappa B y la vasodilatación que aumenta el flujo sanguíneo periférico. En la actualidad sabemos que el uso de NAC aumenta la supervivencia libre de trasplante hepático tanto en la IHAG secundaria a sobredosis de paracetamol como en la no debida a paracetamol19. En este último caso, la eficacia se limita a pacientes con EH grado i-ii, es decir, fases precoces del cuadro19. Estos datos, junto a la falta de efectos adversos de la NAC, hacen que la su administración, lo más precoz posible, se considere obligada en la IHAG. La pauta de administración difiere de la que se utiliza en las sobredosis de paracetamol en dosis y duración (se recomienda perfusión de 72h, y en cualquier caso no más de 5 días por efectos dudosos sobre la regeneración hepática). Así pues, la pauta habitual en IHAG no por paracetamol sería: NAC 150mg/kg en 1h seguido de 50mg/kg en 4h y finalmente de 6,25mg/kg en 67h (total: 72h).
Dieta. Los pacientes con IHAG presentan un marcado estado hipercatabólico. Además, dado el metabolismo del amonio y el riesgo de infecciones, resulta crucial evitar la pérdida de masa muscular y asegurar un correcto estado inmunitario del paciente. Se recomienda una dieta normoproteica en pacientes con EH 0-I. En grados de EH más avanzados, el riesgo de broncoaspiración, en un paciente no intubado, contraindica la ingesta oral. No se ha demostrado que el aporte de nutrición enteral o parenteral mejore el pronóstico.
Hidratación. La suficiente para mantener un balance hídrico equilibrado considerando una posible hipovolemia por vómitos, ingesta escasa y vasodilatación; y evitando también la hipervolemia. Se recomienda evitar sueros hipotónicos para prevenir episodios tanto de hipoglucemia (que se relaciona con el desarrollo de fracaso renal) como de hiponatremia (con el aumento correspondiente de la presión intracraneal, PIC). La hipoglucemia es muy frecuente en estos pacientes. Por ello se recomienda realizar controles de glucemia cada 2h y mantener unas glucemias entre 150-200mg/dL. El sodio debe mantenerse entre 140-145mEq/L.
Encefalopatía hepática. El grado de EH se correlaciona con el pronóstico de los pacientes con IHAG. Así, en pacientes con IHAG subaguda, la presencia de EH leve (grado i) ya implica un mal pronóstico; mientras que en los casos fulminantes o hiperagudos, a mayor grado de EH, peor pronóstico. En todo caso, la EH puede aparecer y progresar de manera muy rápida, por lo que se debe monitorizar el estado neurológico del paciente de forma rutinaria y con una elevada frecuencia. Asimismo evitaremos y/o corregiremos posibles factores desencadenantes de EH (sedantes, antieméticos, hipoxemia, hipoglucemia, hipofosfatemia, acidosis, etc.). Se recomienda tratamiento convencional para grados i-ii de EH (disacáridos no absorbibles por vía oral o por sonda nasogástrica o en forma de enemas de retención y/o rifaximina) aunque no hay ninguna evidencia científica que lo apoye. En pacientes con EH grado iii-iv se consideran contraindicados los enemas por su posible efecto aumentando la PIC. En estos casos debemos considerar la intubación orotraqueal, con o sin ventilación mecánica, para proteger la vía aérea, con la sedación y analgesia adecuadas.
Coagulopatía. No debe corregirse. De hecho, los pacientes con IHAG presentan un equilibrio entre el déficit de factores pro- y anticoagulantes, lo que hace que las hemorragias sean poco frecuentes. Además, corregir el índice de protrombina o el INR podría dificultar la valoración de los criterios de THU. Por tanto, solo corregiremos la coagulopatía en caso de manifestaciones hemorrágicas clínicamente significativas o antes de exploraciones invasivas con elevado riesgo de sangrado (colocación de sensor de PIC, punción lumbar, etc.). La corrección puede realizarse mediante plasma fresco congelado o, con mayor frecuencia, con factor protrombínico a fin de limitar el aumento en la volemia del paciente. Para descartar posibles déficits nutricionales, se administrarán 20-30mg de vitamina K.
La necesidad de tromboprofilaxis debe individualizarse según el riesgo de cada paciente.
El dintel de transfusión es de 7g/dL de hemoglobina.
Antibióticos. La administración de pautas de descontaminación intestinal selectiva protege del desarrollo de complicaciones infecciosas bacterianas y fúngicas en estos pacientes, aunque no aumentan la supervivencia20. Los pacientes con mayor riesgo de infecciones son aquellos que presentan EH grado iii o iv o rápidamente progresiva, insuficiencia renal y parámetros de síndrome de respuesta inflamatoria sistémica (SRIS). Una pauta empírica habitual es la administración de norfloxacina 400mg/día y nistatina 1MU cada 8h.
Inhibidores de la bomba de protones. Suelen administrarse dado el riesgo de fracaso orgánico y por la coagulopatía, aunque no existe una clara evidencia de su eficacia en la IHAG. El potencial beneficio queda contrarrestado por el riesgo de aparición de neumonía asociada al ventilador y/o sobreinfección por Clostridium difficile. Si el paciente recibe nutrición enteral, no se consideran necesarios.
Recomendaciones
- •
Se recomienda la administración precoz (EH grado II o inferior) de NAC en todos los pacientes de forma independiente a la sospecha etiológica (grado de evidencia I; grado de recomendación 1).
- •
Debemos asegurar una nutrición adecuada dado el estado hipercatabólico del paciente (grado de evidencia II-3; grado de recomendación 1).
- •
La vía oral o enteral está contraindicada en pacientes con EH grado II o superior (grado de evidencia III; grado de recomendación 1).
- •
En pacientes en grado III-IV de EH debemos proceder a la intubación orotraqueal para preservar la vía aérea y estar atentos a la presencia de signos clínicos de aumento de la PIC (grado de evidencia III; grado de recomendación 1).
- •
La hipoglucemia se asocia a una mayor mortalidad por lo que debe prevenirse evitando también la hiperglucemia (grado de evidencia II-3; grado de recomendación 1).
- •
Debe evitarse la hiponatremia. Se recomienda mantener el sodio sérico entre 140-150mEq/L (grado de evidencia II-2; grado de recomendación 1).
- •
El uso rutinario de plasma fresco y/o otros factores de coagulación se considera contraindicado excepto en situaciones específicas como la colocación de sensores intracraneales o presencia de hemorragia activa (grado de evidencia II-3; grado de recomendación 1).
- •
La profilaxis antibiótica no aumenta la supervivencia en la IHAG, aunque reduce la incidencia de infecciones (grado de evidencia II-2; grado de recomendación 1).
- •
La administración de inhibidores de la bomba de protones debe considerarse de forma individualizada valorando pros y contras (grado de evidencia II-3; grado de recomendación 1).
Existen ciertas etiologías de IHAG tratables, si bien en la mayor parte de los casos es dudoso que este tratamiento pueda modificar el curso del cuadro, pues la lesión hepática ya está establecida en el momento del diagnóstico. Entre las causas tratables debemos recordar:
- •
La retirada inmediata del posible fármaco hepatotóxico. Dado que no conocemos la potencial hepatotoxicidad de muchos fármacos, es recomendable retirarlos todos excepto los tratamientos hormonales substitutivos (insulina, hormonas tiroideas, etc.).
- •
Infecciones por virus herpes simple, herpes 6, VHZ y CMV: aciclovir y ganciclovir son las opciones terapéuticas. La administración empírica de aciclovir a dosis altas cubre tanto la infección por herpes como por CMV.
- •
Tanto en la reactivación del VHB (ADN-VHB positivo) como de primoinfección por VHB, a menudo imposibles de diferenciar, la administración de análogos de nucleós(t)idos, se ha mostrado eficaz21.
- •
El tratamiento de las intoxicaciones por A. phalloides y paracetamol puede prevenir la aparición de hepatotoxicidad. En las primeras horas tras la ingesta del tóxico (hasta las 3-4h, pero mejor en la primera hora postingesta) debe administrarse carbón activado vía oral (25g en 240ml de agua cada 3h) a fin de reducir la absorción del tóxico.
- -
En caso de intoxicación por A. phalloides también es recomendable inducir diarreas (30g de sulfato sódico en la misma agua del carbón activado) a no ser que el paciente las presente de forma espontánea. Para bloquear la entrada de amatoxinas en el hepatocito suele administrarse penicilina G sódica (48M de unidades/día si no hay insuficiencia renal) y silibinina (1.400mg/día iv) de manera simultánea. Se han establecido unos criterios específicos de THU en esta entidad (tabla 2)22.
Tabla 2.Criterios de trasplante hepático urgente en la IHAG
IHAG no por intoxicación por paracetamol Uno o más de los criterios siguientes: • Encefalopatía hepática grave (grado iii-iv) • Tiempo de protrombina expresado como INR>7 (o<10% expresado en índice) • Factor V<20% en pacientes<30 años; <30% en pacientes>30 años, siempre que vaya asociado a encefalopatía hepática de cualquier grado • Ausencia de mejoría evidente con tratamiento convencional en las formas subfulminantes o subagudas IHAG por intoxicación por paracetamol • pH<7,.3 con independencia del grado de encefalopatía • O los 3 criterios siguientes: - Encefalopatía grado iii o iv - Tiempo de protrombina>100segundos (INR>6,5) - Creatinina>300mmol/l (3,4mg/dl) IHAG porAmanita phalloides • Índice de protrombina<10% (INR>6) 4 días después de la ingesta IHAG por enfermedad de Wilson • SIEMPRE • Antes de la aparición de EH: más de 7 puntos de la puntuación modificada de Nazer para la enfermedad de Wilson (según valores de bilirrubina, leucocitos e INR) - -
En la sospecha de sobredosis de paracetamol, se debe administrar NAC a las dosis habituales y de manera precoz, ya que el intervalo entre la ingesta de paracetamol y el inicio de NAC tiene implicaciones pronósticas. La pauta de NAC es: bolo de 150mg/kg en 250ml de glucosa al 5% en 1h+50mg/kg en 500ml de glucosa al 5% en 4h+100mg/kg en 500ml de glucosa al 5% en 16h. En total son 21h de tratamiento. Para saber si debemos o no tratar al paciente, se utilizan los niveles de paracetamol en plasma con relación a las horas desde la ingesta o la diferencia entre 2 determinaciones separadas 2h. No obstante, a menudo se desconoce la hora exacta de la toma o tomas del tóxico, por lo que, en caso de duda, se recomienda iniciar el tratamiento cuanto antes.
- •
La corrección de los trastornos hemodinámicos constituye el único tratamiento en los casos de hígado de shock con o sin estasis asociada.
- •
El tratamiento inmunosupresor (corticosteroides) puede resultar eficaz en los casos de origen autoinmune si se administran de manera muy precoz. Cabe además considerar que comportan un riesgo incrementado de infecciones oportunistas, en especial si el paciente recibe un THU. Por eso se recomienda un tratamiento inicial de 5-7 días y, si no se observa mejoría, retirarlos y plantear el THU9.
- •
La interrupción inmediata del embarazo mejora sensiblemente el pronóstico de las enfermas con esteatosis gravídica o HELLP e IHAG.
- •
La IHAG por enfermedad de Wilson requiere un THU siempre. Los recambios plasmáticos están indicados cuando se requiere atenuar el cuadro de hemólisis e insuficiencia renal secundarios a los elevados niveles plasmáticos de cobre, y como puente al trasplante. La D-penicilamina constituye una opción terapéutica de poca eficacia en esta fase de la enfermedad. Solo se recomienda en pacientes muy seleccionados: jóvenes, con enfermedad de menos de 2 meses de evolución, con niveles de hemoglobina aún por encima de 8g/dL y sin EH (antes de desarrollar el cuadro de IHAG). El cinc, por su efecto limitante de la absorción intestinal de cobre, es el tratamiento de mantenimiento de la enfermedad de Wilson, pero no existen datos de su eficacia en la forma de presentación aguda. Un vez aparece EH, el trasplante es inexcusable dado que la supervivencia espontánea es nula. Existe un score específico de indicación de THU en la IHAG por enfermedad de Wilson (tabla 2): el Nazer score modificado para enfermedad de Wilson, que se basa en datos de función hepática (INR, albúmina y bilirrubina), niveles de AST y cifra de leucocitos en sangre periférica23. Así no es necesario esperar a que el paciente presente los criterios clásicos de THU (EH avanzada) para su indicación.
- •
El TIPS («Transjugular Intrahepatic Portosystemic Shunt») asociado a anticoagulación y tratamiento de la enfermedad de base es la alternativa de elección en el síndrome de Budd-Chiari o en algunos casos de enfermedad veno-oclusiva aguda. La indicación debe ser precoz pues en casos evolucionados suele requerirse un THU.
- •
La quimioterapia es el único tratamiento en los casos de infiltración neoplásica. Su utilidad y tipo debe establecerse junto a los oncólogos y/o hematólogos en función del tipo de neoplasia y su estadio evolutivo.
- •
El tratamiento antibiótico (con o sin drenaje o cirugía) es el tratamiento de elección en los casos de IHAG debidos a infecciones bacterianas sistémicas.
- •
El tratamiento de la hipertermia podría limitar la progresión de la IHAG debida a este mecanismo (golpe de calor o ingesta de éxtasis, a menudo asociada a hipertermia).
La IHAG es una enfermedad sistémica en la que primero falla el hígado pero, si no se trata, progresa afectando a todos los órganos y desembocando en fracaso multiorgánico y aparición de sepsis, que no solo puede contraindicar el THU, sino que además puede ocasionar el fallecimiento del paciente.
Disfunción cardiorrespiratoriaEn los pacientes con IHAG es habitual la existencia de alteraciones circulatorias caracterizadas por una reducción de las resistencias vasculares sistémicas y del volumen central efectivo y un aumento del gasto cardíaco. En los casos más evolucionados puede llegar a ocasionar una hipotensión marcada que se asocia a hipoxia tisular, condicionando el inicio de metabolismo anaerobio con acumulación de ácido láctico (de aquí la importancia de las determinaciones seriadas de lactato). Este fenómeno parece desempeñar un papel esencial en el desarrollo de fracaso multiorgánico. La hiperlactacidemia debería mejorar con reposición de volumen, aunque la incapacidad del hígado de metabolizar el lactato también desempeña un papel. El tratamiento con NAC podría ser beneficioso en este aspecto al aumentar la perfusión hepática19.
En pacientes con inestabilidad hemodinámica o que requieran THU, se debería realizar un ecocardiograma a fin de valorar la presencia de enfermedad cardíaca previa o actual. Recordemos que el gasto cardíaco también puede determinarse mediante monitores de onda de pulso arterial (siempre que no existan trastornos del ritmo cardíaco) o con un catéter de Swan-Ganz.
El soporte cardiocirculatorio requerido por estos pacientes no difiere del que se precisa en otras enfermedades críticas: reposición de la volemia, con cristaloides tipo suero fisiológico, y fármacos vasoactivos. La administración de albúmina no ha mostrado ninguna utilidad. El agente vasopresor de primera elección es la noradrenalina (objetivo: mantener una presión arterial media>60mmHg,>75mmHg en individuos con hipertensión previa). Si la noradrenalina no es suficiente, se puede asociar dobutamina, en caso de disfunción ventricular izquierda, o vasopresina o su derivado terlipresina24. En caso de refractariedad a fármacos vasoactivos, debe considerarse la posible presencia de insuficiencia suprarrenal relativa, que se trata mediante hidrocortisona, aunque no ha quedado demostrada su utilidad en la supervivencia de estos pacientes.
La insuficiencia respiratoria es frecuente en la IHAG y suele ser multifactorial (insuficiencia ventilatoria asociada al coma, atelectasias pulmonares en pacientes intubados, bronconeumonía, síndrome del distrés respiratorio del adulto, etc.). Su manejo, así como las indicaciones de ventilación mecánica, el tipo de ventilación (protectora, con volumen corriente entre 6 y 8mL/kg de peso ideal), la sedación y analgesia, etc., no difieren de las de otros pacientes críticos. No se contempla la ventilación no invasiva por la posible progresión de la EH y el riesgo de broncoaspiración.
Recomendaciones
- •
Los pacientes con IHAG requieren un manejo exquisito de la volemia, evitando tanto hipo como hipervolemia (grado de evidencia II-1; grado de recomendación 1).
- •
En caso de hipotensión persistente debe iniciarse soporte vasoactivo. La noradrenalina es el fármaco de elección (grado de evidencia II-3; grado de recomendación 1).
- •
El uso de hidrocortisona no reduce la mortalidad del cuadro aunque sí puede reducir la necesidad de fármacos vasoactivos (grado de evidencia II-1; grado de recomendación 1).
- •
Las estrategias de ventilación son las estándar (ventilación protectora) (grado de evidencia II-3; grado de recomendación 1).
Ya se ha comentado que la presencia de EH es un factor clave tanto en el diagnóstico como en la evolución y la evaluación pronóstica de los pacientes con IHAG. La presencia de EH puede traducir tanto fracaso hepático como aparición de otras complicaciones graves, por ejemplo, una marcada respuesta inflamatoria o sepsis, que debe buscarse de manera intencionada.
La complicación neurológica más temida en la IHAG es el desarrollo de edema cerebral, que representa la causa de muerte en un 20-25% de los pacientes. La fisiopatología del edema cerebral no se conoce por completo, pero se sabe que participan tanto un proceso inflamatorio que altera el flujo sanguíneo cerebral y aumenta la permeabilidad de la barrera hematoencefálica a toxinas; como un aumento de los niveles circulantes de amonio por alteración del metabolismo hepático de la urea. La hiperamoniemia condiciona un aumento de la osmolaridad intracelular de los astrocitos, cambios en los neurotransmisores, y alteración de la función mitocondrial astrocitaria, lo que desencadena el «swelling» o hinchazón característica de estas células y, finalmente, disfunción cerebral25. Esta situación es especialmente grave en los casos fulminantes, hiperagudos o agudos, donde los mecanismos compensatorios que hacen que el edema cerebral no comporte un aumento de la PIC (como ocurre en las IHAG subagudas o en la cirrosis hepática) no tengan tiempo de producirse y, en consecuencia, la simple presencia de edema cerebral ya condiciona hipertensión intracraneal.
El edema cerebral es una complicación casi constante en pacientes en EH grado iii o iv, aunque, como ya hemos comentado, no en todos los casos implica hipertensión intracraneal. Estudios previos muestran que el riesgo de presentar hipertensión intracraneal se correlaciona de manera estrecha con la amoniemia arterial. Así, los pacientes con amonio sérico>150-200μmol/L, se consideran pacientes de alto riesgo de aumento de la PIC14. Otros factores de riesgo serían la presencia de hiponatremia y de hipo- o hiperglucemia.
La monitorización continua de la PIC, mediante colocación de sensor epi- o subdural, en pacientes con EH avanzada es controvertida, en especial por el riesgo de hemorragia cerebral que, aún siendo bajo, no es nulo26. Así pues, existen centros donde la monitorización continua de la PIC es la norma en pacientes con EH iii-iv, y otros donde no se realiza nunca. A fin de optimizar el riesgo-beneficio, expertos en el tema recomiendan limitar la monitorización a pacientes de muy alto riesgo, como serían los que reúnen criterios de THU (tabla 2) y además: 1) son jóvenes con presentaciones agudas o hiperagudas; 2) casos con convulsiones o anomalías pupilares; 3) presencia de 3 criterios o más de SRIS; 4) amoniemia arterial>150μmol/L; 5) hiponatremia<135mEq/L; 6) necesidad de fármacos vasoactivos; y 7) signos indirectos que indiquen un flujo sanguíneo cerebral muy bajo o muy elevado (si se mide la saturación de oxigeno del golfo de la vena yugular, SjO2, normal entre el 55 y el 70%, o se realiza una ecografía-Doppler de la arteria cerebral media)27. Como precauciones, antes de la colocación del sensor, debemos asegurar una correcta coagulación. La monitorización de la PIC se mantiene hasta la resolución del cuadro neurológico.
Tratamiento del edema cerebral. Deben aplicarse medidas preventivas (dirigidas a reducir el amonio arterial y evitar factores agravantes) o terapéuticas si es preciso. Los objetivos del tratamiento son mantener una PIC<20mmHg y una presión de perfusión cerebral (PPC, diferencia entre presión arterial media y PIC≥50-60mmHg).
Las medidas generales de tratamiento serían: asegurar el correcto drenaje venoso cerebral (cabecera de la cama incorporada>30° y cabeza semiflexionada); mantener al paciente libre de estímulos sensitivos y sensoriales (por eso no deben administrarse enemas); evitar la fiebre, la hipo/hiperglucemia y los trastornos electrolíticos, en especial la hiponatremia; ajuste exquisito del balance hídrico (el cristaloide de elección es el NaCl 0,9%); sedación farmacológica (perfusión intravenosa continua preferentemente de propofol, midazolam en caso de hipotensión o inestabilidad hemodinámica, a dosis convencionales); analgesia según requerimientos (fentanil o remifentanil); y excepcionalmente relajación. Los antibióticos no absorbibles no suelen ser efectivos y la administración de lactulosa podría ser contraproducente. Tampoco parecen tener ningún efecto sobre el edema cerebral los agentes que actúan sobre el ciclo de la urea como la L-ornitina-L-aspartato28.
Cuando a pesar de estas medidas preventivas aparezcan episodios de hipertensión intracraneal (PIC>20mmHg) debemos seguir las siguientes indicaciones:
Medidas de primer nivel- •
Terapia hiperosmolar. Contraindicada si el sodio plasmático es>150mEq/L. Mediante administración de manitol 20% o de suero fisiológico hipertónico (en casos de sodio plasmático<135mEq/L, hipotensión o inestabilidad hemodinámica). La eficacia de ambos tratamientos es similar, aunque el salino hipertónico se asocia a una menor incidencia de insuficiencia renal aguda o rebote de la PIC posterior al tratamiento. La eficacia de esta terapia es dudosa cuando la PIC supera los 60mmHg. Si existe insuficiencia renal o ausencia de respuesta diurética al manitol, a pesar de observarse cambios de osmolaridad plasmática, el tratamiento debe combinarse con métodos de depuración extrarrenal continua (hemofiltración o hemodiafiltración). La necesidad repetida de terapia hiperosmolar (más de 3 administraciones en 24h) para controlar la PIC indica que deben aplicarse medidas de segundo nivel.
- •
Hiperventilación moderada (paCO2=30-35mmHg). Nunca debe mantenerse una paCO2<25mmHg o un pH>7,60. Provoca una respuesta transitoria (de 4h) por vasoconstricción y reducción del flujo sanguíneo cerebral. NO debe retirarse de forma brusca pues provoca una vasodilatación de rebote. Entre sus efectos secundarios destacan: vasoespasmo coronario y crisis comiciales en pacientes susceptibles, hipocalcemia e hipokaliemia, aumento del riesgo de barotrauma e infección nosocomial.
- •
Indometacina 0,5mg/kg de peso si se constata hiperemia cerebral (aumento de la SjO2).
- •
Inducción de coma barbitúrico. Es la medida más habitual, aunque hay autores que sugieren la posibilidad de utilizar propofol como alternativa. Induce una reducción de la PIC pero también de la presión arterial, con lo que la PPC puede disminuir. Como norma general se mantendrá la mínima dosis que permita controlar la PIC.
- •
Hipotermia moderada. La hipotermia actúa reduciendo el metabolismo sistémico, con lo que disminuye la producción de amonio así como su recaptación a nivel cerebral, con descenso del metabolismo cerebral del amonio y del flujo sanguíneo cerebral. Además, parece que podría mejorar la estabilidad hemodinámica de los pacientes29. Existen resultados contradictorios sobre la eficacia de la hipotermia moderada (32-34°C) en el control de la hipertensión intracraneal refractaria. De hecho, un estudio multicéntrico en pacientes con EH avanzada, mantenidos a 34°C, no observó ningún beneficio sobre la PIC30. Para aplicar hipotermia es preciso que el paciente esté sedado, paralizado y bajo ventilación mecánica; que reciba antibióticos de amplio espectro para prevenir infecciones; y mantenga una PPC>50mmHg. Esta situación debe mantenerse hasta la normalización de la PIC y, a ser posible, hasta el THU. Efectos adversos potenciales de la hipotermia: coagulopatía, trombocitopenia y disfunción plaquetaria, aumento de la incidencia de neumonía y otras infecciones, bradicardia, taquiarritmias graves (si es por debajo de 32°C). El recalentamiento de los pacientes debe ser progresivo y lento para evitar tanto un efecto rebote sobre la PIC como los efectos adversos potenciales, en especial sobre el ritmo cardíaco. Una estrategia práctica podría ser mantener al paciente en normotermia (35-36°C) evitando episodios febriles1.
Recomendaciones
- •
Las técnicas no invasivas, como el Doppler transcraneal, no son útiles en la valoración de la PIC (grado de evidencia II-3; grado de recomendación 1).
- •
La monitorización invasiva de la PIC debe considerarse en pacientes de alto riesgo de hipertensión intracraneal, es decir, en EH grado III-IV, intubados y ventilados, y con al menos uno de los siguientes: paciente joven con presentación hiperaguda; presencia de convulsiones; 3 o más criterios de SRIS; amonio sérico>150μmol/L; sodio sérico<135mEq/L; insuficiencia renal; necesidad de soporte vasoactivo (grado de evidencia II-3; grado de recomendación 1).
- •
Las medidas preventivas de aumento de la PIC deben aplicarse en todos los casos. La terapia hiperosmolar (con manitol o suero fisiológico hipertónico) debe ser la primera opción en caso de hipertensión intracraneal (grado de evidencia II-2; grado de recomendación 1).
Hasta un 40-80% de los pacientes con IHAG presentan insuficiencia renal, en especial los de edad avanzada. Su aparición empeora el pronóstico. En la mitad de los casos es de características funcionales, mientras en el resto obedece a una necrosis tubular aguda, a veces secundaria a un efecto nefrotóxico directo del mismo agente causal de la IHAG (p. ej. el 80% de los pacientes con IHAG por sobredosis de paracetamol presentan fracaso renal agudo del que se recuperan gradualmente)31. Los criterios diagnósticos y la fisiopatología de la insuficiencia renal funcional en la IHAG son los mismos que en el síndrome hepatorrenal de la cirrosis, y se observa sobre todo en cuadros subagudos.
El tratamiento de la insuficiencia renal, en general, requiere un ajuste exquisito de la volemia del paciente, retirada o reducción de dosis de fármacos nefrotóxicos (incluido el manitol) y manejo convencional de los trastornos asociados. El uso de diuréticos en estados oligúricos debe limitarse a casos de hipervolemia, ya que podrían agravar la insuficiencia renal, en especial cuando es funcional. Puede considerarse el uso de terlipresina. Aunque hubo comunicaciones iniciales que indicaban que terlipresina podría aumentar la PIC, estudios posteriores mostraron que no solo no aumenta la PIC ni el lactato intracerebral sino que además aumenta la PPC24.
Las indicaciones de depuración extrarrenal son las convencionales, aunque deben establecerse de manera precoz. En pacientes con edema cerebral, los cambios hiposmolares agudos inducidos por la diálisis pueden precipitar episodios de hipertensión intracraneal, por lo que son aconsejables las técnicas de depuración continua. No suele requerirse anticoagulación, pero si es necesario puede utilizarse heparina o citrato, este último con mucho cuidado por ausencia de metabolismo hepático.
Recomendaciones
- •
La aparición de acidosis, alteraciones metabólicas (hiponatremia, etc.) y hemodinámicas (hipervolemia) en el contexto de insuficiencia renal, requieren la instauración precoz de técnicas de depuración extrarrenal (grado de evidencia III; grado de recomendación 1).
- •
La anticoagulación de los circuitos de depuración extrarrenal es controvertida y debe valorarse de forma individualizada (grado de evidencia II-2; grado de recomendación 1).
- •
Las técnicas continuas de reemplazo renal son las de elección (grado de evidencia III; grado de recomendación 1).
Las infecciones, tanto bacterianas como fúngicas, son frecuentes en la IHAG dada la existencia de una inmunosupresión funcional o inmunoparesia asociada al cuadro32. Se presentan hasta en un 80% y un 33% de los pacientes con IHAG, respectivamente. En caso de sospecha de infección, la administración de antibióticos de amplio espectro que cubran bacilos gramnegativos aerobios, especialmente enterobacterias, y cocos grampositivos aerobios, en especial estreptococos, son la opción de elección hasta que se conozca el resultado de los cultivos microbiológicos.
En estancias prolongadas en UCI, más allá de 2 semanas, debe considerarse la posibilidad de una infección fúngica.
Al no existir una referencia fiable para ajustar las dosis de fármacos de metabolismo hepático a la función hepatocelular, no se aconseja, al menos de forma sistemática, reducir las dosis convencionales de antibióticos en pacientes con IHAG.
Recomendaciones
- •
Debe monitorizarse la presencia de infecciones o colonizaciones mediante cultivos seriados (grado de evidencia III; grado de recomendación 1).
- •
La presencia de criterios clínicos de SRIS o sepsis o la progresión de la EH deben conllevar el inicio precoz de terapia antibiótica (grado de evidencia II-3; grado de recomendación 1).
- •
La administración de antifúngicos debe considerarse en pacientes con estancias prolongadas en UCI (grado de evidencia II-3; grado de recomendación 1).
La identificación temprana de los pacientes que no sobrevivirán de forma espontánea al episodio de IHAG permite plantear un THU, que de hecho es la única alternativa terapéutica que ha demostrado aumentar la supervivencia global en la IHAG.
La mayoría de los centros siguen las indicaciones del King's College de Londres, aunque existen otros criterios (Clichy, etc.). En Catalunya estos criterios se han consensuado en el seno de la OCATT (Organització Catalana de Trasplantament) (tabla 2)33.
Existen enfermedades con criterios de THU específicos, como la IHAG por sobredosis de paracetamol o por intoxicación por A. phalloides y la enfermedad de Wilson (tabla 2).
En los últimos años hemos constatado la necesidad de mejorar la sensibilidad y especificidad de estos criterios, pero la baja incidencia de la enfermedad no lo ha hecho posible. Lo que resulta evidente es que todas las escalas pronósticas tienen elementos comunes: la edad, el grado de EH, y la alteración de la coagulación. Difieren en considerar o no la etiología del cuadro y los valores de bilirrubina. Un metaanálisis reciente34 ha demostrado que los criterios del King's College de Londres y la puntuación MELD («Model for End-Stage Liver Disease») tienen un valor pronóstico similar en pacientes con sobredosis de paracetamol. Algunos autores consideran que añadir otras variables pronósticas, como el fósforo, al MELD (MELD-p), podría aumentar su valor predictivo18.
Recomendaciones
- •
La valoración pronóstica del paciente debe realizarse de forma continuada a fin de decidir la mejor alternativa terapéutica en cada momento (grado de evidencia III; grado de recomendación 1).
- •
Factores de mal pronóstico son: afectación hepática grave, afectación extrahepática, y presentación subaguda (grado de evidencia II-3; grado de recomendación 1).
- •
Debe considerarse el THU en los pacientes que reúnan los criterios para el mismo (grado de evidencia II-2; grado de recomendación 1).
- •
La decisión de realizar un THU debe ser multidisciplinar y tomada por un equipo experto en este procedimiento (grado de evidencia III; grado de recomendación 1).
El THU es la única alternativa de tratamiento en algunos casos de IHAG. Sin embargo, el trasplante no es aplicable de forma universal y, de hecho, menos del 10% de los trasplantes hepáticos se realizan en pacientes con IHAG (7,6% en adultos en Catalunya en 2015)35. Los pacientes con IHAG y criterios de THU entran en una lista de trasplante urgente y tienen prioridad a nivel estatal (alerta 0, que puede ser isogrupo, compatible o incompatible, en función del grupo sanguíneo del paciente y de su gravedad).
Las contraindicaciones generales y específicas al THU son las mismas que para el trasplante no urgente, y están establecidas en el documento de consenso de la OCATT33. También debemos tener en cuenta las contraindicaciones específicas ligadas a la IHAG y que comporten un riesgo quirúrgico inaceptable (infecciones activas o no controladas, hemorragia no controlada, hipertensión intracraneal con imposibilidad de normalizar la PIC con las medidas médicas expuestas previamente y con signos de daño neurológico, fracaso multiorgánico).
La supervivencia post-THU en la IHAG se acerca al 80% al año,<75% a los 5 años35. La muerte suele acontecer durante los 3 primeros meses post-THU, fundamentalmente por complicaciones sépticas, y afecta más a pacientes de edad avanzada y aquellos con injertos de peor calidad o sin identidad AB036.
La disfunción precoz del injerto hepático comporta un aumento del riesgo de hipertensión intracraneal y sepsis.
Recomendación
- •
Los pacientes con IHAG que requieran un THU deben entrar en una lista prioritaria de trasplante (grado de evidencia III; grado de recomendación 1).
Partimos de la base de que la insuficiencia hepatocelular en la IHAG es reversible en muchos casos dada la capacidad regenerativa hepática. Es por ello que los sistemas de soporte hepático, como puente a la regeneración, o al THU si esta no es factible, resultan de gran importancia en esta enfermedad. Estos sistemas de soporte deberían suplir todas las funciones hepáticas: síntesis, excreción y metabolismo. Desafortunadamente, hasta la fecha no disponemos de sistemas tan completos. Las mayores evidencias clínicas las tenemos en sistemas de soporte hepático artificial. Estos sistemas se basan en la eliminación de substancias tóxicas, tanto hidrosolubles como ligadas a albúmina, que se acumulan como resultado de la pérdida o «muerte» de hepatocitos y que, a su vez, favorecen procesos inflamatorios tanto sistémicos como hepáticos.
El sistema de soporte hepático artificial más ampliamente utilizado es el «Molecular Adsorbent Recirculating System» o MARS. Inicialmente fueron varias las comunicaciones de series cortas de pacientes o casos aislados de IHAG tratados de manera favorable con MARS. En el año 2013, Saliba et al. publicaron los resultados de un estudio multicéntrico, aleatorizado y controlado utilizando MARS en pacientes con IHAG y criterios de THU37. El estudio incluyó a 110 pacientes, de los que 102 fueron aleatorizados a tratamiento convencional (49 pacientes) vs. tratamiento convencional+MARS (53 pacientes). Es importante destacar, dadas las implicaciones pronósticas, que la mitad de los casos en ambos grupos eran secundarios a sobredosis de paracetamol. La probabilidad actuarial de supervivencia en los 2 grupos de tratamiento no mostró diferencias significativas. Tampoco se observaron diferencias cuando los pacientes se categorizaron según la etiología de la IHAG, paracetamol vs. no paracetamol. Como dato resaltable, destacar que el tiempo de espera en lista para recibir un injerto hepático fue inferior a 24h en el 75% de los casos. Adicionalmente se observó que aquellos pacientes que habían recibido 3 o más sesiones de MARS (14 pacientes en total), presentaron una supervivencia significativamente superior al resto de pacientes tanto del grupo MARS (57 vs. 8%; p=0,0004) como del total (57 vs. 18%; p=0,004). Es decir, cabe la posibilidad de que los pacientes del grupo MARS no recibieran las sesiones necesarias, o con la precocidad suficiente, para obtener resultados favorables. Por desgracia, esta hipótesis deberá explorarse en futuros estudios.
Pillukat et al.38 trataron 9 casos de intoxicación por A. phalloides, 4 de ellos con criterios de THU, con MARS, consiguiendo la supervivencia libre de trasplante en todos ellos.
En el Hospital Clínic de Barcelona se realizó un estudio piloto tratando con MARS (mínimo 3 tratamientos) a pacientes con IHAG, criterios de THU y contraindicaciones formales al procedimiento. Los resultados fueron mejores que los esperados, derivados de observaciones previas (mortalidad intrahospitalaria en series anteriores: 82%; mortalidad observada: 59%)39.
De manera reciente se ha publicado un estudio de Larsen et al. incluyendo a 182 pacientes, recogidos en 10 años, y aleatorizados a recibir tratamiento convencional o tratamiento convencional+3 días de sesiones de recambio plasmático de alto volumen (8-15% del peso ideal del paciente)40. Este estudio mostró un aumento de la supervivencia libre de trasplante en los pacientes tratados con recambio plasmático, probablemente porque este tratamiento atenúa la respuesta inflamatoria e inmune, con lo que se reduce la incidencia de fracaso multiorgánico. La realización de recambios no aumentaba la supervivencia postrasplante si el paciente acababa recibiendo un órgano. En caso de que nuevos estudios confirmen estos datos, el recambio plasmático de alto volumen deberá ser considerado un «puente», o incluso alternativa, al THU.
Por lo que respecta a los métodos bioartificiales, es decir, que utilizan células hepáticas, se publicaron los resultados de un estudio multicéntrico en el que el uso de un circuito extracorpóreo con células hepáticas vivas no consiguió reducir la mortalidad en la serie global de pacientes pero sí en el subgrupo de pacientes con IHAG de curso fulminante de etiología vírica o por sobredosis de paracetamol41.
Otros sistemas se hallan actualmente en fase de estudio para su utilización como «puente» al trasplante. La utilización de estos métodos solo se recomienda en el marco de estudios controlados.
Recomendaciones
- •
Los sistemas de soporte hepático artificial y bioartificial deben usarse en el contexto de estudios clínicos controlados (grado de evidencia II-1; grado de recomendación 1).
- •
El recambio plasmático de alto volumen se ha asociado a un aumento de la supervivencia libre de trasplante en un estudio aleatorizado controlado (grado de evidencia I; grado de recomendación 1).
- •
La eficacia del recambio plasmático es superior cuando se utiliza de forma precoz y en pacientes que posteriormente no requieren un THU (grado de evidencia I; grado de recomendación 2).
Los autores declaran no tener ningún conflicto de intereses.