La aparición de diarrea intrahospitalaria supone un evento de alto impacto en la morbimortalidad de pacientes hospitalizados, la quimioprofilaxis con antibióticos en pacientes seleccionados podría resultar en una herramienta costo-efectiva para su prevención.
MétodoSe realizó un estudio prospectivo, randomizado, abierto, en un hospital de tercer nivel de la ciudad de México, seleccionando pacientes con alto riesgo de adquirir diarrea intrahospitalaria, se asignó pacientes a un grupo de metronidazol 500mg vía oral cada 8 h durante 7 días y un grupo de observación. El resultado primario fue determinar la presencia de diarrea asociada a antibióticos e infección por Clostridium difficile (C. difficile) durante los 7 días de evaluación. Aprobado por el comité de ética institucional. Número de registro (11.2017) del 14 de marzo de 2017.
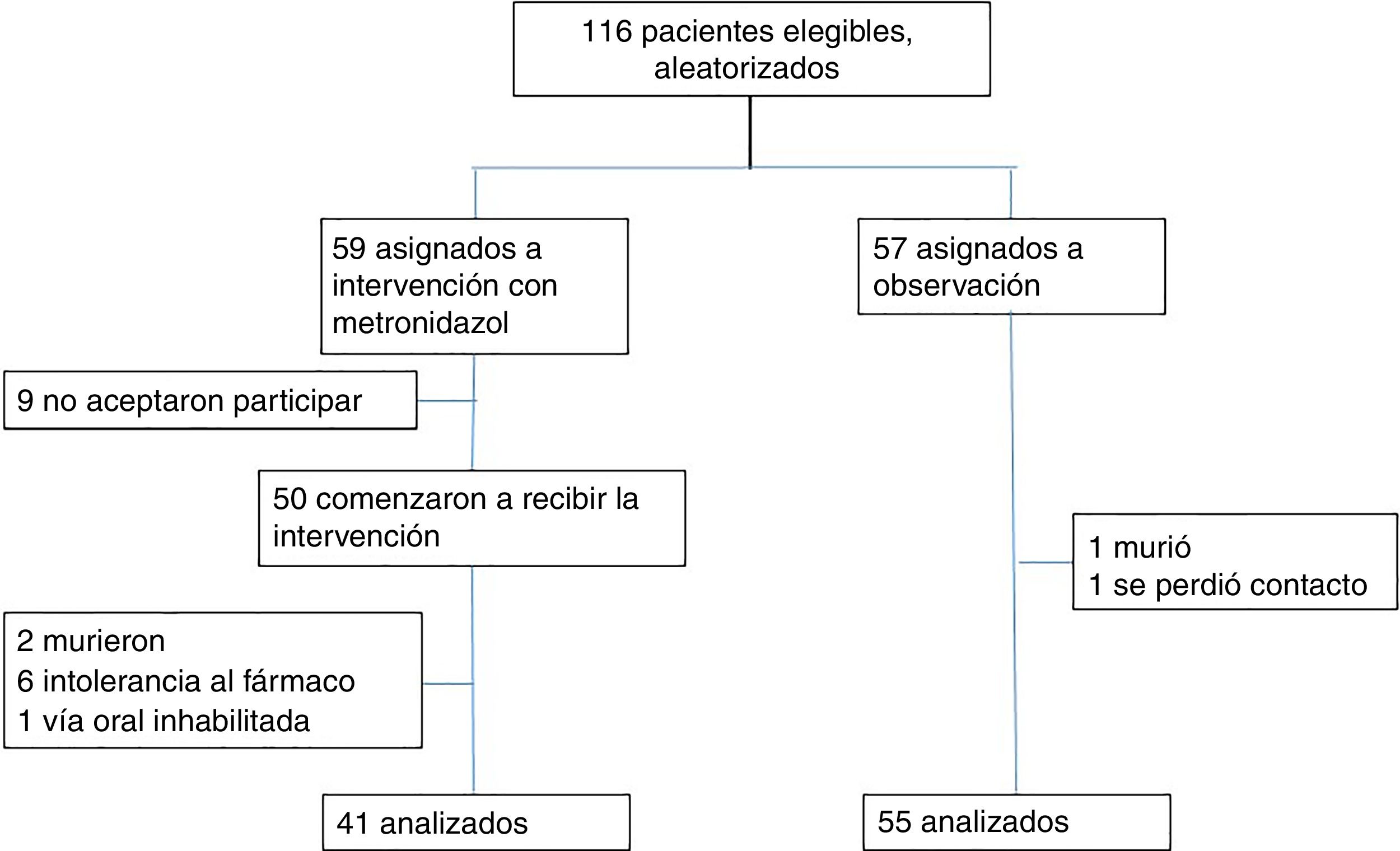
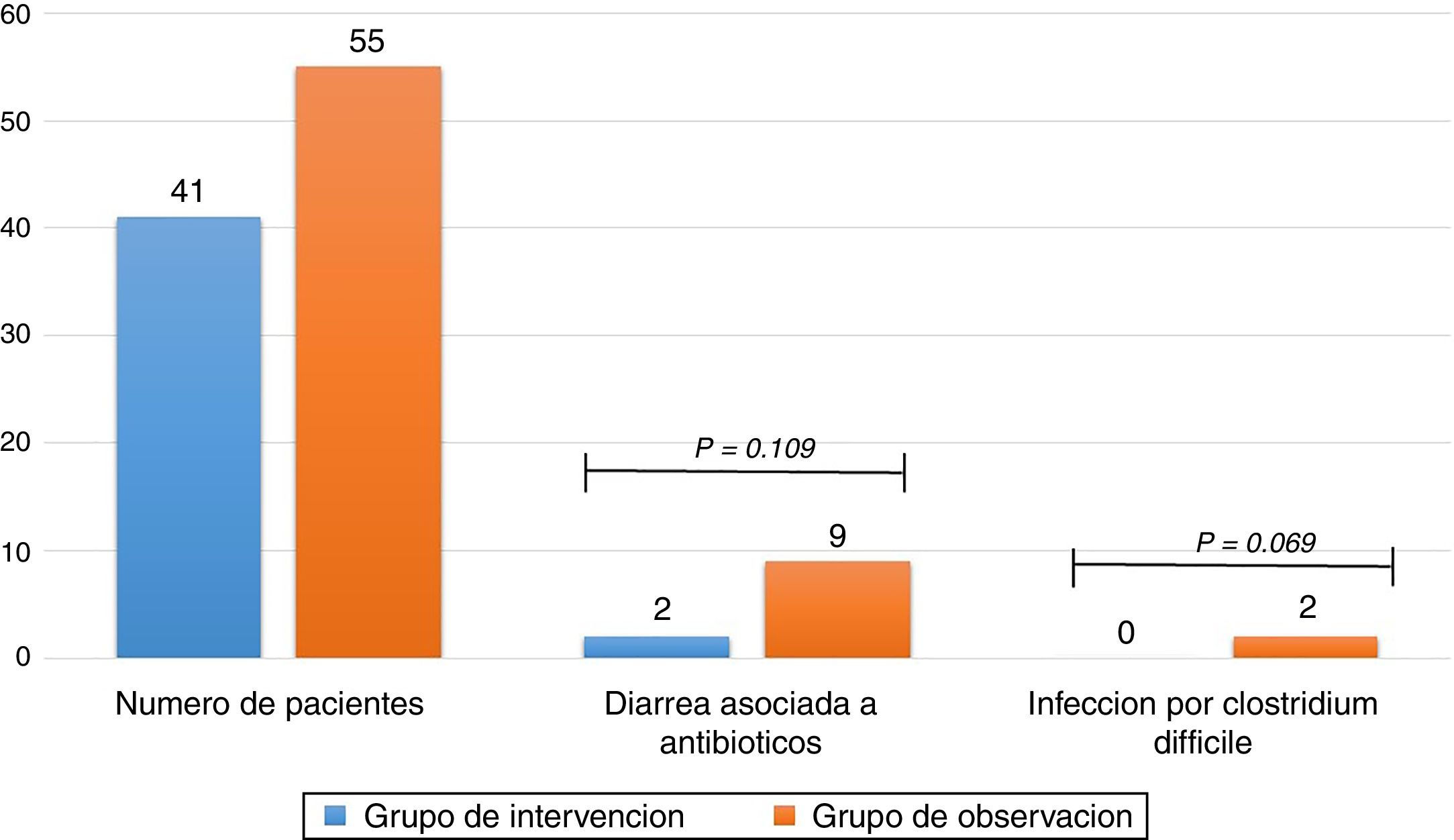
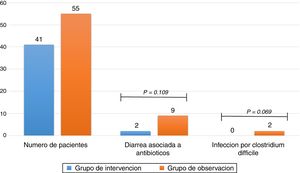
ResultadosDe 116 pacientes que cumplieron criterios de inclusión, 96 fueron analizados, 41 en el grupo de intervención y 55 en el grupo de observación, la diarrea asociada a antibióticos se presentó en un 4,9% de pacientes en el grupo de intervención y en un 16,4% en el grupo de observación (odds ratio [OR] 0,26 (0,05-1,29) p = 0,109). La infección por C. difficile se presentó en el 0% de los pacientes en el primer grupo y en el 9,1% en el segundo grupo (odds ratio [OR] 0,91 (0,84-0,99) p = 0,069).
ConclusionesEl uso de metronidazol para prevención de diarrea asociada a antibióticos no se relacionó con disminución en su aparición, mientras que para infección por C. difficile podría resultar en una alternativa efectiva en seleccionados pacientes de alto riesgo. Éste es el primer estudio prospectivo diseñado para este fin. Se requieren a futuro nuevos estudios que involucren mayor número de pacientes.
In-hospital diarrhoea has a high impact on morbidity and mortality rates among hospitalised patients. Chemoprophylaxis with antibiotics in selected patients could be a cost-effective tool for prevention.
MethodsA prospective randomised, open-label study was conducted in a tertiary hospital in Mexico City, selecting patients at high risk of acquiring in-hospital diarrhoea and assigning them to a group taking metronidazole 500mg orally every eight hours for seven days or an observation group. The primary endpoint was the presence of antibiotic-associated diarrhoea and Clostridium difficile (C. difficile) infection during the seven days of evaluation. The study was approved by the institutional ethics committee. Registration number (11.2017) of 14 March 2017.
ResultsOf the 116 patients who met the inclusion criteria, 96 were analysed, 41 in the intervention group and 55 in the observation group: 4.9% of patients in the intervention group and 16.4% in the observation group developed antibiotic-associated diarrhoea (odds ratio [OR] 0.26 (0.05-1.29); p =.109). 0% of patients in the intervention group and 9.1% in the observation group developed C. difficile infection (odds ratio [OR] 0.91 (0.84-0.99); p =.069).
ConclusionsMetronidazole prophylaxis did not result in a reduction in antibiotic-associated diarrhoea. It could, however, be an effective measure for preventing C. difficile infection in selected high-risk patients. This was the first prospective study designed for this purpose. New studies that involve a larger number of patients are required in the future.
La aparición de diarrea intrahospitalaria (DIH) supone un evento con alto impacto en la mortalidad y morbilidad, que incrementa costos y días de estancia hospitalaria; uno de los factores que favorecen su aparición es el uso de antibióticos de amplio espectro1. La diarrea asociada a antibióticos (DAA) es una patología frecuente en pacientes hospitalizados cuyo principal mecanismo es la disrupción de la flora intestinal con subsecuentes cambios en el metabolismo de hidratos de carbono, ácidos grasos de cadena corta y ácidos biliares2, usualmente es una enfermedad leve y autolimitada pero el 15 a 39% de los casos son causados por infección por Clostridium difficile (C. difficile) –ICD– cuyo curso clínico es más agresivo con alta mortalidad3.
En 1978 se describieron los primeros casos de ICD4, desde entonces esta patología presenta un marcado aumento en su incidencia con aparición de nuevas cepas como la NAP1 / BI / 027, con mayor virulencia y complicaciones5, los factores de riesgo más asociados a su aparición en pacientes hospitalizados son la edad >65 años, uso de antibióticos (cefalosporinas, clindamicina, B-lactámicos y fluoroquinolonas) y el padecimiento de enfermedades graves6, otros factores adicionales incluyen supresión del ácido gástrico, alimentación enteral, cirugía gastrointestinal, obesidad, quimioterapia, trasplante de células madre hematopoyéticas y enfermedad inflamatoria intestinal7–9.
Se han investigado diversas medidas para evitar su aparición, como la restricción en la prescripción de antibióticos, particularmente: clindamicina, fluoroquinolonas y cefalosporinas10, el lavado de manos con agua y jabón sobre productos desinfectantes a base de alcohol el cual se asocia a mayor probabilidad de erradicación de C. difficile11, principalmente jabones a base de clorhexidina12. Se han realizado estudios con probióticos que incluyen combinación de Lactobacillus con resultados variables que dependen del tipo y la formulación usada13,14. Recientemente un estudio evaluó el uso de actoxumab y bezlotoxumab que son anticuerpos monoclonales humanos contra las toxinas A y B de C. difficile, respectivamente, mostrando que el bezlotoxumab se asoció con una disminución en la tasa de recurrencia de la enfermedad frente al placebo, no así en el caso de actoxumab15.
La quimioprofilaxis con fármacos usualmente empleados en el tratamiento de la enfermedad supone una opción razonable de bajo costo para prevenir la aparición de la enfermedad en pacientes seleccionados de alto riesgo, Van Hise et al.16, realizaron un estudio retrospectivo con el uso de vancomicina oral para prevenir la recurrencia de ICD, encontrado que la ICD recurrente se presentó en el 4% de los que recibieron profilaxis frente al 27% de los que no la recibieron. Con respecto al metronidazol Rodríguez et al.17, describieron retrospectivamente la eficacia en prevención primaria de este medicamento en pacientes adultos de alto riesgo (definido como edad mayor a 55 años, uso de inhibidor de bomba de protones y antibióticos de amplio espectro) encontrando que la incidencia en el grupo de pacientes que recibieron metronidazol por causas diferentes a la ICD fue del 1,4% y en el grupo que no recibieron fue del 6,5%, concluyendo que el recibir metronidazol reduce la incidencia de diarrea intrahospitalaria asociada a C. difficile en un 80%.
No se cuenta con estudios prospectivos que evalúen la efectividad de estos fármacos como prevención primaria para aparición de DAA e ICD en pacientes de alto riesgo; en la plataforma de Clinical Trials se registró un ensayo clínico con aplicación de metronidazol o placebo a pacientes con alto riesgo de ICD, estudio que no se concluyó porque los pacientes no siguieron las instrucciones18. El objetivo del presente estudio es evaluar el papel del metronidazol en la prevención de DAA e ICD en pacientes hospitalizados de alto riesgo.
Materiales y métodosDiseño del estudio y participantesSe realizó un ensayo clínico aleatorizado, abierto, aprobado por el comité de ética institucional con número de registro (11.2017) del 14 de marzo de 2017, en el que se incluyó pacientes hospitalizados en el servicio de Medicina Interna del Hospital Regional Licenciado Adolfo López Mateos de la ciudad de México desde el 1 de mayo al 30 de septiembre 2017, que cumplían con los siguientes criterios de inclusión: edad entre 55 años y 75 años (se excluyeron pacientes mayores de 75 años por el riesgo de potenciar posibles efectos adversos relacionados con el uso de otros medicamentos)19,20, uso de inhibidor de bomba de protones, uso de antibióticos de amplio espectro que incluyera uno de los siguientes (cefalosporinas de tercera generación, levofloxacino y/o clindamicina), por ser los de mayor uso en la institución y estancia hospitalaria menor a 72 h antes de la intervención. Se excluyeron pacientes que presentaran diarrea al ingreso, infección por C. difficile documentada en los 6 meses previos, estado mental alterado, uso de metronidazol para el tratamiento de una patología concomitante durante la hospitalización, consumo de medicamentos con interacciones mayores con metronidazol21, embarazadas y pacientes que refieran consumo de alcohol al menos 48 h antes de la intervención22. Todos los pacientes seleccionables fueron invitados a participar por medio de consentimiento informado; se eliminaron pacientes que no aceptaran participar, que durante la intervención presentaran intolerancia a la vía oral o se negaran a continuar la toma del medicamento y que fallecieran por causas no relacionadas con la aparición de diarrea.
AleatorizaciónLos pacientes elegidos fueron aleatorizados por medio de una herramienta del programa EXCEL de paquete OFFICE 2013, a ingresar al grupo de intervención con metronidazol 500mg vía oral cada 8 h por 7 días o al grupo de observación.
ProcedimientosDurante los siguientes 7 días posteriores a la inclusión los pacientes fueron seguidos para identificar la presencia de DIH, la cual se definió como la aparición de tres o más deposiciones de consistencia disminuida (consistencia 5-7 en escala de Bristol)23 en 24 h; el end point se definía por la presencia de DIH por lo cual al presentarse esta se terminaba la observación y los pacientes eran tratados de acuerdo a las guías de práctica clínica institucionales; en caso de presentar DIH se recolectaban las muestras correspondientes y se enviaban a análisis de toxinas A y B para C. difficile. Si los pacientes eran egresados antes de completar los 7 días de observación se entregaban recetas por dosis faltantes de metronidazol al grupo de intervención y se realizaba un seguimiento por vía telefónica a ambos grupos interrogando sobre la presencia o no de diarrea, en caso de presentarla se citaban de urgencia para toma de muestras y valoración.
Análisis estadísticoEl ensayo fue inicialmente diseñado con un muestreo calculado con la fórmula de diferencia de para un total de 454 pacientes, 227 en cada grupo, con un error alfa de 0,05 y un poder 80%, para detectar un 80% por ciento de diferencia en la aparición de DAA en ambos grupos con base en el estudio de Rodríguez et al.17, por cuestiones de logística institucional no se alcanzó la muestra deseada incluyendo finalmente 41 pacientes en el grupo de intervención y 55 en el grupo de observación. Los datos fueron exportados desde la base de datos del estudio y analizados con el uso de Software SPSS (versión 24). La variable de sexo fue analizada mediante U-Mann Withney, la edad presentó distribución normal y se analizó mediante t de Student, las variables de comorbilidades, causas de hospitalización, hospitalización previa y el uso de antibióticos utilizados en la hospitalización fueron analizados mediante chi cuadrado, el punto primario de evaluación que era la aparición de DAA e ICD se analizaron con prueba exacta de Fisher y cálculo de riesgo a través de tablas de contingencia.
ResultadosEl reclutamiento de pacientes se realizó desde mayo a septiembre de 2017, 116 pacientes cumplían con criterios de inclusión, se aleatorizaron y 59 pacientes fueron asignados al grupo de intervención de los cuales 9 no aceptaron participar por temor a presentar efectos adversos previamente conocidos o experimentados con el fármaco y otros 9 fueron excluidos, 2 por muerte, 6 por presentar efectos adversos de predominio gastrointestinal cefalea y vértigo, por último uno se excluyó por indicaciones médica de ayuno, finalmente fueron analizados 41 pacientes. Cincuenta y siete pacientes fueron asignados al grupo de observación donde un paciente se excluyó por muerte y otro por pérdida de contacto después del alta antes del séptimo día, finamente se analizaron 55 pacientes (fig. 1).
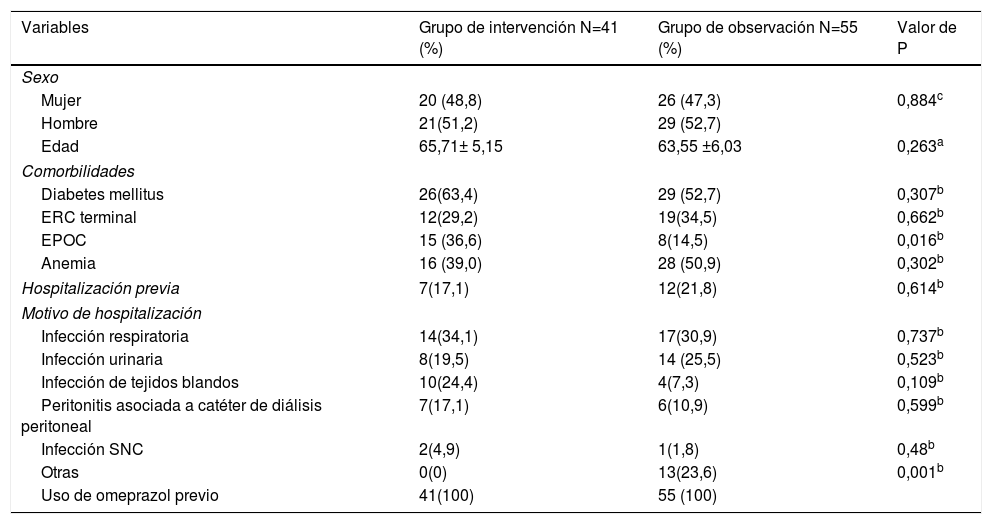
Los pacientes incluidos en el grupo de intervención tenían una edad de 65,71 ± 5,15 y el 51,2% eran hombres, mientras que en el grupo de observación la edad fue de 63,55 ± 6,03 y el 52,7% eran hombres; las comorbilidades evaluadas fueron los antecedentes de diagnóstico previo de diabetes mellitus tipo 2, enfermedad renal crónica (ERC) en terapia sustitutiva de la función renal mediante cualquier modalidad y enfermedad pulmonar obstructiva crónica (EPOC), presentes en un porcentaje importante de pacientes y distribuidos de forma equitativa en ambos grupos a excepción de la EPOC presente en un 36,6% de pacientes en el grupo de intervención y solo en el 14,5% de pacientes en el grupo control (p 0,016). Dentro de las causas de hospitalización se incluyeron infecciones respiratorias, infecciones del tracto urinario, infección de tejidos blandos, peritonitis asociada a diálisis peritoneal, infección del sistema nervioso central que fueron distribuidas en ambos grupos de manera equitativa, se agruparon como otras causas las patologías infecciosas infrecuentes o patologías en las que no se documenta foco infeccioso y los pacientes recibieron tratamiento antibiótico sin indicación clara como falla cardiaca, trastornos hidroelectrolíticos entre otros, el 23,6% de los pacientes en el grupo de observación, mientras que ningún paciente del grupo de intervención fueron asignados a esta categoría (tabla 1). Los antibióticos más utilizados en los pacientes evaluados fueron en orden de frecuencia cefalosporinas de tercera generación, levofloxacino y clindamicina, dependiendo de la indicación médica eran administrados por separado y en un porcentaje importante de pacientes 31,7% para el grupo de intervención y 21,8% para el grupo de observación se administraron de forma conjunta, sin encontrar en análisis de regresión logística relación con un mayor número de pacientes con DAA e ICD (tabla 2).
Características basales de la población
| Variables | Grupo de intervención N=41 (%) | Grupo de observación N=55 (%) | Valor de P |
|---|---|---|---|
| Sexo | |||
| Mujer | 20 (48,8) | 26 (47,3) | 0,884c |
| Hombre | 21(51,2) | 29 (52,7) | |
| Edad | 65,71± 5,15 | 63,55 ±6,03 | 0,263a |
| Comorbilidades | |||
| Diabetes mellitus | 26(63,4) | 29 (52,7) | 0,307b |
| ERC terminal | 12(29,2) | 19(34,5) | 0,662b |
| EPOC | 15 (36,6) | 8(14,5) | 0,016b |
| Anemia | 16 (39,0) | 28 (50,9) | 0,302b |
| Hospitalización previa | 7(17,1) | 12(21,8) | 0,614b |
| Motivo de hospitalización | |||
| Infección respiratoria | 14(34,1) | 17(30,9) | 0,737b |
| Infección urinaria | 8(19,5) | 14 (25,5) | 0,523b |
| Infección de tejidos blandos | 10(24,4) | 4(7,3) | 0,109b |
| Peritonitis asociada a catéter de diálisis peritoneal | 7(17,1) | 6(10,9) | 0,599b |
| Infección SNC | 2(4,9) | 1(1,8) | 0,48b |
| Otras | 0(0) | 13(23,6) | 0,001b |
| Uso de omeprazol previo | 41(100) | 55 (100) | |
EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica.
Terapia antibiótica por clase y grupo de tratamiento
| Variables | Grupo de intervención N=41 (%) | Grupo de observación N=55 (%) | Valor de P |
|---|---|---|---|
| Clase de antibiótico | |||
| Clindamicina | 8(19,5) | 6(10,9) | 0,258a |
| Cefalosporinas de 3.ra generación | 30(73,2) | 44(80) | 0,469a |
| Levofloxacino | 16(39) | 17(30,9) | 0,515a |
| Combinación de terapia antibiótica | |||
| Tratamiento 1 antibiótico | 28(68,3) | 43 (78,2) | 0,348a |
| Tratamiento 2 antibióticos o más | 13(31,7) | 12(21,8) | 0,348a |
El resultado primario del estudio encontró que el 16,4% de los pacientes presentó DAA en el grupo de observación y 4,9% en el grupo de intervención con P de 0,109 y un OR de 0,26 (0,05-1,29), sin que se pueda establecer relación entre la administración de metronidazol y un menor número de pacientes con DAA. Respecto a la ICD se presentaron 5 casos positivos mediante análisis de toxinas A y B en el grupo de observación y ningún caso en el grupo de intervención con una P de 0,069 y OR de 0,91 (0,84-0,99) (tabla 3), sugiriendo sin alcanzar la significación estadística que el uso de metronidazol se asocia con menor número de pacientes con ICD (fig. 2).
Diarrea asociada a antibióticos e infección por Clostridium difficile
La quimioprofilaxis con fármacos empleados usualmente para el tratamiento de la ICD, representaba en estudios retrospectivos una medida costo-efectiva prometedora para pacientes de alto riego; el presente constituye el primer estudio prospectivo que evaluó la efectividad de estos fármacos, usualmente empleados en el tratamiento de ICD, como medida de prevención en pacientes seleccionados, encontrando que el recibir metronidazol no previene la aparición de DAA de forma significativa, mientras que podría sugerirse su uso como medida de prevención de ICD; es importante destacar que este es un medicamento de bajo costo, fácil acceso y amplio uso en múltiples infecciones, sus efectos adversos son múltiples y ampliamente conocidos por los pacientes, lo cual limitó el número de participantes incluidos en el grupo de intervención puesto que el 15,2% de los seleccionados no aceptaron ingresar, sumado a esto el 12% de los que iniciaron la toma del medicamento no la completaron por presentar efectos adversos principalmente gastrointestinales, siendo un fármaco muy poco tolerado. Aunado a esto desconocemos el efecto del fármaco sobre la microbiota intestinal y la generación de resistencias bacterianas derivadas de su uso, y que posiblemente interfiera en su eficacia como tratamiento de primera línea en caso de presentarse ICD.
Es importante resaltar que la población atendida en nuestro centro presenta una alta tasa de comorbilidades en especial ERC en diálisis peritoneal presente en cerca de un tercio y diabetes mellitus presente en más de la mitad de los pacientes seleccionados, disparando de forma importante el número de casos de diarreas no infecciosas; por ser esta una manifestación propia de las enfermedades de base, sin encontrar en análisis de regresión logística que estos antecedentes impacten de forma significativa en la aparición de DAA e ICD.
Este estudio presenta importantes limitaciones como el ser un estudio abierto, el número limitado de pacientes incluidos, el alto porcentaje de pacientes perdidos en el grupo intervención, el diagnóstico de ICD fue basado en la detección de toxinas A y B de C. difficile, las cuales presentan alta especificidad cercana al 100% pero baja sensibilidad24, lo cual pudo infravalorar el número real de pacientes afectados de ICD, tanto en el grupo de intervención como en el de observación, y al tratarse de grupos con un número tan limitado de pacientes, pequeñas modificaciones trasforman de forma importante el análisis de los datos.
ConclusionesLa ICD constituye una patología con alto impacto en mortalidad, morbilidad y costes de atención médica, este estudio prospectivo evaluó el uso de metronidazol en la prevención tanto de DAA como de ICD, sin encontrar una relación significativa entre su administración y menor incidencia de DAA, para el caso de ICD la p se encuentra cercana a la significación estadística con intervalos que pueden sugerir su uso, sin embargo para su diagnóstico se utilizaron pruebas con baja sensibilidad, encontrando además que fue un fármaco muy poco tolerado. Se requieren nuevos estudios con mayor número de pacientes, doble ciego y que usen pruebas diagnósticas más eficaces.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses para la realización de este estudio, el metronidazol fue otorgado por el Hospital Regional Licenciado Adolfo López Mateos, ISSSTE, la recolección y el análisis estadístico de los datos se realizaron con recursos propios de los autores.