La pancreatitis crónica es una enfermedad fibroinflamatoria del páncreas originada por acción combinada de factores etiológicos. Muestra formas de presentación, tipos de complicaciones y grados evolutivos variables. Las opciones terapéuticas son tan diversas como los múltiples escenarios clínicos. Algunas sociedades médicas han desarrollado guías sobre diagnóstico y tratamiento basadas en evidencia científica. Pero la elevada variabilidad que conforman la conjunción de elementos etiológicos, presentaciones clínicas, complicaciones y progresión de la enfermedad hace que los niveles de evidencia obtenidos sean generalmente bajos y, por tanto, las recomendaciones tienden a ser vagas o débiles, salvo excepciones.
En los presentes documentos de posicionamiento de la Societat Catalana de Digestologia y la Societat Catalana de Pàncrees hemos buscado redactar declaraciones bien definidas orientadas al clínico, basadas en revisiones actualizadas de literatura y acuerdos de expertos. El objetivo es proponer el uso de terminología común y circuitos diagnóstico/terapéuticos racionales basados en el conocimiento actual. Para este fin se revisaron 51 secciones relacionadas con pancreatitis crónica por 21 expertos de 6 especialidades diferentes para generar finalmente 88 declaraciones que buscan armonizar conceptos y formular recomendaciones precisas.
La parte 1 de esta serie de documentos discute tópicos sobre etiología, diagnóstico y diagnóstico diferencial. Factores etiológicos de mayor relevancia son tóxicos (alcohol y tabaco), genéticos y obstructivos. Dolor abdominal, insuficiencia exocrina y endocrina y síntomas derivados de complicaciones son las presentaciones más frecuentes. Algunos pacientes permanecen asintomáticos. El diagnóstico (seguro, probable o incierto) debe sustentarse en datos objetivos obtenidos en pruebas de imagen, histología y pruebas de función pancreática.
Chronic pancreatitis is a chronic fibroinflammatory disease of the pancreas with prevalence around 50 cases per 100,000 inhabitants. It appears to originate from diverse and yet mixed etiological factors. It shows highly variable presenting features, complication types and disease progression rates. Treatment options are as wide as the multiple personalized scenarios the disease might exhibit at a given time point. Some medical societies have developed guidelines for diagnosis and treatment based on scientific evidence. Although these efforts are to be acknowledged, the gathered level of evidence for any topic is usually low and, therefore, recommendations tend to be vague or weak.
In the present series of position papers on chronic pancreatitis from the Societat Catalana de Digestologia and the Societat Catalana de Pàncrees we aimed at providing defined position statements for the clinician based on updated review of published literature and on interdisciplinary expert agreement. The final goal is to propose the use of common terminology and rational diagnostic/therapeutic circuits based on current knowledge. To this end 51 sections related to chronic pancreatitis were reviewed by 21 specialists from 6 different fields to generate 88 statements altogether. Statements were designed to harmonize concepts or delineate recommendations. Part 1 of this paper series discusses topics on aetiology and diagnosis of chronic pancreatitis. Main clinical features are abdominal pain, exocrine and endocrine insufficiency and symptoms derived from complications. Some patients remain symptom-free. Diagnosis (definitive, probable or uncertain) should be based on objective data obtained from imaging, histology, or functional tests.
Este es el primero de una serie de 3 documentos cuya intención es resaltar los conceptos principales y las actuaciones recomendadas por la Societat Catalana de Digestologia (SCD) y la Societat Catalana de Pàncrees (SCPanc) sobre aspectos clínicos de la pancreatitis crónica (PCr). El objetivo es proponer una terminología común y unos circuitos diagnósticos y terapéuticos racionales basados en el conocimiento actual. Los siguientes documentos de la serie se orientarán hacia el tratamiento y evolución (parte 2) y hacia las complicaciones y las formas especiales de pancreatitis crónica (parte 3).
Para este fin se revisaron los artículos y sus referencias relevantes publicados en los últimos 6 años sobre 51 apartados relacionados con pancreatitis crónica por parte 21 especialistas provenientes de las disciplinas de gastroenterología (8), endoscopia (4), cirugía (4), anatomía patológica (2), radiología (2) y endocrinología (1) de 11 centros sanitarios de referencia de Cataluña. Se solicitó a los especialistas que en sus conclusiones y recomendaciones priorizaran aspectos de aplicación clínica práctica. De la revisión actualizada de los apartados se confeccionó un documento preliminar que fue discutido por todo el grupo. Donde se detectaron discrepancias entre miembros del grupo el texto se editó para poder alcanzar más del 90% de consenso. El documento fue posteriormente presentado a las 2 sociedades promotoras para su aprobación.
Las frases precedidas de la abreviatura SCD-SCPanc señalan la posición de las 2 sociedades en los diferentes apartados, ya sea para enfatizar un concepto o para manifestar una recomendación. Muchos apartados merecen ser tratados en un artículo de revisión propio, pero este desafío sobrepasa nuestro objetivo actual.
DefiniciónSCD-SCPanc 1.La PCr es un proceso inflamatorio crónico del páncreas que conduce a fibrosis y pérdida del parénquima exocrino y endocrino (atrofia).
La precisa definición de PCr sigue siendo objeto de un debate que tensiona los conceptos subyacentes. El núcleo de la definición suele ser la expresada más arriba, pero algunos expertos tienden a incorporar variaciones, como incluir teorías patogénicas (mecanísticas) en la definición, considerar la PCr como un síndrome o requerir manifestaciones clínicas o aspectos evolutivos. El motivo de elaborar estas definiciones más exigentes es poder llegar a diferenciar la verdadera PCr de alteraciones morfológicas consideradas banales que pueden aparecer en situaciones particulares (edad avanzada, fumadores, diabetes mellitus, etc.). Esta discusión es relevante porque establece límites a considerar en estudios epidemiológicos, clínicos y farmacológicos. La SCD y la SCPanc no se oponen a definiciones de PCr mas complejas, pero consideran que la definición aquí mantenida es la más simple, concentra la esencia de la enfermedad, permite la inclusión de formas asintomáticas y admite la posibilidad de que la enfermedad frene su progresión en condiciones favorables (por ejemplo, si se eliminan los factores causantes).
En relación con la presente serie de documentos consideramos también las siguientes definiciones que requieren aclaración especial:
Pancreatitis recurrente (PAR): un mínimo de 2 episodios de pancreatitis aguda bien documentados separados al menos 3 meses entre ellos con recuperación total (funcional y morfológica) en el intervalo y sin evidencia de PCr1,2.
Pancreatitis hereditaria: pancreatitis que afecta a 2 o más individuos en 2 o más generaciones de una familia sin un factor etiológico conocido. Algunos autores incluyen las pancreatitis asociadas a la presencia de mutaciones genéticas patogénicas, aunque las manifestaciones en otros miembros de la familia sean vagas o inexistentes3. Cuando en este entorno no se cumplen las condiciones estrictas de pancreatitis hereditaria se tiende a hablar de pancreatitis familiar.
Insuficiencia pancreática exocrina (IPEx): deterioro funcional de la secreción pancreática de enzimas y de bicarbonato en grado notable, independientemente de la causa.
EpidemiologíaSCD-SCPanc 2.La incidencia de la PCr oscila entre 5-10 casos por 100.000habitantes/año, y la prevalencia entre 35-50 casos por 100.000habitantes.
Las cifras publicadas son orientativas y muestran gran variabilidad. Los datos originales provienen de estudios con fiabilidad limitada porque dependen de la población estudiada, del método de selección de pacientes y de la precisión diagnóstica de la enfermedad4–6.
Hay grupos que llegan a situar la incidencia en 120 casos/100.000 habitantes. Si fuera 10/100.000, la prevalencia a 20 años debería de ser 200/100.000. Cifras inferiores sugieren que los pacientes tienen alta mortalidad, o que nuestra precisión diagnóstica es deficiente. La incidencia es mayor en hombres que en mujeres4,7.
En Estados Unidos la edad media al diagnóstico es de 56 años8. Un 37% de los pacientes son diagnosticados antes de los 35 años y un 11% después de los 659.
Los ingresos hospitalarios por brotes agudos y complicaciones de la enfermedad son frecuentes6. Sin embargo, solo un 50% de pacientes han tenido un episodio previo documentado de pancreatitis aguda6.
Existen formas asintomáticas cuya prevalencia no se conoce con precisión, pero podrían llegar a representar el 5-10% de todos los pacientes con PCr10.
EtiologíaSCD-SCPanc 3.Se considera que la PCr está causada por uno o múltiples factores actuando sobre individuos con predisposición individual. Es raro que un solo factor sea responsable de su desarrollo.
SCD-SCPanc 4.El riesgo de desarrollar PCr aumenta con la asociación aditiva de factores, el peso específico de cada factor en cada individuo y el tiempo de exposición. La eliminación de factores de riesgo puede frenar la progresión de la enfermedad.
SCD-SCPanc 5.Consideramos que el pancreas divisum puede aceptarse como factor etiológico si se demuestra:
- A.
Enfermedad circunscrita al páncreas dorsal (mediante ultrasonografía endoscópica [USE] o resonancia magnética [RM]).
- B.
U obstrucción de salida al flujo pancreático por papila minor demostrado por la presencia de santorinicele o por dilatación>3mm del conducto de Santorini tras infusión de secretina.
La visión más aceptada actualmente sobre la patogénesis de la PCr es que esta se produce como consecuencia de la acción de uno o, más frecuentemente, múltiples factores agresivos que actúan durante un tiempo más o menos prolongado. La tabla 1 (modificada de la versión 1 TIGAR-O11) enumera los posibles factores etiológicos y nos puede servir de guía para repasarlos frente a un paciente con diagnóstico reciente de PCr.
Factores etiológicos/de riesgo de pancreatitis crónica basados en la clasificación TIGAR-O V1 moficada11
| Tóxico-metabólicos |
| Alcohol |
| Tabaco |
| Hipercalcemia (calcio iónico ≥ 12 mg/dL) |
| Hipertrigliceridemia |
| Fármacos (posible) |
| Toxinas |
| Insuficiencia renal crónica estadio 5 |
| Factores asociados a estrés oxidativo (radioterapia/quimioterapia, isquemia) |
| Casusas metabólicas (diabetes mellitus, obesidad) |
| Idiopática |
| Genética |
| PRSS1 |
| CFTR |
| SPINK1 |
| CTRC |
| CPA1 |
| CEL o CEL-HYB |
| CLDN2 locus |
| TRPV6 |
| Pancreatitis autoinmune tipos 1 y 2 |
| Pancreatitis recurrente y pancreatitis aguda grave |
| De cualquier etiología |
| Obstructiva |
| Páncreas divisum y otras alteraciones anatómicas |
| Estenosis ampular |
| Litiasis intraductales en el conducto pancreático principal |
| Estenosis del conducto del conducto pancreático principal |
| Neoplasia mucinosa papilar intraductal |
| Masa pancreática obstructiva |
El consumo de tabaco y alcohol (tabla 1) son factores de riesgo independiente, pero pocos individuos desarrollan la enfermedad (<5% de grandes consumidores de alcohol)12,13. El riesgo es solo significativo en pacientes que mantienen un consumo elevado y mantenido de alcohol o son fumadores inveterados. Incluso en estos individuos se recomienda siempre realizar una valoración etiológica global que tenga en cuenta también otros posibles factores. Por ejemplo, la combinación de alcohol y mutaciones en CLDN214–16 o de tabaco y mutaciones en cystic fibrosis transmembrane conductance regulator (CFTR) o en quimotripsinógeno C (CTRC) aumentan la incidencia de PCr17. Todas estas combinaciones actuando sobre un determinado individuo explican, en gran parte, la enorme variabilidad respecto a la susceptibilidad de alcohol y tabaco en la inducción y la progresión de PCr.
El alcohol incrementa el riesgo de manera dosis y tiempo dependiente, así como la posibilidad de progresión de la enfermedad18. La persistencia del consumo tras un episodio de pancreatitis aguda facilita recurrencias y progresión hacia PCr19,20.
El riesgo asociado al tabaco es también dosis-dependiente. Se mantiene en menor grado en exfumadores. Es independiente del consumo de alcohol13,21,22.
Un porcentaje elevado de pacientes con PCr son portadores de mutaciones patogénicas en genes específicos13,23. Las más prevalentes en nuestro entorno asientan en CFTR y serine protease inhibitor kazal-type 1(SPINK1), y con menor frecuencia en CTRC, carboxipeptidasa A1 (CPA1) y tripsinógeno catiónico (PRSS1). Algunas variantes en CLDN2 (claudina 2) también se asocian a PCr.
Las mutaciones genéticas son muy prevalentes en pacientes pediátricos (55-73%)24,25, en la PCr idiopática (48-57%) y en formas de inicio antes de 35 años26–28. También se identifican en PCr asociada a alcohol y tabaco13,14,25, lo que refuerza el concepto de la PCr como una enfermedad multifactorial. Los individuos con pancreas divisum tienen alta incidencia de mutaciones en CFTR y SPINK129.
La PCr hereditaria se suele manifestar en edad infantil, muestra rápida evolución hacia cronicidad y comporta un elevado riesgo de cáncer de páncreas30,31.
Mutaciones en PRSS1 inducen la forma mejor caracterizada de pancreatitis hereditaria, aunque es de baja incidencia en nuestro medio. Muestran herencia autosómica dominante con penetrancia incompleta (80%), que suelen afectar a varios miembros de una familia32,33. También ocasionan PCr esporádica34.
Un 30% de pacientes con PCr son portadores de mutaciones en CFTR, porcentaje muy superior al de la población sana. Estas mutaciones inducen una gran variabilidad fenotípica, desde portadores asintomáticos hasta fibrosis quística (FQ)35. Esta variabilidad viene determinada por la función residual de la proteína CFTR, que depende del tipo de mutación (véase: cftr2.org) y la concurrencia de otros factores etiológicos, en particular alcohol y tabaco.
La asociación de 2 mutaciones graves o de una grave y otra leve en alelos diferentes determina el desarrollo de FQ, que cursa con afectación de 2 o más órganos típicos (pulmón y páncreas los más frecuentes) y concentración de cloro en sudor>60mM36. La afectación pancreática es casi universal en forma de atrofia, pancreatitis recurrente o crónica. En algunos pacientes con PCr conocida tendremos que plantearnos el diagnóstico diferencial con FQ (en su forma no clásica), lo cual comportaría beneficios asistenciales para el paciente. La clave está en la detección de test de sudor patológico, de mutaciones patogénicas en CFTR en los 2 alelos y/o la afectación de más de un órgano diana.
Por otro lado, mutaciones en CFTR son frecuentes en la PCr idiopática27,28,37,38. Un tipo de variantes no causantes de FQ (R74Q, R75Q, R117H, R170H, L967S, L997F, D1152H, S1235R y D1270N) afectan predominantemente al transporte de bicarbonato y poco al de Cl−, e incrementan el riesgo de PCr (OR: 1,5)38.
La mutación más frecuente en SPINK1, N34S, se halla en el 9,7% de pacientes (hasta el 30% de las formas idiopáticas) frente al 0,07% de individuos sanos (OR: 11). El riesgo es superior en PCr tropical (OR: 19,15)39. La mutación c.194+2T>C afecta al 3% de las PCr idiopáticas en Occidente, pero hasta el 50% en algunas poblaciones asiáticas (OR: 30,4 en heterocigotos y 162 en homocigotos)26. Otras mutaciones en SPINK1 (intrónicas, deleciones, etc.) son más raras, pero suelen ser graves.
Se han descrito mutaciones en CTRC (R254W, K247_R254del, A73T, V235I) en un 4% de pacientes con PCr no alcohólica (0,7% en población control), que traduce en un riesgo ×540. La variante G60G (c.180 C>T/A) se identifica en el 17-30% de PCr confiriendo un riesgo de ×2,5 en heterocigosis y de ×10 en homocigosis41,42. Se ha descrito con mayor frecuencia en pacientes fumadores con PCr (22,6%), o asociada a mutaciones en CFTR o SPINK1 (22,9%)17.
Las mutaciones en CPA1 están presentes en el 3% de PCr (0,3% en controles) con una OR de 25, mayor en edad infantil (OR: 80)43.
Recientemente se ha comunicado mutaciones en el gen TRPV6 (canal implicado en la absorción de calcio) en el 2-4% de pacientes con PCr idiopática en Japón y en Europa (OR: 48)44.
La asociación de mutaciones en el mismo gen o en genes distintos (p. ej. CFTR y SPINK1) aumenta el riesgo de PCr23,40. Por otro lado, tabaco, alcohol y autoinmunidad pueden reducir la expresión y la función de CFTR en ausencia de mutaciones45–47. El tabaco aumenta el riesgo de PCr asociado a la mayoría de mutaciones.
La obstrucción ductal por tumores, quistes o lesiones secundarias a pancreatitis necrotizante o traumatismos favorece el desarrollo de PCr proximal a la obstrucción. No existe consenso en aceptar disfunción del esfínter de Oddi o pancreas divisum como causas aisladas de PCr, aunque este debate no está cerrado.
El pancreas divisum es una variante del sistema ductal que puede estar presente en el 10% de las personas sanas, en la que el conducto ventral no se fusiona con el dorsal (divisum completo) o existe un conducto de Santorini patente (divisum incompleto). Las técnicas más sensibles para su detección son la USE y la RM (idealmente con secretina48). Algunos estudios han observado mayor incidencia de pancreas divisum en pacientes con PAR o PCr que en la población general (hasta el 43% en un estudio japonés), pero en muchas otras series no se detectan diferencias49,50.
Los pacientes con pancreas divisum y PAR o PCr tienen mayor prevalencia de mutaciones en SPINK1 o en CFTR, o simplemente función de CFTR anormal28,49,51,52. Además, tanto tabaco como alcohol reprimen la expresión de CFTR. La mayoría de estudios que investigan la relación pancreas divisum con PCr no informan del estado mutacional de los pacientes ni de sus hábitos tóxicos.
La pancreatitis autoinmune (PAI) es una forma especial de PCr que se discutirá mejor en la parte 3 de la presente serie. Se caracteriza por tener una buena respuesta a corticoides53. Las PAI evolucionadas son indistinguibles de otras PCr.
La hipercalcemia, la hipertrigliceridemia y algunos fármacos son causas controvertidas y raras de PCr. El mecanismo parece implicar brotes repetidos de pancreatitis grave.
Otros factores como diabetes, obesidad, insuficiencia renal crónica terminal, síndrome metabólico, radioterapia/quimioterapia e isquemia se han asociado a PCr en estudios epidemiológicos o en casos aislados, pero su etiopatogenia se desconoce. Esta asociación está mejor documentada para la diabetes mellitus54.
En un 10-20% de pacientes no se puede identificar ningún factor causal (pancreatitis idiopática).
Manifestaciones clínicasSCD-SCPanc 6.Las principales manifestaciones clínicas de la PCr son dolor abdominal e insuficiencia pancreática exocrina y/o endocrina, pero algunos pacientes pueden permanecer asintomáticos.
SCD-SCPanc 7.No es infrecuente la presentación en forma de pancreatitis aguda o recurrente, o en forma de complicaciones.
Las manifestaciones clínicas asociadas a la PCr son muy variadas55. Con una finalidad académica en la presente serie sobre PCr consideraremos el dolor abdominal, la insuficiencia exocrina, los déficits nutricionales y la insuficiencia endocrina como manifestaciones propias de la enfermedad, mientras que nos referiremos a otras manifestaciones asociadas como complicaciones (tabla 2), teniendo en cuenta que esta diferenciación es artificial.
Manifestaciones clínicas de la pancreatitis crónica
| Dolor abdominal y brotes de pancreatitis aguda |
| Insuficiencia pancreática exocrina |
| Déficits nutricionales |
| Sarcopenia |
| Insuficiencia pancreática endocrina |
| Complicaciones |
| Estenosis de vía biliar |
| Estenosis del conducto pancreático y litiasis intraductal |
| Estenosis duodenal |
| Colecciones pancreáticas y peripancreáticas. Seudoquistes |
| Fístulas internas. Ascitis |
| Complicaciones vasculares: trombosis y hemorragia |
| Sobrecrecimiento bacteriano |
| Osteoporosis |
| Cáncer de páncreas |
| Litiasis renal por hiperoxaluria |
El dolor continuo o intermitente afecta a>75% de pacientes y ocasiona un importante impacto en su calidad de vida. El típico dolor es intenso, epigástrico, irradia a los flancos y se agrava con la ingesta. A veces se dirige hacia la espalda. Pueden aparecer vómitos, pero si son persistentes debemos sospechar obstrucción del vaciamiento gástrico.
El dolor intermitente es incluso más frecuente que el continuo, con largos periodos sin dolor. Muchas veces se acompaña de brotes de pancreatitis aguda, particularmente si existen factores genéticos, alcohol/tabaco, obstrucción ductal o pancreatitis del surco. La PCr es una de las causas más relevantes de pancreatitis aguda recurrente.
Otras causas de dolor relacionado con PCr son: obstrucción duodenal, seudoquistes complicados, úlceras pépticas, hemosuccus pancreaticus y cáncer de páncreas. La obstrucción de la vía biliar solo causa dolor si existe litiasis o colangitis aguda asociada.
En algunos pacientes el dolor abdominal no es un síntoma relevante o puede faltar por completo.
Insuficiencia exocrinaLos grados son variables y se correlacionan con la fase evolutiva de la enfermedad. Es más frecuente tras cirugía pancreática (pancreatectomías, necrosectomías)56. El espectro abarca desde déficits parciales de vitaminas o micronutrientes hasta esteatorrea franca con pérdida de peso57,58.
En casos leves los pacientes pueden permanecer asintomáticos o referir malestar abdominal, hinchazón o meteorismo. Con grados mayores de insuficiencia exocrina (IPEx) aparecen deposiciones blandas o diarrea, signos de malnutrición (hipocolesterolemia, hipoalbuminemia) y pérdida de peso que contrasta con apetito conservado. La esteatorrea suele presentarse en fases avanzadas, incluso con deposiciones aceitosas. En la IPEx avanzada los niveles séricos de enzimas pancreáticas suelen ser bajos o indosificables.
Déficits nutricionalesA la malnutrición contribuye la insuficiencia exocrina y endocrina, pero también una reducida ingesta (por alcoholismo o para evitar dolor abdominal) y un catabolismo acelerado (por inflamación crónica).
El déficit de vitamina D puede afectar al 40-66% de los pacientes. Se asocia a osteopenia (42%) y a osteoporosis (39%), a los que contribuye también el déficit de vitamina K. El 35% de los pacientes presenta déficit de vitamina A y el 18% de vitamina E. Los pacientes fumadores tienen mayor incidencia de déficits de vitamina D y E. Los déficits vitamínicos pueden conducir a osteoporosis, anemia, dermatitis, alteraciones de la coagulación y de la agudeza visual y neuropatía59–61.
Algunos pacientes tienen pruebas de función exocrina y parámetros nutricionales aceptables, pero déficits de elementos como ferritina, prealbúmina, calcio, magnesio, cinc, selenio, tiamina, vitaminas B6 y B12, ácido fólico, manganeso, cobre, sulfuro, riboflavina y colina.
SarcopeniaEs la pérdida de masa y función muscular. Se valora la fuerza muscular mediante un dinamómetro, y la masa muscular mediante pruebas de imagen (TC o RM) o impedancia biométrica.
Afecta hasta a un 20% de los pacientes, independiente del índice de masa corporal (IMC). Suele ser una consecuencia de IPEx62,63 que puede haber cursado de forma indolente y haber sido infratratada. Es predictor de complicaciones posquirúrgicas.
Insuficiencia endocrinaPuede ser la primera manifestación de la enfermedad y confundirse con otras formas más comunes de diabetes, pero tiene características particulares: los pacientes no suelen presentar obesidad, ni cumplen criterios diagnósticos de diabetes mellitus tipo 1 (autoinmunidad negativa). Aunque la insulinopenia es más característica, puede haber también resistencia insulínica.
Esta forma de diabetes se ha denominado pancreatopriva, pancreatogénica, diabetes del páncreas exocrino o diabetes mellitus tipo 3c57,64. Representa solo un 1-8% de todas las diabetes mellitus, pero casi el 80% de los pacientes con PCr la desarrollarán más pronto o más tarde. Es más frecuente en pancreatitis tropical.
El riesgo de diabetes aumenta con la duración de la enfermedad, el estadio evolutivo y tras pancreatectomías. La destrucción de islotes, inflamación, autoinmunidad, alteraciones genéticas y enolismo intervienen en su etiopatogenia.
Los déficits asociados de glucagón y polipéptido pancreático añaden dificultad al control de la glucemia, con lo que son frecuentes las hipoglucemias. Si además se añade algún grado de resistencia insulínica se entiende porqué el control terapéutico de estos pacientes es particularmente difícil.
ComplicacionesEs necesario recordar que los pacientes con PCr tienden a desarrollar complicaciones que pueden dominar el cuadro clínico (tabla 2), e incluso ser la forma de presentación de la enfermedad. La exposición de estas complicaciones será el objetivo de la parte 3 de esta serie.
DiagnósticoSCD-SCPanc 8.La sintomatología puede sugerir la presencia de pancreatitis crónica, pero el diagnóstico ha de establecerse con datos objetivos, indicando el grado de seguridad diagnóstica alcanzado y los medios empleados. Igual de importante es excluir la PCr de una forma razonada, o manifestar que no se dispone de suficiente evidencia para el diagnóstico.
SCD-SCPanc 9.Los datos objetivos necesarios para el diagnóstico se obtienen mediante pruebas radiológicas o endoscópicas de imagen, estudio histológico de tejido pancreático y pruebas de función exocrina y endocrina.
Las causas mas frecuentes de dolor abdominal o de diarrea crónica no son de origen pancreático. Además, el diagnóstico de PCr conlleva una carga asistencial notable: obliga a investigar la etiología y suprimir los factores asociados, atender complicaciones actuales o futuras, considerar la calidad de vida del paciente y anticipar el desarrollo de cáncer en grupos seleccionados.
La colangiopancreatografía retrógrada endoscópica ya no se utiliza para el diagnóstico de PCr, ya que ha sido reemplazada por técnicas de imagen con menor potencial iatrogénico. Sin embargo, su empleo propició el desarrollo de la clasificación de Cambridge, todavía en uso, que categoriza los hallazgos y los correlaciona con el estadio evolutivo de la enfermedad.
Técnicas radiológicas de imagen: tomografía computarizada, resonancia magnética y ecografíaSCD-SCPanc 10.Por razones estratégicas utilizamos la TC como técnica inicial de estudio, pero la RM es perfectamente válida. El protocolo debe incluir la administración de contraste endovenoso y adquisición de imágenes también en fase portal, aunque inicialmente se suele combinar un estudio simple y una fase arterial tardía. El protocolo de RM debe incluir, además del examen estándar con secuencias morfológicas para evaluar el parénquima, secuencias de colangiopancreatografía (CPRM) que permiten una evaluación detallada de la anatomía ductal.
Las técnicas de imagen tienen un valor relativo en las fases iniciales de la enfermedad. La TC y la RM (convencional o CPRM) son las más empleadas. Tienen una precisión diagnóstica elevada y comparable en la PCr bien establecida. Los hallazgos deberían informarse de forma estandarizada.
La ecografía abdominal es de gran valor en población pediátrica65–68.
La administración endovenosa de secretina (1ml/10kg de peso; CPRM-s), permite una mejor visualización del árbol ductal y estimación indirecta de la función exocrina, valorando el grado de excreción de jugo pancreático al duodeno68. Se ha sugerido que la ausencia de dilatación del conducto pancreático principal en respuesta a secretina sería un signo precoz de PCr que traduciría elasticidad deficiente por aumento de rigidez del conducto pancreático.
Signos de pancreatitis crónica establecida1. Signos parenquimatosos:
- -
Calcificaciones. Se detectan mejor por TC, pero algunas son radiotransparentes. La prevalencia es variable. Las calcificaciones no son específicas de PCr y pueden aparecer en ciertos tumores (neoplasia mucinosa papilar intraductal, tumores neuroendocrinos y cistoadenoma seroso) y calcificaciones vasculares (en pacientes ancianos) pueden confundirse con calcificaciones parenquimatosas. Si se presentan de forma difusa en el parénquima y en los ductos son más específicas de PCr.
- -
Atrofia pancreática. Es el hallazgo más frecuente (54%), pero es poco específico, pudiendo confundirse con cambios seniles.
- -
Intensidad de la señal. La disminución de señal del parénquima en secuencias potenciadas en T1 con saturación grasa es un signo precoz que puede preceder a los cambios ductales67.
La elastografía por RM, el mapeo T1 o multiparamétrico y la cuantificación del volumen extracelular son métodos cuantitativos que podrán tener utilidad en el diagnóstico precoz y en el estadiaje69.
- -
Realce de contraste. El patrón de realce y su cuantificación se correlaciona con el grado de fibrosis. Presenta una alta sensibilidad en fases precoces. En la PCr la captación de contraste es heterogénea, retrasada y disminuida en la fase arterial precoz y más persistente en la fase tardía70.
- -
Contorno glandular irregular.
2. Signos ductales:
La mejor técnica no invasiva es la RM71. Se describen varios tipos de hallazgos: dilatación/estenosis del conducto pancreático principal (que puede estar arrosariado) y dilatación de conductos laterales. También se pueden ver litiasis intraductales, seudoquistes o variantes anatómicas67. Reservamos la RM con secretina para casos en los que existe alta sospecha de PCr pero las pruebas de imagen convencionales (incluyendo la USE) no son concluyentes.
Se ha propuesto una modificación de la clasificación de Cambridge para diagnosticar y estadiar la PCr mediante TC y RM65,72. El hallazgo inicial más específico es la presencia de>3 conductos laterales dilatados, mejor si además el conducto principal aparece dilatado e irregular.
Ultrasonografía endoscópicaSCD-SCPanc 11.La ultrasonografía endoscópica detecta cambios muy precoces, pero los hallazgos se han de interpretar con cautela si otras pruebas de imagen o funcionales son normales.
SCD-SCPanc 12.Si hay<2 criterios el diagnóstico de PCr se considera improbable, mientras que si se detectan>5 es muy probable. Entre 3 y 4 criterios el diagnóstico es indeterminado.
La USE es muy sensible en la detección de anomalías en el páncreas. Sin embargo, la concordancia interobservador no es muy buena, y muchas anomalías carecen de especificidad al detectarse también en pacientes asintomáticos con variantes anatómicas, ancianos, obesos, diabéticos, fumadores, enólicos, en esteatosis pancreática y durante la recuperación de una pancreatitis aguda. Por ello hemos de ser prudentes al establecer un diagnóstico de PCr basado únicamente en USE.
La USE permite una buena visualización del parénquima y conductos pancreáticos. Se describen hasta 9 criterios ductales y parenquimatosos potencialmente anormales (tabla 3)73.
Ultrasonografía en el diagnóstico de pancreatitis crónica
| Elementos diagnósticos |
| A.Criterios ductales |
| Dilatación ducto principal |
| Ducto principal irregular-estenótico |
| Paredes ductales hiperecoicas |
| Visualización de conductos secundarios |
| Litiasis intraductal |
| B. Criterios parenquimatosos |
| Contorno lobular |
| Focos hiperecoicos |
| Bandas hiperecoicas |
| (Seudo) quistes |
| Clasificación de Rosemont |
| Se categorizan los hallazgos anteriores otorgando una importancia diferente a cada parámetro en el proceso diagnóstico de PCr |
| Criterios mayores |
| A: Focos hiperecogénicos con sombra acústica posterior>2mm |
| Litiasis en el conducto pancreático principal |
| B: Lobularidad del parénquima con patrón en panal de abeja (3 o más lóbulos contiguos) |
| Criterios menores |
| Quistes |
| Dilatación del conducto principal de más de 3,5mm (1,5mm en cola) |
| Conducto principal irregular |
| Dilatación de conductos secundarios (>3) de más de 1mm |
| Paredes del conducto principal hiperecoicas |
| Tractos fibrosos (>3mm al menos en 2 direcciones) |
| Focos hiperecogénicos sin sombra acústica posterior (>2mm) |
| Lobularidad del parénquima sin patrón en panal de abeja |
| Diagnóstico de PCr basado en criterios ultrasonográficosa |
| Criterios clásicos | Criterios japoneses | Criterios de Rosemont |
|---|---|---|
| Probabilidad alta | Definitivo | Compatible |
| 5-9 criterios | Múltiples calcificaciones en todo el parénquima | Uno mayor A +>3menores |
| Cálculos ductales | Uno mayor A +uno mayor B | |
| Cambios morfológicos ductalesb | 2 mayores A | |
| Precoz | Sugestivo | |
| 3 criterios USEc | Uno mayor A+<3menoresd | |
| Uno mayor B +>3menoresd | ||
| >5 menoresd | ||
| Indeterminado | Probable/posible | Indeterminado |
| 3-4 criterios | Signos sugestivos de litiasis-precipitados o dilatación de ductose | 3-4 menoresd |
| Uno mayor B+<3menoresd | ||
| <2menoresf | ||
| Normal | Normal | Normal |
| 0-2 criterios | 0 criterios USE | <3menores |
Dilatación irregular del conducto principal y dilatación irregular de conductos secundarios de variable intensidad distribuidos por todo el páncreas.
Focos hiperecoicos sin sombra, trama y lobularidad con o sin panal de abeja. Además, ha de tener más de 2 ítems de los siguientes: dolor abdominal recurrente, enzimas pancreáticas elevadas en sangre u orina, evidencia de insuficiencia pancreática exocrina, enolismo>80g/d.
El diagnóstico requiere confirmación con otras técnicas de imagen adicionales (CPRE, resonancia magnética, tomografía computarizada o test funcional pancreático).
Estudios que han comparado histopatología y USE no han encontrado una correlación perfecta: con más de 5 criterios existe alta correlación con la histología, pero el 50% de pacientes con menos de 2 criterios tienen cambios histológicos de PCr. Alteraciones sutiles detectadas en USE pueden desaparecer con el tiempo y no tener significancia.
Se ha intentado categorizar estos criterios dando más importancia a unos que a otros (criterios de Rosemont)75, en particular a las litiasis y a la lobularidad del parénquima, pero la precisión diagnóstica no ha mejorado.
La medición de la tensión relativa mediante elastografía con o sin medidas shear wave velocity ofrece datos objetivos, tiene una buena precisión diagnóstica (91%)76 y se correlaciona con el grado de fibrosis767.
HistologíaSCD-SCPanc 13.El examen histológico del páncreas debería ser una herramienta fundamental para el diagnóstico, pero su uso prequirúrgico es limitado por las dificultades en realizar biopsias y la naturaleza parcheada de las lesiones.
SCD-SCPanc 14.La función más requerida del patólogo en el estudio de una pancreatitis crónica es diferenciarla de una neoplasia maligna, especialmente de un adenocarcinoma ductal, e identificar una pancreatitis autoinmune.
SCD-SCPanc 15.No existe consenso entre anatomopatólogos para definir qué lesiones histológicas se requieren para establecer un diagnóstico de pancreatitis crónica. Muchos considerarían suficiente el hallazgo de fibrosis y atrofia acinar.
Nosotros apoyamos los criterios diagnósticos descritos en la tabla 4.
Criterios diagnósticos de pancreatitis crónica
| A. Pancreatitis crónica segura: cualquiera de las 2 condiciones |
| 1. Histología: fibrosis (intra y/o interlobular) y atrofia focal o difusa, con o sin infiltrado inflamatorio crónico, en ausencia de neoplasia |
| 2. Prueba de imagen con (cualquiera de los 3) |
| 2a: Calcificaciones de distribución difusa parenquimatosas o ductales |
| 2b: Dilatación irregular del conducto principal con estenosis y >3conductos secundarios dilatados (especialmente si hay lesiones típicas en el parénquima) |
| 2c: Más de 5 elementos en USE practicada tras>3 meses del último brote de pancreatitis |
| B. Pancreatitis crónica probable: cualquiera de las 3 condiciones |
| 1. Imágenes anormales |
| USE: 3-4 criterios |
| RM: 3 conductos secundarios anormales |
| TC/RM: (más de 2) conducto principal dilatado, páncreas aumentado-heterogéneo-irregular, pancreatitis focal, quistes |
| 2. Clínica sugestiva (incluyendo pancreatitis recurrente)+función anormal (exocrina o diabetes del páncreas exocrino) |
| 3. Más de 3 lesiones ductales y parenquimatosas combinadas de las siguientes (en ausencia de neoplasia): |
| Calcificaciones únicas o localizadas |
| Dilatación o estenosis aislada del conducto principal |
| Seudoquistes |
| Atrofia pancreática |
| Pancreatitis focal |
| Páncreas heterogéneo, irregular o aumentado, especialmente si hipointenso en RM |
| C. Pancreatitis crónica posible pero incierta (sin suficiente evidencia). Cualquiera de las 2 |
| 1. Imágenes poco específicas (USE<2; RM<3; TC<2) |
| 2. Dolor abdominal sin historia de pancreatitis aguda con imágenes normales, pero con factores de riesgo (tabaco, alcohol, mutaciones) o historia familiar |
| D. Pancreatitis crónica incipiente posible (o con cambios mínimos) |
| TC y RM sin anomalías típicas. USE con menos de 4 criterios y 2 o más de éstos hallazgos: |
| Elastasa fecal baja o bicarbonato en jugo pancreático<60mEq/l |
| Hipointensidad del páncreas en T1 (RM) |
| Diabetes del páncreas exocrino |
| Niveles anormales de enzimas pancreáticas en suero (altas o bajas) |
| Mutaciones patogénicas en CFTR, SPINK1 o PRSS1 |
| Dolor abdominal recurrente o pancreatitis aguda |
El porcentaje de pacientes asintomáticos no se conoce con precisión. En ausencia de dolor abdominal la combinación de cambios morfológicos sutiles (hipointensidad en T1), mutaciones patogénicas y elastasa baja puede tener valor diagnóstico.
RM: resonancia magnética; TC: tomografía computarizada; USE: ultrasonografía endoscópica.
La PCr se caracteriza por una afectación difusa o focal en forma de fibrosis, atrofia parenquimatosa, distorsión y dilatación ductal y variable infiltrado inflamatorio crónico67,78 con presencia de linfocitos, células plasmáticas y eosinófilos, y un componente agudo que incluye neutrófilos. Otros signos característicos son patrón lobular, seudoquistes, litiasis intraductales, haces neurales engrosados, agregación de islotes, engrosamiento y obliteración fibrosa de vasos sanguíneos y metaplasia escamosa del epitelio ductal.
La fibrosis puede ser perilobular o interlobular, e incluso intralobular. Los islotes suelen estar preservados.
Salvo en la pancreatitis autoinmune (por poseer criterios histológicos propios) y la pancreatitis del surco (ductos dilatados, quistes, microabscesos y fibrosis extendiéndose hacia la pared duodenal) las lesiones histológicas no pueden identificar la etiología de una PCr.
En general, el diagnóstico se establece bien con el examen de una pieza quirúrgica, pero el material es insuficiente cuando se obtiene mediante punción citológica, y subóptimo si se emplea una aguja de biopsia77. En caso de sospecha de pancreatitis autoinmune se requiere como mínimo una biopsia pancreática.
Cambios histológicos semejantes a PCr pueden identificarse en pacientes de edad avanzada, proximalmente a una obstrucción ductal, en la insuficiencia renal crónica y posiblemente en pacientes fumadores o diabéticos de larga evolución.
Función pancreática (exocrina y endocrina)SCD-SCPanc 16.En todo paciente con PCr debe evaluarse la función exocrina. Proponemos emplear la determinación de elastasa fecal como prueba de referencia.
SCD-SCPanc 17.Los pacientes deben seguir un programa de detección precoz de diabetes mediante determinación de glucemia y hemoglobina glucosilada al menos una vez al año.
SCD-SCPanc 18.Consideramos el diagnóstico de diabetes del páncreas exocrino cuando existe diabetes bien diagnosticada en ausencia de rasgos típicos de diabetes tipo 1 ni 2 y se asocia a insuficiencia exocrina y/o a pruebas de imagen pancreáticas patológicas.
Se han descrito numerosas pruebas para diagnosticar IPEx y graduar su severidad, pero muchas han sido abandonadas por invasivas y complejas79,80. En la actualidad se puede determinar:
- -
Amilasa pancreática, lipasa o tripsina en suero. Niveles bajos apoyan un diagnóstico de sospecha basado en sintomatología o en pruebas de imagen, con una especificidad próxima al 90%81,82. Niveles muy bajos de las 3 enzimas indica IPEx grave.
- -
Bicarbonato en el aspirado duodenal obtenido mediante endoscopia tras infusión de 0,2μg de secretina. Valores repetidos por debajo de 80mEq/l son diagnósticos de IPEx67. Algunos centros americanos han adoptado esta prueba como de referencia.
- -
Elastasa fecal. A pesar de sus limitaciones, nosotros proponemos actualmente utilizar la determinación de elastasa fecal como prueba de referencia. Es sencilla y permite determinaciones seriadas. Tiene una sensibilidad aproximada del 90-100% para insuficiencia grave y del 63% para moderada. Un valor<200mcg/g de heces se considera anormal, aunque presenta falsos positivos. Con un nivel de corte<100 la especificidad mejora, pero la sensibilidad empeora. Valores>500mcg/g excluyen IPEx. En caso de cirugía pancreática previa los niveles de elastasa fecal pueden no reflejar bien el grado de déficit funcional pancreático56.
- -
Coeficiente de absorción grasa. Es difícil de realizar: tras una dieta controlada (grasas 100g/día, 5 días) se recogen las deposiciones durante 72h y se determina la cantidad de grasa absorbida, que debe ser>93%. No hay diferencia entre causas de esteatorrea, no está disponible en muchos centros y la manipulación fecal es engorrosa. En caso de cirugía pancreática previa es la prueba que mejor puede reflejar una insuficiencia exocrina56.
- -
Test de aliento con triglicéridos mezclados. Pretende ser más sensible que la elastasa fecal y útil para optimizar el tratamiento con enzimas, pero los resultados se alteran si hay hepatopatía, dificultad de vaciamiento gástrico, broncopatía o sobrecrecimiento bacteriano, enfermedades asociadas frecuentemente a PCr.
El valor de la función exocrina en el diagnóstico de PCr se pone de relieve en un estudio de 2013, en el que valores normales de bicarbonato en el aspirado duodenal tras estimulación con secretina en pacientes con dolor abdominal tuvieron un valor predictivo negativo del 97% tras un seguimiento de 1-11 años83.
Probablemente la asociación de elastasa baja y niveles séricos bajos de enzimas tengan mayor precisión diagnóstica de IPEx primaria, pero faltan estudios que acrediten esta posibilidad.
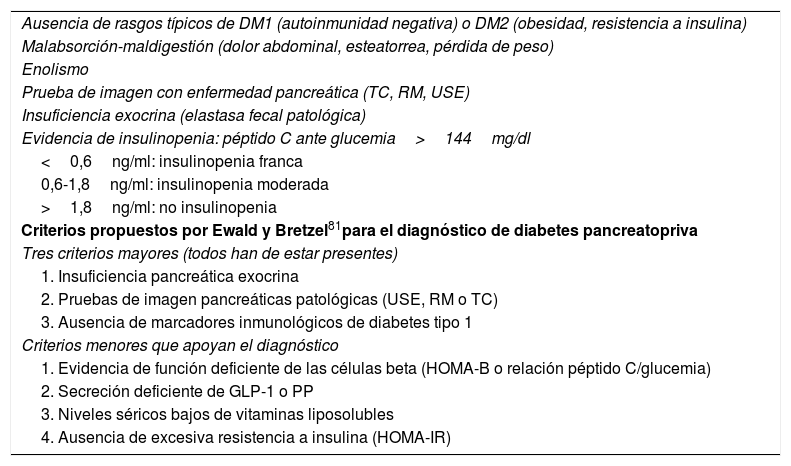
El diagnóstico de diabetes del páncreas exocrino se puede hacer en pacientes que cumplen estas condiciones: 1) diagnóstico de diabetes mellitus bien establecido; 2) enfermedad del páncreas exocrino; y 3) razonable evidencia de que la diabetes es secundaria a enfermedad pancreática. De estos 3 puntos el tercero es el más debatible. La presencia de insulinopenia (demostrada por niveles bajos de péptido C) es común y reafirma el diagnóstico, pero también puede existir resistencia insulínica favorecida por déficit de PP y por fenómenos inflamatorios intrapancreáticos. Los episodios de hipoglucemia son frecuentes por déficit asociado de glucagón.
No existen criterios diagnósticos estandarizados sobre «diabetes del páncreas exocrino», pero las condiciones detalladas en la tabla 5 hacen sospechar su presencia. Los criterios diagnósticos de Ewald y Bretzel84 no han sido validados.
Condiciones que sugieren diabetes del páncreas exocrino
| Ausencia de rasgos típicos de DM1 (autoinmunidad negativa) o DM2 (obesidad, resistencia a insulina) |
| Malabsorción-maldigestión (dolor abdominal, esteatorrea, pérdida de peso) |
| Enolismo |
| Prueba de imagen con enfermedad pancreática (TC, RM, USE) |
| Insuficiencia exocrina (elastasa fecal patológica) |
| Evidencia de insulinopenia: péptido C ante glucemia>144mg/dl |
| <0,6ng/ml: insulinopenia franca |
| 0,6-1,8ng/ml: insulinopenia moderada |
| >1,8ng/ml: no insulinopenia |
| Criterios propuestos por Ewald y Bretzel81para el diagnóstico de diabetes pancreatopriva |
| Tres criterios mayores (todos han de estar presentes) |
| 1. Insuficiencia pancreática exocrina |
| 2. Pruebas de imagen pancreáticas patológicas (USE, RM o TC) |
| 3. Ausencia de marcadores inmunológicos de diabetes tipo 1 |
| Criterios menores que apoyan el diagnóstico |
| 1. Evidencia de función deficiente de las células beta (HOMA-B o relación péptido C/glucemia) |
| 2. Secreción deficiente de GLP-1 o PP |
| 3. Niveles séricos bajos de vitaminas liposolubles |
| 4. Ausencia de excesiva resistencia a insulina (HOMA-IR) |
DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; HOMA: Homeostatic Model Assessment; PP: polipéptido pancreático; RM: resonancia magnética; TC: tomografía computarizada; USE: ultrasonografía endoscópica.
Para diferenciar la diabetes del páncreas exocrino de la diabetes juvenil tipo 1 (especialmente en gente joven) es útil comprobar la ausencia de marcadores inmunológicos, como anticuerpos anti-insulina, anti-GAD65, anti-IA-2 o antiislotes pancreáticos.
HOMA es acrónimo de Homeostatic Model Assessment, que en su forma lineal tiene 2 variantes: HOMA-IR (evalúa la resistencia a la insulina) y HOMA-B (evalúa la función de las células beta).
HOMA-IR: Insulina en ayunas (mUI/l)×glucemia en ayunas (mmol/l)/22,5
Insulina en ayunas (mUI/l)×glucemia en ayunas (mg/dl)/405
Normal<1,96. Sospecha de resistencia a la insulina si el valor se encuentra entre 1,96 y 3.
Resistencia a la insulina si los valores son>3.
HOMA-B: 20× Insulina en ayunas (mUI/l)/(glucemia en ayunas [mmol/l]/3,5)
360× Insulina en ayunas (mUI/l)/(glucemia en ayunas (mg/dl)/63).
Los valores normales dependen de la población estudiada. Valores por debajo del cuartil inferior de la población sana de referencia (75%) sugieren función deficiente de la célula beta.
Glucemia mmol/l=glucemia mg/dl×0,0555.
HOMA2 tiene en cuenta las ecuaciones anteriores y les da un valor no-lineal relativo a la población joven sana a la que se le asigna el 100%. Un calculador HOMA2 de la Universidad de Oxford se puede descargar de aquí:
https://www.dtu.ox.ac.uk/homacalculator/
Hay que tener en cuenta que los parámetros HOMA tan solo orientan hacia una resistencia a ka insulina y hacia la función de las células beta en condiciones basales, pero las células beta tienen un comportamiento dinámico que responde a estímulos. En presencia de una glucemia normal es difícil evaluar un déficit de insulina basal. Por otro lado, en pacientes que reciben insulina el HOMA-B es más correcto calcularlo con los valores de péptido C empleando el calculador de la Universidad de Oxford.
Una crítica adicional a los criterios de Ewald y Bretzel es que requieren de la presencia de insuficiencia exocrina (IPEx), pero la diabetes del páncreas exocrino puede aparecer en ausencia de IPEx demostrable.
Criterios diagnósticosSCD-SCPanc 19.El panel de especialistas del presente documento propone una adaptación combinada de los criterios diagnósticos de pancreatitis crónica de las sociedades americana y japonesa de páncreas. El objetivo final es establecer el diagnóstico con grados de fiabilidad y, en caso afirmativo, definir la funcionalidad exocrina y endocrina.
SCD-SCPanc 20.La PCr incipiente no tiene definición precisa ni criterios diagnósticos fiables en ausencia de datos histológicos. Sería una PCr con cambios radiológicos o ecográficos mínimos o ausentes.
El diagnóstico de PCr es sencillo en formas evolucionadas, pero difícil en los estadios iniciales. Se basa en la demostración de lesiones histológicas características, anomalías en pruebas de imagen y alteraciones funcionales. El diagnóstico preciso es muy importante por las implicaciones terapéuticas y pronósticas que conlleva. Por otro lado, poder excluir con ciertas garantías una PCr es esencial en el diagnóstico diferencial de un dolor abdominal, masa o quiste pancreático, diarrea crónica o diabetes.
Se han buscado elementos para establecer un diagnóstico de PCr estandarizado. Diversas sociedades utilizan criterios de variable fiabilidad. Nosotros proponemos los criterios detallados en la tabla 467,85 teniendo en cuenta las siguientes condiciones:
- 1.
Los criterios de PCr segura tienen validez en ausencia de neoplasia, y en su cumplimentación no interviene la sintomatología del paciente.
- 2.
Cuando se emplea USE pueden identificarse lesiones sugestivas de PCr durante los meses siguientes a una pancreatitis aguda, en personas de edad avanzada, en fumadores y en diabéticos.
- 3.
En la adquisición de imágenes se debe seguir protocolos específicos para páncreas.
- 4.
Para utilizar el parámetro de «función pancreática anormal» como elemento diagnóstico hemos de considerar que las cifras de elastasa fecal son válidas si se determinan al menos 4 meses después de una pancreatitis aguda, que la excreción máxima de bicarbonato<60mEq/l en el test de función pancreática endoscópica tiene una alta fiabilidad diagnóstica de IPEx, y que el diagnóstico de diabetes pancreatopriva ha de ser incuestionable.
- 5.
Los pacientes con criterios de «pancreatitis crónica sin suficiente evidencia» deben adherirse a un programa de seguimiento para rechazar o reconsiderar el diagnóstico.
Estos criterios nos ayudan a establecer un diagnóstico seguro o probable de PCr, o concluir que no existe suficiente evidencia para mantener un diagnóstico.
La PCr incipiente se discutirá mejor en la parte 3 de esta serie.
Valoración del dolor pancreáticoSCD-SCPanc 21.Es importante caracterizar el dolor en cada paciente y registrar su intensidad.
Se pueden emplear escalas unidimensionales (escala numérica del 1 al 10, escala analógica visual) y multidimensionales (escala de Izbicki, Inventario breve de dolor, Cuestionario de dolor de McGill)85. El dolor también se puede estudiar y cuantificar mediante otras pruebas que están restringidas a algunos centros o a estudios de investigación. El estudio sensorial cuantitativo (quantitative sensory testing) puede discriminar el componente de sensibilización central del dolor crónico pancreático y así orientar mejor el tratamiento86,87.
EstadiajeSCD-SCPanc 22.Proponemos categorizar la enfermedad según las recomendaciones de la American Pancreatic Association con mínimas modificaciones.
Para categorizar bien la PCr hemos de describir los factores causales sospechados, el estadio morfológico por pruebas de imagen (de I a IV) y el estadio funcional (de A a X) que se basa en los criterios de Cambridge (tabla 6).
Estadiaje de pancreatitis crónica
| Requiere especificar como activos o inactivos los factores etiológicos asociados (A), graduar la morfología pancreática mediante pruebas de imagen (B) y estimar el estadio funcional actual (C). |
| A. Factores etiológicos asociados activos/inactivos. |
| B. Estadiaje morfológico: equívoco, leve, moderado, extenso. |
| Equívoco (I) | Leve (II) | Moderado (III) | Extenso (IV) | |
|---|---|---|---|---|
| TC/RM | Uno de los siguientes:Wirsung dilatado (2-4mm)Páncreas algo aumentadoParénquima heterogéneoColecciones<10mmDuctos irregularesPancreatitis focalPared ductal realzadaContorno páncreas irregular | Hipointensidad difusa en T1o≥2parámetros de los descritos para PCr equívoca | Igual que leve | Igual que moderado +≥1 de:Colecciones>10mmPáncreas aumentadoCálculos intraductales o parenquimatosos difusosObstrucción ductalEstenosis o irregularidad marcada |
| USE(elementos 0-9) | 0-2 | 3-4 | 5 o más | |
| Morfologíaductal (mejor con RM con secretina) | <3 conductos laterales anormales | 3 o más conductos laterales anormales | >3conductos laterales anormales y Wirsung anormal | Cambios moderados +1 de los siguientes:ObstrucciónLitiasis intraductalMarcada irregularidad o dilatación de Wirsung |
| C. Estadio funcional. |
| A. Normal. |
| B. Disfunción secretora exocrina (test endoscópico de estimulación con secretina anormal). |
| C. Insuficiencia exocrina (elastasa fecal baja, tripsina sérica baja, esteatorrea). |
| D. Insuficiencia endocrina (glucemia en ayunas anormal, hemoglobina glicada anormal, sobrecarga de glucosa anormal). |
| E. C+D. |
| X. Desconocido. |
| Ejemplos de descripción de estadio: |
| Paciente fumador activo con pancreatitis crónica estadio IV E. |
| Paciente portador de mutación patogénica en CFTR con pancreatitis crónica leve sin deterioro funcional (estadio II A). |
| Paciente exenólico con pancreatitis crónica moderada e insuficiencia endocrina (estadio III D). |
No existen estudios prospectivos que hayan validado las diferentes clasificaciones publicadas sobre estadios evolutivos. Las de MANNHEIM, Büchler y de la American Pancreatic Association son las que podrían aportar mayor información descriptiva67,88,89. En cualquier caso, estadios evolutivos más altos no necesariamente han de comportar cuadros clínicos más graves, pero sí suelen asociarse a un mayor número de complicaciones acumuladas.
Parece existir una buena concordancia si se siguen los Criterios de Cambridge cuando se compara TC con RM90.
Idealmente deberíamos poder caracterizar a los pacientes según su grado de certeza diagnóstica, los factores etiológicos asociados identificados, su estadio morfológico y su capacidad funcional (en línea con las recomendaciones de la American Pancreatic Association). Por ejemplo, deberíamos poder concluir que un paciente fumador activo tiene una pancreatitis crónica segura estadio IVE (es decir, con insuficiencia exocrina y endocrina). O que otro paciente con una pancreatitis crónica probable es portador de la mutación N34S en SPINK1, con enolismo inactivo y sin deterioro funcional (estadio IIA).
Ni tan siquiera desde el punto de vista histológico existe un sistema de estadiaje universalmente aceptado. Se pueden categorizar las lesiones en leves, moderadas y graves, pero esta no es una metodología validada78.
Indicaciones para realizar un estudio genéticoSCD-SCPanc 23.Recomendamos hacer estudio genético a todos los pacientes con PCr:
- -
En edad pediátrica.
- -
Con inicio de la enfermedad<35 años.
- -
Con familiares de primer o segundo grado con enfermedad pancreática (pancreatitis-diabetes-cáncer).
Sería aceptable en pacientes:
- -
Con pancreatitis aguda recurrente o crónica de origen incierto.
- -
Con síntomas característicos de fibrosis quística (bronquiectasias, infertilidad y hepatopatía).
- -
En familiares directos de pacientes con PCr portadores de mutaciones patogénicas.
En el resto de grupos la realización de estudios genéticos dependerá del criterio médico, de la disponibilidad de recursos y de la aceptación del paciente.
Estos estudios deben acompañarse de consejo familiar en pacientes afectos.
Diagnóstico diferencialSCD-SCPanc 24.Ha de plantearse el diagnóstico diferencial con dolor abdominal, diarrea crónica, malnutrición, dilatación de Wirsung, formaciones quísticas o insuficiencia pancreática exocrina de otra etiología, con hiperamilasemia idiopática y con cáncer de páncreas.
Hay que tener especial cuidado cuando coincidan algunas de las situaciones, como por ejemplo dolor abdominal de causa no aclarada con quistes pancreáticos o con hiperamilasemia idiopática.
Algunos diagnósticos diferenciales merecen un comentario aparte:
Pancreatitis crónica versus otras causas de insuficiencia pancreática exocrinaSCD-SCPanc 25.La PCr es la principal causa de IPEx en adultos. Otras causas frecuentes son neoplasias de páncreas, cualquier obstrucción del conducto pancreático, resecciones previas y fibrosis quística. (tabla 7)
Causas de insuficiencia pancreática exocrina
| Causas primarias |
| Pancreatitis crónica, todos los tipos, incluyendo pancreatitis autoinmune |
| Fibrosis quística |
| Cáncer de páncreas |
| Pancreatitis aguda (generalmente de forma temporal) |
| Obstrucción ductal (incluidos ampuloma, cáncer de páncreas, quistes y NMPI) |
| Pancreatectomía (más frecuente en la cefálica que en la distal) |
| Atrofia pancreática: senil, adquirida (malnutrición severa persistente, tabaquismo) o congénita (síndromes de Shwachman-Diamond, Johanson-Blizzar y Pearson, lipomatosis pancreática, déficit congénito de tripsinógeno, enteroquinasa, amilasa o lipasa, agenesia páncreas dorsal, algunos MODY como los secundarios a mutaciones en Pdx1, Hnf1b o carboxilester lipasa) |
| Hemocromatosis |
| Causas secundarias |
| Enfermedad celíaca y otras enteropatías (enfermedad de Crohn, immunodeficiencia común variable con afectación intestinal, enteritis eosinofílica, etc.) |
| Gastrectomía-derivación pancreática. Cirugía bariátrica |
| Síndrome de Zollinger-Ellison (gastrinoma) |
| Fármacos (octeótrido en tratamiento crónico). Somatostatinoma |
| De origen incierto (posiblemente multifactorial) |
| Diabetes mellitus tipo 1 y 2 (pancreatopatía exocrina diabética) |
| Síndrome de Sjögren |
| Síndrome de intestino irritable |
| Insuficiencia renal crónica |
| Infección por VIH |
MODY: Maturity-Onset Diabetes of the Young; NMPI: neoplasia mucinosa papilar intraductal; VIH: virus de la inmunodeficiencia humana.
También aparece tras gastrectomías y resecciones de intestino delgado por déficit de la secreción de secretina y colecistoquinina y por asincronía poscibal. Se ha descrito en el 12-50% de pacientes diabéticos de larga evolución sin signos de pancreatitis crónica. Algunos pacientes ancianos desarrollan atrofia pancreática marcada o degeneración grasa sin otros signos de PCr.
SCD-SCPanc 26.En la fase posterior a una pancreatitis aguda edematosa (12%) o necrotizante (90%) existe IPEx transitoria que se correlaciona con el grado de necrosis y puede ser permanente en casos graves.
Además, una pancreatitis necrotizante extensa puede abocar a IPEx permanente sin que exista una PCr de base91.
Pancreatitis recurrente versus pancreatitis crónicaSCD-SCPanc 27.Después de repetidos brotes de pancreatitis aguda, y dependiendo de la gravedad de los episodios, pueden quedar cambios cicatriciales parenquimatosos o ductales permanentes sin que se pueda considerar todavía una forma de PCr. Por otro lado, un 10-30% de pacientes con pancreatitis aguda desarrollará PAR.
La PAR representa un problema clínico muy relevante92. La PCr puede manifestarse inicialmente con episodios de pancreatitis aguda2. El subgrupo de pacientes con PAR que progresará a pancreatitis crónica es del 13-36%, siendo el consumo de alcohol y tabaco factores de riesgo1,2,18. La PAR también es característica en pacientes con mutaciones patogénicas en CFTR, PRSS1, SPINK1 y CTRC, que llegan a estar presentes hasta en el 58% de niños con PAR93.
Se han de practicar pruebas de imagen para detectar cambios morfológicos que a veces son solo evidentes en la evolución. En casos de PAR la USE es superior a la RM para identificar enfermedad biliar, lesiones periampulares o PCr94, pero hay que tener cuidado en no sobrediagnosticar PCr.
Seudoquiste o dilatación de Wirsung versus neoplasia quísticaSCD-SCPanc 28.La neoplasia mucinosa papilar intraductal (NMPI) y la PCr tienen patrones clínicos y morfológicos superponibles y en ocasiones coexisten. El desarrollo de NMPI en un páncreas con PCr no es infrecuente.
SCD-SCPanc 29.La identificación mediante pancreatoscopia de formaciones papilares en el conducto principal confirma NMPI. La comprobación de mutaciones activadoras (R201H y R201C) en el oncogen GNAS confirma la existencia de NMPI con una especificidad del 100% y sensibilidad del 40-60%.
La NMPI de conducto principal, secundario o mixto ocasiona cambios morfológicos superponibles (dilatación de Wirsung y de conductos secundarios) o consistentes (atrofia glandular, calcificaciones) de pancreatitis crónica. Cuando además esta neoplasia cursa con episodios de PAR el diagnóstico diferencial con una pancreatitis crónica de otra etiología es muy difícil. Por otro lado, NMPI de conducto secundario y el cistoadenoma mucinoso también pueden ocasionar PAR y ello puede hacer pensar que se trate de seudoquistes.
La presencia de uno o múltiples quistes pancreáticos y/o de dilatación del conducto principal, en ocasiones con calcificaciones intraductales o parenquimatosas, puede ser indistinguible de PCr. Además, lesiones parenquimatosas de PCr por USE, evidencia de IPEx y niveles séricos bajos de enzimas (signos característicos de PCr) se ven asociados a NMPI malignizada. El diagnóstico diferencial se apoya en las pruebas de imagen (TC, RM, USE y pancreatoscopia)94 y en el análisis del líquido pancreático obtenido mediante punción guiada por USE o mediante canulación de la papila. Apoyan el diagnóstico de NMPI el hallazgo de mucina, de células epiteliales mucinosas y cifras de CEA superiores a 192ng/ml. En estos casos es de gran valor la determinación de mutaciones en los genes GNAS (100% específicas de neoplasias mucinosas) y KRAS (altamente específicas de neoplasias mucinosas, aunque también podrían estar presentes en la pancreatitis crónica).
La detección de comunicación ductal del quiste, o que la dilatación del conducto principal sea homogénea sin estenosis sugiere NMPI, pero no excluye la coexistencia de PCr.
Actualmente las 2 aproximaciones con mejor especificidad diagnóstica son la pancreatoscopia y el análisis de GNAS en líquido pancreático95,96.
Masa inflamatoria versus cáncer de páncreasSCD-SCPanc 30.La pancreatitis del surco, la PAI y cualquier masa inflamatoria asociada a PCr han de diferenciarse del cáncer de páncreas.
La PCr por sí misma comporta un riesgo más elevado de cáncer de páncreas. Hemos de emplear una batería combinada de pruebas de imagen y apoyarnos en la obtención de muestras para estudio histológico cuando sea posible. La USE con punción o biopsia puede ayudar al diagnóstico si es claramente positiva, pero las biopsias negativas han interpretarse con cuidado. Si persisten dudas diagnósticas hemos de repetir pruebas de imagen o, incluso, considerar laparotomía diagnóstica.
El cáncer de páncreas tiende a ser hipodenso e hipovascular, y suele acompañarse de atrofia pancreática proximal. Puede detectarse un signo de doble conducto (dilatación de colédoco y Wirsung con colapso a nivel de la masa). La invasión vascular, de tejidos de vecindad o las metástasis son patognomónicas.
Se ha sugerido que la dilatación de Wirsung>11,5mm y del colédoco>14,5mm es un marcador de cáncer en pacientes con PCr97. El signo del conducto penetrante aparece en el 85% de las masas inflamatorias y tan solo en el 4% de las neoplásicas98.
Otros signos que ayudan al diagnóstico diferencial (pero ninguno es patognomónico) son: aspecto de las estenosis, morfología de la masa incluyendo el desplazamiento de calcificaciones, compromiso vascular, coeficiente de difusión aparente (ADC) en la RM, parámetro MM en la DWI en RM, captación de FDG en PET/TAC y parámetros de perfusión99.
La TC con multidetectores puede discriminar entre PCr y cáncer con una sensibilidad del 89% y una especificidad del 70%100 frente al 96% y 91% de modalidades de USE con contraste (CEHMI-EUS).
Las características que sugieren masa benigna mediante USE incluyen patrón homogéneo con tabiques hiperecoicos, calcificaciones, quistes, aspecto multilobular y señales Doppler positivas. El cáncer se sugiere por masa hipoecoica, hipoecogeneidad periductal y desplazamiento de calcificaciones101. La sensibilidad y especificidad de la USE aislada para diferenciar cáncer de PCr es solo del 64% y 75% respectivamente.
La citología, la elastografía y el contraste son de utilidad102. El rendimiento diagnóstico de citología o biopsia guiada por EUS en masas pancreáticas varía del 80% al 95%103, pero en presencia de PCr disminuye al 50-75%104.
Es especialmente difícil diferenciar PAI de cáncer105,106. La precisión puede aumentar al 90% con>7 punciones, usando una aguja más grande y evaluación in situ por un citopatólogo experto107.
La elastografía por EUS puede diferenciar masas benignas de malignas con una sensibilidad del 88-93% y especificidad del 66-83%. Usando EUS con contraste vemos el cáncer hipovascular con captación retrasada y disminuida en comparación a una masa inflamatoria. Consigue sensibilidades y especificidades próximas al 95%.
El CA 19.9 es el único marcador sérico empleado actualmente en clínica. Tiene una sensibilidad del 77% y una especificidad del 86%, pero la sensibilidad baja a<50% en neoplasias pequeñas y arrastra un 23% de falsos positivos.
Pancreatitis crónica versus cirrosis hepáticaSCD-SCPanc 31.El diagnóstico diferencial es importante porque la ascitis de origen pancreático no suele responder a diuréticos ni a paracentesis repetidas (de un líquido hiperproteico) que solo conseguirá aumentar la hipoproteinemia y acelerar un curso desfavorable.
Fácilmente los pacientes con PCr y ascitis son diagnosticados de cirrosis hepática porque pueden tener un hábito enólico con esteatosis e hipertransaminemia, ser portadores de varices esofágicas (secundarias a trombosis esplénica o portal), esplenomegalia, hipoalbuminemia y un tiempo de protrombina alargado (por desnutrición). Además, muchos pacientes tienen hepatopatía crónica conocida. Como la ascitis pancreática tiene leucocitos elevados, a menudo estos pacientes son diagnosticados de peritonitis bacteriana espontánea.
Clásicamente la ascitis pancreática presenta elevada concentración de amilasa y proteínas. También es útil detectar un gradiente de albúmina sérica/ascitis<1,1, o un cociente albúmina ascitis/albúmina sérica>0,59.
En pacientes con PCr evolucionada y marcada atrofia pancreática la amilasa en el líquido ascítico puede ser baja. En caso de coexistir hepatopatía y si se plantean dudas diagnósticas conviene realizar una hemodinámica hepática, porque si el gradiente de presión portal es<10mmHg es improbable que la ascitis sea de origen hepático.
Conflicto de interesesXavier Molero es consultor para Amadix Advanced Marker Discovery S.L. (Acera de Recoletos 2, 1B, 47004 Valladolid) en el proyecto de investigación sobre cáncer de AMD-CPA-2016-01.
Xavier Molero es beneficiario de una beca de investigación fundamental sobre fibrosis quística en ratones por parte de Vertex Pharmaceutical Inc., 50 Northern Avenue, Boston, MA 02210, EE. UU.
Ningún otro autor declara ningún tipo de conflicto de intereses.