El déficit de hierro sin anemia asociada (DHSA) es un hallazgo frecuente en los pacientes no ingresados con enfermedad inflamatoria intestinal (EII), incluso en mayor proporción que la anemia. Sin embargo, no existen datos concluyentes de su presencia en nuestro medio ni del posible deterioro que conlleva en la calidad de vida relacionada con la salud (CVRS). Los objetivos de este trabajo fueron: establecer la prevalencia del DHSA, identificar posibles factores asociados y medir su impacto en la CVRS.
Material y métodosSe incluyeron 127 pacientes con EII, de manera consecutiva, en medio extrahospitalario en un estudio observacional, descriptivo, de corte transversal. Se definió DHSA como niveles de ferritina ≤30 ng/ml en ausencia de actividad inflamatoria o <100 ng/ml en su presencia, con índice de saturación de transferrina ≤16%, junto a niveles normales de hemoglobina. Se evaluó la CVRS mediante dos cuestionarios: CVEII-9 para los síntomas relacionados con EII, y FACIT-F para medir la presencia de fatiga, considerándola extrema ante una puntuación ≤ 30 puntos.
ResultadosLa prevalencia del DHSA fue del 37%. El sexo femenino (OR=2,9; p=0,015) y la presencia de actividad inflamatoria (OR=9,4; p=0,001) fueron las variables asociadas con su aparición. Los pacientes con DHSA presentaron cuestionarios de CVRS con menores puntuaciones de forma global; registrando una caída de 6,6 (p<0,001) y 4,3 (p=0,037) puntos en CVEII-9 y FACIT-F, respectivamente. Además, se observó un incremento en la presencia de fatiga extrema del 29,4%.
ConclusiónLa prevalencia de DHSA es considerable en los pacientes con EII en el ámbito extrahospitalario. Se asocia al sexo femenino y a la actividad inflamatoria, y supone un claro impacto negativo en la CVRS. Es necesaria una actitud más activa para el tratamiento de esta complicación.
Iron deficiency without anaemia (IDWA) is commonly found in outpatients with inflammatory bowel disease (IBD) in an even higher proportion than anaemia. However, its true prevalence and possible impact on health-related quality of life (HRQoL) are unknown. The objectives of this study were: to establish the prevalence of IDWA, identify possible associated factors and measure their impact on HRQoL.
Material and methods127 patients with IBD in an outpatient setting were consecutively included in an observational, descriptive, cross-sectional study. IDWA was defined as ferritin levels of <100 ng/ml with inflammatory activity or ≤30 ng/ml without it, with transferrin saturation of ≤16%, and with normal haemoglobin levels. HRQoL was assessed using two questionnaires: the IBDQ-9 for symptoms related to IBD and the FACIT-F to measure the presence of fatigue. Fatigue was considered extreme with a score of ≤30 points.
ResultsThe prevalence of IDWA was 37%. Variables associated with its occurrence were female gender (OR=2.9; p=.015) and the presence of inflammatory activity (OR=9.4; p=.001). Patients with IDWA presented HRQoL questionnaires with lower overall scores; decreases of 6.6 (p<.001) and 4.3 (p=.037) points in the IBDQ-9 and the FACIT-F were recorded, respectively. In addition, an increase of 29.4% in the presence of extreme fatigue was observed.
ConclusionThe prevalence of IDWA is considerable in outpatients with IBD. IDWA is associated with female gender and inflammatory activity. It has a clear negative impact on HRQoL. A more active approach is needed to treat this complication.
La anemia es la manifestación extraintestinal más frecuente en la enfermedad inflamatoria intestinal (EII)1–3, con síntomas propios como astenia o fatiga crónica que alteran la funcionalidad de los pacientes. Su manejo ha tomado una importante relevancia en la última década, desarrollándose guías clínicas específicas4–6.
Se denomina déficit de hierro sin anemia (DHSA) a aquella situación en la que existen depósitos de hierro insuficientes, atendiendo a los niveles bajos de ferritina e índice de saturación de transferrina (IST), con niveles de hemoglobina (Hb) normales. Pocos estudios analizan la importancia de su presencia en la EII, centrándose únicamente en el ámbito de la anemia. El intervalo de prevalencia de DHSA en las series publicadas oscila entre un mínimo del 36% hasta un máximo del 90%7–10.
La calidad de vida relacionada con la salud (CVRS), es un concepto en el que intervienen aspectos relacionados con la esfera física, psicológica y la percepción subjetiva del estado de salud11. En la EII su medición es indispensable ya que refleja un importante aspecto de la realidad de los pacientes. Pese a ello, su cuantificación no resulta sencilla, por lo que se han desarrollado cuestionarios específicos. Entre ellos se encuentra el FACIT-F12, que mide el grado de fatiga, y el CVEII-9, para la afectación propia de los síntomas relacionados con la EII13.
La fatiga se define como la percepción subjetiva de cansancio que conlleva a un estado de empeoramiento del funcionamiento mental y físico. Aunque es referida de forma frecuente en los pacientes con EII, la prevalencia real no está bien establecida en nuestro medio. Varios estudios han tratado de establecer las claves para su detección, estimar su prevalencia y los factores asociados14. La mayoría solo analizan el espectro de pacientes con anemia, donde es conocida la relación directa con el detrimento en la CVRS. Sin embargo, se desconoce si el DHSA tiene un papel relevante. Aunque un estudio reciente15 confirma su relación, la evidencia es escasa con resultados contradictorios, dispares o incompletos16,17. No hay datos suficientes para establecer una indicación de tratamiento activo en el DHSA, aunque podría tratarse de un objetivo terapéutico con el que se consiga una mejora en la CVRS.
Para tratar de aportar información sobre este aspecto concreto, se plantea este estudio. Como objetivo principal se estableció determinar la prevalencia del DHSA en pacientes con diagnóstico de EII en el ámbito extrahospitalario. Como objetivos secundarios: identificar los factores asociados, así como el impacto en la CVRS percibida por el paciente. Por último, se revisó el manejo terapéutico ante su detección por el médico responsable.
Material y métodosPacientesSe trata de un estudio observacional, descriptivo, de corte transversal. Se reclutó, de manera consecutiva, una muestra de 127 pacientes diagnosticados de EII, atendiendo a los criterios diagnósticos internacionales18,19, en seguimiento ambulatorio en la Unidad de Enfermedad Inflamatoria Intestinal del Hospital Reina Sofía de Córdoba (España), en el periodo transcurrido de abril a junio de 2015. Se incluyeron pacientes mayores de edad, que tras ser informados, otorgaron su consentimiento. Se excluyeron pacientes con edad <18 años o superior a 70 años, así como aquellos con alguna de las siguientes situaciones clínicas: embarazo, enfermedad neoplásica o hematológica, insuficiencia renal crónica o anemia hemolítica. Se respetaron las normas de buena práctica clínica establecidas en la Declaración de Helsinki20.
Los pacientes se realizaron una analítica previa que incluía hemograma, metabolismo del hierro completo, niveles de vitamina B12 y ácido fólico, para evaluar la existencia y posibles causas de anemia/ferropenia; y como reactante de fase aguda proteína C reactiva (PCR), para detectar la presencia de actividad inflamatoria. En el momento de la entrevista personal médico-paciente se registraron en la historia clínica digital los síntomas y signos, haciendo hincapié en los propios de la EII. Se entregaron 2 cuestionarios: FACIT-F12 para valorar la fatiga y el CVEII-913 para la calidad de vida relacionada con la propia EII, rellenados bajo supervisión de personal de enfermería. Por último, se anotó la actitud terapéutica tomada por el médico responsable en relación con la anemia o situación de ferropenia.
Actividad inflamatoriaSe definió como clínica compatible la presencia de síntomas relacionados con brote de EII (aumento del número de deposiciones, dolor abdominal…), y/o evidencia de lesiones endoscópicas y/o radiológicas en los 3 meses previos a la revisión del paciente en consulta junto con alteración analítica (PCR >5mg/dl).
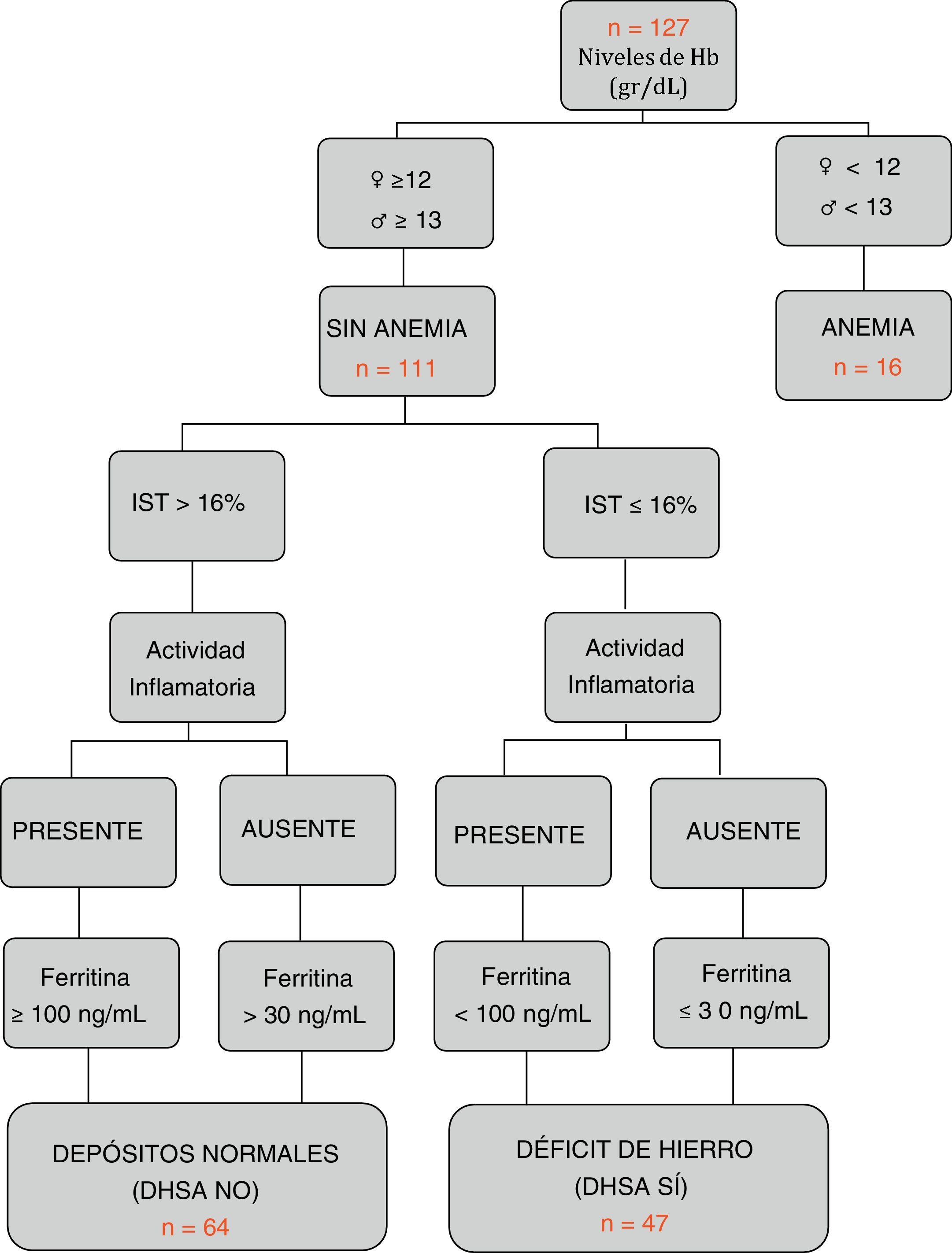
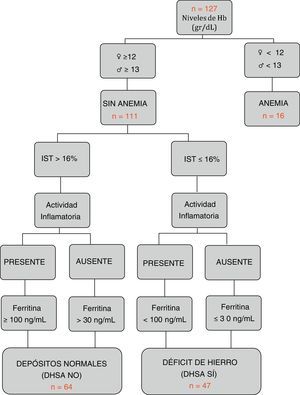
Definición de los diferentes grupos en relación con el metabolismo del hierroSegún los criterios internacionales de la OMS21, se clasificó como anemia si existían cifras de Hb < 12 g/dL en mujeres y < 13 g/dL en hombres. Según los criterios del último consenso europeo6, se definió DHSA aquella situación en la que los niveles de ferritina eran inferiores o igual a 30 ng/l en ausencia de actividad inflamatoria, o <100 ng/dL en su presencia, con niveles de hemoglobina normales y un IST <16% (fig. 1). Además, se registró la toma de hierro oral o intravenoso en los últimos 6 meses (excluyendo los pacientes con tratamiento activo).
Evaluación de la calidad de vida relacionada con la saludPara analizar el impacto subjetivo de la posible aparición de fatiga en los pacientes del estudio, se utilizó la versión en castellano del cuestionario FACIT-F12, validado internacionalmente y estandarizado. Este cuestionario consta de 13 ítems, medidos en una escala Likert, con una puntuación final de 0 a 52 puntos, inversamente proporcional al nivel de fatiga. Se consideró como fatiga extrema una puntación inferior o igual a 30 puntos. Para evaluar la calidad de vida relacionada con los síntomas propios de EII se utilizó la versión abreviada del Inflammatory Bowel Disease Questionnarie (IBDQ) en su versión en castellano (CVEII-9)13. Este cuestionario consta de 9 preguntas con respuestas graduadas siguiendo una escala de 7 puntos en la que 7 representa la mejor función y uno la peor, con un rango posible de 9 a 63 puntos. La puntuación directa se obtiene sumando la puntuación de cada uno de los ítems que lo constituye, y se transforma mediante una tabla específica para obtener una puntuación final entre 0 y 100 puntos, de forma que a menor puntuación menor calidad de vida y viceversa.
Análisis estadístico y cálculo del tamaño muestralSe utilizó la versión 20.0 para MAC del programa IBM SPSS® (IBM Corporation). Se realizó un primer análisis descriptivo donde las variables cualitativas se midieron mediante porcentajes para expresar las proporciones y frecuencias observadas. En las variables cuantitativas se calcularon la media aritmética y desviación estándar para aquellas que seguían una distribución normal, y mediana y rango intercuartílico para las que no. A continuación, se realizó un análisis comparativo entre los 2 grupos de pacientes sin anemia según presentaran (grupo DHSA) o no déficit de hierro (grupo NO DHSA). Se realizó un primer análisis univariante utilizando los test específicos para cada variable (t-Student para variables cuantitativas, Chi-cuadrado para variables cualitativas), considerando un nivel de significación aquel con p <0,05. Finalmente, se llevó a cabo un análisis multivariante para identificar qué variables se asocian a una mayor prevalencia de DHSA usando un modelo asociativo mediante regresión logística múltiple, controlando las posibles interacciones y factores de confusión. Para el cálculo del tamaño muestral se utilizó el programa EPIDAT22 tomando como población de referencia la cifra de 1.500 pacientes. Considerando una prevalencia esperada del 75%, con un intervalo de confianza al 95%, se calculó una muestra mínima necesaria de 118 pacientes.
ResultadosCaracterísticas generalesSe incluyeron un total de 127 pacientes. El sexo masculino fue predominante (58,3%). La edad media se estableció en 42,3 ± 12,1 años. El tipo de EII más frecuente fue la enfermedad de Crohn (61,4%) con 78 pacientes, predominantemente de localización ileocólica (47,4%) y de patrón inflamatorio (B1) (64,1%). El resto presentaban colitis ulcerosa (CU), siendo la afectación extensa la más frecuente (46,9%). La actividad inflamatoria estaba presente en el 21,3% en el momento de la revisión ambulatoria. Solo el 10,2% de los pacientes habían requerido ingreso hospitalario en los 3 meses previos relacionado con la EII.
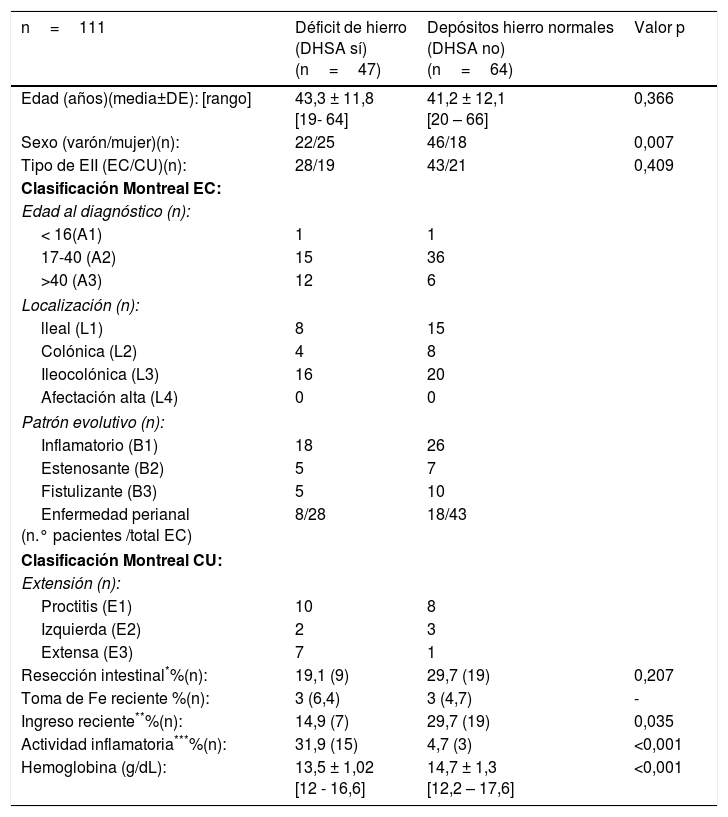
Características según grupos por hemograma y metabolismo férricoSolo 16 de los 127 pacientes (12,6%) presentaban cifras de anemia en el momento del estudio. La causa ferropénica fue la principal (10 de los 16 pacientes). Los pacientes sin anemia (n=111) se clasificaron según el algoritmo adjunto en figura 1: ferropénicos o grupo DHSA (n=47), y con depósitos normales o grupo NO DHSA (n=64). Se estableció una prevalencia global del DHSA del 37%. En la comparación entre grupos no se encontraron diferencias en la distribución por edad, tipo de EII, localización o patrón evolutivo. Sin embargo, el grupo DHSA presentó niveles de Hb inferiores (13,5g/dl vs. 14,7g/dl; p<0,001), mayor porcentaje de mujeres (53,2 vs. 28,1, p<0,007) y de actividad inflamatoria presente (31,9 vs. 4,7%, p<0,001), así como una menor tasa de ingreso hospitalario reciente (14,9 vs. 29,7%, p=0,007). El resto de variables comparadas se muestran en la tabla 1.
Características de los pacientes sin anemia, clasificados por grupos según presenten o no déficit de hierro (análisis univariante: comparación de medias y proporciones)
| n=111 | Déficit de hierro (DHSA sí) (n=47) | Depósitos hierro normales (DHSA no) (n=64) | Valor p |
|---|---|---|---|
| Edad (años)(media±DE): [rango] | 43,3 ± 11,8 [19- 64] | 41,2 ± 12,1 [20 – 66] | 0,366 |
| Sexo (varón/mujer)(n): | 22/25 | 46/18 | 0,007 |
| Tipo de EII (EC/CU)(n): | 28/19 | 43/21 | 0,409 |
| Clasificación Montreal EC: | |||
| Edad al diagnóstico (n): | |||
| < 16(A1) | 1 | 1 | |
| 17-40 (A2) | 15 | 36 | |
| >40 (A3) | 12 | 6 | |
| Localización (n): | |||
| lleal (L1) | 8 | 15 | |
| Colónica (L2) | 4 | 8 | |
| Ileocolónica (L3) | 16 | 20 | |
| Afectación alta (L4) | 0 | 0 | |
| Patrón evolutivo (n): | |||
| Inflamatorio (B1) | 18 | 26 | |
| Estenosante (B2) | 5 | 7 | |
| Fistulizante (B3) | 5 | 10 | |
| Enfermedad perianal (n.° pacientes /total EC) | 8/28 | 18/43 | |
| Clasificación Montreal CU: | |||
| Extensión (n): | |||
| Proctitis (E1) | 10 | 8 | |
| Izquierda (E2) | 2 | 3 | |
| Extensa (E3) | 7 | 1 | |
| Resección intestinal*%(n): | 19,1 (9) | 29,7 (19) | 0,207 |
| Toma de Fe reciente %(n): | 3 (6,4) | 3 (4,7) | - |
| Ingreso reciente**%(n): | 14,9 (7) | 29,7 (19) | 0,035 |
| Actividad inflamatoria***%(n): | 31,9 (15) | 4,7 (3) | <0,001 |
| Hemoglobina (g/dL): | 13,5 ± 1,02 [12 - 16,6] | 14,7 ± 1,3 [12,2 – 17,6] | <0,001 |
Prueba t-Student para comparación de medias y Chi cuadrado para comparación de proporciones (test de Fisher para n < 10).
*Historia de resección intestinal por actividad o complicaciones relacionadas con la EII.
**Necesidad de ingreso hospitalario en los 3 meses previos.
***Actividad inflamatoria clínico-analítica considerada como PCR >5mg/dl ± actividad radiológica o endoscópica en los 3 meses previos.
DE: desviación estándar; DHSA: déficit de hierro sin anemia; EC: enfermedad de Crohn; CU: colitis ulcerosa.
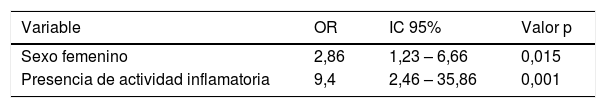
En el análisis multivariante, los factores asociados a la aparición de DHSA fueron sexo femenino con un OR=2,9 (1,2 – 6,7; IC 95%) (p=0,015) y la presencia de actividad inflamatoria (frente a la ausencia) con un OR=9,4 (2,5 – 35,9; IC 95%) (p=0,001). El ingreso hospitalario reciente mostró un OR=4,7 (0,9 – 26,5; IC 95%) sin lograr la significación estadística (p=0,07) (tabla 2).
Variables relacionadas con la presencia del DHSA (análisis multivariante)
| Variable | OR | IC 95% | Valor p |
|---|---|---|---|
| Sexo femenino | 2,86 | 1,23 – 6,66 | 0,015 |
| Presencia de actividad inflamatoria | 9,4 | 2,46 – 35,86 | 0,001 |
DHSA: déficit de hierro sin anemia.
Análisis multivariante según modelo de regresión logística múltiple.
Test de la razón de verosimilitud=21,387; p <0,001; GL=2.
Bondad de ajuste (R2 de Nagelkerke=0,236). Área bajo curva ROC=0,720.
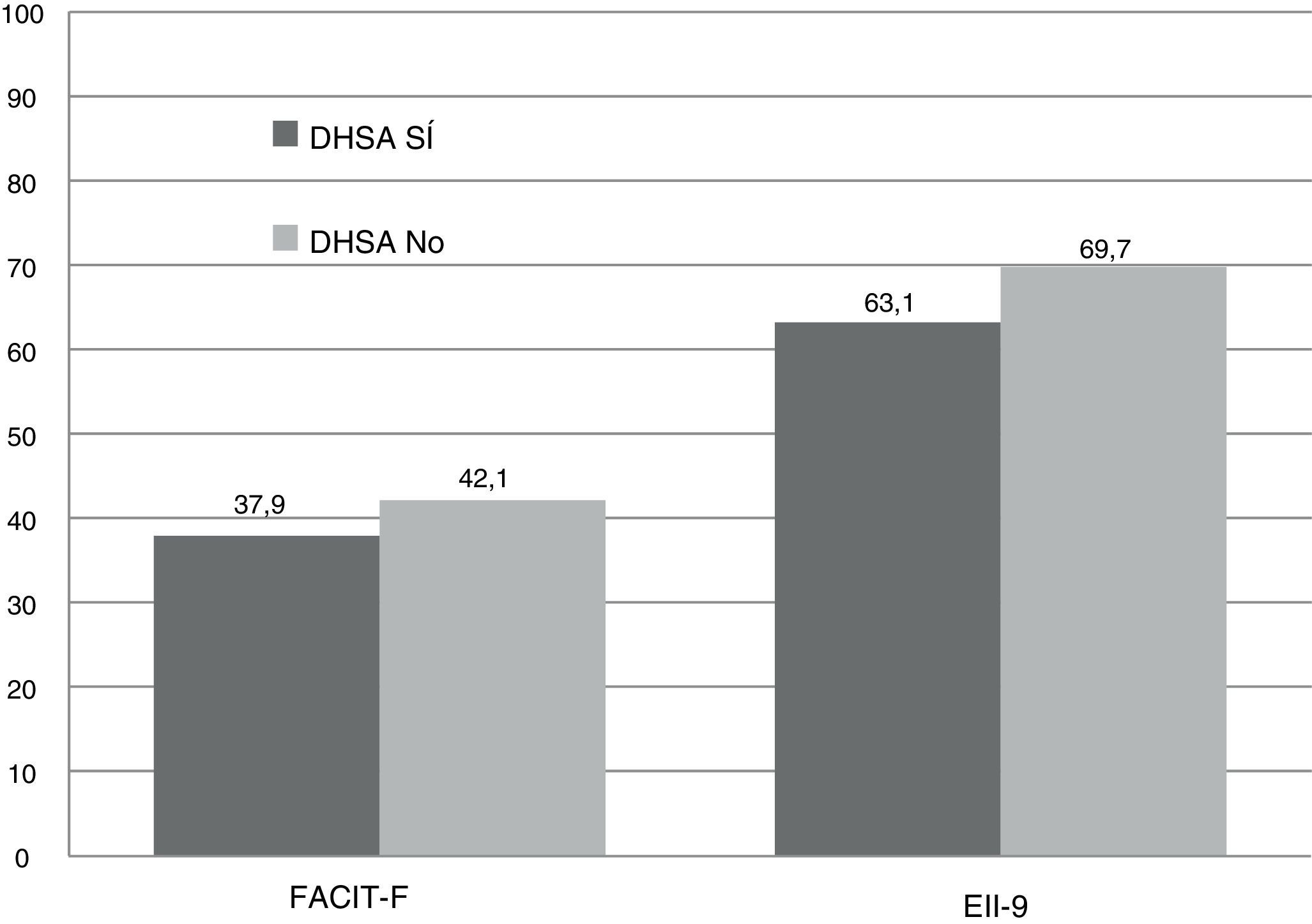
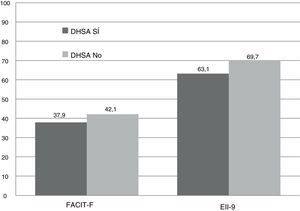
Las puntuaciones registradas fueron significativamente inferiores en el grupo DHSA comparadas con el grupo no-DHSA. En el EII-9 se obtuvo una caída de casi 7 puntos, alcanzando una diferencia significativa (63,2 vs. 69,7 puntos, p<0,001). En el FACIT-F, se registró una puntuación global inferior (37,9 vs. 42,2 puntos; p=0,037). Esto supuso una mayor prevalencia de fatiga extrema (64,7%), con una mediana de 22 puntos con respecto a los pacientes sin ferropenia (35,3%) con una mediana de 45 puntos, sin alcanzar significación estadística (p=0,069) (fig. 2).
Actitud del médico ante déficit de hierro sin anemiaSe tomó una actitud activa en 11 de los 47 pacientes: tratamiento con hierro oral (n=3), consejos para dieta rica en hierro (n=5) o complejos multivitamínicos (n=6). La abstención terapéutica fue la mayoritaria en el 70,2% de los pacientes con DHSA (n=33).
DiscusiónLa prevalencia del DHSA detectada en este estudio fue del 37%. El sexo femenino y la presencia de actividad inflamatoria fueron los factores asociados al desarrollo de esta complicación, la cual impactó negativamente en la calidad de vida percibida por los pacientes.
Pocos estudios analizan la prevalencia real del aspecto concreto de DHSA. Se han estimado cifras en torno al 36-90%8–10. Este amplio intervalo se debe a la heterogeneidad de las poblaciones estudiadas (pacientes en régimen ambulatorio o ingresados, diagnóstico reciente o en el transcurso de la enfermedad), a la propia definición de ferropenia o al año de publicación de los estudios7–10. En una cohorte húngara de 254 pacientes se registraron cifras similares a las de nuestro estudio23. Bager et al.14, en su trabajo sobre población escandinava, obtuvo una tasa del 34%.
Para las definiciones de grupos de nuestro estudio se tomaron como referencia las guías de práctica clínica publicadas por Gasche et al.4 y por la Sociedad Belga5, posteriormente llevadas a consenso por la European Crohn's and Colitis Organisation6. La ferritina sérica es una medida accesible para determinar los depósitos del hierro. Aunque no existe un claro consenso en la definición de niveles adecuados, se considera que un punto de corte <30 ng/mL para considerar estado deficitario y > 100 ng/mL para su exclusión puede asegurar una sensibilidad y especificidad del 92 y 98%, respectivamente24.
El origen de la anemia en la EII es complejo y multifactorial. En el 90% de los casos la causa subyacente es el déficit de hierro. Los factores asociados descritos hasta el momento son: edad temprana al diagnóstico, diagnóstico u hospitalización en los últimos 6 meses, presencia de actividad inflamatoria y la enfermedad de Crohn frente a CU9,10. Si consideramos la ferropenia sin anemia un estado deficitario previo, parecería lógico asumir que los factores relacionados son los mismos. Sin embargo, esta afirmación no se ha demostrado17. En nuestro análisis, se encontraron los siguientes factores asociados al grupo DHSA. En primer lugar, se observó cifras de Hb inferiores. Este hallazgo parece reforzar la suposición de considerar al DHSA un estado «preanémico», por lo que se podría sugerir una vigilancia más activa en este subgrupo de pacientes. En segundo lugar, hubo una mayor asociación con el sexo femenino, lo que concuerda con la evidencia publicada. El último factor asociado fue la presencia de actividad inflamatoria. Este hallazgo podría explicarse por un aumento de los niveles circulantes de citoquinas e interleucinas, donde el hierro resulta un elemento indispensable, lo que conllevaría un mayor consumo24.
El concepto de CVRS ha cobrado una relevancia notable en la última década. Puede verse influenciado por múltiples factores: síntomas asociados a la persistencia de actividad inflamatoria y la incapacidad que conllevan, necesidad de tratamientos crónicos y su respectiva adherencia, o la necesidad de someterse, de forma periódica, a pruebas invasivas como la colonoscopia11. Es fundamental detectar y tratar la aparición de fatiga ya que se trata de un síntoma frecuente en pacientes con enfermedades crónicas y es conocida su conexión con una peor calidad de vida percibida25. Generalmente, se acompaña de síntomas como debilidad, insomnio, irritabilidad o labilidad emocional26. Su presencia afecta a la vida diaria de los pacientes, especialmente en el ámbito laboral donde puede suponer una causa de absentismo. Se ha tratado de establecer el origen de la fatiga, considerándolo como una compleja interacción de múltiples factores entre los que destaca la anemia14. No está claro si la presencia de DHSA por sí misma contribuye a su aparición. Goldenberg et al. no consiguieron demostrarlo17 pese a que reconocen una falta de poder estadístico. Otros estudios, más recientes, como el publicado por Herrera de-Guise et al., sí señalan una correlación entre DHSA y detrimento en la CVRS15. Mediante el análisis objetivo de la puntuación obtenida en los cuestionarios, en el presente estudio se consigue demostrar la afección de forma directa con una peor CVRS referida por los pacientes.
El hierro, elemento esencial, interviene en múltiples funciones como la capacidad para el esfuerzo físico y como neurotransmisor manteniendo capacidades cognitivas como el aprendizaje y la memoria24. No hay estudios concluyentes que aclaren si el tratamiento del déficit férrico, en ausencia de anemia, supone una mejora sobre síntomas como la fatiga o cansancio crónico en el escenario de la EII. Este aspecto sí se ha comunicado en mujeres no anémicas con fatiga no explicada por otra causa27. Anker et al. demostraron una mejora tras la infusión de hierro carboximaltosa en pacientes cardiópatas con ferropenia28. En el año 2013, en el estudio FERGIMAIN29, se realizó un seguimiento de sujetos, previamente anémicos, durante 8 meses observando tasas de recurrencia del 40%. Se tomó una actitud activa, aplicando una dosis preventiva de hierro intravenoso, ante niveles de ferritina inferiores a 100 ng/dL, independientemente de la situación de anemia. Esta acción consiguió disminuir la recurrencia de la anemia al 26,7%.
En nuestro estudio se refleja la actitud clínica más extendida actualmente, la abstención terapéutica en la mayoría de los casos, probablemente por la falta de valoración de esta complicación en el contexto global de nuestros pacientes. Con el fin de mejorar la calidad de vida percibida así como para evitar una posible recidiva de la situación de anemia, parece justificado tomar una actitud más activa. Son necesarios estudios controlados, prospectivos y de coste-efectividad que profundicen en este aspecto.
Como principales limitaciones; cabe destacar, que dado el diseño de manera transversal, sin período de seguimiento, no se pudo establecer relaciones de causalidad. Tampoco se realizó un subanálisis de mujeres pre- y posmenopáusicas o con patología ginecológica, que podría explicar mayor aparición de DHSA en este grupo. Por último, no se utilizó la calprotectina fecal como marcador más preciso de actividad inflamatoria.
En este estudio, se describe una prevalencia de déficit de hierro sin anemia, superior al tercio de pacientes con enfermedad inflamatoria intestinal, en el ámbito extrahospitalario. Existe una mayor asociación en el sexo femenino y a la actividad inflamatoria subyacente, y supone un claro menoscabo de la calidad de vida de los pacientes afectos. Se recomienda una vigilancia más estricta para detectar su aparición e, incluso optar por una actitud terapéutica activa. Futuros estudios prospectivos deberían indagar en las posibles consecuencias beneficiosas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.