La evidencia de que el seguimiento de las recomendaciones sobre el cribado y tratamiento de la infección tuberculosa no evita totalmente la aparición de tuberculosis en pacientes con enfermedad inflamatoria intestinal, y el uso reciente de nuevos fármacos biológicos y de nuevos inmunomoduladores, ha llevado al Grupo Español de Trabajo en Enfermedad de Crohn y en Colitis Ulcerosa a actualizar sus recomendaciones para la prevención de la tuberculosis en los pacientes con enfermedad inflamatoria intestinal. Se revisan los métodos de diagnóstico de la infección tuberculosa latente, los distintos escenarios en los que se va a realizar el cribado, las estrategias para disminuir el riesgo de tuberculosis una vez iniciado el tratamiento biológico, las pautas de quimioprofilaxis de la infección tuberculosa latente y el manejo de la tuberculosis activa durante el tratamiento biológico. Finalmente, se resumen las recomendaciones en el texto y en un algoritmo.
There is evidence that following the recommendations on screening and treatment of tuberculosis infection does not completely prevent the onset of tuberculosis in patients with inflammatory bowel disease. This fact, and the increasing use of new biologics and immunomodulators, has led the Spanish Group Working on Crohn's Disease and Ulcerative Colitis to update their recommendations for the prevention of tuberculosis in patients with inflammatory bowel disease. Diagnostic methods for latent tuberculosis infection, different scenarios in which screening is to be performed, strategies to reduce the risk of tuberculosis once biological treatment is initiated and chemoprophylaxis guidelines for latent tuberculosis infection are reviewed, as well as the management of active tuberculosis during biological treatment. Finally, there is a summary of the current recommendations within the paper and in an algorithm.
Es conocido el riesgo de desarrollar una tuberculosis (TB) activa durante el tratamiento con fármacos inhibidores del factor de necrosis tumoral alfa (anti-TNF)1. Para tratar de minimizar ese riesgo, diferentes sociedades científicas han publicado guías clínicas y recomendaciones. En el año 2003, el Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) publicó sus primeras recomendaciones de cribado y tratamiento de la infección tuberculosa latente (ITBL) en pacientes con enfermedad inflamatoria intestinal (EII)2, que fueron actualizadas por última vez en el año 20153. En los últimos cinco años se han publicado guías para el diagnóstico y tratamiento de la ITBL en pacientes con patología articular y dermatológica que van a recibir tratamiento con fármacos anti-TNF y otros biológicos; un resumen de estas guías, así como algunas particularidades de las mismas se muestran en la tabla 14-14. Existe una gran variabilidad en las recomendaciones, debida en parte a que éstas tienen en cuenta las condiciones socioeconómicas locales, la prevalencia de ITBL, las prácticas locales de tratamiento4 y el distinto riesgo de TB asociado con la patología inmunomediada de base10.
Guías sobre el estudio, prevención y manejo de la infección tuberculosa de los últimos 5 años, excluyendo las propias de la EII
| Autor/año | Organización | Particularidades de la recomendación |
|---|---|---|
| Guías A Nivel General | ||
| Baddley/20184 | Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas | Fármacos antiTNF: Cribado de ITBL, dejando la puerta abierta a recomendaciones locales |
| Winthrop/20185 | Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas | Moléculas dirigidas hacia la IL-12/23: Cribado de ITBL, dejando la puerta abierta a recomendaciones locales |
| Migliori/20186 | Unión Europea | Resumen de los estándares para el cuidado de la ITB en la Unión Europea, actualizados a 2017 que son iguales que los de la Organización Mundial de la Salud para los países con baja incidencia de ITB (Getahun et al., 2015) |
| Lewinsohn/20177 | Sociedades Americanas de: Tórax, Enfermedades Infecciosas y del Centro para el Control y Prevención de Enfermedades | Diagnóstico de ITBL en adultos y niños donde la prueba de cribado más recomendada es la realización de un IGRA en mayores de 5 años y el TCT en menores de 5 años, aunque el TCT es aceptable en todos los escenarios. |
| Getahun/20158 | Organización Mundial de la Salud | Manejo de la ITBL en países de bajo riesgo de ITB. Cribado sistemático obligatorio en: pacientes con VIH, contactos con ITB, pacientes que iniciarán terapias anti-TNF, pacientes en diálisis, futuros receptores de trasplante de órganos sólidos o hematológico y en pacientes con silicosis. Recomendación condicional de cribado: prisioneros, trabajadores de la salud, inmigrantes de zonas endémicas de ITB, personas sin techo y en usuarios de drogas ilícitas. Se sugiere utilizar TCT o un IGRA.No cribado sistemático en: diabetes, alcoholismo, tabaquismo activo o peso bajo, salvo que también se incluyan en alguno de los otros grupos descritos previamente. |
| Patología Articular Inmunomediada | ||
| Handa/20179 | Grupo de reumatólogos y representante gubernamental para el control de ITB en la India | Guía clínica para el cribado y tratamiento de la ITBL en India (país de alta prevalencia de ITB). Similar a todas las guías. |
| Cantini/201510 | Grupo Italiano multidisciplinario para el cribado de ITB antes y durante la terapia biológica (SAFEBIO) | Estrategias de cribado antes y durante la terapia biológica, enfocado a dermatología y reumatología.Factores de riesgo para la reactivación de la ITBL: edad menor de 50 años (RR 2), historia familiar de ITB (RR 2,38), ITB reciente en menos de 2 años (RR 15), ITB antigua (RR 2,69), exposición a otros sujetos con ITB activa (RR 10,1), tabaquismo activo (RR 2), alcoholismo (RR 1,84), abuso de otras drogas (RR 2,83), malnutrición y bajo peso (RR 2), psoriasis/artritis psoriásica (RR 3,1), diabetes (RR 3,11), artritis reumatoide (RR 3,68), espondilitis anquilopoyética (RR 3,9), silicosis (RR 30), enfermedad renal grave (RR 25), signos radiológicos de ITBL (RR 19). Tomando estas características en cuenta, así como el riesgo que supone el tratamiento médico (esteroides RR 2,4; metotrexato RR 3,4; ciclosporina RR 3,8 y azatioprina RR 1,6) se sugiere estratificar a un paciente en mayor riesgo de reactivación si la suma total de los valores aislados de RR es mayor o igual a 10.Por otra parte, en esta guía se aconseja estratificar la enfermedad inmunológica de base según su actividad y en función de eso orientar el tratamiento para reiniciar más tarde o más temprano la medicación inmunosupresora. En el peor de los casos, se aconseja reiniciar la inmunosupresión pasados los dos meses de tratamiento antituberculoso, intentando siempre medicamentos con bajo riesgo como ustekinumab o metotrexato. |
| Lau/201511 | Liga Asia-Pacífico de Asociaciones de Reumatología (APLAR) | Se puntualiza que el cribado mínimo de la ITBL debe incluir un TCT y una radiografía de tórax. Se recomienda considerar una induración mayor de 10mm en el TCT como positivo, en todos los casos. |
| Psoriasis | ||
| Poelman/201912 | Guía práctica de la asociación canadiense de dermatología | Se recomienda descartar la ITB antes de la utilización de cualquier fármaco biológico, sea antiTNF o no. |
| Rodríguez-Jiménez/201813 | Consenso multidisciplinario sobre prevención y tratamiento de la IT en candidatos a tratamiento biológico en Dermatología | Se recomienda considerar un TCT como positiva a partir de una induración de 5 mm, sin tomar en cuenta el antecedente de vacunación con BCG.Se recomienda la realización simultánea del TCT y los IGRA, diagnosticándose ITBL ante la positividad de cualquiera de las dos pruebas. No se recomienda la repetición del TCT (efecto booster). |
| Smith/201714 | Asociación Británica de Dermatólogos | Se recomienda el cribado de ITBL con los IGRA. |
ITB: infección tuberculosa; EII: enfermedad inflamatoria intestinal; ITBL: infección tuberculosa latente; antiTNF: anti-factor de necrosis tumoral; IGRA: interferon-gamma release assay; TCT: test cutáneo de la tuberculina; VIH: virus de inmunodeficiencia humana; BCG: bacilo de Calmette-Guerin.
La evidencia de que el seguimiento de las recomendaciones no evita totalmente la aparición de TB en pacientes con EII, la publicación de nuevos datos sobre cribado y monitorización de TB, y el uso reciente de nuevos fármacos biológicos y de nuevos inmunomoduladores (IMM), ha llevado a GETECCU a actualizar sus recomendaciones para la prevención de la TB en los pacientes con EII.
Epidemiología de la tuberculosis en pacientes con enfermedad inflamatoria intestinalUn 50-70% de las personas infectadas por Mycobacterium tuberculosis (M. tuberculosis) eliminan la infección mediante la inmunidad innata o adaptativa; el resto, evolucionan hacia una ITBL (95%), o hacia una enfermedad activa precoz (5%). A lo largo de la vida, un 5-15% de los pacientes con ITBL reactivarán la infección y desarrollarán una enfermedad activa15,16.
En el año 2017 fueron notificados 4.571 casos de TB activa en España, lo que supone una incidencia de 9,43 casos/100.000 habitantes/año y nos sitúa como un área de baja incidencia (< 10 casos/100.000 habitantes/año). Sin embargo, existen importantes diferencias entre comunidades autónomas, algunas con tasas > 10 casos/100.000/año (Galicia 19,56; Cataluña 12,93; País Vasco 10,47; Aragón 10,18) y otras con tasas < 6 casos/100.000 (Canarias 5,13; Extremadura 5,12; Navarra 4,06)17. Por otra parte, la prevalencia de ITBL en pacientes con EII continúa siendo alta (12,5-33,5%)18,19, lo que hace que exista un gran número de pacientes en riesgo de reactivación de la infección.
El tratamiento con corticoides, inmunosupresores y con anti-TNF incrementa el riesgo de desarrollar una TB activa20; este riesgo es aún mayor cuando se combinan varios de estos fármacos21. En nuestro medio, el 94% de los casos de TB en pacientes con EII se producen durante tratamiento anti-TNF22. Se han descrito también casos de TB durante el tratamiento con fármacos biológicos con distinto mecanismo de acción, como anti IL-12/23 (ustekinumab) o como antiintegrinas (vedolizumab), aunque el riesgo parece menor que con los anti-TNF23,24. Tofacitinib, un inhibidor de las Janus kinasas, es capaz de aumentar la replicación de M. tuberculosis en modelos experimentales de ratón con ITBL25; además, la TB es la infección oportunista más frecuente en los ensayos de aprobación de tofacitinib en pacientes con artritis reumatoide, sobre todo en áreas de alta incidencia de TB26. Actualmente, el cribado de ITBL recomendado antes de iniciar tratamiento anti-TNF se ha incorporado en la ficha técnica de los nuevos biológicos y de los nuevos IMM. Por otra parte, los pacientes con EII se encuentran también en riesgo de una primoinfección por M. tuberculosis por transmisión nosocomial27,28 o tras estancias en áreas geográficas de alta incidencia de TB29. Todos los factores anteriormente expuestos contribuyen a que los pacientes con EII presenten un mayor riesgo de TB activa que la población general; por una parte, los fármacos inmunosupresores y biológicos aumentan el riesgo de reactivación de una ITBL y, por otra parte, incrementarían el riesgo de que tras una primoinfección por M. tuberculosis se produzca una TB activa precoz. Son necesarios estudios de epidemiología molecular que, mediante genotipado de M. tuberculosis, nos permitan saber qué episodios de TB son una reactivación de una ITBL (si se aísla una cepa con un patrón huérfano o único) o una infección de novo (si se aísla una cepa con un patrón similar al de otras circulantes).
Métodos diagnósticos de la infección tuberculosa latenteNo existe una técnica diagnóstica de referencia (gold standard); clásicamente, el proceso diagnóstico incluye la anamnesis, la radiología de tórax y las pruebas de inmunodiagnóstico.
- 1.
La anamnesis se dirige a la detección de factores de riesgo de exposición a M. tuberculosis; existen personas que tienen un mayor riesgo de presentar una ITBL: contactos con pacientes con TB activa, procedencia o viajes a países con alta incidencia de TB, personal sanitario, residentes y trabajadores de instituciones cerradas (prisiones, albergues u otros centros sociosanitarios), consumidores de drogas o con estados de inmunosupresión como la infección por el virus de la inmunodeficiencia humana o trasplantados, con otras comorbilidades como tumores, silicosis e insuficiencia renal crónica en hemodiálisis8. En el caso de que el cribado sea negativo, hay que hacer tratamiento preventivo de reactivación de una ITBL, solamente si ha habido contacto reciente, estrecho y continuado con un paciente bacilífero. También debería realizarse tratamiento preventivo si existe constancia epidemiológica de una TB anterior no correctamente tratada3.
- 2.
La realización de una radiografía de tórax para buscar signos de una TB previa (ganglios o nódulos calcificados, engrosamiento apical pleural, tractos fibrosos) se recomienda en algunas guías11-14, mientras, en otras, el estudio radiológico de tórax se haría sólo para descartar una TB activa tras una prueba de inmunodiagnóstico positiva o ante un contacto reciente con alguien con TB7,9,10. La realización de radiografía de tórax de forma protocolizada no parece aumentar la capacidad de detección de ITBL que aporta la combinación TCT (test cutáneo de la tuberculina)-IGRA (interferon gamma release assay). Tampoco se ha concretado qué tipo de lesión radiológica se asocia al riesgo de reactivación de una ITBL30. Estos motivos han ocasionado que algunas de las guías más recientes (tabla 1) excluyan esta prueba realizándola únicamente ante la positividad de un cribado inicial positivo con TCT, IGRA (o ambos). La tomografía computarizada de tórax es más sensible que la radiografía simple para detectar cualquier tipo de lesión, pero su uso sistemático no estaría indicado dado el elevado coste y el riesgo de radiación frente al bajo incremento diagnóstico31. Por todo lo anterior, la realización de radiografía de tórax se recomendaría solo en los casos de cribado positivo o ante un contacto reciente con alguien con tuberculosis, para descartar una infección activa.
- 3.
Pruebas de inmunodiagnóstico: tanto el TCT como los test de liberación de interferón gamma (IGRA) detectan la respuesta inmunológica de células T de memoria frente a antígenos de M. tuberculosis, sin que puedan diferenciar una ITBL de una infección activa.
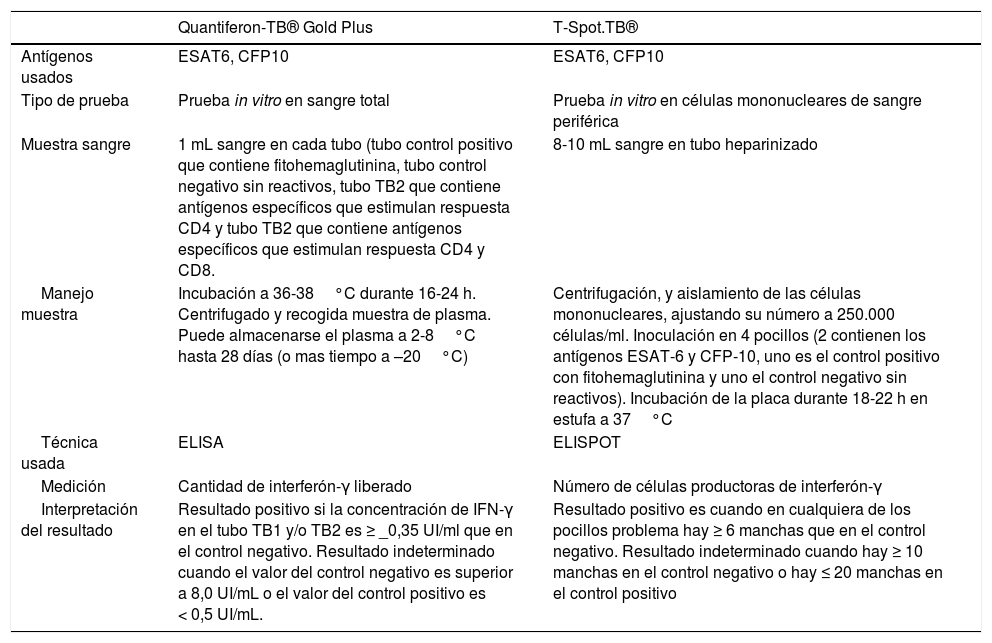
El TCT detecta, in vivo, una hipersensibilidad celular retardada frente al PPD (derivado proteínico purificado que contiene más de 200 proteínas de M. tuberculosis, algunas presentes también en BCG y en algunas micobacterias ambientales). Los test IGRA permiten la cuantificación, in vitro, de la producción de interferón-gamma (IFN-γ) por los linfocitos T sensibilizados frente a M. tuberculosis. Los antígenos utilizados para estimular la respuesta inmunitaria (ESAT-6, CFP-10) son codificados por genes localizados en la región de diferencia 1 (RD1) del M. tuberculosis, y no están presentes en la vacuna BCG ni en la mayoría de las micobacterias ambientales32. En la actualidad hay comercializados dos test IGRA: el QuantiFERON-TB Gold Plus® (QFT-Plus) (Qiagen, Düsseldorf, Alemania) y el T-SPOT.TB® (T-Spot) (Oxford Immunotec, Oxford, Reino Unido) cuyas características se resumen en la tabla 2.
Características técnicas e interpretación de los resultados de los test IGRA (interferon-gamma release assay) comercializados
| Quantiferon-TB® Gold Plus | T-Spot.TB® | |
|---|---|---|
| Antígenos usados | ESAT6, CFP10 | ESAT6, CFP10 |
| Tipo de prueba | Prueba in vitro en sangre total | Prueba in vitro en células mononucleares de sangre periférica |
| Muestra sangre | 1 mL sangre en cada tubo (tubo control positivo que contiene fitohemaglutinina, tubo control negativo sin reactivos, tubo TB2 que contiene antígenos específicos que estimulan respuesta CD4 y tubo TB2 que contiene antígenos específicos que estimulan respuesta CD4 y CD8. | 8-10 mL sangre en tubo heparinizado |
| Manejo muestra | Incubación a 36-38°C durante 16-24 h. Centrifugado y recogida muestra de plasma. Puede almacenarse el plasma a 2-8°C hasta 28 días (o mas tiempo a –20°C) | Centrifugación, y aislamiento de las células mononucleares, ajustando su número a 250.000 células/ml. Inoculación en 4 pocillos (2 contienen los antígenos ESAT-6 y CFP-10, uno es el control positivo con fitohemaglutinina y uno el control negativo sin reactivos). Incubación de la placa durante 18-22 h en estufa a 37°C |
| Técnica usada | ELISA | ELISPOT |
| Medición | Cantidad de interferón-γ liberado | Número de células productoras de interferón-γ |
| Interpretación del resultado | Resultado positivo si la concentración de IFN-γ en el tubo TB1 y/o TB2 es ≥ _0,35 UI/ml que en el control negativo. Resultado indeterminado cuando el valor del control negativo es superior a 8,0 UI/mL o el valor del control positivo es < 0,5 UI/mL. | Resultado positivo es cuando en cualquiera de los pocillos problema hay ≥ 6 manchas que en el control negativo. Resultado indeterminado cuando hay ≥ 10 manchas en el control negativo o hay ≤ 20 manchas en el control positivo |
En la práctica clínica se nos plantean varias preguntas respecto a la aplicabilidad de los test de inmunodiagnóstico en el diagnóstico de la ITBL:
- •
¿Debemos tener en cuenta el antecedente de vacunación BCG al interpretar el resultado del TCT?
La especificidad del TCT para el diagnóstico de la ITBL se ve reducida por la presencia de micobacterias ambientales y por la vacunación por la BCG33; no obstante, los vacunados en el momento del nacimiento rara vez tendrán falsos positivos tras 10 años, frente a un 20% de falsos positivos si la vacunación se produce después del primer año de vida34. En España, la vacunación BCG fue obligatoria al nacimiento entre 1965 y 1981 y, solamente en el País Vasco se continuó vacunando hasta enero del 2013; es por ello que su influencia sobre el resultado del TCT podría no ser relevante. En la población inmigrante procedente de países en los que sea obligatoria aún la vacunación con BCG, podría estar comprometida la especificidad del TCT33, si bien se ha demostrado que, en sujetos mayores de 30 años, la influencia de la vacunación es mínima, sin importar la edad de vacunación o revacunación35. Nuestra recomendación, al igual que la de guías recientes de Estados Unidos y Europa, sería realizar el TCT sin tener en cuenta el estado de vacunación con BCG, tanto en pacientes pediátricos como en adultos13,36.
- •
¿Cuál es el riesgo de falso negativo del TCT en pacientes bajo tratamiento con corticoides y/o con IMM?
La sensibilidad del TCT está influenciada por estados de inmunosupresión y por problemas inherentes a la propia prueba (fallos en la conservación o en la dilución de la tuberculina, inyección incorrecta, error en la lectura). Los pacientes con EII, probablemente por la inmunosupresión, pero también por una respuesta Th1 deficiente37, presentan un fenómeno de anergia38 que limitaría la utilidad del TCT en este contexto. En un reciente metaanálisis, el tratamiento inmunosupresor se asoció significativamente a un menor porcentaje de positividad del TST (OR 0,51; IC 95% 0,42-0,61)39.
- •
¿Es útil realizar elboosteren el TCT?
En pacientes con EII, la realización de un segundo TCT 7-10 días después del primer TCT negativo permite diagnosticar entre un 5,5% y un 25% más de pacientes con ITBL18,19,40. Estas positivizaciones se deben al llamado efecto empuje o booster sobre la respuesta inmunitaria de una segunda inyección de PPD en sujetos previamente infectados por M. tuberculosis (aunque podría también, en menor proporción, aparecer en sujetos vacunados con BCG)41. Una limitación de realizar un segundo TCT es el elevado número de visitas (cuatro) del paciente al centro sanitario, lo cual puede explicar que sea la principal causa de no seguimiento de las recomendaciones de cribado en nuestro medio42.
- •
¿Cómo interpretar los resultados indeterminados en untestIGRA?
Las principales ventajas de los test IGRA respecto al TCT son la ausencia de interferencias con la vacuna BCG, la objetividad en la interpretación de los resultados, la existencia de controles positivo y negativo y la no necesidad de una segunda visita de lectura. No obstante, una limitación es la existencia de resultados indeterminados; estos se producen cuando hay un alto nivel de IFN-γ en el control negativo o un bajo nivel en el control positivo, e impiden confirmar o descartar un diagnóstico de infección TB. La mayoría de los resultados indeterminados se producen por falta de respuesta en el control positivo del test (tubo con mitógeno)43, y se han asociado a hipoalbuminemia y al tratamiento inmunosupresor, especialmente, al uso de corticoides19,44. Los pocos estudios que han analizado en pacientes con EII ambos test IGRA, han mostrado un mayor porcentaje de resultados indeterminados con T-Spot (6-25%) que con QFT-GIT (2,4-10%)19,45,46. En un paciente con un resultado indeterminado en un test QFT-GIT, si se repite este antes de seis meses, el resultado será negativo en un 61% de los casos y nuevamente indeterminado en un 28%43.
- •
¿Cuál es el riesgo de falso negativo de untestIGRA en pacientes bajo tratamiento con inmunosupresores o biológicos?
Un metaanálisis mostró que el uso de fármacos inmunosupresores (corticoides e IMM) disminuye el porcentaje de positividad del QFT-GIT, mientras que no demostró efecto sobre los resultados del T-spot, aunque el poder estadístico del análisis fue bajo al incluir menos estudios39. Lo que se ha observado es que, al añadir los test IGRA al TCT en pacientes con EII bajo tratamiento inmunosupresor, aumenta el número de pacientes diagnosticados de ITBL, siendo la mejora diagnóstica mayor con el T-Spot (56%) que con el QFT-GIT (22%)19. El resultado de los IGRA puede verse afectado también en pacientes tratados con anti-TNF; el mismo metaanálisis anterior, demuestra que los pacientes en tratamiento con un anti-TNF tuvieron una reducción del 50% en la probabilidad de un IGRA positivo39. Probablemente esto ese debe a que los anti-TNF disminuyen el número de linfocitos T-CD4 productores de IFN-γ47.
- •
¿Influye la realización de un TCT en el resultado de untestIGRA?
Tras la realización de un TCT se produce un refuerzo en la producción de IFN-γ que puede alterar los resultados de los IGRA; esto ocurre cuando los IGRA se realizan más de tres días tras la inyección de PPD, y desaparece habitualmente tras tres meses48. Aunque este efecto ocurre especialmente en sujetos que ya eran IGRA positivos, también se ha observado, sobre todo con el QFT, en sujetos IGRA negativos49. Por tanto, se recomienda que los test IGRA se hagan simultáneamente a la inyección de PPD, o no más de tres días tras ella.
- •
¿Cómo interpretar las fluctuaciones o los resultados límite de untestIGRA?
Cuando se realiza de forma seriada un test IGRA a un mismo paciente se observan fluctuaciones en las concentraciones de IFN-γ48, lo cual supone una limitación para su uso como monitorización de la infección TB. Estas variaciones se han relacionado con variabilidad en la técnica de laboratorio y, en algunos casos, con una respuesta inmune débil frente a M. tuberculosis, lo cual ha llevado a establecer un área de incertidumbre para resultados del QFT entre 0,20 y 0,70 UI/mL, y a definir como verdaderos convertidores a aquellos sujetos en los que se produce un incremento del valor de IFN-γ desde < 20 a > 70 UI/mL50.
- •
¿Hay diferencias entre el TCT y lostestIGRA en la capacidad de detección de TB antiguas?
Tras una TB activa correctamente tratada los test IGRA se negativizan con frecuencia, al contrario de lo que ocurre con el TCT51. Por ello, los test IGRA detectarían un menor número de infecciones antiguas que el TCT, debido a que el nivel de IFN-γ no aumentaría durante las 16 h de exposición al antígeno en los test IGRA, pero sí tras las 72 h de exposición en el TCT; se ha demostrado que la incubación prolongada en los IGRA podría detectar también algunas infecciones remotas no detectadas con la incubación habitual52.
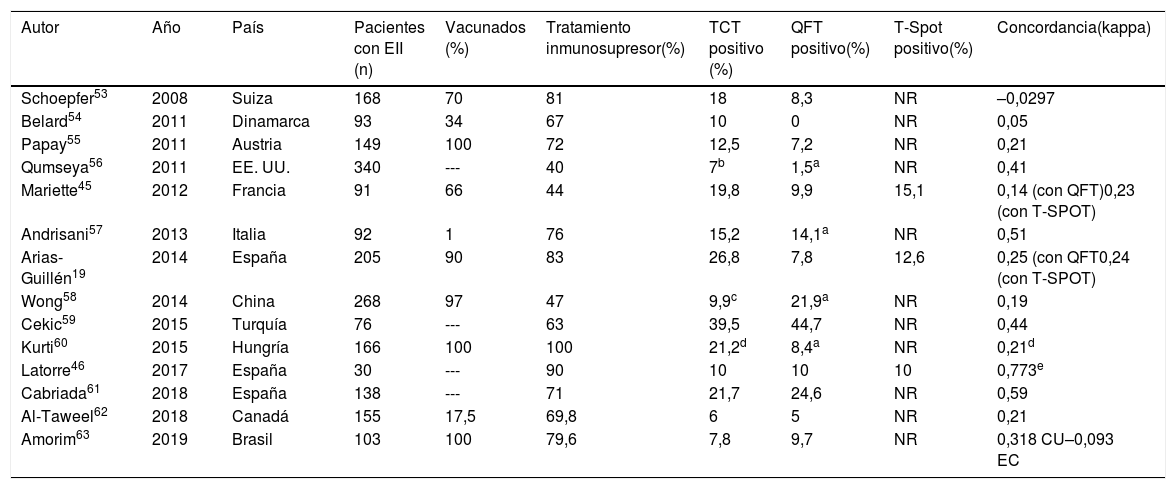
En la tabla 3 se describen los principales resultados de los estudios que han utilizado conjuntamente el TCT y un test IGRA para el cribado de ITBL en pacientes con EII. La concordancia entre los resultados del TCT y los IGRA es baja. Algunas de las limitaciones descritas anteriormente de los test de inmunodiagnóstico pueden explicar esta baja concordancia (posible influencia de la vacunación BCG, distinta capacidad para detectar infecciones antiguas, diferente influencia de la inmunosupresión y de la terapia biológica sobre cada test). En ciertos escenarios, como el de la inmunosupresión, los dos tipos de test se consideran complementarios el uno del otro.
Resultados de los estudios de cribado de infección tuberculosa latente usando la prueba de la tuberculina y un test IGRA (cribado doble) en pacientes con enfermedad inflamatoria intestinal
| Autor | Año | País | Pacientes con EII (n) | Vacunados (%) | Tratamiento inmunosupresor(%) | TCT positivo (%) | QFT positivo(%) | T-Spot positivo(%) | Concordancia(kappa) |
|---|---|---|---|---|---|---|---|---|---|
| Schoepfer53 | 2008 | Suiza | 168 | 70 | 81 | 18 | 8,3 | NR | –0,0297 |
| Belard54 | 2011 | Dinamarca | 93 | 34 | 67 | 10 | 0 | NR | 0,05 |
| Papay55 | 2011 | Austria | 149 | 100 | 72 | 12,5 | 7,2 | NR | 0,21 |
| Qumseya56 | 2011 | EE. UU. | 340 | --- | 40 | 7b | 1,5a | NR | 0,41 |
| Mariette45 | 2012 | Francia | 91 | 66 | 44 | 19,8 | 9,9 | 15,1 | 0,14 (con QFT)0,23 (con T-SPOT) |
| Andrisani57 | 2013 | Italia | 92 | 1 | 76 | 15,2 | 14,1a | NR | 0,51 |
| Arias-Guillén19 | 2014 | España | 205 | 90 | 83 | 26,8 | 7,8 | 12,6 | 0,25 (con QFT0,24 (con T-SPOT) |
| Wong58 | 2014 | China | 268 | 97 | 47 | 9,9c | 21,9a | NR | 0,19 |
| Cekic59 | 2015 | Turquía | 76 | --- | 63 | 39,5 | 44,7 | NR | 0,44 |
| Kurti60 | 2015 | Hungría | 166 | 100 | 100 | 21,2d | 8,4a | NR | 0,21d |
| Latorre46 | 2017 | España | 30 | --- | 90 | 10 | 10 | 10 | 0,773e |
| Cabriada61 | 2018 | España | 138 | --- | 71 | 21,7 | 24,6 | NR | 0,59 |
| Al-Taweel62 | 2018 | Canadá | 155 | 17,5 | 69,8 | 6 | 5 | NR | 0,21 |
| Amorim63 | 2019 | Brasil | 103 | 100 | 79,6 | 7,8 | 9,7 | NR | 0,318 CU–0,093 EC |
EII: enfermedad inflamatoria intestinal; IGRA: interferon gamma release assay; NR: no realizado; TCT: test cutáneo de tuberculina; QFT: quantiferón; EC: enfermedad de Crohn; CU: colitis ulcerosa.
- 1.
¿Se debe realizar el cribado precoz de ITBL a todos los pacientes con EII?
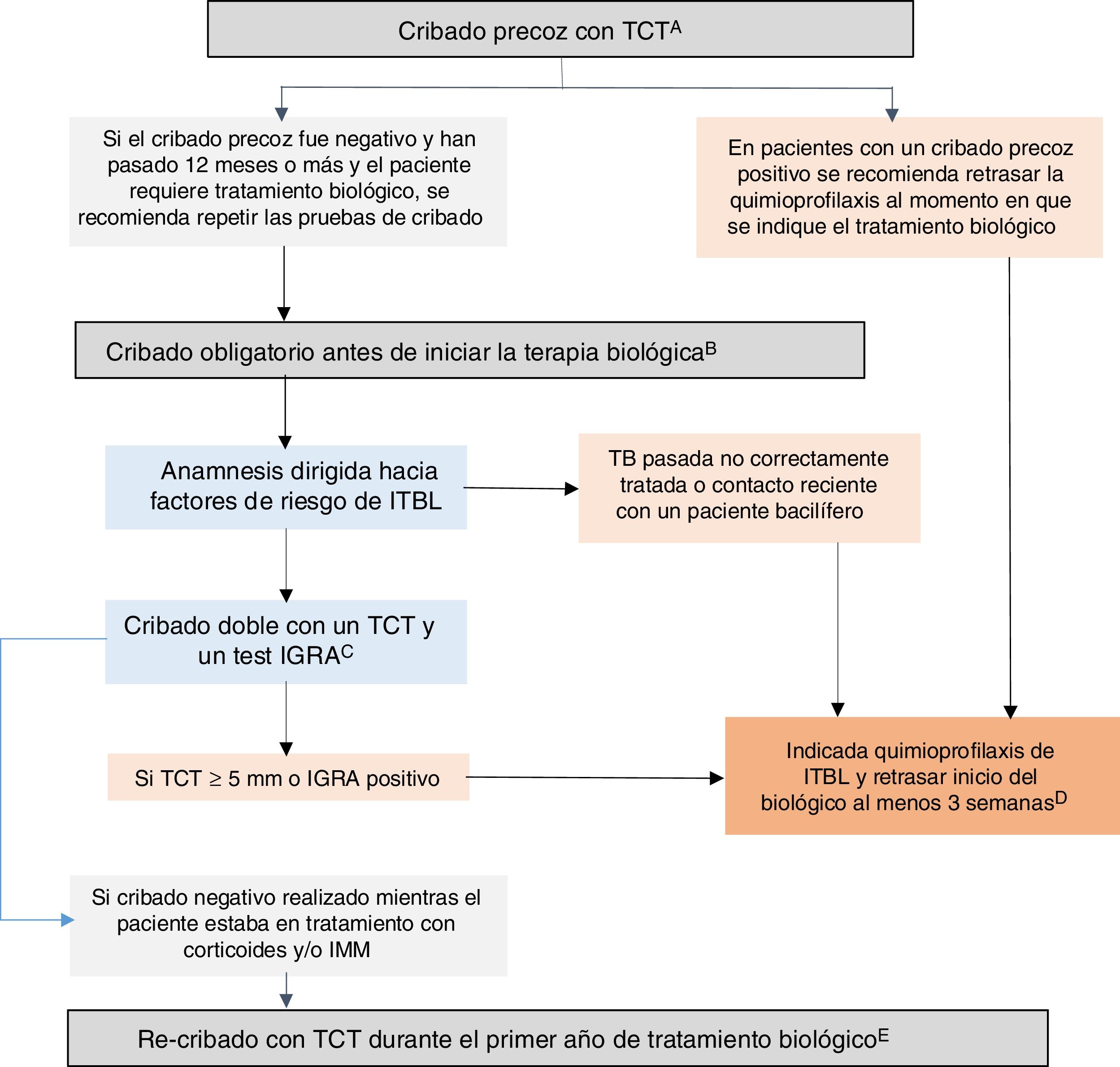
Entendemos por cribado precoz el realizado cuando aún no existe indicación de terapia biológica40 e, idealmente, debería realizarse al diagnóstico de la EII, antes de que el paciente reciba inmunosupresión (o hasta dos semanas después de haber iniciado la inmunosupresión) o, en su defecto, tras el tratamiento del primer brote (tres semanas tras la suspensión de los corticoides)29, y preferiblemente con una baja carga inflamatoria. Muchas veces, al diagnóstico, existe una alta carga inflamatoria que imposibilita hacer un cribado precoz, por lo que en estos casos se debe realizar en cualquier periodo posterior en el que el paciente se encuentre en una situación de inmunocompetencia. Se recomienda la realización de un cribado precoz de ITBL en todos los pacientes con EII dado que, potencialmente, todos ellos podrían precisar tratamiento con agentes biológicos. El estudio SEGURTB ha demostrado que la probabilidad de un resultado positivo de un TCT precoz (realizado antes de que existiese indicación de terapia biológica pero no necesariamente al diagnóstico), sin inmunosupresión asociada y con baja carga inflamatoria, fue el doble comparado con el TCT obligatorio realizado antes de iniciar un anti-TNF40. No obstante, el coste-beneficio de esta estrategia de cribado al diagnóstico de la EII en todos los pacientes podría variar según la prevalencia de la ITBL en la población general.
En situaciones de inmunocompetencia, sobre todo en el grupo de pacientes sin factores de riesgo para ITBL, varias sociedades científicas recomiendan la realización de una sola prueba de cribado7,11,12. En nuestro medio, sería preferible el TCT frente a un IGRA por las siguientes razones: 1) la vacunación con BCG en nuestro país prácticamente no influye en el resultado del TCT, 2) el TCT es una prueba barata, 3) el TCT puede detectar infecciones más antiguas que los IGRA. En este contexto no sería necesaria un segundo TCT (booster). No obstante, la realización de un IGRA como prueba única, aunque menos sensible para detectar casos antiguos, podría ser también una estrategia válida8,64.
En caso de un test de cribado precoz positivo, es aconsejable retrasar la quimioprofilaxis hasta que el paciente reciba el tratamiento biológico40; debemos evitar el sobretratar con isoniazida a pacientes que no precisarán tratamiento biológico; por otra parte, la quimioprofilaxis precoz no protegería frente a nuevos contactos con M. tuberculosis que se produzcan en el intervalo entre el test precoz positivo y el inicio de la terapia biológica. Es obligado explicar al paciente esta recomendación teniendo en cuenta que, aunque realizar una quimioprofilaxis ante un cribado precoz positivo no es incorrecto, no parece que esté justificada desde un punto de vista epidemiológico.
- 2.
¿Cuánto tiempo debe transcurrir tras un cribado negativo para que éste deba repetirse antes de iniciar un tratamiento biológico?
El factor predictor más importante de reactivación de ITBL en pacientes que reciben terapia anti-TNF es la ausencia de un cribado adecuado y reciente42,65. No hay evidencia que apoye que un paciente que ha tenido un cribado negativo deba repetirlo de forma sistemática antes de iniciar tratamiento biológico, a pesar de que es una práctica aconsejada10,64. Ante esta situación, consideramos que se debería repetir un cribado obligatorio antes de iniciar la terapia biológica en todos los pacientes si han pasado más de 12 meses desde el cribado previo y, antes, si éste no fue realizado en situación de inmunocompetencia o si existen factores de riesgo de infección tuberculosa (contactos, viajes o riesgo ocupacional).
- 3.
¿Cual es el cribado obligatorio antes de iniciar terapia biológica o con inhibidores JAK?
Entendemos por cribado obligatorio el que se realiza cuando existe indicación de tratamiento biológico o con inhibidores JAK. Habitualmente los pacientes que van a recibir terapia biológica están inmunodeprimidos, tanto por el uso de fármacos (corticoides, IMM) como por la inflamación activa y la malnutrición, y ello disminuye considerablemente la sensibilidad de los test de cribado para ITBL. En este escenario, tanto en pacientes sin cribado previo o con cribado previo negativo, se debería realizar un cribado obligatorio doble con TCT e IGRA62 inmediatamente antes del uso de biológicos. El cribado doble aumenta la capacidad diagnóstica de ITBL, ha sido estudiado en pacientes con EII19 y con enfermedades reumáticas66,67, y es recomendado por el Centro de Control y Prevención y Enfermedades (CDC) de los Estados Unidos36 y por otras sociedades científicas13,65,68. Los pacientes con cualquiera de los dos test positivos deberían recibir quimioprofilaxis para ITBL. También se sugiere utilizar esta estrategia de cribado doble en personas en zonas de media o alta prevalencia de TB o en pacientes con factores de riesgo adicionales para ITBL64. En situaciones de inmunosupresión y de no disponer de IGRA se recomienda añadir un segundo TCT (booster) realizado 7-10 días tras un primer TCT negativo.
Estrategias para disminuir el riesgo de tuberculosis una vez iniciado el tratamiento biológicoLos pacientes con EII que están recibiendo tratamiento biológico tienen un mayor riesgo de presentar una TB activa, tanto por reactivación de una ITBL no diagnosticada en el cribado basal42,69, como por presentar una infección de novo27,28. Los estudios están hechos con biológicos anti-TNF, mientras que con el resto de biológicos e inhibidores JAK la experiencia es escasa. Hasta que no haya estudios específicos con los nuevos fármacos, y para asegurar la seguridad del paciente, se mantendrán las mismas recomendaciones que con los anti-TNF. Las estrategias para disminuir el riesgo de tuberculosis se deben de adaptar a estos dos escenarios diferentes.
- 1.
Reactivación de ITBL
Algunos casos de TB tras un cribado de ITBL correcto, se han relacionado con una baja sensibilidad del TCT y de los IGRA en situaciones de inmunosupresión39,40. El estudio CONVERT demostró que el repetir un TCT (sin booster) al año de iniciar tratamiento anti-TNF incrementa en un 45% la probabilidad de detectar ITBL en pacientes con EII70. Con esta estrategia y tras un seguimiento de 798 pacientes/año no se produjo ningún caso de TB activa, lo cual supone una tasa de TB activa inferior a las tasas esperadas en nuestro medio17.
Conocemos que la sensibilidad de los IGRA puede verse afectada en pacientes tratados con anti-TNF39; sin embargo, el efecto de los anti-TNF sobre la reactividad del TCT es controvertido. En pacientes con patología reumatológica y un TCT basal positivo, éste permanece positivo en la prueba seriada realizada durante el tratamiento con infliximab, y también se ha observado una tasa relativamente alta de conversiones del TCT, que se explicaría por el control de la actividad inflamatoria71,72. Sin embargo, en el estudio CONVERT los pacientes que recibían anti-TNF tuvieron una menor probabilidad de positivización de un TCT seriado, y este efecto fue independiente del tratamiento concomitante con corticoides o IMM70. En todos los estudios que evaluaron simultáneamente un TCT y un test IGRA durante tratamiento anti-TNF, la tasa de conversión de un TCT fue mayor que la tasa de conversión de un IGRA73-78. Por otra parte, en países con riesgo bajo o medio de tuberculosis, ninguno de los pacientes que positivizó el TCT y recibió quimioprofilaxis, desarrolló TB activa a pesar de continuar con el anti-TNF70,71,76,77. Por tanto, se puede concluir que, en este escenario, es preferible el TCT como prueba para la detección de ITBL en pacientes bajo terapia anti-TNF.
En la mayoría de los estudios el TCT seriado se realizó al año del inicio del anti-TNF70,71,73,75,76, dado que el riesgo de reactivación de una ITBL es mayor durante el primer año1. En el estudio CONVERT la tasa de conversión fue cinco veces mayor en los pacientes que no estaban recibiendo corticosteroides y/o IMM en el momento que se repitió el TCT tras un año del inicio de la terapia biológica. Por ello, en pacientes que estaban recibiendo corticosteroides y/o IMM durante el cribado basal, podría ser recomendable adelantar el re-cribado con TCT a ocho semanas tras la suspensión de estos fármacos, sin necesidad de esperar al año70. Si el re-cribado es positivo se recomienda quimioprofilaxis para ITBL sin ser necesario suspender el biológico. No hay datos suficientes para recomendar la repetición anual del TCT si el TCT del primer año resulta negativo.
- 2.
Infecciones TBde novo
El consenso de la ECCO recomienda repetir el cribado para ITBL en todos los pacientes en tratamiento anti-TNF que refieran contacto con personas con TB activa o que hayan viajado, independientemente del tiempo de estancia, a países con tasas de incidencia intermedia o alta de TB. En estos casos se recomienda realizar el cribado a las 8-10 semanas del contacto o del regreso del viaje29. El personal sanitario podría beneficiarse de un cribado de infección TB durante el tratamiento biológico, especialmente si reciben anti-TNF o inhibidores JAK28. Otros grupos de pacientes que pueden estar en mayor riesgo de una infección de novo por M. tuberculosis son los que trabajan cuidando a domicilio a personas mayores, en instituciones cerradas (cárceles, geriátricos), o que colaboran con organizaciones de ayuda a inmigrantes o a personas sin hogar, etc. En este escenario, no hay estudios que hayan comparado el TCT con los test IGRA, y el cribado debería de realizarse siguiendo las prácticas locales y la graduación de riesgo del contacto.
Quimioprofilaxis de la ITBL- 1.
¿Cuál es la eficacia de la quimioprofilaxis en la prevención de la reactivación de la TB latente en pacientes que están recibiendo tratamiento biológico? ¿Cuál es la pauta más eficaz?
La quimioprofilaxis de la ITBL en pacientes candidatos a recibir tratamiento con fármacos anti-TNF ha demostrado disminuir hasta en un 78% la probabilidad de desarrollar una TB activa79. Antes de comenzar el tratamiento de la ITBL es necesario descartar una TB activa mediante evaluación radiológica. El régimen más utilizado para el tratamiento de la ITBL consiste en isoniazida (INH) a una dosis de 5 mg/kg/día (máximo 300 mg/día) durante nueve meses16. Los estudios aleatorizados demuestran tasas de protección por encima del 75% cuando se completa un curso de 9-12 meses (hasta un 90% si el cumplimiento es correcto), descendiendo la protección a un 60% cuando la duración del tratamiento es de seis meses80,81. Las principales causas del fracaso del tratamiento son la existencia de cepas resistentes a INH16 y los problemas de adherencia, que ocurren hasta en un 20% de los pacientes en nuestro medio82. Esta pauta es la recomendada por la Organización Mundial de la Salud para países de baja prevalencia de TB y la recomendada por la mayoría de las guías y sociedades científicas13,83. El efecto secundario más frecuente de la INH es la hepatotoxicidad, que ocurre hasta en un 4% de los pacientes, aunque solo en el 0,1-0,3% de casos es grave84. Por este motivo, se requiere la monitorización clínica de síntomas hepáticos (ictericia o síntomas de hepatitis) y, en pacientes con antecedentes o aumento de riesgo de hepatopatía crónica (obesidad, alcoholismo, infección VHC), control mensual de las transaminasas. El tratamiento deberá suspenderse si se produce una elevación de las transaminasas superior a tres veces los valores normales (en pacientes sintomáticos) o cinco veces el valor superior de la normalidad (en pacientes asintomáticos)8,84.
Una pauta alternativa es la utilización de rifampicina (RIF) 10 mg/kg/día (máximo 600 mg/día) durante cuatro meses. Esta pauta tiene una eficacia similar a la de INH durante nueve meses, con menor riesgo de hepatotoxicidad y mayor adherencia85. Sin embargo, presenta como limitación la elevada frecuencia de interacciones farmacológicas, incluyendo corticoides y algunos inmunosupresores86, por lo que en la mayoría de las guías clínicas se reserva su utilización para pacientes que presentan efectos adversos a la INH y para pacientes con sospecha de exposición a una cepa de M. tuberculosis resistente a INH. Otras pautas que han demostrado una eficacia y seguridad similares al régimen estándar con INH son la pauta combinada de INH 300 mg-RIF 600 mg durante tres meses87 y la pauta semanal de INH 900 mg-rifapentina 900 mg durante tres meses88, alternativas que podrían valorarse en pacientes con riesgo de baja adherencia. Finalmente, la elección de la pauta de quimioprofilaxis va a depender de las características del paciente, y de la política de tratamiento antibiótico de cada centro.
- 2.
¿Es igual de seguro iniciar simultáneamente la quimioprofilaxis de una ITBL y el tratamiento biológico, que iniciar el tratamiento biológico tras 3-4 semanas de quimioprofilaxis?
No existen estudios controlados acerca del momento ideal de comenzar con el tratamiento biológico en pacientes que van a recibir tratamiento para la ITBL. La mayoría de las Sociedades Científicas recomiendan demorar 1-2 meses el inicio del tratamiento biológico tras el inicio del tratamiento de la ITL13,29,83. Esta recomendación es arbitraria, aunque justificada en parte porque la mayoría de los efectos secundarios de la INH ocurren en los primeros dos meses83. En un estudio observacional reciente de 27 pacientes con espondiloartropatías, la administración simultánea del tratamiento de la ITBL (en este caso INH-RIF durante cuatro meses) y adalimumab, no demostró ninguna reactivación89. Nuestra recomendación es que, en la mayoría de los casos parece razonable demorar el inicio del tratamiento biológico al menos tres semanas, aunque en situaciones graves (p. ej., colitis ulcerosa grave corticorrefractaria) podrían iniciarse ambos tratamientos simultáneamente.
Tuberculosis activa durante la terapia biológica- 1.
¿Cuándo sospechar una TB activa en un paciente a tratamiento biológico? ¿Es diferente su presentación clínica que en otros escenarios?
El cumplimiento de las medidas preventivas, incluyendo la quimioprofilaxis, no elimina totalmente el riesgo de desarrollar una TB activa42,69,90,91, por lo que es necesario mantener la vigilancia clínica para poder realizar un diagnóstico precoz de TB en el caso de que esta se desarrolle.
Ya desde el estudio seminal de Keane et al.1 se comprobó que entre las tuberculosis asociadas a anti-TNF predominaban las formas extrapulmonares (56%), incluyendo un 24% de formas diseminadas. Estos datos iniciales se han visto confirmados en otras series posteriores42,69,90,92, con diagnósticos frecuentes de formas ganglionares, de serosas (pleura, peritoneo, meninge, pericardio) y de localizaciones atípicas. El momento de aparición de los síntomas sigue un patrón dual, con casos que aparecen en los primeros 3-4 meses del inicio del tratamiento en relación con reactivaciones de ITBL1,42 y otros casos de aparición tardía, más allá del año, que sugieren reinfecciones (aunque no pueden descartarse reactivaciones tardías)27.
Aunque en las formas pulmonares los síntomas típicos son tos, disnea y dolor torácico, debido a la elevada presencia de formas diseminadas y atípicas, los síntomas predominantes -y en ocasiones únicos- en las TB asociadas a anti-TNF son síntomas generales como fiebre, astenia o pérdida de peso, pudiendo también asociarse síntomas atípicos en relación con localizaciones inusuales (serositis, genital, urinaria, laringe, lengua)42,69. Por este motivo, debemos advertir a los pacientes sobre los síntomas de una TB activa y debemos tener un elevado índice de sospecha clínica para poder hacer un diagnóstico precoz y evitar la elevada morbimortalidad de un retraso diagnóstico1. Ante la sospecha clínica, deberemos agotar las posibilidades diagnósticas que requerirán con frecuencia, aparte del diagnóstico microbiológico directo, el apoyo de métodos como los hallazgos radiológicos, la determinación de PCR en muestras de biopsia y otras pruebas indirectas de la presencia de M. tuberculosis16,42,62,90.
- 2.
¿Cuánto tiempo debe esperarse para reiniciar el tratamiento biológico en pacientes con EII que han desarrollado una TB activa durante dicho tratamiento? ¿Existe mayor riesgo de desarrollar de nuevo una TB activa?
La evidencia existente sobre el momento óptimo de reiniciar el tratamiento biológico en estos pacientes es escasa. A los pacientes que desarrollaron TB durante los ensayos clínicos con biológicos se les suspendió el fármaco. La mayoría de las sociedades científicas recomiendan arbitrariamente suspender el biológico en el momento del diagnóstico de la TB y demorar su reinicio hasta terminar el tratamiento de la TB o, al menos, esperar dos meses tras el inicio del mismo. Esta recomendación proviene de la opinión de expertos, aunque se sustenta en la necesidad de valorar la susceptibilidad, tolerancia y eficacia del tratamiento tuberculostático13,29. La excepción es la British Thoracic Society, que no recomienda suspender el tratamiento anti-TNF en el caso de desarrollarse una TB, extrapolando los datos provenientes de pacientes HIV en los que no se demuestran diferencias en la eficacia del tratamiento entre pacientes infectados y no infectados93. Además, existen dos casos publicados94,95 en los que se reinició expresamente el anti-TNF durante el tratamiento de la TB como estrategia para manejar el síndrome de reconstitución inmune, dependiente de TNF, que ocurre frecuentemente durante el tratamiento de la TB en estos pacientes tras suspender el anti-TNF96.
Existe alguna evidencia procedente de series de vida real en las que, por motivos clínicos, se reintrodujo precozmente el anti-TNF durante el tratamiento de la tuberculosis42,69,97 o, que incluso no se suspendió el anti-TNF en ningún momento98. En la mayoría de estos pacientes no se observaron problemas con la eficacia o seguridad del tratamiento de la tuberculosis. En la literatura solo se ha publicado un caso de recurrencia de la TB activa tras reiniciar el anti-TNF durante el tratamiento de la misma, con un nuevo diagnóstico de TB pulmonar a los 11 meses de finalizar el tratamiento tuberculostático99.
Respecto al re-tratamiento con anti-TNF en pacientes que han tenido previamente una TB tratada adecuadamente, los consensos no consideran a estos pacientes de especial riesgo y no consideran necesario llevar a cabo quimioprofilaxis. En las series comentadas previamente, existen varios casos en los que se reinicia el tratamiento anti-TNF más de un año después de haber desarrollado TB activa, sin demostrarse nuevas reactivaciones de la TB, excepto en una serie turca de pacientes reumatológicos100. En algunas de estas series, se reinició el tratamiento con un biológico diferente (adalimumab, vedolizumab, ustekinumab), sin observarse empeoramientos o recurrencias de la tuberculosis69,101.
Recomendaciones GETECCU 2020 sobre medidas de prevención y tratamiento de la infección tuberculosa en pacientes con EIIBasadas en la evidencia publicada hasta diciembre de 2019, y en las guías al respecto, se resumen a continuación las recomendaciones de GETECCU sobre medidas de prevención y tratamiento de la infección tuberculosa en pacientes con EII (fig. 1):
- 1.
Debe realizarse cribado de ITBL en todos los pacientes con EII dado que, potencialmente, todos ellos podrían precisar tratamiento con fármacos biológicos o con inhibidores de las JAK, los cuales favorecen el desarrollo de TB activa.
- 2.
Se recomienda realizar un cribado precoz de ITBL en el momento del diagnóstico de la EII, antes de comenzar terapia inmunosupresora (o hasta dos semanas de iniciarla) o, en su defecto, tras el tratamiento del primer brote (tres semanas tras la suspensión de los corticoides), y preferiblemente con una baja carga inflamatoria. Alternativamente el cribado precoz puede realizarse en cualquier periodo posterior en el que el paciente si se encuentre en esta situación de inmunocompetencia.
- 3.
Para este cribado precoz en pacientes inmunocompetentes, se recomienda realizar una única prueba de cribado con TCT. En su defecto, podría considerase una estrategia válida la realización de un test IGRA, aunque pueda ser menos sensible para detectar casos antiguos.
- 4.
En los pacientes con un cribado precoz positivo, se recomienda retrasar la quimioprofilaxis al momento en que se indique tratamiento biológico. Se debe repetir un cribado obligatorio antes de iniciar la terapia biológica en todos los pacientes si han pasado más de 12 meses desde el cribado previo negativo, o antes si este no fue realizado en situación de inmunocompetencia.
- 5.
Antes de iniciar terapia biológica o con inhibidores de las JAK, en pacientes sin cribado previo o con cribado previo negativo, debe hacerse el cribado obligatorio:
- -
una anamnesis dirigida hacia factores de riesgo de ITBL.
- -
al tratarse de pacientes inmunodeprimidos (malnutrición, alta carga inflamatoria, y/o inmunosupresión con corticoides y/o IMM) se recomienda realizar un cribado doble con un TCT y un test IGRA (simultáneamente o, el test IGRA no más de tres días tras el TCT). En caso de no disponer de IGRA se recomienda añadir un segundo TCT (booster) realizado 7-10 días tras un primer TCT negativo.
- 6.
La realización de radiografía de tórax solo está recomendada en los casos de cribado positivo o, ante un contacto reciente con alguien con tuberculosis, para descartar una infección activa.
- 7.
Está indicado el tratamiento de la ITBL si en las pruebas de cribado se objetiva un TCT o un test IGRA positivo o, en el caso de pacientes con TCT o IGRA negativo, si existe constancia epidemiológica de una TB anterior no correctamente tratada o de un contacto reciente con un paciente bacilífero.
- 8.
Se recomienda retrasar el inicio del tratamiento biológico al menos 3 semanas de iniciada la quimioprofilaxis para la ITBL. En situaciones de gravedad se pueden iniciar de forma simultánea.
- 9.
El régimen recomendado para el tratamiento de la ITBL consiste en INH a una dosis de 5 mg/kg/día (máximo 300 mg/día) durante nueve meses. El tratamiento combinado de INH 300 mg-RIF 600 mg durante tres meses es igualmente eficaz y seguro. La elección de la pauta de quimioprofilaxis va a depender de las características del paciente, y de la política de tratamiento antibiótico de cada centro
- 10.
En pacientes con cribado previo negativo realizado mientras el paciente estaba en tratamiento con corticoides y/o IMM, se recomienda re-cribado con un TCT durante el primer año tras el inicio del tratamiento biológico.
- 11.
Durante el tratamiento biológico se debe vigilar la posible primoinfección tuberculosa, especialmente en pacientes de alto riesgo. Tras contacto con una persona bacilífera o si se ha realizado un viaje a una región de incidencia alta de TB, se recomienda repetir el cribado a partir de las 8-10 semanas, a pesar de tener uno negativo reciente.
- 12.
El cumplimiento de estas recomendaciones no elimina totalmente el riesgo de desarrollar una TB activa, por lo que se precisa mantener un alto grado de sospecha clínica; en estos casos es obligatorio realizar todas las pruebas diagnósticas necesarias para descartar o confirmar una TB. Si se diagnostica una TB activa, se recomienda suspender el tratamiento anti-TNF o inhibidores de la JAK y realizarse tratamiento de la TB; el anti-TNF o los inhibidores de la JAK pueden reiniciarse tras 2 meses de tratamiento tuberculostático.
Algoritmo recomendado para el cribado de infección tuberculosa latente (ITBL) en pacientes con enfermedad inflamatoria intestinal (EII). A) Entendemos por cribado precoz el realizado cuando aún no existe indicación de terapia biológica e, idealmente, debería realizarse al diagnóstico de la EII, antes de que el paciente reciba inmunosupresión (o hasta dos semanas después de haber iniciado la inmunosupresión) o, en su defecto, tras el tratamiento del primer brote (tres semanas tras la suspensión de los corticoides) y preferiblemente con una baja carga inflamatoria. Muchas veces, al diagnóstico, existe una alta carga inflamatoria que imposibilita hacer un cribado precoz, por lo que en estos casos se debe realizar en cualquier periodo posterior en el que el paciente se encuentre en una situación de inmunocompetencia. En su defecto, podría considerase una estrategia válida la realización de un IGRA, aunque pueda ser menos sensible que el TCT para detectar casos antiguos. B) Entendemos por cribado obligatorio el que se realiza cuando existe indicación de tratamiento biológico o con inhibidores JAK. Debe realizarse este cribado obligatorio en pacientes sin cribado previo o con cribado previo negativo. C) Se recomienda cribado doble con un TCT y un test IGRA (simultáneamente, o el test IGRA no más de tres días tras el TCT). En caso de no disponer de IGRA se recomienda añadir un segundo TCT (booster) realizado 7-10 días tras un primer TCT negativo. D) En situaciones de gravedad se pueden iniciar la quimioprofilaxis y la terapia biológica de forma simultánea. E) En pacientes con cribado previo negativo realizado mientras el paciente estaba en tratamiento con corticoides y/o IMM, se recomienda re-cribado con un TCT durante el primer año tras el inicio del tratamiento biológico. Si el re-cribado es positivo se recomienda quimioprofilaxis para ITBL sin ser necesario suspender el biológico. TCT: test cutáneo de tuberculina; IGRA: interferon-gamma release assay; IMM; inmunomoduladores.
Sabino Riestra: ha recibido ayudas para la investigación o por asesoramiento de MSD, Abbvie, Takeda, Janssen, Pfizer, Kern, Tillots, Ferring, Faes Farma, Shire Pharmaceuticals y Adacyte.
Carlos Taxonera: ha servido como orador, consultor o asesor para MSD, Abbvie, Pfizer, Janssen, Ferring, Faes Farma, Dr. Falk Pharma, y Tillots.
Yamile Zabana: ha servido como oradora, consultora o asesora para Abbvie, Dr Falk Pharma, Ferring, Janssen, MSD, Pfizer, Shire Pharmaceuticals y Tillots.
Daniel Carpio: ha recibido ayudas para la investigación o por asesoramiento de MSD, Abbvie, Takeda, Janssen, Pfizer, Celltrion, Amgen, Chiesi, Tillots, Ferring, Dr Falk Pharma y Shire Pharmaceuticals.
Belén Beltrán: ha recibido ayudas por asesoramiento de Takeda, Pfizer, MSD y Fresenius.
Miriam Mañosa: ha recibido ayudas para la investigación o por asesoramiento de MSD, Abbvie, Kern, Takeda, Janssen, Pfizer, Ferring, Faes Farma, Dr. Falk Pharma y Adacyte.
Ana Gutiérrez: ha recibido ayudas para la investigación o por asesoramiento de MSD, Abbvie, Pfizer, Takeda y Janssen.
Manuel Barreiro de Acosta: ha recibido ayudas para la investigación o por asesoramiento de MSD, Abbvie, Kern, Takeda, Janssen, Pfizer, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Chiesi, Gebro Pharma y Adacyte.
Todas estas actividades de los autores han sido ajenas al trabajo actual.