A pesar de los avances en las técnicas de imagen, en muchos casos son insuficientes para establecer el diagnóstico de las lesiones quísticas pancreáticas (LQP). Son escasas las publicaciones en nuestro medio que evalúan la combinación de varios métodos obtenidos mediante la punción aspirativa con aguja fina con ultrasonografía endoscópica (USE-PAAF). El objetivo del estudio fue evaluar la utilidad global de la USE-PAAF en el diagnóstico de las LQP.
Material y métodosEstudio retrospectivo a partir de una base de datos actualizada prospectivamente de una cohorte de pacientes remitidos para USE-PAAF por LQP. Se estudió la sensibilidad, la especificidad, el rendimiento diagnóstico del antígeno carcinoembrionario (CEA), la citología y la viscosidad para detectar lesiones mucinosas.
ResultadosDesde noviembre de 2013 a abril del 2018 se realizaron 122 USE por LQP. Se realizó USE-PAAF en 94/122 (77%) y se intervinieron 21/122 (17,2%) pacientes. Se incluyeron 33/122 pacientes que tuvieron confirmación diagnóstica mediante histología, imagen (quiste seroso con patrón típico) o evolución clínica. El estudio de la curva ROC determinó el punto de corte ≥419ng/ml para diferenciar lesión quística mucinosa/no mucinosa. El rendimiento diagnóstico del CEA fue del 87,5% (21/24), de la citología del 81,8% (27/33) y de la viscosidad del 84,4% (27/32). Los 3 parámetros en combinación obtuvieron el mejor resultado (30/33, 90,9%).
ConclusiónLa combinación del análisis del CEA, la citología y la viscosidad del líquido pancreático obtenido mediante USE-PAAF aumenta el rendimiento en el diagnóstico de las lesiones quísticas pancreáticas mucinosas, siendo superior al 90%.
Despite advances in imaging techniques, in many cases they are insufficient to establish the diagnosis of pancreatic cystic lesions (PCL). There are few publications in our setting that evaluate the combination of several methods obtained by endoscopic ultrasound-guided fine needle aspiration (EUS-FNA). The aim of the study was to evaluate the overall utility of EUS-FNA in the diagnosis of PCL.
Material and methodsRetrospective study based on a database updated prospectively of a cohort of patients referred for EUS-FNA due to PCL detected in an imaging test. The sensitivity, specificity and diagnostic yield of carcinoembryonic antigen (CEA), cytology and viscosity were studied to detect mucinous lesions.
ResultsFrom November 2013 to April 2018, 122 EUS were performed for PCL. EUS-FNA was performed in 94/122 (77%) and 21/122 (17.2%) patients were operated on. We included 33/122 patients who had diagnostic confirmation by histology, imaging (serous cyst with typical pattern) or clinical evolution. The study of the ROC curve determined the cutoff point ≥419 ng/ml to differentiate mucinous/non-mucinous cystic lesions. The diagnostic yield of CEA was 87.5% (21/24), cytology 81.8% (27/33) and viscosity 84.4% (27/32). The three parameters in combination obtained the best result (30/33, 90.9%).
ConclusionThe combination of CEA analysis, cytology and viscosity of pancreatic fluid obtained by EUS-FNA increases the performance in the diagnosis of mucinous pancreatic cystic lesions, with it being greater than 90%.
En los últimos años se ha producido un incremento en el diagnóstico de las lesiones quísticas del páncreas (LQP). La expansión de las técnicas de imagen como la tomografía computarizada (TC) y la resonancia magnética nuclear (RMN) podrían justificar una mayor detección y el aumento de frecuencia. Su prevalencia aumenta asimismo con la edad, de tal forma que aproximadamente entre un 10% de los pacientes mayores de 70 años las presentan1. La mayoría de estas lesiones son asintomáticas y se detectan de forma incidental. Se ha descrito que se encuentran hasta en un 14% de los pacientes a los que se les realiza una RMN por indicación no relacionada con el páncreas2. Por otra parte, la ultrasonografía endoscópica (USE) permite identificar lesiones en páncreas de pequeño tamaño. Un estudio prospectivo español reciente describe una tasa del 22% en la detección de LQP cuando se realiza con una indicación no relacionada con el páncreas3.
Las LQP constituyen un grupo de lesiones de naturaleza muy diversa, desde inflamatoria como los seudoquistes, hasta neoplásica, lo cual condiciona un pronóstico muy diferente e implica un abordaje terapéutico distinto. Las LQP se clasifican en mucinosas o no mucinosas. Las LQP mucinosas incluyen a la neoplasia mucinosa papilar intraductal (NMPI) y la neoplasia mucinosa quística (NMQ), y su importancia radica en que son lesiones premalignas4.
A pesar de los avances en las técnicas de imagen, en muchos casos son insuficientes para establecer el diagnóstico, suponiendo un reto la aproximación diagnóstico-terapéutica. Esto es debido a que las LQP tienen un amplio espectro clínico y en algunos casos es difícil de establecer la predicción de malignidad, obteniendo resultados similares con TC, RMN y USE (sin punción aspirativa con aguja fina [PAAF])5.
La ventaja de la USE, con respecto a otras técnicas de imagen, es la posibilidad de realizar PAAF y obtener muestra para estudio, lo que podría aumentar la eficacia diagnóstica6. La rentabilidad de la USE-PAAF en las lesiones sólidas pancreáticas está ampliamente demostrada (en torno al 90%)7. En cambio, los resultados de la citología en las lesiones quísticas son inferiores (alrededor del 50%)7,8, por lo que su utilidad es más discutida. Debido a la baja rentabilidad de la citología, múltiples estudios han analizado diversos parámetros en el líquido quístico (viscosidad, marcadores tumorales,…)9. La realización de una sola determinación tiene sus limitaciones, y son escasas las publicaciones que evalúan la combinación de varios métodos.
Debido a la escasez de estudios en nuestro medio que evalúen la utilidad global de la USE-PAAF en las LQP (estudio macroscópico del líquido obtenido, citológico y bioquímico), y la utilidad limitada de cada uno de estos métodos, se propuso el presente estudio, cuyo objetivo fue evaluar la utilidad de la USE-PAAF en el diagnóstico de las LQP, mediante la combinación de 3 test (viscosidad, citología y antígeno carcinoembrionario [CEA, por sus siglas en inglés]).
Pacientes y métodosPacientes y procedimiento ultrasonografía endoscópicaEstudio de diseño retrospectivo a partir de una base de datos de inclusión prospectiva de pacientes con hallazgo de LQP indeterminada, mediante prueba de imagen (TC y/o RMN), y realización de USE±PAAF en un hospital terciario desde noviembre de 2013 a abril de 2018. El estudio fue aprobado por el comité ético del hospital y todos los pacientes firmaron el consentimiento informado.
En el registro se incluyeron variables epidemiológicas (edad, sexo), farmacológicas (tratamiento con antiagregantes y/o anticoagulantes) tamaño y localización de la LQP, características morfológicas en la USE de la LQP (fig. 1), y del resto de la glándula pancreática (existencia de tabiques, nódulos murales, porción sólida, calcificación, engrosamiento de la pared, comunicación con el conducto pancreático, dilatación del conducto de Wirsung, así como hallazgos parenquimatosos y/o ductales consistentes o sugestivos de pancreatitis crónica según la clasificación de Rosemont10), resultados de la punción (aspecto macroscópico del líquido quístico, nivel del CEA y estudio citológico), complicaciones derivadas de la USE-PAAF, realización de cirugía y resultado histológico, así como seguimiento radiológico y clínico de los pacientes no intervenidos. El registro de complicaciones y la evolución de los pacientes se realizó mediante consulta de la historia clínica electrónica.
La USE se realizó con un ecoendoscopio radial (GF-UE160-AL5, Olympus America Inc., Melville, NY, EE. UU.) seguido por un ecoendoscopio sectorial (GF-UC160P-OL5 EVIS EXERA, Olympus America Inc., Melville, NY, EE. UU.) cuando la USE-PAAF fue indicada, con sistema ultrasónico Aloka - ProSound Alpha 10. Los procedimientos fueron realizados por un ecoendoscopista experto (más de 200 procedimientos/año y más de 10 años de experiencia). Los pacientes fueron colocados en posición de decúbito lateral izquierdo y recibieron sedación profunda pautada por un anestesiólogo. Se administró antibioterapia profiláctica en todos los pacientes que se realizó USE-PAAF. Se utilizó el sistema de aguja-catéter de 22G en la mayoría de los casos, y ocasionalmente 25 y 19G (Boston Scientific Corp, Marlborough, EE. UU.) insertado mediante el canal de trabajo del ecoendoscopio y avanzado en la lesión bajo control ecográfico en tiempo real. El acceso fue vía transgástrica o transduodenal según la ubicación de la lesión. Tras la extracción del estilete, se realizó succión y aspiración con una jeringa de 10ml obteniéndose el líquido quístico. En la mayoría de los pacientes se realizó habitualmente un único pase. Solamente en 6 pacientes se realizaron 2 pases, y en 3 pacientes, 3 pases. Todos los pacientes ingresaron 24h tras el procedimiento.
Se examinó el color del líquido quístico (transparente versus no transparente) y la viscosidad. Se consideró viscoso si la longitud de la cadena de moco entre el pulgar y el dedo índice del examinador era ≥1cm durante ≥1segundo (string sign)11 o era claramente filante.
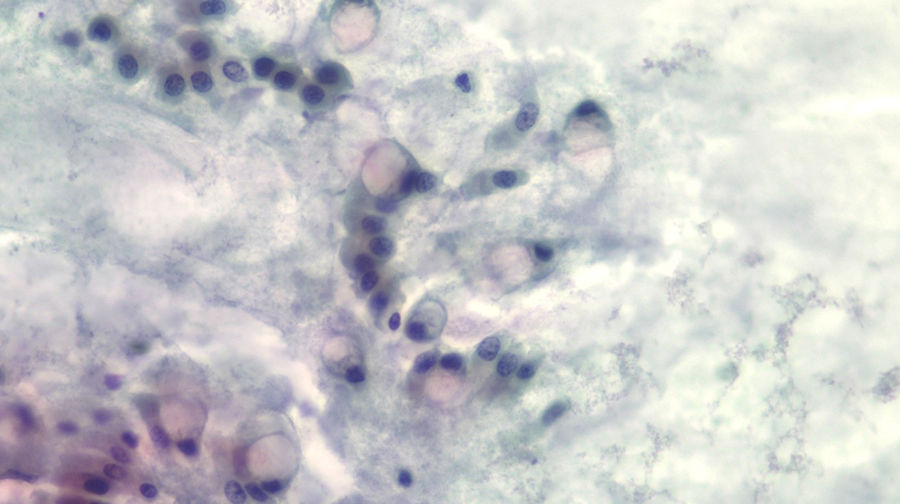
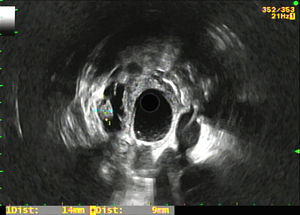
El diagnóstico de lesión quística mucinosa mediante citología se definió como presencia de: 1) epitelio mucinoso: existencia de grupos de células epiteliales en monocapa de morfología cuboidal (más típico de NMQ) o columnar (más típico de NMPI), o papilas de células mucosecretoras con mucina intracitoplásmica con o sin displasia, y/o 2) mucina extracelular densa (fig. 2).
Parte del fluido aspirado se centrifugó y el sobrenadante se sometió a medición del CEA. La cuantificación del CEA en el líquido quístico fue realizada mediante técnica de electroquimioluminiscencia (EQL) (Cobas e 411, Roche, Tokio, Japón). Si el valor obtenido resultante era mayor de 3,8ng/ml se realizó posteriormente dilución directa de la muestra.
Se clasificaron las LQP como lesión quística mucinosa o no mucinosa. En el primer grupo se incluyeron la NMQ y la NMPI. Entre las lesiones quísticas no mucinosas: la neoplasia quística serosa (NQS), el seudoquiste, quiste asociado a pancreatitis crónica y otras lesiones, que a veces pueden tener apariencia quística como el tumor neuroendocrino (TNE) y el adenocarcinoma ductal.
Se incluyeron en el estudio: 1) los pacientes con diagnóstico confirmado de la LQP mediante histología de la pieza quirúrgica; 2) confirmación clínica de seudoquiste y/o 3) imagen compatible con NQS. Se consideró seudoquiste cuando el paciente tenía antecedente de pancreatitis aguda, citología con hallazgo de células inflamatorias y ausencia de células neoplásicas, epitelio papilar y/o mucina, así como desaparición del quiste con ausencia de recurrencia durante al menos un año de seguimiento, o disminución significativa del tamaño del quiste (50%) mediante imágenes de TC y RMN valoradas por un radiólogo experto. Se consideró NQS cuando presentaba patrón típico en panal de abeja en la ecoendoscopia, citología no mucinosa (ausencia de mucina y epitelio papilar) y estabilidad de la lesión al menos durante un año en las pruebas de imagen de control.
Análisis estadísticoLas variables cualitativas se expresaron en valores absolutos y sus porcentajes, mientras que las variables continuas se expresaron como media ±desviación estándar. La comparación de las proporciones se realizó con la prueba de Chi-cuadrado, mientras que la comparación de las variables de exposición cuantitativas con variables de respuesta categóricas se realizó con el modelo de regresión logística (2 categorías) o regresión logística multinomial (>2 categorías). El punto de corte óptimo de la variable cuantitativa CEA se determinó mediante una curva receiver operating characteristic (ROC) para predecir LQP mucinosa. Se calculó el área bajo la curva ROC (interpretación de utilidad clínica en términos de probabilidad predictiva). El punto de corte seleccionado fue el que maximizaba la proporción de LQP correctamente clasificadas. La sensibilidad, la especificidad y la precisión diagnóstica de la citología, la viscosidad del líquido quístico, el CEA y la combinación de estos 3 test fueron también calculadas. El análisis de los datos se realizó con el paquete estadístico Stata® versión 12. Se consideró significación estadística si el valor de p era menor de 0,05.
ResultadosCaracterísticas generales de los pacientes y lesiones quísticas pancreáticasSe remitió para USE un total de 122 pacientes. Se realizó USE-PAAF en 94 pacientes y se desestimó la punción en 28 por los siguientes motivos: LQP de pequeño tamaño (menor de 10mm) (n=22), dificultad de acceso (n=3), interposición de vasos (n=2) y aspecto endoscópico típico seroso (n=1). Se operaron 21/94 pacientes con la siguiente histología: 4 NMPI sin displasia, 2 NMPI con displasia, 6 NMQ, un cistoadenocarcinoma, 4 NQS, 2 TNE, una pancreatitis crónica y un adenocarcinoma ductal. Se siguió la evolución de los restantes 73 pacientes que no fueron intervenidos. De ellos, 7 fueron definidos clínicamente como seudoquiste y 5 NQS por imagen. Finalmente, se incluyeron en el estudio 33 pacientes (13 LQP mucinosas y 20 no mucinosas).
Las características generales de los pacientes se resumen en la tabla 1. Diecisiete (51,5%) pacientes fueron varones con una edad media de 53±17,6 años (rango: 19-83). La localización más frecuente fue en cabeza del páncreas (n=15; 45,4%), seguida de cuerpo (n=13; 39,4%) y cola (n=5; 15,2%). El tamaño medio de las LQP fue de 33,6±16mm (rango: 13-70). La edad, el sexo, la localización y el tamaño del quiste fueron similares en ambos grupos de estudio. Sin embargo, el sexo masculino predominó en todas las LQP no mucinosas excepto la NQS. La edad media se situó en torno a los 50 años excepto en los pacientes con pancreatitis crónica, TNE quístico y adenocarcinoma ductal. La localización más frecuente fue en cabeza del páncreas excepto en la NQS y el TNE quístico que fue en cuerpo. El menor tamaño medio lo tuvieron los TNE quísticos seguido de las NMPI, siendo menor de 3cm. Se detectaron 6/33 (18,2%) lesiones malignas en el grupo de estudio: 2 NMPI malignos, un cistoadenocarcinoma, un adenocarcinoma ductal infiltrante y 2 TNE quísticos.
Características basales de los pacientes
| Lesión | Número | Edad (años) | Sexo (varones, %) | Localización | Tamaño (mm) | ||
|---|---|---|---|---|---|---|---|
| Cabeza | Cuerpo | Cola | |||||
| Mucinosa | 13 | 57 | 6 (46,2) | 9 | 3 | 1 | 35,8 |
| NMQ | 7 | 56 | 3 (42,9) | 6 | 3 | 1 | 45,4 |
| NMPI | 6 | 58 | 3 (50) | 3 | 0 | 0 | 24,7 |
| No mucinosa | 20 | 50 | 11 (55) | 6 | 10 | 4 | 32,1 |
| NQS | 9 | 49 | 1 (11,1) | 0 | 6 | 3 | 30,7 |
| Seudoquiste | 7 | 54 | 7 (100) | 4 | 2 | 1 | 36,7 |
| Pancreatitis crónica | 1 | 30 | 1 (50) | 1 | 0 | 0 | 30 |
| Tumores | |||||||
| TNE quístico | 2 | 36 | 1 (50) | 0 | 2 | 0 | 19 |
| Adenocarcinoma ductal | 1 | 76 | 1 (50) | 1 | 0 | 0 | 40 |
Solo un paciente (1/33, 3%) llevaba tratamiento con antiagregante (ácido acetilsalicílico 100mg/día) y ninguno anticoagulantes. No se registraron complicaciones graves. Únicamente 2 pacientes presentaron hemorragia intraquística autolimitada tras la punción, pero no requirieron prolongación del ingreso hospitalario ni ninguna otra medida adicional; tampoco correspondían al paciente en tratamiento con antiagregante.
Resultados morfológicos de la ultrasonografía endoscópicaLas características ultrasonográficas de las LQP se describen en la tabla 2. La mayoría de nódulos murales se detectaron en el grupo de LQP mucinosas (4/5), y en ningún caso en lesiones no tumorales o serosas. Únicamente hubo porción sólida en lesiones malignas (adenocarcinoma ductal y cistoadenocarcinoma). Sin embargo, se identificaron tabiques en ambos grupos de estudio.
Características ultrasonográficas de las lesiones quísticas pancreáticas
| NMQ (n=7) | NMPI (n=6) | NQS (n=9) | Seudoquiste (n=7) | Pancreatitis crónica (n=1) | Tumores no mucinosos | ||
|---|---|---|---|---|---|---|---|
| TNE quístico (n=2) | Adenocarcinoma ductal (n=1) | ||||||
| Nódulo mural | 2/7 (28,6) | 2/6 (33) | 0 | 0 | 0 | 1/2 (50) | 0 |
| Porción sólida | 1/7 (14,3) | 0 | 0 | 0 | 0 | 0 | 1 (100) |
| Engrosamiento de pared | 1/7 (14,3) | 1/6 (16,7) | 1/9 (11,1) | 0 | 0 | 0 | 1 (100) |
| Tabiques | 4/7 (57,1) | 3/6 (50) | 7/9 (77,8) | 1 (14,3) | 0 | 1 (50) | 1 (100) |
| Patrón en panal de abeja | 0 | 0 | 6/9 (66,6) | 0 | 0 | 0 | 0 |
| Comunicación con Wirsung | 0 | 5/6 (83,3) | 0 | 1 (14,3) | 0 | 0 | 0 |
| Dilatación de Wirsung | 1/7 (14,3) | 4/6 (66,7) | 0 | 4 (57,1) | 1 (100) | 0 | 1 (100) |
| Pancreatitis crónica | 0 | 0 | 0 | 5/7 (71,4) | 1 (100) | 0 | 0 |
NMPI: neoplasia mucinosa papilar intraductal; NMQ: neoplasia mucinosa quística; NQS: neoplasia quística serosa; TNE: tumor neuroendocrino.
Datos presentados como número (%).
Se valoró el aspecto macroscópico del líquido (color y viscosidad) en todos los casos incluidos excepto en uno (n=32), porque no se obtuvo suficiente fluido y únicamente pudo realizarse extensión para estudio citológico.
El color del líquido quístico obtenido fue el siguiente: 22 transparente y 10 no transparente. Se descartó en la valoración de comparación 3/10 por ser hemático probablemente secundario a traumatismo de la punción. No hubo correlación significativa entre la transparencia (22/29) del líquido quístico y la existencia de lesión mucinosa (p=0,10).
En 7/32 punciones de LQP se objetivó viscosidad, y todas ellas correspondieron a lesiones mucinosas (p<0,01). La especificidad fue, por tanto, del 100%. Los datos relativos a la sensibilidad y al rendimiento diagnóstico de la viscosidad para la determinación de LQP mucinosa se detallan en la tabla 3.
Sensibilidad, especificidad y precisión de la citología, CEA en líquido quístico viscosidad y combinación de los 3 en el diagnóstico de lesión quística pancreática mucinosa
| CEAa | Citología | Viscosidad | Combinaciónb | |
|---|---|---|---|---|
| Sensibilidad | 6/6 (100; 61-100) | 7/13 (53,9; 29,1-76,8) | 7/12 (58,3; 32-80,7) | 13/13 (100; 77,2-100) |
| Especificidad | 15/18 (83,3; 60,8-94,1) | 20/20 (100; 83,9-100) | 20/20 (100; 83,9-100) | 17/20 (85; 64-94,8) |
| Rendimiento diagnóstico | 21/24 (87,5; 69-95,7) | 27/33 (81,8; 65,6-91,4) | 27/32 (84,4; 68,2-93,1) | 30/33 (90,9; 76,4-96,9) |
CEA: antígeno carcinoembrionario.
Los datos se presentan como número (%; intervalo de confianza del 95%).
En 9/33 casos no pudo realizarse determinación del CEA debido a la escasa cantidad de líquido quístico obtenido (aproximadamente 0,5ml) y priorizarse el estudio citológico, o por su viscosidad. El diagnóstico final de estos 9 pacientes fue: 7 tumores mucinosos (un cistoadenocarcinoma, 5 NMPI y una NMQ) y 2 no mucinosos (una NQS y un seudoquiste). La citología fue diagnóstica en 8/9 pacientes (NQS no diagnóstica) y el líquido obtenido fue viscoso en todas las lesiones mucinosas.
La mediana de la concentración del CEA en líquido quístico en las lesiones mucinosas fue mayor que en las no mucinosas: 3.044ng/ml (rango intercuartil: 1.073-5.941,5; rango total: 419-13.407) versus 7ng/ml (rango intercuartil: 0,58-168,5; rango total: 0-4.167) (p=0,02). No hubo diferencias estadísticamente significativas en los niveles del CEA en las lesiones mucinosas malignas respecto las restantes (premalignas) (p=0,80). Los niveles del CEA fueron <5ng/ml en 9 LQP, todas ellas no mucinosas: 6 NQS, 2 TNE y un seudoquiste.
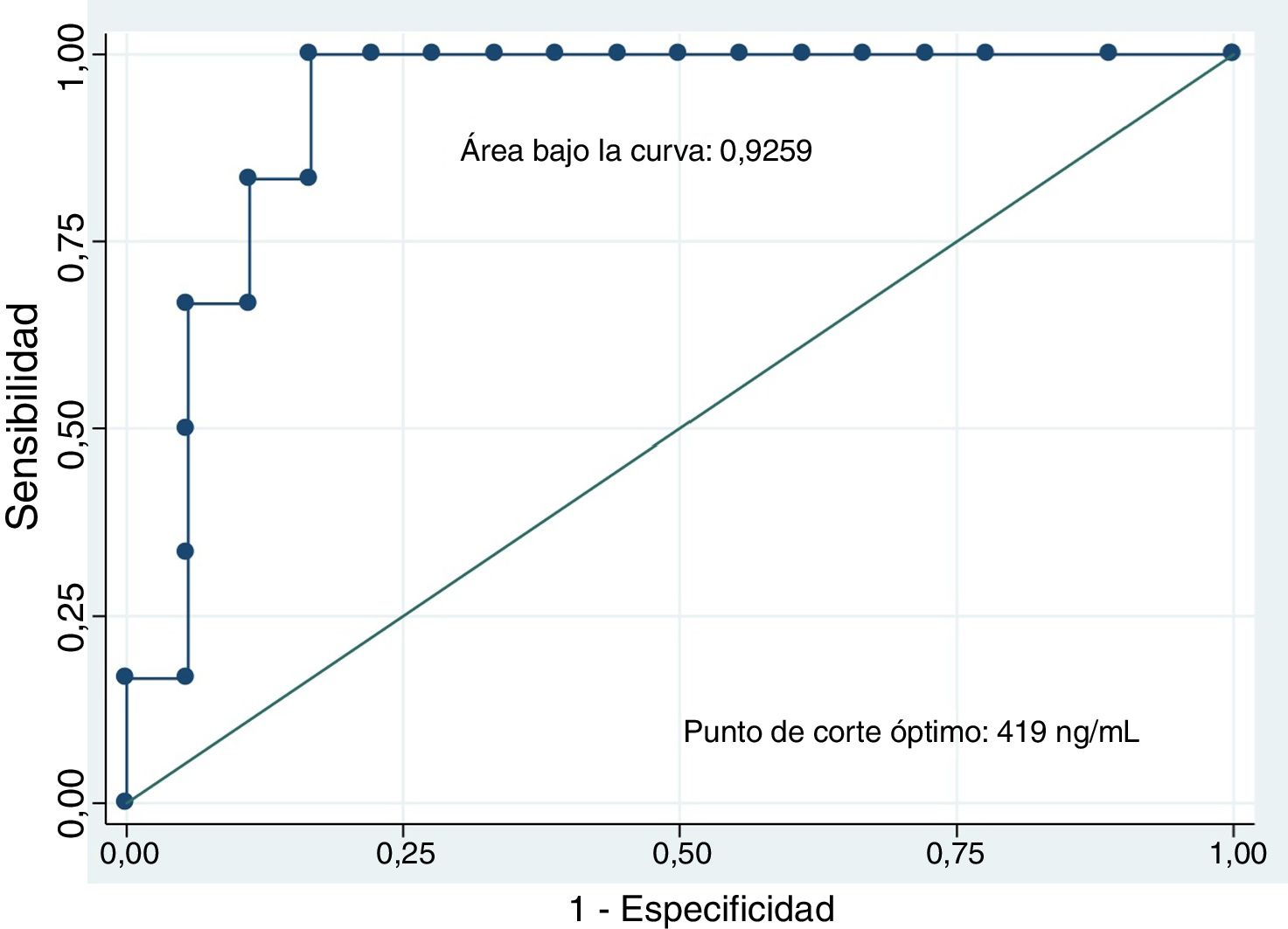
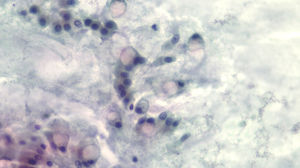
El análisis de los niveles del CEA mediante una curva ROC seleccionó el valor ≥419ng/ml como el punto de corte óptimo para diferenciar lesión quística mucinosa versus no mucinosa con un área bajo la curva de 0,9259 (intervalo de confianza [IC] del 95%: 0,7-0,99) (fig. 3). Con este punto de corte la sensibilidad, la especificidad y el rendimiento diagnóstico fueron del 100, 83,3 y 87,5%, respectivamente (tabla 3). Al utilizar el punto de corte ≥192ng/ml descrito en la serie de pacientes más amplia publicada la sensibilidad no varía (100%); en cambio, la especificidad y el rendimiento diagnóstico son discretamente inferiores (77,8 y 83,3%, respectivamente)8.
CitologíaLos resultados de la citología también fueron categorizados en LQP de tipo mucinoso y no mucinoso. En la tabla 3 se detallan los resultados de la sensibilidad y del rendimiento diagnóstico, que fueron los más bajos de todos los test. La especificidad fue del 100%, que coincide con la especificidad de la viscosidad, y son ambos superiores a la determinación del CEA.
Combinación de testSe analizó la combinación de las 3 pruebas (CEA en líquido quístico, citología y viscosidad) para predecir LQP mucinosa/no mucinosa. En esta combinación se consideró LQP mucinosa si cualquiera de los componentes del test era positivo11. La sensibilidad fue tan elevada como la del CEA (100%), con una especificidad discretamente superior a este test (85 versus 83,3%). El rendimiento diagnóstico del CEA (87,5%) fue ligeramente superior a la citología (81,8%) y la viscosidad (84,4%). Finalmente, el rendimiento diagnóstico global de la combinación fue superior a los tres test individuales (90,9%) (tabla 3).
DiscusiónEn la actualidad el diagnóstico de una LQP en un paciente asintomático, mediante una prueba de imagen, es frecuente12. La importancia del diagnóstico diferencial de estas lesiones se debe a que las mucinosas son malignas o potencialmente malignas y su tratamiento definitivo (cirugía) es agresivo. Sin embargo, la mayoría de lesiones no mucinosas (serosas) no precisan de tratamiento salvo en caso de que sean sintomáticas13,14.
El rendimiento diagnóstico de las técnicas de imagen (TC, RMN) es bajo para diferenciar una lesión quística mucinosa de una no mucinosa15. Por otra parte, la USE permite obtener una información detallada de las LQP y del resto de la glándula pancreática. Sin embargo, en muchos casos no es posible establecer el diagnóstico mediante las características morfológicas. Así, en un estudio multicéntrico de Brugge et al. con 112 pacientes se obtuvo un rendimiento diagnóstico del 51%8. Según las guías de práctica clínica, el tamaño de la LQP (≥3cm), la presencia de nódulos murales y/o componente sólido son factores de riesgo de malignidad13,14. En nuestra serie, únicamente se detectaron nódulos murales en lesiones malignas o premalignas (2 NMQ, 2 NMPI y un TNE) y porción sólida en lesiones malignas (adenocarcinoma ductal y cistoadenocarcinoma). Sin embargo, se identificaron tabiques en ambos grupos de estudio.
La ventaja de la ecoendoscopia con respecto a otras técnicas de imagen es que permite la punción y el análisis del líquido intraquístico. Habitualmente en la práctica clínica se realiza estudio citológico, de la viscosidad, bioquímico y marcadores tumorales. El aspecto macroscópico del líquido puede ser de gran utilidad, los quistes mucinosos normalmente presentan fluido claro y muy viscoso. De forma rápida y sencilla se puede obtener información de la viscosidad con una alta especificidad para el diagnóstico de lesión mucinosa mediante el previamente descrito strign sign. Así, en una serie de 98 pacientes, la especificidad fue del 95% similar a nuestros resultados (100%). Sin embargo, hay que tener en cuenta que la sensibilidad fue del 58%, también similar a la nuestra (58,3%)11.
La citología tiene una alta especificidad (mayor del 90%), pero su sensibilidad en las LQP es baja (alrededor del 50%)16, a diferencia de las lesiones pancreáticas sólidas. El motivo es la escasa celularidad contenida en el aspirado del líquido quístico. De forma similar, en nuestro estudio, la sensibilidad de la citología fue del 54% con una especificidad del 82%.
En la actualidad, el único marcador que se realiza de rutina en el estudio de LQP es el CEA. Esto se definió a raíz de un estudio prospectivo y multicéntrico que evaluó la combinación de datos morfológicos, citología y marcadores tumorales (CEA, CA 19.9, CA 72.4, CA 125 y CA 15.3)8. En nuestro estudio el análisis de los niveles del CEA mediante una curva ROC seleccionó el valor ≥419ng/ml como el punto de corte óptimo para diferenciar lesión quística mucinosa versus no mucinosa. Esta cifra se encuentra dentro del rango descrito en publicaciones previas (30-480ng/ml) para el diagnóstico de LQP mucinosas y su amplia variabilidad puede deberse a la heterogeneidad de los estudios, así como a la ausencia de un método validado del procesamiento de la muestra (dilución o no, adición de fijador,…)17,18. Por otra parte, según la literatura un CEA<5ng/ml es predictor de LQP no mucinosa en un 94%19. Esto coincide con nuestros resultados, en los que ninguno de los pacientes con niveles del CEA inferiores a 5ng/ml tenía lesiones mucinosas. Adicionalmente, se ha descrito que el aumento del CEA no se correlaciona con la malignidad de las LQP20. De este modo, en nuestro estudio tampoco hubo diferencias estadísticamente significativas en los niveles del CEA para distinguir las lesiones malignas (p=0,80).
No fue posible la medición del CEA en el 27,7% de las punciones, debido a LQP de pequeño tamaño y, por tanto, a la escasa cantidad de líquido o bien por su elevada densidad. Otros autores confirman estos hallazgos7 y reafirman las recomendaciones de las guías internaciones de puncionar una LQP con tamaño de al menos 2cm13,14. Sin embargo, cabe la posibilidad de que lesiones menores de 2cm sean tumorales. Así, en nuestros resultados 2 de las lesiones menores de 2cm fueron tumorales (un TNE y un NMPI), por lo que deberíamos ser cautos a la hora de aplicar las guías de práctica clínica e individualizar. Probablemente si la lesión mide más de 1cm, el paciente es joven o presenta algún dato morfológico de alarma (ejemplo: nódulos) debería realizarse punción para estudio citológico, aunque no se pueda determinar el CEA.
La combinación de diversos test aportan un mayor rendimiento en el diagnóstico de las LQP mucinosas como muestra la literatura8,21. Oppong et al. obtuvieron una sensibilidad, especificidad y rendimiento diagnóstico del 91, 75 y 86%, respectivamente al combinar datos morfológicos, citología y CEA en una serie de 133 pacientes21. Bick et al. diseñaron un modelo de interpretación secuencial que incluía el análisis de la citología, la tinción de mucina, el CEA y el string sign obteniendo una sensibilidad, especificidad y rendimiento diagnóstico del 88, 92 y 89%, respectivamente11. Análogamente el rendimiento diagnóstico global del presente estudio combinando citología, string sign y CEA fue del 90,9% superior a las 3 determinaciones individuales.
Respecto a las limitaciones: 1) se trata de un estudio unicéntrico en un hospital terciario en España; 2) todos los procedimientos fueron realizados por un ecoendoscopista experto con acceso a los estudios de imágenes anteriores, lo que podría haber influido en los resultados de la ecoendoscopia; 3) el tamaño muestral es reducido, si bien, es la serie más amplia publicada en el territorio nacional, y 4) se incluyen lesiones no mucinosas sin diagnóstico histológico, pero que cumplen criterios clínicos y/o radiológicos diagnósticos, similar a lo publicado previamente8,9,21.
En un intento de mejorar los resultados de la USE-PAAF se están aplicando nuevas herramientas diagnósticas para aumentar su rentabilidad. La aplicación de técnicas accesorias en la USE como el contraste22,23, los nuevos instrumentales para la obtención de la muestra como la micropinza de biopsias24, otros procedimientos endoscópicos complejos como el basado en la endomicroscopía láser confocal25 y diversos estudios moleculares avanzados como la determinación de GNAS, KRAS o miRNA26–28 podrían en un futuro ayudar en el diagnóstico de las LQP. Si bien, muchas de estas técnicas no están disponibles en la práctica clínica diaria, a diferencia de los test utilizados en nuestro estudio.
En conclusión, se evalúa la utilidad de la USE-PAAF en las LQP mediante el estudio de las características macroscópicas del líquido quístico, el CEA y la citología, así como la combinación de los 3 parámetros, para diferenciar la presencia de lesiones mucinosas frente a las no mucinosas. Hemos seleccionado el valor del CEA≥419ng/ml como el punto de corte óptimo para esta diferenciación, si bien, puede no ser extrapolable a otra población y podría ser necesario un cálculo para cada centro. Las técnicas utilizadas son sencillas y accesibles en la práctica clínica diaria, obteniendo mediante su combinación un alto rendimiento diagnóstico (91%), similar a los resultados de estudios previos realizados fuera de nuestro país, por lo que estos resultados parecen ser extrapolables a otras poblaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.