El infliximab es un anticuerpo contra el factor de necrosis tumoral alfa (TNF-α) usado en el tratamiento de la enfermedad inflamatoria intestinal (EII). Su uso está asociado a complicaciones pulmonares infecciosas e inmunológicas, entre las que se incluye la enfermedad intersticial pulmonar1.
Presentamos el caso de un varón de 54 años de edad, fumador activo, con índice paquete-año de 15 y con una enfermedad de Crohn ileocólica de 14 años de evolución. Requirió tratamiento de mantenimiento con tiopurinas durante 46 meses, que fueron suspendidas al demostrase la remisión prolongada. En los 9meses posteriores presentó un brote grave que fue tratado de inicio con metilprednisolona intravenosa. Posteriormente, se añadió infliximab biosimilar Inflectra®, azatioprina y cotrimoxazol de mantenimiento.
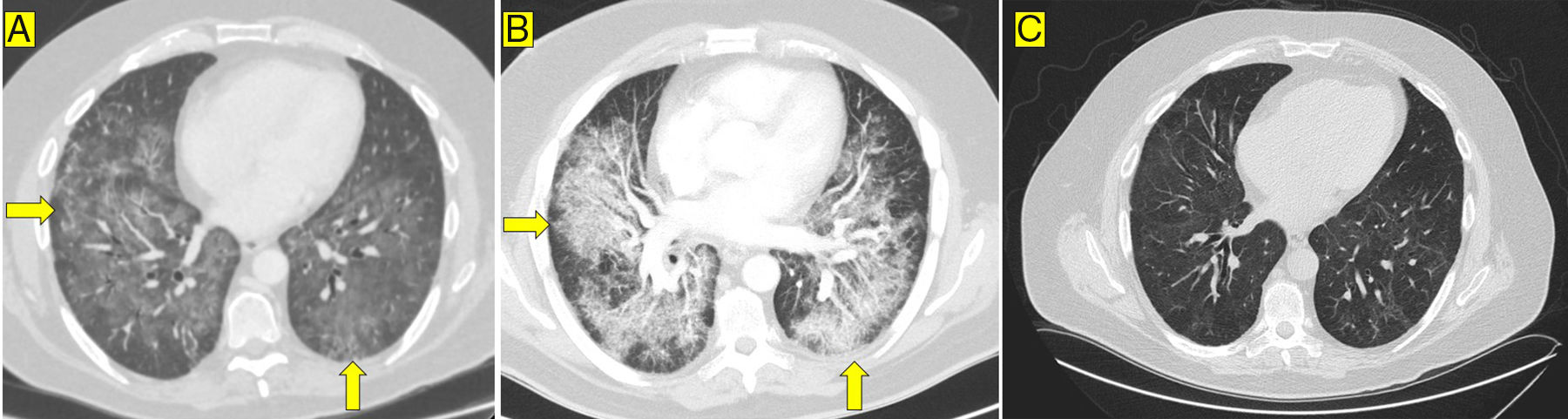
El paciente consultó por dolor torácico y disnea 18 días después de recibir la segunda dosis de infliximab. Estaba afebril, taquicárdico y taquipneico. En la gasometría arterial (oxígeno con gafas nasales a 4 l/min) presentaba: pO2 = 67mmHg, pCO2 = 37mmHg, bicarbonato = 24mM/l. En el resto de la analítica solo destacaba una proteína C reactiva =115mg/l (normal < 5mg/l), dímero-D = 900 ng/ml (normal ≤ 500 ng/ml) y factor reumatoide = 54,1 UI/ml (normal < 40). Una angiotomografía computarizada (angio-TAC) de tórax detectó defectos de repleción en las arterias pulmonares segmentarias y afectación pulmonar en mosaico difusa, bilateral y simétrica (fig. 1 A). El ecocardiograma y la ecografía Doppler de miembros inferiores fueron normales. Se inició heparina de bajo peso molecular (HBPM) 1mg/kg de peso cada 12 h. A pesar de ello, presentó un deterioro respiratorio grave que requirió ingreso en Cuidados Intensivos. Una nueva angio-TAC objetivó empeoramiento radiológico, con opacidades en vidrio deslustrado y áreas de engrosamiento septal (fig. 1 B). El estudio broncoscópico fue negativo para micobacterias, Pneumocystis jiroveci, Mycoplasma pneumoniae y Aspergillus. Con el diagnóstico de presunción de neumonitis intersticial, se añadieron piperacilina/tazobactam, cotrimoxazol y metilprednisolona por vía intravenosa.
El paciente experimentó una mejoría progresiva y fue dado de alta con metilprednisolona por vía oral, azatioprina, cotrimoxazol, HBPM y oxigenoterapia. Se suspendió el infliximab biosimilar y se prescribió vedolizumab (anticuerpo antiintegrina alfa-4 beta-7) para evitar empleo de otros fármacos anti-TNF-α. Seis meses después del alta se retiró la oxigenoterapia y desaparecieron las consolidaciones peribronquiales, persistiendo un patrón inespecífico en mosaico y unas bronquiectasias mínimas (fig. 1 C).
Ninguno de los otros medicamentos a los que el paciente estuvo expuesto durante este período se ha relacionado con el desarrollo de una enfermedad pulmonar intersticial. Por lo tanto, y dado que la reexposición sería tanto peligrosa como no ética, atribuimos el evento adverso al infliximab biosimilar.
En los pacientes con EII, las complicaciones pulmonares más frecuentes vienen derivadas del desarrollo de episodios de tromboembolia pulmonar1, puesto que sus manifestaciones extraintestinales rara vez afectan al sistema respiratorio. Otras complicaciones, como la toxicidad pulmonar por fármacos (mesalazina, metotrexato, etc.), son menos frecuentes1.
Entre las complicaciones no infecciosas del uso de infliximab se encuentra la neumonía intersticial. Aunque su incidencia es desconocida, en algunos registros se estima en torno a un 2,9%2. Es más frecuente en varones, ancianos y con antecedentes personales de enfermedad pulmonar o de uso de glucocorticoides3.
Existen pocos casos descritos de pacientes con EII y neumonitis intersticial secundaria a infliximab4 y no hemos encontrado ninguno hasta ahora asociado a infliximab biosimilar.
En España se describió una serie de 122 pacientes con enfermedad pulmonar intersticial difusa (EPID) asociado al tratamiento con anti-TNF-α, la mayoría por artritis reumatoide y casi la mitad tratados con infliximab5. La EPID apareció una media de 26 semanas tras la administración con clínica de disnea, fiebre y tos5. La mayoría de los pacientes fueron tratados con corticoides, a los que se asociaron en ocasiones otros inmunosupresores, y la tasa de mortalidad fue del 29%5.
En nuestro caso, el paciente presentó una buena evolución de la afectación pulmonar con tratamiento corticoideo, permaneciendo asintomático en la actualidad.
En conclusión, a pesar de que las complicaciones infecciosas sean las más frecuentes, se debe sospechar la afectación pulmonar inflamatoria por fármacos anti-TNF-α ante la aparición de síntomas respiratorios o de un deterioro del intercambio gaseoso. Esta complicación, descrita con el infliximab generador, puede presentarse con el infliximab biosimilar. Es importante reiterar que los pacientes que reciban fármacos anti-TNF-α, especialmente si tienen factores de riesgo, pueden desarrollar EPID, con el objeto de realizar un diagnóstico y un manejo precoz de esta complicación.
Este caso fue comunicado al SEFV por los autores.