Las lesiones premalignas gástricas constituyen un factor de riesgo para desarrollar cáncer gástrico.
ObjetivoEvaluar la utilidad de una endoscopia sistemática que incluye bicromoendoscopia para la detección de displasia en pacientes con lesiones premalignas gástricas.
Pacientes y métodosEstudio longitudinal y prospectivo de pacientes consecutivos con diagnóstico de atrofia gástrica, metaplasia intestinal o displasia remitidos para nueva valoración por endoscopia antes de los 6 meses de la endoscopia inicial. La nueva endoscopia se realizó en 3 fases: revisión exhaustiva y sistemática de toda la mucosa con toma de fotos y biopsias de las lesiones sospechosas (fase 1), bicromoendoscopia con una mezcla de ácido acético 1,2% e índigo carmín 0,5% (fase 2) y mapeo topográfico con toma de biopsias aleatorias (fase 3).
ResultadosCincuenta pacientes con diagnóstico de gastritis atrófica (n=9, 18%), metaplasia intestinal (n=38, 76%) y displasia de bajo grado (n=3, 6%). La endoscopia sistemática con bicromoendoscopia identificó más pacientes con displasia (9 versus 3, p<0,05) y se obtuvieron más biopsias con diagnóstico de displasia, tanto en lesiones visibles (6 vs. 0, p<0,05) como no visibles (6 vs. 3, p=NS). En un paciente con displasia de bajo grado inicial, esta no volvió a detectarse en la endoscopia sistemática, siendo el rendimiento global de la endoscopia de seguimiento para detectar lesiones del 92%.
ConclusionesLos pacientes con lesiones premalignas gástricas presentan lesiones sincrónicas de mayor severidad histológica que se ponen de manifiesto al realizar una endoscopia sistemática que incluye el uso de bicromoendoscopia.
Premalignant gastric lesions have an increased risk to develop gastric cancer.
ObjectiveTo evaluate the usefulness of systematic endoscopy that includes chromoendoscopy with a double dye staining technique for the detection of dysplasia in patients with premalignant gastric lesions.
Patients and methodsThis longitudinal, prospective study was performed in patients with gastric atrophy, intestinal metaplasia or dysplasia who were referred for endoscopy less than 6 months after the initial diagnosis. The second endoscopy was performed in three phases: phase 1, exhaustive and systematic review of the mucosa with photographic documentation and biopsies of suspicious areas; phase 2, chromoendoscopy with a double dye staining technique using acetic acid 1.2% and indigo carmine 0.5%; phase 3, topographic mapping and random biopsies.
ResultsA total of 50 patients were included. Nine (18%) had atrophic gastritis, 38 (76%) had intestinal metaplasia, and 3 (6%) had low-grade dysplasia. Systematic endoscopy with chromoendoscopy using a double dye staining technique detected more patients with dysplasia (9 versus 3, p<.05), and a larger number of biopsies with the diagnosis of dysplasia were obtained. This occurred for visible (6 vs. 0, p<.05) and non-visible lesions (6 vs. 3, p=NS). In one patient, initial low-grade dysplasia was not detected again in the systematic endoscopy, giving a global endoscopic performance for the detection of lesions of 92%.
ConclusionsPatients with premalignant gastric lesions have synchronous lesions with greater histological severity, which are detected when systematic endoscopy is conducted with indigo carmine dye added to acetic acid.
El cáncer gástrico (CG) es uno de los tipos de cáncer más frecuentes en el mundo1, siendo la segunda causa de muerte por cáncer a nivel mundial con unas cifras de hasta un millón de muertes anuales2. El pronóstico es bueno cuando el CG es diagnosticado en estadio precoz (es decir localizado en la mucosa o submucosa), siendo la supervivencia a los 5 años del 80%3. Por esto es muy importante realizar el diagnóstico endoscópico del CG en fases iniciales de la enfermedad.
Las lesiones premalignas del estómago constituyen un importante factor de riesgo para desarrollar CG y abarcan una variedad de condiciones tales como la gastritis crónica atrófica, metaplasia intestinal y displasia4, siendo la displasia de alto grado la que se asocia a un riesgo mayor con una OR de 405. Recientemente se ha publicado la guía europea con directrices para el diagnóstico y seguimiento de estas lesiones4,6 Ante el hallazgo de alguna de las lesiones premalignas mencionadas se recomienda una nueva endoscopia de diagnóstico y estadificación, con obtención de biopsias tanto dirigidas a las lesiones visibles como aleatorias (mapeo topográfico). Esto permite evaluar la extensión y severidad de las lesiones premalignas y el hallazgo de lesiones sincrónicas4,6. Posteriormente, se recomienda un seguimiento endoscópico con una periodicidad variable según la presencia o no de displasia y la extensión de la atrofia y/o metaplasia4. Estas recomendaciones se basan en que la displasia de bajo y alto grado pueden presentarse como lesiones endoscópicamente visibles (deprimidas o elevadas)4, pero también pueden presentarse como lesiones planas, que pueden ser aisladas o multifocales7–10.
Se han propuesto varios métodos que han demostrado mejorar la detección de lesiones endoscópicamente visibles y CG precoz como una buena limpieza de la mucosa gástrica con soluciones mucolíticas11, el examen minucioso de la mucosa gástrica12 y la cromoendoscopia con tinciones o digital13–17. La guía europea menciona utilizar el mejor método endoscópico disponible ya que no hay datos suficientes para recomendar uno de ellos.
La cromoendoscopia con índigo carmín es ampliamente utilizada en el estómago y su eficacia ha sido demostrada en numerosos estudios18. El índigo carmín se deposita sobre las zonas deprimidas de la mucosa y acentúa la detección del CG precoz de tipo deprimido18. El ácido acético, que es ampliamente utilizado en el esófago, produce un cambio en la coloración del epitelio por acetilación y desnaturalización de las proteínas, además de tener un efecto mucolítico19. La bicromoendoscopia con ácido acético e índigo carmín, es una alternativa de la que existe menos evidencia. Yamashita et al., observaron que la bicromoendoscopia permitía apreciar mucho mejor los bordes de las neoplasias gástricas y de las lesiones adenomatosas15, lesiones que no habían sido detectadas con la endoscopia convencional y cromoendoscopia con índigo carmín. Posteriormente, otros estudios han confirmado estos resultados y han demostrado que la bicromoendoscopia es superior a la endoscopia convencional y a la cromoendoscopia con índigo carmín solo para delimitar los bordes de las lesiones15-17,20,21.
Por lo anteriormente expuesto, el objetivo de nuestro estudio es evaluar la utilidad de una endoscopia sistemática que incluye bicromoendoscopia con ácido acético e índigo carmín para la detección de displasia en pacientes con lesiones premalignas gástricas.
Pacientes y métodosEntre marzo de 2014 a agosto de 2014 se incluyeron de forma consecutiva todos los pacientes con diagnóstico de atrofia gástrica, metaplasia intestinal o displasia de bajo grado que eran remitidos para nueva valoración por endoscopia antes de los 6 meses de la endoscopia inicial. Los criterios de exclusión fueron: embarazo, descompensación de enfermedad coexistente y negativa a participar en el estudio. El estudio fue aprobado por el Comité de Ética del Hospital Regional de Lambayeque.
Los procedimientos se realizaron con un gastroscopio de alta resolución (EG-250 WR5, Fujinon, Tokio) y procesador EPX 2500 (Fujinon, Tokio). La sedación fue superficial con midazolan intravenoso además de anestésico faríngeo local. Se utilizó aire para lograr una adecuada insuflación. Para conseguir una adecuada limpieza de la mucosa gástrica, 30 a 60 minutos antes se administró una solución mucolítica consistente en 600mg de acetilcisteína más 40mg de simeticona diluidos en 100ml de agua.
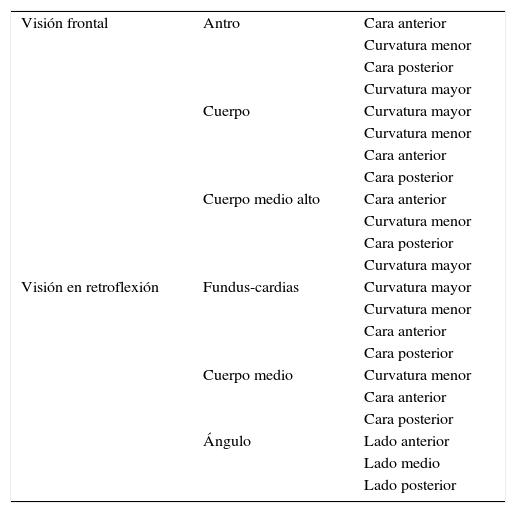
La endoscopia sistemática se realizó en 3 fases. En la fase 1, se procedió a realizar una revisión exhaustiva y sistemática de toda la mucosa gástrica según el protocolo «systematic screening protocol for the stomach»13 que consiste en una revisión secuencial de la mucosa y la toma de fotos de las diferentes áreas del estómago, tal y como se describe en la tabla 1. Las fotos se grabaron en un sistema informático y todos los vídeos fueron digitalizados para posterior revisión. Si se encontró alguna lesión sospechosa se procedió a biopsiar y rotular la muestra. En la fase 2, se procedió a realizar bicromoendoscopia con una mezcla de ácido acético 1,2% e índigo carmín 0,5% en una proporción 1:1 según el siguiente esquema: después de rociar la mucosa gástrica con la solución, se aspiró todo el aire para lograr un mayor contacto con la mucosa gástrica; después de unos 2-3 minutos se procedió a insuflar nuevamente y se aspiraron los restos de la solución; a continuación se realizó una nueva revisión de la mucosa gástrica y se tomaran biopsias de las áreas sospechosas. En la fase 3, se procedió a realizar un mapeo topográfico con toma de biopsias aleatorias de antro, ángulo y cuerpo según la recomendación de la American Society of Gastrointestinal Endoscopy6.
Protocolo de screening sistemático de la mucosa gástrica
| Visión frontal | Antro | Cara anterior |
| Curvatura menor | ||
| Cara posterior | ||
| Curvatura mayor | ||
| Cuerpo | Curvatura mayor | |
| Curvatura menor | ||
| Cara anterior | ||
| Cara posterior | ||
| Cuerpo medio alto | Cara anterior | |
| Curvatura menor | ||
| Cara posterior | ||
| Curvatura mayor | ||
| Visión en retroflexión | Fundus-cardias | Curvatura mayor |
| Curvatura menor | ||
| Cara anterior | ||
| Cara posterior | ||
| Cuerpo medio | Curvatura menor | |
| Cara anterior | ||
| Cara posterior | ||
| Ángulo | Lado anterior | |
| Lado medio | ||
| Lado posterior |
Las biopsias obtenidas fueron evaluadas por un patólogo experto y se clasificaron según el OLGA (de operative link on gastritis assessment)22.
Análisis estadísticoLas variables continuas están expresadas como media±desviación estándar y rango. El análisis univariado se realizó mediante la prueba de Chi-cuadrado de Mc Nemar. Un valor de p <0,05 fue considerado estadísticamente significativo. Se utilizó el programa estadístico SPSS V 18.
ResultadosEn total se incluyeron 50 pacientes con lesiones premalignas gástricas: 9 atrofia (18%), 38 metaplasia intestinal (76%) y 3 displasia de bajo grado (6%). La mayoría de ellos no tenían infección por Helicobacter pylori ni familiares con CG (tabla 2). El tiempo medio de la exploración fue de 23±3,6 minutos (rango 15-28). No se presentaron efectos adversos.
Características epidemiológicas de los pacientes con lesión premaligna gástrica
| Edad | 56±14 (27 -86) | |
|---|---|---|
| Sexo | Hombre | 18(34%) |
| Mujer | 32(66%) | |
| Lesión premaligna inicial | Atrofia leve | 8(16%) |
| Atrofia moderada | 1(2%) | |
| Metaplasia intestinal | 38(76%) | |
| Displasia de bajo grado | 3(6%) | |
| H. pylori inicial | Positivo | 14(28%) |
| Negativo | 36(72%) | |
| Familiar 1.er grado con cáncer gástrico | Sí | 7(14%) |
| No | 43(86%) |
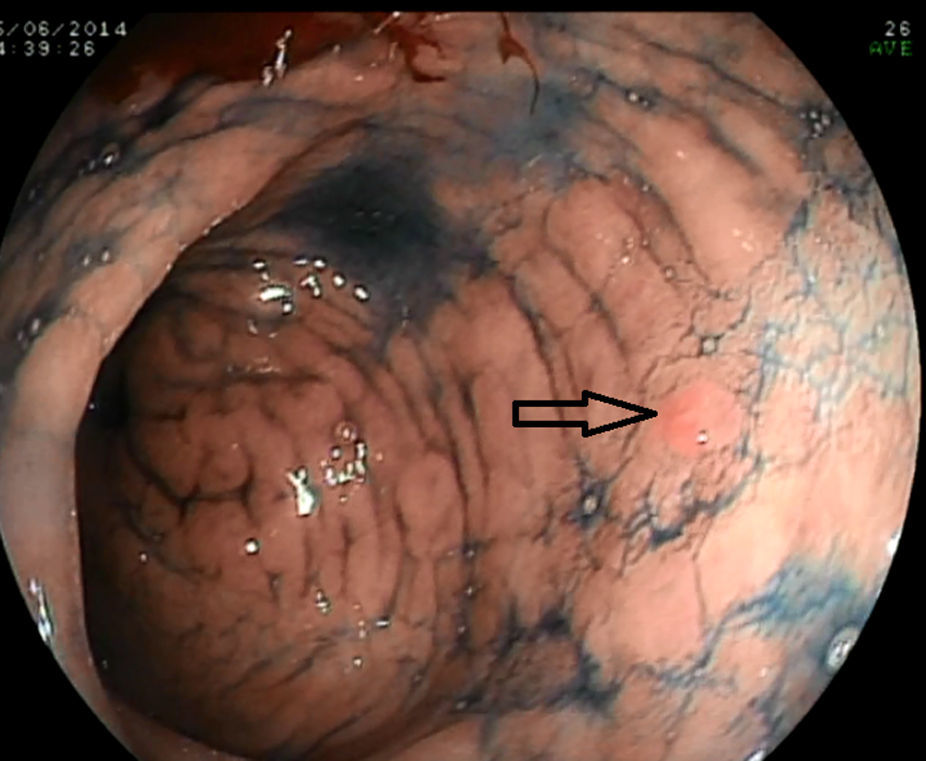
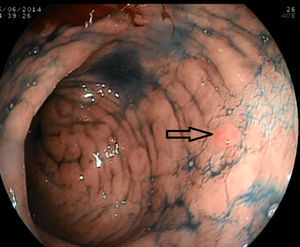
Con la endoscopia sistemática se identificaron y biopsiaron 15 lesiones visibles en las fases 1 y 2 (fig. 1) y se realizaron un total de 150 biopsias aleatorias sobre mucosa normal siguiendo el protocolo de la fase 3. En 12 ocasiones se obtuvo un diagnóstico de displasia (11 de bajo grado y uno de alto grado), y solo 6 de ellas fueron en lesiones visibles. El resultado de las 165 biopsias se detalla en la tabla 3.
Distribución de las lesiones gástricas premalignas halladas en las diferentes fases de la endoscopia sistemática
| Gastritis | Atrofia leve | Atrofia moderada | Metaplasia | DBG | DAG | Total | ||
|---|---|---|---|---|---|---|---|---|
| Endoscopia sistemática | 53 | 27 | 15 | 58 | 11 | 1 | 165 | |
| SSS* | 0 | 1 | 1 | 0 | 3 | 0 | 5 | |
| Bicromoendoscopia* | 3 | 0 | 0 | 4 | 2 | 1 | 10 | |
| Mapeo topográfico | Antro | 12 | 8 | 2 | 23 | 5 | 0 | 50 |
| Incisura | 15 | 9 | 6 | 19 | 1 | 0 | 50 | |
| Cuerpo | 23 | 9 | 6 | 12 | 0 | 0 | 50 |
DAG: displasia de alto grado; DBG: displasia de bajo grado; SSS: «screening sistemático de la mucosa gástrica».
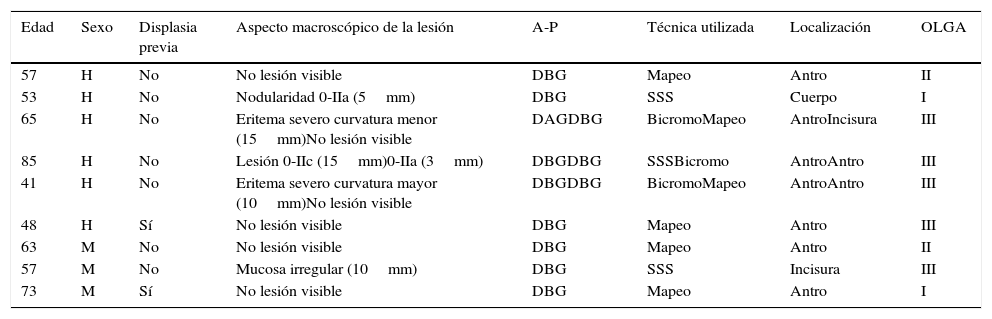
En el análisis por paciente, 46 presentaron alguna lesión que, considerando solo la de mayor severidad histológica, fueron las siguientes: 27 metaplasia intestinal (54%), 14 atrofia gástrica (28%), 8 displasia de bajo grado (16%) y una displasia de alto grado (2%). Siete de las lesiones displásicas se diagnosticaron en 7 pacientes con diagnóstico inicial de metaplasia intestinal (18,5%). En 4 pacientes (8%), la endoscopia sistemática no volvió a identificar ningún tipo de lesión (incluyendo un paciente con previa displasia de bajo grado) (tabla 4). Por tanto, el rendimiento global de la endoscopia sistemática de seguimiento para detectar lesiones fue del 92% (76% en antro, 70% en incisura y 56% en cuerpo) y la prevalencia real de displasia en esta serie de pacientes es de 20% (10 de 50 pacientes). En la tabla 5 se describen las características de los pacientes que presentaron displasia así como las características macroscópicas e histológicas de estas lesiones.
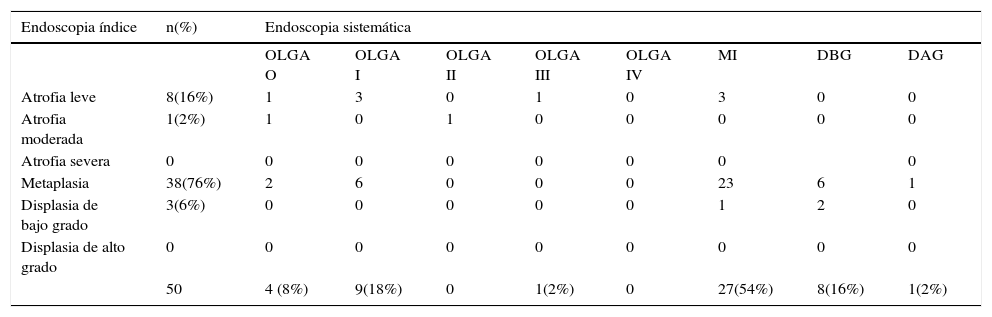
Distribución de los pacientes con lesiones premalignas en la endoscopia sistemática considerando solo la lesión de mayor severidad histológica y su relación respecto a los diagnósticos iniciales
| Endoscopia índice | n(%) | Endoscopia sistemática | |||||||
|---|---|---|---|---|---|---|---|---|---|
| OLGA O | OLGA I | OLGA II | OLGA III | OLGA IV | MI | DBG | DAG | ||
| Atrofia leve | 8(16%) | 1 | 3 | 0 | 1 | 0 | 3 | 0 | 0 |
| Atrofia moderada | 1(2%) | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| Atrofia severa | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Metaplasia | 38(76%) | 2 | 6 | 0 | 0 | 0 | 23 | 6 | 1 |
| Displasia de bajo grado | 3(6%) | 0 | 0 | 0 | 0 | 0 | 1 | 2 | 0 |
| Displasia de alto grado | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 50 | 4 (8%) | 9(18%) | 0 | 1(2%) | 0 | 27(54%) | 8(16%) | 1(2%) | |
DAG: displasia de alto grado; DBG: displasia de bajo grado; MI: metaplasia intestinal; OLGA: operative link on gastritis assessment.
Características de los pacientes y de las lesiones con displasia detectadas en la endoscopia sistemática
| Edad | Sexo | Displasia previa | Aspecto macroscópico de la lesión | A-P | Técnica utilizada | Localización | OLGA |
|---|---|---|---|---|---|---|---|
| 57 | H | No | No lesión visible | DBG | Mapeo | Antro | II |
| 53 | H | No | Nodularidad 0-IIa (5mm) | DBG | SSS | Cuerpo | I |
| 65 | H | No | Eritema severo curvatura menor (15mm)No lesión visible | DAGDBG | BicromoMapeo | AntroIncisura | III |
| 85 | H | No | Lesión 0-IIc (15mm)0-IIa (3mm) | DBGDBG | SSSBicromo | AntroAntro | III |
| 41 | H | No | Eritema severo curvatura mayor (10mm)No lesión visible | DBGDBG | BicromoMapeo | AntroAntro | III |
| 48 | H | Sí | No lesión visible | DBG | Mapeo | Antro | III |
| 63 | M | No | No lesión visible | DBG | Mapeo | Antro | II |
| 57 | M | No | Mucosa irregular (10mm) | DBG | SSS | Incisura | III |
| 73 | M | Sí | No lesión visible | DBG | Mapeo | Antro | I |
DAG: displasia de alto grado; DBG: displasia de bajo grado; OLGA: operative link on gastritis assessment; SSS: «screening sistemático de la mucosa gástrica».
En global, la endoscopia sistemática identificó más pacientes con displasia (9 vs. 3, p<0,05) y realizó más diagnósticos de displasia, tanto en lesiones visibles (6 vs. 0, p<0,05) como no visibles (6 vs. 3, p=NS).
DiscusiónLa importancia de vigilar las lesiones premalignas gástricas se debe a que constituyen un factor de riesgo para desarrollar cáncer gástrico y este riesgo depende tanto de la extensión como de la severidad de las mismas4,5. Después del diagnóstico inicial de una lesión premaligna gástrica, las guías europeas recomiendan realizar una nueva endoscopia de diagnóstico y estadificación, señalando que se debe ofrecer el mejor método endoscópico disponible para detectar otras lesiones premalignas sincrónicas, ya que ninguna técnica ha demostrado una superioridad suficiente4. Nuestro estudio es el primero que demuestra la utilidad de una endoscopia de revisión sistemática juntamente con la adición de la técnica de bicromoendoscopia con ácido acético e índigo carmín. Con esta técnica no solo detectamos más lesiones visibles sino también más pacientes con displasia y un mayor número de biopsias con diagnóstico de displasia.
Pocos estudios han evaluado un enfoque sistematizado con la utilización de varias técnicas especiales para realizar la endoscopia de vigilancia inicial. Sin embargo, se ha demostrado su utilidad en pacientes con diagnóstico histológico de adenocarcinoma sin lesión visible10. Simone et al. estudiaron 20 pacientes con hallazgo histopatológico de displasia y adenocarcinoma bien diferenciado pero sin lesiones visibles. A estos pacientes les realizaron una endoscopia que llamaron de rescate y que consistió en la utilización secuencial de FICE (Flexible Spectral Imaging Color Enhancement), cromoendoscopia con índigo carmín y magnificación, logrando encontrar en 18 pacientes lesiones visibles.
Tampoco existen datos que permitan recomendar cuánto tiempo después de la endoscopia índice debe hacerse la endoscopia de vigilancia inicial. En este sentido, un estudio reciente con pacientes que presentaron cáncer gástrico precoz teniendo una endoscopia normal antes de los dos años previos demuestra una asociación con la presencia de lesiones muy sutiles de metaplasia intestinal9. Por este motivo, los autores recomiendan un seguimiento más estricto de los pacientes con diagnóstico inicial de metaplasia intestinal. Nuestro estudio corrobora esta recomendación, ya que 7 de los 38 (18,5%) pacientes con metaplasia intestinal inicial presentaron displasia en la endoscopia sistemática.
En nuestro estudio, la endoscopia sistemática con bicromoendoscopia volvió a confirmar el diagnóstico de lesión premaligna (metaplasia, atrofia o displasia) en un 92% de los pacientes, cifra superior a la reportada por otros autores utilizando otros métodos. Así por ejemplo, De Vries23 y Singla24 lograron un rendimiento diagnóstico de 75 y 71% utilizando luz blanca y mapeo topográfico y Capelle25 de 83,7% utilizando mapeo sistemático y NBI. Estos estudios no realizaron una obtención de muestras aleatorias tan exhaustiva como recomiendan las guías actuales y este factor podría explicar la menor rentabilidad. Además, la prevalencia de CG en sus poblaciones (EE. UU. y Holanda) es menor que la de la población de Perú que constituye la muestra de nuestro estudio26,27.
Un gran problema de las endoscopias de vigilancia es que muchas veces no solo no se logra confirmar el diagnóstico previo de displasia sino que además no se identifican nuevos casos23–25. Sin embargo, en nuestro estudio, a pesar de no identificar uno de los 3 pacientes con displasia inicial, conseguimos diagnosticar 7 pacientes con displasia adicionales. Siguiendo nuestro protocolo de endoscopia sistemática, la bicromoendoscopia solo consiguió identificar 3 lesiones mientras que las biopsias aleatorias identificaron 6 áreas de displasia. Estos hallazgos confirman la importancia de biopsiar las diferentes áreas anatómicas del estómago23. De nuevo, estos resultados podrían estar influidos por tratarse de una población con alta prevalencia de CG23,27.
La morfología endoscópica de la displasia gástrica es variable y se puede presentar como lesiones visibles fácilmente identificables con luz blanca o pasar desapercibidas incluso con el uso de técnicas especiales4. En nuestro estudio encontramos que el 25% de las lesiones presentó una morfología clasificable según los criterios de Paris, 25% solo presentaron alguna anormalidad en la mucosa y 50% se presentaron endoscópicamente como gastropatía inespecífica.
El diagnóstico de lesiones displásicas tiene una especial importancia ya que condiciona el intervalo de seguimiento de estos pacientes de forma que, en los casos con metaplasia intestinal y/o gastritis atrófica, se recomienda una endoscopia de control a los 3 años y en los casos con displasia esta debe hacerse entre los 6 meses y un año según se trate de displasia de alto o bajo grado4. En nuestro estudio, el uso de una endoscopia sistemática que incluye la bicromoendoscopia permitió detectar lesiones sincrónicas de mayor severidad histológica en un 14% de los casos con el consiguiente cambio en la estrategia de seguimiento. Por el contrario, 21 pacientes (42%) en nuestra serie podrían ahorrarse las endoscopias de seguimiento ya que solo presentaron atrofia gástrica leve o moderada y/o metaplasia localizada en antro4.
Un factor importante en las gastroscopias de vigilancia con métodos avanzados es el tiempo utilizado. A diferencia de las colonoscopias de cribado28, no existen tiempos recomendados que se asocien a una mayor calidad de la exploración, pero existe un estudio que demuestra que un tiempo superior a 7 minutos permite identificar un mayor número de lesiones premalignas en pacientes con diagnóstico de dispepsia29. Algunas sociedades científicas han propuesta que la endoscopia en pacientes de alto riesgo debería durar entre 30 a 45 minutos30.
En conclusión, los pacientes con lesiones premalignas gástricas presentan lesiones sincrónicas de mayor severidad histológica que se ponen de manifiesto al realizar una endoscopia sistemática que incluye el uso de bicromoendoscopia con ácido acético e índigo carmín. Por las implicaciones prácticas que tiene en los intervalos de seguimiento de estos pacientes, creemos justificado realizar una endoscopia sistemática con bicromoendoscopia antes de los 6 meses posteriores al diagnóstico inicial de una lesión premaligna gástrica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.