La infección por Helicobacter pylori es muy frecuente entre la población española y representa la causa fundamental de gastritis crónica, úlcera péptica y cáncer gástrico. Previamente se han llevado a cabo cuatro reuniones de Consenso sobre el manejo de la infección por H. pylori en España, la última de ellas en 2016. Los cambios en los esquemas de tratamiento y la creciente evidencia disponible al respecto han justificado la organización de esta V Conferencia Española de Consenso en mayo de 2021, centrada en el tratamiento de esta infección. Participaron 14 expertos sobre el tema, que realizaron una búsqueda sistemática de la evidencia científica y elaboraron una serie de recomendaciones que fueron sometidas a un proceso de interacción de votaciones anónimas seriadas mediante metodología Delphi. Para clasificar la evidencia científica y la fuerza de las recomendaciones, se utilizó el sistema GRADE. Este consenso establece, como punto de partida, un aumento de la exigencia en la eficacia de los tratamientos recomendados, que deben alcanzar, o preferiblemente superar, el 90% de curación al ser administrados empíricamente. De este modo, tanto en primera como en segunda línea se recomiendan tratamientos cuádruples con o sin bismuto, generalmente prescritos durante 14 días. Como tratamiento de primera línea se recomienda una pauta cuádruple concomitante sin bismuto (inhibidor de la bomba de protones, claritromicina, amoxicilina y metronidazol) o una combinación cuádruple con bismuto (inhibidor de la bomba de protones, bismuto, tetraciclina y metronidazol). En el presente consenso se revisan también con detalle otras alternativas de tratamiento de rescate.
Helicobacter pylori infection is very common in the Spanish population and represents the main cause of chronic gastritis, peptic ulcer, and gastric cancer. The last iteration of Spanish consensus guidelines on H. pylori infection was conducted in 2016. Recent changes in therapeutic schemes along with increasing supporting evidence were key for developing the V Spanish Consensus Conference (May 2021). Fourteen experts performed a systematic review of the scientific evidence and developed a series of recommendations that were subjected to an anonymous Delphi process of iterative voting. Scientific evidence and the strength of the recommendation were classified using GRADE guidelines. An eradication therapy, when prescribed empirically, is considered acceptable when it reliably achieves, or preferably surpass, 90% cure rates. Currently, only quadruple therapies (with or without bismuth) and generally lasting 14 days, accomplish this goal in first- and second-line therapies. A non-bismuth quadruple concomitant regimen (proton pump inhibitor, clarithromycin, amoxicillin, and metronidazole) or a quadruple bismuth-based combination (proton pump inhibitor, bismuth, tetracycline, and metronidazole), are recommended as first-line regimens. Rescue therapies after eradication failure and management of H. pylori infection in peptic ulcer disease were also reviewed.
La infección por Helicobacter pylori (H. pylori) afecta a alrededor del 50% de la población mundial y desempeña un papel fundamental en el desarrollo de diversas enfermedades digestivas como la gastritis crónica, la úlcera péptica y el cáncer gástrico, por lo que un diagnóstico adecuado y un tratamiento eficaz son esenciales en la práctica clínica. En España, se han organizado hasta la fecha cuatro reuniones de consenso sobre la infección por H. pylori: en 19991,2, 20043,4, 20125 y, la última, en 20166. Los notables cambios acontecidos en los esquemas de tratamiento y la creciente evidencia disponible al respecto (sobre todo en nuestro medio) han justificado la organización de esta V Conferencia Española de Consenso en mayo de 2021. Dado que no se han producido avances tan relevantes en los aspectos relacionados con las indicaciones del tratamiento o las técnicas diagnósticas de la infección, esta conferencia de consenso se centrará exclusivamente en la actualización de las recomendaciones sobre el tratamiento de la infección por H. pylori.
MetodologíaParticipantes en el consenso: se invitó a participar a los investigadores españoles que durante los últimos 5 años hubieran publicado al menos 5 artículos sobre el tratamiento de la infección por H. pylori, identificados mediante la estrategia de búsqueda «Helicobacter pylori AND Spain» en PubMed. En total, 14 expertos fueron invitados, y todos ellos aceptaron, incluyendo gastroenterólogos, médicos de Atención Primaria y expertos en metodología científica y medicina basada en la evidencia. Un gastroenterólogo (JPG) actuó como coordinador. Las recomendaciones sobre el tratamiento erradicador de H. pylori del presente consenso van dirigidas y se aplican, fundamentalmente, a población adulta.
Búsquedas bibliográficas: se priorizó la identificación de revisiones sistemáticas y otros documentos de síntesis crítica de la literatura científica. Se consultaron las siguientes bases de datos electrónicas: TRIP Database, NHS National Library of Guidelines, National Guideline Clearinghouse, Cochrane Database of Systematic Reviews (The Cochrane Library), Database of Abstracts of Reviews of Effects (DARE) y MEDLINE (acceso mediante PubMed). En una segunda fase, se realizó una búsqueda de estudios individuales, ensayos clínicos aleatorizados y estudios observacionales, así como una revisión de las referencias bibliográficas de los documentos incluidos.
Clasificación de la evidencia científica y fuerza de las recomendaciones: para clasificar la evidencia científica y la fuerza de las recomendaciones, se utilizó el sistema Grading of Recommendations Assessment, Development and Evaluation Working Group (GRADE) (ht*tp://ww*w.gradeworkinggroup.org/). El sistema GRADE es una clasificación estructurada y explícita que ha sido adoptada de manera generalizada en el ámbito internacional, con la ventaja de superar las limitaciones de los sistemas previos y homogeneizar el sistema de formulación de recomendaciones7,8.
Evaluación de las recomendaciones por el grupo de consenso: las recomendaciones fueron elaboradas inicialmente por el coordinador. Posteriormente fueron sometidas a un proceso de interacción de votaciones seriadas mediante metodología Delphi9. Se realizaron dos rondas de votación telemáticas.
Para cada recomendación, los participantes puntuaron su grado de acuerdo mediante una escala de Likert de 6 grados (1: totalmente en desacuerdo; 2: bastante en desacuerdo; 3: algo en desacuerdo; 4: algo de acuerdo; 5: bastante de acuerdo; 6: totalmente de acuerdo). Cualquier valoración inferior al 6 obligaba a los evaluadores a realizar sugerencias de mejora. Tras cada votación, el coordinador revisó las recomendaciones de acuerdo con los comentarios y votos recibidos, integrando las sugerencias para maximizar el acuerdo. Una recomendación fue aprobada si más del 75% de los participantes estaba de acuerdo (puntación de 4 a 6 en la escala de Likert).
Aspectos éticos: el consenso se ajustó a las recomendaciones éticas establecidas10. Los participantes realizaron declaraciones de conflictos de intereses antes y después del proceso de votación Delphi (véase el apartado Conflicto de intereses).
Patrocinios, avales y financiación: la conferencia contó con el patrocinio científico del Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBEREHD). Este documento de consenso ha sido avalado por la Asociación Española de Gastroenterología y por la Sociedad Española de Patología Digestiva, las cuales se han adherido y dan soporte a las recomendaciones del consenso. No se ha contado con financiación por parte de la industria farmacéutica.
RecomendacionesCada recomendación se acompaña del resultado de la votación (porcentaje de acuerdo), el grado de recomendación (GR; fuerte o débil), la calidad de la evidencia (CE; alta, moderada, baja o muy baja) y de la discusión de la evidencia correspondiente.
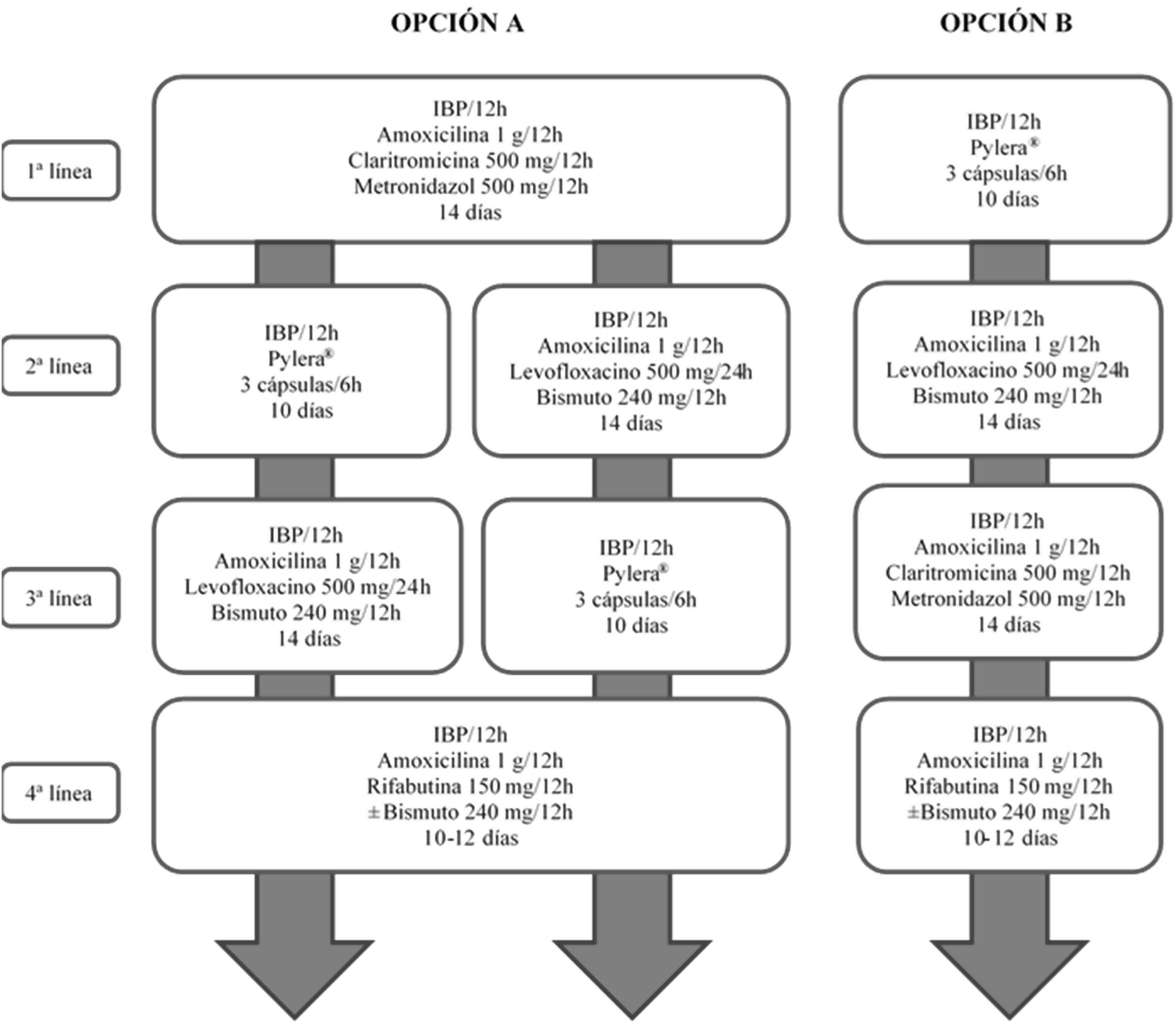
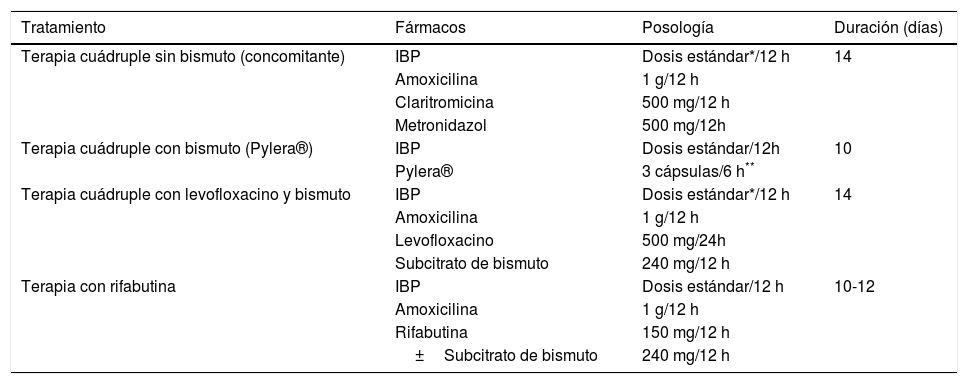
Todas las recomendaciones aprobadas en el presente consenso español sobre el tratamiento de la infección por H. pylori se incluyen en la tabla 1. Los fármacos, la duración y la dosis de cada uno de los componentes de las pautas recomendadas se encuentran desglosados en la tabla 2. Finalmente, el algoritmo de tratamiento inicial y de rescate de la infección está representado en la figura 1.
Recomendaciones sobre el tratamiento de la infección por H. pylori
| Recomendación 1. Actualmente, se recomienda que un tratamiento erradicador sea considerado efectivo cuando sea capaz de curar la infección por H. pylori en un porcentaje próximo o preferiblemente superior al 90% de los pacientes. |
| Recomendación 2. Como tratamiento de primera línea de la infección por H. pylori se recomienda una pauta cuádruple concomitante sin bismuto (IBP, claritromicina, amoxicilina y metronidazol) o una combinación cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol). |
| Recomendación 3. Se recomienda que la duración del tratamiento cuádruple concomitante sin bismuto (IBP, claritromicina, amoxicilina y metronidazol) sea de 14 días. |
| Recomendación 4. Se recomienda que la duración de la terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) sea de 10 días como mínimo. |
| Recomendación 5. En pacientes alérgicos a la penicilina se recomienda de primera línea una pauta cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol). |
| Recomendación 6. No se recomienda asociar probióticos al tratamiento erradicador. |
| Recomendación 7. Tras el fracaso de un primer tratamiento que incluya claritromicina (triple o cuádruple), se recomienda una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol). Otra alternativa es una pauta cuádruple con levofloxacino (IBP, amoxicilina, levofloxacino y bismuto). |
| Recomendación 8. Tras el fracaso de un primer tratamiento con una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol), se recomienda una pauta cuádruple con levofloxacino (IBP, amoxicilina, levofloxacino y bismuto). |
| Recomendación 9. Tratamiento de rescate en pacientes alérgicos a la penicilina: |
| a) Tras el fracaso de un primer tratamiento triple (IBP, claritromicina y metronidazol), se sugiere emplear una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol). |
| b) Tras el fracaso de un primer tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol), se sugiere una terapia cuádruple con IBP, levofloxacino, claritromicina y bismuto. |
| Recomendación 10. Tras el fracaso de un primer tratamiento con claritromicina y una segunda línea con levofloxacino, se recomienda un tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol). |
| Recomendación 11. Tras el fracaso de un primer tratamiento con claritromicina y una segunda línea cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol), se recomienda un tratamiento cuádruple con levofloxacino (IBP, amoxicilina, levofloxacino y bismuto). |
| Recomendación 12. Tras el fracaso de un primer tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) y una segunda línea con levofloxacino, se sugiere un tratamiento cuádruple concomitante (IBP, amoxicilina, claritromicina y metronidazol). |
| Recomendación 13. Tras el fracaso de un tercer tratamiento, se sugiere reevaluar cuidadosamente la necesidad de erradicar la infección y, en su caso, pautar una cuarta línea con rifabutina. |
| Recomendación 14. En los pacientes con úlcera duodenal no complicada que no requieren antiinflamatorios no esteroideos/aspirina, no se recomienda mantener el tratamiento antisecretor tras haber finalizado el tratamiento erradicador de H. pylori. |
| Recomendación 15. En los pacientes con úlcera gástrica que no requieren antiinflamatorios no esteroideos/aspirina, se recomienda mantener el tratamiento antisecretor durante cuatro a ocho semanas tras haber finalizado el tratamiento erradicador de H. pylori. |
| Recomendación 16. En los pacientes con hemorragia digestiva por úlcera péptica la erradicación de H. pylori elimina la práctica totalidad de las recidivas; por tanto, una vez confirmada la erradicación y en ausencia de toma de antiinflamatorios no esteroideos/aspirina, se recomienda no administrar tratamiento de mantenimiento con antisecretores. |
Fármacos, dosis y duración de los tratamientos erradicadores de H. pylori recomendados
| Tratamiento | Fármacos | Posología | Duración (días) |
|---|---|---|---|
| Terapia cuádruple sin bismuto (concomitante) | IBP | Dosis estándar*/12 h | 14 |
| Amoxicilina | 1 g/12 h | ||
| Claritromicina | 500 mg/12 h | ||
| Metronidazol | 500 mg/12h | ||
| Terapia cuádruple con bismuto (Pylera®) | IBP | Dosis estándar/12h | 10 |
| Pylera® | 3 cápsulas/6 h** | ||
| Terapia cuádruple con levofloxacino y bismuto | IBP | Dosis estándar*/12 h | 14 |
| Amoxicilina | 1 g/12 h | ||
| Levofloxacino | 500 mg/24h | ||
| Subcitrato de bismuto | 240 mg/12 h | ||
| Terapia con rifabutina | IBP | Dosis estándar/12 h | 10-12 |
| Amoxicilina | 1 g/12 h | ||
| Rifabutina | 150 mg/12 h | ||
| ±Subcitrato de bismuto | 240 mg/12 h |
IBP: inhibidor de la bomba de protones.
El beneficio de administrar IBP de última generación (rabeprazol o esomeprazol) y la utilización de doble dosis de IBP no está claramente establecido, a diferencia de lo que ocurre con el tratamiento triple estándar; sin embargo, es posible que estas optimizaciones añadan también beneficios erradicadores a estas pautas terapéuticas68.
Aunque esta es la dosis incluida en ficha técnica, un estudio reciente basado en los datos del Registro Europeo de Helicobacter pylori (Hp-EuReg) sugiere que la dosis de 4 cápsulas/8h podría tener una similar efectividad y tolerancia264.
Debido a que la ventaja de guiar la terapia erradicadora mediante el estudio de la susceptibilidad antimicrobiana de H. pylori frente a la administración empírica del tratamiento no ha sido suficientemente confirmada11–14, y a que este estudio no es generalmente accesible15,16, los comentarios incluidos en este documento de consenso se han basado en el supuesto de que dicha susceptibilidad individual (del paciente concreto) es desconocida. No obstante, parece razonable recomendar la realización de pruebas de susceptibilidad (cultivo o PCR) de forma rutinaria, incluso antes de prescribir un tratamiento erradicador de primera línea, en centros especializados con interés en el manejo de la infección por H. pylori. En cualquier caso, el ámbito de aplicación del presente consenso se circunscribe al territorio español y a otras áreas geográficas que presenten una similar frecuencia de resistencias antibióticas a los fármacos recomendados, especialmente a claritromicina, metronidazol y levofloxacino.
Recomendación 1. Actualmente, se recomienda que un tratamiento erradicador sea considerado efectivo cuando sea capaz de curar la infección por H. pylori en un porcentaje próximo o preferiblemente superior al 90% de los pacientes.
Acuerdo 100%; votos: totalmente de acuerdo (85,7%); bastante de acuerdo (14,3%). GR: fuerte. CE: muy baja.
El objetivo de la terapia dirigida a eliminar cualquier microorganismo debería ser alcanzar un éxito del 100%, y la infección por H. pylori no debe ser una excepción17. Sin embargo, en todos los consensos europeos18–21 y españoles2,4,5 iniciales se había establecido que una tasa de curación igual o superior al 80% podía ser considerada suficiente. Dado que actualmente disponemos de terapias antibióticas con tasas de curación próximas o incluso superiores al 90% para la mayoría de las infecciones bacterianas, se ha considerado que este umbral de eficacia –aunque arbitrario– debería ser también el exigido para considerar como efectivo un tratamiento frente a la infección por H. pylori, tanto de primera línea como de rescate (si bien es cierto que en los tratamientos de segunda línea y sucesivas este umbral puede ser más difícil de alcanzar). Estas cifras de erradicación (≥90%) se refieren al análisis por «intención de tratar» (ITT), es decir, considerando el peor escenario (penalizado por el posible incorrecto cumplimiento del tratamiento por parte del paciente) y no solo teniendo en cuenta los ensayos clínicos sino también, y fundamentalmente, los estudios de práctica clínica. Para conseguir este objetivo, todos los tratamientos deben estar optimizados en términos de duración, dosis e intervalo de administración de los inhibidores de la bomba de protones (IBP) y antibióticos22,23 (fig. 1).
Recomendación 2. Como tratamiento de primera línea de la infección por H. pylori se recomienda una pauta cuádruple concomitante sin bismuto (IBP, claritromicina, amoxicilina y metronidazol) o una combinación cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: moderada.
La elección del tratamiento de primera línea para la infección por H. pylori dependerá primordialmente de la tasa de resistencia de esta bacteria a los antibióticos prescritos24. No se recomienda la terapia triple clásica (IBP, claritromicina y amoxicilina) cuando la tasa de resistencia a claritromicina sea mayor del 15%25, dado que por encima de este umbral las cifras de erradicación son inaceptablemente bajas22. Otros factores que influyen sobre la eficacia del tratamiento erradicador son la adhesión por parte del paciente y su historial previo de consumo de antibióticos, que podría condicionar la elección de la primera opción terapéutica22,26,27. A continuación, se revisa la evidencia disponible respecto de las potenciales pautas de tratamiento de primera línea.
Terapia triple (IBP, claritromicina y amoxicilina)La eficacia media de la terapia triple en nuestro país fue del 80% y 70% en dos revisiones sistemáticas publicadas en 2011 y 201328,29. La eficacia de dicho tratamiento en los estudios publicados posteriormente en España ha sido habitualmente inferior al 75%30–34. El Registro Europeo de H. pylori (Hp-EuReg) nos proporciona información de gran interés a este respecto; en dicho registro, en el que se evalúa el manejo de la infección por H. pylori por los gastroenterólogos europeos, participan más de 300 investigadores procedentes de 30 países35. Al analizar los datos españoles de este registro, que incluyó aproximadamente 3.000 pacientes desde el año 2013 al 2020, se comprobó cómo la tasa de erradicación alcanzada con el tratamiento triple con claritromicina fue de tan solo el 80%, en el análisis por ITT «modificado»36 (este análisis pretende obtener un resultado lo más cercano posible al de la práctica clínica, incluyendo para ello a todos los pacientes que completan el seguimiento y en los que se realiza una prueba confirmatoria del éxito erradicador, independientemente del cumplimiento del tratamiento; en adelante, cuando se mencionen los resultados del Hp-EuReg, nos referiremos siempre a este análisis). A pesar de estos pobres resultados, dicho tratamiento continúa siendo empleado con cierta frecuencia en España (y en Europa37), especialmente en el contexto de la Atención Primaria38. El empleo de vonoprazan (un inhibidor competitivo de la bomba de H+/K+ ATPasa), en lugar de un IBP, se asocia con un incremento notable de la eficacia del tratamiento triple (e incluso del tratamiento dual únicamente con claritromicina)39–44, pero los estudios son aún escasos y no existe experiencia con este fármaco en nuestro medio, donde todavía no está comercializado.
Con respecto a la tasa media de resistencia a claritromicina en España, esta era del 14% en 200945 y del 17-18% en revisiones más actualizadas27,29. Un reciente estudio español ha evidenciado una tasa de resistencia a claritromicina del 34% en niños46, mientras que en adultos las cifras publicadas en estudios recientes han sido de aproximadamente el 20%47–50. En conjunto, toda esta evidencia apunta a continuar con la recomendación de no prescribir la terapia triple como tratamiento de primera línea en España, especialmente cuando existen en la actualidad alternativas terapéuticas capaces de obtener tasas de curación significativamente mejores51; entre ellas se encuentran las terapias cuádruples con o sin bismuto, que se revisarán a continuación.
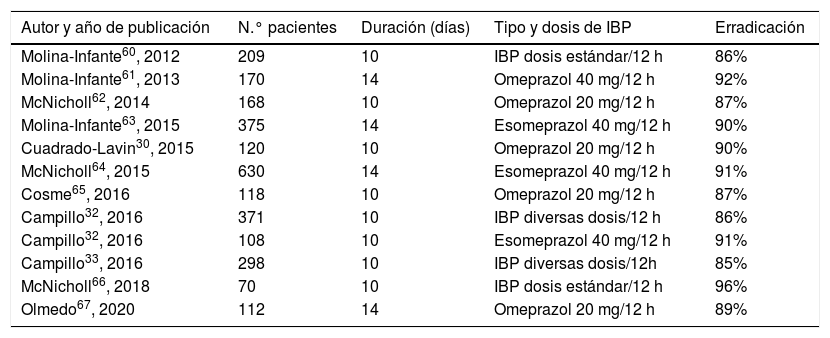
Terapias cuádruples sin bismuto (IBP, amoxicilina, claritromicina y metronidazol)La eficacia de las terapias cuádruples sin bismuto dependerá fundamentalmente de la tasa de resistencia dual (a la vez) a claritromicina y a metronidazol22. El tratamiento denominado «concomitante» es el cuádruple sin bismuto más efectivo en situaciones de alta resistencia. Se ha estimado que el tratamiento secuencial, híbrido y concomitante conseguirán tasas de curación>90% cuando esta tasa de resistencia doble esté por debajo del 5%, 9% y 15%, respectivamente. En nuestro medio la tasa de resistencia dual se mantiene aún por debajo del 15%. Diversos estudios llevados a cabo con el tratamiento concomitante en muy diversos países han demostrado una eficacia próxima o superior al 90% en el análisis por ITT52–54. Una reciente revisión sistemática y metaanálisis que ha incluido 107 estudios (55 de ellos aleatorizados) y casi 30.000 pacientes, ha calculado una eficacia media del tratamiento concomitante de aproximadamente el 90% (con buenos resultados incluso en presencia de resistencia a claritromicina o metronidazol), con resultados superiores al tratamiento triple estándar y al secuencial55. No obstante, en determinadas regiones de Europa y Asia, con tasas de resistencia a claritromicina y metronidazol muy superiores, la eficacia del tratamiento concomitante ha sido subóptima56–59. Los resultados obtenidos con este tratamiento cuádruple concomitante en diversos estudios llevados a cabo en España se resumen en la tabla 3, constatándose una eficacia erradicadora media de aproximadamente el 90%30,32,33,60–67. Al considerar los estudios españoles que prescriben este tratamiento durante 14 días, las tasas de erradicación oscilan entre el 89% y el 92%, resultando significativamente superiores a las obtenidas por la triple terapia clásica optimizada y prolongada hasta las dos semanas (81%)63. Estos favorables resultados se han descrito no solo cuando la prescripción ha sido realizada por gastroenterólogos sino también en el contexto de la Atención Primaria67. Finalmente, los datos del Hp-EuReg han confirmado los excelentes resultados del tratamiento concomitante, tanto en Europa en general68,69 como en España en particular36, con tasas de erradicación (por ITT) superiores al 90% en ambos casos (si el tratamiento se prescribía durante 14 días, que como más adelante se especifica, se considera la duración adecuada).
Estudios que han evaluado la eficacia de la terapia cuádruple sin bismuto concomitante de primera línea en España
| Autor y año de publicación | N.° pacientes | Duración (días) | Tipo y dosis de IBP | Erradicación |
|---|---|---|---|---|
| Molina-Infante60, 2012 | 209 | 10 | IBP dosis estándar/12 h | 86% |
| Molina-Infante61, 2013 | 170 | 14 | Omeprazol 40 mg/12 h | 92% |
| McNicholl62, 2014 | 168 | 10 | Omeprazol 20 mg/12 h | 87% |
| Molina-Infante63, 2015 | 375 | 14 | Esomeprazol 40 mg/12 h | 90% |
| Cuadrado-Lavin30, 2015 | 120 | 10 | Omeprazol 20 mg/12 h | 90% |
| McNicholl64, 2015 | 630 | 14 | Esomeprazol 40 mg/12 h | 91% |
| Cosme65, 2016 | 118 | 10 | Omeprazol 20 mg/12 h | 87% |
| Campillo32, 2016 | 371 | 10 | IBP diversas dosis/12 h | 86% |
| Campillo32, 2016 | 108 | 10 | Esomeprazol 40 mg/12 h | 91% |
| Campillo33, 2016 | 298 | 10 | IBP diversas dosis/12h | 85% |
| McNicholl66, 2018 | 70 | 10 | IBP dosis estándar/12 h | 96% |
| Olmedo67, 2020 | 112 | 14 | Omeprazol 20 mg/12 h | 89% |
Tasas de erradicación «por intención de tratar».
IBP: inhibidor de la bomba de protones.
Respecto a la terapia secuencial (IBP junto con amoxicilina durante los primeros 5-7 días, seguido de IBP junto con claritromicina y metronidazol durante los últimos 5-7 días), diversos estudios y metaanálisis han puesto de manifiesto que no es superior a la terapia triple de 14 días de duración70–74. Por otra parte, el tratamiento concomitante es significativamente superior al secuencial cuando ambos son pautados con una duración similar54. Además, se han publicado resultados subóptimos con la pauta secuencial en nuestro medio62,75,76. Por tanto, actualmente se desaconseja el empleo de la terapia secuencial.
En resumen, como tratamiento de primera línea de la infección por H. pylori en España se recomienda, como una de las opciones, una pauta cuádruple concomitante sin bismuto. La duración y la dosis de sus componentes (esto es, IBP, claritromicina, amoxicilina y metronidazol) se resumen en la tabla 2. Para más detalles acerca de la duración del tratamiento concomitante, véase la recomendación 3.
Terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol)La terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) representa una alternativa válida al tratamiento cuádruple sin bismuto, dado que está constituida por fármacos, como el bismuto y la tetraciclina, frente a los que H. pylori nunca o solo excepcionalmente es resistente77. Por otra parte, la resistencia a metronidazol puede ser parcialmente compensada mediante el uso prolongado, a intervalos cortos y con dosis altas de este antibiótico77.
Tres metaanálisis llevados a cabo en la última década han coincidido en subrayar que el tratamiento cuádruple con bismuto (eficacia media 81%, 78%, 77%) no aporta ninguna ventaja sobre el tratamiento triple78–80. Sin embargo, la terapia cuádruple con bismuto fue prescrita solo durante 7 días en los estudios en los que se basan estos metaanálisis, y además fueron publicados hace una década o más, cuando las tasas de resistencia a claritromicina (que penalizan la eficacia de la triple terapia) eran considerablemente menores. De hecho, un ensayo clínico multicéntrico, realizado entre 2013 y 2016, en un área geográfica con elevada resistencia a claritromicina, concluyó que la terapia cuádruple con bismuto administrada durante 10 días era superior a la triple clásica de 14 días (eficacia de 90% vs. 84%)81.
La experiencia en España y en otros países con el tratamiento cuádruple con bismuto convencional ha estado limitada por la falta de disponibilidad de la tetraciclina clorhidrato, y por el hecho de que la doxiciclina (que sí está comercializada) se asocia con peores resultados82. La reciente comercialización de Pylera® (una cápsula que contiene bismuto, tetraciclina y metronidazol), ha permitido de nuevo la prescripción de esta combinación terapéutica. Un ensayo multicéntrico europeo demostró, inicialmente, buenos resultados con Pylera® administrada durante 10 días, alcanzando una eficacia por ITT (basada en el resultado de una prueba del aliento) del 90%, significativamente superior a la de la terapia triple83. Posteriormente se han publicado numerosos estudios, que han sido compendiados en un reciente metaanálisis, demostrando que el tratamiento con Pylera® de primera línea (21 estudios incluidos) alcanzaba una eficacia erradicadora (por ITT) del 90%84. Estos resultados se obtuvieron independientemente del tipo y dosis del IBP e incluso en pacientes infectados por cepas de H. pylori resistentes a claritromicina o a metronidazol84. De hecho, la elevada eficacia de este esquema de tratamiento de primera línea (próxima o superior al 90%) ha sido demostrada en dos recientes estudios llevados a cabo en China y Tailandia85,86, países con una muy elevada tasa de resistencia a claritromicina (del 50% aproximadamente). La tolerancia de este tratamiento es aceptable: aunque la incidencia de efectos adversos es relativamente elevada (como ocurre con todas las terapias erradicadoras87), la mayoría son leves, y solo excepcionalmente obligan a la suspensión del tratamiento36,84,88.
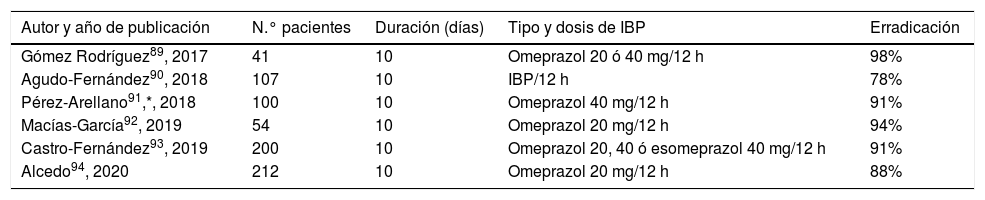
Los resultados obtenidos con Pylera® en diversos estudios llevados a cabo en España se resumen en la tabla 4, constatándose una eficacia media de aproximadamente el 90%89–94. Los datos del Hp-EuReg han confirmado estos excelentes resultados, tanto en Europa en general88 como en España en particular36 (actualmente con más de 2.500 pacientes tratados con Pylera®), obteniendo tasas de erradicación superiores al 90%. Una actualización muy reciente de dicho registro, incluyendo en este caso a más de 5.000 pacientes, ha confirmado una vez más estos hallazgos (erradicación del 94% por ITT, como tratamiento de primera línea)95.
Estudios que han evaluado la eficacia de la terapia con Pylera® de primera línea en España
| Autor y año de publicación | N.° pacientes | Duración (días) | Tipo y dosis de IBP | Erradicación |
|---|---|---|---|---|
| Gómez Rodríguez89, 2017 | 41 | 10 | Omeprazol 20 ó 40 mg/12 h | 98% |
| Agudo-Fernández90, 2018 | 107 | 10 | IBP/12 h | 78% |
| Pérez-Arellano91,*, 2018 | 100 | 10 | Omeprazol 40 mg/12 h | 91% |
| Macías-García92, 2019 | 54 | 10 | Omeprazol 20 mg/12 h | 94% |
| Castro-Fernández93, 2019 | 200 | 10 | Omeprazol 20, 40 ó esomeprazol 40 mg/12 h | 91% |
| Alcedo94, 2020 | 212 | 10 | Omeprazol 20 mg/12 h | 88% |
Tasas de erradicación «por intención de tratar».
IBP: inhibidor de la bomba de protones.
Finalmente, un metaanálisis muy reciente ha compendiado los ensayos clínicos que comparaban, en primera línea, el tratamiento cuádruple con bismuto frente al concomitante (10 estudios, aunque no todos empleaban las pautas estándar de estos regímenes) y ha demostrado una similar eficacia y seguridad con ambas terapias96. En particular, un estudio prospectivo (aunque no aleatorizado) español ha comparado estas dos pautas (Pylera® durante 10 días frente a concomitante durante 14 días) y ha evidenciado tasas de erradicación semejantes (94% y 98%, respectivamente), con una similar tolerancia92. Otro estudio español más reciente, también prospectivo (aunque no aleatorizado), ha confirmado de nuevo que ambos tratamientos (Pylera® y concomitante) son equivalentes (tasas de erradicación del 88% y 86%, respectivamente)94.
Una variante de tratamiento cuádruple con bismuto consiste en la adición de este fármaco a la triple terapia clásica (es decir, la combinación de un IBP, claritromicina, amoxicilina y bismuto), con el que se han obtenido buenos resultados en algunos estudios23. No obstante, la experiencia con este tratamiento en nuestro medio es muy limitada (se ha publicado un único estudio en España97) y los resultados en otros países no siempre han sido tan alentadores23.
En resumen, el tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol), y en particular empleando la formulación de Pylera®, puede considerarse actualmente una alternativa válida de primera elección, junto con el tratamiento concomitante. La duración y la dosis de sus componentes se resumen en la tabla 2. Para más detalles acerca de la duración del tratamiento, véase la recomendación 4.
Recomendación 3. Se recomienda que la duración del tratamiento cuádruple concomitante sin bismuto (IBP, claritromicina, amoxicilina y metronidazol) sea de 14 días.
Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: moderada.
La terapia cuádruple concomitante sin bismuto, desarrollada a finales de los años 90, fue diseñada inicialmente para reducir la duración del tratamiento erradicador53. De hecho, los estudios iniciales provenientes de Alemania y Japón sugerían que una duración de 3 a 5 días podría ser suficiente para alcanzar tasas de curación aceptables98,99. Sin embargo, más recientemente, diversos ensayos clínicos que han comparado esta terapia con diferentes duraciones han demostrado tasas de curación superiores con los tratamientos más largos: 3 días (81%) vs. 5 días (89%)100; 5 días (87%) vs. 7 días (90%)101; 5 días (89%) vs. 10 días (96%)102; 5 días (78%) vs. 14 días (86%)103; 10 días (80%) vs. 14 días (96%)104. En un reciente estudio español, no aleatorizado, un tratamiento concomitante con una duración de 14 días (y con dosis altas de IBP) fue superior a otro con una duración de 10 días (y con dosis estándar de IBP; 87% vs. 91%, p<0,01)64. Acorde con ello, el primer metaanálisis que se publicó sobre esta terapia puso de manifiesto que la eficacia del tratamiento concomitante era dependiente de su duración52. En este sentido, en el Hp-EuReg se administró tratamiento concomitante a 4.164 pacientes, confirmándose una mayor tasa de erradicación con los regímenes de 14 frente a 10 días (92% vs. el 88%)68. Por último, esta misma tendencia puede observarse en la experiencia colectiva española obtenida en los últimos años, donde los tratamientos de 14 días son los únicos que de manera consistente han alcanzado (o incluso superado) el umbral de eficacia del 90% (tabla 3).
En resumen, actualmente se recomienda que la duración del tratamiento cuádruple concomitante sea de 14 días.
Recomendación 4. Se recomienda que la duración de la terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) sea de 10 días como mínimo.
Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: moderada.
Se ha sugerido que un tratamiento cuádruple con bismuto de 10 días sería altamente eficaz frente a cepas sensibles a metronidazol, pero es posible que un tratamiento de 14 días sea más eficaz que el de 10 frente a microorganismos resistentes a este antibiótico85. Sin embargo, diversos estudios han sugerido que la duración de 10 días podría ser suficiente, como se revisa a continuación.
En un metaanálisis publicado en el año 2004 sobre diferentes tratamientos erradicadores, se observó que la eficacia de la terapia cuádruple con bismuto administrada durante 1-3, 4 y 7 días fue inferior comparada con una duración de 10 a 14 días105. De igual manera, se constató que una duración igual o superior a 10 días alcanzaba tasas de curación superiores al 85%, incluso en regiones con elevada prevalencia de resistencia a metronidazol105. Hasta la fecha, existe un único estudio (incluyendo 417 pacientes) que compare directamente la terapia cuádruple con bismuto con una duración de 10 y 14 días, sin encontrar diferencias entre ambas pautas (92% vs. 93%)106.
Por otra parte, en los últimos años se han obtenido excelentes resultados con la presentación de la cuádruple terapia con bismuto en cápsula única (Pylera®), cuya formulación comercial implica su prescripción durante 10 días. Así, un metaanálisis reciente que incluyó 30 estudios y más de 6.000 pacientes tratados con Pylera® durante 10 días, constató una eficacia (por ITT) del 90% en primera línea84. En ocho estudios se pudo estimar la proporción de pacientes con resistencia a claritromicina o metronidazol, y Pylera® fue altamente eficaz a pesar de la presencia de dichas resistencias84.
Por último, el Hp-EuReg ha analizado recientemente la efectividad de Pylera® (10 días) en la práctica clínica en diversos países europeos (principalmente España, Italia y Portugal), donde se evaluaron 2.100 pacientes88. La eficacia (por ITT) fue del 95% en primera línea, 89% en segunda línea y 92% en el tratamiento de rescate de tercera a sexta líneas88. Aunque únicamente se realizó cultivo para evaluar la resistencia antibiótica en 48 casos, Pylera® fue eficaz (>90%) también en aquellos pacientes con cepas de H. pylori resistentes a claritromicina o metronidazol, o a ambos88. Una actualización muy reciente de este registro europeo ha incluido a más de 5.000 pacientes tratados con esta terapia cuádruple con bismuto en cápsula única durante 10 días y ha confirmado las excelentes tasas de erradicación (por ITT): 94% como tratamiento de primera línea, 90% en segunda línea y 86% en líneas de tratamiento posteriores95.
Lamentablemente, no existen estudios que comparen directamente el tratamiento cuádruple con bismuto clásico (con sus componentes por separado) y Pylera® (en cápsula única), ni entre diferentes duraciones (10 vs. 14) de esta última presentación. Por tanto, son necesarios estudios comparativos que evalúen la eficacia, seguridad y coste de distintas pautas para aclarar la duración ideal de la terapia cuádruple con bismuto, en especial dependiendo del patrón de resistencias a metronidazol. Mientras tanto, parece prudente recomendar que la duración de este tratamiento sea como mínimo de 10 días.
Recomendación 5. En pacientes alérgicos a la penicilina se recomienda de primera línea una pauta cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: moderada.
La amoxicilina es uno de los agentes antimicrobianos más eficaces contra H. pylori y, por tanto, muchos de los tratamientos erradicadores incluyen este antibiótico. Hasta el momento, la experiencia con la terapia erradicadora en los pacientes alérgicos a la penicilina es escasa, aunque en la práctica clínica esta circunstancia está presente con relativa frecuencia. No obstante, es preciso tener en cuenta que únicamente una minoría de los pacientes que refieren antecedentes (teóricos) de alergia a la penicilina tienen realmente evidencia de hipersensibilidad inmunomediada, y por ello es fundamental su confirmación fehaciente107.
En los pacientes con alergia a los betalactámicos, tradicionalmente se ha recomendado un tratamiento triple con IBP, claritromicina y metronidazol21. En un metaanálisis realizado hace más de 20 años, el tratamiento con IBP, claritromicina y nitroimidazol se consideró relativamente efectivo, con tasas medias de erradicación por encima del 80%108. Sin embargo, en un estudio prospectivo español se administró este régimen durante 7 días a 12 pacientes alérgicos a la penicilina y se obtuvo una tasa de erradicación (por ITT) de tan solo el 58%109. En otro estudio español posterior, en este caso multicéntrico, se alcanzaron cifras de erradicación tan bajas como del 55% al emplear este mismo tratamiento en 50 pacientes110. Las desalentadoras cifras de curación (<60%) en los estudios españoles mencionados anteriormente109,110 podrían ser debidas, al menos en parte, al reciente aumento de las tasas de resistencia tanto a claritromicina como a metronidazol29,45,111.
Por otra parte, dos grupos de investigadores evaluaron hace ya unos años la eficacia de un régimen con IBP, tetraciclina y metronidazol durante 10 días en 5 y 17 pacientes con alergia a la penicilina, obteniendo tasas de erradicación (por ITT) del 80-85%112,113. Estos alentadores resultados sugirieron que esta combinación triple (o mejor aún, con la adición de bismuto, que resultaría en un régimen cuádruple), podría ser una mejor alternativa para el tratamiento de primera línea en presencia de alergia a la penicilina (principalmente en áreas con alta resistencia a metronidazol o claritromicina). Esto sería así, probablemente, debido a que el efecto negativo de la resistencia a metronidazol se supera por la coadministración de bismuto114 y porque la eficacia de este régimen no está influenciada por la resistencia a claritromicina83.
En este sentido, recientemente se han actualizado los resultados de un estudio multicéntrico español, prospectivo, en el que se administró a 267 pacientes alérgicos a la penicilina un tratamiento de primera línea con IBP, claritromicina y metronidazol durante 7 días o con IBP, bismuto, tetraciclina y metronidazol durante 10 días115. La tasa de erradicación (por ITT) con la terapia triple fue de tan solo el 57%, siendo claramente mayor con el régimen cuádruple (74%). La adhesión al tratamiento fue del 94% y 98%, respectivamente. Se describieron un 14% de efectos adversos con ambos regímenes (todos leves). Por lo tanto, se concluyó que, a pesar de que en zonas de baja resistencia a claritromicina quizá podría prescribirse una combinación triple con IBP, claritromicina y metronidazol en pacientes alérgicos a la penicilina, la terapia cuádruple con bismuto debería preferirse en áreas, como España, con alta resistencia a claritromicina.
En la misma línea, recientemente se han publicado los resultados de un estudio del Hp-EuReg específicamente dirigido a analizar la experiencia en los pacientes –más de 1.000– alérgicos a la penicilina116. En primera línea, la efectividad de la combinación de un IBP, claritromicina y metronidazol fue de tan solo el 69%, mientras que la terapia cuádruple con bismuto (ya fuera en su formato clásico o con la cápsula única de Pylera®) alcanzó el 91%.
Finalmente, Liang et al. aleatorizaron a 109 pacientes alérgicos a la penicilina a recibir una terapia cuádruple clásica con bismuto (IBP, bismuto, tetraciclina y metronidazol) o un régimen cuádruple con bismuto modificado (IBP, bismuto, tetraciclina y furazolidona)117. Las tasas de erradicación (por ITT) fueron, respectivamente, del 88% y del 92%, apoyando la efectividad de los regímenes cuádruples que contienen bismuto en pacientes alérgicos a la penicilina.
En resumen, en pacientes alérgicos a la penicilina se recomienda, en nuestro medio, emplear como primera línea una pauta cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
Recomendación 6. No se recomienda asociar probióticos al tratamiento erradicador.
Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: baja.
Los probióticos son microorganismos vivos que, administrados en unas cantidades adecuadas, pueden conferir efectos beneficiosos para la salud. A pesar de que existen algunas evidencias a favor de la utilidad clínica de determinados probióticos, la última Guía de Práctica Clínica de la Asociación Americana de Gastroenterología solo recomienda su uso en la prevención de la diarrea por Clostridioides difficile y la enterocolitis necrosante del recién nacido pretérmino118. No obstante, la heterogeneidad en la metodología de los estudios y la variabilidad de las cepas implicadas, probablemente agrupadas de forma inadecuada en muchos casos, podrían justificar, al menos en parte, la obtención de resultados inconsistentes. Los microorganismos más comúnmente utilizados en las formulaciones probióticas en la práctica clínica son Lactobacillus spp., Bifidobacterium ySaccharomyces, así como Bacillus, Streptococcus y Escherichia coli. Sus potenciales efectos beneficiosos incluyen la regulación de la microbiota intestinal, la estimulación de la respuesta del sistema inmune y la actividad inhibitoria frente a H. pylori demostrada in vitro e in vivo119.
En lo relativo al tratamiento erradicador frente a H. pylori, existe considerable evidencia científica, sintetizada en múltiples metaanálisis, sobre el uso de múltiples formulaciones probióticas, que apuntan globalmente a una reducción de efectos adversos y, en menor medida, a una posible mejoría en las tasas de erradicación con los tratamientos erradicadores120–137. Sin embargo, se han publicado diversos resultados negativos con el uso de probióticos asociados, fundamentalmente, a la terapia triple138–142. Es probable que estos resultados discordantes estén relacionados con el uso de diferentes cepas y combinaciones de estas, así como de distintas concentraciones, dosis y duraciones del tratamiento143,144. Por otro lado, la inmensa mayoría de estudios publicados sobre probióticos han evaluado su impacto sobre la terapia triple clásica, un tratamiento relativamente bien tolerado, con una eficacia insuficiente y que ya no se recomienda como primera línea en nuestro medio23. En este contexto, un metaanálisis reciente incluyendo 33 ensayos clínicos y 4.459 pacientes demostró que la ganancia terapéutica obtenida con los probióticos era mayor cuanto menos eficaz era el tratamiento erradicador125. De hecho, la suplementación probiótica no aportó beneficio terapéutico alguno cuando la efectividad del tratamiento erradicador era superior al 80%. En este sentido, la utilidad de los probióticos asociados al tratamiento cuádruple concomitante, que es uno de los recomendados actualmente en España en primera línea, ha sido, en un ensayo clínico aleatorizado, nula66. Y el potencial efecto beneficioso (en términos de erradicación de H. pylori) de los probióticos asociados al tratamiento cuádruple con bismuto, que representa otra de las opciones de primera línea en nuestro medio, no ha podido tampoco ser demostrado en dos recientes estudios aleatorizados145,146.
Finalmente, es preciso señalar que los probióticos no están financiados en España, lo que incrementa el coste del tratamiento erradicador. Además, hace más complejo el tratamiento cuádruple, al añadir un quinto compuesto. Por último, no se han publicado estudios que nos permitan predecir qué pacientes tienen un riesgo más elevado de padecer efectos secundarios con la antibioterapia, lo cual permitiría individualizar la administración de los probióticos. En todo caso, podría plantearse el uso de probióticos en casos muy seleccionados, como por ejemplo en pacientes con mala tolerancia o con efectos secundarios con tratamientos antibióticos previos.
En conclusión, se precisa disponer de una mayor evidencia acerca del impacto de los probióticos sobre la efectividad y seguridad de las nuevas terapias cuádruples erradicadoras frente a H. pylori antes de que puedan ser implementados en la práctica clínica diaria. Por ello, por el momento no se recomienda asociar probióticos al tratamiento erradicador.
Recomendación 7. Tras el fracaso de un primer tratamiento que incluya claritromicina (triple o cuádruple), se recomienda una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol). Otra alternativa es una pauta cuádruple con levofloxacino (IBP, amoxicilina, levofloxacino y bismuto).
Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: moderada.
Tras el fracaso de una terapia con claritromicina, es concebible pensar que H. pylori ya era resistente a este antibiótico (resistencia primaria) o bien que ha desarrollado resistencia (secundaria) frente a él tras el tratamiento erradicador fallido; por tanto, se debe evitar utilizar de nuevo claritromicina. En este sentido, un análisis combinado de ocho estudios constató una tasa de erradicación muy baja, del 46%, cuando se repitió un tratamiento que contenía este antibiótico147.
Cuando ha fracasado el tratamiento triple estándar (IBP, claritromicina y amoxicilina, combinación que actualmente ya no se recomienda) tradicionalmente se ha recomendado como rescate una terapia cuádruple clásica (IBP, bismuto, tetraciclina y metronidazol), con la que, según un metaanálisis publicado en 2013, se lograba una erradicación media del 78%147. Recientemente, un metaanálisis de nueve estudios usando la misma pauta ha obtenido resultados similares (76%)148. En los últimos años se ha ido generando progresivamente experiencia con el uso de Pylera® como tratamiento de rescate. Así, en un metaanálisis actualizado se concluye que este tratamiento dispone de una eficacia (por ITT) del 89% en segunda línea, con un buen perfil de seguridad84. Del mismo modo, la experiencia del Hp-EuReg es también alentadora, habiéndose confirmado los resultados del mencionado metaanálisis, al alcanzar tasas de erradicación de aproximadamente el 90% (por ITT), tanto en Europa como en España en particular, tras el fracaso de un primer intento erradicador36,88,95,149.
Debido a la complejidad de la terapia cuádruple con bismuto clásica y a la ausencia de disponibilidad de tetraciclina y sales de bismuto en muchos países, se han llevado a cabo diversos estudios empleando levofloxacino como tratamiento de rescate150. Los resultados han sido semejantes a los obtenidos con la terapia cuádruple con bismuto, con una erradicación media del 76-79%147,148. Diversos metaanálisis han comparado, como segunda línea, una pauta triple con levofloxacino frente a una terapia cuádruple con bismuto, y han demostrado una similar eficacia con ambas pautas (o incluso algo superior con levofloxacino en algunos casos) y una menor incidencia de efectos adversos con la terapia con quinolonas147,151–157.
Estos prometedores resultados con levofloxacino fueron confirmados en un amplio estudio multicéntrico español, en el que 1.000 pacientes en los que había fracasado un primer tratamiento erradicador con IBP, amoxicilina y claritromicina recibieron durante 10 días IBP, amoxicilina y levofloxacino158. La erradicación se logró en el 74% de los pacientes y, aunque se describieron efectos adversos en una quinta parte de los casos, ninguno de ellos fue grave. En este estudio se valoró también si la eficacia disminuía con el paso del tiempo, pues las resistencias a las quinolonas en España parecen estar incrementándose con cierta rapidez24,27. Sin embargo, las tasas de erradicación se mantuvieron estables con el paso del tiempo (durante los 6 años del estudio)158.
Los tratamientos cuádruples sin bismuto, que incluyen IBP, amoxicilina, claritromicina y un nitroimidazol (sobre todo en régimen concomitante), son ampliamente utilizados como primera línea en la actualidad. Es un reto encontrar tratamientos de rescate tras el fracaso de estas terapias, que emplean antibióticos clave como la claritromicina y los nitroimidazoles. Recientemente se ha realizado un metaanálisis para evaluar qué tratamientos de segunda línea se han investigado tras una tentativa fallida de erradicación con dichas terapias159. La mayoría de los estudios evaluaban una terapia de rescate con IBP, amoxicilina y levofloxacino, combinación con la que se obtuvo una tasa de erradicación global (por ITT) del 80% aproximadamente, tras el fracaso de una terapia cuádruple sin bismuto139,160–165. Esta terapia triple (IBP, amoxicilina y levofloxacino) fue relativamente efectiva tanto tras el fracaso del tratamiento secuencial (81%)139,161–165 como del concomitante (77%)160,161,165.
Es evidente que la eficacia de la triple terapia con levofloxacino es mejorable (recordemos que actualmente nuestro objetivo terapéutico debe ser alcanzar una eficacia erradicadora igual o superior al 90%, y no conformarnos con cifras menores, independientemente de que se trate de un tratamiento inicial o de rescate). Por otra parte, como se ha mencionado previamente, la tasa de resistencias a las quinolonas parece estar aumentando y ello puede repercutir negativamente en la eficacia de la terapia triple con levofloxacino166,167. Se ha sugerido que con la adición de bismuto se podría disminuir dicho efecto negativo, al poseer este fármaco un efecto sinérgico con determinados antibióticos y superar en gran medida la resistencia a claritromicina y levofloxacino168,169. En este sentido, un reciente estudio ha demostrado que con la adición de bismuto (IBP, amoxicilina, levofloxacino y bismuto durante 14 días) se obtiene una eficacia erradicadora del 95% «por protocolo» y del 88% por ITT169. Estas cifras fueron superiores a las obtenidas con un tratamiento triple−sin bismuto−con IBP, amoxicilina y levofloxacino. Estos resultados favorables se obtuvieron a pesar de una elevada tasa de resistencia a quinolonas (30%), superior a la descrita en nuestro medio. Este tratamiento cuádruple (IBP, amoxicilina, levofloxacino y bismuto) logró la erradicación en el 98% de los pacientes con cepas de H. pylori sensibles a las quinolonas y, lo que es más importante, alcanzó la erradicación en un porcentaje relativamente elevado (del 71%) de cepas resistentes a levofloxacino. Sin embargo, cuando se empleaba el tratamiento triple con levofloxacino, únicamente se logró erradicar la infección en el 38% de los pacientes con cepas resistentes a quinolonas.
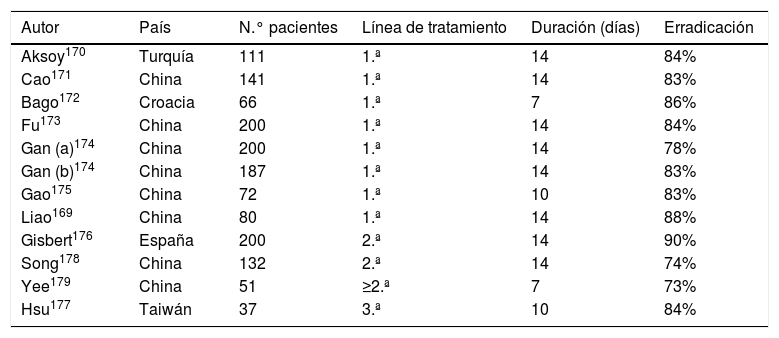
Más recientemente, diversos estudios han evaluado la mencionada combinación cuádruple con levofloxacino (IBP, amoxicilina, levofloxacino y bismuto) como tratamiento de segunda línea150, como se muestra en la tabla 5, logrando en general tasas de erradicación satisfactorias169–179. Entre ellos, un reciente estudio multicéntrico español administró una combinación cuádruple con IBP/12h, amoxicilina (1g/12h), levofloxacino (500mg/24h) y bismuto (240mg/12h) durante 14 días a 200 pacientes en los que había fracasado previamente una terapia triple (IBP, claritromicina y amoxicilina) o cuádruple sin bismuto176. El 96% de los pacientes tomó correctamente la medicación. Globalmente, las tasas de erradicación por ITT fueron del 90%. Estas cifras fueron similares independientemente del tratamiento previo: terapia triple 88,5% vs. secuencial 93,8% vs. concomitante 91,9%. Por tanto, la terapia cuádruple con bismuto y levofloxacino durante 14 días constituye una terapia de segunda línea eficaz (≥ 90% curación) no solo en pacientes tras un fracaso erradicador con la terapia triple estándar sino también en aquellos con fracaso del tratamiento cuádruple sin bismuto.
Estudios que evalúan la eficacia de la combinación de IBP, amoxicilina, levofloxacino y bismuto para la erradicación de H. pylori
| Autor | País | N.° pacientes | Línea de tratamiento | Duración (días) | Erradicación |
|---|---|---|---|---|---|
| Aksoy170 | Turquía | 111 | 1.ª | 14 | 84% |
| Cao171 | China | 141 | 1.ª | 14 | 83% |
| Bago172 | Croacia | 66 | 1.ª | 7 | 86% |
| Fu173 | China | 200 | 1.ª | 14 | 84% |
| Gan (a)174 | China | 200 | 1.ª | 14 | 78% |
| Gan (b)174 | China | 187 | 1.ª | 14 | 83% |
| Gao175 | China | 72 | 1.ª | 10 | 83% |
| Liao169 | China | 80 | 1.ª | 14 | 88% |
| Gisbert176 | España | 200 | 2.ª | 14 | 90% |
| Song178 | China | 132 | 2.ª | 14 | 74% |
| Yee179 | China | 51 | ≥2.ª | 7 | 73% |
| Hsu177 | Taiwán | 37 | 3.ª | 10 | 84% |
Tasas de erradicación «por intención de tratar».
Gan (a): levofloxacino 500mg/24h; Gan (b): levofloxacino 200mg/12h; IBP: inhibidor de la bomba de protones.
En este sentido, la terapia cuádruple con levofloxacino (IBP, levofloxacino, amoxicilina y bismuto) administrada durante al menos 10 días demostró ser el tratamiento más eficaz en un metaanálisis en red que incluyó 26 ensayos clínicos sobre terapias erradicadoras de segunda línea157, acorde con los resultados del metaanálisis previamente citado (en el que la erradicación alcanzó el 90% con esta pauta cuádruple)159. En la misma línea, los datos más actualizados del Hp-EuReg muestran cómo, tras el fracaso de un tratamiento de primera línea conteniendo claritromicina, se obtiene una erradicación óptima (≥90%) con una terapia cuádruple con bismuto, ya sea la clásica (con tetraciclina y metronidazol) o con levofloxacino95,149. En particular, los datos españoles de dicho registro confirman cómo se pueden alcanzar cifras de erradicación de aproximadamente el 90% tanto con la terapia cuádruple con levofloxacino como con Pylera®36. En este último sentido, la terapia cuádruple con IBP, bismuto, tetraciclina y metronidazol ha logrado resultados alentadores como tratamiento de rescate tras el fracaso de una terapia cuádruple sin bismuto, pero la experiencia es todavía limitada180,181.
Debe señalarse que se ha estimado que el tratamiento erradicador con levofloxacino no alcanzará cifras de erradicación aceptables (≥ 90%) si la proporción de cepas de H. pylori resistentes a este antibiótico es>25%182. En España, los datos publicados describen, en la mayoría de los casos, tasas de resistencia a levofloxacino que no alcanzan dicho umbral47,49,50,183,184, pero es obvio que se debe vigilar localmente el incremento de resistencia a quinolonas.
En relación a la duración del tratamiento con levofloxacino, esta debe ser como mínimo de 10 días, y probablemente mejor de 14 días150. Así, 3 metaanálisis151–153 han evidenciado, al igual que tres ensayos clínicos aleatorizados recientes166,185,186, tasas de curación más altas con regímenes de 10 a 14 días que con tratamientos que contienen levofloxacino durante solo 7 días. Además, dos estudios recientes han comparado la eficacia de la terapia triple que contiene levofloxacino durante 14, 10 y 7 días como tratamiento de rescate, y han demostrado una mayor tasa de erradicación con el régimen más prolongado187.
Con respecto a la posología de levofloxacino, una dosis de 500mg al día se considera la adecuada150. Así, se ha demostrado que levofloxacino 500mg al día es igualmente eficaz, pero mejor tolerado, que dosis más elevadas (p. ej., 1.000mg/día)166,188–190.
Recientemente, la U.S. Food and Drug Administration y la Agencia Europea del Medicamento (European Medicines Agency) han publicado diversas alarmas sobre efectos adversos graves de las fluoroquinolonas. Por ello, ambas agencias desaconsejan el uso de las fluoroquinolonas para la mayoría de las infecciones leves y moderadas o en las que exista una alternativa terapéutica, restringiendo su uso a infecciones en las que el beneficio terapéutico supere los riesgos191. En este sentido, teniendo en cuenta los resultados obtenidos en la práctica clínica, consideramos que, por el momento, no se deberían modificar sustancialmente las recomendaciones emitidas por la Conferencia Española de Consenso sobre el tratamiento de la infección por H. pylori previa (IV)6, así como por otros consensos internacionales25,192, respecto del uso de fluoroquinolonas como tratamiento de rescate tras el fracaso erradicador de H. pylori. Dicho esto, es preciso insistir en la necesidad de hacer un uso responsable de todos los antibióticos –y de las quinolonas en particular, que en el caso de H. pylori deberían reservarse para tratamientos de rescate–, de notificar todas las sospechas de reacciones adversas y de mantenernos atentos a las posibles comunicaciones de las autoridades sanitarias nacionales e internacionales sobre efectos adversos graves de estos fármacos191.
Recomendación 8. Tras el fracaso de un primer tratamiento con una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol), se recomienda una pauta cuádruple con levofloxacino (IBP, amoxicilina, levofloxacino y bismuto).
Acuerdo 100%; votos: totalmente de acuerdo (92,8%); bastante de acuerdo (7,1%). GR: fuerte. CE: baja.
Después de un fracaso erradicador con una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) podría utilizarse teóricamente cualquier tratamiento, incluyendo la repetición de la misma terapia cuádruple pero con mayores dosis y duración de metronidazol, dado que la tasa de resistencia adquirida después del uso de amoxicilina, bismuto o tetraciclina es insignificante (<3%) y la resistencia a metronidazol se podría superar, al menos parcialmente, de esta manera22. Sin embargo, parece lógico no repetir un tratamiento que ya ha fracasado37. También parece razonable suponer que si se ha utilizado como primera opción el tratamiento cuádruple con bismuto puede ser debido a la existencia de una elevada tasa de resistencia a claritromicina (la cual reduce la eficacia de la terapia triple estándar) o una elevada tasa de resistencia combinada a claritromicina y metronidazol (lo que se asocia con una menor eficacia de las terapias cuádruples sin bismuto)22. En este sentido, al haber fracasado un primer intento erradicador con metronidazol, existe una alta probabilidad de que H. pylori sea resistente a este antibiótico (bien porque tuviera resistencia primaria previa o porque hubiera desarrollado resistencia secundaria tras el tratamiento). En cualquier caso, como es bien sabido, la presencia de resistencia dual –a claritromicina y a metronidazol– mayor del 15% penalizaría significativamente la eficacia del tratamiento cuádruple concomitante. De este modo, el empleo de un tratamiento de segunda línea que contenga claritromicina±metronidazol tras el fracaso de una terapia cuádruple con bismuto probablemente no sería la mejor opción (no obstante, sí podría considerarse, teóricamente, administrar una combinación cuádruple con IBP, amoxicilina, claritromicina y bismuto, aunque la experiencia como tratamiento de rescate es muy limitada)23,97
Por el contrario, es bien sabido que la terapia con levofloxacino es efectiva como segunda línea tras el fracaso de un tratamiento con claritromicina150; por tanto, esta parecería más recomendable tras el fracaso erradicador de un régimen cuádruple con bismuto. No obstante, la experiencia tras el fracaso de un tratamiento cuádruple con bismuto en general, y con la administración de un tratamiento de rescate con levofloxacino en particular, es notablemente escasa. Los estudios que han evaluado la eficacia de una tercera línea combinando IBP, amoxicilina y levofloxacino para la erradicación de H. pylori después del fracaso de dos tratamientos, siendo el de segunda línea la pauta cuádruple con bismuto, se revisan en la recomendación 11 (obteniendo una eficacia entre el 60% y el 85%, con una media de aproximadamente el 75%).
Como se ha mencionado previamente (véase recomendación 7, dedicada al tratamiento de rescate tras el fracaso de las terapias con claritromicina), la adición de bismuto a la terapia triple con levofloxacino ha alcanzado resultados prometedores, por lo que sería por tanto de elección. En este sentido, los resultados del Hp-EuReg avalan esta recomendación, al demostrar que, después del fracaso de una terapia cuádruple con bismuto, un régimen de segunda línea cuádruple con quinolonas (es decir, IBP, levofloxacino, amoxicilina y bismuto), administrado durante 14 días, alcanza unas cifras de erradicación óptimas (≈90%)149.
Recomendación 9. Tratamiento de rescate en pacientes alérgicos a la penicilina:
- a)
Tras el fracaso de un primer tratamiento triple (IBP, claritromicina y metronidazol), se sugiere emplear una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol). GR: débil. CE: muy baja.
- b)
Tras el fracaso de un primer tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol), se sugiere una terapia cuádruple con IBP, levofloxacino, claritromicina y bismuto.
Acuerdo 100%; votos: totalmente de acuerdo (92,8%); bastante de acuerdo (7,1%). GR: débil. CE: muy baja.
La erradicación de H. pylori en pacientes alérgicos a la penicilina es un reto, especialmente en aquellos en los que ya ha fracasado un intento erradicador previo. En un estudio piloto español, 15 pacientes alérgicos a la penicilina en los que había fracasado un primer tratamiento con IBP, claritromicina y metronidazol recibieron un segundo tratamiento con IBP, claritromicina y levofloxacino durante 10 días110. La adhesión al tratamiento fue completa en todos los casos. Se describieron efectos adversos en el 20% de los pacientes, todos ellos leves. La tasa de erradicación (por ITT) fue del 73%.
Más recientemente, en un estudio multicéntrico español, 267 pacientes alérgicos a la penicilina recibieron un tratamiento de primera línea con IBP, claritromicina y metronidazol o una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol); y como tratamientos de rescate, una terapia cuádruple con bismuto o un régimen con IBP, claritromicina y levofloxacino durante 10 días115. La tasa de erradicación (por ITT) con IBP, claritromicina y levofloxacino fue del 64%, tanto tras el fracaso de IBP, claritromicina y metronidazol como de la cuádruple con bismuto de primera línea, y la adhesión fue del 88-100%, con un 23-29% de efectos adversos (todos leves). Por tanto, los autores concluyeron que un tratamiento triple con IBP, claritromicina y levofloxacino representa una alternativa de segunda línea en pacientes con alergia a la penicilina.
En este sentido, recientemente se han publicado los resultados del Hp-EuReg centrados específicamente en los pacientes alérgicos a la penicilina116. En segunda línea, tras el fracaso de una combinación de un IBP, claritromicina y metronidazol, dos opciones de rescate mostraron una eficacia similar: una cuádruple terapia con IBP, bismuto, tetraciclina y metronidazol (78%) y una combinación triple con IBP, claritromicina y levofloxacino (71%)116.
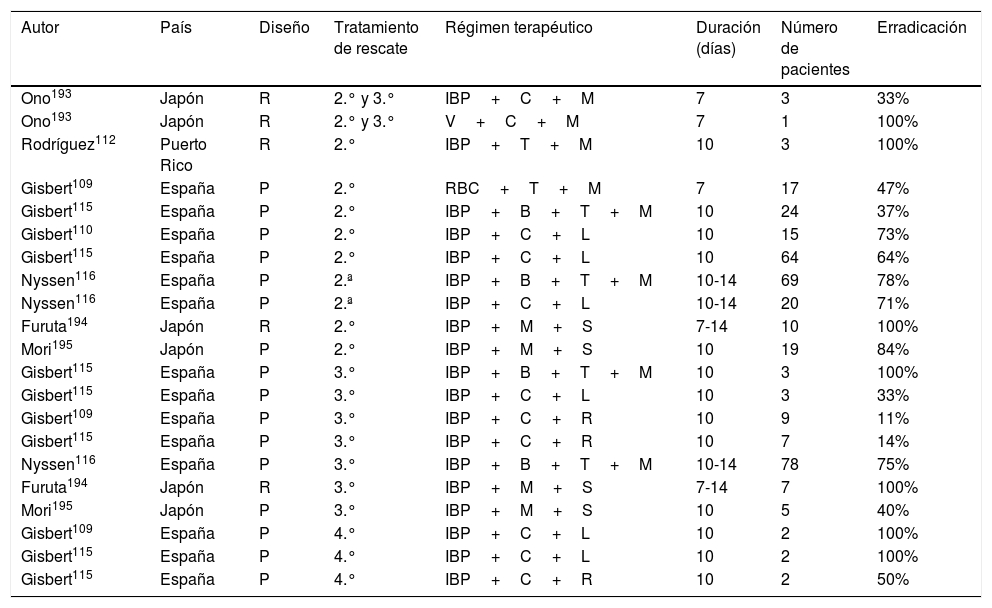
Los escasos estudios que han evaluado los diversos tratamientos erradicadores de rescate prescritos empíricamente (sin estudio de sensibilidad bacteriana) en pacientes con alergia a la penicilina se resumen en la tabla 6109,110,112,115,116,193–195. A partir de ellos se puede concluir que, en pacientes alérgicos a la penicilina, tras el fracaso de un tratamiento triple (IBP, claritromicina y metronidazol, combinación que actualmente ya no se recomienda), se podría sugerir emplear una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol); mientras que, tras el fracaso de un primer tratamiento cuádruple con bismuto, se podría plantear una terapia triple con IBP, levofloxacino y claritromicina. No obstante, puesto que, como se ha discutido previamente en otras recomendaciones, la adición de bismuto a diversas terapias triples parece incrementar su eficacia23, parece más razonable sugerir, aunque no exista evidencia directa que lo sustente, el empleo de una terapia cuádruple añadiendo este último fármaco (IBP, levofloxacino, claritromicina y bismuto).
Estudios que evalúan los tratamientos erradicadores de rescate de H. pylori prescritos empíricamente (sin estudio de sensibilidad bacteriana) en pacientes con alergia a la penicilina
| Autor | País | Diseño | Tratamiento de rescate | Régimen terapéutico | Duración (días) | Número de pacientes | Erradicación |
|---|---|---|---|---|---|---|---|
| Ono193 | Japón | R | 2.° y 3.° | IBP+C+M | 7 | 3 | 33% |
| Ono193 | Japón | R | 2.° y 3.° | V+C+M | 7 | 1 | 100% |
| Rodríguez112 | Puerto Rico | R | 2.° | IBP+T+M | 10 | 3 | 100% |
| Gisbert109 | España | P | 2.° | RBC+T+M | 7 | 17 | 47% |
| Gisbert115 | España | P | 2.° | IBP+B+T+M | 10 | 24 | 37% |
| Gisbert110 | España | P | 2.° | IBP+C+L | 10 | 15 | 73% |
| Gisbert115 | España | P | 2.° | IBP+C+L | 10 | 64 | 64% |
| Nyssen116 | España | P | 2.ª | IBP+B+T+M | 10-14 | 69 | 78% |
| Nyssen116 | España | P | 2.ª | IBP+C+L | 10-14 | 20 | 71% |
| Furuta194 | Japón | R | 2.° | IBP+M+S | 7-14 | 10 | 100% |
| Mori195 | Japón | P | 2.° | IBP+M+S | 10 | 19 | 84% |
| Gisbert115 | España | P | 3.° | IBP+B+T+M | 10 | 3 | 100% |
| Gisbert115 | España | P | 3.° | IBP+C+L | 10 | 3 | 33% |
| Gisbert109 | España | P | 3.° | IBP+C+R | 10 | 9 | 11% |
| Gisbert115 | España | P | 3.° | IBP+C+R | 10 | 7 | 14% |
| Nyssen116 | España | P | 3.° | IBP+B+T+M | 10-14 | 78 | 75% |
| Furuta194 | Japón | R | 3.° | IBP+M+S | 7-14 | 7 | 100% |
| Mori195 | Japón | P | 3.° | IBP+M+S | 10 | 5 | 40% |
| Gisbert109 | España | P | 4.° | IBP+C+L | 10 | 2 | 100% |
| Gisbert115 | España | P | 4.° | IBP+C+L | 10 | 2 | 100% |
| Gisbert115 | España | P | 4.° | IBP+C+R | 10 | 2 | 50% |
Tasas de erradicación «por intención de tratar».
Diseño: P (prospectivo), R (retrospectivo).
B: bismuto; C: claritromicina; IBP: inhibidor de la bomba de protones; L: levofloxacino; M: metronidazol; R: rifabutina; RBC: ranitidina citrato de bismuto; S: sitafloxacino; T: tetraciclina; V: vonoprazan.
Recomendación 10. Tras el fracaso de un primer tratamiento con claritromicina y una segunda línea con levofloxacino, se recomienda un tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
Acuerdo 100%; votos: totalmente de acuerdo (92,8%); bastante de acuerdo (7,1%). GR: fuerte. CE: baja.
Tras el fracaso de una combinación triple o cuádruple con claritromicina, como se ha revisado previamente, frecuentemente se recomienda administrar una terapia con levofloxacino150. En ocasiones, este segundo tratamiento también fracasa, y en estos casos habitualmente se prescribe una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol)15. La elección del tratamiento de rescate depende de los fármacos que se hayan empleado en los intentos erradicadores previos. Ya que la repetición del mismo antibiótico no es recomendable (con las consabidas excepciones del bismuto, la amoxicilina y, en menor medida, el metronidazol), la terapia cuádruple con bismuto parece actualmente la opción más adecuada, pues evita fundamentalmente la readministración de claritromicina y levofloxacino15.
Hace unos años se realizó un estudio multicéntrico español en el que se evaluó la eficacia de la terapia cuádruple con bismuto como tercera línea196. Se administró un tercer tratamiento erradicador con IBP (a dosis estándar cada 12h), subcitrato de bismuto (120mg/6h o 240mg/12h), tetraciclina (entre 250mg/8h y 500mg/6h) y metronidazol (entre 250mg/8h y 500mg/6h) durante 7 a 14 días a 200 pacientes; la erradicación (por ITT) fue deficiente (del 65%), probablemente debido, al menos en parte, a la insuficiente dosis y duración del tratamiento antibiótico196. Posteriormente se han llevado a cabo otros estudios, empleando la formulación de cápsula única Pylera® (y por tanto con una dosis y duración homogénea de sus integrantes), y el metaanálisis como tratamiento de tercera línea ha calculado una erradicación media del 82%84. De entre estos estudios destaca uno realizado en España, en el que se incluyeron 101 pacientes con fracaso previo de la triple terapia con claritromicina y la triple con levofloxacino, siendo Pylera® eficaz en el 80% (por ITT) de los casos197. Más recientemente, los datos del Hp-EuReg centrados en la tercera línea de tratamiento han confirmado estos alentadores resultados, describiendo cifras de erradicación del 88% al evaluar 275 pacientes tratados con Pylera®82. Estas elevadas cifras de erradicación (de aproximadamente el 90%) se han confirmado en diversos análisis actualizados del Hp-EuReg, llevados a cabo en los años 2020 y 2021, sobre la eficacia de Pylera® en tercera línea88,95.
Una posibilidad ante el fracaso de dos tratamientos erradicadores es realizar cultivo y antibiograma para, en función de la susceptibilidad bacteriana, seleccionar la combinación antibiótica más adecuada de tercera línea. Aunque esta opción de tratamiento «dirigido» es la recomendada en algunos consensos, su ventaja sobre el tratamiento empírico no ha sido confirmada13. El subanálisis de los estudios que incluían tratamientos de segunda línea en un reciente metaanálisis11 y una revisión de la literatura en donde se comparaba la eficacia del tratamiento empírico frente a la terapia basada en la susceptibilidad antibiótica12, no pudieron demostrar diferencias estadísticamente significativas entre ambas estrategias, resultados que coinciden con los descritos en un metaanálisis posterior198. No se identificó ningún ensayo clínico aleatorizado que comparara tratamiento empírico frente a dirigido por antibiograma en tercera línea, pero la tasa media de erradicación de los estudios que empleaban la estrategia basada en el cultivo fue de tan solo el 72%11. Finalmente, en un metaanálisis actualizado realizado en 2020, cuando se incluyeron todas las terapias de rescate (13 estudios), se demostraron resultados similares con ambas estrategias−empírica y basada en la susceptibilidad microbiana−, tanto al incluir todos los estudios como únicamente los ensayos clínicos aleatorizados14.
Previamente se ha especificado que los comentarios incluidos en este documento de consenso se han basado en el supuesto de que la susceptibilidad antibiótica del paciente concreto es desconocida. Además, la mayoría de los autores del presente documento opinan que existen argumentos para no tener que realizar sistemáticamente cultivo antes de indicar un tercer tratamiento erradicador, sino que, por el contrario, es perfectamente factible y adecuado administrar un tratamiento empírico tras el fracaso de un segundo intento. Esta recomendación está basada en la evidencia y tiene en cuenta, además, que el cultivo de H. pylori es una técnica disponible en pocos centros, que precisa realizar una prueba invasiva como es la endoscopia digestiva alta (puesto que la detección mediante PCR en heces todavía no está suficientemente evaluada), con una sensibilidad media inferior al 90% y con una considerable discordancia entre los resultados obtenidos in vitro y la tasa de erradicación in vivo13,199. Además, el cultivo únicamente proporciona información útil acerca de algunos antibióticos ya utilizados en tratamientos erradicadores previos de primera línea (claritromicina y metronidazol) y de segunda línea (levofloxacino), los cuales, por definición, no se deberían volver a emplear.
En resumen, se concluye que el tratamiento empírico de rescate cuádruple con bismuto es una alternativa válida tras el fracaso de un tratamiento con claritromicina y otro con levofloxacino.
Recomendación 11. Tras el fracaso de un primer tratamiento con claritromicina y una segunda línea cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol), se recomienda un tratamiento cuádruple con levofloxacino (IBP, amoxicilina, levofloxacino y bismuto).
Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: baja.
Tras el fracaso de un tratamiento triple o cuádruple con claritromicina, frecuentemente se recomienda una terapia cuádruple con IBP, bismuto, tetraciclina y metronidazol5,15. Cuando este segundo tratamiento también fracasa, con la intención de no readministrar ni claritromicina ni metronidazol, se ha sugerido prescribir una pauta triple con IBP, amoxicilina y levofloxacino5,15.
No obstante, la experiencia con quinolonas tras el fracaso de dos tratamientos erradicadores es escasa. Hace unos años se publicó un estudio multicéntrico español en el que se evaluaba la eficacia de la triple terapia con levofloxacino como tercera línea, alcanzándose la erradicación en aproximadamente el 70% de los casos200. Recientemente, estos resultados han sido confirmados en un estudio multicéntrico nacional más amplio, incluyendo un total de 200 pacientes201. Se incluyeron pacientes en los que había fracasado un primer tratamiento con IBP, amoxicilina y claritromicina, y un segundo con una pauta cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol). Se administró un tercer tratamiento erradicador con IBP, amoxicilina y levofloxacino durante 10 días. La erradicación (por ITT) fue del 68%. Otros autores han obtenido resultados similares o discretamente superiores con este tratamiento de tercera línea con levofloxacino, con tasas de erradicación que han oscilado entre el 60% y el 84% (con una media del 75%), como se resume en la tabla 7177,200–206. De entre dichos estudios, los mejores resultados (con tasas de erradicación del 84%) se obtuvieron cuando se añadía bismuto al tratamiento triple con levofloxacino, convirtiéndolo en cuádruple177,205, a semejanza de lo descrito previamente para la terapia con levofloxacino de segunda línea176.
Estudios que evalúan la eficacia de una combinación de tercera línea con IBP, amoxicilina y levofloxacino (± bismuto) para la erradicación de H. pylori tras dos fracasos erradicadores
| Autor y año de publicación | N.° pacientes | Tratamientos previos (fallidos) | Duración (días) | Erradicación |
|---|---|---|---|---|
| Gatta202, 2005 | 151 | 1°) IBP+C+A o M2°) IBP+C+A o M; Q | 10 | 76% |
| Gisbert200, 2006 | 100 | 1°) IBP+C+A2°) Q | 10 | 60% |
| Gisbert203, 2006 | 20 | 1°) IBP+C+A2°) Q | 10 | 85% |
| Hsu*177, 2008 | 37 | 1°) IBP+C+A2°) Q | 10 | 84% |
| Rokkas204, 2009 | 30 | 1°) IBP+C+A2°) Q | 10 | 70% |
| Gisbert201, 2012 | 200 | 1°) IBP+C+A2°) Q | 10 | 68% |
| Burgos-Santamaría205, 2019 | 65 | 1°) IBP+C+A2°) Q | 7-14 | 75% |
| Burgos-Santamaría*205, 2019 | 19 | 1°) IBP+C+A2°) Q | 14 | 84% |
| Burgos-Santamaría206, 2020 | 39 | 1°) IBP+C+A±M2°) Q | 10-14 | 74% |
| Burgos-Santamaría*206, 2020 | 28 | 1°) IBP+C+A±M2°) Q | 14 | 75% |
Tasas de erradicación «por intención de tratar».
A: amoxicilina; C: claritromicina; IBP: inhibidor de la bomba de protones; M: metronidazol; Q: terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
Por tanto, se concluye que el tratamiento empírico de rescate cuádruple con IBP, amoxicilina, levofloxacino y bismuto constituye una alternativa de tercera línea tras el fracaso de dos terapias erradicadoras previas conteniendo antibióticos clave como amoxicilina, claritromicina, metronidazol y tetraciclina.
Recomendación 12. Tras el fracaso de un primer tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) y una segunda línea con levofloxacino, se sugiere un tratamiento cuádruple concomitante (IBP, amoxicilina, claritromicina y metronidazol).
Acuerdo 100%; votos: totalmente de acuerdo (92,8%); bastante de acuerdo (7,1%). GR: débil. CE: muy baja.
En este caso (fracaso de un primer tratamiento cuádruple con bismuto y una segunda línea con levofloxacino), puesto que no se ha utilizado claritromicina anteriormente, se sugiere emplear un tratamiento cuádruple concomitante, que es precisamente uno de los tratamientos de elección en primera línea en nuestro medio. Es preciso mencionar que esta recomendación no se basa en ninguna evidencia directa, sino que se establece de acuerdo con asunciones teóricas, y debido a la ausencia de otras alternativas terapéuticas eficaces. Así, aunque previamente se ha esgrimido que el tratamiento concomitante probablemente no sería la mejor opción tras el fracaso de una terapia cuádruple con bismuto (véase recomendación 8), en este caso no disponemos de una mejor opción (sobre todo si optar inicialmente por la terapia cuádruple con bismuto y no por la cuádruple concomitante no se debió a una tasa elevada de resistencia a claritromicina).
Como alternativa, podría sugerirse la combinación de un IBP, claritromicina, amoxicilina y bismuto, con la que se han obtenido buenos resultados en algunos estudios23, aunque la experiencia en nuestro medio es muy limitada97. Otra opción es emplear rifabutina, aunque este antibiótico se reserva habitualmente, como se detalla más adelante, para una cuarta línea de tratamiento207,208.
Recomendación 13. Tras el fracaso de un tercer tratamiento, se sugiere reevaluar cuidadosamente la necesidad de erradicar la infección y, en su caso, pautar una cuarta línea con rifabutina.
Acuerdo 92,8%; votos: totalmente de acuerdo (92,8%); algo en desacuerdo (7,1%). GR: débil. CE: muy baja.
En ocasiones, la infección por H. pylori persiste a pesar de haber administrado tres tratamientos erradicadores199. Dado que se desconoce si el beneficio obtenido por la potencial erradicación de H. pylori supera los problemas de seguridad con líneas de tratamiento más complejas, en estos pacientes se debe reevaluar individualmente la indicación del tratamiento erradicador y la posibilidad de dejar, su fuera necesario, tratamiento antisecretor de mantenimiento. Evidentemente, la decisión de prescribir una cuarta línea de tratamiento será más clara cuanto mayor sea el beneficio de la erradicación de H. pylori, como es el caso de pacientes con una úlcera péptica (sobre todo si han sufrido complicaciones previas) o con un linfoma MALT gástrico.
Una reciente revisión de la literatura ha evaluado el papel de la rifabutina−un antibiótico que posee una elevada actividad in vitro frente a H. pylori−en el tratamiento de esta infección208. La tasa media de resistencia de H. pylori a la rifabutina (calculada a partir de 39 estudios y casi 10.000 pacientes) fue menor del 1%. Cuando únicamente se consideraron aquellos estudios que incluían pacientes sin tratamiento erradicador previo, esta cifra fue incluso menor (0,07%). Globalmente, la tasa media de erradicación (por ITT) con las combinaciones que incluían rifabutina (3.000 pacientes analizados) fue del 73%. Específicamente, las cifras correspondientes para los tratamientos con rifabutina de cuarta línea fueron del 70% aproximadamente115,205,209–215. Para el tratamiento de la infección por H. pylori, la mayoría de los estudios han prescrito 300mg/día de rifabutina, dosis que parece ser más efectiva que 150mg/día. La duración óptima del tratamiento no está establecida, pero generalmente se recomienda administrarlo durante 10-12 días. La incidencia media de efectos adversos fue del 15%; la mielotoxicidad fue el más relevante, aunque excepcional. Hasta este momento, todos los pacientes se han recuperado de la leucopenia en unos pocos días tras la finalización del tratamiento, y no se han descrito infecciones ni otras complicaciones asociadas a la mielotoxicidad208.
Estos resultados han sido confirmados en un amplio estudio multicéntrico español, en el que se evaluó la eficacia de un cuarto tratamiento de rescate empírico con rifabutina en pacientes en los que habían fracasado previamente tres intentos erradicadores (el primero con IBP, claritromicina y amoxicilina; el segundo con una cuádruple terapia con IBP, bismuto, tetraciclina y metronidazol; y el tercero con IBP, amoxicilina y levofloxacino)213. Se administró un cuarto tratamiento erradicador con IBP, amoxicilina (1g/12h) y rifabutina (150mg/12h) durante 10 días a 100 pacientes, y la tasa de erradicación (por ITT) fue del 50%. Se describieron efectos adversos en el 30% de los pacientes; la mielotoxicidad (siempre leve) se constató en el 4% de los pacientes y se resolvió espontáneamente en todos los casos tras la finalización del tratamiento. Por último, los datos más recientes del Hp-EuReg han confirmado unas cifras de erradicación algo superiores, del 65% en cuarta línea de tratamiento216.
Finalmente, aunque la evidencia al respecto es muy limitada217–219, ante múltiples fracasos erradicadores podría plantearse asociar bismuto a la rifabutina217–219, con la intención de incrementar la eficacia erradicadora. Así, Ciccaglione et al. describieron que la adición de bismuto a una terapia triple que incluía IBP, amoxicilina y rifabutina en pacientes que recibían una tercera línea de tratamiento, resultaba en una ganancia terapéutica del 30% en comparación con la triple terapia basada en rifabutina219. Finalmente, este régimen de rifabutina con bismuto ha sido evaluado recientemente en el contexto del Hp-EuReg, donde se analizaban diversas terapias de rescate empíricas en tercera línea y siguientes, obteniéndose una eficacia (por ITT) con IBP, rifabutina, amoxicilina y bismuto del 60% aproximadamente206.
Por último, como cuarta línea de tratamiento, se podría sugerir también una combinación de un IBP y amoxicilina, ambos a dosis altas (por ej. omeprazol 40mg/8h y amoxicilina 1g/8h durante 14 días); no obstante, aunque esta combinación dual ha obtenido buenos resultados en algunos países (asiáticos en su mayoría)220,221, su eficacia no ha sido confirmada en nuestro medio.
En resumen, tras el fracaso de un tercer tratamiento se recomienda evaluar cuidadosamente la necesidad de erradicación y la posibilidad de dejar tratamiento antisecretor de mantenimiento. En caso de que se considere apropiada la erradicación, se recomienda valorar individualmente la necesidad de una cuarta línea de tratamiento, por ejemplo, con rifabutina (probablemente junto con bismuto, además de amoxicilina), con un estricto control y seguimiento del paciente.
Recomendación 14. En los pacientes con úlcera duodenal no complicada que no requieren antiinflamatorios no esteroideos/aspirina, no se recomienda mantener el tratamiento antisecretor tras haber finalizado el tratamiento erradicador de H. pylori.
Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
Inicialmente, la mayoría de los autores que empleaban IBP en las terapias erradicadoras para la enfermedad ulcerosa duodenal no complicada (sin hemorragia digestiva ni perforación) prolongaban estos fármacos durante 2-4 semanas tras la conclusión del tratamiento antibiótico, con el objetivo de «asegurar» la cicatrización ulcerosa222. Sin embargo, se ha comprobado que para obtener una elevada tasa de cicatrización ulcerosa en estos pacientes es suficiente el empleo del IBP limitado al período de administración de los antibióticos en el contexto del tratamiento erradicador. Así, una revisión sistemática de la literatura médica identificó 24 estudios, incluyendo un total de 2.378 pacientes, en los que se evaluaba la cicatrización ulcerosa con IBP más dos antibióticos durante 7 días223. La tasa de cicatrización media (por ITT) fue del 86% al considerar todos los pacientes (tanto con éxito como con fracaso erradicador de H. pylori). Esta cifra ascendió al 95% cuando únicamente se incluyeron aquellos pacientes en los que se había erradicado la infección. El metaanálisis de los 6 estudios aleatorizados224–229 que comparan la eficacia en términos de cicatrización ulcerosa al administrar IBP más 2 antibióticos durante 7 días frente a ese mismo tratamiento asociado a IBP durante 2-4 semanas más223, confirmó la cicatrización de la úlcera en el 91% y 92% de los casos, respectivamente. La odds ratio (OR) para esta comparación fue de 1,11 (intervalo de confianza del 95%, IC 95%, de 0,71 a 1,74), siendo los resultados homogéneos. Por último, cuando se efectuó un subanálisis incluyendo únicamente los pacientes con úlcera duodenal, los resultados fueron similares (OR de 1,14, con un IC 95% de 0,71 a 1,84). Posteriormente a la publicación de este metaanálisis se han llevado a cabo otros dos estudios aleatorizados adicionales, con resultados similares230,231.
En resumen, se concluye que para obtener una elevada tasa de cicatrización de la úlcera duodenal no complicada en pacientes que no toman antiinflamatorios no esteroideos (AINE) ni aspirina, es suficiente el empleo de IBP durante el período de administración de los antibióticos. No obstante, en el caso de las úlceras duodenales complicadas (hemorragia digestiva, perforación), es prudente administrar antisecretores hasta confirmar la erradicación de H. pylori.
Recomendación 15. En los pacientes con úlcera gástrica que no requieren antiinflamatorios no esteroideos/aspirina, se recomienda mantener el tratamiento antisecretor durante cuatro a ocho semanas tras haber finalizado el tratamiento erradicador de H. pylori.
Acuerdo 100%; votos: totalmente de acuerdo (92,8%); bastante de acuerdo (7,1%). GR: fuerte. CE: moderada.
Existen dos revisiones de la literatura médica publicadas hace más de una década que proporcionan argumentos a favor de no prolongar el tratamiento antisecretor en los pacientes con úlcera gástrica, en consonancia con la actitud adoptada con la úlcera duodenal. La primera de ellas concluye que «la erradicación de H. pylori induce una mayor cicatrización de las lesiones ulcerosas independientemente de que estas sean duodenales o gástricas»232. La otra revisión sistemática llega a la conclusión de que «la erradicación de H. pylori cicatriza tanto la úlcera duodenal como la gástrica, con un porcentaje de curación similar»233. De estos datos se desprendería que la tasa de cicatrización con el tratamiento erradicador de H. pylori sería similar para la úlcera gástrica y la duodenal.
Sin embargo, estudios más recientes sugieren la necesidad de prolongar el tratamiento con antisecretores, especialmente en las úlceras gástricas de tamaño superior a 1cm. Un primer estudio documentó la cicatrización del 100% de las úlceras gástricas menores de 1cm a las ocho semanas de la administración de un tratamiento erradicador durante dos semanas234. Esta tasa de cicatrización se redujo considerablemente cuando las úlceras fueron mayores de 1cm, siendo importante destacar que todas las lesiones no cicatrizadas a las ocho semanas lo hicieron tras tratamiento adicional con IBP. Uno de los estudios, con un diseño aleatorizado, que aporta información muy relevante sobre este tema evaluó la cicatrización de la úlcera gástrica tras tratamiento erradicador durante una semana o IBP durante ocho semanas235. Se pudo comprobar cómo la tasa de cicatrización a las ocho semanas del tratamiento erradicador se reducía exponencialmente en función del tamaño de la úlcera (89% para úlceras <1cm, 54% para úlceras de entre 1 y 1,4cm, y 5% para aquellas iguales o mayores de 1,5cm); mientras que era significativamente superior en el grupo tratado con IBP durante ocho semanas (100% para úlceras <1cm, 77% para úlceras de entre 1 y 1,4cm, y 77% para aquellas iguales o mayores de 1,5cm)235.
Más recientemente se ha publicado otro estudio aleatorizado en el que se comparaba la administración de terapia erradicadora aislada frente a esta seguida de IBP durante tres semanas236. La cicatrización de la úlcera gástrica a las cuatro semanas fue inferior en los pacientes tratados solo con triple terapia, sin IBP posterior (64% vs. 82%). Así mismo, en los pacientes con úlcera gástrica no cicatrizada, un ciclo de cuatro semanas adicionales de IBP (esomeprazol) incrementó el porcentaje de cicatrización hasta el 89-96%. Cabe destacar que este estudio adolece de ciertas deficiencias metodológicas, como la exclusión de pacientes con úlceras de tamaño>2cm y un control endoscópico de la cicatrización excesivamente precoz (a las cuatro semanas) para una úlcera gástrica.
Finalmente, un reciente estudio japonés aleatorizó a 115 pacientes con úlcera gástrica estratificados en función del tamaño de la lesión (<0,5cm, 0,5-1,5cm y>1,5cm) a recibir tratamiento erradicador (durante una semana) más siete semanas de IBP frente a tratamiento erradicador más siete semanas de un agente citoprotector231. Las tasas de cicatrización ulcerosa a las ocho semanas fueron significativamente superiores en el grupo de tratamiento erradicador más IBP. En concordancia con los estudios previos, los resultados de cicatrización ulcerosa con tratamiento erradicador más IBP fueron superiores para las úlceras gástricas>1,5cm (85% vs. 43%).
En resumen, la evidencia disponible apunta a una mayor tasa de cicatrización ulcerosa con el tratamiento erradicador seguido de IBP para las úlceras gástricas asociadas a la infección por H. pylori. En todos los estudios consignados previamente231,235,236 se constató una ausencia de cicatrización de hasta el 20% con el tratamiento erradicador aislado, siendo este fallo superior para las úlceras de mayor tamaño. Por tanto, se recomienda que, tras haber finalizado el tratamiento erradicador, se prolongue la terapia antisecretora entre cuatro y ocho semanas en las úlceras gástricas, especialmente en aquellas mayores de 1cm
Recomendación 16. En los pacientes con hemorragia digestiva por úlcera péptica la erradicación de H. pylori elimina la práctica totalidad de las recidivas; por tanto, una vez confirmada la erradicación y en ausencia de toma de antiinflamatorios no esteroideos/aspirina, se recomienda no administrar tratamiento de mantenimiento con antisecretores.
Acuerdo 100%; votos: totalmente de acuerdo (92,8%); bastante de acuerdo (7,1%). GR: fuerte. CE: alta.
La úlcera péptica es la primera causa de hemorragia digestiva alta y la infección por H. pylori es el principal factor etiológico de la enfermedad ulcerosa gastroduodenal237. La terapia antisecretora de mantenimiento a largo plazo era, tradicionalmente, el tratamiento estándar para prevenir la recidiva hemorrágica en los pacientes con un episodio previo de sangrado digestivo por úlcera péptica. Aunque es sobradamente conocido que la erradicación de H. pylori se asocia con una drástica disminución de las recidivas ulcerosas, hasta hace relativamente poco tiempo se desconocía la eficacia del tratamiento erradicador en la prevención de la recidiva hemorrágica por úlcera péptica.
Se ha publicado un metaanálisis, siguiendo la metodología de la Colaboración Cochrane, en el que se comparaba la eficacia del tratamiento erradicador de H. pylori frente al tratamiento antisecretor para la prevención de la recidiva hemorrágica por úlcera péptica238,239. En un primer subanálisis se incluyeron siete estudios, con un total de 578 pacientes: el porcentaje promedio de recidiva hemorrágica en el grupo de tratamiento erradicador fue del 2,9% y en el grupo sin tratamiento erradicador ni antisecretores de mantenimiento fue del 20% (OR de 0,17; IC 95% de 0,10 a 0,32). En un segundo subanálisis se incluyeron tres estudios, con un total de 470 pacientes: el porcentaje promedio de recidiva hemorrágica en el grupo que recibió tratamiento erradicador fue del 1,6% y en el grupo en el que no se prescribió tratamiento erradicador, pero sí antisecretores de mantenimiento, fue del 5,6% (OR de 0,24; IC 95% de 0,09 a 0,67).
Diversos estudios han evaluado la incidencia de recidiva hemorrágica en pacientes con erradicación de H. pylori confirmada y que fueron seguidos sin administrar tratamiento antisecretor de mantenimiento240–259. Dado que la duración del seguimiento oscila notablemente entre los diversos estudios, se han tenido en cuenta los períodos de seguimiento de cada uno y hemos calculado la incidencia de recidiva hemorrágica anual respectiva (por paciente y año de seguimiento). Así, el seguimiento global fue de 1.913 pacientes-año, y se detectaron 13 recidivas hemorrágicas entre los pacientes en los que se erradicó la bacteria; así, la recurrencia anual es de tan solo 0,88% por paciente y año de seguimiento6.
Estos resultados favorables han sido confirmados en un estudio multicéntrico español, en el que se incluyeron prospectivamente 1.000 pacientes con hemorragia digestiva por úlcera gastroduodenal en los que se erradicó la infección por H. pylori y, posteriormente, no se prescribió tratamiento antisecretor260. Se detectaron tres episodios de recidiva hemorrágica al año de seguimiento (en dos casos tras la ingesta de AINE y en uno tras la reinfección por H. pylori), y otros dos episodios a los dos años (uno tras la ingesta de AINE y otro tras la reinfección por H. pylori). La incidencia acumulada de resangrado fue del 0,5% y la tasa de incidencia del 0,15% por paciente-año.
De los resultados mencionados se deduce que el tratamiento de la infección por H. pylori es más efectivo que el tratamiento antisecretor (ya sea con o sin antisecretores de mantenimiento) para prevenir la recidiva hemorrágica por úlcera péptica. Consecuentemente, debe evaluarse la presencia de infección por H. pylori en todos los pacientes con hemorragia digestiva por úlcera péptica (de forma precoz261, idealmente durante el propio ingreso hospitalario262) y prescribirse tratamiento erradicador a aquellos que estén infectados. Una vez confirmada la erradicación (lo que debería hacerse siempre, y sin demora263) no es preciso administrar tratamiento de mantenimiento con antisecretores (si el paciente no requiere AINE), ya que la erradicación de H. pylori elimina la práctica totalidad de las recidivas hemorrágicas. No obstante, parece prudente que en una úlcera péptica que haya sufrido complicaciones (por ejemplo, hemorragia digestiva) se administren antisecretores hasta confirmar la erradicación de H. pylori.
Conflicto de interesesJ. Alcedo, J. Amador, L. Bujanda, X. Calvet, M. Castro-Fernández, E. Gené, A. Lanas, A.J. Lucendo, J. Molina-Infante, A. Pérez-Aisa e I. Puig declaran no tener ningún conflicto de intereses.
L. Fernández-Salazar actividad docente: Janssen, Norgine, Salvat, Tillots.
J.P. Gisbert asesoramiento científico, soporte para investigación o actividades formativas: Mayoly, Allergan, Diasorin, Gebro Pharma, Richen.
O.P. Nyssen soporte para investigación: Mayoly, Allergan.
Este documento se publica simultáneamente en las revistas Gastroenterología y Hepatología – [https://doi.org/10.1016/j.gastrohep.2021.07.011] y Revista Española de Enfermedades Digestivas – [https://doi.org/10.17235/reed.2021.8358/2021], con el consentimiento de los autores y editores.