El estudio reporta la modificación de los estudios dinámicos renales con radioisótopos (EDRR) en animales control después de la administración de medios de contraste iodado (MCI). Se realizó EDRR con 99mTc-DTPA (37MBq) en ratas (n=9, Sprague Dawley) adquiriendo un cuadro/s durante el primer minuto y luego un cuadro/15 s, completando los 30 min. Una semana después se repitió el EDRR una hora después de la administración intravenosa de MCI. Los resultados mostraron que las curvas basales se encontraban dentro de los patrones normales esperados, TMAX 3,1±1,8min, T50%Mx 7,25±1,90min y valores de función renal relativa (FRR) normales, 50,0±4,3%. Las curvas post-MCI mostraron cambios cualicuantitativos como prolongación del TMAX hasta 12min, la fase de eliminación compatible con un patrón obstructivo y la FRR se mantuvo dentro del rango normal. En conclusión, el MCI interfirió con la función renal normal como se demuestra en el EDRR.
The study presents a modification of the radionuclide basic renogram (RBR) in control animals after the administration of iodine contrast media (ICM). Sprague-Dawley rats (n=9) were used to perform RBR with 99mTc-DTPA (37 MBq) under control conditions. Dynamic studies were acquired taking 1 frame/1 second during the first minute, and then one frame/15s up to 30min. After one week, we repeated the RBR but this time it was performed one hour after the intravenous administration of ICM. The results showed that RBR under control conditions displayed functional curves with the expected normal patterns: mean TMAX of 3.1±1.8min, T50%Mx of 7.25±1.90min, and normal relative renal functions of 50.0±4.3%. Changes that affected functional curves after ICM administration were TMAX of 12min, and the elimination phase was significantly prolonged while relative renal function remained normal. In conclusion, ICM interfered with normal renal function as demonstrated in RBR.
Existen diversos ámbitos en los cuales se utilizan medios de contraste y radiofármacos de manera simultánea. Por ejemplo, los controles de salud que se realizan a los pacientes oncológicos suelen requerir estudios de Medicina Nuclear como la centellografía ósea con 99mTc-MDP o la tomografía por emisión de positrones (PET) con18F-FDG de manera asociada con otras técnicas diagnósticas como la tomografía computarizada (TC) con contraste iodado intravenoso entre otras. La optimización de las prácticas multimodales con equipos híbridos PET-TC, PET y resonancia magnética nuclear (PET-RMN) y tomografía de emisión de fotón único y TC (SPECT-TC) también pone de manifiesto este hecho, pues la utilización de contraste iodado aumenta la sensibilidad y especificidad de dichos métodos diagnósticos1, sobre todo a nivel de cuello, donde poder diferenciar estructuras vasculares de otras, es de vital importancia.
Por otro lado, el advenimiento y desarrollo de la imagenología para pequeños animales también incluye a los equipos híbridos entre las herramientas que hoy se encuentran al alcance de la investigación preclínica. En este sentido, la utilización simultánea de sondas para diferentes modalidades brinda un amplio espectro de posibilidades para la puesta en marcha de protocolos de investigación2–4.
La afectación que produce el contraste iodado en la función renal está ampliamente reportada en la imagenología en humanos, sobre todo en aquellos pacientes con antecedentes de enfermedades como diabetes mellitus, nefrouropatías y tumores productores de catecolaminas, entre otras5–7. Asimismo, también se han reportado interacciones farmacológicas entre medicamentos convencionales y medios de contraste iodado8. Sin embargo, esto no es así para el caso de los medios de contraste y los radiofármacos.
Es por ello por lo que el objetivo de nuestro trabajo de investigación fue estudiar la performance de los estudios dinámicos renales con radioisótopos (EDRR) en animales control a los que previamente se les administró un medio de contraste iodado por vía intravenosa.
Materiales y métodosAnimalesSe utilizaron 9 ratas sanas controles de la cepa Sprague Dawley (hembras, peso promedio 250±26g). Los animales fueron anestesiados previamente al comienzo de los estudios imagenológicos con la mezcla de quetamina/xilacina en dosis estándar por kilo de peso9.
Los procedimientos realizados en los animales estuvieron de acuerdo con las recomendaciones internacionales del Guidelines for the welfare and use of animals in cancer research British Journal of Cancer del 2010. Asimismo, los protocolos realizados fueron aprobados por el Comité de Ética para el Uso y Cuidado de Animales de Laboratorio de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires (EXP-FYBN°53406/2013).
RadiofármacoSe radiomarcó el 99mTc-DTPA (Nefrotec®, Tecnonuclear S.A.) con el eluído de un generador de 99Mo/99mTc (Laboratorios Bacon S.A.I.C.) y se realizó el control de calidad según las especificaciones del fabricante.
La administración del radiofármaco se realizó en bolo en una dosis de 37 MBq, por una venopunción realizada en la vena lateral de la cola de cada animal.
Protocolo de trabajoEn la primera semana del protocolo se realizó el EDRR basal a cada uno de los individuos involucrados en el estudio. Para ello, se ubicó a cada animal en posición ventral sobre el colimador de la cámara gamma para estandarizar su posición. La adquisición de las imágenes comenzó unos segundos antes de que fuera administrado el radiofármaco de manera que se capturase el flujo de radiofármaco desde su instante cero de administración lo que permitirá valorar correctamente el pasaje del 99mTc-DTPA por los grandes vasos; esto es indispensable para obtener la fase de perfusión de la curva renográfica.
En la segunda semana del protocolo se repitió el EDRR en las mismas condiciones en las que fue realizado el estudio basal, pero una hora antes del inicio se administró por vía intravenosa iopamidol 75,5%, contraste iodado comercial no iónico (Opacrile 370, Laboratorios Bacon S.A.I.C.) en dosis de 1mg/kg por vía intravenosa.
Imágenes y equipamientoLas imágenes fueron adquiridas en una cámara gamma planar (Ohio Nuclear®, modelo Sigma 420) de campo chico equipada con colimador de alta resolución. El protocolo de adquisición de EDRR consistió en registrar las imágenes durante 30 min totales diferenciando 2 etapas: un cuadro/s durante el primer minuto para construir la curva correspondiente a la fase de perfusión renal y luego un cuadro/15 s por el resto de la adquisición para construir la curva renográfica integral que abarca la totalidad de la adquisición.
Las imágenes obtenidas fueron analizadas en un software (Alfanuclear® IM512P) dedicado para animales. Se utilizaron 2 protocolos de procesamiento semiautomáticos que permitieron la evaluación de la curva de la fase de perfusión renal y la curva renográfica integral, por separado.
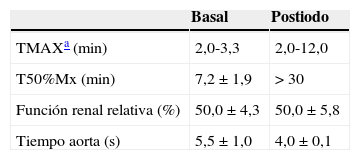
Sobre las curvas renográficas obtenidas se calcularon diferentes parámetros característicos10,11. Los resultados expresados como TMAX reflejan el tiempo en el cual la curva renográfica alcanza su valor máximo expresado en cuentas a lo largo del tiempo. Aquellos expresados como T50%Mx representan el tiempo que tarda la curva renográfica en alcanzar la mitad de su valor máximo y los valores expresados como función renal expresan la función renal relativa y fueron calculados por la relación de las áreas debajo de cada curva entre los límites de integración. En todos los casos los resultados se expresan como media y desviación estándar del grupo de datos.
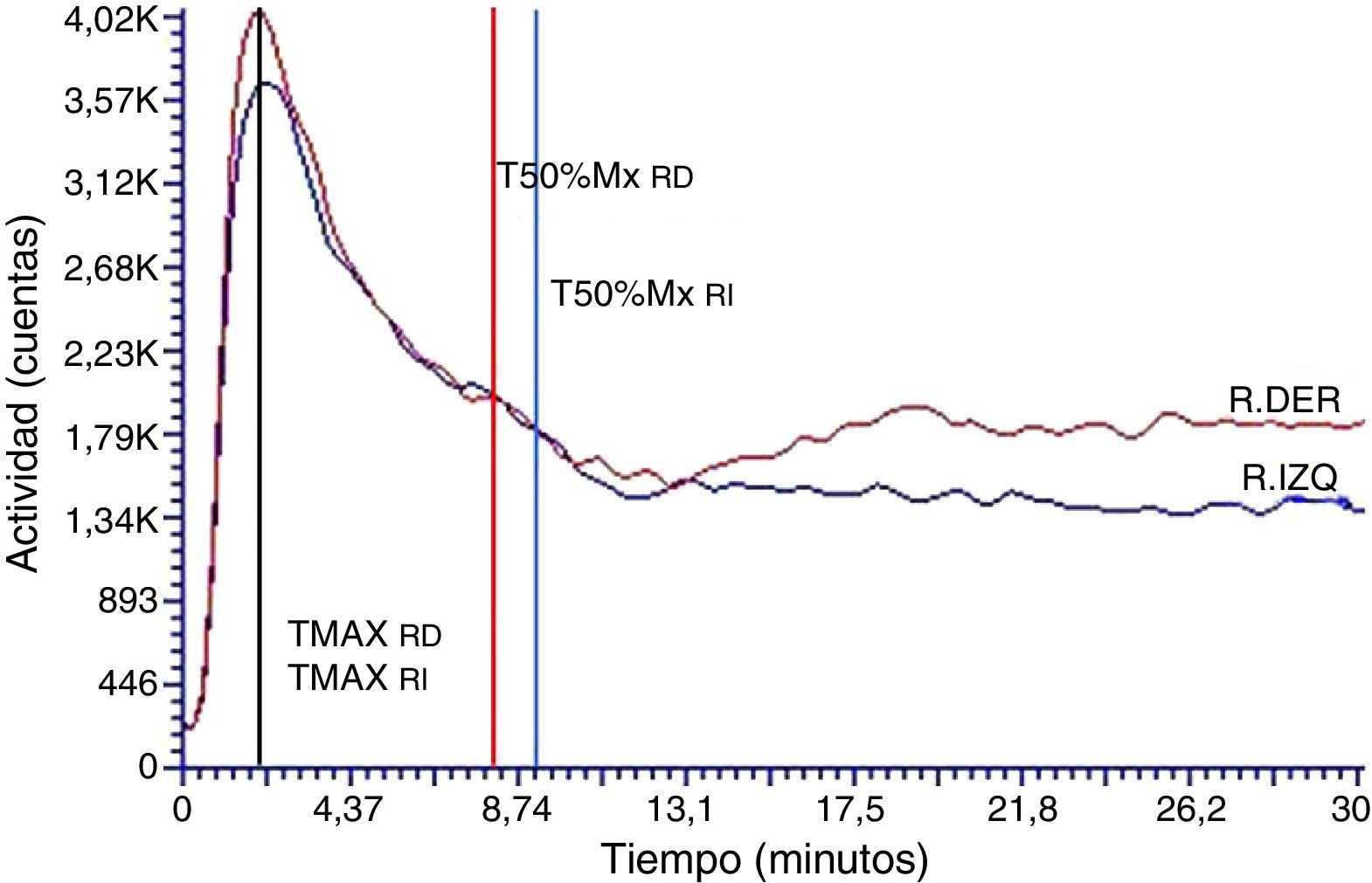
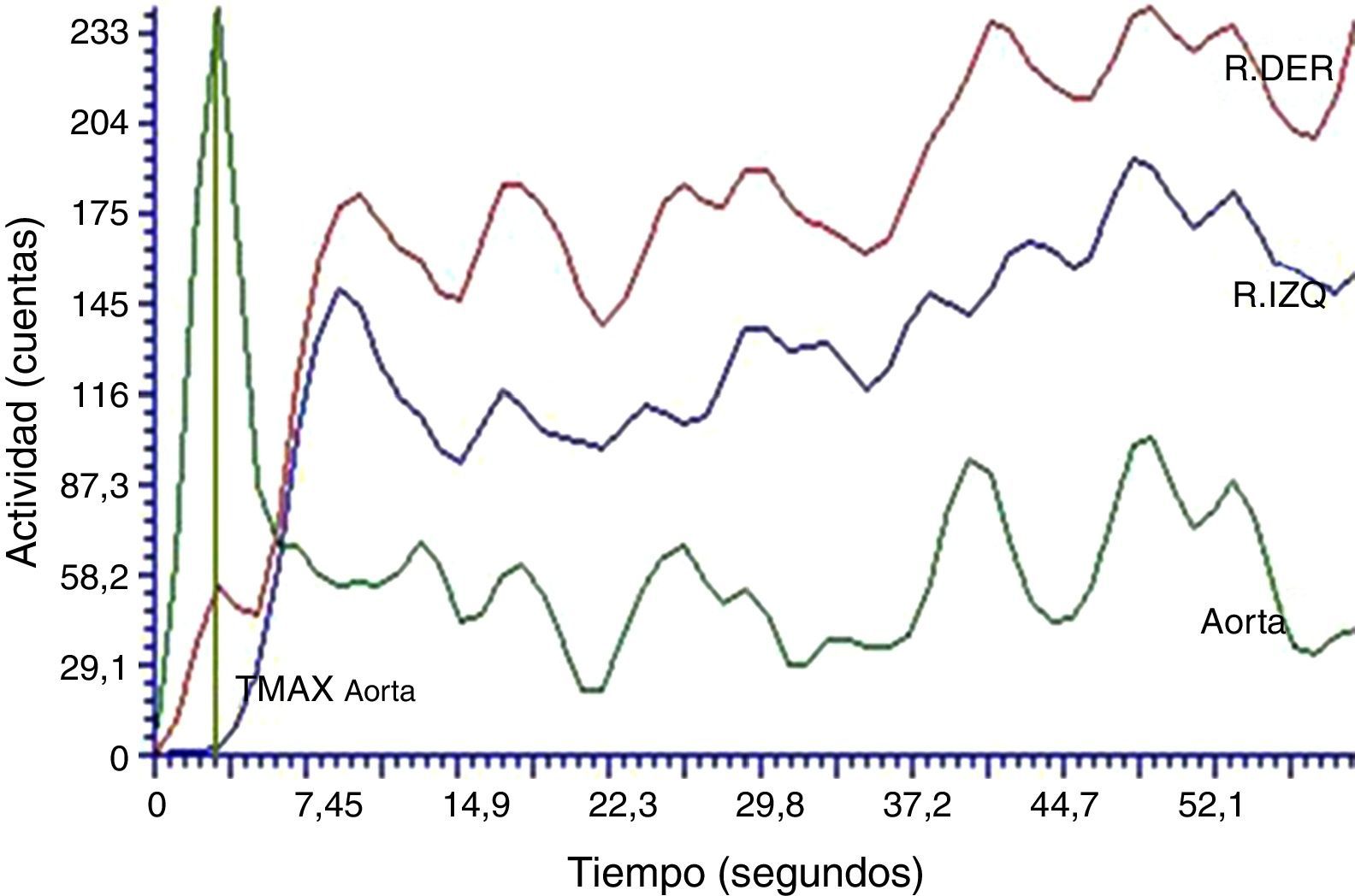
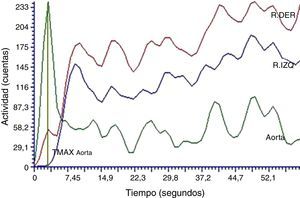
ResultadosEstudios dinámicos renales con radioisótopos basalesLas curvas renográficas permiten diferenciar las 3 fases típicas de perfusión, función y eliminación características de estos estudios junto con las pendientes respectivas esperadas de cada una de las etapas (fig. 1). Particularmente, aquellas curvas construidas a partir de los datos obtenidos en los primeros 60 s, correspondientes a la fase de perfusión renal, mostraron picos pronunciados en las respectivas curvas aórticas. Esto pone en evidencia la llegada del radiofármaco a la arteria aorta en tiempos cortos posteriores a la inyección de 5,5±1,0 s. Por otro lado, también se verifican las curvas renales ascendentes para ambas siluetas renales (fig. 2). Los parámetros característicos calculados sobre la curva renográfica integral revelaron que el TMAX resultó de 3,1±1,8 min, indicando el comienzo de la fase de eliminación, el T50%Mx promedió los 7,25±1,90 min y la función renal relativa en todos los animales se encontró dentro de los valores normales para cada riñón 50,0±4,3%11 (tabla 1).
Resultados del análisis de las curvas renográficas basales y postadministración de MCI
| Basal | Postiodo | |
|---|---|---|
| TMAXa (min) | 2,0-3,3 | 2,0-12,0 |
| T50%Mx (min) | 7,2±1,9 | > 30 |
| Función renal relativa (%) | 50,0±4,3 | 50,0±5,8 |
| Tiempo aorta (s) | 5,5±1,0 | 4,0±0,1 |
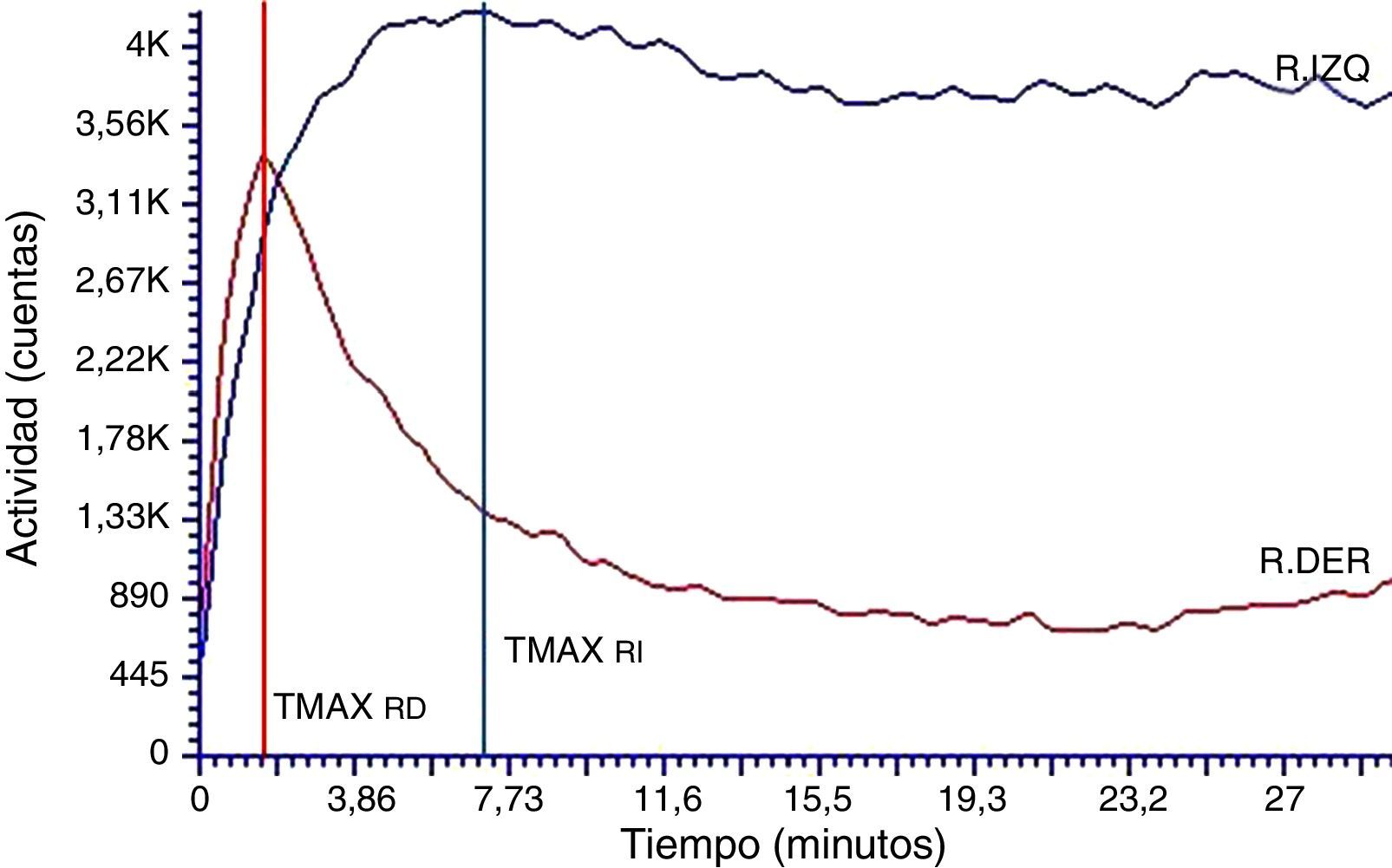
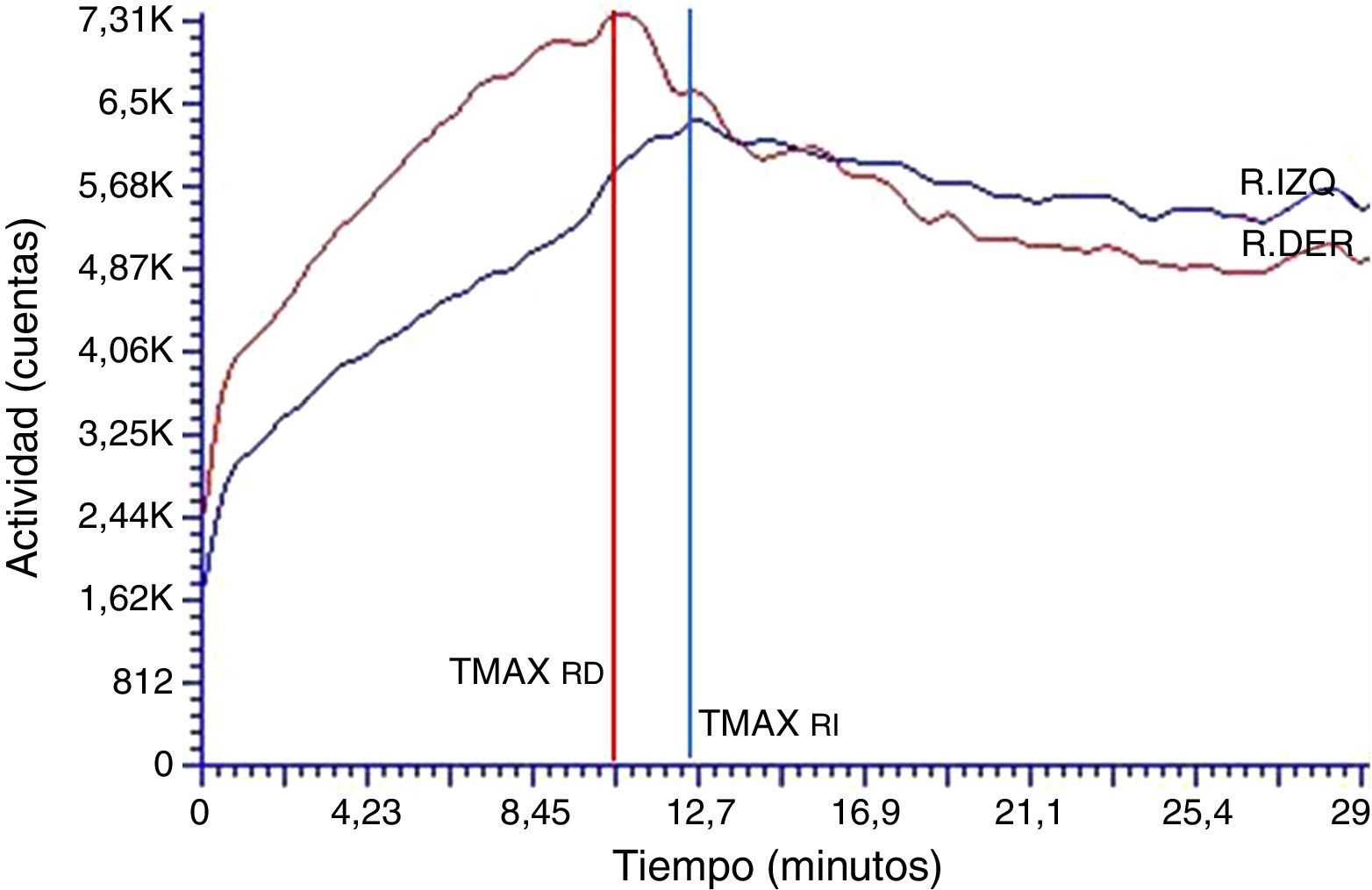
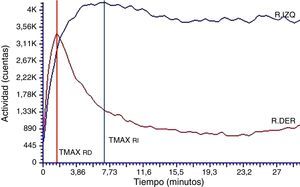
De todos los estudios adquiridos, el análisis de la curva renográfica obtenida para uno de los individuos del grupo no muestra el patrón normal para las curvas teóricas (fig. 3) de los estudios renales en humanos reportados en bibliografía11,12. El hallazgo implicó la exclusión del individuo del grupo en estudio. Particularmente, mostró un patrón normal para la curva del riñón derecho (RD) con parámetros de TMAX (1,8 min) y T50%Mx (6,0 min) dentro de los límites normales mientras que el riñón izquierdo (RI) mostró un patrón de tipo obstructivo con TMAX prolongado (7,3 min) y no fue posible determinar el T50%Mx. Los valores de la función renal relativa fueron 60 y 40% para el RD y el RI, respectivamente.
Curva renográfica basal con patrón de eliminación alterado para el riñón izquierdo.
La curva renográfica muestra el TMAX conservado para el RD. La curva renográfica del RI es compatible con un patrón de eliminación obstructivo, mostrando retraso al valor pico de la curva (TMAX alargado) y sostenimiento de la etapa de eliminación (T50%Mx >30).
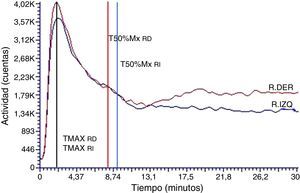
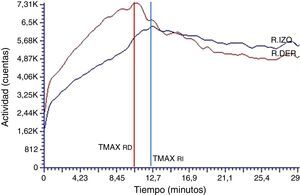
El análisis de las curvas renográficas correspondientes a los EDRR postadministración del medio de contraste iodado por vía intravenosa exhibió modificaciones cualicuantitativas. En principio, se encontraron patrones alterados en las etapas de función y eliminación de la curva renográfica a expensas de modificaciones en la duración y pendiente asociadas a cada una de las etapas. En relación con esto, y a consecuencia de ello, los TMAX calculados fueron muy variables, dependiendo de si la alteración se producía en la etapa de función, en la de eliminación o en ambas, con valores en el rango de 2-12 min. Asimismo, los T50%Mx se encontraron retrasados o ni siquiera fue posible calcularlos para la duración total de la adquisición, reportándose como >30 min. Es más, en todos los casos, la fase de eliminación mostró un patrón alterado semejante a aquel de carácter obstructivo11–13 (fig. 4).
La evaluación de la fase de perfusión (fig. 2), segmento correspondiente a los primeros 60 s de la curva renográfica, no mostró ningún tipo de alteración cualicuantitativa (tabla 1).
DiscusiónResulta interesante aclarar que el animal excluido del ensayo fue considerado como un outlier pues el EDDR demostró enfermedad renal previa y no conocida. La nefropatía crónica progresiva es una enfermedad renal que puede afectar a las ratas de laboratorio14–16. Así, la imagenología adquiere vital importancia en este estudio puesto que permitió que cada individuo sea su propio control, identificando a este animal previo a la administración de MCI, evitando que la variación individual interfiera con las observaciones en la dinámica renal. En el abordaje clásico de los protocolos de investigación se utiliza un grupo control y un grupo tratado por lo que si nuestro outlier hubiera pertenecido al grupo de los animales tratados no se hubiera identificado la patología preexistente considerándola una modificación de la dinámica renal por interacción con el MCI.
La administración de medios de contraste iodado intravenoso es rutinaria en la realización de estudios por imágenes. Su uso mejora la detectabilidad al modificar los patrones de atenuación en los tejidos, aumentando la certeza diagnóstica17,18.
Shinn-Huey Chou et al. reportaron19 que el 31% de los pacientes tratados previamente con procedimientos que requirieron el uso de contraste iodado intravenoso y luego fueron tratados mediante una TC sin contraste mostraron retención del MCI en el parénquima renal hasta por 7 días posteriores a dicho procedimiento. Los autores indicaron que este hecho podría aumentar el riesgo de desarrollar nefropatías inducidas por el contraste. Además, identificaron que la retención presenta 2 patrones de persistencia predominantes: patrón global de realce en el 24% de los casos y patrón cortical de realce en el 10%, e indicaron que la retención se produciría en los glomérulos corticales, responsables de la filtración renal, y en concordancia con la fisioanatomía renal. En este sentido, ha sido ampliamente reportado que el contraste iodado intravenoso induce nefropatías que en muchos casos pueden llegar a ser muy severas y a poner en riesgo la vida del paciente5–7. Es más, la administración de medios de contraste iodado figura como la tercera causa de insuficiencia renal adquirida en el hospital (11% de los casos)20, y es especialmente probable si el paciente está sensibilizado fisiopatológicamente por disfunción renal subyacente, diabetes mellitus, anemia o si es anciano21.
Por otro lado, también existen reportes de retención de medios de contraste iodado en hígado y bazo por tiempos cercanos a los 7 días en animales de experimentación utilizados para investigación preclínica17.
Estudios realizados en animales de experimentación han demostrado que la administración de medios de contraste iodado por vía intravenosa modifica los parámetros de flujo sanguíneo tanto en la médula como en corteza renal. Esto se debería al fenómeno de downregulation en la síntesis de óxido nítrico endógeno cortical, que actúa como vasodilatador para el mantenimiento del flujo sanguíneo renal y la función normal en la microvasculatura renal cortical22. Otros estudios también realizados en animales de experimentación indican que el medio de contraste iodado podría producir estenosis en los túbulos de los glomérulos, disminuyendo así el flujo sanguíneo y aumentando los niveles de especies reactivas del oxígeno, que aumentarían la probabilidad de sufrir una nefropatía23.
Considerar el efecto de las características fisicoquímicas de los medios de contraste iodados en la función renal, especialmente su viscosidad, osmolaridad e hidrofilia, todos ellos propios del iopamidol como representante de los contrastes derivados del ácido triiodobenzoico, monomérico y no iónico24, es importante, ya que su viscosidad a 20°C es 20 veces mayor que para el agua a igual temperatura y la osmolaridad es aproximadamente 2,5 mayor a la del plasma sanguíneo. Esto induce cambios hemodinámicos y en los túbulos renales25–27 que contribuyen al desarrollo de daño renal aguda y también existen reportes de que los medios de contraste inducen necrosis y apoptosis de las células del túbulo renal28.
El presente reporte muestra que el medio de contraste iodado interfirió con la función renal normal, como se demuestra por los resultados obtenidos, en la comparación de los EDRR pre- y postadministración de contraste iodado intravenoso. En nuestro estudio tanto el medio de contraste iodado utilizado, iopamidol 75,5%, como el radiofármaco 99mTc-DTPA, poseen la misma vía de eliminación mediante filtración glomerular como único mecanismo para ambos compuestos12,23. Los resultados obtenidos mediante imagenología nuclear muestran que las modificaciones cualicuantitativas de las curvas renográficas del EDRR postadministración del medio de contraste iodado respecto de las del EDRR basal se corresponderían con el concepto nefrotóxico asociado a la utilización de medios de contraste iodado intravenoso y lo reforzarían. Por otro lado, podría considerarse la posibilidad de traslación de los hallazgos al humano, dado que el comportamiento farmacocinético de los medios de contraste iodado, de tipo no iónicos, es comparable entre estas especies cuando son administrados por vía intravenosa29.
Finalmente, es importante tener en cuenta que la interferencia hallada durante la realización del EDRR en el presente reporte indica que esto podría suceder con otros radiofármacos cuya eliminación depende de la normal función renal, como por ejemplo el 99mTc-MDP o 99mTc-ciprofloxacina, etc. Las implicaciones de dicha interferencia deberían estudiarse, puesto que se podrían ver afectadas las distribuciones biológicas, tanto en el tiempo como en sus correspondientes patrones de captación en los diferentes radiofármacos, resultando perturbadas la dosimetría interna y la certeza diagnóstica asociadas a su uso.
FinanciaciónProyecto UBACyT 20020130100721BA de la Secretaría de Ciencia y Técnica, Universidad de Buenos Aires: Desarrollo de radiofármacos y protocolos de imágenes moleculares en animales de experimentación. Programación Científica 2014-2017. Resolución (C.S.) 921/14.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.