El aumento significativo de la cirugía plástica de mama –estética y oncológica– que se ha producido en los últimos años hace reflexionar sobre la posibilidad de una reducción de sensibilidad mamográfica. Con este estudio, se quiso valorar la posibilidad de obtener imágenes mamográficas con una pérdida mínima de sensibilidad por medio de la aplicación selectiva y racional de la técnica de Eklund (TE) con abordaje frontal oblicuo (FOA), y sacando ventajas de las posibilidades que ofrece la tecnología digital con el uso racional del post processing (Pp), ya que su aplicación a imágenes obtenidas con TE y FOA permite visualizar más tejido mamario y detectar algunas modificaciones intracapsulares y extracapsulares asintomáticas.
Para realizar el estudio se ha utilizado un mamógrafo IMS “Giotto Image” y un CR Fuji “PROFECT CS” con algoritmos originales y modificados. Los resultados preliminares parecen mostrar que en la práctica clínica el uso racional y combinado de Pp, TE y FOA puede ayudar a limitar la pérdida de sensibilidad mamográfica y, en algunos casos, sugerir una integración de diagnóstico justificada.
The significant increase in breast implant surgery – aesthetic al or oncological – seen in the last several years has led to consider the possibility of a reduction in mammographic sensitivity. This study attempts to determine the likelihood of obtaining mammographic images with a minimal loss of sensitivity by means of the selective and rational use of the Eklund technique (ET) with a frontal oblique approach (FOA), and taking advantage of the possibilities offered by digital technology and the rational use of post-processing(Pp), since when this is applied to images obtained with ET and FOA, more breast tissue can be seen and any intracapsular or extracapsular changes may be detected.
Mammographs obtained using IMS “Giotto Image” and a Fuji Profect CS – CR with original and modified algorithms were analysed in the study. The preliminary results appear to show that the rational and combined use of Pp, ET and FOA in clinical practice may help to limit the loss of mammography sensitivity and, in some cases, may justify an integrated diagnosis.
Actualmente, el número de mujeres con prótesis de mama se estima alrededor de 6 millones, con tendencia hacia un incremento continuo1. La mayoría de ellas llevan prótesis por motivo estético, aunque está creciendo también el número de reconstrucciones posmastectomía.
Aunque la resonancia magnética (RM) ha demostrado ser más eficaz en la detección de complicaciones1, la mamografía conserva el papel de herramienta importante para el diagnóstico temprano, y en el caso de mujeres con implantes, el técnico de mamografía debe actuar con mucho cuidado y experiencia2.
Desde que en 1968 Dempesey y Lathan descubrieron la colocación subpectoral en la mamoplastia de aumento, los planos utilizados suelen ser subglandular o subpectoral (o mixto, en la técnica dual-plane): a) en la colocación subglandular tenemos la ventaja de que el postoperatorio va a ser menos doloroso, así como la posibilidad que ofrece de corregir una ptosis mínima y de proporcionar un aspecto más natural, y b) en la colocación submuscular hay una cobertura mayor de la prótesis (lo que evita el tacto), un índice menor de contracturas y un riesgo menor de infección y hemorragia, por ser un plano avascular. En su contra, las desventajas de la elección subglandular son un sangrado mayor, una tendencia mayor a la contractura capsular y un porcentaje mayor de infecciones, frente a una recuperación más lenta y dolorosa en el caso de la colocación submuscular3. Con las dos técnicas pueden surgir una serie de complicaciones que se resumen en:
- –
Contractura capsular: más frecuente en los implantes subglandulares, que va a depender de varios factores, y que Baker clasificó en 4 grados:
- 1.
Grado I: la mama presenta tacto y forma natural.
- 2.
Grado II: la mama presenta un tacto un poco duro, pero con un aspecto natural.
- 3.
Grado III: la mama presenta un tacto duro y forma con visible distorsión.
- 4.
Grado IV: la mama presenta un tacto duro, forma distorsionada y dolor.
- 1.
- –
Asimetrías.
- –
Desplazamientos de la prótesis.
- –
Infecciones, seromas y hematomas.
- –
Pérdida de sensibilidad del pezón, según la vía utilizada.
- –
Depósitos de calcio (diagnóstico diferencial con carcinoma).
- –
Galactorrea, que suele ceder espontáneamente.
- –
Atrofia del tejido glandular y deformidad del tórax por la presión mantenida durante mucho tiempo.
- –
Extrusión de los implantes.
- –
Rotura de la prótesis3.
De hecho los implantes mamarios no duran toda la vida, y como causas de rotura encontramos el manejo que se realiza en la intervención quirúrgica y que puede debilitar la cápsula, así como el envejecimiento inevitable del implante, una compresión excesiva de la mama o un trauma.
En implantes de gel de silicona pueden ocurrir dos clases de rotura: a) una asintomática, cuando la cápsula que envuelve la prótesis no deja salir gel, y b) otras roturas caracterizadas por la migración del gel a distancia y la aparición de nódulos y dolor. El efecto más notable de una rotura está en la variación de tamaño y de forma del seno y, dependiendo del grado, los cambios pueden ocurrir en pocos días o en una temporada muy larga, y el tratamiento siempre va a ser el reemplazo de la prótesis1.
Por supuesto, el diagnóstico correcto de la mamografía en estas mujeres es escaso: como la opacidad del implante puede ocultar el tejido glandular a su alrededor, y su presencia puede hacer que sea difícil alcanzar la compresión óptima necesaria para obtener la imagen más adecuada4, la valoración mamográfica certificará de forma más limitada la presencia de lesiones que no se asocien a microcalcificaciones2, lo que se traduce en un incremento de falsos negativos y en una pérdida de sensibilidad mamográfica.
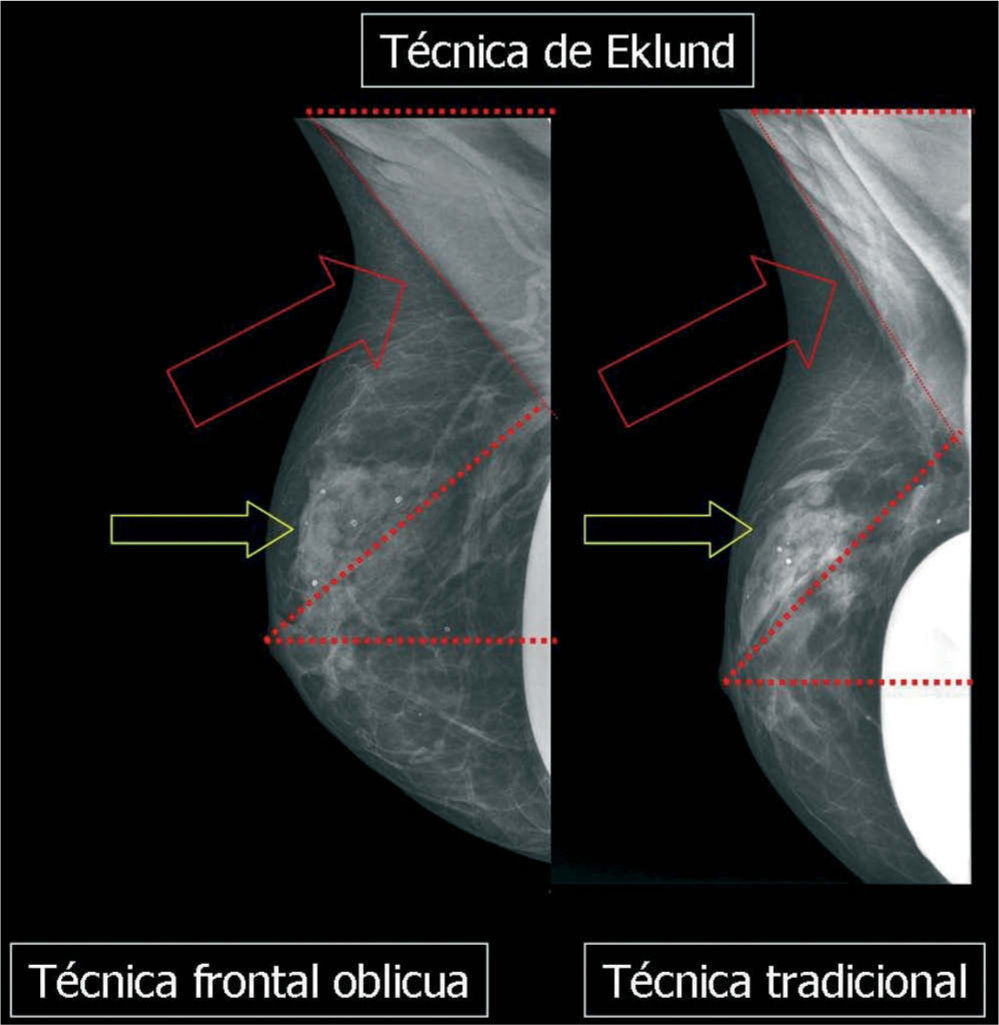
Eklund desarrollo una nueva técnica que presentó en 1988 y que consistía en el desplazamiento póstero-superior de la prótesis simultáneamente a la tracción anterior de la mama. Las ventajas de esta técnica de dislocación están representadas por una mejora significativa en calidad de imagen y por la visualización de una mayor cantidad de glándula mamaria5.
En la práctica, el éxito de la dislocación depende mucho de la colocación del implante; así, en el caso de falta de experiencia o de informe anamnéstico, se puede aprovechar un test muy sencillo para acertar la colocación del implante, invitando a la mujer a empujar con fuerza las manos contralas caderas: en presencia de implante submuscular, la maniobra determinará una depresión a nivel de los cuadrantes superiores, mientras que en presencia de implante subglandular, no se realizarán modificaciones sustanciales.
En un estudio comparativo entre técnica estándar y técnica de Eklund (TE), Silverstein et al midieron el tejido glandular visualizado antes y después la mastoplastia. La TE resultó ser mejor, independientemente del plano quirúrgico (reducción del 49% con técnica estándar frente al 39% con TE en implantes subglandulares; el 29 frente al 9% en implantes submusculares), aunque el implante submuscular facilita su aplicación. Tras este estudio, Silverstein sugirió realizar mamografías de cribado utilizando las proyecciones CC y OML con TE y con técnica tradicional, aplicando la mínima compresión necesaria6 para conseguir la inmovilización de la mama sin riesgo de rotura protésica (no debería sobrepasar los 60/80 N) (Aunque en una mamografía realizada por técnicos expertos el riesgo de rotura del implante es mínimo [según la Food and Drug Administration estadounidense y la bibliografía médica, se informó de 58 de implantes mamarios que se rompieron durante una mamografía de 1992 a 2002 en los Estados Unidos], estos deberían tener especial cuidado para asegurar que no se ponga presión excesiva en los senos, ya que la compresión también puede causar en algunos implantes de silicona de modelo antiguo fugas de material de relleno fuera de una cápsula afec tada2).
Estas proyecciones son necesarias para visualizar el perfil de los implantes, especialmente en las áreas posterior y axilar de la prótesis, mientras que las proyecciones CC y OML con TE permitirán la visualización de la glándula (que resultará distribuida en un área más amplia) y del tejido glandular periprotésico. Silverstein sugiere añadir una proyección ML con técnica estándar para visualizar áreas periprotésicas craneales y caudales, y la “tierra de nadie”7.
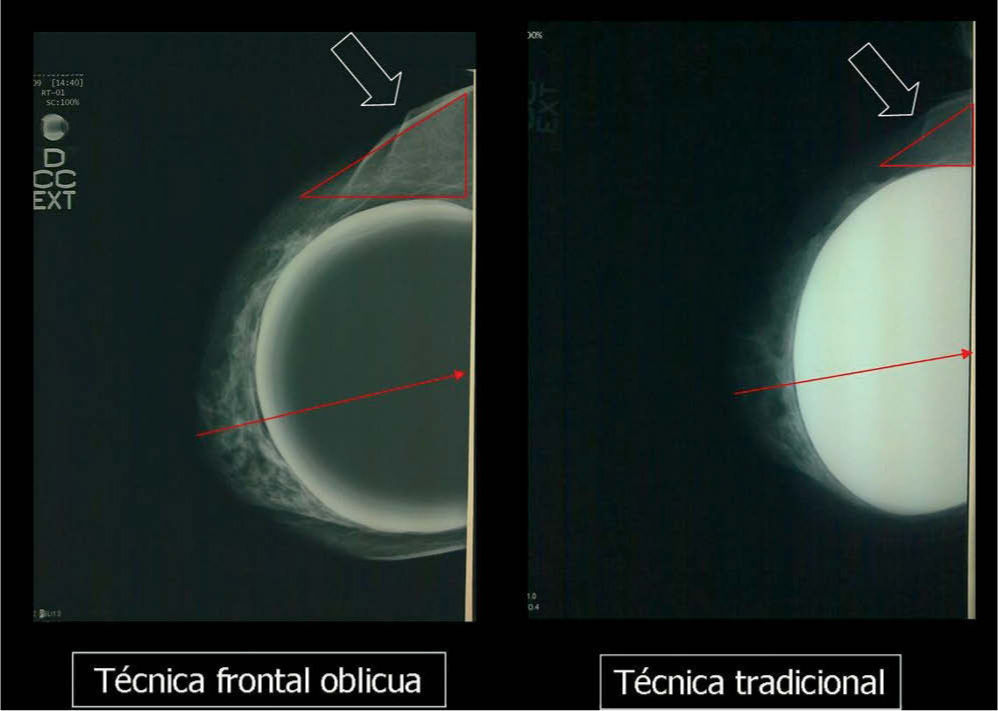
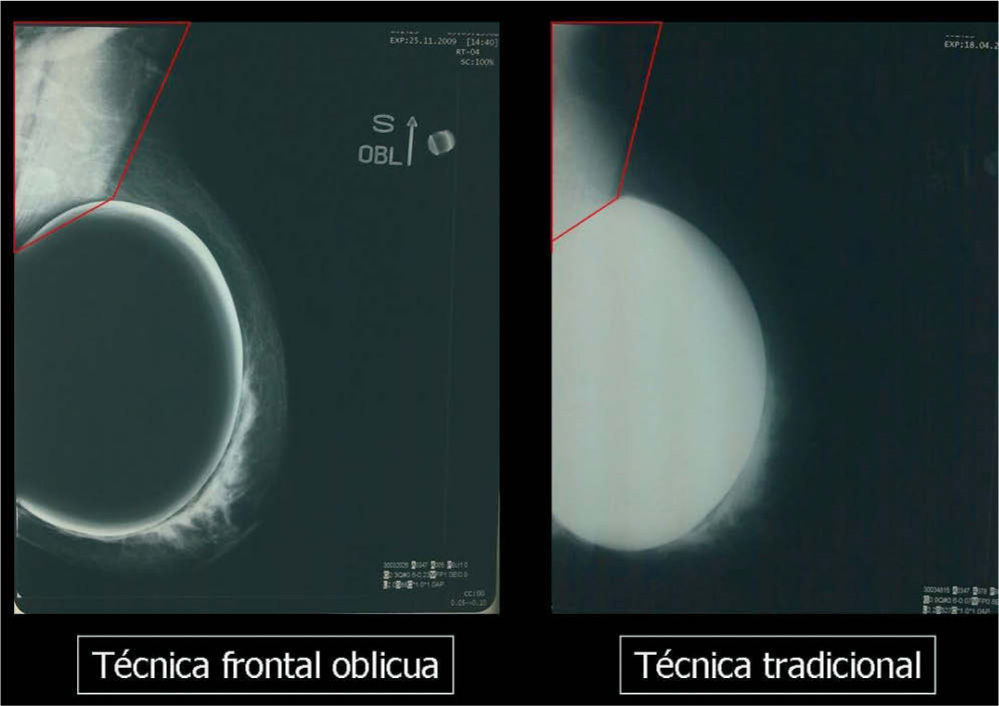
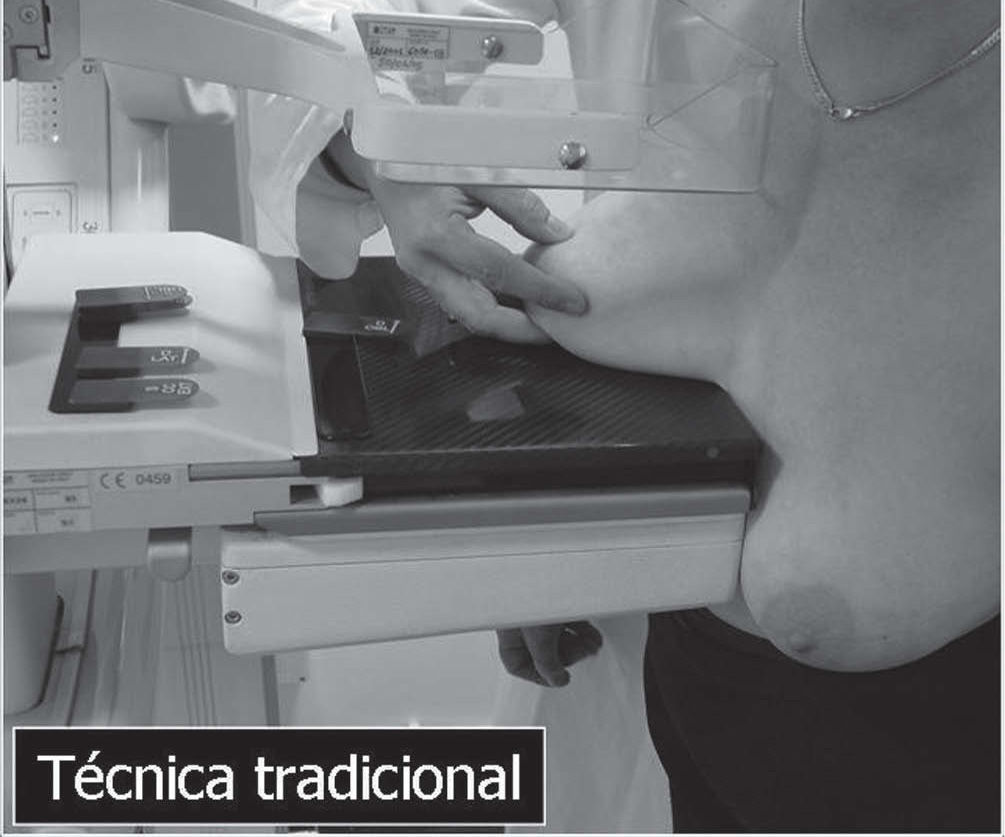
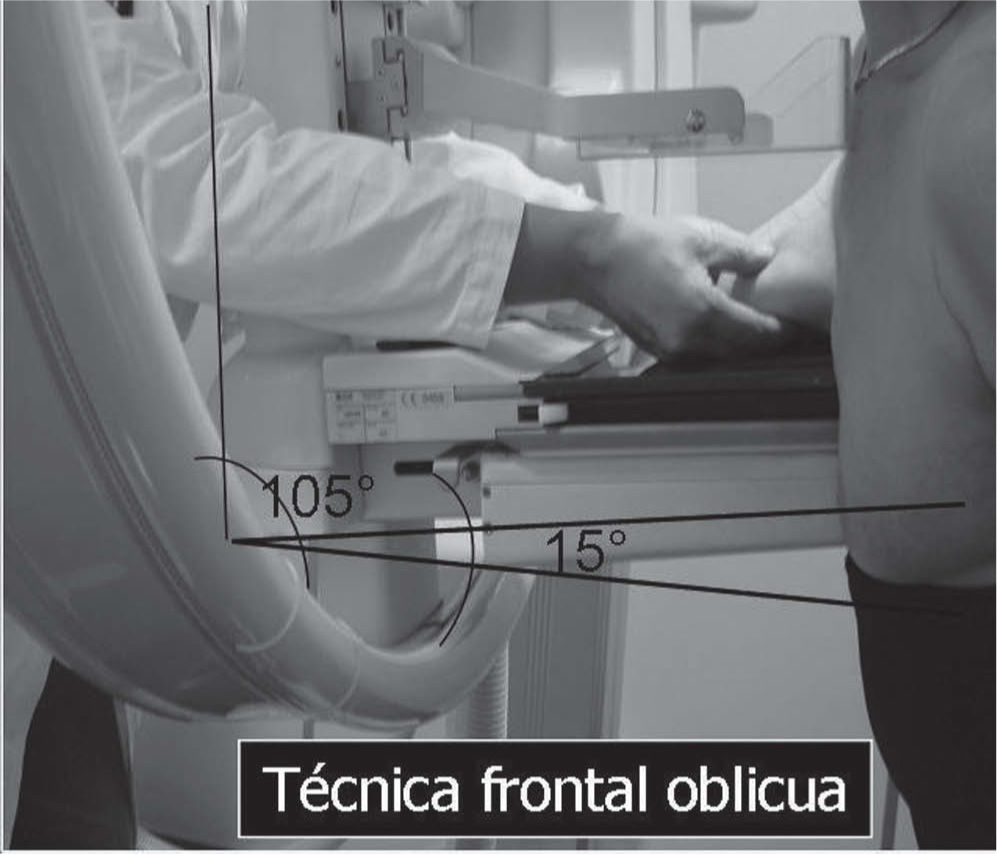
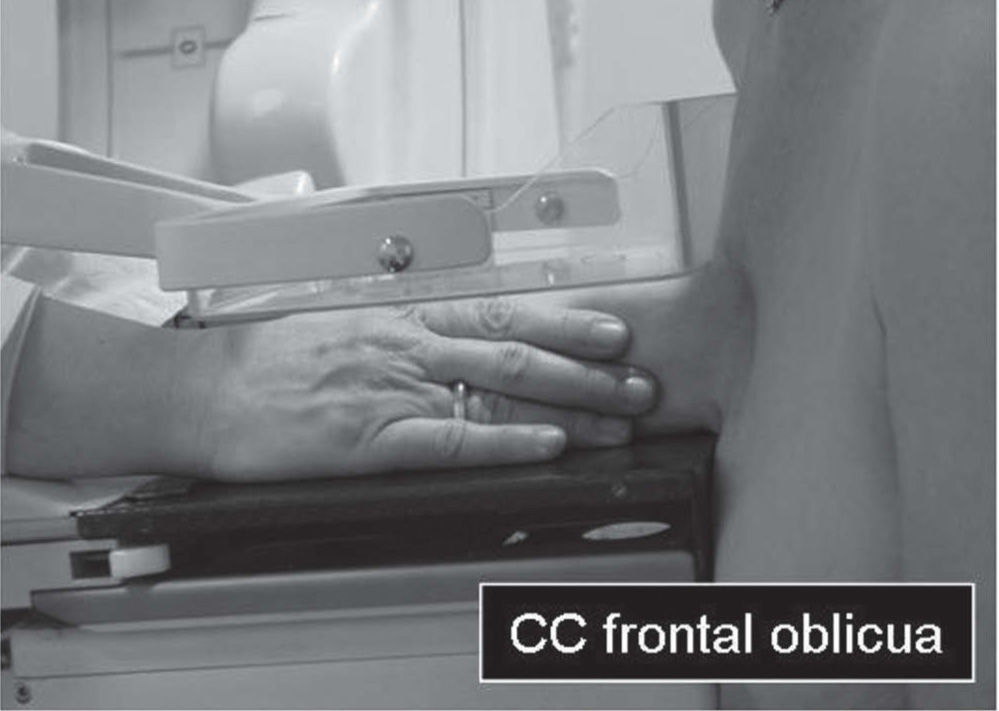
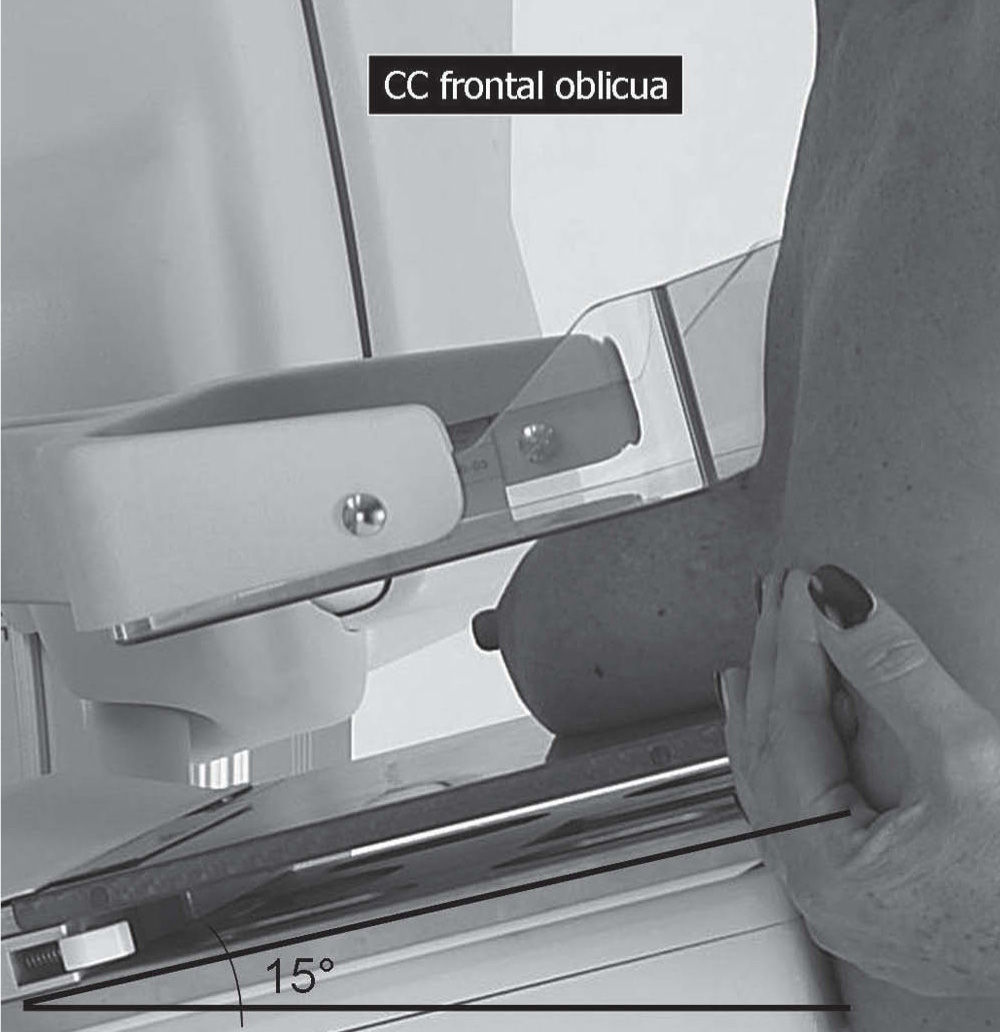
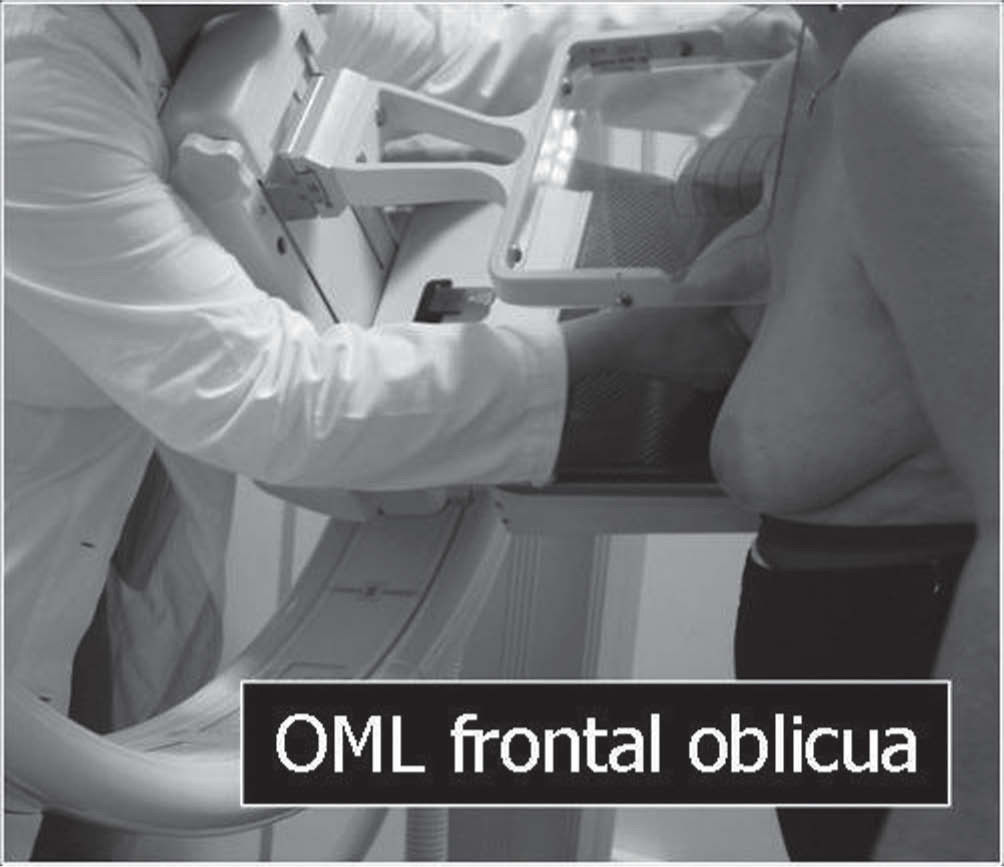
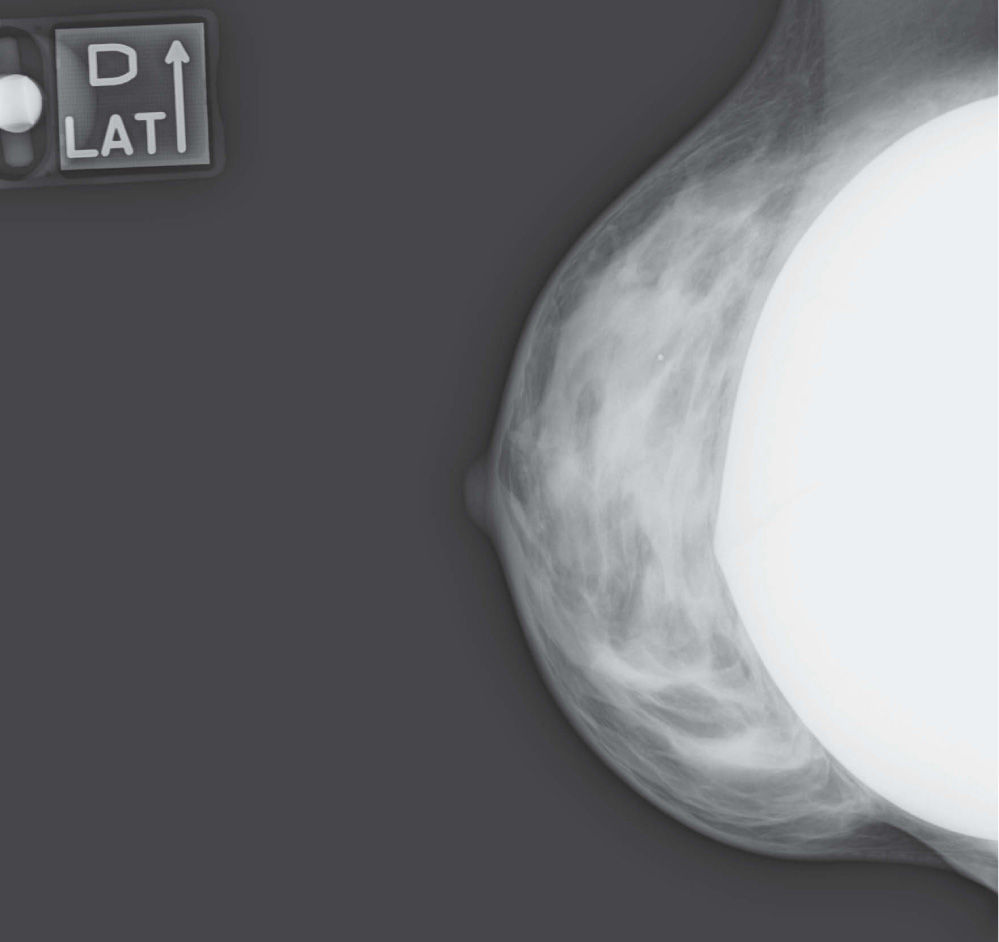
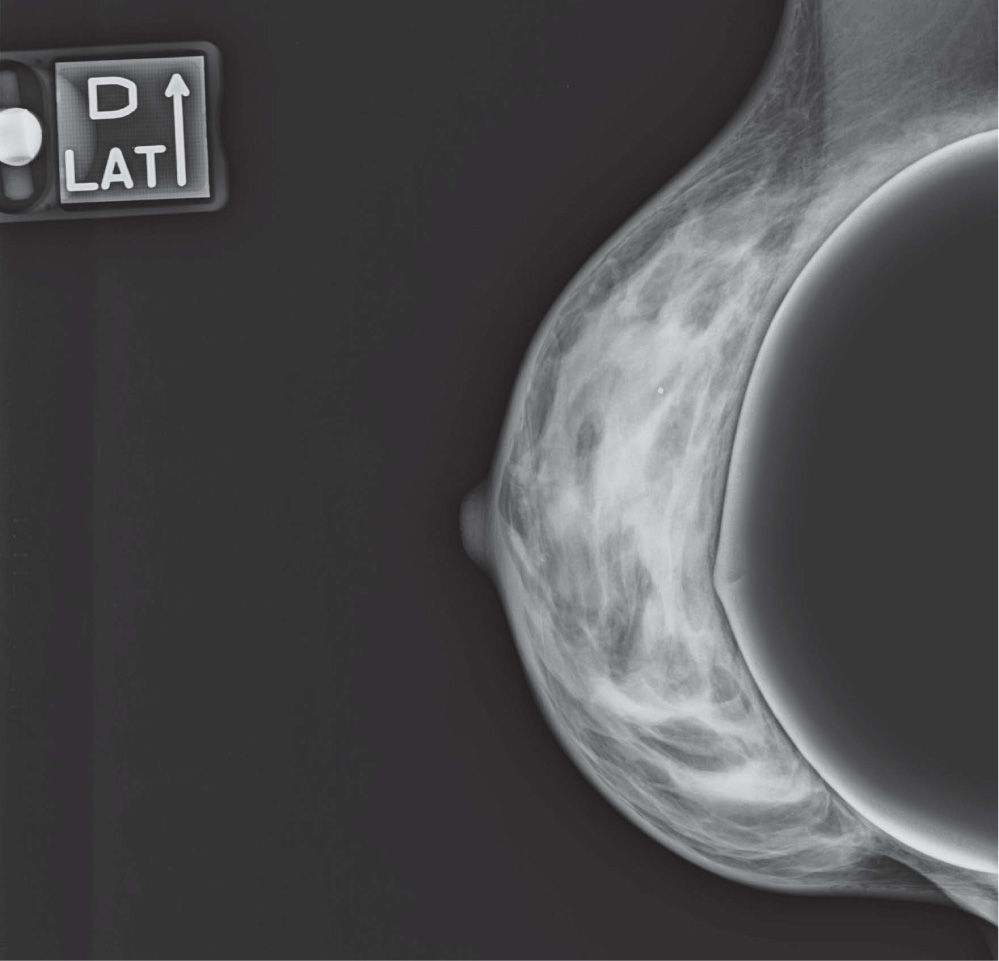
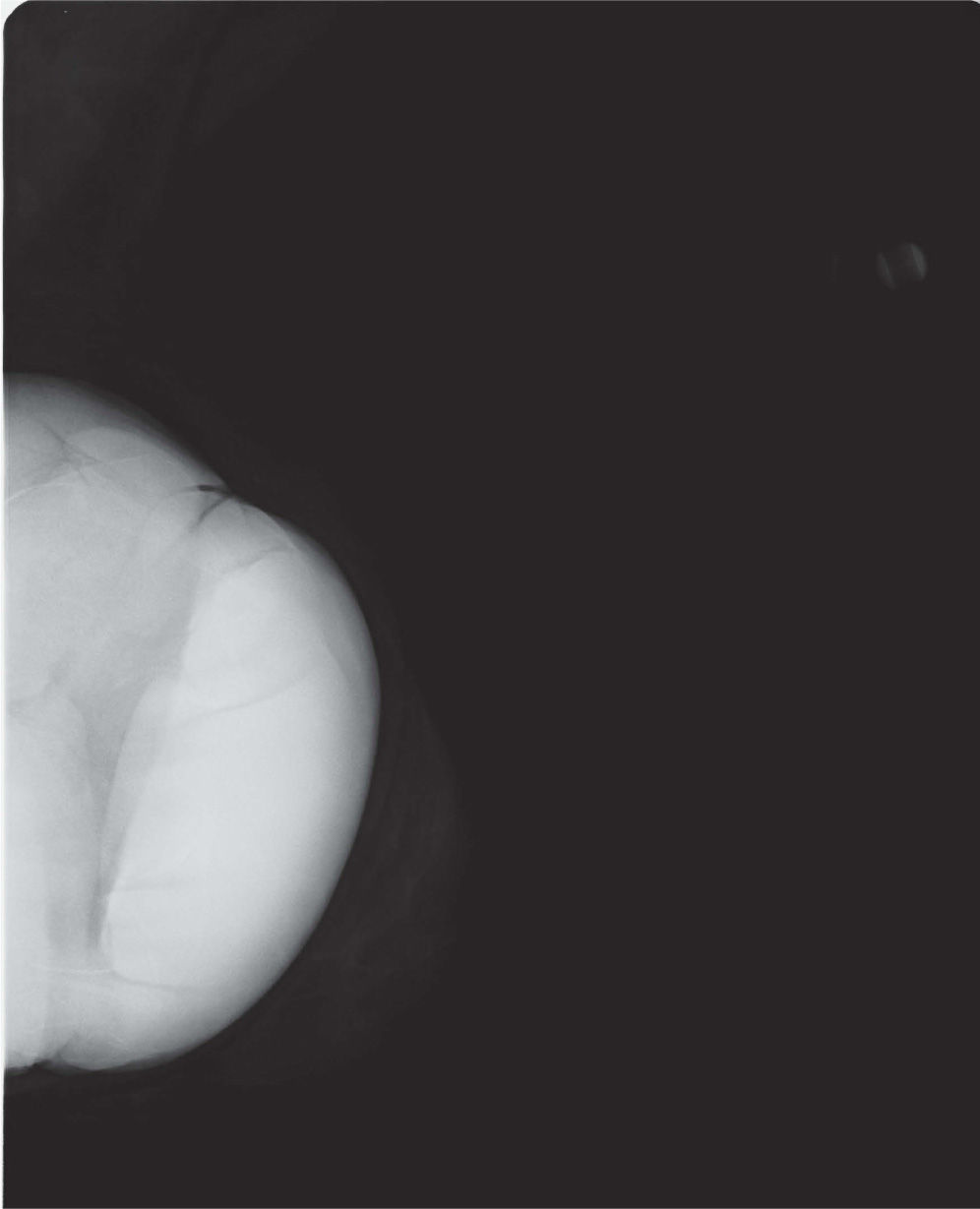
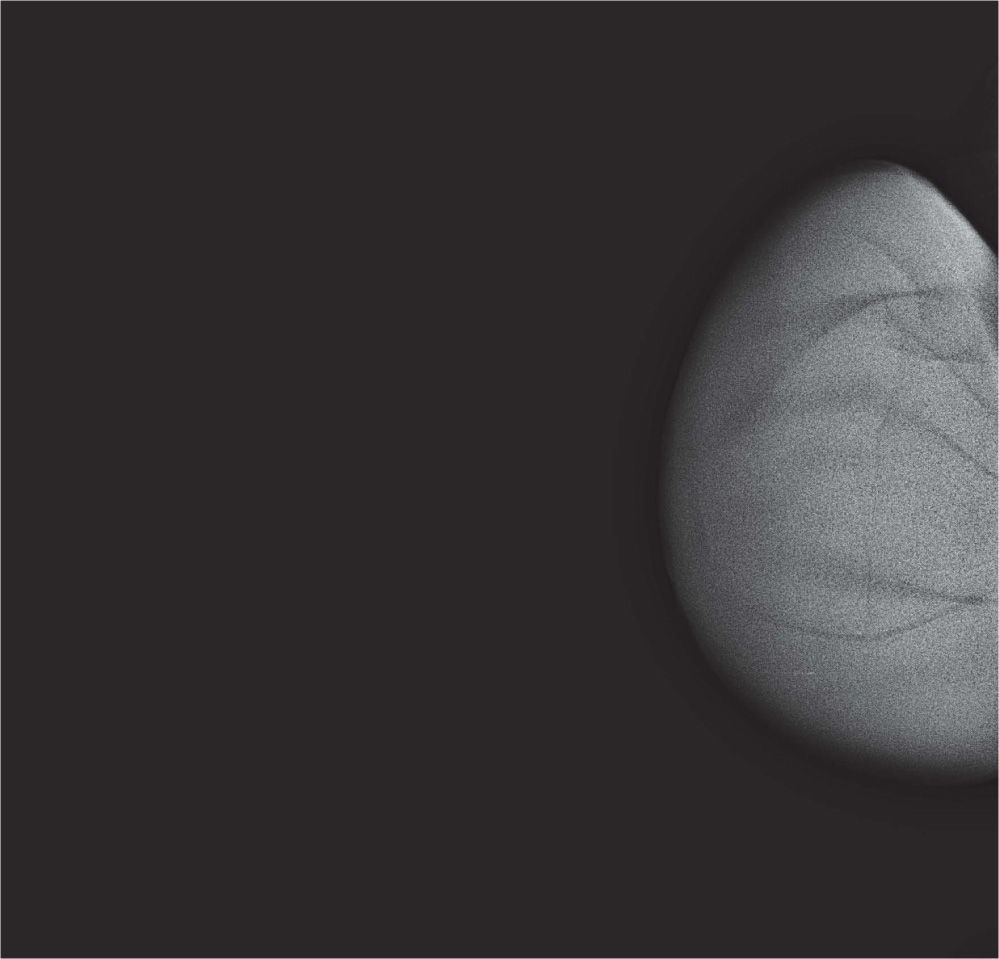
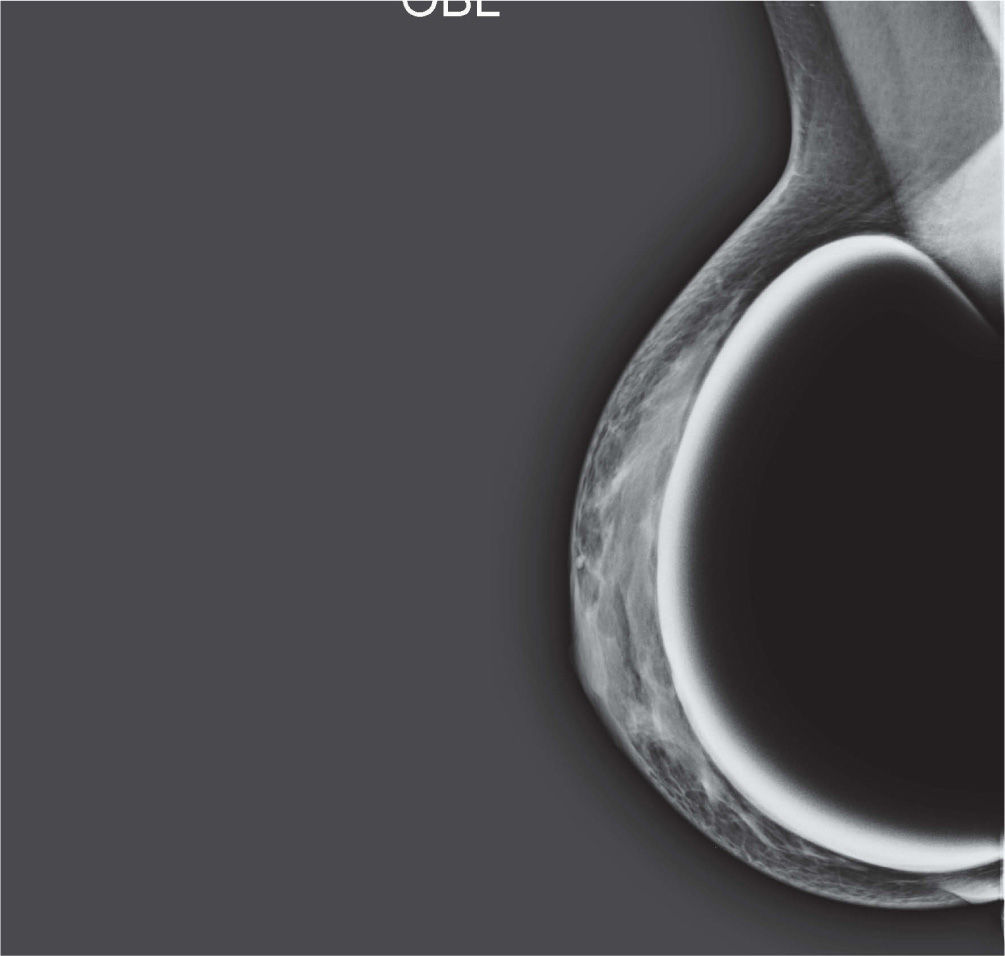
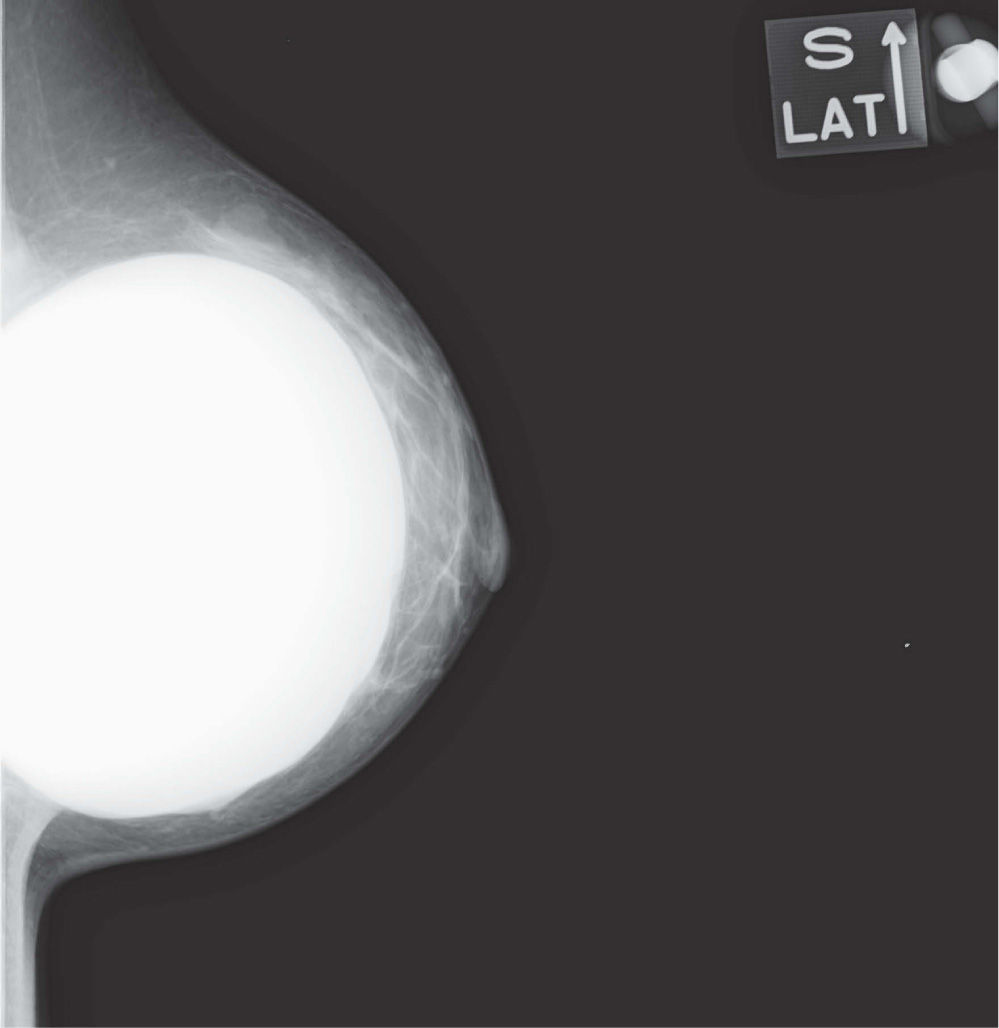
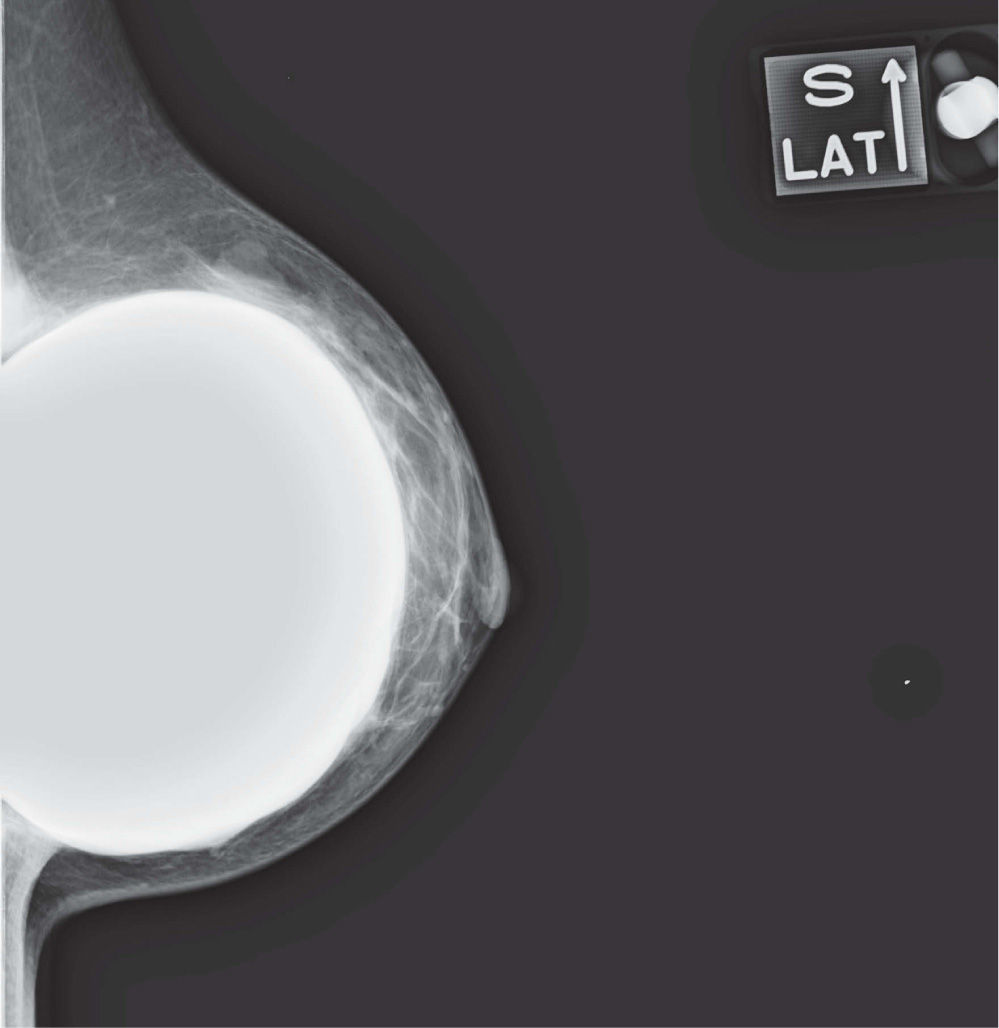
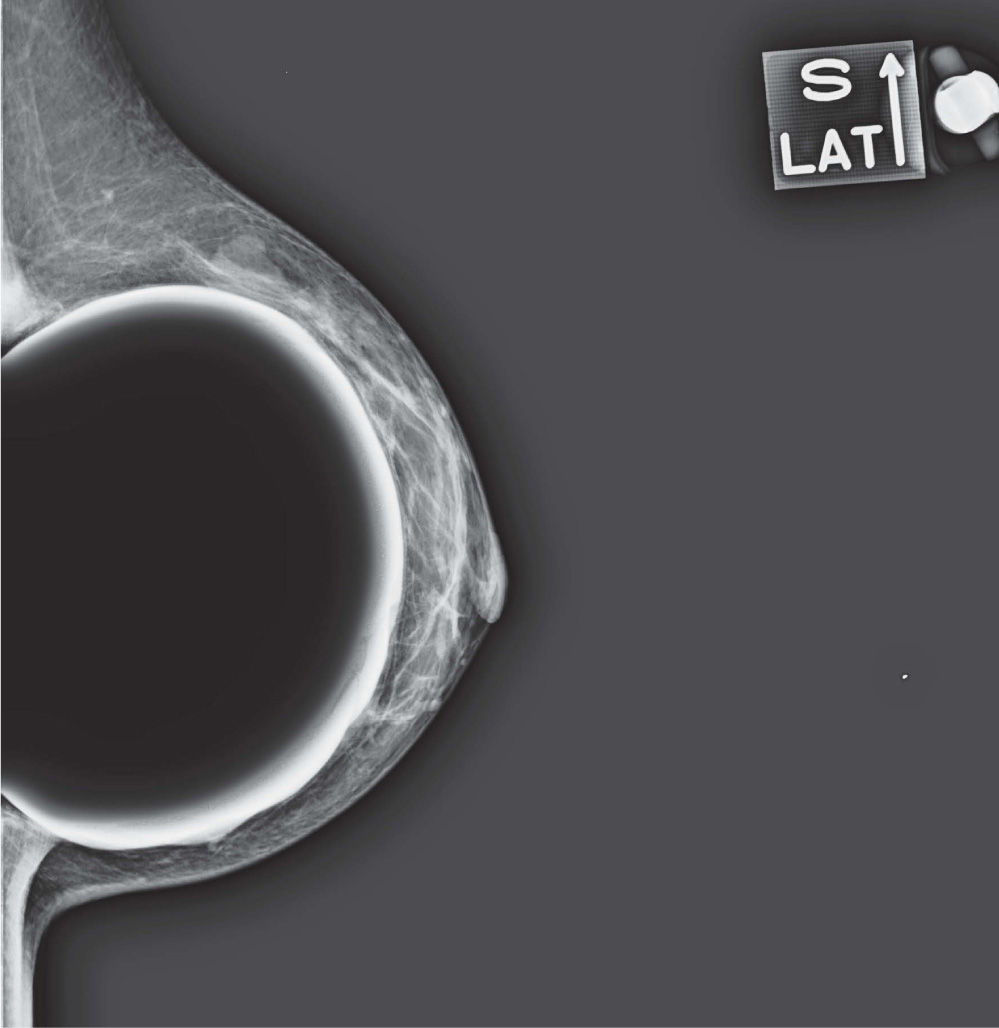
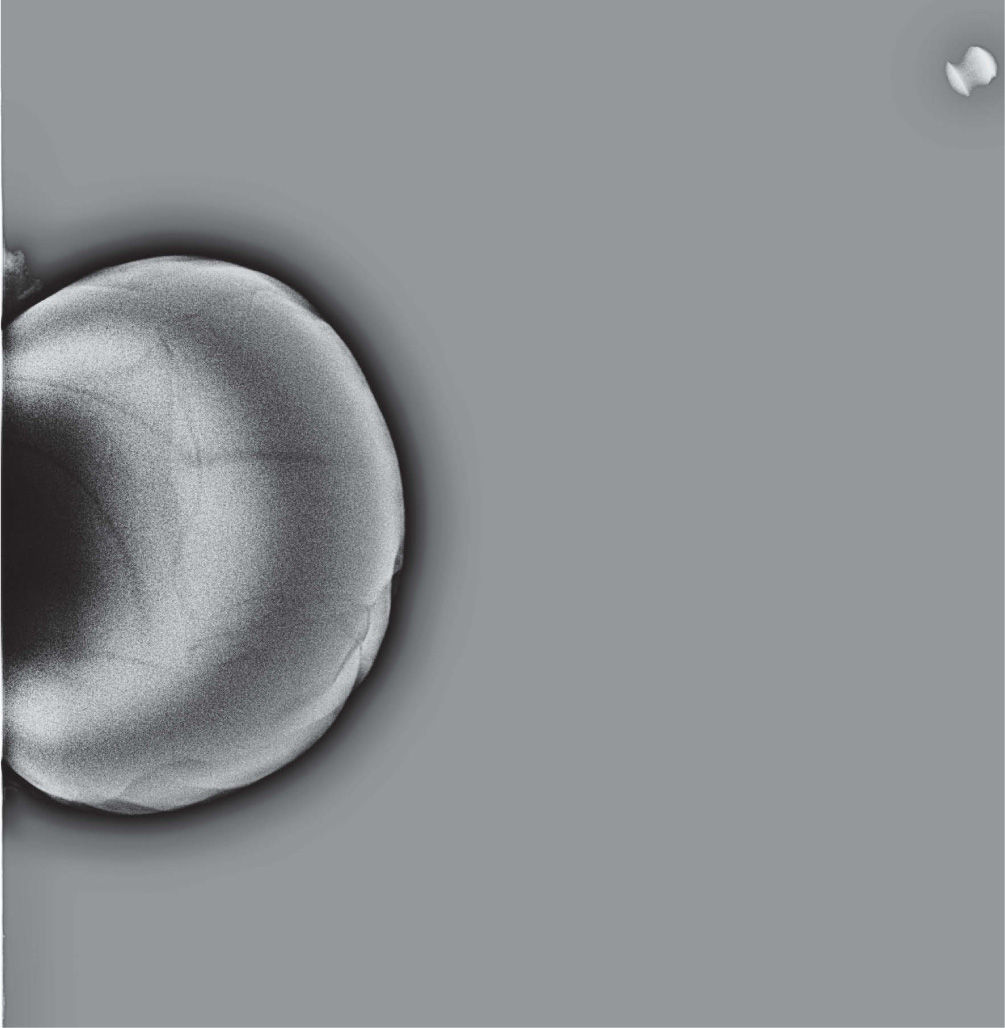
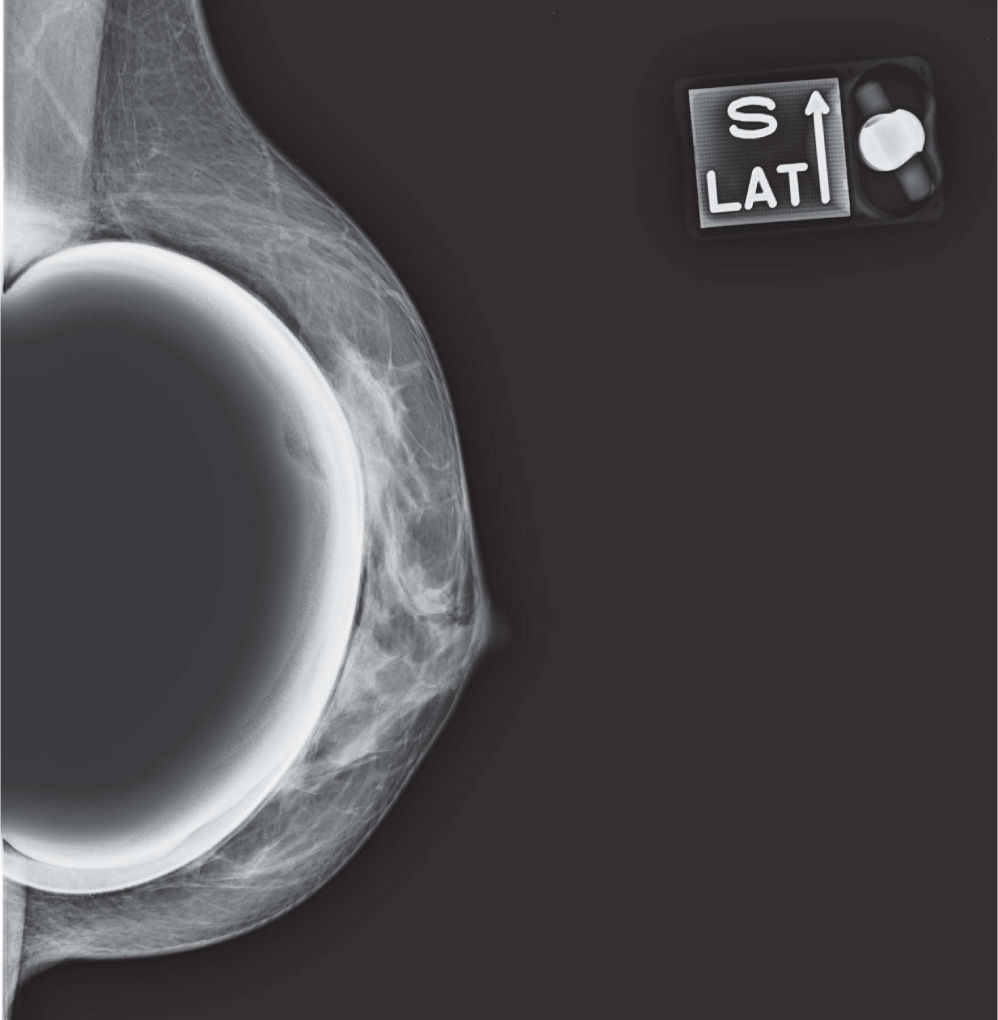
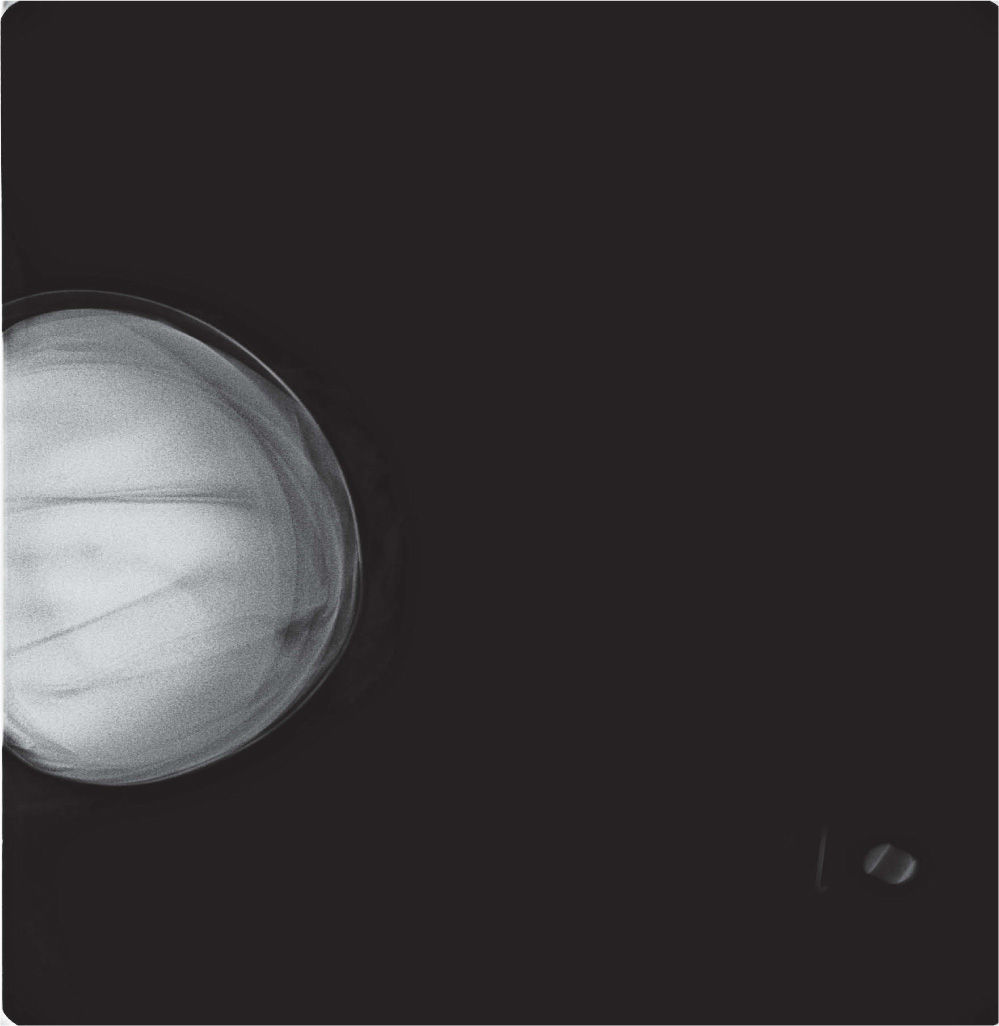
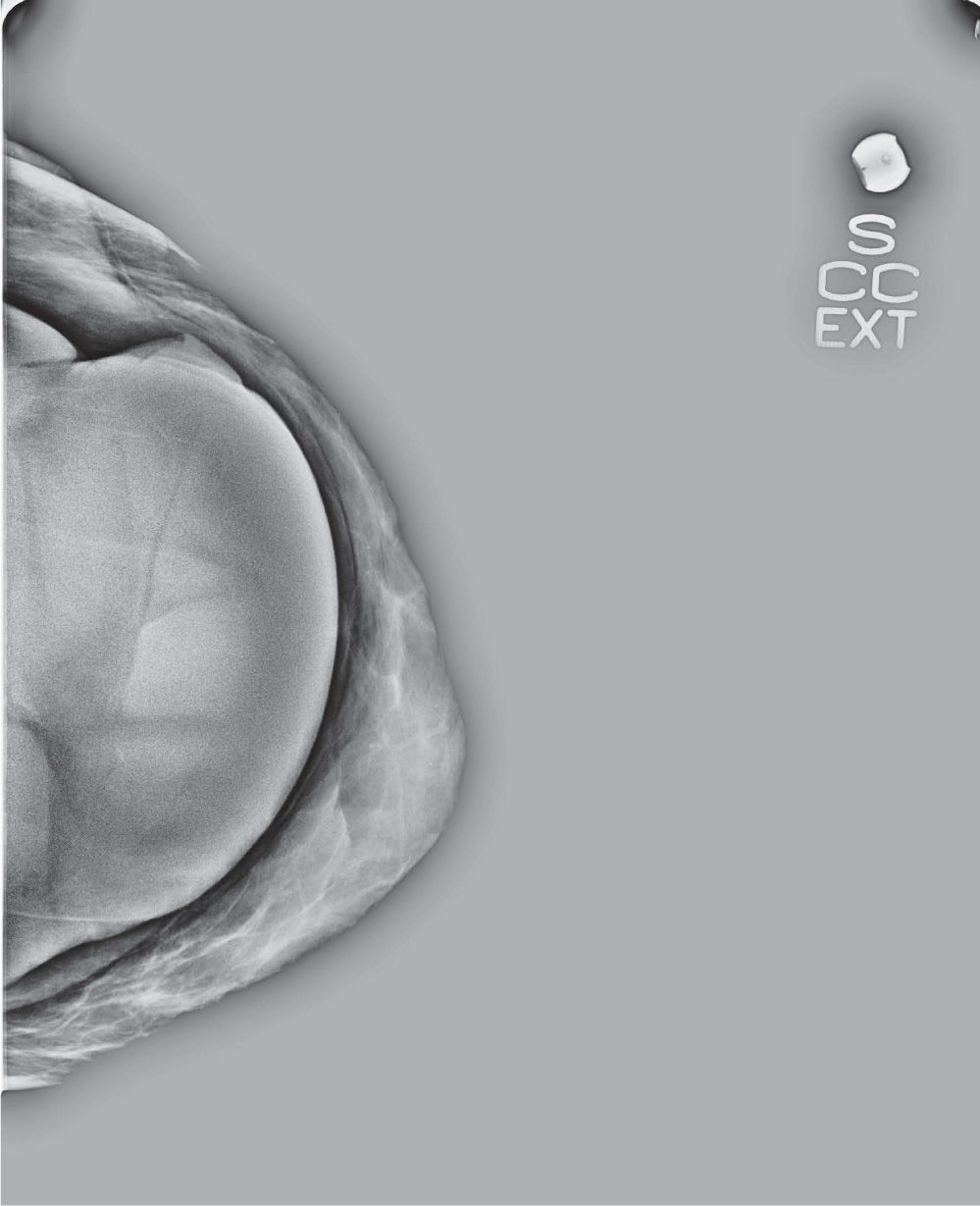
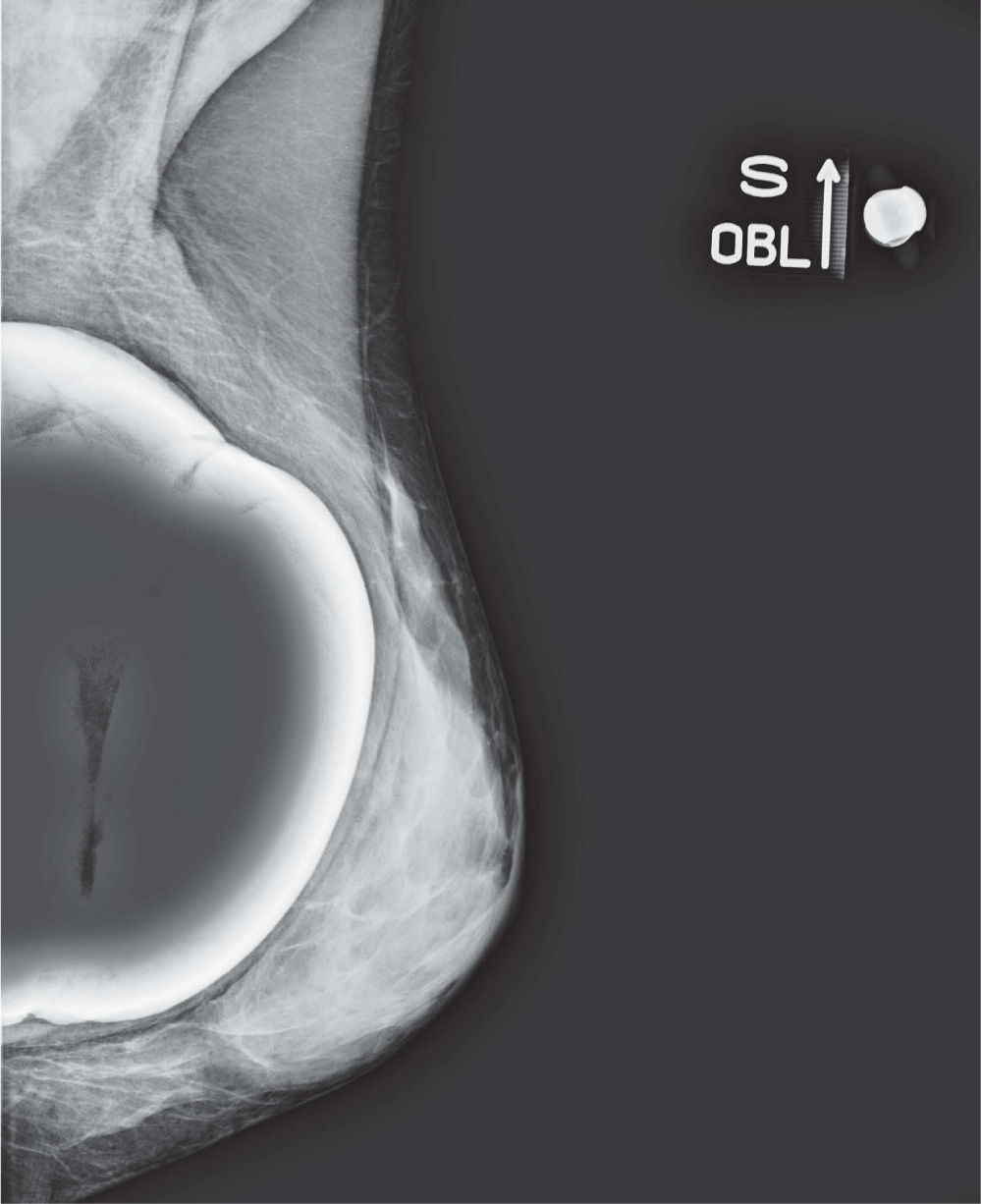
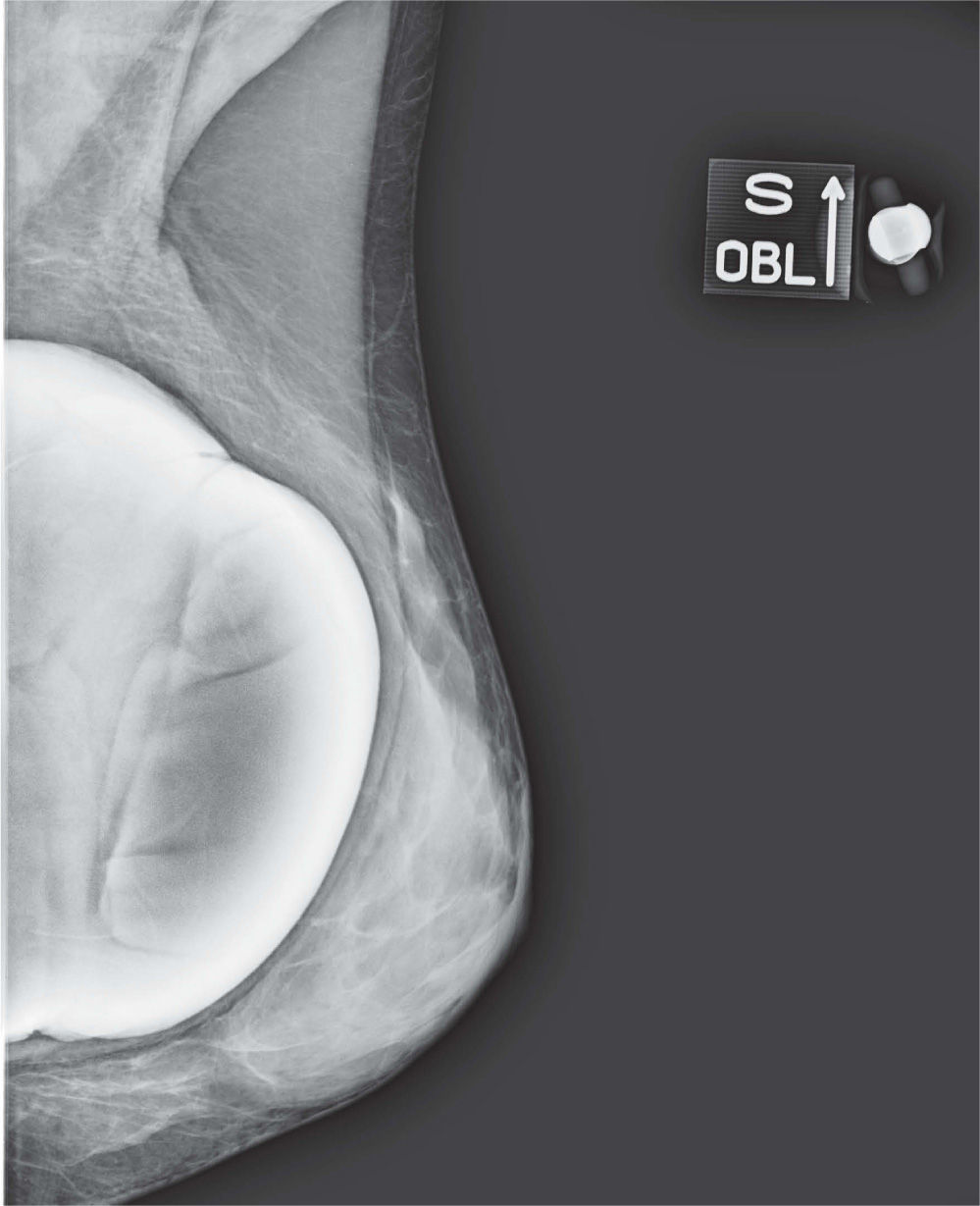
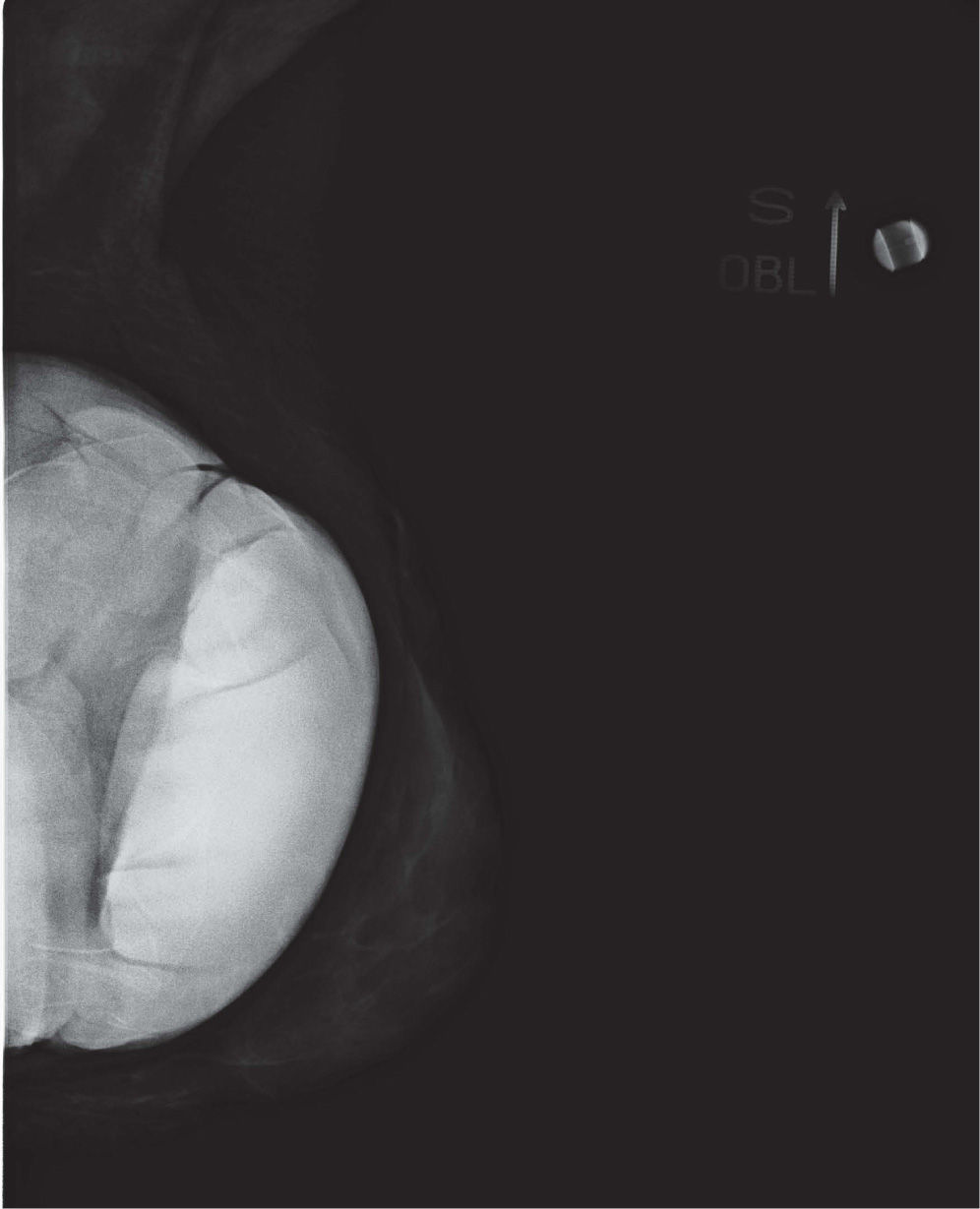
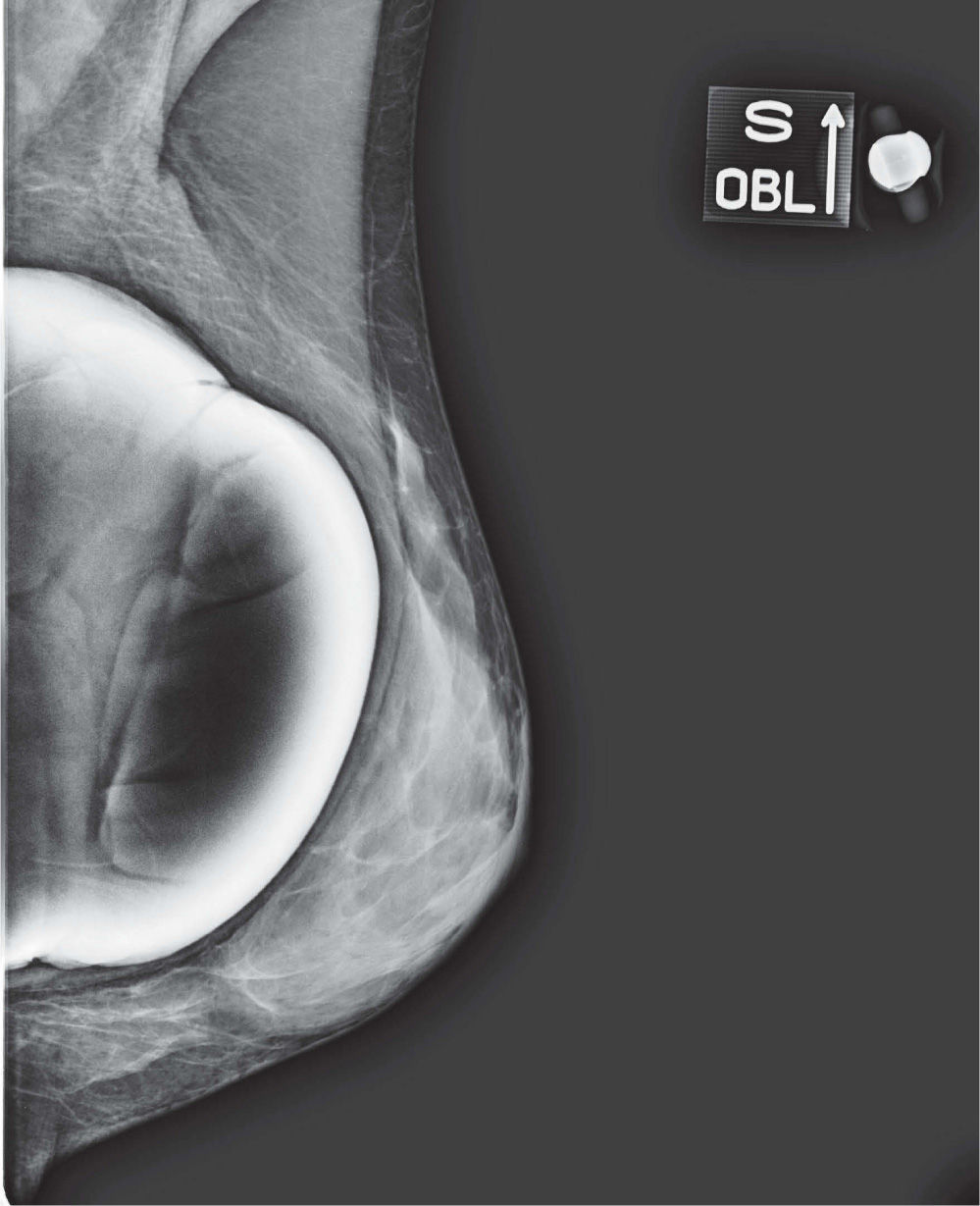
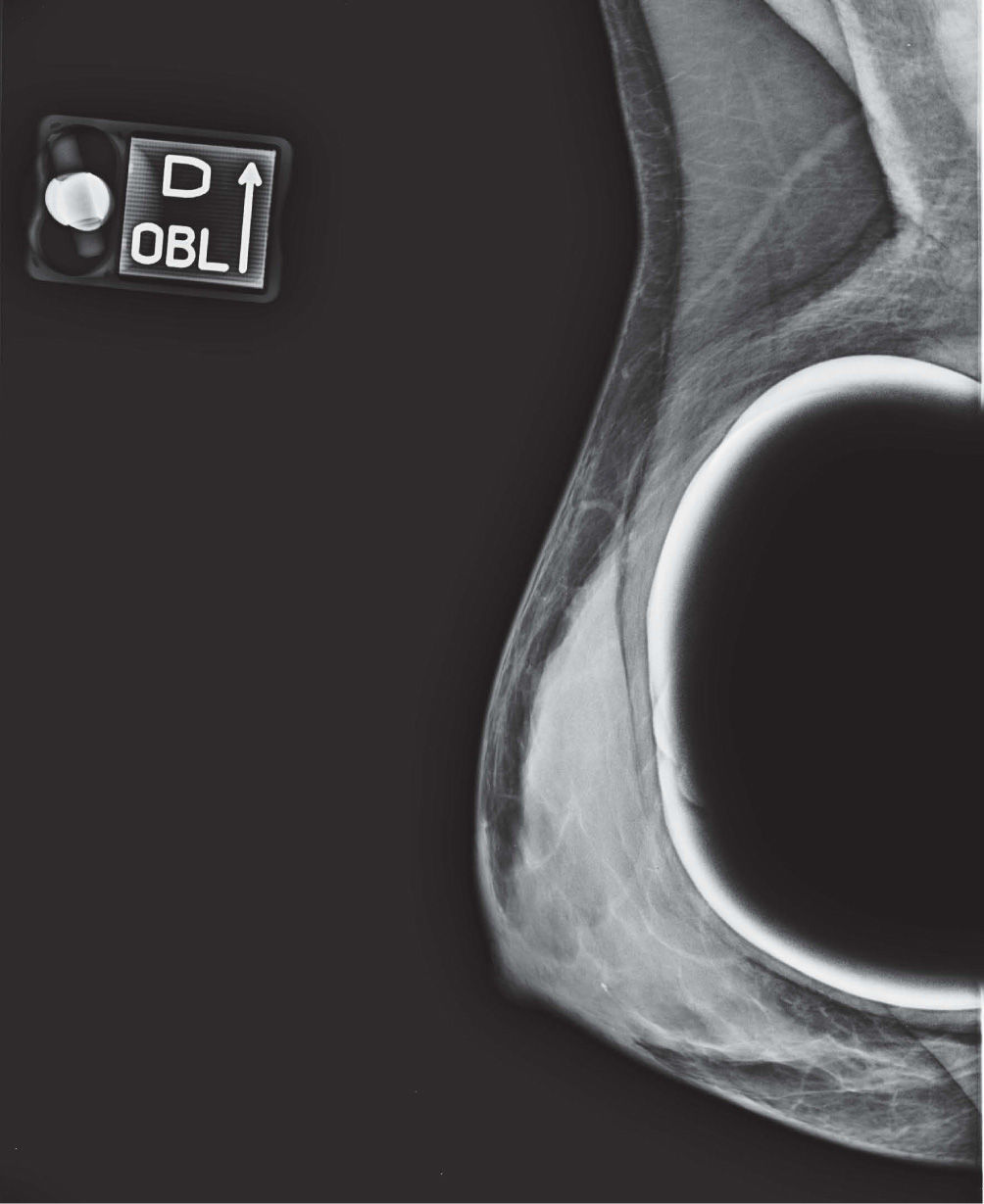
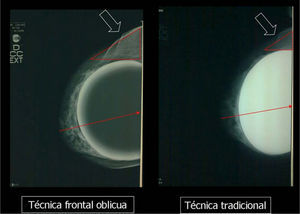
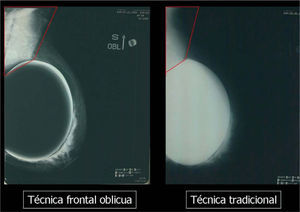
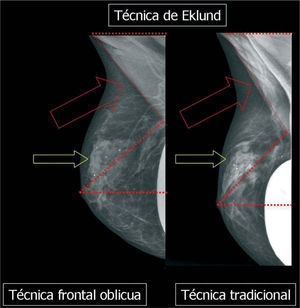
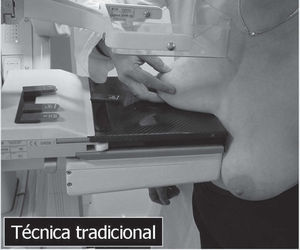
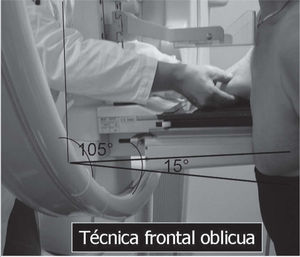
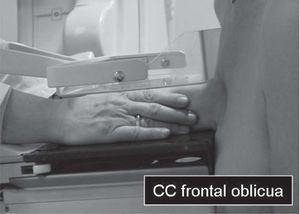
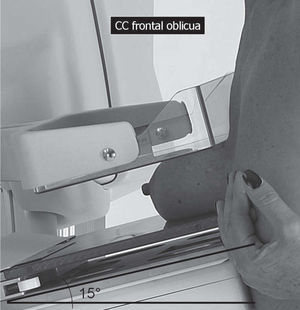
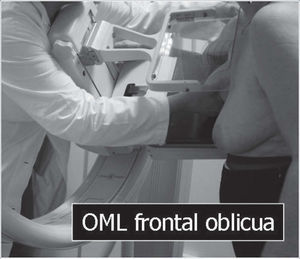
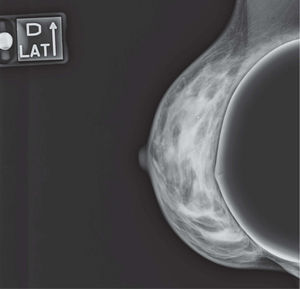
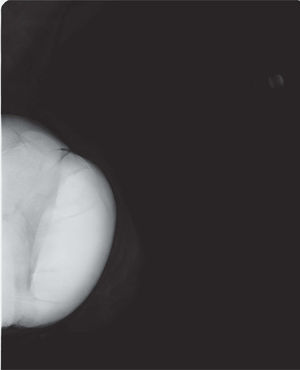
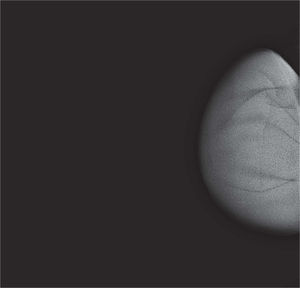
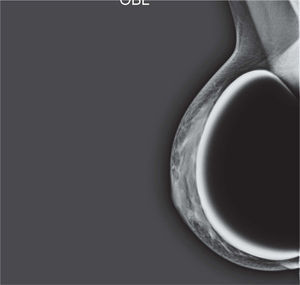
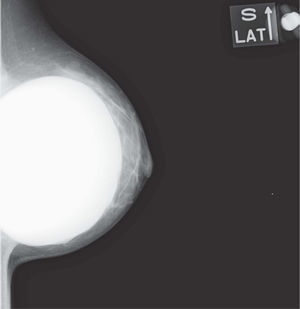
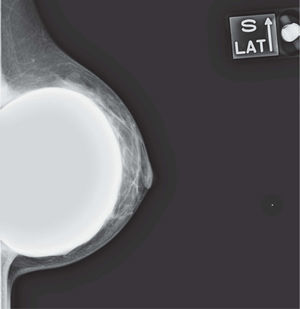
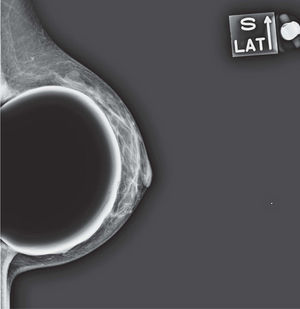
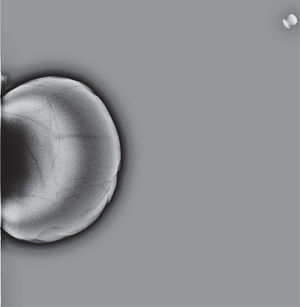
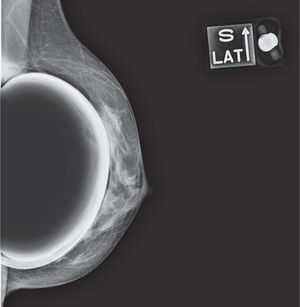
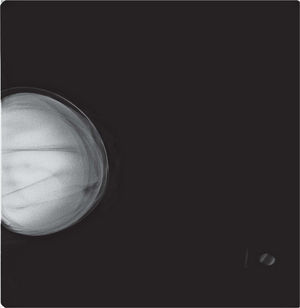
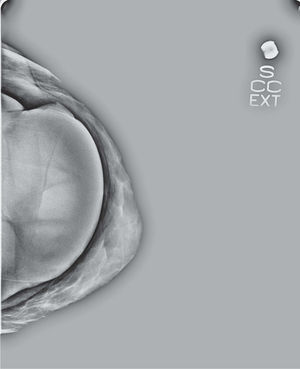
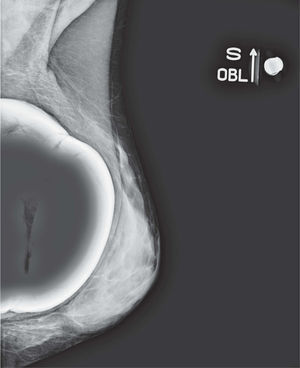
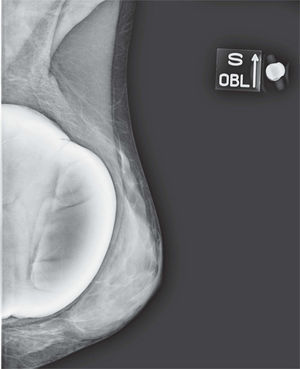
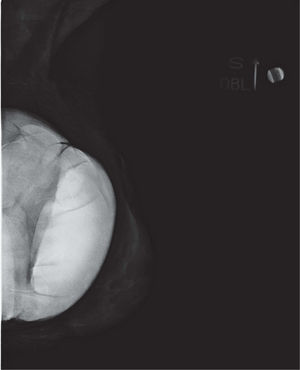
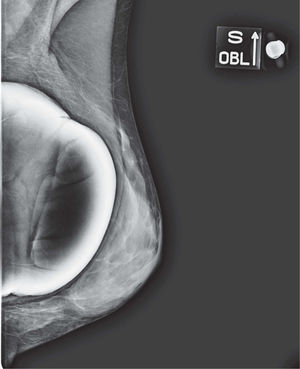
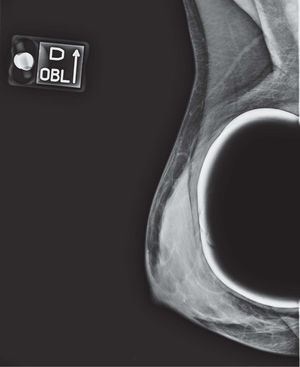
En un estudio presentado en ocasión del 2.° Congreso de ACTEDI (Barcelona, febrero de 2010), se demostró que el empleo de la FOA facilita el posicionamiento y la compresión, a beneficio de la representación del músculo pectoral y de la axila en la proyección OML, y de la cantidad de tejido mamario en la proyección CC8. Además, al utilizar la TE con FOA resultó más fácil la dislocación del implante, y mejoró la representación del tejido mamario y la distensión del tejido axilar (figs. 1.1-1.3).
La mamografía puede detectar algunas roturas extracapsulares, cuando la pérdida de la integridad del implante determina la salida de silicona de la cápsula con consecuente alteración de forma y volumen, o difusión de silicona en el parénquima con formación de nódulos densos intraparenquimales y ganglionares. Aunque en la bibliografía médica no hay informes sobre la posibilidad de detección mamográfica de roturas intracapsulares (tarea encomendada electivamente a la RM), si se actúa sobre algunos parámetros de post-processing (Pp), podrían detectarse señales sospechosas de rotura sin someter a la mujer a exposiciones adicionales: la tecnología digital podría ser una herramienta clave más para abordar la reducción de sensibilidad.
El sistema utilizado en este estudio para producir imágenes es un mamógrafo IMS “Giotto” y un CR FUJI “Profect CS” con estación de identificación y workstation.
Una característica del mamógrafo empleado es su posibilidad de permitir la técnica FOA (figs. 2.1-2.5).
Producción de imágenes y post-processing en sistemas CR FujiEn el Pp se utilizan siete parámetros (GT, GA, GC, GS, RN, RT, y RE) y cada variación de estos parámetros va a influir en el resultado.
Exposure Data Recognition (EDR, reconocedor de datos de exposición)Los sistema digitales proporcionan un resultado óptimo, independientemente de la exposición utilizada, en el que sereconoce el área de irradiación y se determina el área necesaria para el diagnóstico. El algoritmo EDR crea un histograma de la imagen con tamaño y frecuencia de señal de cada píxel, correspondiente a la cantidad de rayos X utilizados en la exposición9.
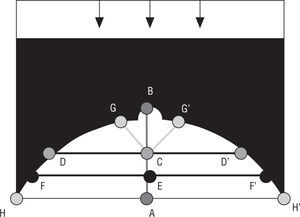
Detección del área de irradiaciónLa mamografía necesita un proceso especial de detección del área de irradiación, porque, a diferencia de otras exploraciones radiográficas, la mama no está posicionada en el centro del image plate (IP), sino en contacto con un lado, y además porque la densidad de la radiación directa no es uniforme a causa de la distancia del tubo.
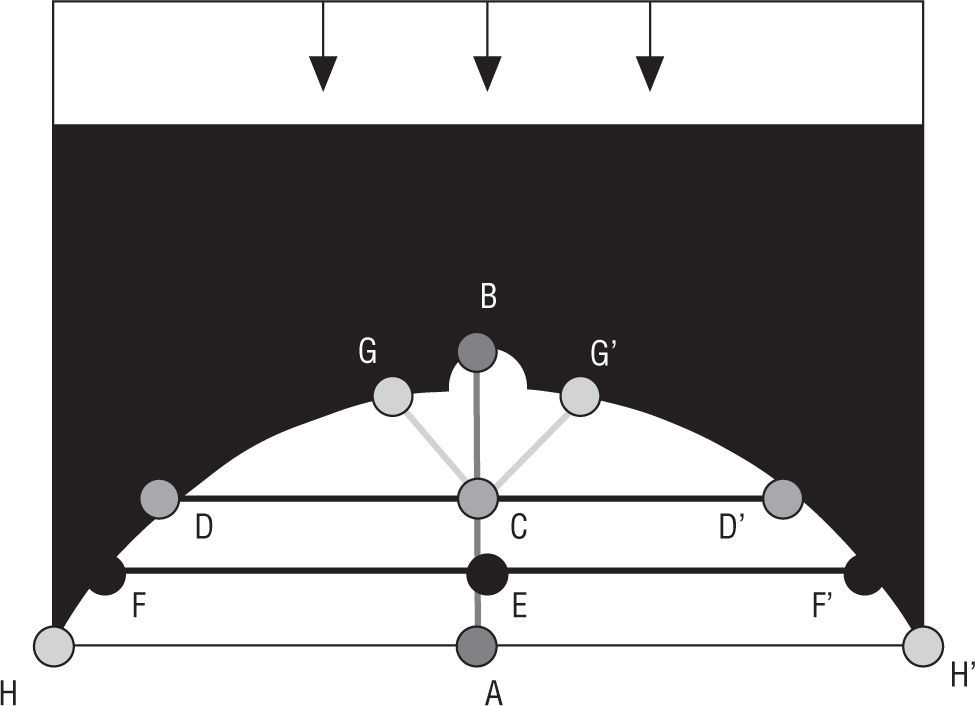
El histograma entero tiene que ser creado dentro del área de la mama, que será nuestra región de interés (ROI en sus siglas en inglés), y que será determinada según la secuencia siguiente9:
- 1.
Binarización de la imagen.
- 2.
Identificación del lado de IP donde está colocado el objeto a través de una escaneo en 3 puntos y la determinación del lado del IP de acuerdo con la transición 0/1 y alrededores.
A continuación se determina la ROI, actuando según los pasos 3, 4 y 5:
- 1.
Individuación de los puntos A, B, C, D y D’.
- 2.
Individuación de los puntos E, F y F’.
- 3.
Individuación de los puntos G, G’, H, y H’.
- 4.
Creación de un histograma dentro de los 10 puntos A, H, F, D, G, B, G’, D’, F’ y H’ (fig. 3).
Aunque, a diferencia del sistema screen-film, en el Pp es posible ajustar sensibilidad, contraste, MTF (transferencia de modulación de frecuencia), WS y γ (valores relacionados a cuanto ruido equivalente), hay que tener en cuenta que esos valores no se pueden modificar de modo indiscriminado.
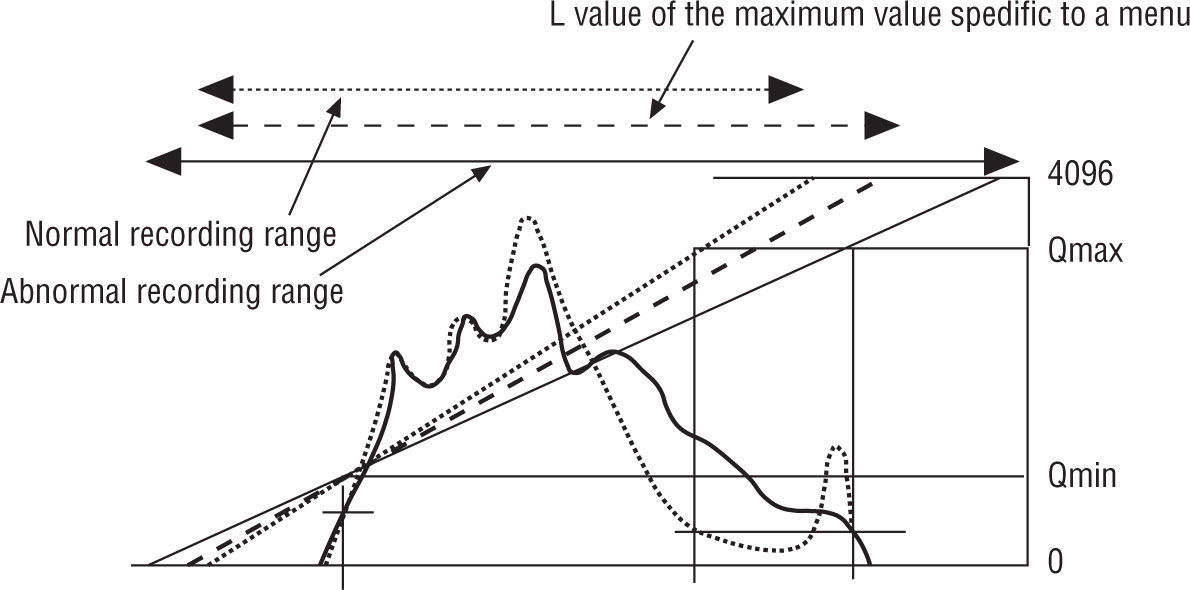
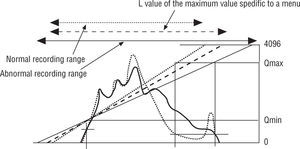
Los controles de ventanas GA y GS de hecho actúan en un rango determinado por la curva S de irradiación del IP. El valor S (indicador de detección de dosis) está definido por la ecuación S=4×12(4-Sk), derivada del valor Sk determinado por la función de corrección automática de la sensibilidad (EDR), donde Sk es el valor central de la expresión logarítmica del rango de dosis de rayos X, leído como datos de imagen digital, es decir el valor relacionado a la dosis logarítmica a la que está asignado el valor digital 2.048 en la cuantización a 12 bit10–14 (fig. 4).
Multi Frequency Processing (MFP – procesamiento multifrecuencia)El MFP enfatiza las imágenes combinando datos de áreas claro/oscuro con datos del tejido periférico, y crea una imagen con tonos más naturales. Imágenes puntiformes como las microcalcificaciones, que en el MFP perderían contraste y definición, se enfatizan con la función de proceso de mejora de patrón (PEM, del inglés Pattern Enhancement Processing for Mammography), que, reconociéndole como patrón de puntos, las diferencia del tejido glandular y de los vasos sanguíneos que reconocerá como patrón lineal9.
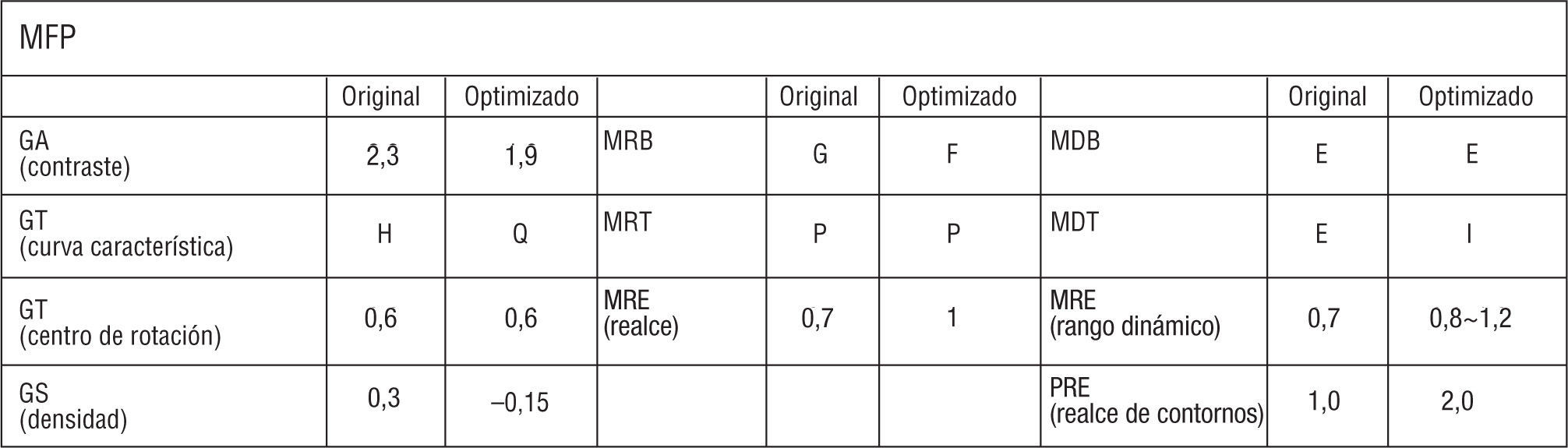
En la figura 5 se comparan valores originales de parámetros MFP con valores modificados para obtener una imagen más definida (figs. 6.1-6.3).
De aquí hay que ir acotando variaciones para mejorar la visualización de los detalles que queremos resaltar (figs. 6.4-6.6).
Por ejemplo, visualizaremos mejor las microcalcificaciones con valores de RN=9 y las masas con RN=0.
En la modalidad “auto”, a pesar de la exposición manual, lapresencia del implante provocará un incremento abnormal del valor S (> 1.300) (fig. 7), así que necesitaremos corregir este valor entre límites apropiados (60∼120) (fig. 8) y lo mismo con el valor L, que lo fijaremos en 200. Para el estudio protésico, es más apropiado el algoritmo de lectura “fix mode”: en esta condición la conversión entre el logaritmo de dosis y el nivel de gris (GL) de la imagen es lineal y depende de dos parámetros (L y S) determinables de forma manual9.
El parámetro L (latitud) determina el intervalo de dosis (en mR) que el sistema se muestra en 4.096 GL (12-bit)9.El parámetro S (sensibilidad) determina el valor de dosis al cual corresponde un GL=2.0489.
Para visualizar el perfil cutáneo se ha modificado la curva MDT (Multi-DRC Enhancing Type, que define las áreas de densidad que hay que comprimir) mediante valores entre G e I, enfatizándolos a través del parámetro MDE (Degree of Multi-DRC Enhancement, encargado del grado de control de la corrección de densidad) con la aplicación de valores entre 0,8 y 1,2 (figs. 9.1-9.5, 10.1-10.4 y figs. 11.1-11.9).
ConclusionesEl uso habitual de la FOA ha demostrado que, independientemente de la colocación del implante, permite visualizar más tejido mamario y axilar8 y, en caso de mastoplastia de aumento subglandular abundante que impida la dislocación según Eklund, permite una visualización mejor del perfilprotésico posterior. Además, el empleo racional del Pp permite mejorar la visualización del tejido mamario periprotésico y de reacciones periprotésicas, valorar el estado del implante y, en algunos casos, modificaciones intracapsulares (los resultados preliminares acerca de la posibilidad de detectar modificaciones intracapsulares parecen prometer ser satisfactorios y confirmados por RM).
En la práctica clínica, el uso racional y combinado de las técnicas TE, FOA y Pp podría ser de ayuda para limitar la pérdida de sensibilidad mamográfica, con la reducción del número de falsos negativos relacionados a ocultación de posibles lesiones por la presencia del implante. Los resultados preliminares sobre la posibilidad de detectar modificaciones intracapsulares parece que son satisfactorios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.