Streptococcus agalactiae (S. agalactiae) es el principal microorganismo causante de sepsis neonatal temprana (SNT) en el mundo. La profilaxis basada en la tamización rectovaginal de las gestantes es una estrategia eficaz para prevenir la SNT.
ObjetivoDescribir la prevalencia de colonización rectovaginal por S. agalactiae en gestantes tamizadas en la Clínica del Prado de Medellín durante 2010 y establecer la relación entre colonización materna y SNT.
Materiales y métodosEstudio observacional, descriptivo y de corte transversal, para determinar la prevalencia de colonización rectovaginal por S. agalactiae, mediante revisión de historias clínicas y resultados de laboratorio. Se incluyó aleatoriamente a 182 gestantes de 540 tamizadas.
ResultadosLa prevalencia de colonización rectovaginal por S. agalactiae determinada fue de 17,6%. La edad promedio de las gestantes fue 25 años (14-44), la edad gestacional promedio fue 35,4 semanas. Se suministró profilaxis con penicilina cristalina en 21,4% de las mujeres tamizadas y en 44% de las colonizadas, entre las que el 17% tuvieron el parto por cesárea y recibieron profilaxis con cefazolina. En el 48,9% no se suministró profilaxis. Ninguno de los hijos de las madres incluidas desarrolló SNT. Entre los nacidos en 2010 la prevalencia de esta entidad fue 0,14%. No se encontró asociación estadística (p=0,062) entre el tamización rectovaginal y la administración de profilaxis antibiótica.
ConclusiónLa prevalencia de colonización rectovaginal por S. agalactiae hallada apoya la recomendación de adoptar la tamización sistemática de las gestantes para conocer su estado de portador y tomar medidas oportunas que disminuyan la incidencia de SNT.
Streptococcus agalactiae (S. agalactiae) is the main worldwide cause of early onset neonatal sepsis (EONS). Antibiotic prophylaxis based on vaginal-rectum screening of pregnant women is an effective strategy to prevent EONS.
ObjectiveTo describe the prevalence of vaginal-rectum S. agalactiae colonization in pregnant women screened at the Clinica del Prado in Medellin during 2010 and to establish a relationship between maternal colonization and EONS.
Materials and methodsThis was an observational, descriptive and, cross-sectional study to determine the prevalence of vaginal-rectum colonization by S. agalactiae, through a review of medical records and laboratory test results. A total of 182 pregnant women out of 540 screened were randomly included.
ResultsThe prevalence of vaginal-rectum S. agalactiae colonization was 17.6%. The average age of the women was 25 years (14-44 range); the mean gestational age was 35.4 weeks. Prophylaxis with crystalline penicillin was given to 21.4% of the screened women and to 44% of those colonized. A total of 17% had cesarean deliveries and cephazolin prophylaxis was given. A total of 48.9% did not receive prophylaxis. None of the children of mothers included in the treatment developed EONS. The prevalence of EONS among the children born in 2010 was 0.14%. There was no statistical association (P=0,062) between vaginal-rectum screening and antibiotic prophylaxis.
ConclusionsThe prevalence of vaginal-rectum S. agalactiae colonization found supports a universal screening strategy in pregnant women, to know their carrier status and to take appropriate actions to minimize the incidence of EONS.
Streptococcus agalactiae o Streptococcus del grupo B de Lancefield (SGB) es un coco grampositivo que coloniza el tracto genitourinario y gastrointestinal de los humanos después de la pubertad, y es el principal causante de infección neonatal precoz. Su importancia en embarazadas radica en la posibilidad de ser transmitido al feto por vía vertical. Esta enfermedad ha despertado gran interés en pediatría y ginecoobstetricia por su alta prevalencia y tasas de mortalidad en todas las regiones del mundo1–9. En algunos países de Europa la prevalencia oscila entre el 10 y el 22%10–13, en Tailandia es del 16%14, en Canadá del 17%15 y en Estados Unidos varía entre el 10 y el 30%1,16–19.
Desde comienzos de los años 60, cuando se conoció la asociación entre infección o colonización puerperal y enfermedad neonatal por SGB, el microorganismo adquirió gran importancia epidemiológica, pues los estudios demostraron una incidencia de infección neonatal precoz de 2 por cada 1.000 nacidos vivos y tasas de mortalidad cercanas al 50%1–3.
En la década de los 90 los centros de control y prevención para las enfermedades de los Estados Unidos (CDC) y otras organizaciones como la Academia Americana de Pediatría, desarrollaron una serie de estrategias de aplicación universal, entre las que se encuentra la implementación de la profilaxis antibiótica intraparto a gestantes que cumplan los factores de riesgo asociados a sepsis neonatal temprana (SNT), permitiendo reducir hasta en un 80% la incidencia de esta infección en los Estados Unidos1–3,6,7,9,20–22. Esta estrategia comenzó a implementarse de manera ordinaria en los países del primer mundo en el año 20021,6,7,20. En Colombia aún no se ha generalizado y, a pesar de que se tiene claro el impacto económico y social que esta infección representa, no se cuenta con estudios que permitan conocer las tasas reales de infección neonatal precoz por SGB, los factores de riesgo propios asociados a la misma y el estado de portador de las gestantes3.
Se han llevado a cabo algunos estudios en Medellín, Bogotá y Cali, encontrándose frecuencias de colonización variables por SGB, 7,83; 5,823; 16,424, y 8,6%25, entre las gestantes2. Sin embargo, estos datos no son concluyentes para conocer la verdadera situación del país al respecto.
En la Clínica del Prado de la ciudad de Medellín, institución que atiende a pacientes de ginecología y obstetricia de alto nivel de complejidad, se realiza el cultivo de muestras de rectovagina a las gestantes que ingresan a la institución con riesgo de parto pretérmino, o que son vistas en consulta entre las semanas 35 y 37 de gestación, en las que además la empresa prestadora de servicios de salud autorizó, en su momento, el tamizaje para determinar su estado de portadora y definir con este, y el análisis de otros factores de riesgo asociados, la necesidad de profilaxis intraparto, cuyo objetivo es prevenir la infección neonatal precoz por SGB. Las gestantes que llegan con el trabajo de parto instaurado no son tamizadas y la decisión de dar profilaxis se basa en los factores de riesgo de SNT asociados.
Hasta el momento se desconoce el impacto que esta estrategia está teniendo en la incidencia de dicha infección. Este estudio determinó la frecuencia de colonización rectovaginal por SGB e indagó por los posibles factores de riesgo asociados a la misma durante el año 2010. Adicionalmente, se buscaron los factores de riesgo asociados a la infección neonatal precoz, y se analizó la efectividad de la tamización y otros aspectos a considerar para decidir la quimioprofilaxis que se debe suministrar a las gestantes en el momento del parto.
Materiales y métodosSe realizó un estudio retrospectivo observacional, descriptivo, de corte transversal, para determinar la prevalencia de colonización rectovaginal por S. agalactiae, mediante la revisión manual de 182 historias clínicas, seleccionadas aleatoriamente, a través del programa EPIDAT versión 3.1.
La muestra se calculó teniendo en cuenta una prevalencia promedio de colonización por S. agalactiae en gestantes de países latinoamericanos con condiciones sociodemográficas similares a las de Colombia, del 22%26–32, en la población de estudio (540 gestantes), con un error máximo permitido del 5% y un nivel de confianza del 95%.
El estudio fue aprobado por el Comité de Investigaciones de la Clínica del Prado y no requirió evaluación por el Comité de Ética debido a que se catalogó como un estudio con riesgo ético menor que el mínimo.
Los datos fueron recolectados a partir de la revisión de historias clínicas, aplicando un formato de recolección de información en el que se contemplaron las siguientes variables: edad de la gestante, régimen de afiliación al sistema de salud, semanas de gestación, presencia de rotura prematura de membranas, fiebre intraparto, bacteriuria por SGB, profilaxis o tratamiento antibiótico recibido, resultado del examen de tamización rectovaginal para SGB33 y sepsis neonatal precoz causada por este microorganismo, definida como la descripción, en la historia clínica, de sintomatología compatible con sepsis durante las primeras 2 semanas de vida extrauterina, asociada a hemocultivos positivos para SGB.
Las gestantes incluidas cumplían con:
- 1.
Haber sido tamizadas para colonización rectovaginal por SGB.
- 2.
Haber sido atendidas en la Clínica del Prado de Medellín, entre el 1 de enero y el 31 de diciembre de 2010.
- 3.
Que el cultivo de rectovagina se hubiera procesado en el laboratorio clínico Prolab S.A.S.
Las muestras de exudado rectovaginal fueron tomadas con 2 hisopos, vaginal y rectal, que se transportaron al laboratorio en un único tubo seco y estéril, en el lapso de la primera hora. Fueron sembradas en un medio de cultivo cromogénico suplementado con antibióticos, que permite seleccionar e identificar directamente Streptococcus del grupo B. El medio de cultivo se incubó a 35°C en atmósfera de CO2 al 5%, durante 24-48 h.
Con la información recolectada se hizo un análisis por distribución de frecuencias y porcentajes para las variables cualitativas, y de medidas de tendencia central, dispersión y posición para las variables cuantitativas. A las variables cualitativas se les aplicó la prueba de chi2. El nivel de significación estadística empleado fue del 5%. La tabulación de la información se hizo en una hoja de cálculo de Microsoft Excel, el análisis estadístico se realizó con programas de licencia libre y se presentó a través de tablas y gráficos.
ResultadosEn el año 2010 se atendieron 7.834 partos en la Clínica del Prado. El 7% (540) de esas gestantes fueron tamizadas para colonización rectovaginal por SGB, y 182 de estas fueron incluidas en el estudio aleatoriamente. Se excluyó a todas las gestantes que en el momento de la toma de la muestra para la tamización, o en las 48 h previas a esta, estuvieran recibiendo tratamiento antibiótico con ampicilina, penicilina, cefazolina, eritromicina, cefalexina, vancomicina, clindamicina u otro, para evitar resultados falsos negativos.
La prevalencia hallada fue de 17,6%. La edad promedio fue 25 años (14-44), 47% de las gestantes con tamizaje positivo estaban tenían entre 14 y 24 años, 44% entre 25 y 34 años y 9% entre 35 y 44 años (tabla 1).
La edad gestacional estuvo entre 25 y 40 semanas, promedio 35,4. En relación con el régimen de afiliación a salud, el 41% de las mujeres con tamizaje positivo eran del subsidiado y el 59% del contributivo. Se aplicó el test de chi2 y se determinó que no había relación estadísticamente significativa (p=0,776) entre el régimen de afiliación a salud y el estado de portador.
En 119 (65,4%) gestantes se reportó rotura de membranas inferior a 17 h, en 19 (10,44%) se observó rotura de membranas superior a 18 h. En las 44 (24%) restantes, no se encontraron datos. Al analizar la relación entre fiebre intraparto y SNT, se observa que solo el 0,55% (un caso) presentó aumento de temperatura, dato que resulta insuficiente para establecer la posible relación. No se dispuso de información suficiente para analizar la relación entre bacteriuria y SNT.
El 25% (45) de las gestantes no tuvo el parto en la Clínica del Prado, aun cuando se les realizó el cultivo de rectovagina en dicha institución, lo que impidió disponer de los datos clínicos completos de la madre y su recién nacido.
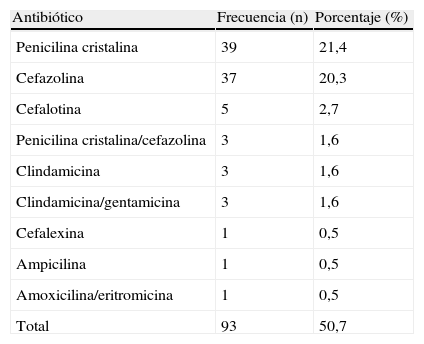
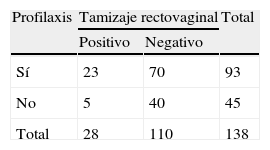
Siguiendo la recomendación internacional, el antibiótico de primera elección para profilaxis intraparto (tabla 2) utilizado en la clínica fue penicilina cristalina1,2, prescrito al 21,4% (39) de las mujeres tamizadas y al 44% (14) de aquellas cuyo tamizaje fue positivo. En el 17% (7) de las gestantes colonizadas, el parto fue atendido por cesárea. En estos casos la profilaxis recibida fue cefazolina. En el 48,9% (45) de las gestantes no se indicó profilaxis. Al comparar las variables profilaxis y tamizaje de rectovagina, se observa que no hay relación estadísticamente significativa (p=0,062) entre el resultado del tamizaje y el uso de profilaxis antibiótica (tabla 3).
Antibióticos usados para profilaxis en la población estudiada
| Antibiótico | Frecuencia (n) | Porcentaje (%) |
| Penicilina cristalina | 39 | 21,4 |
| Cefazolina | 37 | 20,3 |
| Cefalotina | 5 | 2,7 |
| Penicilina cristalina/cefazolina | 3 | 1,6 |
| Clindamicina | 3 | 1,6 |
| Clindamicina/gentamicina | 3 | 1,6 |
| Cefalexina | 1 | 0,5 |
| Ampicilina | 1 | 0,5 |
| Amoxicilina/eritromicina | 1 | 0,5 |
| Total | 93 | 50,7 |
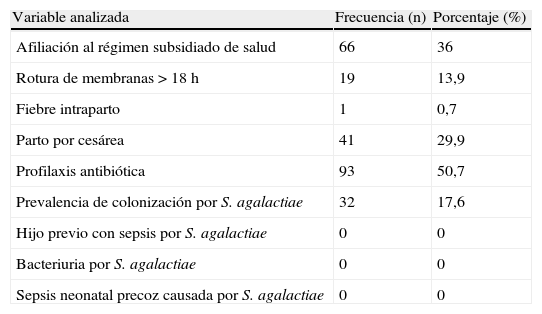
Las variables antes mencionadas se presentan en la tabla 4.
Características generales de la población estudiada
| Variable analizada | Frecuencia (n) | Porcentaje (%) |
| Afiliación al régimen subsidiado de salud | 66 | 36 |
| Rotura de membranas > 18 h | 19 | 13,9 |
| Fiebre intraparto | 1 | 0,7 |
| Parto por cesárea | 41 | 29,9 |
| Profilaxis antibiótica | 93 | 50,7 |
| Prevalencia de colonización por S. agalactiae | 32 | 17,6 |
| Hijo previo con sepsis por S. agalactiae | 0 | 0 |
| Bacteriuria por S. agalactiae | 0 | 0 |
| Sepsis neonatal precoz causada por S. agalactiae | 0 | 0 |
Ninguno de los hijos de las gestantes incluidas en el estudio desarrolló SNT. Sin embargo, durante el año 2010 se presentaron 11 casos de SNT por SGB; la prevalencia calculada de esta entidad fue 0,14%.
La edad gestacional promedio de las 11 madres cuyos neonatos desarrollaron SNT fue 38 semanas (37-41). Una de ellas tuvo rotura de membranas superior a 18 h. En ningún otro caso se describieron factores de riesgo adicionales como bacteriuria por SGB, temperatura intraparto superior a 38°C o hijo previo con sepsis por este microorganismo. Dos de estas gestantes fueron tamizadas para S. agalactiae en rectovagina. Una de ellas estaba colonizada.
Cinco de los neonatos que desarrollaron SNT nacieron por cesárea y sus madres recibieron profilaxis con cefazolina. En los 6 casos restantes el parto fue vaginal y sus madres no recibieron profilaxis antibiótica. Uno de los neonatos murió por esta causa.
DiscusiónS. agalactiae es el principal microorganismo asociado a SNT en el mundo26–29,34–36. Los países del primer mundo han logrado disminuir sustancialmente la incidencia de esta entidad gracias a la instauración del tamización rectovaginal en todas las gestantes3,8,9, lo que refleja la importancia de realizar la tamización para determinar el estado de portador y definir la necesidad de prescribir profilaxis antibiótica2,6,7,22.
La prevalencia de colonización hallada (17,6%), difiere de lo reportado por Restrepo A., Duque C. y Restrepo N., en estudios de prevalencia realizados en gestantes de las ciudades de Medellín y Bogotá, que refieren cifras de 8,6425, 5,823 y 8%24, respectivamente. Esta diferencia puede obedecer a la metodología seguida en cada caso. Los estudios referidos son prospectivos y no aleatorizados, a diferencia del presente que es retrospectivo y aleatorizado. Cada uno empleó un procedimiento de conservación de muestras, medios de cultivo y técnicas de identificación disímiles, lo que probablemente lleva a obtener datos de sensibilidad y especificidad propios, que no necesariamente son comparables y que pueden marcar diferencias en las prevalencias obtenidas. Se considera pertinente hacer estudios que involucren centros de atención hospitalaria de varias ciudades del país, con el fin de obtener una muestra más heterogénea, en la que se contemplen los diversos grupos poblacionales, se incluya a gestantes con todas las variaciones de esa condición y no se tienda a involucrar a aquellas de alto riesgo o alto grado de complejidad.
La prevalencia calculada se aproxima a lo reportado en la literatura de países como Chile26,30,31, Venezuela32 y otras poblaciones latinas27–29, que podrían tener características sociodemográficas similares a las de Colombia.
La recomendación internacional consiste en realizar la tamización rectovaginal entre las semanas 35 y 37 de gestación, o antes en caso de que la condición clínica de la paciente así lo requiera. Si es necesario repetirlo después, debe hacerse 5 semanas antes del parto, ya que el estado de portador es intermitente1,2,20.
El porcentaje de gestantes tamizadas para determinar el estado de colonización por SGB en la Clínica del Prado durante el año 2010 fue 6,9%. Teniendo presente que la recolección de la información se hizo de manera retrospectiva, se dificultó establecer la asociación entre las variables analizadas. Además, el 25% de ellas no tuvo el parto en la institución, razón por la que no se accedió ni a sus datos clínicos completos ni a los de sus recién nacidos.
Ninguno de los hijos de las gestantes incluidas en el estudio, cuyo parto ocurrió en la clínica, presentó SNT por SGB. Sin embargo, haciendo una búsqueda retrospectiva de los resultados de hemocultivos positivos para SGB entre los neonatos atendidos en la institución en el año 2010, que se contrastó con los datos clínicos contenidos en sus historias, se determinó que hubo 11 casos de SNT por este microorganismo. En el 82% de ellos, no se había realizado el tamizaje rectovaginal a la madre, razón por la que no fue posible establecer la asociación entre colonización materna y SNT.
La prevalencia calculada de SNT fue de 0,14%, cifra que se correlaciona con las de estudios hechos en diferentes regiones del mundo, que varían entre 0,341 y 41,16,26,37 por cada 1.000 nacidos vivos. Estas cifras adquieren más importancia cuando se piensa en las tasas de mortalidad que asocian, 9% (un caso) en el presente estudio, y de 4 a 20% según datos reportados en la literatura1,26. Algunos estudios refieren que la incidencia de la infección neonatal se asocia a la raza, siendo más frecuente en la negra que en la blanca16.
La profilaxis administrada a 5 de las madres cuyos hijos padecieron sepsis neonatal precoz fue la indicada para partos por cesárea: cefazolina, antibiótico que según recomendación de los CDC es apropiado para cubrir SGB en mujeres que hayan tenido episodios leves de alergia a la penicilina. No obstante, el hecho de que la cefazolina no haya evitado la aparición de SNT, sugiere la necesidad de analizar cada caso individualmente, así como de evaluar la pertinencia de hacer rutinariamente pruebas de susceptibilidad para los aislamientos rectovaginales de S. agalactiae y tener presentes los aspectos farmacocinéticos y farmacodinámicos del medicamento, que tal como la penicilina debe ser suministrado como mínimo 4 h antes del parto1,6,7,30.
Lo antes mencionado apoya la recomendación de prescribir la profilaxis en aquellas gestantes que antes de la cesárea hayan iniciado el trabajo de parto, pues los resultados insinúan que este procedimiento no exime al neonato de padecer sepsis por SGB1. De los 11 niños con sepsis, 45% (5) nacieron por cesárea. Si bien es cierto que el neonato puede infectarse por vía ascendente, hace falta esclarecer otras causas de infección, así como alternativas de prevención que se relacionen con factores aún no contemplados, como complicaciones inherentes a la cirugía que prolonguen el procedimiento, la asepsia quirúrgica, el tiempo de trabajo de parto previo a la cesárea, y profundizar en factores predisponentes a la infección como el estado nutricional de la madre y del recién nacido, directamente relacionados con la producción de anticuerpos, el estrato socioeconómico, enfermedades de base en la gestante, entre otras2,3,7,20,22,36,38.
Los países desarrollados luego de la implementación de la profilaxis basada en la tamización con cultivo de rectovagina han logrado reducir alrededor del 70% las tasas de SNT por SGB1–3. Se considera importante incorporar al programa de control prenatal colombiano la tamización de las gestantes entre las semanas 35 y 37, o a aquellas que tengan amenaza de parto pretérmino, mediante cultivos selectivos tomados de la vagina y la región perianal, con el posterior manejo antibiótico profiláctico de las portadoras de SGB desde el inicio del trabajo de parto, como estrategia de obligatorio cumplimiento.
El uso de medios de cultivo selectivo o diferenciales facilita el aislamiento de SGB en muestras de rectovagina1,23,32. En este estudio se empleó un medio de cultivo cromogénico que facilita el crecimiento de S. agalactiae y su diferenciación de otros microorganismos usualmente presentes en la región rectovaginal. Se considera importante su implementación en los laboratorios de microbiología que procesan estas muestras, con el fin de aumentar la probabilidad de aislar el microorganismo, disminuir el tiempo para conocer o descartar el estado de portador de cada gestante, establecer la prevalencia de colonización en la población de influencia y facilitar al médico tratante la toma de medidas oportunas con las gestantes colonizadas.
De acuerdo con las recomendaciones de los CDC1, en caso de que no sea posible realizar la tamización antes del parto, se debe considerar la quimioprofilaxis con penicilina cristalina u otro antibiótico sugerido, a aquellas pacientes que tengan factores de riesgo tales como: rotura de membranas superior a 18 h, fiebre intraparto, hijo previo con SNT por SGB y bacteriuria por SGB durante la gestación1. Lo anterior, con el fin de minimizar la posibilidad de transmisión vertical de SGB al recién nacido, aun cuando el parto se realice por cesárea, puesto que este procedimiento no elimina el riesgo1–3,6,7,20,38.
Se considera necesario plantear y desarrollar nuevos estudios que determinen la incidencia de la infección neonatal precoz por SGB en las instituciones del país, y que permitan conocer el perfil local de susceptibilidad del microorganismo a los antibióticos, para determinar cuáles son las mejores opciones antibióticas y promover medidas eficaces y ajustadas a la población colombiana, como estrategia preventiva y terapéutica que reduzca la morbimortalidad asociada a la infección.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A las personas que apoyaron esta idea, en especial al grupo de Microbiología del Laboratorio Clínico Prolab S.A.S.
Al departamento de información de la Clínica del Prado, por facilitar el acceso a las historias clínicas.