La infección por virus linfotrópico humano 1 es frecuente en la costa pacífica colombiana y se ha relacionado con leucemia/linfoma de células T del adulto y mielopatía en una proporción baja de los seropositivos. En pacientes con trasplante de órganos sólidos pareciera que estas patologías se desarrollan más rápidamente que en los otros escenarios pero se desconoce el curso de la infección por virus linfotrópico humano 1 en trasplante de médula ósea por lo cual describimos 3 casos de pacientes seropositivos y linfoma que fueron llevados a trasplante autógeno. Uno de ellos tuvo recaída de su patología hematológica y falleció a consecuencia de la misma, otra paciente presentó un cuadro compatible con mielopatía asociada al virus linfotrópico humano 1 y la última, una enfermedad injerto contra hospedero. En las personas seropositivas y que necesitan un trasplante de células hematopoyéticas se requiere una búsqueda activa de este virus para hacer seguimientos y evaluar su impacto real en los desenlaces y saber si el curso de la infección podría cambiar con el régimen condicionante del trasplante.
Human T-lymphotropic virus 1 infection is common in Colombia's Pacific coast and has been linked to adult T-cell leukemia/lymphoma and human T-lymphotropic virus 1-associated myelopathy in a low percentage of cases. In patients with solid organ transplantation, these diseases occur more quickly than in other scenarios but in bone marrow transplantation the true impact is unknown. We describe 3 seropositive patients with lymphoma who underwent autologous stem cell transplantation; in one case there was relapse of the hematologic malignancy and death occurred as a result. Another patient had symptoms compatible with human T-lymphotropic virus 1-associated myelopathy and the last patient had a graft vs. host disease. In seropositive people who need hematopoietic cell transplantation, an active search for this virus is required to be able to follow and assess the virus's impact on outcomes, as well as to assess whether the evolution could change according to the transplant conditioning regimen.
La infección por virus linfotrópico humano 1 (HTLV-1) afecta a 15-20 millones de personas en el mundo y su prevalencia varía del 37% en algunas regiones de Japón al 0,0039% en Francia1; en Colombia es frecuente en la costa pacífica (2,8-5,3%)2 pero menos en ciudades como Bogotá (0,07%)3. La importancia de este virus es su asociación con leucemia/linfoma de células T del adulto (ATL) y mielopatía asociada al HTLV-1 (HAM), también con la hiperinfección por Strongyloides stercoralis la cual puede tener un curso complejo en pacientes hematológicos4. En trasplante de médula ósea (TMO) no está clara la implicación de la presencia del HTLV-1 luego de la fijación del injerto y es difícil saber si la infección es pasada, activa, en progresión o reactivación pues solo disponemos de una prueba de IgG para su diagnóstico. Presentamos 3 pacientes seropositivos llevados a TMO con sus diferentes escenarios y desenlaces clínicos.
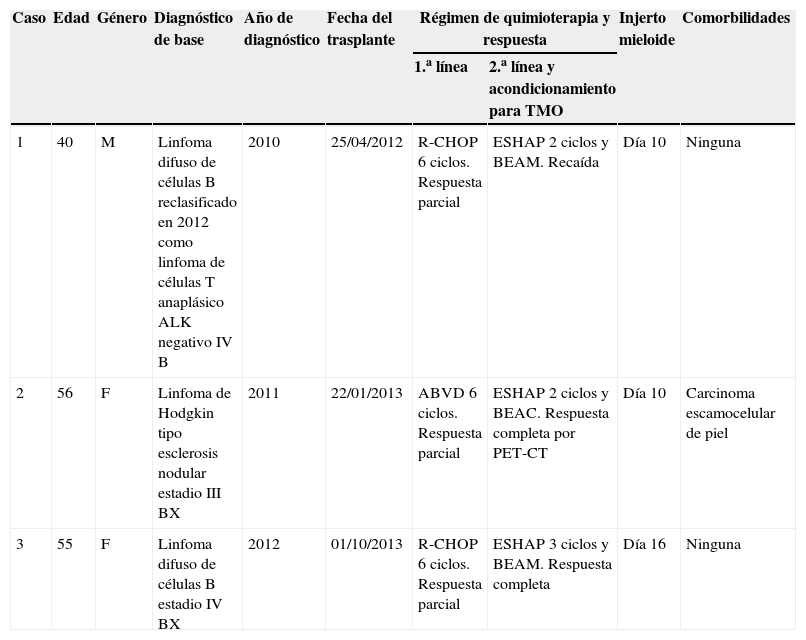
Descripción de los casosEn nuestra institución, del 2011 al 2013 hemos realizado 92 TMO en adultos, 79 autógenos, 8 alogénicos de donante familiar y 5 de cordón umbilical. En la valoración pretrasplante se tamizan anticuerpos contra HTLV 1 y 2 por método de inmunoanálisis quimioluminiscente de micropartículas y se confirma con inmunoanálisis en látex cuando son positivos. Esta prueba no distingue entre los 2 serotipos y solo muestra la presencia de IgG sin dar una relación directa con la carga viral. En la tabla 1 están las principales características de 3 pacientes con linfoma y respuesta parcial a quimioterapia de primera línea quienes fueron llevados a TMO autógeno con prueba confirmatoria positiva para HTLV.
Características de los pacientes trasplantados de médula ósea con infección por HTLV
| Caso | Edad | Género | Diagnóstico de base | Año de diagnóstico | Fecha del trasplante | Régimen de quimioterapia y respuesta | Injerto mieloide | Comorbilidades | |
|---|---|---|---|---|---|---|---|---|---|
| 1.a línea | 2.a línea y acondicionamiento para TMO | ||||||||
| 1 | 40 | M | Linfoma difuso de células B reclasificado en 2012 como linfoma de células T anaplásico ALK negativo IV B | 2010 | 25/04/2012 | R-CHOP 6 ciclos. Respuesta parcial | ESHAP 2 ciclos y BEAM. Recaída | Día 10 | Ninguna |
| 2 | 56 | F | Linfoma de Hodgkin tipo esclerosis nodular estadio III BX | 2011 | 22/01/2013 | ABVD 6 ciclos. Respuesta parcial | ESHAP 2 ciclos y BEAC. Respuesta completa por PET-CT | Día 10 | Carcinoma escamocelular de piel |
| 3 | 55 | F | Linfoma difuso de células B estadio IV BX | 2012 | 01/10/2013 | R-CHOP 6 ciclos. Respuesta parcial | ESHAP 3 ciclos y BEAM. Respuesta completa | Día 16 | Ninguna |
ABVD: adriamicina, bleomicina, vinblastina y dacarbazina; BEAC: carmustina, etopósido, citarabina y ciclofosfamida; BEAM: carmustina, etopósido, citarabina y melfalán; ESHAP: etopósido, metilprednisolona, citarabina y cisplatino; R-CHOP: rituximab, ciclofosfamida, adriamicina, vincristina y prednisona.
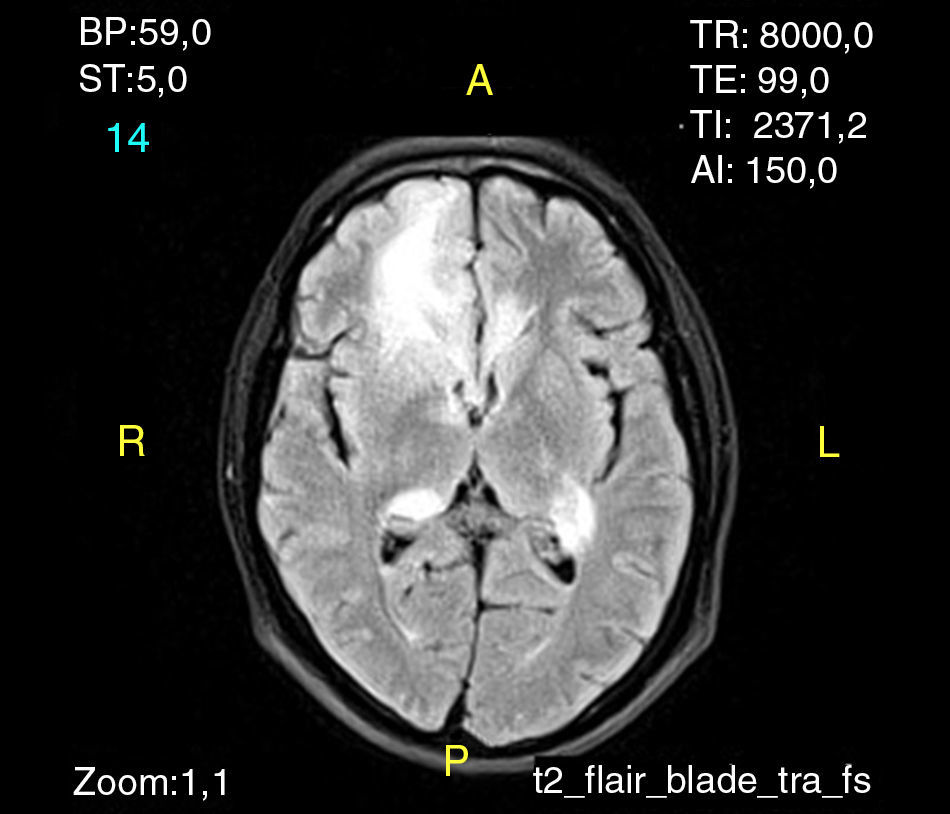
Tenía un diagnóstico inicial de linfoma difuso de células B grandes en 2010 sin respuesta a quimioterapia de primera línea, se revisó nuevamente la histopatología en 2012 y se reclasificó como un linfoma de células T anaplásico ALK negativo; con este último diagnóstico se hizo el TMO. En el día 48 postrasplante presenta convulsiones tónico-clónicas generalizadas y adenomegalias. El hemograma mostraba 4.040 leucocitos/μl, 2.290 neutrófilos/μl, 930 linfocitos/μl, hemoglobina 9,7g/dl y plaquetas 126.000/μl, deshidrogenasa láctica 1.067U/l (valor normal hasta 214U/l). La imagen de resonancia magnética (IRM) cerebral tenía una lesión de aspecto neoproliferativo (fig. 1) y el análisis de líquido cefalorraquídeo fue negativo para infecciones, pero la citometría evidenciaba neoplasia de fenotipo T con expresión de CD3, CD5 y CD4. Se consideró una recaída del linfoma en el sistema nervioso central y se trató con radioterapia y esteroides con mala evolución pues fallece en el día 78 por progresión de la enfermedad.
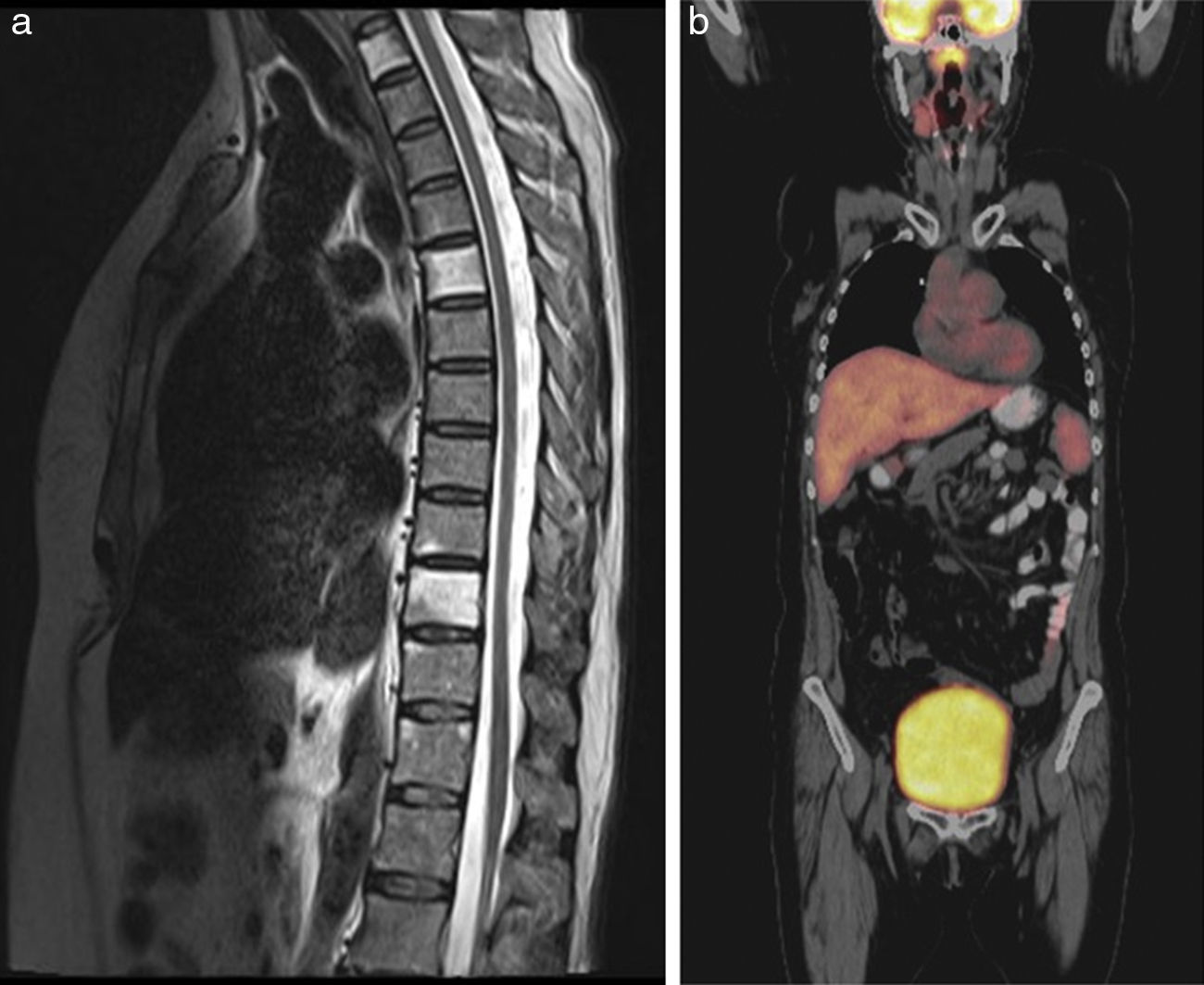
Caso 2En el día 71 postrasplante presentó síntomas respiratorios y urinarios, no se documentó ningún germen y se investigó un síndrome relacionado con el injerto; recibió un ciclo corto de esteroides, con mejoría. Nuevamente se hospitalizó en el día 270 por parestesias y disminución de la fuerza en miembros inferiores, dificultad para la micción y estreñimiento, tenía fuerza 4/5 de predominio distal, hiperreflexia generalizada, signo de Hoffman positivo y Babinski bilateral, sin nivel sensitivo. El hemograma y la deshidrogenasa láctica eran normales. La IRM de columna no mostraba signos de mielopatía (fig. 2a). El líquido cefalorraquídeo fue negativo para infecciones y células tumorales pero no teníamos disponible el análisis para HTLV. En la electroforesis de proteínas se observó una tenue banda en la región gamma. Se realizó una tomografía por emisión de positrones (PET-CT) donde se vieron numerosas adenomegalias (fig. 2b) pero estas no eran susceptibles de biopsia por su tamaño y ubicación. Se consideró una HAM y se administraron esteroides, con mejoría parcial; actualmente está en seguimiento.
IRM contrastada de columna y PET-CT del caso 2. 2a. Corte sagital en T2 que muestra aumento en la intensidad de señal generalizada de los cuerpos vertebrales T1, T5 y T10 que presentan discreto realce con el medio de contraste. 2b. Numerosas adenomegalias a nivel laterocervical, mediastino, hiliar bilateral e inguinal izquierdo con leve actividad metabólica que varía entre 2 y 2,4 de SUV máximo.
En el día 4 postrasplante presentó diarrea con bacteriemia por Escherichia coli productora de β-lactamasas de espectro extendido y recibió tratamiento con meropenem. En el día 20 tuvo un rash eritematoso pruriginoso generalizado. El hemograma mostraba 2.360 leucocitos/μl, 1.610 neutrófilos/μl, 450 linfocitos/μl, hemoglobina 10,2g/dl y plaquetas 12.000/μl, deshidrogenasa láctica 362U/l, bilirrubinas normales, AST 40,5U/l (valor normal hasta 32U/l) y ALT 36,9U/l (valor normal hasta 33U/l). Se investigó una toxicodermia relacionada con las sulfas usadas en la profilaxis pero se tomó una biopsia de piel y fue compatible con enfermedad de injerto contra huésped; se dieron esteroides con mejoría y continuó en seguimiento ambulatorio.
Revisión de la literatura y discusiónLa mayoría de los portadores del HTLV-1 permanecen asintomáticos y durante su vida el riesgo de ATL es del 1-5% y de HAM del 0,3-4%1,4. En el primer escenario hay una expansión clonal por los genes Tax/HBZ e incorporación del ADN proviral en los CD4, aumentando las mitosis, mientras para el segundo los CD8 producen citocinas que dañan la mielina y los axones4,5. Aunque la transmisión se realiza principalmente por lactancia, relaciones sexuales y transfusiones4, se ha reportado a través de órganos sólidos, con aparición de trastornos linfoproliferativos y una mielopatía de progresión más rápida6,7. Hay también casos de ATL derivada del donante8 y HAM después de TMO9. El uso de ciclosporina ha sido considerado un factor que acelera las manifestaciones clínicas de esta infección6; de hecho en modelos animales su empleo antes de la primoinfección aumenta la expresión del ADN proviral pero si se usa después del contacto con el virus se disminuye dicha situación10.
Sin embargo, la tamización para HTLV-1 previa a un trasplante no es una práctica generalizada y va de la mano de la prevalencia pues la especificidad de las pruebas es baja donde no es frecuente el virus6,11, pero dado el riesgo de transmisión a través de injertos se ha empezado a realizar más frecuentemente7. La utilidad de evaluar al HTLV en trasplante de órganos sólidos podría implicar la profilaxis con zidovudina o raltegravir, tal como han propuesto algunos autores11, pero en pacientes con linfoma sometidos a TMO esto no es claro y no hay evidencia sólida que permita recomendar esta conducta, más aún si no son del tipo ATL.
En los casos presentados vemos escenarios clínicos disímiles. Por un lado, la disminución de la carga proviral con los inmunosupresores haría una recaída de la ATL menos probable, como se vio en un reporte donde hubo supervivencia libre de enfermedad de 12 años12, pero en nuestro paciente la recaída fue rápida y fatal. Nuestra otra paciente presentó HAM a los 9 meses tras el TMO mientras en otro reporte se dio después de 3 años9. Finalmente, en nuestro último caso la enfermedad injerto contra huésped es muy llamativa en un TMO autógeno pues es un evento raro que no ha sido reportado por otros autores13.
En una serie de casos se observó que el TMO autógeno no aumentó la supervivencia de los pacientes con ATL, sin embargo, no analizaron el impacto del HTLV-1 en este desenlace14; pero un estudio más grande de TMO alogénico encontró que la seropositividad del donante sí la disminuía en forma significativa15. Por otro lado, un análisis retrospectivo encontró desaparición de la carga proviral tras el TMO alogénico en todos los casos aunque con reaparición en algunos de ellos después de los 36 meses, pero no pudieron establecer relación con recaídas16; dicho efecto se puede asociar con la reconstitución inmune postrasplante que lleva al reconocimiento de la proteína viral HBZ con una respuesta inmunoespecífica del injerto contra el HTLV-117.
Con nuestros datos actuales no podemos establecer el papel real del HTLV en los pacientes con cualquier tipo de linfoma sometidos a TMO pero se puede considerar latente el riesgo de inducir neoplasia o recaídas8. Para el tratamiento están disponibles el interferón-α que es capaz de suprimir la expresión genética del virus y llevar a una interrupción del ciclo celular y combinado con zidovudina a apoptosis de las células infectadas18,19, el raltegravir que disminuye la carga proviral aunque no más de 6 meses20, y también la prosultiamina que podría tener un efecto en el número de copias y la disfunción motriz en pacientes con HAM21. Sin embargo, en la práctica no hay eficacia contundente con dichas intervenciones4 y por eso la utilidad de encontrar el virus es discutible; en nuestros casos ningún paciente recibió antirretrovirales antes ni después del TMO. Aun así, recomendamos la búsqueda rutinaria de los anticuerpos contra HTLV-1 en los pacientes y donantes en países de alta prevalencia para así poder determinar el verdadero impacto de esta infección en el desenlace postrasplante y definir la necesidad de pruebas de laboratorio adicionales como la carga proviral.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.