La incidencia de la tosferina ha mostrado un incremento en los últimos años, afectando predominantemente a los niños menores de un año, adolescentes y adultos. En el 2005, el Comité Asesor de Prácticas en Inmunización de los Estados Unidos (Advisory Committee on Immunization Practices [ACIP]) recomendó administrar una dosis de refuerzo de la vacuna con un componente acelular antipertusis a los adolescentes, estrategia que ha sido adoptada por distintos países. Nuestro objetivo fue realizar una revisión sistemática que evaluara la efectividad a corto plazo de esta medida de prevención primaria, la cual no ha sido realizada hasta el momento.
MétodosRevisión sistemática de la literatura en inglés y español de artículos acerca de la efectividad a corto plazo de la administración de la vacuna de difteria, tétanos, pertusis acelular de contenido antigénico reducido (Tdap) como dosis de refuerzo en adolescentes, entre enero de 1990 y diciembre de 2012.
ResultadosLa búsqueda inicial arrojó un total de 121 resultados; de 26 artículos preseleccionados, solo 4 cumplieron los criterios de selección. La evidencia disponible fue clasificada como Ib. En los artículos se evaluó la inmunogenicidad generada contra tétanos y difteria por la vacuna Tdap versus tétanos, difteria reducida (Td) con resultados significativos y similares. Se documentó que la respuesta inmunológica protectora generada por la Tdap contra tétanos, difteria y Bordetella pertussis es apropiada. La reactogenicidad de la vacuna acelular fue baja, y el dolor en el sitio de administración fue el evento más común.
ConclusiónLa evidencia disponible indica que se puede recomendar la vacuna Tdap como dosis de refuerzo en adolescentes entre los 10 y los 18 años de edad por su baja reactogenicidad y adecuada inmunogenicidad contra tétanos, difteria y Bordetella pertussis.
In recent years, there has been an increase in the number of cases of pertussis, predominantly affecting infants under one year of age, teenagers and adults. In 2005, the Advisory Committee on Immunization Practices of the United States (ACIP) recommended administering a booster shot of acellular pertussis-containing vaccine for teenagers, a strategy adopted by various countries. Our objective was to perform a systematic review of the short-term effectiveness of this preventive strategy. As far as we know, this review has not been performed to date.
MethodsA systematic literature review of publications in English and Spanish on the short-term effectiveness of a reduced antigen content diphteria-tetanus-acellular pertussis vaccine (Tdap) as a booster shot for teenagers, between January 1990 and December 2012.
ResultsAn initial search revealed a total of 121 results; of 26 papers preselected, 4 were included in the review. They were classified as level of evidence Ib. The immunogenicity against tetanus and diphtheria was tested with the Tdap vaccine versus tetanus, reduced diphtheria (Td). The authors found that the immune responses were significant and similar. The responses to the Tdap against specific antigens of Bordetella pertussis, diphtheria and tetanus were appropriate and significant. The reactogenicity was low, and the most common local adverse event was pain, predominantly in the group that received Tdap.
ConclusionsAvailable evidence supports the strategy of using Tdap vaccine as a booster in teenagers from 10 to 18 years of age. This conclusion is based on its low reactogenicity and its adequate immunogenicity against tetanus, diphtheria and Bordetella pertussis.
La tosferina o pertusis es una enfermedad respiratoria altamente contagiosa, causada por la bacteria Bordetella pertussis (B. pertussis). Cursa con una presentación clínica y pronóstico variable de acuerdo al grupo etario afectado. En los adolescentes y adultos, la infección puede causar una tos prolongada y en ocasiones se asocia a una elevada morbilidad. En los niños, en particular los lactantes menores y neonatos, la morbilidad es aún mayor y la enfermedad puede ser fatal1,2.
La infección por B. pertussis es de distribución mundial3. Antes del inicio de la vacunación, era una de las principales enfermedades responsables de la morbimortalidad infantil4. Con la introducción de la vacuna se observó una reducción importante en la incidencia de la infección. Sin embargo, en los últimos años se ha evidenciado un aumento en el número de casos de tosferina, con un desplazamiento de la enfermedad hacia los menores de un año, adolescentes y adultos5. De estos grupos etarios afectados, los que tienen mayor riesgo de morbimortalidad relacionada con la tosferina son los lactantes (especialmente<6 meses) y los niños que no han sido completamente inmunizados6.
Al revisar los datos del Sistema de Vigilancia en Salud Pública (SIVIGILA) del año 2004 al 2012 en Colombia, se ha registrado un promedio de 1,6 casos de tosferina por cada 100.000 habitantes, con un aumento progresivo de la incidencia en los últimos años. El grupo de edad más afectado es el de los menores de un año, seguido por los niños de entre 1 y 4 años7.
Adicionalmente, en el año 2012 se notificaron en Colombia al sistema individual del SIVIGILA un total de 11.404 casos. La distribución de los casos por edad, en orden descendente de incidencia, muestra en primer lugar el grupo de cero a un mes (22,97%), seguido de la cohorte de 5 a 14 años (19,90%) y en tercer puesto los niños de 2 a 3 meses (17,40%)8.
Con respecto a la infección por B. pertussis en adolescentes, los datos de vigilancia de 1990 a 2003 de los Centros para el Control y Prevención de Enfermedades (Centers for Disease Control and Prevention [CDC]) demuestran que la incidencia en este grupo etario ha aumentado sustancialmente en casi 10 veces9. Por otra parte, al comparar las tasas de enfermedad de la tosferina en el período 1990-1993 con los datos de los CDC de 2004 se revela un aumento de casi 19 veces en el número de casos en personas entre 10 y 19 años de edad10.
La causa del aumento en la incidencia y del cambio general en la distribución por edades de la tosferina no se comprende completamente. Se han propuesto distintas explicaciones. Una de las más aceptadas es la disminución de la protección inmunológica conferida por la vacuna después de 4 a 12 años de su administración11, lo cual podría explicar el aumento en el número de casos entre adolescentes.
Teniendo en cuenta lo anterior y, debido al ya nombrado aumento en la frecuencia de la tosferina entre los adolescentes, el Comité Asesor de Prácticas en Inmunización (Advisory Committee on Immunization Practices [ACIP]) de los CDC de los Estados Unidos, la Academia Americana de Pediatría (American Academy of Pediatrics [AAP]) y la Academia Americana de Médicos de Familia (American Academy of Family Physicians [AAFP]) recomiendan la administración de una dosis de refuerzo de 0,5ml intramuscular de la vacuna acelular contra tosferina más toxoide diftérico reducido y toxoide tetánico (Tdap) para los adolescentes entre los 11 y los 18 años. La edad preferida para su aplicación es entre los 11 y los 12 años12–15.
Actualmente existen 2 presentaciones disponibles de la vacuna Tdap, aprobadas por la agencia Food and Drug Administration (FDA) de Estados Unidos en el año 200513,16. Estas vacunas están constituidas por antígenos de B. pertussis purificados incluyendo: toxina pertúsica (PT) (pertussis toxin), hemaglutinina filamentosa (FHA) (filamentous haemagglutinin), pertactina (PRN) (pertactin) y una de ellas adicionalmente contiene los antígenos fimbriales serotipo 2 y 3 (FIM2+3) (fimbriae types 2 and 3); además, ambas presentaciones se encuentran asociadas a toxoide diftérico reducido y toxoide tetánico17. Estas 2 vacunas se diferenciarán a lo largo de todo el artículo de acuerdo a su contenido de FIM2+3 (Tdap sin FIM2+3 y Tdap con FIM2+3).
La recomendación generada por el ACIP, la AAP y la AAFP fue realizada para proteger a los adolescentes contra la tosferina y para prevenir la mortalidad infantil secundaria a la transmisión a lactantes menores susceptibles por no protección adecuada por edad12. Esta estrategia ha sido puesta en práctica en distintos países3. Sin embargo, aún no existe una revisión sistemática que demuestre que esta medida es efectiva. Debido a ello, se planteó la realización de esta revisión sistémica de la literatura con el objetivo de esclarecer la efectividad a corto plazo de la vacuna de difteria, tétanos, pertusis acelular de contenido antigénico reducido (Tdap) en adolescentes para ser utilizada como estrategia de prevención primaria.
MetodologíaSe hizo una revisión sistemática de la literatura a partir de artículos de investigación originales publicados en las siguientes bases de datos: MEDLINE, EMBASE, Pubmed, BIREME que incluye LILACS, La Biblioteca Cochrane, SciELO y WHOLIS. Adicionalmente se realizó la búsqueda de literatura gris con el fin de disminuir el sesgo de publicación, revisando la información disponible en bibliotecas de universidades colombianas y COLCIENCIAS (grupos de investigación colombianos y su producción científica). El intervalo de tiempo utilizado para la búsqueda fue el comprendido entre enero de 1990 y diciembre de 2012, limitándose el idioma a español e inglés.
Los términos de búsqueda utilizados incluyeron: Medical Subject Headings (MeSH), Descriptores en Ciencias de la Salud (DECS) y términos de texto libres.
Los términos MeSH que se emplearon para la búsqueda fueron: treatment outcome, pertussis vaccine, adolescent, Boostrix®, Adacel®. También se utilizaron los DECS: efficacy, diphtheria-tetanus-acellular pertussis vaccines, effectiveness. Adicionalmente, se utilizaron los términos de texto libres: Tdap vaccine, vacuna acelular antipertusis, vacuna contra la tosferina, vacunas acelulares, vacuna contra difteria, tétanos y tosferina, vacunas de gérmenes enteros y acelulares, adolescente.
La sintaxis de búsqueda utilizada en las bases de datos PUBMED así como en MEDLINE fue la siguiente: ((((«Tdap Vaccine» OR «Tdap Vaccines» OR Boostrix OR Adacel)) OR ((«Pertussis Vaccine»[Mesh] AND «Vaccines, Acellular»[Mesh]) OR «Diphtheria-Tetanus-acellular Pertussis Vaccines»[Mesh]))) AND (((Effectiveness OR efficacy)) OR («Treatment Outcome»[Mesh])). Para realizar la búsqueda en EMBASE se utilizaron las combinaciones de términos MESH y los operadores booleanos de manera similar a lo mencionado previamente. Finalmente para la pesquisa en BIREME y en la literatura gris se utilizaron los términos de texto libres citados en el párrafo anterior.
Por otra parte, para la selección de los estudios se tomaron como criterios de inclusión:
- •
Estudios tipo ensayos clínicos controlados y aleatorizados (ECCA); estudios de casos y controles con más de 10 participantes por variables incluidas en el análisis18 (estudios que controlaron múltiples variables confusoras o exploraron múltiples factores de riesgo a través de un modelo de regresión logística múltiple) y estudios de cohorte.
- •
Población entre los 10 y los 18 años de edad.
- •
Información acerca de la aplicación de las 2 vacunas Tdap disponibles en el mercado, con o sin administración concomitante de otras vacunas.
- •
Estudios con control adecuado de las variables de confusión.
Como criterios de exclusión, se tuvieron:
- •
Artículos sin relevancia en el título y resumen.
- •
Estudios sin resultados en cuanto a efectividad.
- •
Estudios con sesgos de selección y con inadecuada clasificación que imposibiliten el adecuado análisis de la información.
- •
Estudios que no tengan datos originales.
- •
Estudios sin grupo control.
- •
Estudios con un puntaje de calidad no adecuado (<3 puntos en la escala de Jadad19).
La identificación de los artículos se realizó de manera independiente por 2 revisores y, en caso de desacuerdo, se revisó el artículo entre los 2 evaluadores para llegar a un consenso en la selección del artículo. Se tuvo en cuenta la escala Jadad para determinar la calidad de los estudios. Se realizó una lectura crítica con posterior extracción de los resultados de los artículos identificados que cumplían con los criterios de inclusión.
Para el análisis de los artículos incluidos, se tuvieron en cuenta las siguientes medidas de resultados:
- •
La respuesta a la dosis de refuerzo contra tétanos, difteria y antígenos específicos de B. pertussis, la cual fue presentada a partir de promedios y comparación de proporciones de la vacuna Td y Tdap con sus respectivos intervalo de confianza al 95%.
- •
Se calculó la media geométrica de títulos (GMT) de anticuerpos contra tétanos, difteria y antígenos específicos de B. pertussis.
- •
Se calculó la ratio GMT: la GMT de anticuerpos contra tétanos y difteria de la vacuna Td entre Tdap (GMT Td/GMT Tdap) con sus respectivos intervalos de confianza de 95% (pre- y posvacunación), los cuales fueron interpretados como sugieren Horne et al.20, y otros autores como Nauta en el libro Statistics in clinical vaccine trials21. De acuerdo a lo anterior, el análisis utilizado de los intervalos de confianza fue teniendo en cuenta la hipótesis de no inferioridad de la GMT Td/GMT Tdap, donde se considera que se cumple esta hipótesis si el valor de la ratio GMT no supera el límite superior del intervalo de confianza calculado.
- •
Se empleó el análisis de varianza con el modelo de efectos aleatorios para comparar GMT y ratio GMT entre los grupos y la prueba exacta de Fisher para evaluar la diferencia entre los porcentajes de seroprotección y reacciones adversas. La significación estadística fue una p<0,05.
La búsqueda electrónica inicial en las diferentes bases de datos arrojó los siguientes resultados: se identificaron 121 referencias, de las cuales se excluyeron 95 por no tener relevancia en el título y resumen. La selección preliminar fue de 26 artículos discriminados según las bases de datos de la siguiente manera: BIREME 10 artículos, MEDLINE 5 artículos, Pubmed 5 artículos, EMBASE 6 artículos. Teniendo en cuenta que algunas de estas referencias se encuentran en más de una base de datos, el número total de artículos con relevancia en título y resumen fue de 15. Se revisaron los 15 artículos en texto completo y tras la aplicación de los criterios de selección, se incluyeron finalmente 4 artículos para este estudio. En la figura 1 se describe de forma detallada el diagrama de flujo del proceso de selección de los artículos revisados.
El total de individuos incluidos en la muestra fue de 6.887 pacientes. De este total, 4.902 recibieron la vacuna Tdap como dosis de refuerzo, 3.606 niños en la presentación de Tdap sin FIM2+3 y 1.296 niños en la presentación Tdap con FIM2+3. La vacuna Td fue administrada como dosis de refuerzo en 1.985 pacientes (ver tabla 1).
Tamaño de la muestra y características demográficas
| Autor-año | Tamaño muestral | Tdap | Comparación | Edad promedio (años) | Ratio género | Raza blanca (%) | Raza negra (%) | Otras razas (%) | TP |
|---|---|---|---|---|---|---|---|---|---|
| Pichichero et al. 200622 | N: 4.114 | Sin FIM2+3a n: 3.080 | Vacuna Tdn: 1.034 | Tdap: 12,9Td: 12,9 | Tdap: 1Td: 1,1 | Tdap: 85,8Td: 85,4 | Tdap: 5,7Td: 5,4 | Tdap: 2,9Td: 3,2 | 30 |
| Pichichero et al. 200523 | na: 2.028 | Con FIM2+3an: 1.213 | Vacuna Tdn: 815 | Tdap: 13,8Td: 13,8 | Tdap: 1Td: 0,98 | Tdap: 86,4Td: 85 | Tdap: 9,4Td: 9,2 | Tdap: 1,6Td: 1,8 | 28 |
| Southern et al. 200525 | nb: 241 | Sin FIM2+3a n: 79Con FIM2+3an: 83 | Vacuna Tdn: 79 | Sin FIM2+3: 14,9Con FIM2+3: 14,7Td: 14,9 | Sin FIM2+3: 0,72Con FIM2+3: 1,37Td: 1,13 | ND | ND | ND | 28 a 42 |
| Tran Minh et al. 199924 | N: 504 | Sin FIM2+3an: 447 | Vacuna Tdn: 57 | Tdap: 10,8Td: 10,8 | Tdap: 0,82Td: 0,82 | 100 | 0 | 0 | 30 |
N: número total de pacientes incluidos en el estudio; n: subgrupo de pacientes receptores de la vacuna Td, Tdap con FIM2+3 o Tdap sin FIM 2+3; na: subgrupo de pacientes adolescentes incluido en el estudio; nb: subgrupo de pacientes que recibió la vacuna Td o Tdap en este estudio; ND: no descrito; Td: vacuna contra tétanos y difteria; Tdap: vacuna acelular contra tosferina más toxoide diftérico reducido y toxoide tetánico; TP: tiempo de seguimiento en días.
El promedio de edad en los diferentes estudios osciló entre 10,8 y 14,9 años. La distribución de acuerdo al género fue similar entre los grupos de estudio con una ratio de género (masculino/femenino) entre 0,72 y 1,37. La mayoría de los pacientes incluidos fueron de raza blanca. El tiempo mínimo de seguimiento fue de 28 días y el máximo de 42 (ver tabla 1).
En todos los estudios se encuentran descritos los resultados en cuanto a inmunogenicidad y reactogenicidad de las vacunas Tdap y Td, lo cual se describirá a continuación.
En los estudios de Pichichero et al. 200622 y Pichichero et al. 200523 donde se evaluaron Tdap sin FIM2+3 y Tdap con FIM2+3 respectivamente versus Td se observó que la respuesta a la dosis de refuerzo contra difteria y tétanos inducida por las vacunas Tdap era estadísticamente significativa (ver tabla 2). Adicionalmente, la respuesta a la dosis de refuerzo contra difteria y tétanos generada por Tdap no es inferior a la alcanzada con Td (ver tabla 3).
Respuesta a la dosis de refuerzo contra tétanos y difteria con Tdap vs. Td
| Autor-año | Seroprotección prevacunación de refuerzoa | Tdapn (%) | Td n (%) | Respuesta a la dosis de refuerzob | Tdap n (%) | Td n (%) |
|---|---|---|---|---|---|---|
| Pichichero et al. 200622 | Anti-D | 2.466 (85,8) | 814 (84,8) | Anti-D | 2.463 (90,6)c | 814 (95,9)c |
| Anti-T | 2.471 (97,7) | 817 (96,8) | Anti-T | 2.469 (89,7)c | 817 (92,5)c | |
| Pichichero et al. 200523 | Anti-D | 526 (99,8) | 515 (99,8) | Anti-D | 501 (95,1)c | 489 (95,0)c |
| Anti-T | 527 (100,0) | 516 (100,0) | Anti-T | 483 (91,7)c | 471 (91,3)c |
Anti-D: anticuerpos antitoxoide-diftérico; Anti-T: anticuerpos antitoxoide tetánico; Td: vacuna contra toxoide tetánico y diftérico reducido; Tdap: vacuna acelular contra la tosferina, toxoide diftérico reducido y toxoide tetánico.
Seroprotección prevacunación de refuerzo se define como una concentración de anticuerpos anti-D y anti-T ≥ 0,1 IU/Ml28.
Respuesta a la dosis de refuerzo contra la difteria y el tétanos se define como una concentración de anticuerpos después de la vacunación ≥0,4 UI/ml en los adolescentes inicialmente seronegativos (concentraciones de anticuerpos <0,1 UI/ml) o un aumento después de la vacunación ≥ 4 veces la concentración de anticuerpos antes de la vacunación para adolescentes inicialmente seropositivos28.
Ratio GMT de anticuerpos contra tétanos y difteria con Tdap vs. Td
| Autor-año | Concentración de anticuerpos postvacunación | Tdap GMT (UI/mL) | Td GMT (UI/mL) | Ratio GMT posvacunaciónb (IC) | ||
|---|---|---|---|---|---|---|
| Pichichero et al. 200622 | Anti-D | 7,35 | 14,02 | 1,9 (1,8-2,0) | ||
| Anti-T | 15,68 | 20,72 | 1,3 (1,2-1,4) | |||
| Pichichero et al. 200523 | Anti-D | 8,46 | 7,10 | 0,83 (0,71-0,94) | ||
| Anti-T | 12,87 | 14,35 | 1,1 (0,82-1,3) | |||
| Southern et al. 200525 | Anti-D | Tdap sin FIM2+3a | Tdap con FIM2+3a | 6,60 | Tdap sin FIM2+3a | Tdap con FIM2+3a |
| 4,43 | 7,64 | 1,48(1,32-1,56) | 0,86(0,64-0,97) | |||
| Anti-T | 22,24 | 27,98 | 21,860,98(0,87-1,1) | 0,78(0,65-0,96) | ||
| Tran Minh et al. 199924 | Anti-D | 7 | 8 | 1,1 (0,91-1,2) | ||
| Anti-T | 24 | 38 | 1,5 (1,4-1,7) | |||
Anti-D: anticuerpos antitoxoide-diftérico; Anti-T: anticuerpos antitoxoide tetánico; GMT: media geométrica de los títulos de anticuerpos; IC: intervalo de confianza; ND: no descrito; Td: vacuna contra toxoide tetánico y diftérico reducido; Tdap: vacuna acelular contra la tosferina, toxoide diftérico reducido y toxoide tetánico.
Sin FIM2+3 y con FIM2+3 hace referencia a las 2 vacunas Tdap comercialmente disponibles en el momento.
Ratio GMT: GMT posvacunación de Td dividida entre GMT posvacunación de Tdap. La respuesta de Tdap no es inferior a la alcanzada con Td si el GMT ratio posvacunación es menor que el límite superior del intervalo de confianza20,21.
Por otra parte, la inmunogenicidad generada por la vacuna Tdap fue evaluada con respuesta a la dosis de refuerzo, la GMT y ratio GMT de anticuerpos contra antígenos específicos de B. pertussis (PT, FHA, PRN y fimbrias tipo 2 y 3).
En los estudios de Pichichero et al. 200622 y Pichichero et al. 200523 se documenta que la mayoría de sujetos (84,5 y 92%, respectivamente) que recibieron Tdap alcanzaron concentraciones de anticuerpos adecuadas contra los antígenos específicos de B. pertussis con evidencia de anticuerpos anti-PT superiores en el grupo que recibió Tdap con FIM2+3, y mayor concentración de anticuerpos anti-FHA en los sujetos que recibieron Tdap sin FIM2+3. En cuanto a la respuesta a la dosis de refuerzo anti-PRN no se documentaron diferencias estadísticamente significativas entre los grupos (Tdap sin FIM2+3 vs. Tdap con FIM2+3; p = 0,493) (ver tabla 4).
Evaluación de la respuesta a la dosis de refuerzo con Tdap sin FIM2+3 vs. Tdap con FIM2+3
| Autor- año | Seroprotección prevacunacióna | Tdap n (%) | Respuesta a la dosis de refuerzob | Tdap n (%) | T |
|---|---|---|---|---|---|
| Pichichero et al. 200622 | Anti-PT | 2.710 (65,1) | Anti-PT | 2.677 (84,5)c | 30 días |
| Anti-FHA | 2.745 (96,3) | Anti-FHA | 2.744 (95,1)c | ||
| Anti-PRN | 2.754 (72,9) | Anti-PRN | 2.752 (95,4)c | ||
| Pichichero et al. 200523 | Anti-PT | ND | Anti-PT | 482 (92,0)c | 28 días |
| Anti-FHA | ND | Anti-FHA | 450 (85,6)c | ||
| Anti-PRN | ND | Anti-PRN | 496 (94,5)c | ||
| Anti-FIM2+3 | ND | Anti-FIM2+3 | 499 (94,9)c |
Anti-FHA: anticuerpos antihemaglutinina filamentosa; Anti-FIM2+3: anticuerpos antifimbrias tipo 2 y 3; Anti-PRN: anticuerpos antipertactina; Anti-PT: anticuerpos antitoxina pertúsica; ND: no descrito; T: tiempo de seguimiento serológico; Tdap: vacuna acelular contra la tosferina, toxoide diftérico reducido y toxoide tetánico.
Seroprotección prevacunación de refuerzo se define como una concentración de anticuerpos anti-PT, anti-FHA, y anti-PRN ≥ 5,0 EL.U./ml28.
Respuesta a la dosis de refuerzo para PT, FHA, y PRN es definida como una concentración de anticuerpos ≥ 20 EL.U./ml en los adolescentes que fueron seronegativos (concentraciones de anticuerpos<5,0 EL.U./ml) antes de la vacunación; o al menos un aumento en la concentración de anticuerpos de 4 veces en los adolescentes que eran seropositivos con concentraciones de anticuerpos previos a la vacunación ≥ 5,0 EL.U./ml y<20 EL.U./ml; o al menos un aumento en la concentración de anticuerpos del doble en los adolescentes que eran seropositivos con concentraciones de anticuerpos previas a la vacunación ≥ 20 EL.U./ml28.
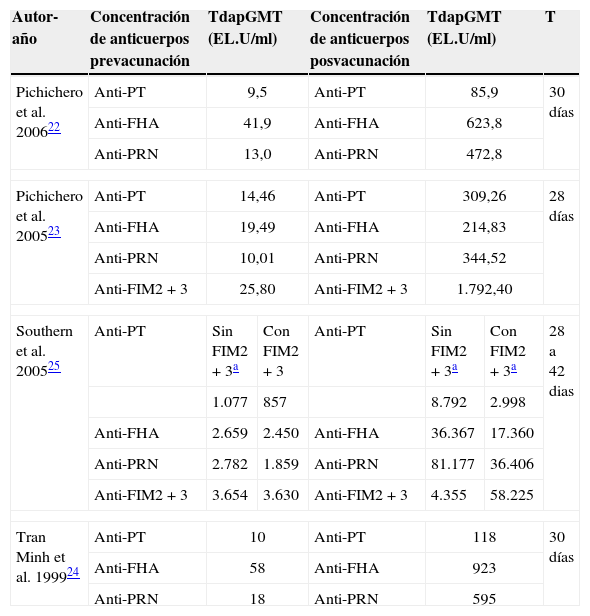
Adicionalmente, todos los sujetos que recibieron la vacuna Tdap mostraron un significativo aumento (7-69,4 veces) en la GMT de anticuerpos contra antígenos específicos de B. pertussis, alcanzándose los niveles más elevados con Tdap con FIM2+3 (ver tabla 5).
Evaluación de la media geométrica de los títulos de anticuerpos contra antígenos específicos de B. pertussis
| Autor- año | Concentración de anticuerpos prevacunación | TdapGMT (EL.U/ml) | Concentración de anticuerpos posvacunación | TdapGMT (EL.U/ml) | T | ||
|---|---|---|---|---|---|---|---|
| Pichichero et al. 200622 | Anti-PT | 9,5 | Anti-PT | 85,9 | 30 días | ||
| Anti-FHA | 41,9 | Anti-FHA | 623,8 | ||||
| Anti-PRN | 13,0 | Anti-PRN | 472,8 | ||||
| Pichichero et al. 200523 | Anti-PT | 14,46 | Anti-PT | 309,26 | 28 días | ||
| Anti-FHA | 19,49 | Anti-FHA | 214,83 | ||||
| Anti-PRN | 10,01 | Anti-PRN | 344,52 | ||||
| Anti-FIM2+3 | 25,80 | Anti-FIM2+3 | 1.792,40 | ||||
| Southern et al. 200525 | Anti-PT | Sin FIM2+3a | Con FIM2+3 | Anti-PT | Sin FIM2+3a | Con FIM2+3a | 28 a 42 dias |
| 1.077 | 857 | 8.792 | 2.998 | ||||
| Anti-FHA | 2.659 | 2.450 | Anti-FHA | 36.367 | 17.360 | ||
| Anti-PRN | 2.782 | 1.859 | Anti-PRN | 81.177 | 36.406 | ||
| Anti-FIM2+3 | 3.654 | 3.630 | Anti-FIM2+3 | 4.355 | 58.225 | ||
| Tran Minh et al. 199924 | Anti-PT | 10 | Anti-PT | 118 | 30 días | ||
| Anti-FHA | 58 | Anti-FHA | 923 | ||||
| Anti-PRN | 18 | Anti-PRN | 595 | ||||
Anti-FHA: anticuerpos antihemaglutinina filamentosa; Anti-FIM2+3: anticuerpos antifimbrias tipo 2 y 3; Anti-PRN: anticuerpos antipertactina; Anti-PT: anticuerpos antitoxina pertúsica; GMT: media geométrica de los títulos de anticuerpos; T: tiempo de seguimiento serológico; Tdap: vacuna acelular contra la tosferina, toxoide diftérico reducido y toxoide tetánico.
En todos los estudios incluidos fueron evaluadas las reacciones adversas locales y sistémicas producidas por las vacunas Tdap y Td.
En el caso de la vacuna Tdap, la reacción adversa local más frecuentemente descrita fue cualquier grado de dolor, entre el 58 y 79% de los sujetos vacunados; la segunda en orden de frecuencia fue el edema, el cual fue registrado entre el 20 y el 35% de la muestra. Para la vacuna Td, al igual que con la vacuna Tdap, la reacción adversa local más frecuentemente descrita fue cualquier grado de dolor con un registro entre el 62,5 y el 83,3% de la muestra. El segundo lugar fue para el eritema en el sitio de aplicación de la vacuna, del 13,9 al 53,3%.
Al comparar las reacciones adversas locales presentadas con estas vacunas se observó que cualquier grado de dolor en el sitio de aplicación de la vacuna se presentó de manera más frecuente entre los sujetos que recibieron Tdap (Pichichero et al. 200622) y se presentó edema de manera más frecuente en el grupo que recibió Td (Tran Minh et al. 199924).
Por otra parte, en cuanto a las reacciones adversas sistémicas se encontró que la más frecuente fue cefalea (Tdap: 31,1-35,3% y Td: 27,8-51,7%) seguida de cansancio (Tdap: 13,2-29,9% y Td: 6,9-50%) sin diferencias estadísticamente significativas para estos 2 síntomas entre las vacunas Tdap y Td.
Al contrastar las reacciones adversas producidas por las 2 vacunas Tdap disponibles se observó que los síntomas como eritema en el sitio de administración de la vacuna y cansancio se registraron de manera más frecuente y significativa en el grupo que recibió Tdap sin FIM2+3 (ver tabla 6).
Efectos secundarios de Tdap sin FIM2+3 vs. Tdap con FIM2+3
| Reacción adversa | Tdap sin FIM2+3 (%)a | Tdap con FIM2+3 n (%)b | p (IC) |
|---|---|---|---|
| Dolor | 2.666,9/3.548 (75,1) | 957/1.249 (76,6) | 0,32 (−0,043-0,013) |
| Eritema | 818,8/3.548 (23)c | 254/1.249 (20,3)c | 0,049 (0,001-0,054) |
| Edema | 780,8/3.548 (22) | 263/1.249 (21) | 0,50 (−0,017-0,036) |
| Temperatura >38°C | 95,8/3.548 (2,7) | 39/1.249 (3,1) | 0,86 (−0,009-0,012) |
| Cefalea | 1.196,8/3.548 (33,7) | 396/1.249 (31,7) | 0,20 (−0,010-0,051) |
| Cansancio | 1.166,7/3.548 (32,8)c | 299/1.249 (23,9)c | 0,000 (0,061-0,118) |
| Vómito | 5/68 (6,9) | 41/1.249 (3,2) | 0,14 (−0,030-0,111) |
IC: intervalo de confianza; Tdap: vacuna acelular contra la tosferina, toxoide diftérico reducido y toxoide tetánico.
Por medio de esta revisión sistemática de la literatura se buscó establecer si la vacuna Tdap es lo suficientemente inmunogénica y segura a corto plazo para brindar protección contra B. pertussis en adolescentes y para generar una respuesta inmune similar a Td contra difteria y tétanos.
Los ECCA incluidos donde se utilizaba la vacuna Tdap sin FIM2+322,24,25 y Tdap con FIM2+323,25 arrojaron resultados alentadores. Al comparar las vacunas Tdap con la vacuna Td se documentó que la mayoría de los sujetos que recibían la vacuna Tdap lograban instaurar adecuada respuesta a la dosis de refuerzo contra difteria y tétanos.
Adicionalmente, la GMT de anticuerpos contra difteria y tétanos alcanzada con Tdap no fue inferior a la conseguida por el grupo que recibió la vacuna Td, teniendo en cuenta que la relación GMT calculada para cada uno de los estudios no es mayor que el límite superior de su intervalo de confianza. Lo anterior evidencia que la vacuna Tdap genera inmunogenicidad similar contra tétanos y difteria, al compararla con la vacuna Td. Resultados equivalentes fueron descritos en el estudio realizado por Halperin et al.26 en el año 2000, en el cual incluyeron a 749 adolescentes y adultos sanos entre las edades de 12 a 54 años (no estratificados por edad) los cuales dividieron aleatoriamente en 3 grupos para recibir Td, Tdap o vacuna acelular antipertusis (aP) con seguimiento de un mes postimunización de los niveles de anticuerpos contra tétanos, difteria y antígenos específicos de B. pertussis.
Por otra parte, todos los sujetos que recibieron la vacuna Tdap mostraron un incremento significativo (7-69,4 veces) en la GMT de anticuerpos contra antígenos específicos de B. pertussis, reportándose los niveles más elevados en los sujetos que recibieron Tdap con FIM2+3. Hasta el momento no se encuentra establecido el incremento ideal en los niveles de GMT de anticuerpos contra antígenos específicos de B. pertussis que confieren protección definitiva para la tosferina con la vacuna Tdap. Sin embargo, la eficacia de la vacuna acelular contra tosferina más toxoide diftérico y toxoide tetánico (DTaP) en el esquema de inmunización primaria está bien definido (aumento en la GMT de anticuerpos contra los antígenos específicos de B. pertussis de al menos 4 veces con respecto a la GMT previo a vacunación)23,27. De acuerdo a los resultados de los 4 estudios incluidos en esta revisión sistemática, se puede inferir de manera global que la vacuna Tdap provee adecuada protección contra la tosferina como dosis de refuerzo en los adolescentes. Conclusiones similares describe Halperin et al.26 quienes documentaron una respuesta potente de anticuerpos contra los antígenos de B. pertussis en los grupos de individuos que recibieron Tdap y aP.
En cuanto a la reactogenicidad, documentamos resultados similares a lo descrito por Halperin et al.26 reportándose dolor en el sitio de aplicación de la vacuna como el efecto adverso local más frecuente entre los grupos; con un predominio de este síntoma entre los individuos que recibieron la vacuna Tdap. Los efectos secundarios menores como eritema local y cansancio se documentaron de manera más frecuente con la administración de la vacuna Tdap sin FIM2+3.
Para terminar, con la evidencia que se obtuvo a través de esta revisión sistemática de la literatura se pueden alcanzar las siguientes conclusiones:
- 1.
La vacuna Tdap genera inmunogenicidad similar a la producida por la vacuna Td contra tétanos y difteria.
- 2.
Las vacunas Tdap proveen adecuada protección contra la tosferina como dosis de refuerzo en los adolescentes. La anterior afirmación se corrobora teniendo en cuenta el mayor incremento en la GMT de anticuerpos contra antígenos específicos de B. pertussis en los sujetos que recibieron Tdap respecto a los alcanzados en estudios previos con DTaP durante el esquema de inmunización primaria.
- 3.
La reactogenicidad de la vacuna Tdap es similar a la de la vacuna Td, con un predominio de algún grado dolor en el sitio de aplicación de la vacuna en el grupo Tdap.
- 4.
Al comparar la reactogenicidad de las vacunas Tdap disponibles, se documentó que efectos secundarios menores como eritema local y cansancio se presentan de manera más frecuente con la administración de Tdap sin FIM2+3.
Con los resultados obtenidos en esta revisión sistemática y el grado de evidencia de los estudios incluidos, se puede recomendar la inclusión de la vacuna Tdap como dosis de refuerzo en adolescentes entre los 10 y los 18 años de edad, teniendo en cuenta su baja reactogenicidad y adecuada inmunogenicidad contra tétanos, difteria y B. pertussis. Sin embargo, se considera que es necesario determinar en nuevos ensayos clínicos controlados aleatorizados a largo plazo el tiempo de protección conferido contra B. pertussis posterior a la dosis de refuerzo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNinguna.
Conflicto de interesesAlvarez-Larrañaga MI declara que participó como investigadora de estudio local en método diagnóstico de pertusis en lactantes menores de un año de edad, el cual fue patrocinado por la Secretaría Distrital de Salud y Sanofi-Pasteur. Los demás autores no declaran conflictos de interés para la publicación de este manuscrito.