La malaria o paludismo, enfermedad causada por protozoos parásitos de género Plasmodium, se considera un gran problema de salud pública mundial por sus elevadas tasas de morbimortalidad. Las manifestaciones clínicas de esta infección van desde un síndrome febril agudo hasta un cuadro de malaria complicada que afecta órganos específicos, pudiendo progresar a una falla multisistémica que comprometa la vida del paciente. En la malaria, el riñón es un órgano susceptible de daño por mecanismos fisiopatológicos directos del plasmodio como el secuestro de glóbulos rojos parasitados, la obstrucción de la microcirculación y la activación del sistema inmune; además, por efectos indirectos hematológicos, hepáticos y metabólicos. La lesión renal en malaria se ha informado en Colombia hasta en el 31% de los pacientes con malaria grave; incluye la lesión renal aguda y el síndrome nefrótico, cada uno con manifestaciones clínicas, implicaciones terapéuticas y factores pronósticos propios. La lesión renal aguda es la condición más frecuente y puede llevar a una acidosis metabólica grave, daño renal crónico e incluso, cuando hace parte de una falla multiorgánica, asociarse con mortalidad que alcanza tasas de entre 40 y 50%. Un mejor entendimiento de la fisiopatología de la lesión renal en la malaria permitirá reconocer las manifestaciones clínicas para hacer un diagnóstico temprano e iniciar un tratamiento oportuno, con los beneficios que esto conlleva para la evolución y pronóstico del paciente.
Malaria, a parasitic disease caused by protozoa of the genus Plasmodium, is currently considered a public health problem due to its high rates of morbidity and mortality. The clinical picture of malaria is diverse, ranging from classical febrile illness to severe malaria, which affects various organs and becomes a multisystem organ dysfunction. The kidney is an organ susceptible to damage from the plasmodia by direct pathophysiological mechanisms such as the sequestration of parasitized red blood cells, obstruction of microcirculation and immune system activation, and by indirect hematological, hepatic and metabolic causes. In Colombia, renal lesions have been reported in up to 31% of patients with severe malaria. This complication in malaria can appears as an acute renal injury or as a nephrotic syndrome, each one having different symptoms, therapeutical approach and prognosis. Acute kidney injury is the most common and can cause severe metabolic acidosis, chronic renal failure or in the presence of multiorgan dysfunction may be associated with high mortality rates (40-50%). We need to improve our knowledge about the phisiopathology of renal impairment during malaria in order to obtain early clinical diagnosis and to achieve better treatment outcomes.
En el siglo xxi la malaria sigue siendo una de las enfermedades más relevantes en las zonas tropicales, con un estimado de 207 millones de casos en el 2012 y de 627.000 muertes, la mayoría de las cuales ocurrieron en niños1. Sus efectos clínicos son motivo de preocupación, pues evolucionan desde un síndrome febril agudo hasta un cuadro de malaria complicada que compromete varios órganos y sistemas, amenazando la vida del paciente2. El diagnóstico de malaria complicada se hace generalmente aplicando los criterios definidos por la OMS, que incluyen la lesión renal aguda (LRA) en pacientes con malaria por Plasmodium falciparum (P. falciparum) definida por aumento de la creatinina (C) sérica por encima de 3mg/dL con eliminación urinaria menor de 400mL en 24h en un adulto y nitrógeno ureico en sangre (BUN) mayor de 60mg/dL3; esta entidad, sin embargo, puede ser causada por P. falciparum, P. vivax o P. knowlesi3–6.
La LRA era una complicación poco atribuida a la malaria, pero en los últimos años se informa con mayor frecuencia, alcanzando prevalencias hasta del 60% en los casos de malaria complicada7–9 con una mortalidad general que alcanza entre 40 y 50% y, en unidades de cuidado intensivo, entre 70 y 80%10. Estas cifras son cambiantes según la dinámica de relación entre el hospedero, el parásito y el entorno11; por ejemplo la incidencia de complicación renal es mayor en adultos no inmunes residentes en zonas de baja transmisión (30-40%) que en aquellos de zonas de alta endemia (3-5%)12, y la mortalidad informada en un centro de referencia de nefrología fue del 9,9%13. Se ha establecido que el hecho de vivir en un área no endémica para malaria es un factor de riesgo para LRA en pacientes con malaria14.
La LRA en malaria es la forma de compromiso renal más informada, sin embargo existen otras formas de alteración renal que se manifiestan con acidosis metabólica15,16 o síndrome nefrótico (SN)12,17 que afectan la función del riñón como órgano regulador del equilibrio ácido-base y de la membrana de filtración, respectivamente.
En Colombia, un estudio en 294 pacientes con malaria, hospitalizados entre 1992 y 1996, informó de aumento de la creatinina sérica por encima de 1mg/dL en 10 casos (3,4%), tanto en infecciones por P. vivax (44%), como por P. falciparum (39%) e infección mixta (8%); esta alteración se usó como criterio de falla renal, la cual cursó con anuria, oliguria, poliuria, o su combinación18. Estudios más recientes informan una mayor frecuencia de alteración renal; en 2001 en un municipio del Pacífico colombiano se encontró que el 74% de los pacientes con malaria por P. falciparum hospitalizados presentaron algún criterio de gravedad y entre ellos la complicación renal (C>1,2mg/dL) fue la segunda en frecuencia, en el 31%, de los casos graves18. Otro estudio realizado en Colombia informó disfunción renal moderada (C >1,5mg/dL o BUN 41-60 mg/dL) en 6 de 188 pacientes (3,2%), mientras que 39 (20,7%) presentaron disfunción renal leve (C = 1,1-1,5mg/dL; BUN 21-40 mg/dL); estos pacientes tenían infección por P. vivax (28 de 136; 20,6%) y por P. falciparum (17 de 51; 33,3%); al aplicar los criterios de complicación de la Organización Mundial de la Salud (OMS), ninguno se clasificó con disfunción renal grave19. Aunque se observan diferencias en las frecuencias reportadas por diferentes estudios, estas se pueden explicar por el uso de criterios diagnósticos distintos y, posiblemente, porque los pacientes provenían de regiones endémicas diferentes. Es evidente la presencia de alteración renal en los pacientes con malaria.
El objetivo de la presente revisión es mostrar los tipos de disfunción renal en los pacientes con malaria, su base fisiopatológica y la correlación con los hallazgos clínicos, con el fin de resaltar la importancia que tiene esta complicación y mejorar su comprensión como indicador de mal pronóstico en los pacientes con malaria.
MetodologíaEn este documento se presenta una revisión narrativa elaborada a partir de literatura disponible en la base de datos PubMed. Inicialmente se utilizó una estrategia de búsqueda por especificidad utilizando los descriptores MESH «malaria», «P. falciparum», «P. vivax», «kidney», «acute kidney injury», «acute renal failure» y «nephrotic syndrome»; posteriormente se usaron diferentes combinaciones de estos términos. Se llevó a cabo además una búsqueda por sensibilidad utilizando como descriptores «*malar*», «*Paludism», «*Kidn*», «*neph*», «*falcipar*», «*» y «*viva*». Se realizó revisión de los resúmenes y se seleccionaron referencias bibliográficas que estuvieran disponibles en idioma español y en inglés. Los datos epidemiológicos y guías de diagnóstico y tratamiento fueron obtenidos de los parámetros dictados por la OMS y el Ministerio de Salud y Protección Social de Colombia. La revisión se enfocó en la fisiopatología y el cuadro clínico de la lesión renal en malaria. Se analizó críticamente la variabilidad de los criterios diagnósticos usados en los estudios y la necesidad de reconocer oportunamente la instauración del daño renal para iniciar una terapia temprana y adecuada.
Aspectos generales de la patogénesis en malariaLa infección por el Plasmodium en el humano comienza tras la inoculación, por hembras de mosquitos del género Anopheles, de esporozoítos, que son una forma móvil del parásito, los cuales llegan por circulación sanguínea hasta el hígado donde invaden hepatocitos y se reproducen asexualmente. Después de un proceso de maduración, liberan al torrente sanguíneo los merozoítos que invaden y rompen eritrocitos, proceso que activa la respuesta inmune y causa las manifestaciones clínicas de la enfermedad11.
Eventos del ciclo eritrocíticoLa membrana del glóbulo rojo parasitado (GRP) sufre modificaciones como la formación de «knobs» o protuberancias debidas a la expresión de proteínas como pfEMP-1, HRP1 y HRP2; esto permite la unión del GRP con receptores endoteliales (fenómeno de secuestro), fijación con eritrocitos no parasitados (rosetas) y disminución de la deformabilidad eritrocitaria, causando obstrucción vascular e hipoxia en distintos órganos12,15,20-23.
Respuesta inmuneLa activación de linfocitos Th1 durante el episodio agudo produce liberación de citocinas proinflamatorias entre las cuales el factor de necrosis tumoral alfa (TNFα) parece ser la más implicada en la inmunopatología de la malaria ya que exacerba la sintomatología al producir fiebre, hipoglucemia e hipotensión, e induce coagulopatía, supresión de la médula ósea, hipergammaglobulinemia, y producción de catecolaminas que aumentan el estrés oxidativo y promueven otros mediadores que mantienen la cascada de inflamación12,15,22,25,26; estos fenómenos potencian el proceso patológico iniciado por la invasión del eritrocito12,22. Otros mediadores implicados son las interleucinas 1 y 6, asociadas a enfermedad grave20,21. El TNFα y las citocinas que de este se derivan también se relacionan con la activación del endotelio, expresión de receptores para el secuestro del parásito (ICAM-1, VCAM-1, CD36 y trombospondina)12,17 y alteración del metabolismo de la glucosa y el oxígeno; de este modo la hipoxia en malaria tiene 2 etiologías: obstrucción mecánica debida al secuestro de eritrocitos y disfunción metabólica celular secundaria a citocinas (fig. 1).
Fisiopatología del daño renal en la malariaEl daño renal en la malaria se produce en forma aguda o crónica; el primero es la LRA que se asocia con acidosis metabólica y es más frecuente en las infecciones producidas por P. falciparum, mientras que el segundo produce un SN y se ha informado frecuentemente en infecciones con P. malariae.
Lesión renal agudaLa patogénesis de la lesión renal en los casos de malaria complicada está relacionada con diferentes cambios hemodinámicos, que son más frecuentes y graves en la infección por P. falciparum17, pero que están presentes también en infecciones por P. vivax7,12. La forma más común de lesión renal en malaria se debe a necrosis tubular aguda cuya patogénesis puede explicarse por eventos en el riñón y fuera de él, y que desencadenan azoemia prerrenal, necrosis tubular aguda y finalmente LRA que en un porcentaje pequeño de los pacientes puede llevar a falla renal crónica con compromiso permanente de la función renal22.
Eventos extrarrenales que pueden tener un efecto secundario sobre el riñón:
- •
Hematológicos: hipovolemia, hipoxemia, hiperparasitemia, hemólisis, esquizontemia y coagulación intravascular diseminada12,23,24.
- •
Hepáticos: hiperbilirrubinemia (bilirrubina total >3mg/dL)7,12,25.
- •
Rabdomiolisis y mioglobinemia debidas a lesión de músculo esquelético, causando toxicidad en el epitelio renal23,26,27.
- •
Otras alteraciones sistémicas: vasodilatación, hipotensión, liberación de catecolaminas y deshidratación7,9,24,28.
Eventos locales: principalmente la activación endotelial (expresión de receptores y producción de citocinas), citoadherencia, secuestro de GRP, respuesta inflamatoria, obstrucción vascular y vasoconstricción7,26,29,30 (fig. 2). Estos eventos convergen y causan desorden en la microcirculación renal, produciendo hipoperfusión, hipoxia tisular y acumulación de metabolitos como radicales libres de oxígeno que causan daño tisular y necrosis, que finalmente se manifiestan como falla renal aguda.
La nefritis tubulointersticial aguda causada por el influjo masivo de linfocitos Th1 hacia el tejido renal y la glomerulonefritis atribuida a reacciones mediadas por complejos inmunes y proteínas del complemento son formas poco reportadas en la malaria y su patogénesis es poco conocida17. Otra forma poco frecuente de lesión renal aguda en malaria se asocia al síndrome fiebre de aguas negras (blackwater fever) o fiebre biliosa hemoglobinúrica, caracterizada por hemólisis intravascular masiva, hemoglobinuria, orina oscura y daño renal; en este caso la toxicidad directa de la hemoglobina es la causa de la afección renal, informada con mayor frecuencia en personas con deficiencia de glucosa-6-fosfato deshidrogenasa (G6PDH) o expuestas repetidamente a la quinina o a sustancias antioxidantes31–33.
AcidosisAunque la misma LRA puede causar acidosis metabólica, en malaria este trastorno es multifactorial y es causado por la combinación de alteraciones como isquemia, hipovolemia, glucólisis anaerobia, anemia, obstrucción vascular, hipoxia y probablemente pueda deberse a la menor depuración hepática del lactato debido a hepatitis malárica11,34. Se ha señalado que los cambios de volumen intravascular probablemente no explican la acidosis láctica en los pacientes con malaria grave y que la alteración de la función renal puede ser el principal mecanismo de acidosis, ya que hay una disminución en la capacidad del riñón para regular el balance de líquidos y electrolitos y para mantener constante la excreción de protones y la regeneración de bicarbonato hacia el plasma35. Otras explicaciones de la acidosis en malaria son el aumento de óxido nítrico en las glándulas suprarrenales, debido a la activación excesiva del sistema inmune del hospedero, cuyos efectos son inducir hiponatremia, aumento del sodio en orina y acidosis metabólica. En el riñón el aumento del óxido nítrico puede interferir con la función de diferentes proteínas transportadoras como los canales epiteliales de sodio y el contratransportador Na+/H+; ambos participan en la regulación del estado ácido-base, estimulando la reabsorción de sodio, excreción de protones (H+) y la reabsorción de bicarbonato para prevenir la acidosis15.
Síndrome nefróticoEn el SN está comprometida la función de la barrera de filtración glomerular, sin embargo la patogénesis no es bien clara y se sabe poco sobre los mecanismos responsables de este daño que, al parecer, está mediado por la respuesta inmune con predominio de células Th217,28. Los cambios patológicos observados por microscopia de luz son compatibles con glomerulonefritis membranosa o glomerulonefritis membranoproliferativa12. Biopsias tomadas de pacientes con infección por P. malariae36 y analizadas con inmunofluorescencia han mostrado depósitos granulares de IgG, IgM y fracción C3 del complemento. Se propone que, tanto en malaria como en otras enfermedades parasitarias, el depósito de complejos inmunes en la membrana glomerular puede causar una enfermedad leve y autolimitada como reflejo de un desorden simultáneo de la inmunidad, la cual puede progresar hasta un rango nefrótico37. Sin embargo, esta teoría se ve contrariada porque todos los pacientes con malaria desarrollan complejos inmunes circulantes, pero no se ha demostrado que su depósito sea capaz de inducir enfermedad38.
Elementos en el diagnóstico de la disfunción renalTradicionalmente se ha definido la LRA secundaria a malaria como un aumento súbito en la concentración plasmática de C (>3mg/dL), concentración de nitrógeno ureico en sangre mayor de 60mg/dL y eliminación urinaria menor de 400mL en 24 h, en cualquier individuo con formas asexuadas de P. falciparum en sangre periférica3. Dos grandes dificultades se presentan con esta definición la primera es que ignora la capacidad de P. vivax para causar LRA4 y la segunda se relaciona con lo elevado del valor de referencia para la C usado para hacer el diagnóstico en comparación con los criterios usados en guías internacionales19,39. Recientemente se ha reconocido la capacidad de P. vivax y P. knowlesi de producir complicaciones40.
El espectro de definiciones empleadas en los estudios de LRA en malaria incluye los diagnósticos basados en el aumento de la C, desde incrementos relativamente pequeños de su concentración (0,3 a 0,5mg/dL) hasta incrementos exagerados (5mg/dL)41. Lo más frecuente es encontrar definiciones de LRA que se apoyan en los valores de C inferiores a los valores propuestos por la OMS; entre ellos el criterio de C en suero >2mg/dL es común a distintos estudios24,25,42. Actualmente los criterios aceptados para la definición de LRA incluyen: un aumento absoluto de C sérica igual o mayor a 0,3mg/dL en menos de 48 h, o un incremento 1,5 veces la C sérica basal, o una reducción del flujo urinario (<0,5 cc/kg/h por más de 6 h consecutivas); la ventaja de estos criterios es que permiten subclasificar a los pacientes, ayudando a definir el pronóstico43.
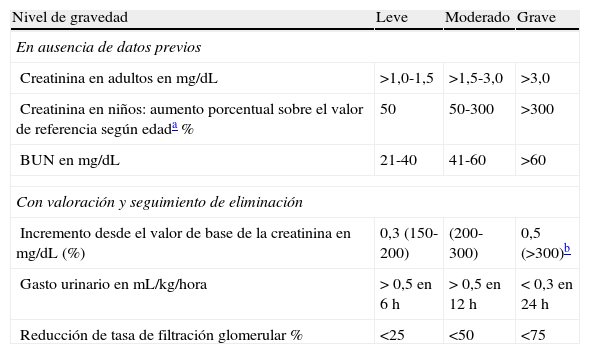
Se ha propuesto el uso de escalas que valoran la gravedad de la LRA, fundamentadas en las cifras de C. En Mumbai (India)8 se adaptó una escala de valoración cuantitativa que comprende disfunción leve (C <2mg/dL), moderada (2-5mg/dL) y grave (>5mg/dL). Se ha cuestionado la utilidad de las definiciones de LRA basadas en los valores de C, dada su falta de sensibilidad y especificidad, por lo que se propone que su diagnóstico incluya otros elementos como las enfermedades de base, el tiempo de evolución de la enfermedad y la disfunción de otros órganos41. Este cuestionamiento se basa en que los cambios en la concentración sérica de la C no discriminan el tipo de daño (isquemia o toxicidad), y por su poca variabilidad con los cambios en la tasa de filtración glomerular41. De otro lado, si se emplea la concentración del BUN sérico como indicador de LRA, debe tenerse en cuenta que este es influido por factores como la deshidratación, aporte de proteínas a la dieta, hemorragia digestiva y medicamentos27. Por lo anterior, de acuerdo a nuestra experiencia44, con base en el consenso de la conferencia KDIGO y en criterios diagnósticos empleados en niños39,45, proponemos en los primeros niveles de atención donde se puede medir creatinina y BUN, emplear criterios que de manera complementaria permitan reconocer no solo la extrema gravedad, sino además identificar tempranamente la instauración del daño y hacer intervenciones oportunas en los pacientes (tabla 1)44,46.
Clasificación de la lesión renal por parámetros de laboratorio
| Nivel de gravedad | Leve | Moderado | Grave |
| En ausencia de datos previos | |||
| Creatinina en adultos en mg/dL | >1,0-1,5 | >1,5-3,0 | >3,0 |
| Creatinina en niños: aumento porcentual sobre el valor de referencia según edada % | 50 | 50-300 | >300 |
| BUN en mg/dL | 21-40 | 41-60 | >60 |
| Con valoración y seguimiento de eliminación | |||
| Incremento desde el valor de base de la creatinina en mg/dL (%) | 0,3 (150-200) | (200-300) | 0,5 (>300)b |
| Gasto urinario en mL/kg/hora | > 0,5 en 6 h | > 0,5 en 12 h | < 0,3 en 24 h |
| Reducción de tasa de filtración glomerular % | <25 | <50 | <75 |
La LRA puede cursar con acidosis metabólica por la alteración en la regulación del balance hidroelectrolítico34. Es importante reconocer la acidosis en el paciente con malaria por su relación directa con el síndrome de dificultad respiratoria aguda (SDRA)47, complicación que tiene alta mortalidad. El control de la acidosis es determinante de la supervivencia por su repercusión en la funcionalidad de diferentes sistemas, causando disfunción cardiovascular48–50, interferencia con funciones cerebrales en especial las del centro respiratorio51, aumento de resistencia a la insulina e inhibición de la glucólisis y gluconeogénesis52.
Comúnmente el SN se ha asociado a infecciones por P. malariae pero actualmente no es frecuente encontrarlo como agente causal12,53, se han reportado casos esporádicos en los últimos años54; P. vivax y P. falciparum también pueden llegar a causar este síndrome55. El patrón histológico del SN asociado a P. malariae no es específico, siendo la glomerulonefritis focal y segmentaria y la enfermedad de cambios mínimos los más frecuentes38,56. Algunos autores recomiendan reconsiderar la relación entre la infección por P. malariae y SN debido a la ausencia de un patrón histológico característico, el cual varía según factores geográficos, raciales y metodológicos, además por la escasez de información reciente en la literatura médica sobre este tema12,38.
Manifestaciones clínicasEl cuadro clínico agudo no complicado de malaria se presenta generalmente con escalofrío, fiebre intermitente, sudoración y signos como hepatomegalia, esplenomegalia y palidez2,8,17; también puede presentarse cefalea, anorexia, astenia, vómito, diarrea, ictericia y lumbalgia, entre otros2,57,58. Las complicaciones clínicas pueden ser de origen neurológico, hepático, hematológico, respiratorio o renal46. Algunos hallazgos clínicos y parasitológicos de fácil reconocimiento pueden indicar tempranamente la disfunción de un órgano específico46,59, se conocen como signos de peligro y permiten identificar a los pacientes que están en riesgo de complicarse o se encuentran iniciando una complicación. Por ejemplo, signos como orina oscura, oliguria, anuria, palidez y deshidratación se asocian con riesgo de daño renal57,60, y además con anemia aguda29,57 y colapso circulatorio12,42 que inciden en la función renal.
Lesión renal agudaLa forma de presentación más común de la LRA de origen isquémico asociada a malaria es oligúrica (<400mL/día) e hipercatabólica; la frecuencia de pacientes oligúricos varía de 63 a 87%24,61. La evolución a LRA luego de la aparición de fiebre varía entre 5 y 7 días8,9 con promedio de 10,5±4,0 días62. Las características clínicas más comunes en los pacientes con LRA son fiebre de grado variable, anemia, ictericia17,42,63,64, hepatomegalia, esplenomegalia9, tendencia al sangrado8 y cefalea65. Se ha informado de la utilidad de la hepatomegalia para identificar LRA (sensibilidad 76%, especificidad 54%) con buen valor predictivo negativo (96%) pero con bajo valor predictivo positivo (14%)8. La disfunción hepática y el alto índice de secuestro de GRP en el hígado se han encontrado asociados a LRA30,66 por lo que en el paciente con alteración hepática debe estudiarse la función renal.
Las modificaciones en los parámetros de laboratorio en pacientes con malaria y con disfunción renal incluyen trombocitopenia (<150.000/mL), anemia (hemoglobina 8g/dL ± 2,7) y bilirrubinemia (10,43mg/dL ± 7,75)42. La C y el BUN presentan grandes cambios; Naqvi et al.8 encontraron aumento de C (9,4mg/dL ± 5,39) y BUN (353,52 ± 12,31]; Mehta et al. informan de valores de C similares (10,2mg/dL ± 5,8), pero con menor alteración del BUN (100mg/dL ± 32,48)8.
La LRA en el paciente con malaria puede acompañarse de cambios en la coloración en la orina67,68. El citoquímico de orina es útil para establecer cambios que se presentan con el daño renal; algunos de ellos pueden utilizarse como indicadores tempranos de daño26,67 pues se ha encontrado asociación entre hemoglobinuria26, mioglobinuria8,42 y hematuria9,69,70 con disfunción renal.
Diferentes factores indican mal pronóstico, mortalidad y necesidad de diálisis en el paciente con LRA asociada a malaria: disfunción cerebral7,9,13,61, hiperbilirrubinemia15,24,61, SDRA7, acidosis7,24, coagulación intravascular diseminada42,61,71, hemoglobinuria7, bajos niveles de hemoglobina61, duración prolongada de la enfermedad9,18,42, oliguria o anuria a la admisión14,61, demora en la remisión a un nivel hospitalario mayor9,18,24 y retardo en la instauración del tratamiento27. En niños se ha asociado la hemoglobinuria con LRA, por lo que se recomienda que en su presencia se sospeche de esta complicación en la malaria72.
Se ha determinado que algunas complicaciones como malaria cerebral, ictericia e hipoglucemia ocurren más frecuentemente en los pacientes con falla renal66. La trombocitopenia se ha reportado con más frecuencia en los pacientes con hiperparasitemia y LRA73.
AcidosisLa disminución del pH sanguíneo debida al aumento en lactato sérico induce cambios del patrón respiratorio con taquipnea y polipnea para compensar la acidosis15,16. Si la capacidad compensatoria es superada, el paciente usa músculos accesorios de la respiración, acompañado de disnea, taquipnea y polipnea, cuadro clínico conocido como SDRA11 directamente relacionado con aumento en la incidencia de complicación y mortalidad de los pacientes con malaria16. La acidosis metabólica altera el metabolismo en el SNC16,74, pudiendo causar cefalea y alteración en el nivel de consciencia con signos como letargia, estupor o coma16,75.
La hipovolemia puede causar acidosis16,27, por esta razón manifestaciones como taquicardia, retardo en el llenado capilar (>3 s) e hipotensión, acompañadas de signos respiratorios indican acidosis metabólica.
Síndrome nefróticoEsta alteración predomina en niños menores de 5 años; su presentación clínica es variable, teniendo como signos principales el edema generalizado y la proteinuria17. La hipertensión y microhematuria son hallazgos poco frecuentes en los pacientes con SN, sin embargo, estuvieron presentes en el 43% de 80 pacientes de un estudio realizado en Uganda76. La descripción clínica hecha por Hendrickse y Adeniyi76 incluye la fiebre en casi todos los pacientes que consultaron luego de 2-4 semanas de evolución de edema generalizado, ascitis o derrame, con disminución de los picos febriles con la progresión clínica; otros hallazgos incluyeron hepatoesplenomegalia en 50% y aumento de uno de los 2 órganos en 25%; en algunos pacientes se presentó anemia. También se ha asociado SN con una enfermedad renal insidiosa que evoluciona durante 3-5 años, incluso después de curada la infección, que termina en falla renal crónica12,17,38, sin embargo este tipo de enfermedad solo ha sido reportada en África.
Los factores asociados con mal pronóstico en los pacientes con SN asociado a malaria son la resistencia a los esteroides12, expansión de la lesión renal focal, que lleva a glomérulo-esclerosis focal y segmentaria38,76,77 y resistencia a otros inmunosupresores (ciclofosfamida y azatioprina)78.
TratamientoLa terapia inicial busca estabilizar el paciente, tratar la deshidratación y la hipotensión con líquidos isotónicos y la eliminación de la parasitemia79. En Colombia la terapia de elección para la malaria complicada es el artesunato por vía intravenosa. La dosis recomendada por la OMS es 2,4mg/kg, disuelto en dextrosa en agua destilada (DAD) 5% intravenoso (IV) o intramuscular (IM), con la misma dosis a las 12 y 24 h y seguir con una dosis diaria hasta que se pueda pasar a vía oral, cuando se continúa con un esquema completo de terapia combinada con derivados de artemisinina78. La superioridad de este esquema para reducir la mortalidad ha sido evidenciada en ensayos clínicos multicéntricos, abiertos y aleatorizados80,81 y recientemente confirmados en un metaanálisis con 7.429 pacientes con malaria grave82. La quinina es la segunda línea; debe suministrarse por vía intravenosa, a una dosis inicial de quinina clorhidrato, 20mg/kg, disuelta en 300–500mL DAD 5-10% (10 ml por kg, hasta máximo 500 mL) luego continuar con 10mg/kg cada 8 h en igual perfusión; pasar a quinina sulfato vía oral 10mg/kg cada 8 h una vez se supere la urgencia hasta completar 7 días. Debe tenerse la precaución de disminuir la dosis a la tercera parte si el paciente persiste con lesión renal después de 48 h de iniciado el tratamiento o presenta falla hepática al momento de iniciar la terapia, con una dosis de mantenimiento de 3,3-5mg/kg cada 8 h. En todo caso se recomienda consultar los esquemas terapéuticos indicados en las guías de atención de cada país. Si, a pesar del tratamiento adecuado, el paciente persiste oligúrico y acidótico, el BUN continúa incrementando y presenta cambios electrocardiográficos compatibles con hipercalemia se debe considerar la terapia de reemplazo renal7,9,24,79.
El tratamiento de la acidosis metabólica es controvertido3, se ha usado bicarbonato de sodio con poca utilidad porque no soluciona la causa de la acidosis y no mejora el pronóstico clínico79.
El uso de corticoesteroides en el SN causado por malaria no mejora la respuesta clínica de los pacientes, por el contrario se ha visto que puede empeorar el curso de otras complicaciones como la malaria cerebral. Los estudios iniciales en niños con infección por P. malariae muestran que, excepto en algunos casos de estadios tempranos del SN, la prednisona es inefectiva para inducir remisión de los síntomas en la mayoría de pacientes y su uso se asoció con infección grave, hipertensión inducida por esteroides y muerte súbita83. Una revisión reciente indica que en adultos se ha reportado desde pobre efectividad hasta cerca del 50% de adecuada respuesta con este medicamento12. Estudios realizados en África, específicamente en Nigeria, Anochie y Eke, demostraron una baja respuesta a prednisona con mejoría únicamente en 2/45 pacientes84. A pesar de lo anterior, los esteroides juegan un papel importante en el manejo del SN sin malaria, de hecho en niños con SN sensible a esteroides son piedra angular del manejo, causando una disminución en la recaída del SN85.
ConclusionesLa LRA es una de las complicaciones más comunes en los adultos con malaria; en los últimos años ha venido aumentando su incidencia. Además, la presencia concomitante con estados como malaria cerebral, dificultad respiratoria, coagulación intravascular, entre otras, aumenta la probabilidad de muerte y la necesidad de terapia intensiva como la diálisis. El diagnóstico temprano, tratamiento oportuno y adecuado, y la remisión a un nivel de atención mayor cuando sea necesario son medidas que modificarían de forma positiva el pronóstico. El uso de criterios diagnósticos de laboratorio con puntos de corte muy elevados como los propuestos por la OMS dificulta el reconocimiento temprano del paciente en riesgo, permitiendo la progresión a disfunción renal avanzada.
La acidosis en malaria es una manifestación frecuente cuya importancia debe reconocerse por su papel como factor pronóstico de mortalidad. Los mecanismos fisiopatológicos propios de la enfermedad guardan estrecha relación con alteraciones del riñón que impiden mantener la homeostasis ácido-base, con desequilibrio entre la producción y depuración de ácido, llevando a acidosis de origen metabólico.
Existen diferentes teorías que intentan explicar la patogénesis del SN en malaria, algunas de ellas contradictorias, lo que hace necesaria mayor investigación sobre esta nefropatía cuyo conocimiento actual es confuso.
Estudiar la infección malárica desde la fisiopatología permitirá comprender mejor los mecanismos patogénicos del parásito y la forma como el hospedero responde a estos, con el fin de reconocer a tiempo la presencia de daño, tratar de prevenirlo y suministrar terapias adecuadas.
FinanciaciónEl manuscrito se realizó con recursos de la Universidad de Antioquia (recursos de sostenibilidad 2014-2015). Edgar Martínez participó como joven investigador en el Grupo Malaria, quien recibió aportes de vicerrectoría de investigación de la Universidad de Antioquia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.