Como parte de la Guía de atención integral para la prevención, detección temprana y tratamiento de las complicaciones del embarazo, desarrollada y financiada por el Departamento de Ciencia, Tecnología e Innovación, Colciencias, y el Ministerio de Salud y Protección Social de Colombia, se seleccionó a la infección por Toxoplasma para el desarrollo de recomendaciones para su prevención, diagnóstico y tratamiento. La infección por Toxoplasma gondii (T. gondii) durante el embarazo puede resultar en graves complicaciones para el feto y dejar importantes secuelas al recién nacido. Se realizó una guía basada en la mejor evidencia disponible en la literatura científica, con especial pertinencia a la información colombiana. Un consenso de expertos en parasitología, ginecología, neonatología e infectología, tanto de adultos como pediátrica, desarrolló las recomendaciones. Se propone que las recomendaciones de esta guía de atención integral sean utilizadas por los profesionales de salud de los programas de atención del embarazo del país con el fin de disminuir la morbilidad y mortalidad atribuible a esta enfermedad. Se formulan recomendaciones específicas para el diagnóstico desde el primer trimestre, consejos de prevención en las mujeres no infectadas, identificación de la infección del feto o del recién nacido y recomendaciones de tratamiento en estos escenarios.
Toxoplasma infection was selected for the development of recommendations for its prevention, diagnosis and therapy as a part of the clinical practice guideline for the prevention, early detection and treatment of the complications of pregnancy, developed y sponsored by the Department of Science, Technology and Innovation, Colciencias and Health and Social Protection Ministry of Health in Colombia. Infection by Toxoplasma gondii that occurs during pregnancy may end up in serious complications for the fetus and important sequelae for the newborn. A clinical guideline based on the best available scientific evidence, with emphasis on Colombian references, was performed. Experts on parasitology, neonatology and infectious diseases (adult and pediatric) developed the recommendations. Recommendations are proposed to be followed by healthcare professionals in pregnancy care programs all around the country, with the aim of lowering the morbidity and mortality related to this disease. Specific recommendations for the diagnosis starting in first trimester of the pregnancy, recommendations for prevention in women not infected with the parasite, identification of infection in the fetus or the newborn and recommendations for treatment in those settings are done. © 2012 ACIN. Published by Elsevier España, S.L. All rights reserved.
En Colombia, el Ministerio de Salud y Protección Social y Colciencias, en asocio con grupos expertos, adelanta desde 2010 el desarrollo de guías de práctica clínica basadas en la evidencia, enfocadas en temas prioritarios para la salud de la población colombiana. Una de las guías de atención integral (GAI) basada en la evidencia que fue desarrollada durante 2011 fue la Guía de atención integral para la prevención, detección temprana y tratamiento de las complicaciones del embarazo, parto y puerperio. En esta guía, se incluyó una sección dedicada a recomendaciones para el manejo de las infecciones en el embarazo, en especial, la infección debida a la toxoplasmosis.
La toxoplasmosis puede llevar a serias consecuencias en el desarrollo neurológico y en la salud visual del niño, y es (en la mayoría de casos) el resultado de una infección primaria en una mujer embarazada inmunocompetente1. Varios programas en el ámbito mundial están enfocados a su detección durante el embarazo2–4. Durante más de una década, existió debate sobre la eficacia del tratamiento prenatal; sin embargo, publicaciones recientes que incluyen una revisión sistemática comparando cohortes de Europa, Norteamérica y de Suramérica5, así como otros estudios observacionales6, indican que existe beneficio del tratamiento prenatal sobre las formas graves en el niño. De otra parte, se ha encontrado que la situación en Suramérica es de mayor gravedad que en Europa y Norteamérica, no solo por una mayor frecuencia, sino porque se presentan formas clínicas más severas y con mayor mortalidad5,7, debido a una mayor virulencia de las cepas circulantes en esta zona geográfica8–11. En Colombia, más de la mitad de las mujeres embarazadas (50–60%) poseen anticuerpos anti-Toxoplasma, lo cual indica una alta exposición y circulación del parásito en el país12,13. Es de esperar que entre el 0,6 a 3% de las gestantes adquieran la infección durante el embarazo1. Este riesgo es mayor en adolescentes, quienes tienen un riesgo de seroconversión de 1,5%, y es menor para las gestantes de 35 o más años, quienes tienen un riesgo de seroconversión de 0,7%1. Existe información acerca de diferencias en la frecuencia de la infección congénita en Colombia. Por ejemplo, Florencia (Caquetá) y Armenia (Quindío) tuvieron los porcentajes más altos (3 y 6/1.000 nacidos vivos, respectivamente). Bogotá, Barran-quilla y Bucaramanga tuvieron porcentajes intermedios (1, 2 y 1 /1.000 nacidos vivos, respectivamente); mientras que Cúcuta y Riohacha tuvieron los porcentajes más bajos (0,5 y 0,7/1.000 nacidos vivos respectivamente). Por primera vez, en un estudio epidemiológico sobre toxoplasmosis congénita, se logró descubrir una relación entre alta o baja frecuencia de marcadores de riesgo para toxoplasmosis congénita con alta o baja precipitación de lluvias por ciudad14.
Las recomendaciones contenidas en esta sección de la GAI de embarazo, parto y puerperio están dirigidas al personal clínico asistencial que brinda cuidados a mujeres en la prevención, detección temprana y atención de la toxoplasmosis en el embarazo, parto o puerperio, en los diferentes niveles de atención en salud (médicos familiares, médicos generales, médicos rurales, médicos especialistas en obstetricia y ginecología, medicina interna, infectología, pediatría, neonatolo-gía, profesionales de enfermería y otros profesionales de la salud). También se dirige, indirectamente, a quienes toman decisiones administrativas, tanto en el medio hospitalario como en las aseguradoras, pagadores del gasto en la salud y en la generación de políticas de salud. Se incluyó información relacionada con 9 preguntas clínicas relacionadas con el manejo de esta infección durante la gestación:
- 1)
¿Cuáles son los factores de riesgo para la transmisión de la toxoplasmosis durante el embarazo?
- 2)
¿Cuáles son las recomendaciones para la prevención primaria de la infección por Toxoplasma durante el embarazo?
- 3)
¿Cuál es el seguimiento recomendado de una mujer embarazada seronegativa?, ¿cómo debe monitorizarse?
- 4)
¿Cuáles son las pruebas de detección de anticuerpos contra Toxoplasma que se deben solicitar en primer lugar?
- 5)
¿Cuáles son las pruebas confirmatorias recomendadas para toxoplasmosis?
- 6)
¿Se recomienda el uso de la ecografía para determinar la severidad del compromiso del feto con pruebas positivas ara infección por Toxoplasma?
- 7)
¿Cuál es el esquema de prevención secundaria (prevención de la transmisión fetal) recomendado en mujeres con diagnóstico de infección adquirida durante el embarazo?
- 8)
¿Cuáles son las pruebas recomendadas para establecer el diagnóstico de infección congénita en el recién nacido?
- 9)
¿Cuál es el medicamento recomendado para los recién nacidos con diagnóstico de infección congénita?
En la construcción de esta guía de práctica clínica, el Grupo Desarrollador de Guías (GDG) de la GAI de preven-ción, detección temprana y tratamiento de las complicaciones del embarazo, parto o puerperio siguió los linea-mientos presentados por la Guía metodológica para la elaboración de GAI en el Sistema General de Seguridad Social en Salud colombiano realizado por el Ministerio de Salud y Protección Social junto con Colciencias, el Centro de Estudios e Investigación en Salud de la Fundación Santa Fe de Bogotá y la Escuela de Salud Pública de la Universidad de Harvard15. La información generada en las diferentes etapas del proceso fue publicada para el conocimiento de los diferentes interesados en las páginas web del Ministerio de Salud y Protección Social, así como en la página web del GDG (http://guiascolcienciasminproteccionsocialalianzacinets.org/; http://www.minproteccionsocial.gov.co/salud/Paginas/Gu%C3%ADasdeAtenci%C3%B3n.aspx), para el conocimiento de los diferentes actores interesados en la elaboración de la guía.
Mayor información sobre el contenido completo de la GAI, el GDG y los pasos en el desarrollo de las guías (incluyendo la búsqueda sistemática de información científica) serán objeto de publicación por el Ministerio de Salud y Protección Social y Colciencias.
Preguntas y recomendaciones clínicas incluidas en la sección¿Cuáles son los factores de riesgo para la transmisión de la toxoplasmosis durante el embarazo?La toxoplasmosis es una enfermedad altamente prevenible y los estudios sobre factores de riesgo de la infección durante el embarazo han logrado identificar variables asociadas a su adquisición. Sin embargo, la epidemiología de la toxoplasmosis varía de un país a otro. El conocimiento de factores de riesgo permitirá sugerir recomendaciones para la prevención y para los programas de educación.
Resumen y descripción del cuerpo de la evidenciaFactores de riesgo sociodemográficosEdad: existe evidencia de que la prevalencia de la toxoplasmosis se incrementa con la edad. En Colombia, el Estudio Nacional de Salud de 1980 encontró que la prevalencia aumentó desde un 32% en < 10 años a 65% en personas de 60 años o más13. Un estudio en Taiwán encontró una diferencia significativa en anticuerpos contra T. gondii entre los adultos (28,3%) y niños (18,7%), con mayor frecuencia de seropositividad (38,1%) en el grupo de edad de 50–59 años, y la menor frecuencia (7,7%) en el grupo de edad de 1–9 años16. El aumento de la seroprevalencia con la edad es un resultado previsible debido a la duración cada vez mayor de exposición a T. gondii.
Género: no se ha encontrado evidencia acerca de diferencias significativas en la prevalencia de anticuerpos contra T. gondii entre hombres y mujeres. Sin embargo, el aumento del riesgo de seropositividad en los hombres encontrado en un estudio de prevalencia con 134 personas es explicado por los autores por una menor atención en el momento de la limpieza y preparación de los alimentos17.
Raza: existe evidencia de estudios europeos que encuentran diferencias en la prevalencia de T. gondii entre poblaciones nativas e inmigrantes; sin embargo, esta diferencia puede explicarse por factores geográficos y epidemiológicos de adquisición de la infección más que por factores étnicos o genéticos del hospedero18. En un estudio desarrollado en Noruega, las mujeres extranjeras tuvieron una incidencia mayor de toxoplasmosis que las mujeres nativas (0,60 y 22,6%, respectivamente). Por el contrario, en Francia, dicha prevalencia fue mayor entre las mujeres nativas de Francia en comparación con las mujeres inmigrantes18.
Área de residencia: la incidencia de la toxoplasmosis difiere aún dentro de un mismo país. La precipitación media anual es un factor que recientemente se ha asociado con estas diferencias. En el Estudio Nacional de Salud en Colombia de 1988, se encontró la prevalencia más alta en la región de la costa atlántica (63%), mientras que la más baja perteneció a la región central (36%)13. Esta misma heterogeneidad fue identificada en el primer estudio multicéntrico colombiano de toxoplasmosis neonatal19, el cual encontró 3 diferentes niveles de prevalencia en el país: ciudades con baja prevalencia (Riohacha y Cúcuta), intermedia (Bogotá, Barranquilla y Bucaramanga) y alta prevalencia (Armenia y Florencia). Las diferencias en prevalencia se asociaron con promedio de precipitación (intensidad de lluvias), pero no con temperatura ni con altura sobre el nivel del mar. Este factor no es sorprendente, dado que se conoce desde hace tiempo que el ooquiste se conserva durante largos períodos en condiciones de humedad19. Por otra parte, las gestantes residentes en Oslo tuvieron una incidencia de infección por T. gondii 5 veces mayor que las gestantes que vivían fuera de Oslo, hecho que se atribuyó a la mayor proporción de mujeres extranjeras viviendo en la ciudad. Las tasas de prevalencia más elevadas (13,4%) se detectaron en los condados, donde hay un clima templado y predomina la costa, y la prevalencia más baja (6,7%) se encontró en los condados donde existía un clima seco con inviernos fríos y veranos calientes20. De igual manera, un estudio en Chile encontró un aumento progresivo de la seroprevalencia de la toxoplasmosis a mayor altura con respecto a las regiones de menor altitud del país; este fenómeno probablemente esté relacionado con las condiciones geográficas y el tipo de carne que se consume21.
Factores de riesgo biológicosEmbarazo: en el Estudio Nacional de Salud en Colombia de 1980, hubo una mayor seroprevalencia de T. gondii en la submuestra de gestantes en comparación con el resto de la población13. La inmunidad celular juega un papel principal en la resistencia del huésped a la infección por T. gondii; un perfil de citocinas Th1 es necesario para la protección y el control de la infección. La producción de progesterona durante el embarazo y el aumento de expresión en la molécula HLAG, que inhibe la inducción de células natural killer, son factores importantes para evitar el rechazo del feto por la madre, y conducen a una reducción de las funciones inmunes celulares; por lo tanto, en mujeres embarazadas, existe evidencia de factores inmunofisiológicos que contribuirían a aumentar la susceptibilidad de infección por T. gondii u otros organismos intracelulares22.
Número de nacimientos: existe evidencia de que las mujeres con hijos tienen una mayor prevalencia de infección por T. gondii, incrementándose proporcionalmente con el aumento del número de gestaciones. En un estudio de factores de riesgo en Brasil, el antecedente de tener hijos obtuvo un odds ratio (OR) de 14 (intervalo de confianza [IC] 95% 2,8–68) después de controlar por la edad23. En otro estudio en Suecia, hubo un aumento del riesgo de positivos de T. gondii a medida que aumentaba la paridad. Esto puede explicarse por el mismo factor de reducción en la respuesta inmune derivado del aumento de expresión de la molécula HLAG durante el embarazo24.
Predisposición genética: existe evidencia de una asociación entre el antígeno leucocitario humano (HLA) y la susceptibilidad a la infección por T. gondii. Entre los caucásicos, la frecuencia de los alelos del gen DQ3 HLADQ fue significativamente mayor en los lactantes infectados por Toxoplasma con hidrocefalia (78%) que en los bebés infectados sin hidrocefalia (48%) o en los controles normales. Aunque no hay asociación significativa entre los antígenos HLA, se observó la ausencia total del antígeno HLA-B51 en las madres de los pacientes con toxoplasmosis ocular. La tipificación HLA que se llevó a cabo en estos pacientes reveló un aumento en la frecuencia del antígeno HLA-Bw62 en pacientes con afectación ocular severa, lo que indica una posible relación entre la gravedad de la toxoplasmosis ocular y un factor inmuno-genético. Recientemente, se han identificado polimorfismos para el gen que codifica para una proteína transportadora de adenosin trifosfato (ATP), la ABCA4 subfamilia A, y mayor probabilidad de enfermedad ocular y cerebral, igualmente polimorfismos en el gen COL2A1, que codifica para colágeno tipo II (predominante, en tejido ocular), se asocian con una mayor probabilidad de compromiso ocular en niños con infección congénita por Toxoplasma25.
Inmunodeficiencia: existe evidencia de la relación entre la severidad de la infección por T. gondii y el estado inmu-nológico de la persona infectada. Mientras que la toxoplasmosis en los adolescentes o adultos inmunocompetentes es generalmente asintomática, en los individuos inmunocom-prometidos causa una importante morbilidad y mortalidad. La inmunosupresión causada por el síndrome de inmunodeficiencia adquirida, terapias para enfermedades malignas, trasplantes o trastornos linfoproliferativos puede resultar en la reactivación de una infección toxoplásmica preexistente latente, llevando a manifestaciones con un amplio espectro clínico, en especial en el sistema nervioso central (SNC), donde produce lesiones intracerebrales. La toxoplasmosis es una infección oportunista común en los pacientes con virus de la inmunodeficiencia humana (VIH) avanzado; las mujeres embarazadas seropositivas para VIH tenían mayores tasas de títulos positivos de T. gondii (21,1%) comparado con las mujeres VIH seronegativos (13,1%). La infección por T. gondii puede causar complicaciones graves en mujeres embarazadas infectadas con VIH, dando lugar a defectos congénitos, aborto espontáneo, muerte fetal, retraso mental, ceguera, epilepsia, etc.26.
Factores de riesgo ligados al estilo de vida
Exposición a gatos: el riesgo de contraer toxoplasmosis asociado al contacto con gatos es variable de una región a otra. La transmisión de ooquistes excretados por el gato al humano depende de la edad, el estado nutricio-nal y el nivel de riesgo de contraer la infección por el gato mismo27. Entre los gatos, la seroprevalencia es alta, variando entre 21 y 87% en América Latina28,29.
En Colombia, un estudio en 170 gatos de Bogotá y Armenia (Quindío) encontró una prevalencia de infección del 45%; sin embargo, hubo grandes diferencias en la seroprevalencia entre los 137 gatos en Bogotá (35%) con respecto a los 33 gatos estudiados de Armenia (84%). De 15 animales en quienes se aisló Toxoplasma, 3 se clasificaron como de tipo I, 1 de tipo II y 11, una combinación de tipo I y tipo III10. Asimismo, un estudio seroepidemiológico en Bangladesh encontró una diferencia significativa en la prevalencia de anticuerpos contra T. gondii entre los que tenían o no gato en la casa (24 vs. 11%, respectivamente, p = 0,01)30. Un estudio en Illinois, EE. UU., también reportó una asociación entre las infecciones de gatos con T. gondii y un mayor riesgo de infecciones en humanos por el contacto del suelo como un mecanismo probable de transmisión17. Por el contrario, el estudio multicéntrico europeo de factores de riesgo no encontró asociación fuerte entre tener gato e infección por T. gondii31. De hecho, la asociación entre los gatos y la toxoplasmosis humana es difícil de evaluar por estudios epidemiológicos porque es el suelo y no los gatos el principal reservorio. Aunque la actividad de jardinería no se asoció a la sero-positividad, se encontró una seroprevalencia más baja no significativa en jardineros que siempre llevaban guantes con respecto a los que no los usaban.
Recientemente, se ha desarrollado una prueba seroló-gica que identifica anticuerpos por exposición a ooquistes, lo que permitiría ayudar a identificar si la infección se adquirió por contacto con gatos u ooquistes en el agua, y si esta resulta negativa para estas proteínas del ooquiste, se podría considerar que la fuente de infección fue el consumo de carne poco cocida32.
Alimentos contaminados : la ingestión de quistes contenidos en carne infectada es una fuente importante de infección por T. gondii en humanos. En Colombia, se ha encontrado que el riesgo para infección por Toxoplasma al consumir carne cruda o a medio cocer tiene un riesgo 13,2 veces mayor33. En un estudio multicéntrico europeo, se reportó que consumir carne a medio cocer explica entre el 30 y el 63% de las infecciones en diferentes partes del continente europeo31. T. gondii se ha detectado incluso en 1 de cada 67 muestras de carne curada listas para el consumo en el Reino Unido, sugiriendo que los métodos de curación no matan todos los quistes de los tejidos.
La prevalencia de quistes en los tejidos de la carne de diferentes animales varía considerablemente; la más alta se ha reportado en el ganado ovino (23,9%) y porcino (12–15%), y la más baja en el ganado bovino (0–10%) y gallinas (0,3–8%). La carne de cerdo ha sido identificada como la más comúnmente asociada con toxoplasmosis transmitidas por alimentos. En un estudio realizado en 1994 en 47 granjas de cerdos en Illinois, EE. UU., el 17% estaban contaminadas con ooquistes de Toxoplasma. También fueron detectados anticuerpos contra T. gondii en el suero de 6,9% de los caballos sacrificados para la alimentación en Norteamérica. Además, se encontró una diferencia significativa en la seroprevalencia de T. gondii entre los consumidores de carne mal cocida y cocinada adecuadamente (19,5 y 9,6%, respectivamente).
En Colombia, en un estudio en 180 muestras de carne para consumo humano obtenidas en los 3 departamentos del eje cafetero, el 52,7% fueron positivas para T. gondii.
La carne de cerdo fue la más contaminada (70%), con mayor prevalencia en Manizales (80%), seguida por la carne de res en Armenia con 80%, y, por último, la carne de pollo en Pereira presentó la prevalencia más alta (70%) con respecto al pollo de las otras ciudades. No hubo muestras positivas en pollos en Manizales34.
Beber agua no tratada: en el embarazo, el consumo de agua de la llave o agua sin filtrar aumenta el riesgo de infección, comparado con el consumo de agua de botella o filtrada. El primer brote de toxoplasmosis que afectó al mayor número de personas en el mundo se reportó en 1955 y se asoció con el suministro de agua municipal de un reservorio particular en la ciudad de Victoria, en la provincia de Columbia Británica, en Canadá32. De los 94 individuos relacionados con el brote de casos agudos que vivían en el distrito capital de la región, 83 (88%) vivían en el área servida por un sistema de distribución de agua. La tasa de incidencia de la infección aguda entre las personas que residían en el área servida por el embalse implicado fue 3 veces el de las zonas atendidas por otras fuentes (riesgo relativo 3,53; IC 95% 1,88–6,63), y la infección aguda por T. gondii en 3.812 mujeres embarazadas se asoció con el consumo de agua municipal y sin hervir32. Ingerir bebidas hechas con agua sin hervir fue un factor de riesgo importante para la infección por T. gondii en mujeres embarazadas en Armenia, Colombia33. Por lo tanto, el consumo de agua de la llave sin hervir es un factor de riesgo para la infección por Toxoplasma, y el consumo de agua de botella o filtrada reduce el riesgo33. Como en el caso de Giardia o Cryptosporidium, la cloración no es suficiente para eliminar el Toxoplasma en aguas tratadas, y se requiere la filtración para reducir la transmisión. Un estudio hecho en Francia encontró que 1 de cada 6 muestras de agua de llave contenía ácido desoxirribonucleico de Toxoplasma, y se propuso la detección de ácido ribonucleico mensajero en agua del parásito utilizando reacción en cadena de la polimerasa (PCR, en inglés polymerase chain reaction) con transcrip-tasa inversa con el fin de vigilar o monitorear las fuentes de agua potable y poder prevenir a la población sobre la contaminación con este parásito35.
¿Cuáles son las recomendaciones para la prevención primaria de la infección por Toxoplasma durante el embarazo?Las estrategias de prevención primaria como la educación en salud surgen como elementos de alta importancia para evitar la infección por Toxoplasma; su éxito depende de la modificación de hábitos y de estilos de vida que están impregnados con fuertes componentes culturales.
Resumen y descripción del cuerpo de la evidenciaUn estudio de cohorte que incluyó a 27.827 gestantes mostró la experiencia en una clínica de obstetricia durante los años 1979–2001 para la prevención de la infección por Toxoplasma36. En la fase 1 (1979–1982), no se llevaron a cabo asesoramientos específicos, mientras que en la fase 2 (1983–1990), las mujeres recibieron una lista de instrucciones por escrito acerca de la prevención primaria más una explicación completa por el médico tratante. En la tercera fase (1991–2001), las mujeres recibieron un folleto con una explicación más profunda de la toxoplasmosis congénita y una reiteración oral de recomendaciones a mediados de la gestación en clases prenatales. Se encontró una disminución sostenida de las tasas de seroconversión en los 3 períodos, desde 1,43, 0,53 hasta 0,09%. Se calculó una reducción del 63% en la incidencia de seroconversión entre la fase 1 y 2, y del 92% entre la primera y la tercera fase. (Nivel de evidencia 2-)
Un estudio que incluyó varios cortes transversales sucesivos incluyó a 8.267 pacientes que asistían a 4 salas de obstetricia en Polonia37. Durante el intervalo 1991–1997, los investigadores, a través de cuestionarios administrados por entrevistadores entrenados, midieron el conocimiento y el estado serológico de 4.311 mujeres, entre 1991–1992. Luego, se evaluó el conocimiento durante el embarazo y después del parto en 1.246 mujeres entre 1995–1996, así como el estado serológico, el conocimiento y el comportamiento en 2.710 mujeres en 1997. La prevalencia de anticuerpos de Toxoplasma se redujo durante el período 1991–1992 a 1997, pasando de 58,9 a 44,0%. El conocimiento considerado como “bueno” aumentó desde 24,3 a 45,3%. Entre las mujeres analizadas después del parto, el conocimiento sobre medidas de prevención pasó del 45,5 al 80,3%. Sin embargo, la falta de conocimiento no predijo un comportamiento “poco saludable”, y cerca de la mitad de las mujeres que consideraron que tenían un conocimiento insuficiente practicaron conductas correctas. En cuanto a la evaluación de los medios de intervención y su uso, entre las 2.710 mujeres encuestadas en 1997, el 60% habían oído hablar de la toxoplasmosis a través de la televisión o las revistas para mujeres, en comparación con menos del 40% a través de la radio, los diarios y los proveedores de servicios de salud. (Nivel de evidencia 3)
Se realizó un estudio clínico controlado a 432 mujeres embarazadas de una agencia de salud urbana y rural en Ontario, Canadá38. Dentro de algunas clases de educación prenatal se les brindó, de forma aleatoria, un módulo de 10 minutos basado en el conocimiento de la toxoplasmosis, el efecto de la enfermedad en el feto y las estrategias de prevención. Las medidas preventivas se enfocaron en higiene de gatos, higiene alimentaria e higiene personal. En el grupo control, no se hizo mención a la toxoplasmosis de forma específica, a menos que se preguntara por la enfermedad. Se realizaron cuestionarios previos y posteriores a las clases con respecto a información demográfica, conocimiento y comportamientos específicos. La muestra fue determinada retrospectivamente entre las mujeres que llenaron ambos cuestionarios. De las 432 mujeres que respondieron el cuestionario previo, solo 285 (66%) respondieron el posterior a las clases. El tiempo de respuesta varió entre 5 semanas y 5 meses. Se desarrolló una escala que puntuaba a favor de los comportamientos preventivos. Al final del estudio, las mujeres en el grupo de intervención tuvieron una mejor puntuación que aquellas en el grupo control con respecto a la higiene del gato (p < 0,05). También se observó una mejoría en el comportamiento de cocinar más las carnes. La alta pérdida de pacientes y la ausencia de un desenlace basado en la infección por Toxoplasma limitan la utilidad de este estudio. (Nivel de evidencia 2+)
Un ECC no publicado incluyó a 5.023 gestantes pertenecientes a un grupo de clínicas de atención prenatal en 7 departamentos en el área de Lyon, Francia39. Se evaluaron los efectos de proporcionar un folleto de 20 páginas con 4 páginas dedicadas a la información sobre la toxoplasmosis, dirigido principalmente a los modos de transmisión y las medidas de prevención sumado a una grabación de audio que abarcaba las preguntas más frecuentes durante el embarazo, en especial, las relacionadas con la toxoplasmosis. Al inicio del estudio, no se encontraron diferencias significativas entre los 2 brazos del estudio con respecto a niveles de conocimiento o comportamiento ni diferencias significativas entre los 2 grupos en aspectos demográficos o sociales. En los 2 modelos de regresión ajustada, no se encontró asociación significativa entre la asignación a los grupos y los comportamientos en el seguimiento. El consumo de carne de res cocida “siempre” frente a “menor a siempre” se asoció marginalmente con el brazo del estudio (OR 1,21, p 0,08). El lavado de manos “siempre” después del contacto con el suelo, la carne cruda o vegetales sin lavar tampoco mostró asociación con la intervención (OR 1,01; IC 95% 0,8–1,2). Sin embargo, otras variables como el conocimiento de base de las conductas relativas a la toxoplasmosis (OR 1,2; IC 95% 1,0–1,4), el tabaquismo (OR 1,3; IC 95% 1,0–1,6) y el consumo de alcohol (OR 1,2; IC 95% 1,0–1,5) fueron asociadas con cambios de comportamiento. Solo el 0,43% de las gestantes presentaron seroconversión para toxoplasmosis: 13/2.591 (5/1.000) en el grupo experimental y 4/1.358 (3/1.000) en el grupo control (p = 0,35). (Nivel de evidencia 1 -)
Interpretación y discusión de la evidenciaLa evaluación de la evidencia en el tema de efectividad de la educación en el embarazo para la prevención de la toxoplasmosis presenta debilidades, dado los problemas metodológicos en los estudios encontrados. A pesar de que los estudios canadiense y francés fueron ensayos clínicos con aleatorización de las intervenciones y grupos control, existen limitaciones serias sobre las conclusiones debido a las pérdidas en el seguimiento y en el desenlace utilizado. El estudio de mayor calidad sobre estrategias de educación en Francia no encontró cambios significativos en los comportamientos de riesgo a pesar de entregar información detallada y continua39. Solo un estudio permite recomendar proporcionar información en folletos que incluyan medidas sencillas y precisas.
El GDG consideró que las recomendaciones de prevención de la toxoplasmosis deben incluir tópicos como la higiene personal (lavado de manos), la higiene en el procesamiento de alimentos (limpieza de las superficies, lavado apropiado de verduras), en la preparación de las carnes y su adecuada cocción, así como el uso de agua filtrada o hervida, acorde con los factores de riesgo identificados para la infección por Toxoplasma. Debe subrayarse que la cloración es insuficiente para la eliminación de los ooquistes.
Recomendación clínica- B
Dentro del control prenatal, se aconseja realizar I recomendaciones a las pacientes respecto a: con-I sumo de carnes bien cocinadas, consumo de agua I potable y manejo higiénico de los alimentos, lavado I de manos posterior a actividades de jardinería, mani-I pulación de animales (gatos), para prevenir la infección por Toxoplasma
La mujer seronegativa para Toxoplasma es el objetivo primario de los programas de tamización durante el embarazo. Dichas gestantes son susceptibles a la infección, y son quienes deben tener un seguimiento serológico para detectar su adquisición. En Europa, existen programas que contemplan el seguimiento mensual (Francia), trimestral (Austria) o no seguimiento (Dinamarca), y es necesario establecer si estos programas son aplicables al contexto colombiano.
Resumen y descripción del cuerpo de la evidenciaUna revisión sistemática de estudios de cohortes de 1.438 madres y niños diagnosticados durante programas de tami-zaje prenatal y neonatal evaluó el efecto del tratamiento sobre la transmisión vertical y las manifestaciones clínicas de toxoplasmosis antes de la edad de 1 año5. Los análisis se ajustaron de acuerdo con la edad gestacional en el momento de la seroconversión materna y de otras variables como la latitud geográfica. Se encontró una reducción en la transmisión relacionada con el tiempo transcurrido entre la seroconversión y el inicio del tratamiento: Si el tratamiento se iniciaba en las 3 primeras semanas de seroconversión, el riesgo se estimaba en OR 0,48 (IC 95% 0,28 -0,80); riesgo que aumenta a 0,6 (IC 95% 0,4–1,0) si se iniciaba el tratamiento a la semana 4, o entre la semana 5 y 8 (OR 0,6, IC 95% 0,36–1,0). En cuanto al efecto sobre reducción de síntomas en el niño, en la publicación solo se presentaron los resultados del análisis en 550 recién nacidos vivos infectados europeos, sin incluir las cohortes americanas, y no se encontraron pruebas de que el tratamiento prenatal redujera el riesgo de manifestaciones clínicas (OR 1,11; IC 95% 0,61–2,02). La no inclusión de las cohortes americanas se fundamentó en que en Colombia y Brasil se utilizó la tomografía para el diagnóstico de lesiones cerebrales, mientras que en Europa se utilizó el ultrasonido. (Nivel de evidencia 2++)
El análisis de los resultados no publicados del Syste-matic Review on Congenital Toxoplasmosis incluyó a 691 niños, incluidas las cohortes americanas excluidas en el análisis previamente presentado40. Se encontró una disminución del riesgo de infección congénita relacionado con el tiempo en que se inicia el tratamiento: el riesgo estimado para la presentación de signos clínicos en el recién nacido con tratamiento prenatal fue de 0,4 (IC 95% 0,2–0,9) con espiramicina iniciada 4 semanas posterior a la seroconversión; también se estimó un riesgo de 0,6 (IC 95% 0,4–0,99) si se iniciaba luego de las 4 semanas de la seroconversión. (Nivel de evidencia 2++)
Un ECC que incluyó a 276 pacientes mostró que la mayoría de las pruebas de inmunoglobina M (IgM) por ELISA e ISAGA obtienen sensibilidades superiores al 98% para detectar seroconversiones por encima de cualquier otra prueba41. (Nivel de evidencia 1b)
Interpretación y discusión de la evidenciaEl análisis y la comparación directa de los resultados de los programas europeos de tamización no permiten concluir cuál es la mejor estrategia, dada la heterogeneidad geográfica en el riesgo de infección42. Los datos agrupados existentes en revisiones sistemáticas de cohortes observacionales de varios continentes muestran que el beneficio de tratamiento prenatal para reducir la transmisión solo se obtiene si se trata antes de la semana 4 de seroconversión; luego de este período de infección, existe incertidumbre sobre si hay beneficio con el tratamiento. Por esta razón, los seguimientos serológicos en seronegativas mayores a cuatro semanas de intervalos entre las pruebas no permitirían detectar casos con la suficiente anticipación para obtener un efecto significativo del tratamiento. Respecto a la prueba de elección para dicho seguimiento, la prueba ELISA o ISAGA para detección de IgM anti-Toxoplasma permite detectar la infección luego de 15 días de adquirida y se recomienda como la prueba de elección en este caso. Es necesario señalar que debe existir un control de calidad de las pruebas para garantizar la detección de la seroconversión.
Recomendación clínica- B
Se recomienda tamizar a mujeres seronegativas con I una periodicidad mensual con una prueba de IgM para Toxoplasma
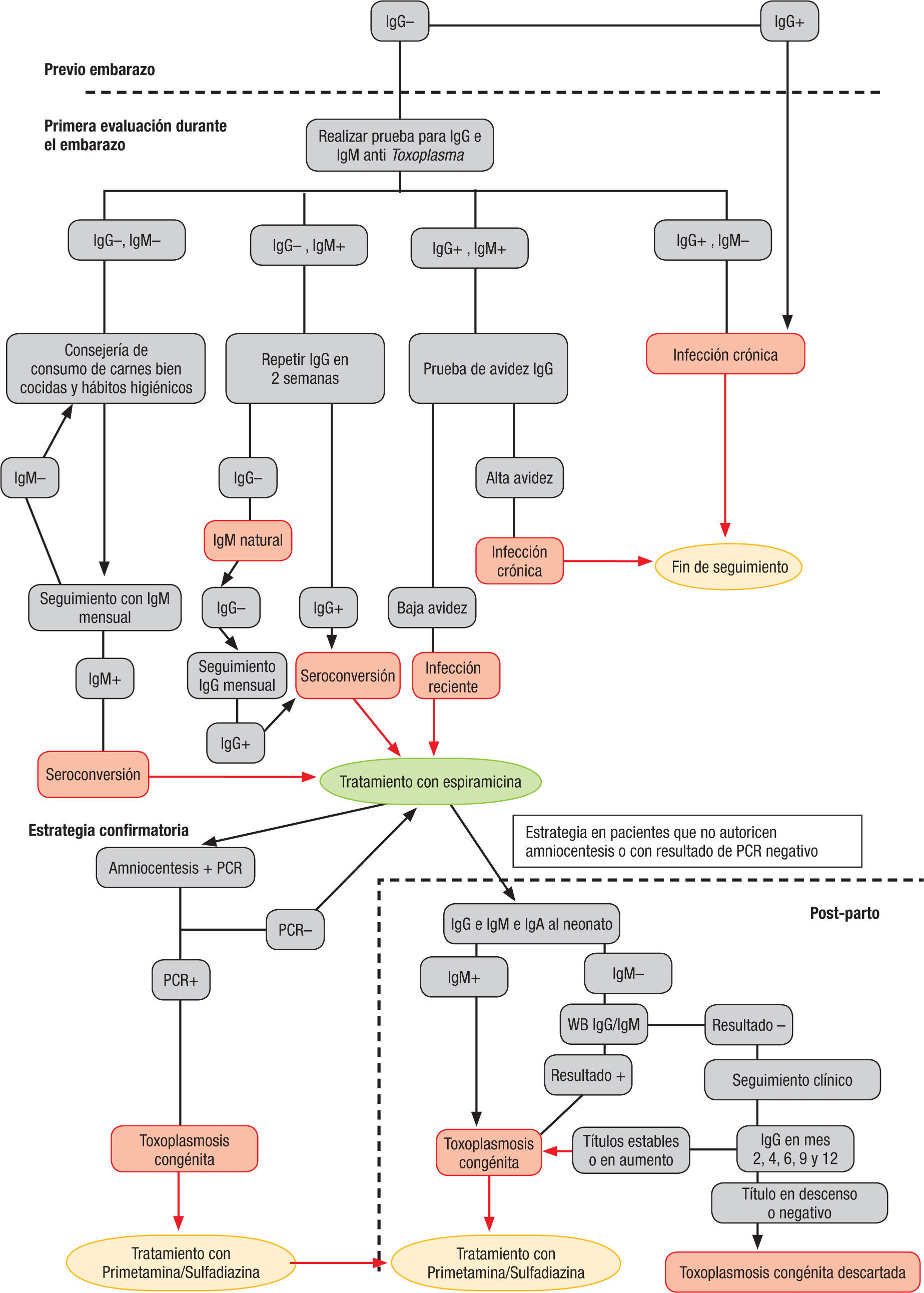
Existen numerosas pruebas para el diagnóstico de la toxoplasmosis en el embarazo; el objetivo que comparten es distinguir entre una infección adquirida durante la gestación o antes del embarazo. La detección de anticuerpos que son marcadores de infección reciente se puede llevar a cabo con pruebas basadas en principios de detección para IgM específica como inmunofluorescencia (IF), inmunoensayo, quimioluminiscencia, Western blot (WB) o inmunoaglutina-ción. A diferencia de lo que sucede en otras enfermedades, la IgM, aunque es marcadora de enfermedad aguda, puede permanecer positiva durante varios meses, dificultando la diferenciación entre infección aguda y antigua. También se pueden utilizar estrategias que permiten diferenciar una infección crónica de una aguda midiendo la avidez de la inmunoglobina G (IgG), la presencia de isotipos específicos de anticuerpos como IgM, inmunoglobulina A (IgA), inmu-noglobulina E (IgE) o la aglutinación diferencial (AC/HS). Entonces, se hace necesario realizar recomendaciones para la práctica que permitan seleccionar la estrategia más adecuada para la detección de infección adquirida durante el embarazo. (Fig. 1)
Una revisión sistemática de 11 estudios de pruebas diagnósticas encontró que la sensibilidad de los anticuerpos IgG en las mujeres embarazadas con antecedente de toxoplasmosis era extremadamente alta. De estos estudios, 6 que incluyeron 3.096 pacientes contenían información que permitían identificar correctamente el diagnóstico y las características de la población. La sensibilidad de las pruebas para la detección de IgG es superior al 95%, con una especificidad superior al 94%43.
Las IgG contra Toxoplasma suelen aparecer a partir de la cuarta semana después de la infección, y persisten toda la vida. Se observa que su utilidad para la identificación de una infección antigua puede ser mayor antes del embarazo o temprano en la gestación. Se considera que las mujeres IgG negativas son susceptibles a la infección aguda. (Nivel de evidencia Ia)
Precisión de las pruebas utilizadas para el diagnóstico de toxoplasmosis aguda en mujeres embarazadasEn un estudio multicéntrico41, se incluyeron 276 sueros de pacientes (mujeres embarazadas y no embarazadas) en los que se diagnosticó toxoplasmosis aguda de menos de 3 meses de diferencia, de 3 a 12 meses de diferencia y más de 12 meses de diferencia. Se evaluaron los resultados de diagnóstico en un solo suero con pruebas para IgM anti-Toxoplasma específica, IgA, IgG, y anticuerpos IgE y diferentes combinaciones de los ensayos de anticuerpos. La prueba de referencia era una seroconversión de IgG específica o la prueba colorante de Sabin-Feld-man. Se evaluaron 195 combinaciones (ensayos de IgM en la primera línea, IgM, IgA otra AC/HS o de la avidez de IgG en la segunda línea). Todos los ensayos de ELISA IgM e ISAGA, excepto uno, mostraron sensibilidades > 98%. La sensibilidad de la IgA fue menor, con una variación importante (50–90%). La IgE tenía una sensibilidad muy baja (54%). La especificidad de IgM e IgA para distinguir infección adquirida en el pasado fue > 92%, a excepción de 2 ensayos de ELISA de IgA. Se utilizaron pruebas de IgM e IgA para discriminar la infección aguda de la convalecencia con una especificidad del 40%. Ninguna combinación de ensayo de cualquier tipo fue capaz de discriminar las infecciones agudas de las que se produjeron 3–12 meses antes. Se alcanzaron excelentes resultados diagnósticos mediante el uso secuencial de los ensayos de IgM altamente sensibles combinados con métodos que examinaron la avidez IgG con especificidades alrededor del 96%, mientras se mantuvo la sensibilidad alrededor del 96%, teniendo en cuenta un período de infección reciente < 16 semanas. Ensayos de IgA o IgE eran menos adecuados que IgM para la infección aguda. (Nivel de evidencia Ib)
Interpretación y discusión de la evidenciaLos estudios incluidos coinciden en mostrar que la prueba de elección para el diagnóstico durante el embarazo es una combinación de pruebas (realizadas bajo el principio de ELISA, quimioluminiscencia o fluorometría o ISAGA) para IgM junto con pruebas IgG en una primera fase de diagnóstico. Unas pruebas IgG anti-Toxoplasma positiva e IgM anti-Toxoplasma negativa en el inicio de la gestación indican una infección crónica (previa o antigua) y descartan el riesgo de infección durante el embarazo para la mujer embarazada.
Una prueba IgG negativa con prueba IgM positiva requiere una nueva muestra para diferenciar entre seroconversión o IgM natural. Estas pacientes deben tener una segunda prueba con IgG. Una segunda prueba IgG positiva es evidencia de seroconversión reciente. Las pacientes con IgG negativa (y, por tanto, con IgM naturales) deben tener seguimiento mensual con IgG. No se debe repetir la prueba IgM por cuanto no se espera que este resultado cambie.
Una prueba IgG positiva con IgM positiva requiere de confirmación de fase aguda con pruebas de avidez para IgG anti-Toxoplasma. Esta combinación de pruebas se debe realizar antes de la semana 16, período en el cual el rendimiento de la combinación de pruebas es mayor. La prueba IgA ISAGA puede recomendarse para apoyar el diagnóstico cuando la gestante llega a realizar sus pruebas luego de la semana 16, y un resultado de avidez alta no permite descartar infecciones durante el inicio de la gestación. Una prueba de IgG contra Toxoplasma positiva antes del embarazo o en un embarazo anterior precluye la posibilidad de infección durante el embarazo en la materna.
Recomendación clínica- A
En los casos en que no se conozca el estatus de infec-I ción, se recomienda realizar pruebas de IgG e IgM a la I mujer embarazada en su primer control prenatal para I determinar la presencia de la infección por Toxoplasma
- A
Se recomienda que las mujeres con IgG e IgM positivas I se realicen prueba de avidez para confirmar la antigüe-I dad de la infección si el embarazo es menor a 16 semanas, e IgA si mayor a 16 semanas
- B
Se recomienda que las mujeres con IgG e IgM negativas I sean seguidas mensualmente en los términos estableci-I dos por esta guía
- √
Se recomienda que las mujeres con IgG negativa e IgM I positiva se realicen repetición de IgG en 2 semanas para I documentar seroconversión aguda o presencia de IgM natural
- √
Se recomienda que una mujer que considere quedarse I embarazada se realice una prueba de IgG contra Toxo-I plasma para identificar su estatus de infección previa I con el parásito
Cuando en una gestante se encuentra seroconversión o resultados de pruebas de infección por Toxoplasma reciente (IgG avidez baja, IgM e IgA ambas positivas), se requiere conocer si la infección fetal ya está presente. Dicha transmisión varía de acuerdo con la edad gesta-cional en el momento de la infección, siendo necesario subrayar que existen infecciones asintomáticas que no presentan alteraciones ecográficas. Hasta hace poco, los expertos aconsejaban la amniocentesis para hacer cambio de tratamiento de la madre, de espiramicina a pirimetamina-sulfadiazina; sin embargo, varios estudios observacionales no han podido demostrar que el tratamiento con pirimetamina-sulfadiazina sea mejor que solo con espiramicina.
Resumen y descripción del cuerpo de la evidenciaInmunoglobina M específica en la sangre fetal o líquido amnióticoUna cohorte de evaluación de pruebas diagnósticas con 134 gestantes encontró que la prueba de IgM obtuvo una sensibilidad del 47% y una especificidad del 95% para la detección de infección fetal, las características operativas más bajas reportadas en la literatura44. (Nivel de evidencia Ib)
Un estudio de evaluación de pruebas diagnósticas que incluyó a 127 gestantes encontró que la sensibilidad de test en líquido amniótico y en sangre fetal fue del 88,2% (15/17) y el 87,5% (14/16), respectivamente. Las especificidades se estimaron entre el 86,3 al 100%44–46. (Nivel de evidencia Ib)
Otro estudio de evaluación de pruebas diagnósticas que incluyó a 127 mujeres francesas (1985–1993) que adquirieron la infección durante el embarazo y recibieron diagnóstico prenatal encontró que la sensibilidad de los test en líquido amniótico y en sangre fetal fue del 88,2% (15/17) y el 87,5% (14/16), respectivamente. Las especificidades estuvieron entre el 86,3 al 100%. Los resultados apoyan el abandono de la cordocentesis frente al uso de la amnio-centesis46. (Nivel de evidencia II)
Aislamiento de Toxoplasma gondii en la sangre fetal o líquido amnióticoUn estudio de evaluación de pruebas diagnósticas en 134 gestantes encontró que la sensibilidad del aislamiento de T. gondii mediante la inoculación en ratones en la sangre fetal oscilaba entre el 31 al 73%44. (Nivel de evidencia Ib)
Un estudio de pruebas diagnósticas con 280 sueros en los que se aisló T. gondii mediante la inoculación los ratones en el líquido amniótico, encontró que la sensibilidad se estimaba en el 52%47. (Nivel de evidencia Ib)
PCRUn estudio prospectivo multicéntrico de evaluación de pruebas diagnósticas en 270 casos, 75 de ellas con infección confirmada, encontró que la sensibilidad de la PCR fue del 64%48. (Nivel de evidencia Ib)
En el estudio de pruebas diagnósticas que incluyó a 593 casos, se encontró que la sensibilidad de la PCR osciló entre el 69 al 71%, y la especificidad entre el 96 al 99%. La sensibilidad de la PCR parecía aumentar con la edad de la seroconversión, pero no se vio influenciada por el tratamiento materno49. (Nivel de evidencia Ib)
En un estudio de evaluación de pruebas diagnósticas con 110 casos, se estimó que la sensibilidad de la PCR osciló entre el 70 al 97%, mientras que la especificidad varió entre el 93 al 100%. Al combinar el diagnóstico por PCR con aislamiento de T. gondii en el líquido amniótico por inoculación en ratón, la sensibilidad aumentó a 91 y 94%, y la especificidad a 97 y 99%47. (Nivel de evidencia II)
Interpretación y discusión de la evidenciaLa sensibilidad de las pruebas de amplificación de ácido desoxirribonucleico de Toxoplasma por PCR en líquido amniótico para determinar si hay infección fetal oscilan entre el 67 al 80% (PCR convencional), junto con especificidades cercanas al 100%. La cordocentesis está excluida por ser riesgosa y de baja sensibilidad para el diagnóstico. Desde un punto de vista práctico, puede ser innecesaria la realización de amniocentesis en el tercer trimestre, teniendo en cuenta las altas tasas de transmisión de la infección al feto (> 66%).
El GDG no recomienda realizar la amniocentesis antes de la semana 18. Como cualquier procedimiento invasivo, la realización de una amniocentesis debe ir acompañada de una valoración del balance entre los riesgos (parto pretérmino, sangrado, etc.) y los beneficios. La decisión de la mujer debe quedar consignada en la historia clínica, y se recomienda la realización de un consentimiento informado.
Recomendación clínica- B
Se sugiere ofrecer como alternativa el diagnóstico de I infección fetal a través de amniocentesis y realización I de PCR en segundo trimestre de gestación; la decisión I final debe ser consensuada y consignada en la historia I clínica. Un resultado negativo no descarta la infección
- B
congénita
- •
No se recomienda el uso de la cordocentesis como I prueba confirmatoria para infección por toxoplasmosis
- √
Se recomienda realizar controles de calidad a los centros que realizan las diferentes pruebas para diagnóstico basado en líquido amniótico para la infección por Toxoplasma
La infección fetal por Toxoplasma puede o no manifestarse ecográficamente. La detección de alteraciones morfológicas sugiere la presencia de lesiones cerebrales que podrían ser compatibles con infección por Toxoplasma y compromiso grave del SNC.
Resumen y descripción del cuerpo de la evidenciaUna revisión sistemática que incluyó 7 estudios con 25.036 mujeres encontró que la calidad de la detección de anomalías fetales mediante el ultrasonido depende del sistema de órganos afectados, con mayores tasas de detección para el SNC y no por las anomalías esqueléticas y cardíacas50. (Nivel de evidencia Ib)
Un estudio de pruebas diagnósticas que incluyó a 162 niños con seguimiento por 15 a 71 meses encontró que 27 de ellos tenían toxoplasmosis congénita confirmada y sin lesiones ecográficas, y reportaron un desarrollo neuroló-gico normal en el seguimiento51. (Nivel de evidencia Ib)
Un estudio de pruebas diagnósticas con 286 casos52encontró que los exámenes prenatales combinados (sero-logía, amniocentesis, ecografía) permiten diagnosticar el 77% de los casos de toxoplasmosis congénita. (Nivel de evidencia II)
Interpretación y discusión de la evidenciaEl seguimiento ecográfico permite, fundamentalmente, la detección de alteraciones del SNC. La ausencia de alteraciones ecográficas se correlaciona con menor probabilidad de compromiso neurológico evidenciado posnatalmente. La ausencia de alteraciones ecográficas cerebrales no descarta la presencia de compromiso en el ámbito ocular.
Recomendación clínica- A
Se recomienda el seguimiento de la gestante con eco-I grafía de morfología fetal para definir la severidad y I compromiso del feto en presencia de pruebas positivas para infección por Toxoplasma
- √
Se recomienda que la ecografía de seguimiento para I estas pacientes sea realizada por personal especializado I y entrenado para la identificación del riesgo asociado a Toxoplasma
El propósito de los programas de detección de infección durante el embarazo es poder detectar y tratar los casos, así como disminuir la transmisión de la infección y los daños severos en el feto y en el recién nacido. La espiramicina ha sido utilizada como tratamiento principal en los programas del Gobierno de Francia durante muchos años; sin embargo, su eficacia fue puesta en duda por una revisión sistemática que no permitió concluir si existía evidencia sobre su beneficio. El programa European Multicentre Study on Congenital Toxoplasmosis de la Unión Europea permitió durante varios años llevar a cabo estudios colabo-rativos entre varios países con el fin de recopilar evidencia que permitiera definir si el tratamiento prenatal de la toxoplasmosis tenía utilidad. A pesar de que los estudios son observacionales, los resultados finalmente han sido consistentes y permiten realizar recomendaciones basadas en la mejor evidencia disponible.
Resumen y descripción del cuerpo de la evidenciaUna revisión sistemática incluyó 22 cohortes europeas (550 niños) y 4 cohortes de otros países (141 niños) para evaluar el efecto de la espiramicina y la pirimetamina-sulfadiazina sobre el riesgo de transmisión al niño. Se encontró que el tratamiento con espiramicina (3 g/día hasta el parto) era efectivo para la prevención de la transmisión si este se hacía en las primeras 3 semanas posteriores a la sero-conversión (OR 0,48; IC 95% 0,2–0,8). Se encontró una tendencia al beneficio con tratamiento realizado entre 3 y 5 semanas luego de seroconversión (OR 0,64; IC 95% 0,4–1,0). No se encontró un efecto benéfico si el tratamiento se administraba entre 5 a 8 semanas luego de seroconversión o luego de 8 semanas de seroconversión. Se estimó un OR ajustado de 0,42 (IC 95% 0,2–0,9) para riesgo de síntomas clínicos en el niño si el tratamiento prenatal con espiramicina (3 g día hasta el nacimiento) era dado en las primeras 4 semanas luego de seroconversión, y un OR ajustado de 0,64 (IC 95% 0,4–0,99) si se daba posterior a este tiempo. En las cohortes europeas, este efecto protector fue menos evidente (OR 0,68; IC 95% 0,3–1,5 con tratamientos previos a las 5 semanas de la seroconversión, y OR 0,87; IC 95% 0,4–1,8 posterior a 5 semanas de seroconversión). Con respecto a medicamentos o esquemas diferentes a espiramicina, en Austria, por ejemplo, se emplea un esquema de inicio de tratamiento con pirimetamina-sulfadiazina. No se encontraron diferencias entre el efecto pro-tector por espiramicina o por pirimetamina-sulfadiazina5. (Nivel de evidencia 2++)
Un estudio observacional que incluyó a 293 pacientes evaluó en mujeres con seroconversión o bebés con infección de toxoplasmosis congénita el tratamiento prenatal con espiramicina vs. pirimetamina vs. no tratamiento6. La terapia redujo las secuelas neurológicas graves (OR 0,23; IC 95% 0,07–0,70), pero no se observaron diferencias entre espiramicina y pirimetamina-sulfadiazina (OR 0,77; IC 95% 0,204–2,849). (Nivel de evidencia 2++)
Interpretación y discusión de la evidenciaEn la evidencia identificada no se encontraron ensayos clínicos controlados acerca de la eficacia de las diferentes opciones terapéuticas para la transmisión al feto de la infección por Toxoplasma; sin embargo, los estudios observacionales son consistentes en demostrar un beneficio del tratamiento prenatal con espiramicina, el cual no se ha podido demostrar que es superior al esquema de pirimetamina-sulfadiazina. El tratamiento debe iniciarse de forma temprana después del diagnóstico de toxoplasmosis aguda, idealmente, antes de 4 semanas después de la seroconversión. No se encontraron estudios que evaluaran otros antibióticos diferentes a los analizados en la revisión sistemática para tratamiento prenatal de la toxoplasmosis.
Recomendación clínica- B
Se recomienda tratamiento farmacológico con espirami-I cina (3 g/día por el resto del embarazo) para la infección confirmada por Toxoplasma en la gestante
- √
En caso de confirmación de la transmisión fetal de toxo -I plasmosis (pruebas de PCR o ecografías que sugieren I compromiso neurológico), se recomienda el cambio a pirimetamina más sulfadiazina más ácido folínico
El recién nacido de una madre con infección en el embarazo requiere una evaluación diagnóstica que permita confirmar o descartar la infección congénita. Dado que la infección puede ser asintomática y los signos clínicos son inespecíficos, se deben utilizar pruebas serológicas que permitan diferenciar entre anticuerpos maternos o propios. Igualmente, debe revisarse el papel de las pruebas de detección de ácido desoxirribonucleico del parásito en el diagnóstico del recién nacido.
Resumen y descripción del cuerpo de la evidenciaPruebas serológicas inmunoglobina MUn estudio de pruebas diagnósticas estimó en 105 pacientes la especificidad de IgM en muestra de sangre de cordón en 78%. La prueba de IgM ISAGA tuvo las más altas estimaciones de sensibilidad, variando entre el 54 al 73%. Se encontró un aumento de la sensibilidad con la secuencia IF, ELISA y luego ISAGA53. (Nivel de evidencia II)
Un estudio de pruebas diagnósticas con 126 casos encontró que la sensibilidad de la prueba de IgM en la sangre del cordón umbilical al nacer osciló entre el 28% con la prueba ELISA al 91% con ISAGA. Más allá del nacimiento, se reportó una menor especificidad de IgM (96%). La sensibilidad más baja se encontró en las pruebas IF, oscilando entre el 10 al 27%54. (Nivel de evidencia II)
Dos estudios, uno de pruebas diagnósticas con 593 casos y otro de pruebas diagnósticas con evaluación retrospectiva en 294 gestantes, encontraron una asociación positiva entre la sensibilidad de la IgM y la edad de la madre en la seroconversión. No hubo asociación entre los resultados de la prueba y el tratamiento de la madre49,55. (Nivel de evidencia Ib)
Pruebas serológicas inmunoglobina A + inmunoglobina MUna evaluación retrospectiva de pruebas diagnósticas que involucró a 294 niños de madres con seroconversión encontró que la IgM en sangre de cordón umbilical fue positiva en el 80% de los casos cuando las gestantes no eran tratadas, y en el 35% cuando recibían tratamiento (P = 0,01), mientras que la IgA en cordón fue positiva en 78 y 61% casos, respectivamente (P = 0,45)47,53,55–57. (Nivel de evidencia 1b)
Un estudio de pruebas diagnósticas que involucró a 14 laboratorios del programa biomédico de la Comunidad Europea evaluó métodos inmunológicos para el diagnóstico posnatal de la toxoplasmosis congénita. Se analizaron 55 recién nacidos con IgG anti-Toxoplasma persistente y 50 bebés de control sin anti-Toxoplasma IgG en el primer año de vida. La prueba ISAGA tuvo una especificidad por debajo del 90%, mientras que la del ELIFA fue del 100%; la sensibilidad para estas 2 pruebas fue de 64,2 y 56,7%, respectivamente. Cuando los resultados fueron combinados para IgM e IgA por métodos estandarizados y para IgG e IgM por métodos de perfiles inmunológicos comparativos (CIP por sus siglas en inglés), la sensibilidad aumentó, pero la especificidad se mantuvo similar a la combinación de IgA-IgM58. (Nivel de evidencia 1 b)
Un estudio de pruebas diagnósticas en 894 pacientes que comparó IgM e IgA encontró que ambas pruebas fueron más específicas en sangre neonatal (IgM: 98%; IgA: 100%) que los resultados de cordón umbilical (IgM: 85%; IgA: 88%). La sensibilidad para IgM e IgA en sangre neonatal fue de 61 y 60%, respectivamente) y en sangre de cordón umbilical (67 y 54%, respectivamente). La combinación de IgM e IgA produjo un aumento de la sensibilidad global de 73% y especificidad de 98%47,53,55–57. (Nivel de evidencia 1b)
Un estudio de evaluación de pruebas diagnósticas que comparó WB contra la serología en 175 niños, 36 infectados y 139 no infectados, estimó una sensibilidad del 85% en el tercer mes de vida, de esta prueba. Asimismo, al combinarlo con serología, la sensibilidad de WB aumentó a 94%, con especificidad de 100% (IC 95% 98,7–100)47,53,55–57. (Nivel de evidencia 1 b)
Western blotEn un estudio de evaluación de pruebas diagnósticas, se incluyeron 48 infantes: 27 con diagnóstico confirmado de toxoplasmosis congénita y 21 con sospecha y no presentación de la infección congénita. Se evaluó la relación entre el diagnóstico con inmunoblot y otros métodos, encontrando que la sensibilidad, especificidad y valores predic-tivos positivos en inmunoblot para IgG fueron 92,6, 89,1, y 92,4%, respectivamente59. (Nivel de evidencia 1 b)
Un estudio de pruebas diagnósticas en pacientes de 3 meses de edad, evaluó una cohorte de 165 gestantes en su relación con el tratamiento prenatal. El estudio encontró una sensibilidad con el WB del 85%60. (Nivel de evidencia 1 b)
Un estudio de pruebas diagnósticas para tamizaje realizado en Colombia con 200 pacientes evaluó la prueba de WB para el diagnóstico de la toxoplasmosis congénita con un nuevo criterio determinado por densitometría de las bandas o inmunodensitometría, con el cual se diagnosticó un 91% de los casos comparado con no utilizarlo con un 72%. Dicho método permitió comparar si en el suero del niño había anticuerpos con especificidad diferente a los de la madre, y así, fue posible diferenciar entre anticuerpos transmitidos pasivamente por la madre y los que produce el niño, eliminando el problema que plantea la medición de IgG61. (Nivel de evidencia II)
PCRUn estudio de pruebas diagnósticas con 94 pacientes evaluó el papel de la PCR en el tejido de la placenta en el diagnóstico de toxoplasmosis congénita, encontrando sensibilidad del 61% y especificidad del 92%62. Cuando el aislamiento de T. gondii en el tejido de la placenta fue investigado por la inoculación en ratón y el cultivo de células para el cultivo celular, la sensibilidad fue del 30%, y la especificidad osciló entre el 98 y el 100%. (Nivel de evidencia 1 b)
Interpretación y discusión de la evidenciaEl uso de la combinación de IgM + IgA para el diagnóstico posnatal se informó en 7 estudios demostrando mejoras consistentes en la sensibilidad en todos los estudios. La sensibilidad de la combinación de IgA + IgM al nacer varió del 55 al 89%. Después del nacimiento, varió del 63 al 94%. Aunque existe buena evidencia de que la utilización de pruebas de IgM e IgA anti-Toxoplasma tienen una sensibilidad y especificidad adecuadas para la detección de toxoplasmosis congénita, la seronegatividad de estas pruebas no descarta el diagnóstico de toxoplasmosis congénita. El GDG consideró que ambas pruebas deben usarse simultáneamente. En caso de tener resultados negativos en ambas pruebas, la prueba de WB puede aumentar la sensibilidad. Otra forma de identificar los pacientes con toxoplasmosis congénita es el seguimiento de los títulos de IgG. En los niños no infectados, los títulos de IgG maternos deben desaparecer entre los 6 y los 10 meses de edad, indicando paso transplacentario, mientras que los títulos en ascenso son indicativos de infección congénita.
Recomendación clínica- A
Se recomienda el uso de IgG, IgM e IgA conjuntamente para el diagnóstico de infección congénita por Toxo-plasma en el recién nacido
- A
Ante resultados negativos en el IgA y el IgM, se recomienda la confirmación por Western blot para infección por Toxoplasma
- √
Ante resultado de IgG positivo y resultados negativos en las 3 pruebas (IgM, IgA y Western blot), se recomienda el seguimiento del recién nacido mensual-mente durante 6 meses, y luego cada 3 meses hasta el año con IgG para descartar seroconversión
Cuando un recién nacido tiene un diagnóstico confirmado de toxoplasmosis congénita requiere un tratamiento específico, el cual se recomienda suministrar durante un año. El objetivo del tratamiento en los casos sintomáticos es disminuir las secuelas oculares y neurológicas y la mortalidad. En los niños asintomáticos, se busca prevenir la aparición de lesiones de retinocoroiditis o el desarrollo de hidrocefalia. De acuerdo con estudios de niños sin tratamiento (historia natural de la enfermedad), el riesgo varía de acuerdo con la zona geográfica. En series europeas y norteamericanas4, más del 82% de los niños no tratados tenían lesión en retina en la adolescencia, y de los niños con síntomas neurológicos al nacimiento, el 85% presentaban retardo en desarrollo psicomotor, 81% convulsiones, 70% dificultades motoras, 60% pérdida de la visión, 33% hidrocefalia o microcefalia y 14% pérdida auditiva a los 4 años de edad. En algunas cohortes suramericanas, se observó que las lesiones oculares aparecen más rápidamente, así, por ejemplo, en el sur de Brasil, en los primeros meses de vida, el 80% de los recién nacidos ya tenían lesiones de retinocoroiditis, y 50% de ellas eran activas63.
Resumen y descripción del cuerpo de la evidenciaUn estudio multicéntrico incluyó 120 niños con toxoplasmosis congénita tratados por un año con pirimetamina-sulfadiazina (pirimetamina 2mg/kg el primer día y luego continuaba con 1mg/kg/día [no exceder 15mg/día] hasta completar un año + sulfadiazina: 100mg/kg/día repartida en 2 dosis, hasta completar un año) y evaluó si había diferencia en desenlaces cognitivos, neurológicos y oculares en comparación con 120 controles históricos. Se encontró que la mayoría de los niños tratados tuvieron desempeños cognitivos normales en la evaluación al año. El 72% de los niños con compromiso neu-rológico mayor tuvieron puntuaciones cognitivas normales y ausencia de compromiso auditivo4. (Nivel de evidencia 3)
En cuanto al uso del ultrasonido transfontanelar en la primera evaluación del recién nacido para identificar la presencia de calcificaciones intracerebrales, se identificó un estudio de pruebas diagnósticas que incluyó 44 pacientes, encontrando que ambos métodos tenían muy buena concordancia (k> 0,8)64. (Nivel de evidencia Ib)
Interpretación y discusión de la evidenciaNo existe evidencia que permita dar recomendación basada en ensayos aleatorios controlados. El GDG junto con el grupo de expertos concluyó que todos los niños sintomáticos y asintomáticos con criterios paraclínicos o clínicos compatibles con toxoplasmosis, así como todos aquellos con confirmación de infección fetal durante la gestación, independiente de si su madre recibió o no tratamiento, deben ser tratados con un esquema de pirimetamina-sulfadiazina/ácido folínico por un año. En aquellos neonatos asintomáticos con datos serológicos equívocos, debe realizarse seguimiento para confirmar o descartar la infección por T. gondii y proceder en consecuencia. Se administra pirimetamina: 1mg/kg cada 12h los 2 primeros días, seguido por 1mg/kg por día por 1 año, y sulfadiazina a dosis de 50mg/kg cada 12 h y ácido folínico (10mg 3 veces/semana) hasta 1 semana posterior a suspensión de pirimetamina. Diversos estudios han presentado otras combinaciones de pirimetamina-sulfadoxina, aparte a la expuesta en el resumen de la evidencia65–68, así:
- •
Pirimetamina + sulfadoxina tabletas (1 comprimido = 500mg de sulfadoxina y 25mg de pirimetamina). Se da disuelto e igualmente con base en la dosis de sulfadoxina 25mg/ kg cada 8 días. Se da una dosis de carga de 50mg/kg según sulfadoxina el primer día, y luego 25mg/kg en dosis única semanal hasta el primer año de vida asociado a ácido folínico 7,5mg/día (media tableta de 15mg). Existe controversiasobre el uso de esta combinación, dado el riesgo de efectos adversos y dudas sobre los niveles terapéuticos durante la administración a intervalos semanales.
- •
Pirimetamina 1mg/kg/día vía oral más clindamicina 30mg/kg/día intramuscular dividida en 3 dosis en fase aguda y luego pasar a vía oral a 20mg/kg/día dividido en 3 dosis (clindamicina suspensión 75mg=5ml) para mantenimiento hasta el primer año de vida.
- •
Se debe tratar a todos los niños sintomáticos y asinto máticos por infección por Toxoplasma con pirimetamina más sulfadiazina (1mg kg/día una vez al día más 100mg/kg/día, 2 veces al día durante un año) más I ácido folínico
- •
En caso de efectos adversos y/o limitaciones al tra tamiento de primera elección, y a juicio del médico, se puede usar como alternativa clindamicina, sulfadoxina o azitromicina en conjunto con pirimetamina I más ácido folínico
El trabajo científico de investigación, así como la elaboración de las recomendaciones incluidas en el presente documento, fue realizado de manera independiente por el GDG de la Universidad Nacional de Colombia. Todos los miembros del GDG, así como las personas que han participado tanto en la colaboración experta como en la revisión externa realizaron una declaración de conflicto de intereses previo a su participación.
Actualización de la guíaLas recomendaciones de esta guía deben actualizarse en los próximos cinco años a partir de su expedición, o previamente en caso de disponer de nuevas evidencias que modifiquen de manera significativa las recomendaciones aquí anotadas.
Reconocimiento a instituciones participantesLa Asociación Colombiana de Infectología participó en la construcción metodológica, desarrollo del documento y socialización de la Guía. Las siguientes instituciones participaron en las reuniones de socialización de la GAI de embarazo, parto y puerperio: Federación Colombiana de Asociaciones de Obstetricia y Ginecología, Sociedad Colombiana de Anestesiología y Reanimación, Asociación Colombiana de Facultades de Medicina, Asociación Colombiana de Facultades de Enfermería, Asociación Colombiana de Empresas de Medicina Integral, Academia Nacional de Medicina, Colegio Médico Colombiano, Asociación Colombiana de Hospitales y Clínicas, Instituto Nacional de Salud, CAFAM IPS, Centro Médico Imbanaco, Clínica de Occidente, Clínica de la Mujer, Clínica del Norte, Clínica Materno Infantil Los Farallones, Clínica el Rosario, Clínica del Prado, Fundación Cardioinfantil, Fundación Valle de Lili, Fundación Santa Fe de Bogotá, Hospital Militar, Hospital San José, Hospital Simón Bolivar, Fundación Universitaria de Ciencias de la Salud, Universidad de Antioquia, Universidad del Quindío, Universidad Libre, Universidad Surcolombiana.
| Preguntas sobre intervenciones | |
| 1++ | Metanálisis de alta calidad, revisiones sistemáticas de ensayos clínicos o ensayos clínicos de alta calidad con muy poco riesgo de sesgo. |
| 1 + | Metanálisis bien realizados, revisiones sistemáticas de ensayos clínicos o ensayos clínicos bien realizados con poco riesgo de sesgos. |
| 1- | Metanálisis, revisiones sistemáticas de ensayos clínicos o ensayos clínicos con alto riesgo de sesgos. |
| 2++ | Revisiones sistemáticas de alta calidad de estudios de cohortes o de casos y controles. Estudios de cohortes o de casos y controles con riesgo muy bajo de sesgo y con alta probabilidad de establecer una relación causal. |
| 2+ | Estudios de cohortes o de casos y controles bien realizados con bajo riesgo de sesgo y con una moderada probabilidad de establecer una relación causal. |
| 2- | Estudios de cohortes o de casos y controles con alto riesgo de sesgo y riesgo significativo de que la relación no sea causal. |
| 3 | Estudios no analíticos, como informes de casos y series de casos. |
| 4 | Opinión de expertos. |
| Grados de recomendación | |
| A | Al menos un metanálisis, revisión sistemática o ensayo clínico clasificado como 1++ y directamente aplicable a la población diana de la guía; o un volumen de evidencia científica compuesto por estudios clasificados como 1+ y con gran consistencia entre ellos. |
| B | Un volumen de evidencia científica compuesta por estudios clasificados como 2++, directamente aplicable a la población diana de la guía y que demuestran gran consistencia entre ellos; o evidencia científica extrapolada desde estudios clasificados como 1++ o 1+. |
| C | Un volumen de evidencia científica compuesta por estudios clasificados como 2+ directamente aplicables a la población diana de la guía y que demuestran gran consistencia entre ellos; o evidencia científica extrapolada desde estudios clasificados como 2++. |
| D | Evidencia científica de nivel 3 o 4; o evidencia científica extrapolada desde estudios clasificados como 2+. Los estudios clasificados como 1- y 2- no deben usarse en el proceso de elaboración de recomendaciones por su alto potencial de sesgo. |
| / | Práctica recomendada, basada en la experiencia clínica y en el consenso del grupo desarrollador. |
| Preguntas sobre diagnóstico | |
| Adaptación del National Institute for Health and Clinical Excellence de los niveles de evidencia del Oxford Centre for Evidence Based Medicine y del Centre for Reviews and Dissemination | |
| Ia | Revisión sistemática con homogeneidad de estudios de nivel 1. |
| Ib | Estudios de nivel 1. |
| II | Estudios de nivel 2. Revisión sistemática de estudios de nivel 2. |
| III | Estudios de nivel 3. Revisión sistemática de estudios de nivel 3. |
| IV | Consenso, opiniones de expertos sin valoración crítica explícita. |
| Estudios de nivel 1 | Cumplen:• Comparación enmascarada con una prueba de referencia (patrón de oro) válida.• Espectro adecuado de pacientes. |
| Estudios de nivel 2 | Presentan solo uno de estos sesgos:• Población no representativa (la muestra no refleja la población donde se aplicará la prueba).• Comparación con el patrón de referencia (patrón de oro) inadecuado (la prueba que se evaluará forma parte del patrón de oro o el resultado de la prueba influye en la realización del patrón de oro).• Comparación no enmascarada.• Estudios casos-control. |
| Estudios de nivel 3 | Presentan 2 o más de los criterios descritos en los estudios de nivel 2. |
| Grados de recomendación | |
| A | Ia o Ib |
| B | II |
| C | III |
| D | IV |
Esta guía y sus secciones forman parte de un grupo de 25 guías de atención integral basadas en la evidencia que incorporan consideraciones económicas y de implementabilidad en el contexto del Sistema General de Seguridad Social en Salud colombiano, y que se desarrollaron por iniciativa del Ministerio de Salud y Protección Social y el Departamento de Ciencia, Tecnología e Innovación, Colciencias, en temas prioritarios y de alta prevalencia en el país mediante contrato otorgado a la Universidad Nacional de Colombia en el año 2010.