Evaluar el impacto de un programa de uso regulado de antibióticos en observancia, consumo antibiótico y resistencia bacteriana en 2 unidades de cuidados intensivos (UCI) de un hospital universitario de tercer nivel en Colombia.
Matenales y MétodoEstudio prospectivo observacional de intervención que analiza 2 períodos en el tiempo en 2 UCI: preintervención (agosto de 2008 a febrero de 2009) y posintervención (marzo a septiembre de 2009). El estudio se llevó a cabo en el Hospital Universitario del Valle Evaristo García E.S.E. Se evaluaron: observancia a guías de uso de antibióticos creadas por epidemiología hospitalaria, consumo antibiótico en dosis diaria definida e incidencia acumulada mensual de infección por Escherichia coli (E. coli) y Klebsiella pneumoniae (K. pneumoniae) BLEE, Pseudomonas aeruginosa (P. aeruginosa) resistente a quinolonas y cefalosporinas de cuarta generación, Staphylococcus aureus resistente a oxacilina y Acinetobacter baumannii multirresistente.
ResultadosSe encontró observancia a guías de uso de antibióticos superior al 80% para ambas UCI durante la intervención. Se redujo significativamente el consumo de meropenem (UCI-1 p=0,009/UCI-2 p=0,000), vancomicina (UCI-1 y UCI-2 p=0,018), ceftriaxona (UCI-1 p=0,015/ UCI-2 p=0,018), ciprofloxacina (UCI-1 p=0,027/UCI-2 p=0,018), se incrementó el consumo de piperacilina/tazobactam (UCI-1 p = no significativa/UCI-2 p=0,017) y cefepime (UCI-1 p=0,028/UCI-2 p=0,004). Se redujo la incidencia de infección por E. coli y K. pneumoniae BLEE + (UCI-1 83%/UCI-2 78%), P. aeruginosa resistente a ciprofloxacina (UCI-1 87%/UCI-2 82%) y cefalosporinas de cuarta generación (UCI-1 83%/UCI-2 76%).
ConclusionesLa creación de un programa de uso regulado de antibióticos reduce significativamente el consumo y los costos de antibióticos en las UCI del Hospital Universitario del Valle y la infección por microorganismos resistentes.
To determine the impact of a Program of Regulated Use of Antibiotics in adherence, antibiotic use and bacterial resistance in two medical-surgical Intensive Units Care (ICU's) in a third level mayor teaching hospital in Colombia.
Materials and MethodsProspective observational study of intervention that examines two time periods in two ICU: pre-intervention (august/2008 to February/2009) and post-intervention (march to September/2009). The study was carried out in the Hospital Universitario del Valle Evaristo García E.S.E. (H.U.V). We evaluated adherence to the antibiotic therapy guidelines established by Hospital Epidemiology, antibiotic use measured by Defined Daily Doses and monthly incidence of infection by ESBL producer E.coli and K.pneumoniae, P.aeruginosa fluoroquinolone and four generation cephalosporin resistant, oxacilin resistant S.aureus and multidrug resistant A.baumannii.
ResultsThe adherence to the antibiotic guidelines of antibiotic use was greater to 80% for the both ICU during the intervention period. Antibiotic use was significantly reduced for meropenem (ICU1 p=0,009/ICU2 p=0,000), vancomycin (ICU1-ICU2 p=0,018), ceftriaxone (ICU1 p=0,015/ICU2 p=0,018), ciprofloxacin (ICU1 p=0,027/ICU2 p=0,018), and increased the used of piperacilin/tazobactam (ICU2 p=0,017), and cefepime (ICU1 p=0,028/ICU2 p=0,004). The incidences of infection by ESBL producer E.coli and K.pneumoniae (ICU1 83%/ ICU2 78%), ciprofloxacin resistant and four generation cephalosporin resistant P.aeruginosa (ICU1 87%/ ICU2 82%) and (ICU1 83%/ICU2 76%) ware also reduced.
ConclusionsThe implementation of a Program of Regulated Use of Antibiotics reduces antibiotics use and resistant micro-organism specific infection rate in the Hospital Universitario del Valle's ICU.
El uso de antibióticos data de más de 2.500 años, siendo una de las actividades más frecuentes a las que el personal de salud se enfrenta en su práctica clínica1. En contraste, las infecciones nosocomiales superan como causa de muerte al virus de la inmunodeficiencia humana, cáncer de mama o accidentes de tránsito en el mundo, generalmente debidas a la disminución del lavado de manos del personal tras el contacto con pacientes, el aumento del uso de antibióticos y la resistencia a los mismos2. Este incremento en el consumo de antibióticos también ha afectado a Latinoamérica y Colombia. Betalactámicos, cefalosporinas y carbapenémicos sobrepasan el percentil 90 de dosis diaria definida (sistema de clasificación anatómica, terapéutica y química, dosis diaria definida, Organización Mundial de la Salud) en comparación con Estados Unidos3,4; además, la mitad de los pacientes dentro de un hospital necesitarán como parte de su tratamiento un antibiótico6. El reflejo de esta situación se ve en un incremento de los costos, que solo en Estados Unidos representa 100 millones de dólares hasta 30 billones de dólares anualmente, y constituye una amenaza para la salud pública5,6. En contraste, el gran consumo antibiótico en humanos, asociado al uso no humano en ambientes extrahospitalarios en crecimiento y nutrición animal y fumigación han inducido la aparición de cepas de microorganismos multirresistentes7,8.
En el medio hospitalario, las áreas de cirugía y unidades de cuidados intensivos (UCI) son los escenarios más propicios para el desarrollo de infecciones intrahospitalarias por bacterias resistentes a los antibióticos, debido a la alta prevalencia de la infección nosocomial, al consumo indiscriminado de antibióticos y al grado de complejidad del paciente3,9. Es necesario garantizar un tratamiento antibiótico adecuado para el paciente infectado, conocer el microorganismo causante y su perfil de resistencia y así formular esquemas que se ajusten a la realidad del hospital y de la infección por sí misma, ya que no cubrir eficazmente un agente infeccioso desde el principio se verá reflejado en un incremento en la mortalidad del paciente10. Algunos reportes de la literatura enfocan la estrategia contra la resistencia bacteriana y el uso indiscriminado de antibióticos basada en la participación multidisciplinaria de infectología, microbiología, epidemiología hospitalaria — Comité de Infecciones— y farmacia, con el apoyo de la dirección médica hospitalaria, que articula y operativiza planes más efectivos. En algunas instituciones, en Colombia, se han usado estas estrategias6,11–13.
Desde 2009, se ha venido implementando un programa de uso regulado de antibióticos (PURA) secuencialmente en varias salas del Hospital Universitario del Valle. Se realizará un análisis del impacto del PURA en observancia a las guías de antibióticos creadas por epidemiología hospitalaria –Comité de Infecciones–, consumo de antibióticos, costos y resistencia bacteriana.
Material y métodoEl Hospital Universitario del Valle Evaristo García E.S.E es una institución universitaria de tercer nivel de atención con una capacidad instalada de 736 camas, con convenios académicos asistenciales con varias universidades de la región, y se constituye como el referente del sur occidental colombiano, especialmente para los sectores de EPS (empresas promotoras de salud subsidiada), Sistema de Identificación de Potenciales Beneficiarios de Programas Sociales y sin seguridad social. Cuenta con 7 UCI, 4 de adultos (32 camas), 1 de neurocirugía (8 camas), 1 de pediatría (9 camas) y 1 de neonatología (39 camas). La población objeto son 2 UCI de adultos (UCI-1 –8 camas– y UCI-2 –8 camas–). La UCI-1 está conformada, principalmente, por pacientes con patología médica y la UCI-2, médico-quirúrgica. Se desarrolló un estudio observacional antes y después de la intervención. El período de observación fue dividido en una fase de 7 meses preintervención, que comprende el período de agosto de 2008 a febrero de 2009, y 7 meses posintervención que va de marzo a septiembre de 2009. En el período preintervención, las UCI disponían de protocolos para la selección de antibióticos pero no existía política alguna de uso ni control o restricción en su formulación. Para la intervención, se elaboró una guía detallada de uso de antibióticos con el apoyo de infectología, basada en el perfil microbiológico de la resistencia bacteriana de la institución obtenido del análisis por microorganismo, sensibilidad y tipo de muestra asociado a infección de los archivos del software del laboratorio de bacteriología del hospital (MicroScan, WHO-NET). La guía está conformada por manejos empíricos de las patologías infecciosas por especialidad, ofreciendo un manejo inicial con alternativa y un esquema ante la falla terapéutica. Fue distribuida al personal médico en las 2 UCI, quienes recibieron instrucción sobre el uso de la guía institucional mediante charlas educativas de capacitación y ejercicios prácticos de formulación de antibióticos según la patología infecciosa. Se cambió el esquema de formulación antibiótica de la fórmula convencional al formato formulación/evaluación de antibióticos, avalado y normativizado por la dirección médica del hospital, el cual contiene información útil para caracterizar la infección, y permite el reporte de eventos adversos y falla terapéutica basada en evaluación clínica y microbiológica. Al proceso de dispensación del medicamento se le adicionó un software en farmacia que permitía ingresar los datos del formato formulación/evaluación de antibióticos para realizar un seguimiento estricto día a día del uso de antibióticos, indicación y observancia a las guías. Se realizaron pruebas piloto en cada UCI que consistieron en el acompañamiento diario en las revistas de la sala durante un mes, y posteriormente, en el acompañamiento periódico con asesoría de infectología para los casos especiales y no adherentes. Durante el período de intervención del PURA, no se realizó ninguna otra estrategia de impacto en resistencia bacteriana ni consumo antibiótico (campañas de higiene de manos, restricción en la formulación antibiótica); tampoco se realizaron cambios drásticos en el personal que labora en ambas salas ni cambios en los distribuidores de los antibióticos hospitalarios ni en insumos como alcohol glicerinado y material quirúrgico. Durante el período pre y posintervención del PURA, hubo disponibilidad de todos los antibióticos solicitados.
El consumo antibiótico para los períodos pre y posinter-vención fue registrado como dosis diaria definida por 1.000 camas día (sistema de clasificación anatómica, terapéutica y química/dosis diaria definida, Organización Mundial de la Salud). Se usó el sistema MicroScan para la identificación y sensibilidad de los microorganismos según los puntos de corte establecidos por el Clinical and Laboratory Standars Institute.Y se calculó la incidencia de infección por microorganismo específico en los períodos pre y posintervención (agosto de 2008 a febrero de 2009 y de marzo a septiembre de 2009) para E. coli y K. pneumoniae BLEE (+), P. aeruginosa resistente a quinolonas y cefalosporinas de tercera generación, S. aureus resistente a oxacilina y A. baumannii multirresistente. Los aislamientos fueron realizados por el servicio de microbiología del Hospital, y los datos fueron recolectados por el médico de epidemiología hospitalaria — Comité de Infecciones—.
El análisis estadístico para el consumo antibiótico se realizó mediante test de rachas para comprobar la aleatoriedad de las muestras; la prueba de Shapiro-Wilk (< 30 datos) para comprobar normalidad o no, y la comparación de las muestras (variables cuantitativas) se realizó mediante estadística paramétrica (t de Student) o no paramétrica (prueba de Wilconxon-Mann-Whitney para 2 grupos independientes) según el caso. Un valor de p < 0,05 fue considerado como estadísticamente significativo. La incidencia para microorganismos específicos fue cal-culada mensualmente desde enero de 2006 hasta septiembre de 2009, tomando en el numerador los pacientes que fueron caso de infección para cada microorganismo, y en el denomi-nador los pacientes que ingresaron en la sala por 100. Para el análisis de los costos, se calculó el valor en pesos colombianos del total de ampollas de cada antibiótico por mes, tomando el valor promedio durante el período pre y posintervención de cada ampolla de antibiótico. Se utilizó el paquete estadístico STATA® version 10 (StataCorp, College Station, Texas) para realizar los cálculos.
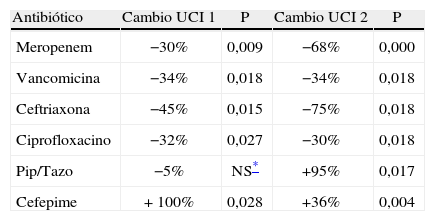
ResultadosLa observancia del personal médico a las guías de uso de antibióticos en el período de marzo a septiembre de 2009 fue en promedio del 83% para UCI-1 y 86% para UCI-2. Se observó una disminución general en el consumo antibiótico en el período de intervención (tabla 1), especialmente en los carbapenémicos, así como un incremento en el consumo de piperacilina/tazobactam y cefepime debido a que las patologías infecciosas más prevalentes en ambas salas contemplan su uso como manejo empírico según las guías de antibióticos.
Porcentaje de cambio del consumo antibiótico durante el período de intervención del programa de uso regulado de antibióticos en la unidad de cuidados intensivos 1 y 2 del Hospital Universitario del Valle
| Antibiótico | Cambio UCI 1 | P | Cambio UCI 2 | P |
| Meropenem | −30% | 0,009 | −68% | 0,000 |
| Vancomicina | −34% | 0,018 | −34% | 0,018 |
| Ceftriaxona | −45% | 0,015 | −75% | 0,018 |
| Ciprofloxacino | −32% | 0,027 | −30% | 0,018 |
| Pip/Tazo | −5% | NS* | +95% | 0,017 |
| Cefepime | + 100% | 0,028 | +36% | 0,004 |
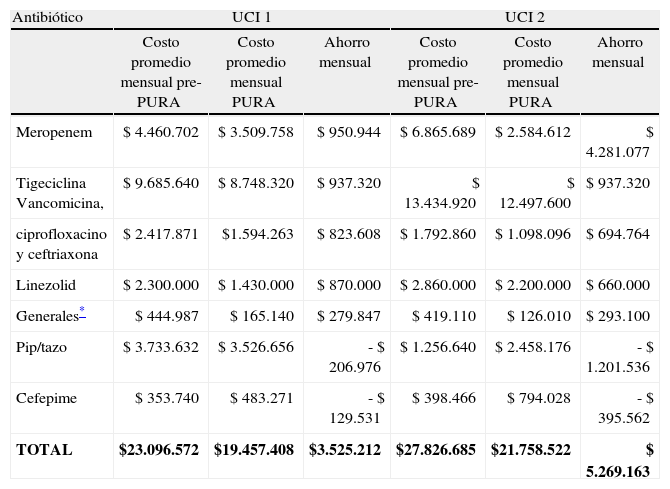
Esta reducción en el consumo antibiótico significó un ahorro mensual promedio durante la intervención en pesos colombianos de 3.525.212 para la UCI-1 y 5.269.163 para la UCI-2 (tabla 2) solo en ampollas de antibiótico, para un ahorro total de 61.560.625 pesos colombianos en ambas UCI en el período de intervención del PURA (marzo a septiembre de 2009).
Comparación del costo de antibiótico pre y posintervención del programa de uso regulado de antibióticos en la uni dad de cuidados intensivos 1 y 2 del Hospital Universitario del Valle
| Antibiótico | UCI 1 | UCI 2 | ||||
| Costo promedio mensual pre-PURA | Costo promedio mensual PURA | Ahorro mensual | Costo promedio mensual pre-PURA | Costo promedio mensual PURA | Ahorro mensual | |
| Meropenem | $ 4.460.702 | $ 3.509.758 | $ 950.944 | $ 6.865.689 | $ 2.584.612 | $ 4.281.077 |
| Tigeciclina Vancomicina, | $ 9.685.640 | $ 8.748.320 | $ 937.320 | $ 13.434.920 | $ 12.497.600 | $ 937.320 |
| ciprofloxacino y ceftriaxona | $ 2.417.871 | $1.594.263 | $ 823.608 | $ 1.792.860 | $ 1.098.096 | $ 694.764 |
| Linezolid | $ 2.300.000 | $ 1.430.000 | $ 870.000 | $ 2.860.000 | $ 2.200.000 | $ 660.000 |
| Generales* | $ 444.987 | $ 165.140 | $ 279.847 | $ 419.110 | $ 126.010 | $ 293.100 |
| Pip/tazo | $ 3.733.632 | $ 3.526.656 | - $ 206.976 | $ 1.256.640 | $ 2.458.176 | - $ 1.201.536 |
| Cefepime | $ 353.740 | $ 483.271 | - $ 129.531 | $ 398.466 | $ 794.028 | - $ 395.562 |
| TOTAL | $23.096.572 | $19.457.408 | $3.525.212 | $27.826.685 | $21.758.522 | $ 5.269.163 |
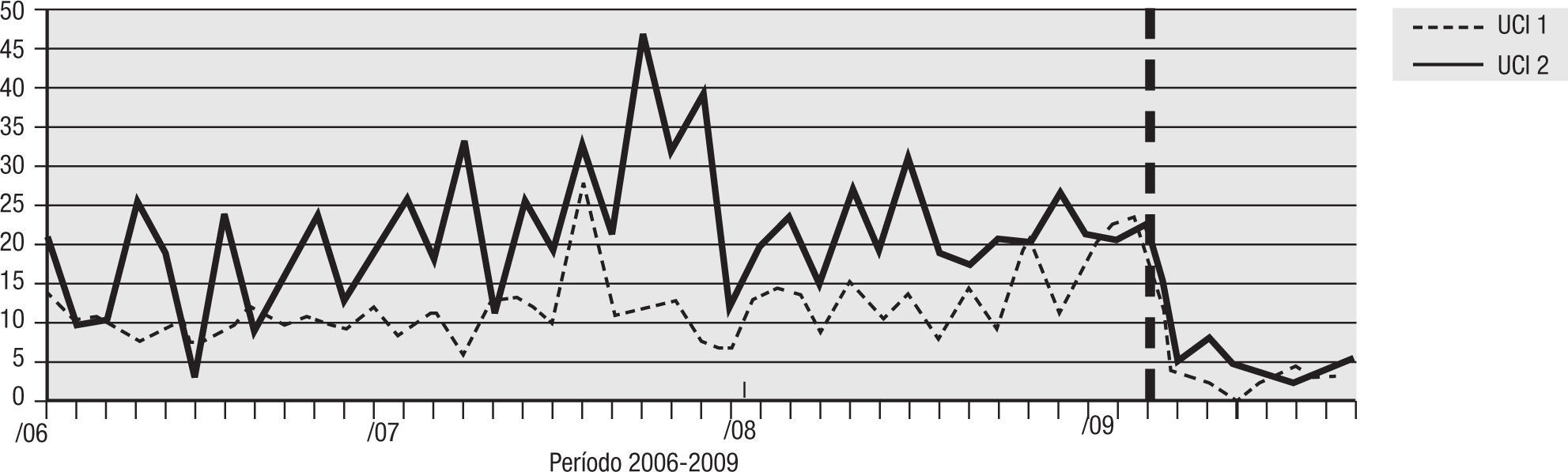
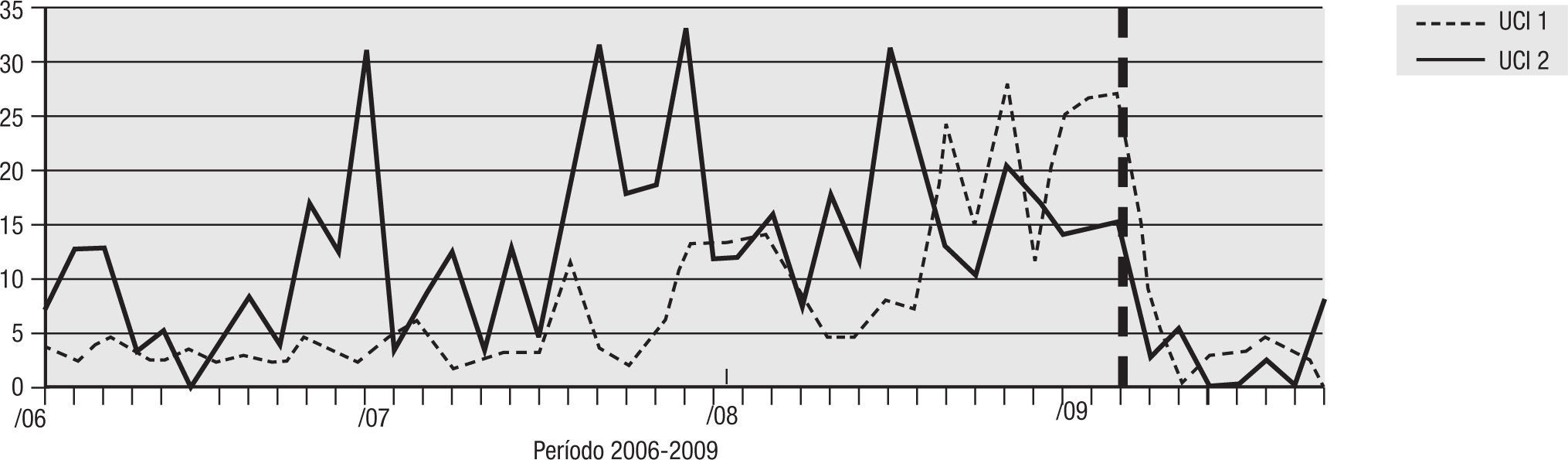
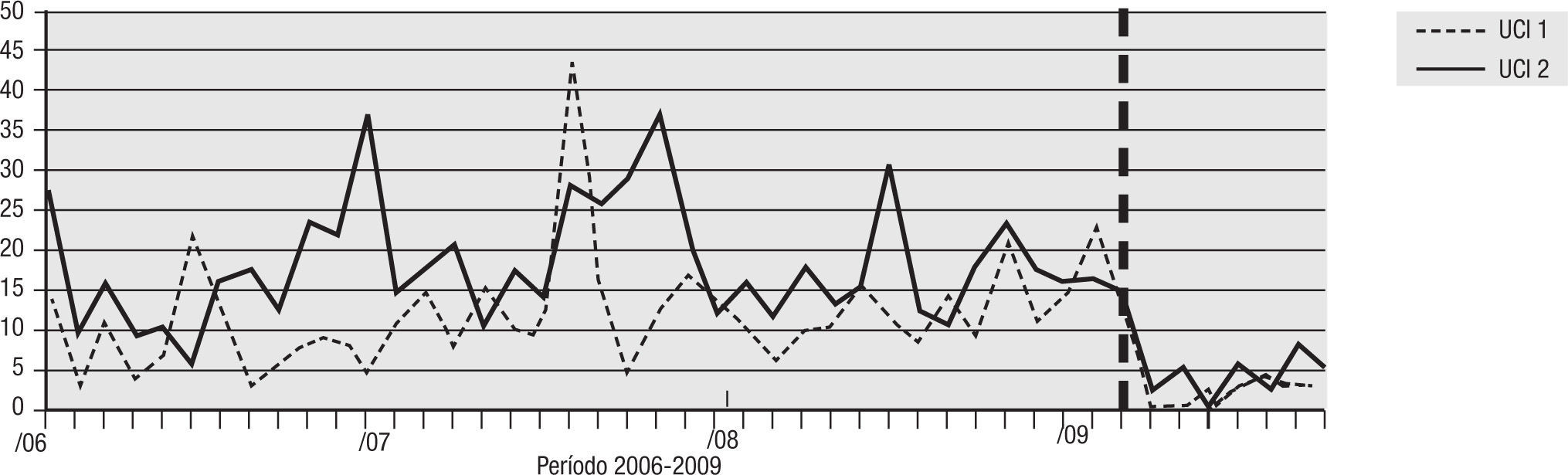
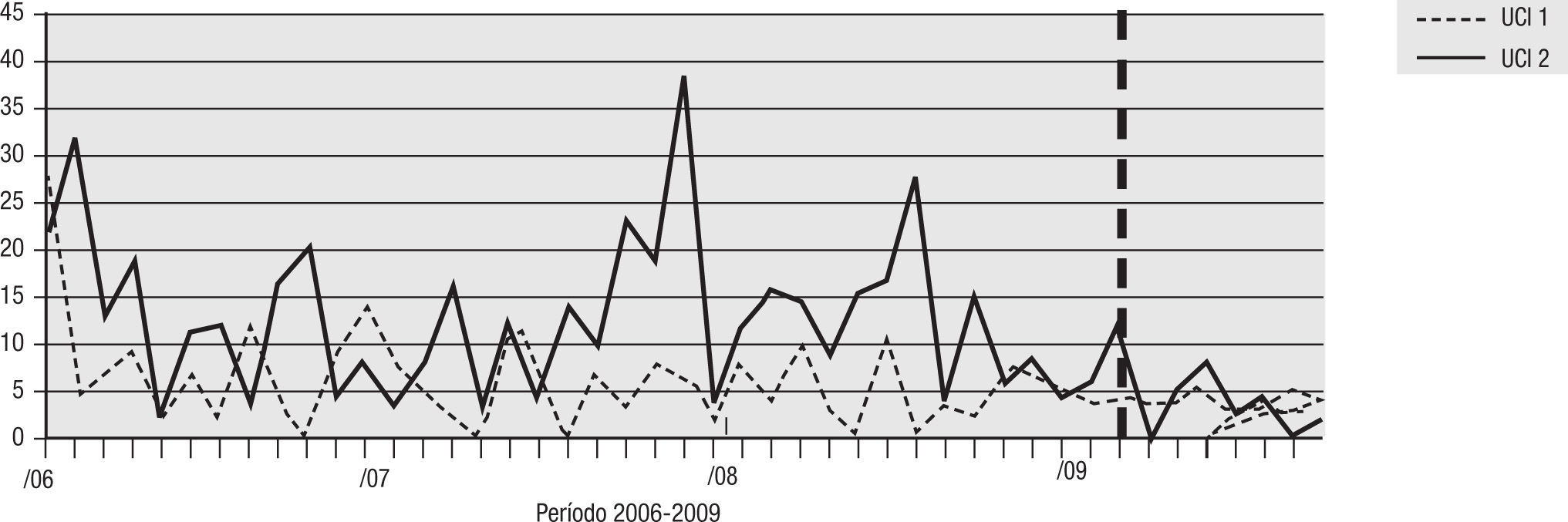
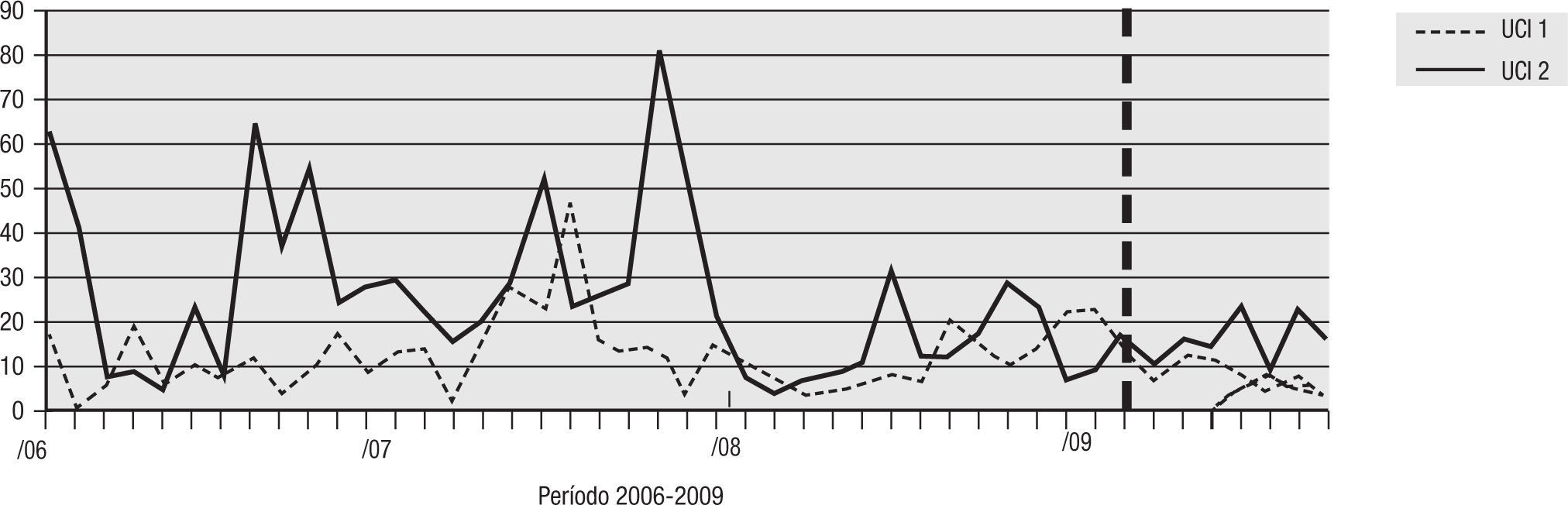
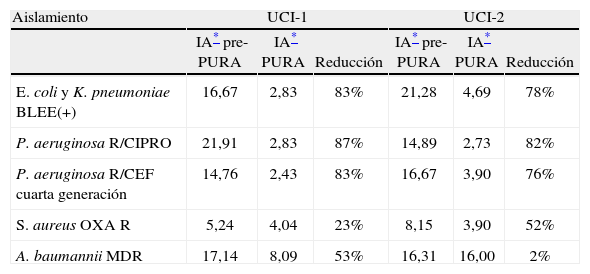
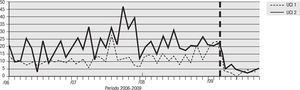
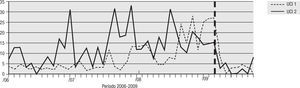
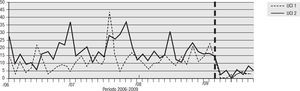
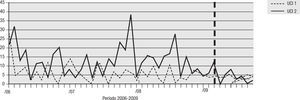
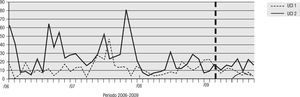
Para el análisis del impacto en la reducción de la infección por microorganismo específico, se graficó la tendencia de la incidencia acumulada mensual (2007–2009) para E. coli y K. pneumoniae BLEE (+), P. aeruginosa resistente a quinolonas y cefalosporinas de cuarta generación, S. aureus resistente a oxacilina y A. baumannii multirresistente (figs. 1–5). Se presentó una reducción significativa en l incidencia de infección por E. coli y K. pneumoniaeBLEE (+), P. aeruginosa resistente a ciprofloxacina y cefalosporinas de cuarta generación en ambas UCI (tabla 3). De acuerdo con el comportamiento de la infección por micro-organismos específicos en E. coli y K. pneumoniae BLEE (+), P. aeruginosa resistente a ciprofloxacina y cefalosporinas de tercera generación, se observa que la reducción de la incidencia no es acorde con la tendencia, lo cual sugiere que esta disminución en la incidencia de infección no es secundaria al comportamiento histórico de la misma. Para A. baumannii multiresistente y S. aureus resistente a oxacilina, esta reducción forma parte del comportamiento normal de la infección para ambas UCI en el tiempo.
Comportamiento de la infeccion por microorganismo especifico pre y posintervención del programa de uso regulado de antibióticos en la unidad de cuidados intensivos 1 y 2 del Hospital Universitario del Valle
| Aislamiento | UCI-1 | UCI-2 | ||||
| IA* pre-PURA | IA* PURA | Reducción | IA* pre-PURA | IA* PURA | Reducción | |
| E. coli y K. pneumoniae BLEE(+) | 16,67 | 2,83 | 83% | 21,28 | 4,69 | 78% |
| P. aeruginosa R/CIPRO | 21,91 | 2,83 | 87% | 14,89 | 2,73 | 82% |
| P. aeruginosa R/CEF cuarta generación | 14,76 | 2,43 | 83% | 16,67 | 3,90 | 76% |
| S. aureus OXA R | 5,24 | 4,04 | 23% | 8,15 | 3,90 | 52% |
| A. baumannii MDR | 17,14 | 8,09 | 53% | 16,31 | 16,00 | 2% |
Existen múltiples referencias en la literatura con recomendaciones variadas para el control de la resistencia bacteriana y uso apropiado de antibióticos14,15. Caracterizar la infección conociendo específicamente la ecología bacteriana, los patrones de resistencia y las infecciones más prevalentes permite crear estrategias específicas de control epidemiológico, el cual, aunado a un PURA garantiza un impacto en la reducción en el consumo antibiótico, siendo el control con restricción de uso de antibióticos inapropiados, por un lado, y la sugerencia de cambio por experto, por otro, el factor modificable más importante en la práctica de uso de antibióticos en una institución. Previamente, se ha reportado que estrategias que incluyan solo educación o guías de antibioticoterapia, sin restricción ni control, no resultan eficaces en un programa de uso racional de antibióticos16–22.
El presente estudio muestra cómo una estrategia conformada por el análisis de la ecología hospitalaria, la educación al personal médico y el control en la formulación antibiótica reduce, no solo el consumo antibiótico y los costos, sino también infecciones por microorganismos multirresistentes, cuya aparición es secundaria en gran proporción al uso inapropiado de antibióticos23–26. Es llamativo el gran incremento en el consumo de betalactámicos y cefalosporinas de cuarta generación, el cual no impactó de forma negativa en la aparición de la multirresistencia. Este potencial efecto protector en la selección de la resistencia bacteriana deberá analizarse en profundidad.
La literatura sugiere que para disminuir la infección por cocos grampositivos (S. aureus) como para A. baumannii es necesario hacer uso de otras estrategias como campañas de higiene de manos y aislamiento de contacto. Esta puede ser la razón por la cual para la infección por estos 2 microorganismos en especial no se observaron cambios en la tendencia.
ConclusiónCon base en los presentes hallazgos, se sugiere la elaboración de una estrategia en los hospitales para combatir el uso indiscriminado de antibióticos y la resistencia bacteriana, constituida por guías basadas en los patrones microbiológicos de cada entidad de salud, la restricción en el uso de antibióticos y un sistema de vigilancia y monitoria permanente a la formulación. De esta forma, se promovería un cambió conductual basado en la educación del personal médico sobre el uso antibiótico adecuado y procedimental, vigilando estrictamente cada consumo.
A la Dirección General y Médica del Hospital Universitario del Valle por su apoyo incondicional en la implementación del PURA. Al equipo de trabajo de epidemiología hospitalaria –Comité de Infecciones- y al Laboratorio de Microbiología del Hospital Universitario del Valle.
Conflicto de interesesLos autores manifiestan que no tienen conflictos de intereses para la publicación de este artículo.