La excreción renal es uno de los principales mecanismos para la eliminación de medicamentos, lo cual convierte a los riñones en blanco frecuente de lesión. Distintos medicamentos han sido asociados a desarrollo de insuficiencia renal aguda. El aciclovir es un antiviral altamente efectivo en el tratamiento de infecciones por virus del complejo Herpesviridae y puede causar daño renal agudo por depósito de cristales en los túbulos contorneados distales. Se presenta el caso de un paciente, quien desarrolla insuficiencia renal aguda secundaria probablemente a tratamiento con aciclovir intravenoso administrado para manejo de herpes zóster facial.
Renal excretion is one of the main mechanisms for the elimination of drugs, which makes the kidneys a frequent target of injury. Various drugs have been associated with development of acute renal failure. Acyclovir is an antiviral highly effective in the treatment of herpes virus infections and can cause acute kidney damage for crystal deposition in the distal convoluted tubules. Here we present a case report on a patient who developed acute renal failure likely due to intravenous acyclovir administered for the treatment of facial herpes zoster.
Los riñones son un blanco frecuente de muchos medicamentos que usados en la práctica médica rutinaria pueden producir alteración estructural y funcional1,2. Al ser la función renal uno de los mecanismos más importantes de eliminación de medicamentos, los riñones son particularmente susceptibles a la lesión inducida por estos2. Innumerables agentes terapéuticos pueden inducir insuficiencia renal aguda (IRA) a través de diversos mecanismos1. La nefritis intersticial aguda se cree que se desarrolla a partir de medicamentos que producen una reacción de hipersensibilidad. La necrosis tubular aguda es un proceso dosis-dependiente que se desarrolla por toxicidad directa sobre el epitelio tubular. Adicionalmente, se puede presentar nefropatía por depósito de cristales, nefropatía osmótica y nefrocalcinosis aguda. La disfunción renal por depósito de cristales ocurre por su precipitación en la luz del túbulo distal debido a su relativa insolubilidad en la orina humana. La nefropatía por cristales puede ser causada por varios medicamentos entre ellos aciclovir, sulfonamidas, metotrexato, triamtereno1,3. La IRA tras las aplicación intravenosa (iv) de aciclovir es a menudo un efecto adverso subestimado.
Caso clínicoUn paciente de sexo masculino de 68 años de edad consulta al servicio de urgencias por cuadro clínico de 8 días de evolución que comienza con eritema en lado izquierdo de la cara, de predominio en región frontal y periocular, asociado a dolor urente, edema y lesiones papulovesiculares, sin fiebre ni otros síntomas acompañantes. Tres días después, inició manejo con aciclovir 800mg vía oral cada 4 h, aciclovir ungüento dermatológico 4 veces/día, aciclovir ungüento oftalmológico 3 veces/día, sin embargo, por no mejoría de lesiones, consultó nuevamente.
Antecedentes personales: hipertensión arterial (HTA) en manejo con amlodipino 10mg/día, losartán 200mg/día. Niega antecedentes quirúrgicos y toxicoalérgicos. Niega consumo de otros medicamentos o sustancias tóxicas. Al examen físico del ingreso: en buenas condiciones generales, hidratado, consciente, afebril. Tensión arterial: 132/72mmHg; frecuencia respiratoria: 18 por min; frecuencia cardíaca: 85 por min; temperatura: 36,5°C; peso: 88kg; SaO2: 96%; piel: en región frontal izquierda presentaba lesión de aproximadamente 5cm2, abundantes papulovesículas, sobre una base eritematosa, acompañada de calor local. Ojos: edema periocular severo, eritema, calor local en párpados superior e inferior izquierdos, apertura ocular limitada, hiperemia conjuntival leve, secreción purulenta en moderada cantidad. Sin signos de impetiginización. Otoscopia: normal. Neurológico: sin signos de déficit o compromiso neurológico. Resto de examen físico sin alteraciones. El tratamiento inicial incluyó: dieta con bajo contenido de sal, manejo antibiótico con ceftriaxona 2 g iv/día, aciclovir 880mg iv/8 h (10mg/kg/8 h) y aciclovir para uso tópico. Además se continuó el manejo de la HTA con los mismos medicamentos ambulatorios.
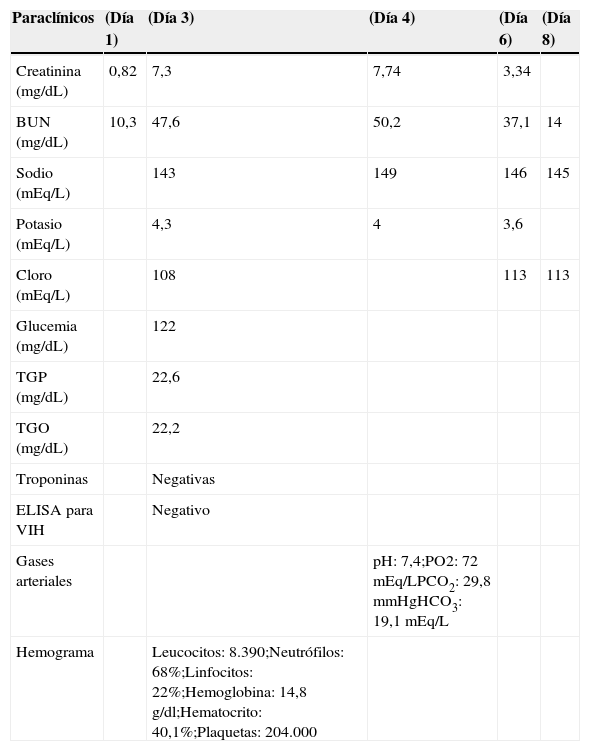
Durante los primeros 2 días de hospitalización el paciente presentó una evolución adecuada de su condición: disminución de edema, de signos inflamatorios locales, lesiones en piel y de secreción conjuntival. Después de 48 h del ingreso, empezó con astenia y adinamia progresiva, acompañadas por vértigo y posteriormente presentó un episodio de lipotimia. Se realizaron estudios en sangre, en líquido cefalorraquídeo, un electrocardiograma e imágenes (tomografía y resonancia magnética de cráneo), los cuales descartaron la presencia de evento cerebrovascular (tabla 1).
Resultados de los exámenes paraclínicos realizados a un paciente con insuficiencia renal aguda asociada a aciclovir, Colombia, 2013
| Paraclínicos | (Día 1) | (Día 3) | (Día 4) | (Día 6) | (Día 8) |
|---|---|---|---|---|---|
| Creatinina (mg/dL) | 0,82 | 7,3 | 7,74 | 3,34 | |
| BUN (mg/dL) | 10,3 | 47,6 | 50,2 | 37,1 | 14 |
| Sodio (mEq/L) | 143 | 149 | 146 | 145 | |
| Potasio (mEq/L) | 4,3 | 4 | 3,6 | ||
| Cloro (mEq/L) | 108 | 113 | 113 | ||
| Glucemia (mg/dL) | 122 | ||||
| TGP (mg/dL) | 22,6 | ||||
| TGO (mg/dL) | 22,2 | ||||
| Troponinas | Negativas | ||||
| ELISA para VIH | Negativo | ||||
| Gases arteriales | pH: 7,4;PO2: 72 mEq/LPCO2: 29,8 mmHgHCO3: 19,1 mEq/L | ||||
| Hemograma | Leucocitos: 8.390;Neutrófilos: 68%;Linfocitos: 22%;Hemoglobina: 14,8 g/dl;Hematocrito: 40,1%;Plaquetas: 204.000 |
Se consideró que el paciente presentaba cuadro de IRA posiblemente secundario a precipitación tubular de cristales de aciclovir. La conducta adoptada ante tal evento incluyó: hidratación con líquidos iv isotónicos a razón de 100-150 cc/h por bomba de infusión, suspensión de aciclovir iv, solicitud de ayudas paraclínicas adicionales (gases arteriales, control de creatinina, nitrógeno ureico [BUN], potasio y sodio séricos) y controles periódicos.
Durante los días siguientes la evolución del paciente fue favorable: presentó estabilidad hemodinámica, resolución significativa de las lesiones cutáneas y recuperación neurológica. Los marcadores de control de función renal mostraron una disminución progresiva de valores séricos. El seguimiento posterior del paciente reveló la resolución completa del cuadro, estabilización hemodinámica y neurológica y del gasto urinario con pruebas de función renal normales.
DiscusiónEste reporte describe el caso de un paciente de 68 años de edad, hipertenso en tratamiento, sin deterioro renal previo quien desarrolla IRA posterior a la aplicación de aciclovir iv prescrito para manejo de herpes zóster facial.
El aciclovir es un agente antiviral, altamente efectivo en la inhibición de la replicación del virus del herpes simplex I y II y varicela zóster, se distribuye en varios tejidos y fluidos corporales, pero se acumula especialmente en pulmón y riñón1,2,4,5. Debido a su rápida depuración desde el plasma, altas concentraciones del medicamento pueden encontrarse en la luz tubular. La excreción renal del aciclovir a través de filtración glomerular y secreción tubular representa aproximadamente el 62,0-91,0% de su eliminación1,4,5. Es muy poco soluble en orina, la mayor parte del agente se excreta en su forma original y tiende a depositarse en forma de cristales en los túbulos renales contorneados distales. El aciclovir tanto parenteral como oral puede inducir IRA, un efecto secundario a menudo subestimado1–3,6,7 y aunque su incidencia tras la aplicación iv se considera entre el 5,0 y el 19,0% de los pacientes, los reportes en la literatura originados en el país y en América Latina son escasos, lo cual hace relevante que se llame la atención sobre este riesgo2.
La creatinina y el BUN de ingreso del paciente eran normales. Aproximadamente 48 h después de iniciar el manejo con aciclovir presentó síntomas sistémicos y alteración de la conciencia, lo cual llevó a realizar exámenes complementarios que revelaron alteración específica y marcada de las pruebas de función renal. De acuerdo con los criterios establecidos por el algoritmo de Naranjo et al. para establecer la asociación de causalidad entre el medicamento y la reacción adversa, esta se calificó como probable (7 puntos) y fue clasificada como grave por el compromiso severo que presentó el paciente8. El diagnóstico fue sugerido además por los hallazgos clínicos y paraclínicos relacionados con el tiempo transcurrido tras la administración y suspensión del medicamento.
La IRA inducida por aciclovir se plantea que es debida a la obstrucción renal asociada al depósito de microcristales en túbulos renales lo cual produce edema, hemorragia intersticial y disminución en la tasa de filtración glomerular, mientras la precipitación severa intraparenquimatosa puede afectar la red venosa y causar un aumento en la resistencia al flujo sanguíneo renal y la subsecuente elevación de la creatinina1,6,7,9.
En ocasiones, el aciclovir puede ser causa de nefritis intersticial y necrosis tubular directa generando igualmente insuficiencia renal3,7. La nefropatía por cristales suele ser asintomática, pero puede asociarse con náuseas, vómitos y dolor abdominal o en flancos, secundario al edema producido por la obstrucción intratubular1,2,4,9,10. La IRA asociada a aciclovir a menudo ocurre dentro de las 24-48 h siguientes a la administración del medicamento1,2,4,9.
Debe considerarse que el paciente no reportaba antecedente de daño renal preexistente. Al ingreso sus condiciones de salud fueron adecuadas, no presentaba signos de deshidratación ni de afección sistémica. El medicamento antiviral fue prescrito a dosis apropiadas y se indicó para administración iv, en un tiempo aproximado de 60 min. Algunos autores han identificado los factores de riesgo que se asocian con la precipitación y daño ocasionado por aciclovir, entre ellos, la administración en bolo de altas dosis que eleva el riesgo de IRA hasta un 48,0%, la disminución del volumen sanguíneo circulante efectivo, la deshidratación, la edad avanzada y el daño renal previo1–4,6,9. Se ha reconocido que su aplicación lenta iv durante 1-2 h reduce las altas concentraciones de aciclovir en la luz tubular y el riesgo de IRA1–5.
Un grupo de medidas que deben aplicarse a todo paciente con el objetivo de disminuir la probabilidad de causar toxicidad y lesión renal por medicamentos incluye: evitar la infusión en bolo; realizar reposición de volumen en el paciente deshidratado e inducir altas tasas de gasto urinario (100 a 150ml/h) antes de la infusión del medicamento1–3,5 y ajustar la dosis en pacientes de edad o con insuficiencia renal subyacente1,3,6.
Una vez que la toxicidad renal se establece, el manejo general incluye la suspensión del tratamiento antiviral y medidas de soporte (ajuste de las dosis de medicación, control metabólico y de líquidos), e inducción de diuresis con un diurético de asa3,5,7. Las medidas instauradas en este paciente reflejaron la mejoría clínica y la resolución del daño renal.
Se ha visto que el pronóstico de la IRA asociada a aciclovir depende de la detección temprana y la suspensión oportuna del fármaco6. La mayoría de pacientes recuperan su función renal en pocos días, no obstante un pequeña proporción de ellos puede desarrollar insuficiencia renal avanzada e incluso crónica con requerimiento de hemodiálisis1,2,5,9.
En conclusión, el paciente desarrolló IRA, de acuerdo al algoritmo de casualidad, probablemente asociada al depósito de cristales de aciclovir a nivel tubular, lo cual se apoya en la aparición de síntomas y la alteración de marcadores de función renal en el periodo inmediato luego de la administración del medicamento, la ausencia de otras causas probables y la resolución del cuadro después de la suspensión del medicamento y el establecimiento de medidas específicas para este tipo de casos.
Debido a la escasa notificación de casos en Colombia y América Latina es importante mostrar el riesgo, las manifestaciones y el manejo oportuno para evitar consecuencias graves sobre la función renal de los pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo recibió financiación de la Universidad Tecnológica de Pereira y de Audifarma S.A.
Conflicto de interesesLos autores manifiestan que no tienen ningún conflicto de intereses.