El dengue es la enfermedad viral transmitida por mosquitos más importante en el mundo. Alrededor del 10% de los pacientes con dengue, pueden presentar alteraciones neurológicas durante o después de la infección, asociadas a la replicación viral en el tejido, a la respuesta inmunológica local, a la disfunción endotelial y a signos hemorrágicos en el tejido. En muchos de estos casos se ha detectado virus o anticuerpos en el tejido, sugiriendo la invasión del virus al encéfalo, sin embargo, no siempre es posible hacer esta relación, dando origen a una gran pregunta: ¿son los daños del tejido nervioso producto de una encefalopatía asociada a disfunción extraneural o son debidos a la infección misma del tejido? Como sigue siendo controversial la interpretación de los signos neurológicos durante el dengue, a continuación presentamos algunas generalidades del virus, sus forma clínicas y algunas evidencias clínicas y experimentales que intentan explicar y asociar la neuroinfección y la neuropatogenia por DENV.
Dengue is the most important viral infection transmitted by arthropods in the world. Some studies report that about 10% of dengue or severe dengue patients present neurological symptoms and these signs could be related with nervous system viral replication, immune response and endothelial or metabolic dysfunction in neural or extraneural tissues. These nervous system signs are more frequent in endemic zones and in some patients, viruses or specific antibodies can be detected in the brain, suggesting a direct neural invasion. However, in other cases we cannot establish a direct relationship, begging the question: are the neurological signs and nervous tissue damage secondary to extraneural organ dysfunction or are these changes related to viral replication in the brain? Given the controversy, this review is intended to present some general information on the dengue virus, the clinical characteristics of the disease and current evidence on the neurological manifestations. In addition, we will present experimental evidence to explain the dengue virus neuroinfection and neuropathogenesis.
La palabra española “dengue”, sinónimo de afección, melindre ó remilgo; proviene del vocablo Swahili ka dinga pepo, que significa espasmo muscular producido por los malos espíritus1. En 1839 se acogió la palabra dengue para referir la enfermedad que hoy conocemos y en 1906 se evidenció que ésta era producida por un arbovirus (arthropod borne virus) y transmitida por la picadura del mosquito Aedes2,3.
La OMS ha estimado que ocurren entre 50 a 100 millones de casos de dengue en el mundo cada año, siendo la principal arbovirosis humana en la actualidad. Mundialmente, las zonas más afectadas por el virus de dengue (DENV, acrónimo oficial) son el suroriente asiático, el occidente del Pacífico y las Américas, por lo cual más de 3000 millones de personas en el mundo se encuentran en riesgo de contraer la infección4.
Colombia, es uno de los países de Latinoamérica con más altas tasas anuales de dengue, debido a que en la mayor parte del territorio nacional circulan tanto el vector como los cuatro serotipos del virus (DENV 1 al 4), siendo los más frecuentes el DENV 1 y 2. El cambio climático, el aumento en la resistencia a los insecticidas o larvicidas de mayor uso (Temefos)5 y la falta de acueducto y alcantarillado en varias de las poblaciones endémicas, ha favorecido el aumento de casos por dengue en el país, haciendo de esta enfermedad un serio problema de salud pública. En cifras, en el 2005 se notificaron 43.257 casos y 48 defunciones en el país6, mientras que en el 2010 se reportaron 157.202 casos, de los cuales 9.776 fueron de dengue grave con 217 fallecidos, lo que muestra el alarmante incremento de la enfermedad en solo 5 años7. Para julio de 2013, se habían notificado 47.866 casos de dengue, de los cuales 1.127 correspondieron a dengue grave con un 5,8% de letalidad, siendo la población más vulnerable los recién nacidos y los menores de 15 años, esto demuestra la crítica situación de endemicidad en el país8.
Se estima que alrededor del 10% de los pacientes con dengue, pueden presentar alteraciones neurológicas durante o después de la infección, lo que sugiere que el virus puede inducir disfunción neurológica, ya sea directamente al invadir e infectar el tejido nervioso o indirectamente al afectar otros órganos que repercuten en la función nerviosa. Esto ultimo reafirma la necesidad de incluir a las manifestaciones neurológicas, como un criterio de severidad asociado a la infección, tal como lo sugiere la WHO desde el 20094. Por lo tanto, a continuación se presenta en esta revisión de tema, las generalidades de la infección por DENV, las formas clínicas y las alteraciones neurológicas reportadas en diferentes partes del mundo, además se presentan algunos de los modelos experimentales que intentan explicar la neuropatogenia asociada a la infección.
GeneralidadesEl DENV, hace parte del genero Flavivirus, al cual pertenecen el virus del Nilo Occidental (WNV), el virus de la Fiebre Amarilla (YFV), el virus de la Encefalitis Japonesa (JEV), el virus de la Encefalitis de Murray Valley (MVEV), el virus de la Encefalitis transmitida por garrapatas (TBEV), el Virus de la Encefalitis rusa de primavera y verano, el Virus de Poswassan y el virus de la Encefalitis de San Luis (SLEV), todos ellos implicados en infecciones y alteraciones neurológicas9. El DENV, es un virus icosaédrico de 50nm de diámetro, con envoltura lipídica y una única hebra de RNA genómico de cadena sencilla y sentido positivo de aproximadamente 11.000 bases con un extremo 5′ tipo I y un extremo 3′ carente de poli-adeninas10. La replicación viral es citoplasmática, aunque algunos eventos (poco esclarecidos) suceden en el núcleo11. Por su parte, la traducción del RNA viral sucede en el retículo endoplásmico rugoso y produce una poliproteína que, por clivaje co-traduccional, da origen a 3 proteínas estructurales, cápside (core, C), la proteína precursora asociada a la membrana (prM) y la proteína de la envoltura (E) y a 7 proteínas no estructurales (NS, non structural) denominadas NS1, NS2A, NS2B, NS3, NS4A, NS4B y NS512.
La propagación del virus, es posible gracias a un ciclo de transmisión humano-mosquito-humano. El principal vector del virus es la hembra del genero Aedes aegypti que luego de consumir sangre infectada, permite la replicación del virus en su intestino y glándulas salivares por 8-12 días, para transmitirlo de nuevo al alimentarse. Luego de la inoculación en un nuevo hospedero, se presenta un periodo de incubación que va de 2 a 7 días antes del inicio de los síntomas12.
Formas clínicasLa infección por cualquier serotipo DENV, induce un amplio espectro de manifestaciones que van desde la ausencia de síntomas hasta la muerte. Aunque un gran porcentaje de los casos son asintomáticos, en los casos sintomáticos, la severidad del cuadro clínico podría depender de factores como el serotipo viral, la virulencia de la cepa, del estado nutricional, los factores genéticos del hospedero y la historia de infecciones previas con otros serotipos de DENV. Después de la picadura del mosquito en un individuo susceptible, transcurre un periodo de incubación de 2 a 7 días durante el cual el virus se localiza y se replica en los ganglios linfáticos, el bazo y el hígado, luego pasa hasta la sangre (fase de viremia) para infectar leucocitos y otros tejidos linfáticos. En este momento aparecen los signos y síntomas característicos, que pueden identificarse clínicamente como: Fase febril, Fase crítica y Fase de recuperación13.
- -
Fase febril: Después del periodo de incubación que coincide con el periodo de viremia, el dengue comienza con fiebre alta de inicio súbito, escalofrío, cefalea y dolor retro-ocular. Las mialgias, artralgias y dolor lumbar son característicos de esta etapa temprana de la enfermedad. Puede haber edema palpebral, enrojecimiento facial y congestión conjuntival, anorexia y astenia, exantema macular o morbiliforme y manifestaciones hemorrágicas espontáneas menores como sangrado nasal, gingival y petequias14. En general, estos signos son inespecíficos y hace difícil el diagnóstico preciso, si no se hace la investigación del caso en el laboratorio.
- -
Fase Crítica: Hacia el día 4 o 5 de enfermedad, la fiebre disminuye (defervescencia) y se inicia la fase critica que puede durar hasta 3 días. En este momento, el signo clave para identificar el riesgo de complicaciones es la fuga plasmática. Una proporción alta de pacientes presentan cambios en la permeabilidad capilar con signos clínicos y de laboratorio como el aumento del hematocrito, edema y linfopenia. Estos últimos hacen posible identificar los “signos de alarma”, que pueden predecir el inicio de un cuadro de dengue grave, acompañado de signos como dolor abdominal intenso y persistente, más de tres episodios de vomito diarios, hipotermia súbita, decaimiento, irritabilidad, somnolencia y plaquetopenia. Además del sangrado en mucosas (gingivorragia, epistaxis, sangrado gástrico), es frecuente la metrorragia que se confunde con sangrado menstrual. En el examen clínico se puede sospechar la existencia de derrame pleural o ascitis, pero deben ser evaluados con imágenes diagnósticas15.
Muchos pacientes con dengue grave no presentan signos de alarma, pero pueden presentar alteraciones funcionales en algún órgano vital. Por otra parte, un porcentaje bajo de pacientes con dengue con o sin signos de alarma, pueden evolucionar hacia la forma grave de la enfermedad. En esta fase crítica, es cuando se puede hacer el diagnóstico del dengue grave, propuesto en la nueva clasificación de la OMS y que propone la instauración de medidas de control mas acordes con la evolución del paciente.
A continuación, hacemos una descripción del dengue grave y sus complicaciones:
- -
Dengue grave: Se presenta debido fundamentalmente a la extravasación de plasma hacia el intersticio, a la desregulación en la coagulación y al daño tisular (puede ser hepático, miocárdico o nervioso). De acuerdo a los nuevos criterios para el diagnóstico del dengue, se considera un paciente con dengue grave cuando, presenta una o más de las siguientes complicaciones después de la fase febril (con o sin signos de alarma):
- a.
Hipotensión o Choque: Que se puede presentar con taquicardia y vasoconstricción periférica, retraso en el llenado capilar y extremidades frías. Ocurre una disminución en la diferencia entre presión arterial sistólica y diastólica (que puede ser menor a 20mm Hg).
- b.
Sangrado mayor: Debido a la disfunción en el sistema coagulatorio, se presentan sangrados mayores, principalmente hematemesis, que puede evolucionar hacia una falla orgánica múltiple y coagulación intravascular diseminada.
- c.
Lesiones severas de órgano: Las afecciones de otros órganos, se consideraban anteriormente como “manifestaciones inusuales” del dengue, que pueden resultar del daño directo por el virus o indirecto por la respuesta inmunológica anormal. La alteración funcional de un solo órgano afectado, así no se presenten otras manifestaciones, permite clasificar el caso como “dengue grave” y los signos que principalmente aparecen, son hepatopatía, miocardiopatía, encefalopatía o encefalitis, que frecuentemente están asociados a fatalidad16.
La intervención médica temprana asociada a un proceso de rehidratación parenteral, reduce las tasas de fatalidad, sin embargo uno de los inconvenientes más críticos en el tratamiento, es la dificultad de identificar en las etapas tempranas de la enfermedad aquellos casos que se complicarán hacia formas graves y desarrollarán condiciones mórbidas más severas. Finalmente, la mayor parte de los casos de dengue o de dengue grave pasan a la fase llamada de recuperación.
- a.
- -
Fase de recuperación: Después que ha pasado la fase crítica de la enfermedad (que dura máximo 3 días desde el inicio de la defervescencia), el paciente mejora su estado general y desaparecen los dolores y la astenia. Los síntomas gastrointestinales desaparecen y se estabiliza la presión arterial. En algunos casos aparece un exantema generalizado con manchas blancas, que es característico de esta fase. Los valores de plaquetas, hematocrito y leucocitos se normalizan y el paciente se recupera completamente17.
Varios autores han reportado que aproximadamente el 20% de los casos de dengue grave (anteriormente fiebre hemorrágica por dengue), se presentan con alteraciones en órganos vitales18.
Las de mayor frecuencia, corresponden a manifestaciones hepáticas severas19, evidenciadas por una elevación en la concentración de las enzimas hepáticas (ALT/AST >1000 UI/L), acompañada de un aumento en el tiempo de protrombina y otros signos como encefalopatía metabólica, ictericia y colecistitis alitiasica. Las alteraciones cardiacas se presentan con bradicardia o taquicardia supraventricular, inversión de la onda T y disfunción ventricular (disminución de la fracción de eyección del ventrículo izquierdo)20. En un bajo porcentaje de pacientes con dengue grave (aproximadamente el 3%), se ha reportado falla renal aguda asociada a altas tasas de mortalidad, principalmente en aquellos pacientes en choque por dengue, que han tenido un diagnóstico previo de insuficiencia renal o hemorragias gastrointestinales21.
Respecto a las manifestaciones nerviosas, existe una gran controversia acerca de si los signos neurológicos asociados a la infección por DENV, son debidos a la infección directa en el tejido nervioso, o si estos son el resultado de la disfunción nerviosa asociada a daños ó fallas en órganos extraneurales (p. ej. encefalopatía hepática), ó a la presencia y circulación constante de mediadores inflamatorios sistémicos o metabolitos aumentados por la infección, que modulan la función neurológica22. El diagnóstico correcto de estas presentaciones, requiere de análisis clínicos y paraclínicos completos y del uso de imagenología compleja, sin embargo éstos casi nunca se hacen.
En el curso de las investigaciones sobre la etiopatogenia de las manifestaciones neurológicas del dengue, se pensó inicialmente que los anticuerpos anti-dengue, serían los directos responsables del compromiso neurológico en los individuos afectados y que la encefalopatía era resultado de la fuga plasmática hacia espacios serosos, hemorragia, shock y desórdenes metabólicos en el tejido nervioso23,24. Sin embargo, una vez se constató la presencia de RNA o antígenos virales en el LCR25, se trató de identificar el mecanismo mediante el cual, el virus alcanzaba el tejido nervioso y generaba encefalitis, lo cual indefectiblemente podría sugerir que algunas veces el DENV tuviera propiedades de neurovirulencia.
Los signos de alteraciones neurológicas que más frecuentemente se reportan son letargía, coma y convulsiones, sin embargo, algunos pacientes reportan otro tipo de complicaciones como encefalitis, que se define como la inflamación del parénquima cerebral, asociada a una infección por patógenos neurotrópicos induciendo fiebre, disminución de la conciencia, cefaleas, convulsiones y signos focales. Mientras que la encefalopatía, corresponde a un cuadro clínico que induce la disminución de la conciencia asociada a infecciones o alteraciones extraneurales, a desordenes metabólicos o intoxicaciones por alcohol o medicamentos26. Las regiones del sistema nervioso (SN) que pueden verse directamente comprometidas por la infección con dengue son varias. Al respecto Yeo et al., reportaron un caso en un paciente de 25 años de edad con encefalitis hipocampal caracterizada por amnesia retrógrada, sin compromiso de la barrera hematoencefálica (BHE), según los resultados de resonancia magnética nuclear27. Esto permitió postular que la encefalitis ocurrió como consecuencia de invasión directa del DENV al cerebro, algo similar se reportó en un caso fatal, donde se detectó antígeno viral en el núcleo olivar inferior de la médula y en la capa granular del cerebelo28.
En la médula espinal, las neuronas del asta anterior parecen ser más susceptibles que las del asta lateral y posterior29. Adicionalmente en 2008 se describió un primer caso de neuropatía del frénico asociada a DENV, con parálisis diafragmática, definida por la disminución en la amplitud de la velocidad de neuroconducción30.
A continuación, se presentan algunas de las evidencias clínicas sobre las manifestaciones neurológicas del dengue y su impacto en el diagnóstico y pronóstico en la actualidad.
Presentación de casos con alteraciones neurológicas asociadas a la infeccion por dengueSe estima que alrededor del 10% (cifra que puede estar subestimada) de los pacientes con dengue pueden presentar manifestaciones neurológicas31. En el transcurso de la infección, la cefalea y el vómito (éste último especialmente en niños) son las manifestaciones neurológicas más frecuentes, aún en ausencia de otras. La cefalea, de predominio frontal, se presenta en el 98% de los pacientes y es considerada como un criterio de diagnóstico para dengue y se presenta con mayor intensidad en pacientes con dengue con o sin signos de alarma, que en aquellos con dengue grave o hemorrágico32. Adicionalmente, el SN puede verse involucrado de manera subclínica (no por ello menos importante) posterior a la infección. Esto fue reportado por Cabrera et al., en un estudio en Cuba donde se demostró que el 44% de los pacientes con fiebre hemorrágica por dengue presentaron anormalidades electroencefalográficas en ausencia de manifestaciones neurológicas clínicas33.
Algunos casos de dengue grave presentan alteraciones neurológicas como desórdenes del comportamiento (trastornos del ánimo con características maniacas y depresión)34. En otros pacientes, se presentan encefalitis, encefalopatias35, convulsiones, mielitis transversa36, polineuropatías, parálisis flácida37, síndrome de Guillain-Barré38, pérdida de memoria a corto plazo, herniación de amígdalas cerebelosas, parálisis de pares craneales, meningitis, síndrome de Reyé38, hemorragia subaracnoidea, síndrome de Millar-Fisher, leucoencefalitis perivenosa, entre otras39,40. Esto demuestra claramente, que la sintomatología y signología de las alteraciones neurológicas son variadas y en algunos casos, estos signos pueden pasar inadvertidos en el diagnóstico y llegar a ser fatales. Adicionalmente, la fisiopatología de estas complicaciones, puede ser debida a fenómenos aislados o asociados como encefalopatía portosistémica, anoxia cerebral, hemorragia microcapilar, liberación de productos tóxicos28, edema, congestión vascular e infiltración linfocítica perivascular25.
Hoy en día se reconoce que las manifestaciones neurológicas durante las infecciones por DENV, pueden ocurrir en cualquier caso y como resultado de la infección con cualquier serotipo41. A pesar de que se sabe poco acerca de los mecanismos que favorecen la infección del SN central por parte del DENV, se propone que la edad de los individuos, los antecedentes genéticos, las infecciones previas por serotipos o genotipos de DENV diferentes, y el estado inmunológico, podrían explicar la habilidad del virus para invadir el SN42. Adicionalmente, las manifestaciones neurológicas causadas por los flavivirus, pueden depender del sitio afectado en el SN: las meninges (causan meningitis), el parénquima cerebral (encefalitis) o la médula espinal (mielitis)43.
La asociación entre el diagnostico de alteraciones neurológicas (consideradas atípicas anteriormente por la OMS) y la infección por DENV, sugiere en primera instancia cambios en el perfil de la enfermedad debidos probablemente a variaciones en el tropismo del virus, que promueven su interacción con diferentes tipos de moléculas y células receptoras. Esto resalta la necesidad de conocer más sobre el virus y los posibles mecanismos que está utilizando para infectar diferentes tipos celulares y tejidos42–44. Varios reportes en todo el mundo, han documentado el aislamiento de DENV a partir de LCR o de tejido nervioso y la detección de anticuerpos anti-dengue, que apoyan la tesis de que el virus es capaz de invadir, en algunas ocasiones el SN. La frecuencia de la infección por DENV asociada a manifestaciones multisistémicas, entre ellas las neurológicas, aún no está bien definida45, sin embargo varios equipos de investigación en el mundo se han dedicado a estudiar y reportar, los hechos relevantes de dicha sintomatología causada por DENV en los países endémicos.
El primer reporte oficial en el mundo sobre fiebre rompehuesos con hemorragia, fue publicado por Rush en 1789 y da cuenta de la aparición en varios de los pacientes, de depresión profunda postinfección46. En 1924 se reportaron 13 casos de parálisis en un brote en el Pacifico Central y en Grecia en 1928, se diagnosticaron signos de encefalitis en casos fatales de dengue. Adicionalmente durante la II Guerra Mundial, se reportaron varios casos con parálisis, perdida de sensaciones, delirios, psicosis, depresión y demencia47.
Por otra parte, Kho et al., confirmaron por técnicas de virología clásica la presencia de virus y reportaron por primera vez el desarrollo de manifestaciones neurológicas (encefalopatía aguda) en 41 casos48. Posteriormente, se reportó en 21 de 30 casos fatales de dengue hemorrágico confirmados por laboratorio, alteraciones como somnolencia, encefalitis y convulsiones49.
Entre 1987 y 1998 Pancharoen y Thisyakorn estudiaron 1493 pacientes pediátricos con serología positiva para dengue y reportaron manifestaciones neurológicas en 5.4% de los niños, demostrando una vez más, que las alteraciones del SN se pueden presentar durante la infección por DENV50. En 1990, un estudio de 5 casos post mortem reveló en todos los cerebros estudiados: edema, congestión vascular y focos de hemorragia, sin embargo, solo un caso presentó infiltrado linfocítico perivascular, compatibles con una leucoencefalítis perivenosa. De acuerdo a esto, los autores sugieren que las manifestaciones neurológicas asociadas a DENV, pueden ser debidas a la respuesta inmunológica producida por la infección, favoreciendo el depósito de inmunocomplejos en el tejido y la subsecuente inflamación perivascular y no a la invasión directa del virus en el cerebro51. Tiempo después, en muestras obtenidas post mortem, se identificó en el parénquima cerebral antígeno viral por inmunohistoquímica52 y Nogueira et al., lograron aislar virus a partir de cerebro53.
Otros casos que demuestran la neuroinfección por DENV, fueron reportados por Lum et al. (1996) en una serie de 6 casos pediátricos que presentaron encefalitis y cambios electroencefalográficos que fueron confirmados para DENV por aislamiento viral, IgM y PCR en suero y LCR54. En otro estudio, Solomon et al., encontraron en Vietnam, que 16 pacientes (4,2%) de 378 que consultaron por enfermedad neurológica, fueron positivos para dengue por aislamiento viral, PCR, e inmunoglobulinas en el suero y LCR y se concluyó que la presencia del virus se debía probablemente a nuevas propiedades neurotrópicas y neurovirulentas del DENV55. Finalmente, en algunos casos fatales se encontraron macrófagos CD68+ infectados alojados en encéfalo, sugiriendo que la migración de macrófagos infectados hacia el tejido nervioso puede ser una de las vías utilizadas por el virus para alcanzar e infectar el SN52. Adicionalmente, la respuesta inmune pro-inflamatoria acompañada de vasculitis, puede facilitar el acceso del virus independientemente de células transportadoras, por los daños que ocurren en la permeabilidad de la BHE27, tal como lo sugiere Chaturvedi et al., en un modelo de infección en ratones56.
En Colombia, el equipo de Pediatría del Hospital Universitario de Santander en Bucaramanga, después de estudiar retrospectivamente más de 900 niños con dengue hemorrágico entre los años 1992 y 2004, reportaron que 168 de los niños presentaron manifestaciones atípicas del dengue. De estos, el 25% presentaron signos neurológicos (46 pacientes con encefalopatía y 3 con encefalitis) y mayores tasas de mortalidad41,57. En ese momento, los resultados permitieron proponer que la presencia de manifestaciones neurológicas, debería ser uno de los criterios de severidad del dengue, tal como ocurrió en las redefiniciones posteriores.
En Brasil, en el 2008 se reportó un estudio en el que el 21,4% de 101 pacientes con dengue admitidos para hospitalización presentaron principalmente confusión mental, en otros casos descoordinación, disimetrías y hemiparesias. En este estudio, los hallazgos neurológicos no fueron atribuidos a anormalidades hematológicas ó hipotensión, disfunción renal o coagulopatías, por lo tanto se sugirió que dichos síntomas podían deberse a la infección per se del tejido nervioso58.
En varios de los reportes revisados, el Síndrome de Guillain-Barré (SGB) aparece frecuentemente como una manifestación asociada al DENV. Por ejemplo, Santos et al., presentaron un caso de una mujer adulta con diagnóstico confirmado de dengue, que siete días después del inicio de la enfermedad, presentó sintomatología sugestiva de polineuropatía desmielinizante (tetraparesia, diplejía facial y arreflexia generalizada). Los hallazgos electromiográficos y de neuroconducción fueron consistentes con el diagnóstico de SGB38.
En el estudio de Brito-Ferreira et al., se reportó que en 41 casos confirmados de dengue, se presentaron manifestaciones neurológicas como encefalitis, mielitis, parálisis facial, poliradiculoneuropatias periféricas, eventos cerebrovasculares hemorrágicos y encefalomielitis diseminada y se detectaron anticuerpos y virus en el LCR, todos ellos dentro de dos momentos de la epidemia de dengue del 200523.
En un análisis retrospectivo de 13 pacientes positivos para IgM de dengue y con signos neurológicos, 10 de ellos presentaron pleocitosis, hiperproteinorraquia y anticuerpos anti-DENV en el LCR58. Posteriormente, en el Estado de Ceará (Brasil), se evaluaron retrospectivamente 150 pacientes fallecidos y que tuvieron diagnóstico de alteraciones nerviosas, descartando infecciones por bacterias u hongos. En estos, se definió como un caso positivo para dengue, si la historia clínica del paciente reportaba algún signo o síntoma compatibles con la enfermedad y que alguna prueba de laboratorio (aislamiento viral en el suero, RT-PCR positiva, detección de IgM específica o detección de antígeno NS1), fuera positiva para el virus en suero, LCR o tejidos. Se analizaron 150 muestras de LCR y 109 muestras de sangre/suero y se evaluó la presencia de antígeno viral en cortes histológicos de 120 bloques de tejidos. En el 56% de los casos (84 pacientes) se demostró la presencia de virus por cualquiera de las técnicas y 41 de estos, fueron diagnosticados como encefalitis o meningoencefalitis por DENV, ya que se detectó virus o anticuerpos en el LCR o el cerebro. Este estudio, uno de los más completos para evaluar alteraciones neurológicas por dengue, advierte con razón, sobre la neurovirulencia que podría tener el DENV y señalan además, la dificultad clínica de su diagnóstico, dado que en 19 de 84 pacientes (12,7%) confirmados para el virus, no tenían ningún signo sugestivo de dengue antes de su fallecimiento59.
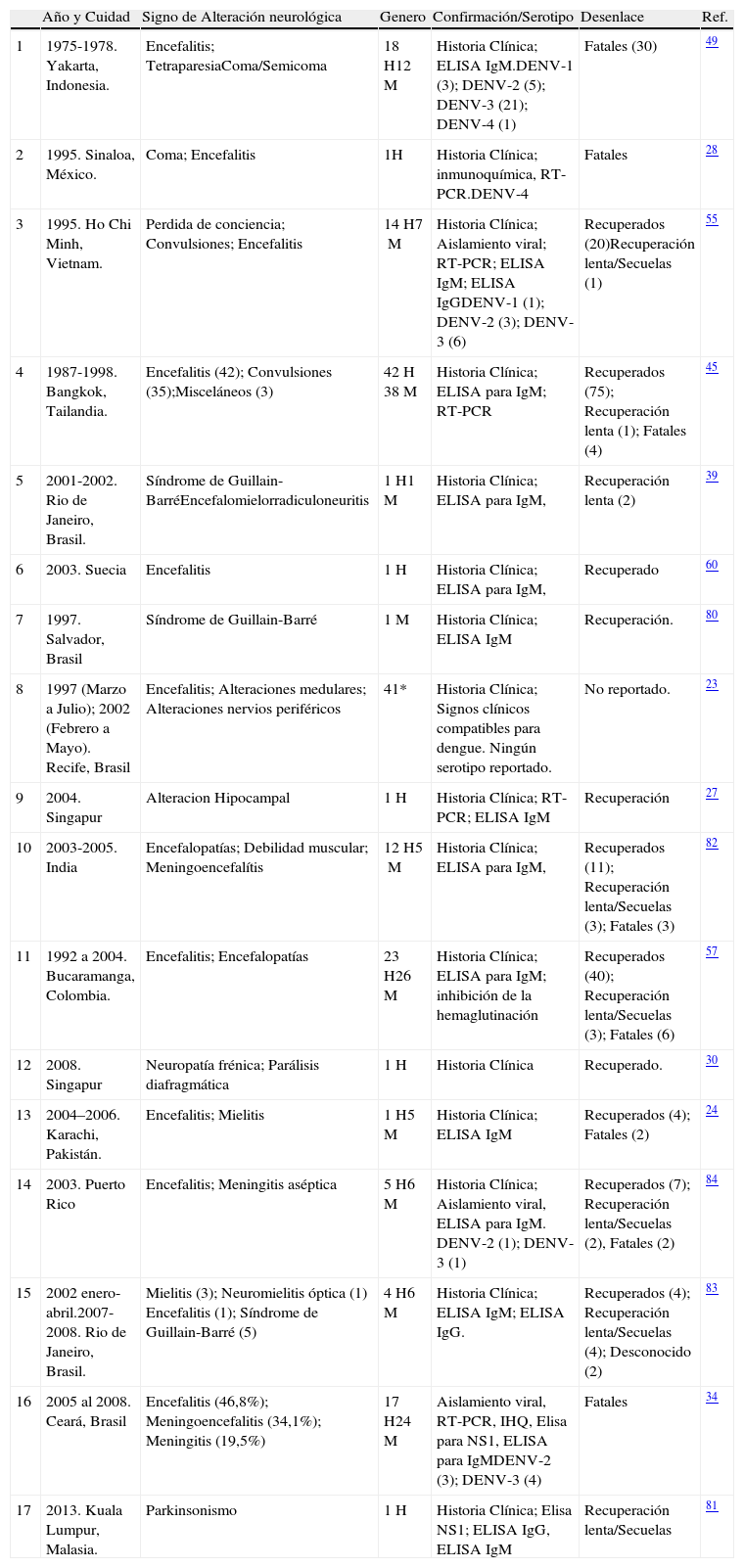
Este mismo grupo de autores, en un estudio posterior, reportó que 8 pacientes de 209 con diagnóstico de meningitis o meningoencefalitis fueron positivos para dengue (3,8%). Aunque esta cifra es similar a la reportada previamente, es claro que la infección y el desarrollo de la enfermedad fue un factor de riesgo para desarrollar una encefalitis fatal, pues el 14,8% de los fallecidos fueron dengue positivos, mientras que el 2,2% fueron dengue negativos (OR= 6,7)34. Por lo tanto los autores sugieren, que mientras los pacientes no muestren signos de dengue grave que permitieran predecir la fatalidad, es necesario hacer una vigilancia más acuciosa de los casos de encefalitis que se presentan en regiones endémicas para dengue, incluyendo turistas que hayan visitado zonas endémicas, como se reportó en un viajero escandinavo60 (Tabla 1).
Reporte de casos con alteraciones neurológicas asociadas a DENV
| Año y Cuidad | Signo de Alteración neurológica | Genero | Confirmación/Serotipo | Desenlace | Ref. | |
| 1 | 1975-1978. Yakarta, Indonesia. | Encefalitis; TetraparesiaComa/Semicoma | 18 H12M | Historia Clínica; ELISA IgM.DENV-1 (3); DENV-2 (5); DENV-3 (21); DENV-4 (1) | Fatales (30) | 49 |
| 2 | 1995. Sinaloa, México. | Coma; Encefalitis | 1H | Historia Clínica; inmunoquímica, RT-PCR.DENV-4 | Fatales | 28 |
| 3 | 1995. Ho Chi Minh, Vietnam. | Perdida de conciencia; Convulsiones; Encefalitis | 14 H7M | Historia Clínica; Aislamiento viral; RT-PCR; ELISA IgM; ELISA IgGDENV-1 (1); DENV-2 (3); DENV-3 (6) | Recuperados (20)Recuperación lenta/Secuelas (1) | 55 |
| 4 | 1987-1998. Bangkok, Tailandia. | Encefalitis (42); Convulsiones (35);Misceláneos (3) | 42 H 38M | Historia Clínica; ELISA para IgM; RT-PCR | Recuperados (75); Recuperación lenta (1); Fatales (4) | 45 |
| 5 | 2001-2002. Rio de Janeiro, Brasil. | Síndrome de Guillain-BarréEncefalomielorradiculoneuritis | 1 H1M | Historia Clínica; ELISA para IgM, | Recuperación lenta (2) | 39 |
| 6 | 2003. Suecia | Encefalitis | 1 H | Historia Clínica; ELISA para IgM, | Recuperado | 60 |
| 7 | 1997. Salvador, Brasil | Síndrome de Guillain-Barré | 1M | Historia Clínica; ELISA IgM | Recuperación. | 80 |
| 8 | 1997 (Marzo a Julio); 2002 (Febrero a Mayo). Recife, Brasil | Encefalitis; Alteraciones medulares; Alteraciones nervios periféricos | 41* | Historia Clínica; Signos clínicos compatibles para dengue. Ningún serotipo reportado. | No reportado. | 23 |
| 9 | 2004. Singapur | Alteracion Hipocampal | 1 H | Historia Clínica; RT-PCR; ELISA IgM | Recuperación | 27 |
| 10 | 2003-2005. India | Encefalopatías; Debilidad muscular; Meningoencefalítis | 12 H5M | Historia Clínica; ELISA para IgM, | Recuperados (11); Recuperación lenta/Secuelas (3); Fatales (3) | 82 |
| 11 | 1992 a 2004. Bucaramanga, Colombia. | Encefalitis; Encefalopatías | 23 H26M | Historia Clínica; ELISA para IgM; inhibición de la hemaglutinación | Recuperados (40); Recuperación lenta/Secuelas (3); Fatales (6) | 57 |
| 12 | 2008. Singapur | Neuropatía frénica; Parálisis diafragmática | 1 H | Historia Clínica | Recuperado. | 30 |
| 13 | 2004–2006. Karachi, Pakistán. | Encefalitis; Mielitis | 1 H5M | Historia Clínica; ELISA IgM | Recuperados (4); Fatales (2) | 24 |
| 14 | 2003. Puerto Rico | Encefalitis; Meningitis aséptica | 5 H6M | Historia Clínica; Aislamiento viral, ELISA para IgM. DENV-2 (1); DENV-3 (1) | Recuperados (7); Recuperación lenta/Secuelas (2), Fatales (2) | 84 |
| 15 | 2002 enero-abril.2007- 2008. Rio de Janeiro, Brasil. | Mielitis (3); Neuromielitis óptica (1) Encefalitis (1); Síndrome de Guillain-Barré (5) | 4 H6M | Historia Clínica; ELISA IgM; ELISA IgG. | Recuperados (4); Recuperación lenta/Secuelas (4); Desconocido (2) | 83 |
| 16 | 2005 al 2008. Ceará, Brasil | Encefalitis (46,8%); Meningoencefalitis (34,1%); Meningitis (19,5%) | 17 H24M | Aislamiento viral, RT-PCR, IHQ, Elisa para NS1, ELISA para IgMDENV-2 (3); DENV-3 (4) | Fatales | 34 |
| 17 | 2013. Kuala Lumpur, Malasia. | Parkinsonismo | 1 H | Historia Clínica; Elisa NS1; ELISA IgG, ELISA IgM | Recuperación lenta/Secuelas | 81 |
Estudio de casos o retrospectivos reportados en diferentes años y ciudades del mundo.
(H) hombres, (M) mujeres, * No reportado.
Números entre parentesis: número de casos con cada uno de los serotipos, signos o desenclace presentado.
Es poco lo que se conoce acerca del neurotropismo y neuroinfección por DENV, esto se debe en parte, por la ausencia de un modelo animal que reproduzca completamente los signos y síntomas característicos de la enfermedad y que permitan conocer los posibles mecanismos asociados a la neuropatología61. Los modelos de infección en ratones son los más estudiados y para reproducir algunos signos de la enfermedad, se requiere de la modificación de factores virales, del hospedero o ambos62. De acuerdo a esto, se ha sugerido que las neuronas son el principal sitio de replicación viral dentro del SN63, sin embargo, otros autores han reportado la replicación del virus en “ciertas células gliales” de ratones infectados, sin una distinción clara entre astrocitos y microglía64.
Estos resultados sugieren entre otros aspectos, que el virus posee una gran capacidad de adaptación e interactúa con diferentes moléculas para infectar las diferentes poblaciones celulares del tejido nervioso. Al respecto, en 1997, se sugirió que una proteína de 65kDa presente en células de neuroblastoma humano (SK-N-SH), podría actuar como un posible receptor viral65. Posteriormente, se reportó que las proteínas HSP90 y HSP70 podrían actuar como receptores o correceptores virales en células SH-SY5Y, ya que la incubación previa a la infección, con anticuerpos contra ambas proteínas, redujo considerablemente la infección y producción de virus66.
In vivo, la inoculación intracerebral (i.c) de DENV en ratones adultos o neonatos, indujo un aumento en la producción de antígenos virales a través del tiempo, sugiriendo la replicación activa del virus en el tejido67. Posteriormente, Chaturvedi et al., en 1991 demostraron que el DENV traspasa la BHE, lo cual podría favorecer el paso de células infectadas y mediadores inflamatorios aumentando la infección56 y por consiguiente los daños en el tejido, especialmente en corteza cerebral, en ganglios basales e hipocampo68,69. En el 2012, nuestro grupo, reportó un modelo de neuroinfección y neuropatogenia por DENV en ratones de diferentes edades post-natales, inoculados por la vía intraperitoneal, con una cepa de DENV-4 neuroadaptada denominada D4MB-6. Este virus, evidenció que se unía a los proteoglicanos de la membrana celular, infectó diferentes poblaciones celulares como neuronas, microglia y oligodendrocitos, se replicó exitosamente en el tejido, e indujo la alteración de la arquitectura cortical, hipocampal y del tallo cerebral70.
La encefalitis observada en estos ratones, se relacionó con altos títulos virales, con cambios en la permeabilidad vascular y de la BHE y con la activación de la respuesta inmune local, que indujo la activación glial, la infiltración leucocitaria (linfocitos y macrófagos), la dilatación capilar y hemorragias parenquimatosas en ratones de 2 y 7 días postnatales (dpn), pero no en ratones de 14 o 21 dpn, lo cual sugiere que la inmadurez del tejido nervioso aumenta la susceptibilidad a la infección y favorece la alteración neuronal durante la misma70. Esto último fue reportado previamente por Ogata et al., quienes demostraron que la edad es un factor determinante durante la infección con el JEV, sugiriendo que la neurosusceptibilidad fue menor en los anímales adultos44.
En un estudio similar, Castorena et al., revelaron que las neuronas humanas diferenciadas sufren menos daño citopático durante la infección con el Virus de la Encefalitis Equina Occidental (WEEV) que las células inmaduras71. Por lo tanto, es posible suponer que el grado de madurez fisiológica y neuronal, sea uno de los factores que aumenta la susceptibilidad a la neuroinfección por DENV en niños menores de 15 años.
Mecanismos asociados a la neuropatogeniaLos aspectos moleculares inducidos por la infección con el DENV y asociados a los daños sobre el tejido nervioso son poco conocidos. An et al., determinaron que la principal respuesta patológica a la infección en SN fue la necrosis neuronal, evaluada por los cambios morfológicos en las células29. En 1996 Desprès et al., demostraron que la infección con dos cepas de DENV-1, indujo apoptosis de células de neuroblastoma murino (Neuro2a) asociada a la acumulación de proteínas virales en el RER68.
Posteriormente, se confirmó in vivo la fragmentación de DNA y la muerte de las neuronas infectadas en ratones albinos inoculados por vía intracerebral, con el DENV-169, sugiriendo que la muerte celular es el principal daño del tejido asociado a la neuroinfección por DENV-1, la cual podría ser debida a algunas mutaciones puntuales en la proteína E y NS372. Posteriormente Catteau et al., demostraron que 9 aminoácidos del extremo carboxi-terminal de la proteína M, tiene propiedades pro-apoptóticas en las células Neuro2a. Este péptido (denominado ApoptoM) fue identificado en los 4 serotipos del virus e indujo cambios en el potencial de membrana mitocondrial y activó la caspasa 3, sin la participación de la caspasa 973,74, sugiriendo el potencial apoptogénico de las proteínas virales, sin embargo hasta el momento este es el único reporte que sugiere este efecto.
Adicional a la muerte celular, la respuesta inmune local y sistémica podría inducir la disfunción neuronal durante la infección por DENV. La exacerbada respuesta inmune que se presenta durante la infección por DENV es un signo clásico de la enfermedad, sin embargo los factores virales y del hospedero que la inducen, no son del todo conocidos. En el suero de pacientes infectados con DENV, se han detectado algunos mediadores solubles como el Factor de Necrosis Tumoral alfa (TNF-alfa) y algunas interleucinas como IL-1β, 2, 4, 6, 7, 8, 10, 13, 18, quimocinas como MCP-1 e interferones tipo I y II75. Estos mediadores, también han sido detectados durante la neuroinfección por virus como DENV, WNV, JEV y TBEV75,76, e inducen la activación de los astrocitos y de las células de la microglía, lo cual se evidencia por cambios morfológicos y por la expresión de moléculas de adhesión, quimiocinas y citocinas pro- y anti-inflamatorias que intentan contrarrestar la infección y reparar los daños en el tejido77. Esta respuesta junto a la respuesta inmune extraneural, favorecen la infiltración de las células inmunes al parénquima cerebral, aumentando la inflamación y los daños en el tejido78. Es posible que estos fenómenos también se estén presentando durante la neuroinfección por DENV, pues con cada vez mayor frecuencia se reportan casos con un componente y sobre todo, se investigan a profundidad79.
ConclusiónLa evidencia clínica aquí referenciada, demuestra que durante la infección por dengue, se pueden presentar algunos signos neurológicos asociados a esta. Por la frecuencia e importancia de estos signos, la OMS en el 2009 los incluyó dentro de los criterios de diagnóstico y manejo de la enfermedad, con miras hacer un mejor tratamiento de la enfermedad severa. Sin embargo, hasta el momento no se conocen completamente los mecanismos celulares y moleculares que promueven la aparición de estos signos. En algunos casos, se han detectado anticuerpos específicos contra el virus en el LCR, en otros, se ha detectado antígeno o RNA viral, lo que sugiere la invasión directa del virus dentro del tejido nervioso. Esto último, podría favorecer la disfunción endotelial y la subsecuente aparición de edema, hemorragias o anoxia, que en conjunto permitirían el ingreso de virus, la infección y la aparición de algunos de los signos descritos anteriormente, sin descartar el transporte axonal retrogrado o el ingreso de células inmunes infectadas al tejido nervioso, como otros posibles mecanismos de ingreso del virus al tejido.
Aunque las manifestaciones neurológicas, se pueden presentar durante el desarrollo del dengue leve o grave, en la mayoría de los reportes el diagnostico de alteraciones neurológicas se relacionan con altas tasas de mortalidad y/o secuelas de mayor duración, incluso, en algunos casos las manifestaciones neuropatológicas, pueden ser el único signo de dengue severo. Esta complejidad, sumada a las dificultades que existen en Colombia para el correcto diagnóstico de la enfermedad, hace necesaria la sensibilización de los profesionales de la salud para que conozcan el carácter multifactorial de la enfermedad e incluyan durante el examen médico en las zonas endémicas, la evaluación de los signos y síntomas que sugieran alteraciones neurológicas por dengue. Estas consideraciones resaltan la necesidad de implementar en el algoritmo de diagnóstico la búsqueda activa de anticuerpos, antígeno o ARN viral en el LCR, lo cual podría ayudar a orientar el manejo, disminuyendo la carga de la enfermedad y favoreciendo una atención más adecuada, que reduzca la frecuencia de pacientes con secuelas en la función sensorial o motora asociada a la infección por DENV.
Los autores agradecen a la División de Investigaciones de la Universidad El Bosque, por la financiación del proyecto PCI-2011-219 y a COLCIENCIAS por la financiación, Programa 5015-537-30843, Contrato 360-2011.