“Recomendaciones para el diagnóstico, tratamiento y prevención de la neumonía adquirida en la comunidad en adultos”
Población objetoAdultos inmunocompetentes de 18 años o más, con sospecha de neumonía adquirida en la comunidad.
Dirigida aEspecialistas en medicina interna, meumología, infectología, cuidado crítico, médicos generales, estudiantes en formación de pregrado y posgrado, entidades prestadoras de servicio de salud, universidades con programas de formación en áreas de la salud y a los entes territoriales y direcciones de salud nacionales, regionales y locales.
IntroducciónEn nombre de las Asociaciones Colombianas de Neumología y Cirugía del Tórax, de Medicina Crítica y Cuidado Intensivo, de Medicina Interna y de Infectología, es un placer presentar las “Recomendaciones para el diagnóstico, tratamiento y prevención de la neumonía adquirida en la comunidad en adultos inmunocompetentes”. Este el fruto de un trabajo en conjunto durante tres años, en los cuales profesionales de las 4 asociaciones contribuyeron en el desarrollo de este documento que actualiza la versión previa de la guía del 2003. En este documento, no solo se tuvo en cuenta la mejor evidencia disponible publicada mediante la evaluación de guías existentes y búsquedas primarias, sino que también se incluyó información valiosa publicada localmente, especialmente datos epidemiológicos relacionados con etiología y resistencia bacteriana, entre otros.
Aunque la elaboración de esta guía supuso un gran esfuerzo, el impacto de la misma no será significativo si no se socializa y se implementa de una manera efectiva. Por esta razón, invitamos a cada uno de los lectores a contribuir a su implementación y seguimiento, ya que sin lugar a dudas estas son las etapas más importantes del desarrollo de una guía. De esta manera se puede lograr el objetivo primordial de una guía de práctica clínica: mejorar la atención de los pacientes y en particular la de aquellos pacientes con sospecha de neumonía adquirida en la comunidad, una de las causas más frecuentes de morbilidad y mortalidad en nuestro país.
PresentaciónLa neumonía adquirida en la comunidad es una de las infecciones más frecuentes en el ámbito mundial, su incidencia es variable y está relacionada con la edad, presencia de enfermedades concomitantes y algunos factores de riesgo específicos como tabaquismo y abuso de alcohol. La incidencia es mayor en menores de 5 años, mayores de 65 años y en personas con enfermedades concomitantes como enfermedad pulmonar obstructiva crónica (EPOC), insuficiencia cardíaca, insuficiencia renal crónica, diabetes mellitus, enfermedades hepáticas y enfermedades neurológicas1–9
Se han reportado tasas de incidencia entre 1,0 por 1.000 y 11 por 1.000 habitantes. La neumonía adquirida en la comunidad representa del 5 a 12% de las infecciones del tracto respiratorio inferior y entre el 20 y 42% de los casos requieren atención hospitalaria; de estos, entre el 10 y el 30% ingresan a la unidad de cuidados intensivos (UCI). La neumonía adquirida en la comunidad se asocia con altas tasas de morbilidad y mortalidad2–9
Los avances en los métodos diagnósticos para la detección de agentes patógenos respiratorios han permitido entender mejor el perfil epidemiológico de la neumonía adquirida en la comunidad, sin embargo, Streptococcus pneumoniae (S. pneumoniae) sigue siendo el patógeno predominante. En un alto porcentaje de pacientes (40 a 60%) no es posible documentar la etiología, y el tratamiento que se ha de seguir es empírico. De aquí deriva la importancia del aporte epidemiológico de los trabajos realizados en cada país o región y del enfoque diagnóstico y terapéutico adecuado y racional, acorde con nuestra situación epidemiológica2,5,6,10–20.
El manejo de la neumonía adquirida en la comunidad sigue siendo un tema de controversia mundial, razón por la cual se ha promovido la elaboración de guías y recomendaciones de las diferentes asociaciones científicas como la American Thoracic Society (ATS)4, la Sociedad Española de Neumología y Cirugía del Tórax6, la Infectious Diseases Society of America (IDSA)3,21, la British Thoracic Society2,9, la Canadian Infectious Disease Society y la Canadian Thoracic Society8 y la Asociación Latinoamericana del Tórax22, entre otras. Estas guías se actualizan de manera periódica con el fin de incorporar nueva información de relevancia en el manejo.
En los últimos años, ha sido de gran importancia la estratificación del riesgo en la neumonía adquirida en la comunidad y la emergencia de resistencia a los antibióticos. Por tal razón, se han desarrollado escalas o índices de gravedad para la clasificación clínica de la neumonía adquirida en la comunidad y se han implementado programas de uso de antibióticos y de control de infecciones que nos permiten optimizar la aproximación diagnóstica y terapéutica.
En la estratificación del riesgo de la neumonía adquirida en la comunidad, el índice de gravedad de la neumonía (PSI, en inglés Pneumonia Severity Index) o índice de Fine18 y la escala CURB-652,9 han sido suficientemente estudiados y validados en diferentes países. Además, en esta estratificación del riesgo se debe tener en cuenta la presencia de enfermedades concomitantes, de factores de riesgo específicos para algunos gérmenes y el juicio clínico del médico, con el fin de definir si el tratamiento de la neumonía adquirida en la comunidad se hace de forma ambulatoria u hospitalaria y si se requiere o no su hospitalización en las unidades de terapia intensiva11,23,24.
La decisión del sitio de tratamiento permite a la vez optimizar las condiciones de manejo y reducir la carga económica derivada del tratamiento hospitalario1,25.
La atención de la neumonía adquirida en la comunidad se ha convertido en algunas instituciones y países en un indicador de la calidad de atención, diagnóstico y operatividad de los sistemas de salud.
En nuestro país, la Asociación Colombiana de Neumología y Cirugía de Tórax en conjunto con la Asociación Colombiana de Infectología y la Asociación Colombiana de Medicina Interna emitieron la guía conjunta en 20035, y en la presente guía se suma a este esfuerzo conjunto la Asociación Colombiana de Medicina Crítica y Cuidado Intensivo, para emitir las recomendaciones para el diagnóstico, tratamiento y prevención de la neumonía adquirida en la comunidad en adultos, basadas en los mejores niveles de evidencia de la información nacional e internacional de relevancia disponible hasta la fecha.
Para su elaboración, el comité desarrolló la siguiente metodología en los últimos 3 años:
- •
Convocatoria a las asociaciones o sociedades científicas nacionales que tienen bajo su responsabilidad el manejo de la neumonía adquirida en la comunidad, a saber: la Asociación Colombiana de Neumología y Cirugía de Tórax, la Asociación Colombiana de Infectología, la Asociación Colombiana de Medicina Interna y la Asociación Colombiana de Medicina Crítica y Cuidado Intensivo.
- •
Búsqueda sistemática de la bibliografía posterior a la publicación de la guía conjunta de 2003.
- •
Selección de los artículos disponibles con la mejor información.
- •
Búsqueda de bibliografía nacional, incluyendo trabajos, resúmenes y presentaciones realizadas en congresos nacionales, que nos permita acercarnos a la realizad epidemiológica de nuestro país.
- •
En el tratamiento de la neumonía adquirida en la comunidad, dada la importancia de este tópico, se estableció una formulación de las estrategias de tratamiento de ella con un proceso de adaptación de las guías de práctica clínica26. Como preguntas que se debían adaptar se seleccionaron únicamente las opciones terapéuticas recomendadas por las guías de práctica clínica en el ámbito nacional o internacional, la duración del tratamiento antimicrobiano y la posibilidad de hacer cambios a medicamentos para administración oral.
Se realizó una búsqueda sistemática utilizando las palabras “guidelines” y “pneumonia” con el fin de identificar las guías de práctica clínica de neumonía adquirida en la comunidad realizadas en diferentes países. Además, se hizo una búsqueda sistemática en PubMed utilizando la siguiente estrategia: ((«residence characteristics»[MeSH Terms] OR («residence»[All Fields] AND «characteristics»[All Fields]) OR «residence characteristics»[All Fields] OR «community»[All Fields]) AND acquired[All Fields] AND («pneumonia»[MeSH Terms] OR «pneumonia»[All Fields])) AND (randomized controlled trial[Publication Type] OR (randomized[Title/Abstract] AND controlled[Title/Abstract] AND trial[Title/Abstract])).
Las búsquedas se hicieron teniendo como fecha límite el 31 de enero de 2013. Para las guías de práctica clínica se incluyeron todas las guías identificadas publicadas a partir del año 2000, mientras que para los estudios clínicos se incluyeron las publicaciones de los últimos 5 años. Las guíasde práctica clínica fueron evaluadas siguiendo la metodología AGREE27 por 2 participantes del consenso. Se seleccionaron aquellas con mayor puntaje y se presentaron las opciones terapéuticas a los panelistas, los cuales votaron por las diferentes opciones presentadas con una escala ordinal de 1 a 928. De acuerdo con esta escala, los valores de 1 a 3 implican desacuerdo con la recomendación; los valores de 4 a 6 no implican estar de acuerdo ni en desacuerdo (y se entiende como alternativa de tratamiento), y los valores 7 a 9 implican estar de acuerdo con la recomendación.
- •
Elaboración de un documento base por parte del coordinador del comité de la neumonía adquirida en la comunidad de la Asociación Colombiana de Neumología y Cirugía del Tórax.
- •
Envío del documento base a los diferentes expertos para que sobre el mismo se consignaran las observaciones, recomendaciones y ajustes pertinentes.
- •
Cada sección de la guía fue asignada a expertos de las asociaciones científicas, buscando siempre que en cada sección quedasen incluidos representantes de cada una de ellas.
- •
Una vez recibidas las recomendaciones de cada experto y de las asociaciones o sociedades científicas participantes, el coordinador junto con los miembros del comité de la neumonía adquirida en la comunidad integró dichos ajustes al documento base.
- •
Una vez el documento estuvo listo, se reenvió para discusión final y proceder con la redacción y corrección de estilo por personal calificado.
- •
Con las recomendaciones y correcciones del personal calificado de redacción y corrección de estilo se procedió a la edición y presentación del consenso.
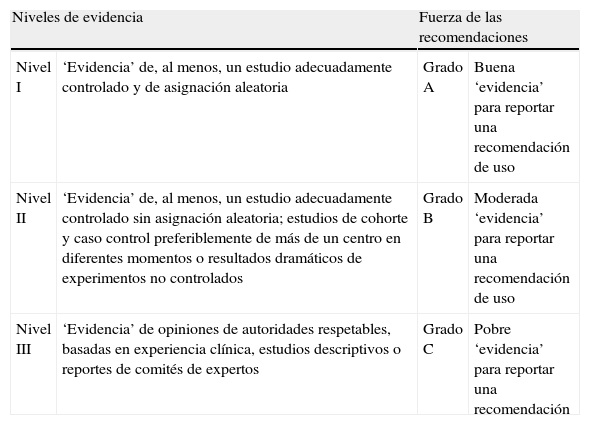
Los niveles de evidencia y grados de recomendaciones emitidos en la guía están basados en el Canadian Task Force y que se relacionan a continuación en la tabla 1.
Niveles de evidencia.
| Niveles de evidencia | Fuerza de las recomendaciones | ||
| Nivel I | ‘Evidencia’ de, al menos, un estudio adecuadamente controlado y de asignación aleatoria | Grado A | Buena ‘evidencia’ para reportar una recomendación de uso |
| Nivel II | ‘Evidencia’ de, al menos, un estudio adecuadamente controlado sin asignación aleatoria; estudios de cohorte y caso control preferiblemente de más de un centro en diferentes momentos o resultados dramáticos de experimentos no controlados | Grado B | Moderada ‘evidencia’ para reportar una recomendación de uso |
| Nivel III | ‘Evidencia’ de opiniones de autoridades respetables, basadas en experiencia clínica, estudios descriptivos o reportes de comités de expertos | Grado C | Pobre ‘evidencia’ para reportar una recomendación |
La neumonía es el proceso inflamatorio del tejido parenquimatoso pulmonar desencadenado por diversas especies de bacterias, virus, hongos o parásitos. Se ve afectada la porción distal del tracto respiratorio, bronquiolos y alvéolos; la reacción inflamatoria puede afectar también el intersticio alveolar y puede generar infiltrado celular inflamatorio y exudación en el espacio alveolar (consolidación del espacio aéreo), cuya expresión final es la alteración del intercambio gaseoso, la liberación de citocinas y mediadores inflamatorios, que se traducen en un complejo de síntomas y signos de compromiso del tracto respiratorio inferior, respuesta inflamatoria sistémica y evidencia de dicho compromiso en la radiografía del tórax2–9,21–23,29,30.
Para que se pueda catalogar como neumonía adquirida en la comunidad, debe ocurrir en pacientes que no se encuentren hospitalizados o en aquellos hospitalizados en quienes los síntomas y signos ocurren en las primeras 48h de su ingreso2–9,21–23,29.
En esta definición se excluye la neumonía que se presenta en personas residentes en hogares de cuidado crónico o en hogares geriátricos, o en quienes están en tratamiento ambulatorio en contacto frecuente con instituciones prestadoras de salud, condición que se ha denominado neumonía asociada a la atención en salud4,6,8,9,21,22.
1.2. EpidemiologíaEn los estudios adelantados en Europa y Norteamérica se ha podido establecer que la incidencia de la neumonía adquirida en la comunidad está entre 1 y 11 por 1.000 habitantes por año, es decir, cerca de 4 millones de casos nuevos al año2,4,9,21,31–33. De estos pacientes con diagnóstico de neumonía adquirida en la comunidad, entre el 20 y el 42% requiere hospitalización, y de los pacientes hospitalizados, aproximadamente, entre el 10 y el 30% requiere manejo en la UCI y corresponden al grupo denominado “neumonía grave”2–4,6,8,9,21,22.
En el mundo, la neumonía adquirida en la comunidad es la sexta causa de mortalidad general y la primera causa de mortalidad por enfermedades infecciosas. La mortalidad atribuible a la neumonía adquirida en la comunidad es del 1 al 5% para los pacientes con tratamiento ambulatorio, de 5,7 a 25% para quienes requieren tratamiento hospitalario y asciende hasta el 50% para los pacientes que requieren UCI. El costo de atención hospitalaria es cerca de 20 veces mayor que el tratamiento ambulatorio y está directamente relacionado con la estancia hospitalaria y la morbilidad asociada; se ha podido cuantificar este costo en cerca de 9 mil millones de dólares al año1,4,6,8,9,21,22,25,34–36.
En Colombia, la neumonía adquirida en la comunidad es la sexta causa de muerte y la primera por infección. Es responsable del 4% de los egresos hospitalarios y de más de 70.000 egresos anuales en todos los grupos de edad. La tasa de mortalidad por la neumonía adquirida en la comunidad es de 13 por 100.000 habitantes en la población general5,7,33.
En nuestro país existen varios estudios sobre la neumonía adquirida en la comunidad12–15,17,19,37–40 que se han centrado en describir el comportamiento clínico, el diagnóstico etiológico y la observancia de las guías de manejo, siendo la mayoría de ellos series descriptivas. En los estudios realizados en Antioquia y en Bogotá12–15,37,38, se evaluó, entre los métodos diagnósticos, el comportamiento del antígeno urinario en el diagnóstico de la neumonía adquirida en la comunidad y, a diferencia de otros, los estudios previos realizados en Colombia, sobre el diagnóstico etiológico de la neumonía adquirida en la comunidad se determinó la utilidad de los métodos tradicionales, las pruebas serológicas y la detección de antígenos para microorganismos diferentes de las bacterias usuales.
En los estudios realizados en nuestro país, la mortalidad general por neumonía adquirida en la comunidad es de 9,5% en los pacientes que requieren hospitalización; sin embargo, cuando se analiza la mortalidad en algunos grupos especiales, esta cifra es variable: por neumococo, 3%13,37; por gérmenes atípicos, 11,5%41; en mayores de 65 años, 19%15, y neumonía grave, 33%37.
En Colombia, la carencia de un sistema de vigilancia y de registro nacional no permite establecer la verdadera realidad de este problema, por lo cual se hace necesario implementarlos y poder retroalimentar posteriormente nuestras decisiones.
Sección 2Fisiopatología, etiología, factores de riesgo y resistencia microbiana2.1. FisiopatologíaEl sistema respiratorio de defensa, en sus componentes anatómico, mecánico e inmunológico, es muy efectivo, logrando mantener estéril el tracto respiratorio inferior. Cuando un agente infeccioso llega allí, ya sea por inhalación de aerosoles portadores de microbios o por aspiración de secreciones del tracto respiratorio superior o, menos comúnmente, por vía sanguínea, generalmente es eliminado por estos mecanismos. La neumonía adquirida en la comunidad se presenta cuando el sistema de defensa es sobrepasado por una combinación de factores tales como un inóculo bacteriano muy grande o muy virulento o una deficiencia de los mecanismos de defensa.
Las partículas infecciosas que superan las defensas de las vías respiratorias y se depositan sobre la superficie alveolar son eliminadas por las células de la fagocitosis y por factores humorales. Los principales fagocitos de la vía respiratoria inferior son los macrófagos alveolares. Algunos microorganismos fagocitados son destruidos por los sistemas dependientes de oxígeno de los fagocitos, las enzimas lisosómicas y las proteínas catiónicas. Otros microorganismos consiguen eludir los mecanismos microbicidas y persisten en el sitio de la lesión o en el interior del macrófago. Los agentes patógenos pueden entonces diseminarse por vía hematógena o transportarse por los vasos linfáticos a los ganglios linfáticos regionales y el conducto torácico y alcanzar la vía hematógena. Los macrófagos alveolares elaboran y presentan los antígenos microbianos a los linfocitos y también secretan citocinas, como el factor de necrosis tumoral (TNF, en inglés tumor necrosis factor) y la interleucina 1 (IL-1) entre otros, que regulan el proceso inmunitario en los linfocitos T y B. Las citocinas facilitan que se presente una respuesta inflamatoria, activan los macrófagos alveolares y reclutan fagocitos y células mononucleares adicionales y otros factores inmunitarios del plasma. El exudado inflamatorio es el responsable de muchos de los signos locales como la producción de esputo o la consolidación pulmonar y la liberación de citocinas y mediadores inflamatorios de las manifestaciones sistémicas de la neumonía, tales como fiebre, escalofríos, mialgias y malestar general.
La expresión de este fenómeno inflamatorio y la búsqueda incesante por establecer con certeza la presencia de la infección bacteriana, que nos permita garantizar un tratamiento antimicrobiano oportuno, ha impulsado la investigación en búsqueda de marcadores bioquímicos que nos sustenten en el contexto clínico la decisión de iniciar o retirar el tratamiento antimicrobiano con base en los criterios de la neumonía adquirida en la comunidad, los factores de riesgo y la presencia de enfermedades concomitantes. Entre estos marcadores se distinguen 3: la procalcitonina, la proteína C reactiva y el receptor de activación soluble expresado en las células mieloides (sTREM, en inglés SolubleTriggering Receptor Expressed on Myeloid Cells)42.
El proceso neumónico afecta, principalmente, los alvéolos, pero también puede existir compromiso del intersticio, y las manifestaciones usuales en la radiografía del tórax son la presencia de infiltrados de ocupación alveolar, las consolidaciones segmentarias o lobares y los infiltrados intersticiales.
No es infrecuente que ocurra necrosis del parénquima pulmonar cuando las enzimas líticas secretadas por los patógenos o por las células inflamatorias ocasionan destrucción del parénquima pulmonar, generando, entonces, lo que se ha denominado neumonía necrosante. Este tipo de neumonía tiene presentaciones características tanto en la radiografía como en la tomografía del tórax, como son la presencia de numerosas cavidades pequeñas con un diámetro < 2cm en uno o más segmentos o lóbulos pulmonares, llamadas neumatoceles, o la presencia de una o más cavidades con un diámetro > 2cm, usualmente con nivel hidroaéreo, llamadas abscesos pulmonares.
El proceso inflamatorio en el parénquima pulmonar puede afectar el espacio pleural por contigüidad y manifestarse clínicamente por dolor de características pleuríticas. El compromiso pleural se manifiesta por ocupación del espacio pleural por líquido o detritos (agua, leucocitos, células, proteínas, gérmenes), debido al incremento de la permeabilidad capilar o al incremento de la formación de líquido pleural que excede su absorción. La presencia de líquido en el espacio pleural (derrame pleural) se presenta cuando la formación de líquido pleural excede su absorción, denotando un proceso inflamatorio activo en las superficies pleurales. Cualquier derrame pleural, asociado con neumonía bacteriana, se denomina derrame paraneumónico y la presencia de pus en la cavidad pleural o derrame paraneumónico con presencia de gérmenes en la tinción de Gram o cultivo positivo en el líquido pleural hacen que el derrame pleural tome el nombre de empiema, conllevando la connotación clínica de drenaje del espacio pleural43.
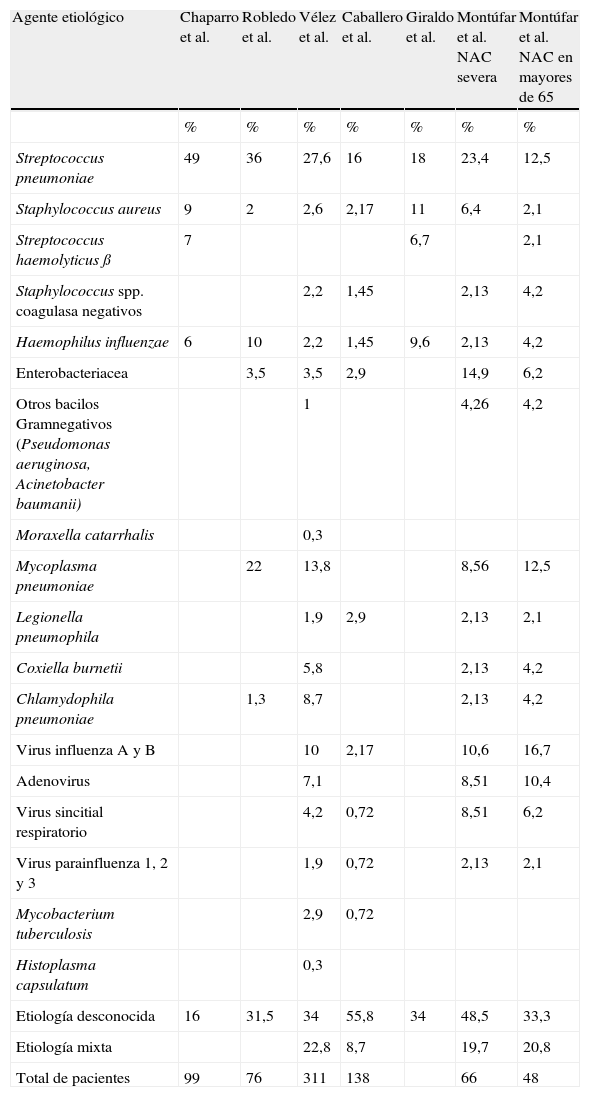
2.2. EtiologíaCuando existe etiología definida en la neumonía adquirida en la comunidad, el microorganismo más frecuentemente aislado es S. pneumoniae (20 a 60%), seguido por Haemophilus influenzae (H. influenzae) (3 a 10%), Staphylococcus aureus (S. aureus), bacilos entéricos Gramnegativos, Mycoplasma pneumoniae (M. pneumoniae), Clamydophila pneumoniae (C. pneumoniae), Legionella pneumophila (L. pneumophila) y virus respiratorios. Su prevalencia es variable en las diferentes series, variación que depende de los métodos diagnósticos utilizados y de otros factores como las condiciones de salud o las enfermedades concomitantes del paciente, el uso previo de antimicrobianos y las condiciones climáticas y sociodemográficas12–15,19,29,37–40,44–46 (tablas 2 y 3).
Etiología de la neumonía adquirida en la comunidad en Colombia.
| Agente etiológico | Chaparro et al. | Robledo et al. | Vélez et al. | Caballero et al. | Giraldo et al. | Montúfar et al. NAC severa | Montúfar et al. NAC en mayores de 65 |
| % | % | % | % | % | % | % | |
| Streptococcus pneumoniae | 49 | 36 | 27,6 | 16 | 18 | 23,4 | 12,5 |
| Staphylococcus aureus | 9 | 2 | 2,6 | 2,17 | 11 | 6,4 | 2,1 |
| Streptococcus haemolyticus ß | 7 | 6,7 | 2,1 | ||||
| Staphylococcus spp. coagulasa negativos | 2,2 | 1,45 | 2,13 | 4,2 | |||
| Haemophilus influenzae | 6 | 10 | 2,2 | 1,45 | 9,6 | 2,13 | 4,2 |
| Enterobacteriacea | 3,5 | 3,5 | 2,9 | 14,9 | 6,2 | ||
| Otros bacilos Gramnegativos (Pseudomonas aeruginosa, Acinetobacter baumanii) | 1 | 4,26 | 4,2 | ||||
| Moraxella catarrhalis | 0,3 | ||||||
| Mycoplasma pneumoniae | 22 | 13,8 | 8,56 | 12,5 | |||
| Legionella pneumophila | 1,9 | 2,9 | 2,13 | 2,1 | |||
| Coxiella burnetii | 5,8 | 2,13 | 4,2 | ||||
| Chlamydophila pneumoniae | 1,3 | 8,7 | 2,13 | 4,2 | |||
| Virus influenza A y B | 10 | 2,17 | 10,6 | 16,7 | |||
| Adenovirus | 7,1 | 8,51 | 10,4 | ||||
| Virus sincitial respiratorio | 4,2 | 0,72 | 8,51 | 6,2 | |||
| Virus parainfluenza 1, 2 y 3 | 1,9 | 0,72 | 2,13 | 2,1 | |||
| Mycobacterium tuberculosis | 2,9 | 0,72 | |||||
| Histoplasma capsulatum | 0,3 | ||||||
| Etiología desconocida | 16 | 31,5 | 34 | 55,8 | 34 | 48,5 | 33,3 |
| Etiología mixta | 22,8 | 8,7 | 19,7 | 20,8 | |||
| Total de pacientes | 99 | 76 | 311 | 138 | 66 | 48 |
NAC: neumonía adquirida en la comunidad.
- –
Chaparro et al. Rev Colomb Neumol. 1989;1:19–24. Referencia40.
- –
Robledo et al. Rev Colomb Neumol. 2003;15:7–14. Referencia39.
- –
Vélez et al. Infectio. 2006;10:2:103. Referencia12; Rev Colomb Neumol. 2007;19:154. Referencia41.
- –
Giraldo et al. Rev Colomb Neumol. 1993;5:171. Referencia14.
- –
Caballero et al.Revista Médica Sanitas. 2010;13:8–15. Referencia38.
- –
Montúfar et al. Infectio. 2006;10:113. Montúfar FE et al. Infectio. 2006;10;2:103. Referencias15,48.
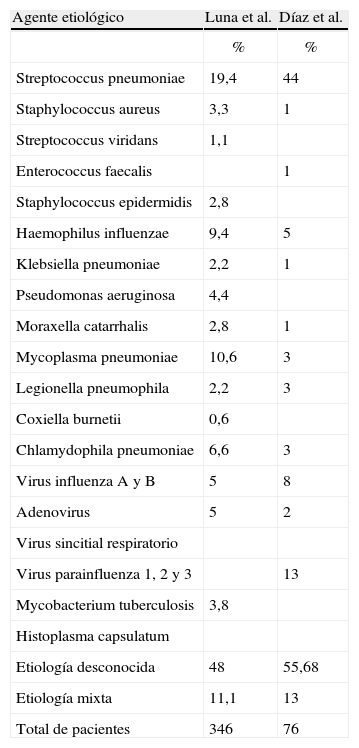
Etiología de la neumonía adquirida en la comunidad en Latinoamérica.
| Agente etiológico | Luna et al. | Díaz et al. |
| % | % | |
| Streptococcus pneumoniae | 19,4 | 44 |
| Staphylococcus aureus | 3,3 | 1 |
| Streptococcus viridans | 1,1 | |
| Enterococcus faecalis | 1 | |
| Staphylococcus epidermidis | 2,8 | |
| Haemophilus influenzae | 9,4 | 5 |
| Klebsiella pneumoniae | 2,2 | 1 |
| Pseudomonas aeruginosa | 4,4 | |
| Moraxella catarrhalis | 2,8 | 1 |
| Mycoplasma pneumoniae | 10,6 | 3 |
| Legionella pneumophila | 2,2 | 3 |
| Coxiella burnetii | 0,6 | |
| Chlamydophila pneumoniae | 6,6 | 3 |
| Virus influenza A y B | 5 | 8 |
| Adenovirus | 5 | 2 |
| Virus sincitial respiratorio | ||
| Virus parainfluenza 1, 2 y 3 | 13 | |
| Mycobacterium tuberculosis | 3,8 | |
| Histoplasma capsulatum | ||
| Etiología desconocida | 48 | 55,68 |
| Etiología mixta | 11,1 | 13 |
| Total de pacientes | 346 | 76 |
- –
Luna CM, Famiglietti A, Absi R, Videla AJ, Nogueira FJ, Fuenza-lida AD, et al. Community-acquired pneumonia: etiology, epidemiology and outcome at a teaching hospital in Argentina. Chest. 2000; 118:1344–54. Referencia46.
- –
Díaz A, Barria P, Niederman M, Restrepo M, Dreyse J, Fuentes G, et al. Etiology of community-acquired pneumonia in hospitalized patients in Chile: the increasing prevalence of respiratory viruses among classic pathogens. Chest. 2007; 131:779–87. Referencia49.
En los estudios realizados con las mejores condiciones de recolección y utilización de pruebas diagnósticas, solamente se ha logrado identificar el germen causal de la neumonía adquirida en la comunidad en el 40 a 60% de los casos. En muchos de estos trabajos se describen infecciones mixtas por gérmenes usuales, virus y gérmenes atípicos, lo cual tiene grandes implicaciones en el tratamiento. Cabe resaltar, además, que la mayoría de los trabajos adelantados para determinar la etiología de la neumonía adquirida en la comunidad se llevan a cabo en población que requiere tratamiento hospitalario12,14,15,19,29,38–40,44–46.
Esta situación se refleja también en los trabajos realizados en Colombia (tabla 3); en el estudio de la neumonía adquirida en la comunidad hecho en el Valle de Aburrá por Vélez et al.12,41, se estableció el diagnóstico etiológico en 66%, pero en la práctica clínica usual este porcentaje es aún menor.
En los trabajos hechos en Antioquia (estudios multicéntricos)12,15,37,41 y en el trabajo realizado en urgencias de la Clínica Reina Sofía38, así como en los trabajos anteriores en Colombia17,19,39,40,47, podemos apreciar que si bien S. pneumoniae continúa siendo el principal agente etiológico, existe también evidencia de infecciones por agentes atípicos, virus respiratorios, bacilos entéricos Gramnegativos y S. aureus. En un porcentaje no despreciable, la etiología de la infección es mixta. De igual forma, en los grupos de neumonía grave y neumonía en mayores de 65 años, después de S. pneumoniae, la etiología más frecuente está determinada por los bacilos Gramnegativos.
En el trabajo de Vélez et al.12,41, uno de los trabajos con mayor número de pacientes incluidos y de carácter muticéntrico, los gérmenes más frecuentes fueron: S. pneumoniae, 27,6%; M. pneumoniae, 13,8%; virus de la influenza A y B, 10%; C. pneumoniae, 8,7%; adenovirus, 7,1%; Coxiella burnetii, 5,8%; virus sincitial respiratorio, 4,5%; bacilos entéricos Gramnegativos (Enterobacteriaceae), 3,5%; Mycobacterium tuberculosis, 2,9%; S. aureus, 2,6%, y L. pneumophila, 2%. La etiología mixta se identificó en el 22% de los casos.
Cabe resaltar que el comportamiento de la neumonía adquirida en la comunidad en nuestro país tiene un comportamiento similar al de Latinoamérica, como lo demuestran los artículos publicados por Luna et al.46, en la población argentina y por Díaz et al.49, en la población chilena, en las cuales S. pneumoniae sigue siendo el principal agente etiológico y donde también se documentó una alta incidencia de gérmenes atípicos y virus respiratorios como causa de neumonía (tabla 3). Una diferencia entre los estudios realizados por estos 2 autores y nuestros estudios es la alta frecuencia de H. influenzae y Moraxella catarrhalis como agentes etiológicos, situación que no se ha documentado en nuestros trabajos. En estos 2 estudios latinoamericanos, además, la etiología mixta fue inferior a la de nuestra población y la falta de documentación etiológica fue mucho mayor y oscilaba entre el 48 y el 56%.
2.3. Factores o condiciones que incrementan el riesgo de infección con patógenos específicosExisten ciertas condiciones clínicas, ocupacionales, enfermedades concomitantes o factores sociodemográficos que generan un comportamiento epidemiológico diferente y que en los pacientes con neumonía adquirida en la comunidad, se consideran marcadores y nos permiten inferir la etiología y definir la terapia empírica (tablas 4 y 5). Todas estas condiciones denominadas factores de riesgo o enfermedades concomitantes ya han sido bien identificadas en los diferentes estudios de neumonía adquirida en la comunidad realizados en el ámbito mundial y también han sido corroborados en los estudios de nuestro país y de Latinoamérica2–6,8,9,12–15,18,20–22,29,37,38,44,46,50–56.
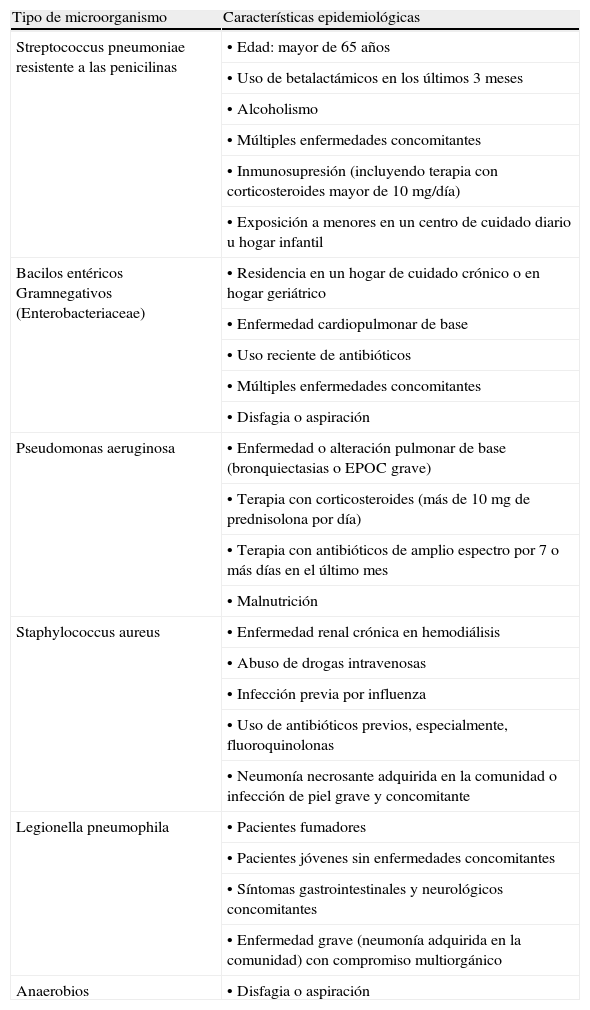
Factores de riesgo epidemiológicos asociados con etiología específica.
| Tipo de microorganismo | Características epidemiológicas |
| Streptococcus pneumoniae resistente a las penicilinas | • Edad: mayor de 65 años |
| • Uso de betalactámicos en los últimos 3 meses | |
| • Alcoholismo | |
| • Múltiples enfermedades concomitantes | |
| • Inmunosupresión (incluyendo terapia con corticosteroides mayor de 10mg/día) | |
| • Exposición a menores en un centro de cuidado diario u hogar infantil | |
| Bacilos entéricos Gramnegativos (Enterobacteriaceae) | • Residencia en un hogar de cuidado crónico o en hogar geriátrico |
| • Enfermedad cardiopulmonar de base | |
| • Uso reciente de antibióticos | |
| • Múltiples enfermedades concomitantes | |
| • Disfagia o aspiración | |
| Pseudomonas aeruginosa | • Enfermedad o alteración pulmonar de base (bronquiectasias o EPOC grave) |
| • Terapia con corticosteroides (más de 10 mg de prednisolona por día) | |
| • Terapia con antibióticos de amplio espectro por 7 o más días en el último mes | |
| • Malnutrición | |
| Staphylococcus aureus | • Enfermedad renal crónica en hemodiálisis |
| • Abuso de drogas intravenosas | |
| • Infección previa por influenza | |
| • Uso de antibióticos previos, especialmente, fluoroquinolonas | |
| • Neumonía necrosante adquirida en la comunidad o infección de piel grave y concomitante | |
| Legionella pneumophila | • Pacientes fumadores |
| • Pacientes jóvenes sin enfermedades concomitantes | |
| • Síntomas gastrointestinales y neurológicos concomitantes | |
| • Enfermedad grave (neumonía adquirida en la comunidad) con compromiso multiorgánico | |
| Anaerobios | • Disfagia o aspiración |
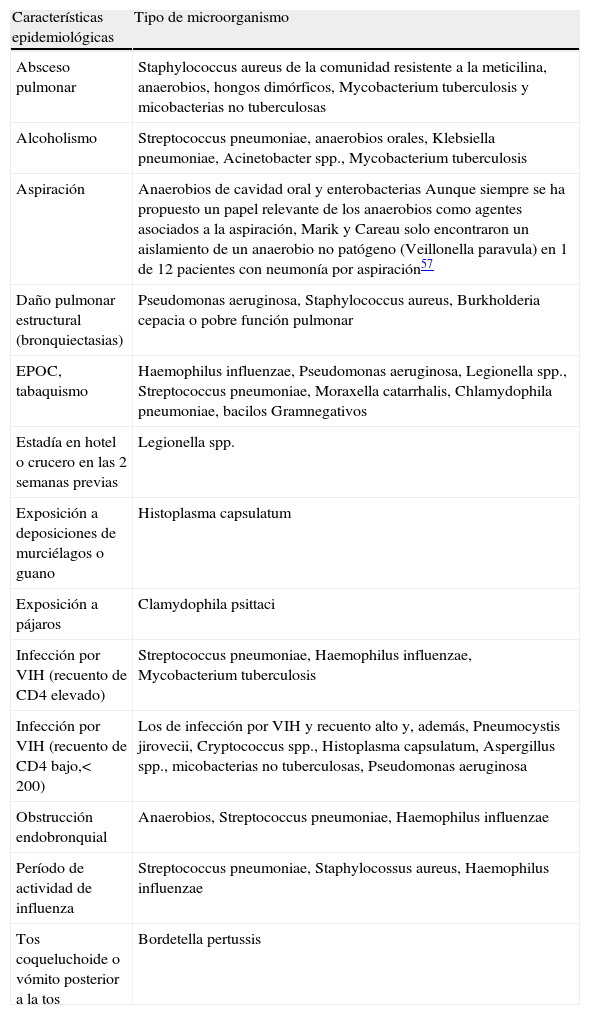
Enfermedades concomitantes que se asocian con patógenos específicos en pacientes con neumonía adquirida en la comunidad.
| Características epidemiológicas | Tipo de microorganismo |
| Absceso pulmonar | Staphylococcus aureus de la comunidad resistente a la meticilina, anaerobios, hongos dimórficos, Mycobacterium tuberculosis y micobacterias no tuberculosas |
| Alcoholismo | Streptococcus pneumoniae, anaerobios orales, Klebsiella pneumoniae, Acinetobacter spp., Mycobacterium tuberculosis |
| Aspiración | Anaerobios de cavidad oral y enterobacterias Aunque siempre se ha propuesto un papel relevante de los anaerobios como agentes asociados a la aspiración, Marik y Careau solo encontraron un aislamiento de un anaerobio no patógeno (Veillonella paravula) en 1 de 12 pacientes con neumonía por aspiración57 |
| Daño pulmonar estructural (bronquiectasias) | Pseudomonas aeruginosa, Staphylococcus aureus, Burkholderia cepacia o pobre función pulmonar |
| EPOC, tabaquismo | Haemophilus influenzae, Pseudomonas aeruginosa, Legionella spp., Streptococcus pneumoniae, Moraxella catarrhalis, Chlamydophila pneumoniae, bacilos Gramnegativos |
| Estadía en hotel o crucero en las 2 semanas previas | Legionella spp. |
| Exposición a deposiciones de murciélagos o guano | Histoplasma capsulatum |
| Exposición a pájaros | Clamydophila psittaci |
| Infección por VIH (recuento de CD4 elevado) | Streptococcus pneumoniae, Haemophilus influenzae, Mycobacterium tuberculosis |
| Infección por VIH (recuento de CD4 bajo,< 200) | Los de infección por VIH y recuento alto y, además, Pneumocystis jirovecii, Cryptococcus spp., Histoplasma capsulatum, Aspergillus spp., micobacterias no tuberculosas, Pseudomonas aeruginosa |
| Obstrucción endobronquial | Anaerobios, Streptococcus pneumoniae, Haemophilus influenzae |
| Período de actividad de influenza | Streptococcus pneumoniae, Staphylocossus aureus, Haemophilus influenzae |
| Tos coqueluchoide o vómito posterior a la tos | Bordetella pertussis |
VIH: virus de la inmunodeficiencia humana
- •
Streptococcus pneumoniae: la disminución de la sensibilidad de este agente patógeno a los betalactámicos continúa presentándose de manera controversial, la mayoría de estudios la reportan según el antiguo punto de corte de concentración inhibitoria mínima (CIM) para la penicilina como sensible ≤ 0,06μg/ml, en lugar del actualmente recomendado “punto de corte respiratorio”, es decir, CIM de penicilina ≤ 2μg/ml59,60. De hecho, la interpretación actual del Clinical and Laboratory Standards Institute para enfermedades respiratorias (punto de corte “respiratorio”) es: CIM para penicilina, < 2,0μg/ml (sensible), de 4,0μg/ml (intermedio) y ≥ 8.0μg/ml (resistente, SPRP). Además, a pesar de que se informó una mayor frecuencia global de cepas de SPRP en todo el mundo, no se encontraron cepas que presentaran un alto nivel de resistencia a la penicilina (es decir, CIM > 2μg/ml, según la anterior clasificación) en los estudios de vigilancia microbiológica antes mencionados ni en los grandes estudios clínicos prospectivos efectuados en pacientes adultos con neumonía adquirida en la comunidad. La única población en la que realmente se ha demostrado un alto impacto del neumococo resistente ha sido en la población con VIH y neumonía adquirida en la comunidad y bacteriemia asociada61.
En Colombia, según la vigilancia de neumococos invasivos realizada por el Instituto Nacional de Salud, no se han identificado cepas resistentes a la penicilina en los últimos años (2009 a 2011) (Informe, Grupo de Microbiología, Instituto Nacional de Salud, 2012). Las tasas de resistencia a los macrólidos en nuestro medio difieren de las tasasreportadas en el mundo; en general, se encuentran tasas del 15 al 39% de resistencia en Europa y en los Estados Unidos62–64, en América Latina está entre el 2 y el 15%65, y en Colombia –según el reporte publicado por el Instituto Nacional de Salud– está alrededor del 5%66,67.
Las mal llamadas “quinolonas respiratorias” (gatifloxacina, gemifloxacina, grepafloxacina, levofloxacina, moxifloxacina, sparfloxacina y trovafloxacina), se convirtieron en una opción adecuada para el tratamiento de la neumonía adquirida en la comunidad, dado que son igualmente activas contra S. pneumoniae resistente y sensible a la penicilina, algunas de estas ya no son comercializadas. Se mencionan en diferentes guías y artículos; sus índices de resistencia para S. pneumoniae permanecen por debajo del 5% en el mundo (incluyendo Latinoamérica)58,68. Sin embargo, varias publicaciones, incluso informes publicados en Latinoamérica, reportan un preocupante aumento en las concentraciones inhibitorias mínimas de las fluoroquinolonas contra S. pneumoniae69–72.
El consenso, acorde con la literatura mundial, recomienda que estas fluoroquinolonas se limiten solamente a los adultos para quienes uno de los esquemas primarios ya haya fracasado, a sujetos alérgicos a los agentes alternativos o a pacientes que presenten infección documentada con S. pneumoniae muy resistente a la penicilina59. A la fecha, no se han presentado informes de fallas terapéuticas a la penicilina ni a la amoxicilina asociadas a S. pneumoniae con resistencia a la penicilina, aunque sí hay diferentes descripciones de fallas con otros betalactámicos menos activos, como la ticarcilina, la cefazolina, y lo que es peor, muchos con quinolonas “respiratorias”.
- •
Haemophilus influenzae: esta especie es la tercera causa más común de neumonía adquirida en la comunidad que requiere hospitalización; fue descrita más frecuentemente en pacientes con EPOC grave o fumadores. La resistencia adquirida más relevante en esta especie es a las aminopenicilinas mediada por betalactamasas, que se puede evitar por la combinación de un inhibidor de betalactamasas, como el ácido clavulánico, y sulbactam a los betalactámicos. Este tipo de betalactamasas producidas por H. influenzae no afectan la actividad de las cefalosporinas de segunda y tercera generación68. Los macrólidos, al igual que las quinolonas, tienen acción sobres este agente patógeno.
- •
Staphylococcus aureus: aunque es una causa relativamente poco frecuente de neumonía, su relevancia ha aumentado en los últimos años, en especial por su posible asociación con el virus de la influenza y la aparición en la comunidad de cepas resistentes a la meticilina (SARM-AC).
La epidemiologia molecular de SARM en Colombia ha cambiado a partir del surgimiento de aislamientos SARM-AC en pacientes sin factores de riesgo, documentado desde la descripción de los 2 primeros casos en infecciones de piel y tejidos blandos y presencia de SCCmec de tipo IV y PVL73. La frecuencia de infecciones causadas por SARM-AC es cada vez más frecuente en nuestro medio e incluso se ha planteado que está diseminado y podría desplazar a las cepas clásicas en la comunidad y en los hospitales74–78. Se debe recordar que la presencia de SAMR-AC se ha asociado a cuadros que presentan una rápida evolución, muy graves y con un desenlace fatal en muchos de los casos, especialmente causando neumonías e infecciones de piel y tejidos blandos. Específicamente en neumonía, en 2009 se describieron los primeros casos de neumonía necrosante causados por SARM-AC79.
Dada la gravedad del cuadro clínico, se considera que en aquellos pacientes que ingresan al servicio de urgencias con neumonía grave, la infección por SARM-AC se debe considerar entre los diagnósticos diferenciales, y se debe iniciar una búsqueda activa de dicha etiología microbiana e iniciar un manejo antimicrobiano adecuado para evitar la mortalidad asociada a esta infección bacteriana.
Actualmente, es difícil la diferenciación entre los aislamientos hospitalarios y los de la comunidad, por lo que se recomienda apoyarse en las características fenotípicas (microbiológica y perfiles de resistencia) y, en lo posible, genotípicas para establecer su clasificación y administrarle al paciente un adecuado tratamiento.
Sección 3Características clínicas, criterios de hospitalización, escalas de gravedad y clasificaciónLa categorización es importante para el manejo de los pacientes con neumonía adquirida en la comunidad, dado que orienta la necesidad de estudios adicionales así como la definición del tipo y el lugar de asistencia, al igual que la elección del tratamiento antimicrobiano inicial, definido por el estado clínico en ese momento, y el pronóstico del paciente69–71.
Aunque existen diversos sistemas de clasificación para estimar el riesgo de muerte en la neumonía grave adquirida en la comunidad, tales como la Acute Physiological and Chronic Health Care Evaluation (APACHE II) para pacientes en cuidados intensivos, y también otros 2 índices pronósticos limitados, el Acute Physiological Score (APS) y el Simplified Acute Physiological Score (SAPS), estos últimos pueden ser de utilidad para comparar la gravedad de la enfermedad y el resultado del tratamiento entre diferentes cohortes de pacientes, y con poder predictor para el manejo individual de los pacientes72.
Por esta razón, se han desarrollado estrategias para estratificar el riesgo de los pacientes con neumonía adquirida en la comunidad sobre la base de la posibilidad de muerte. El Comité de Investigación de la British Thorax Society desarrolló y validó una escala para identificar aquellos pacientes que requieren hospitalización tanto en salas generales como en unidades de cuidados intensivos, mediante la evaluación del estado de conciencia, la uremia, la frecuencia respiratoria y la presión arterial, actualmente conocido como CURB80. Esta clasificación fue luego expandida agregando la edad en los pacientes mayores de 65 años y se le conoce como CURB-6581. El Pneumonia Patient Outcomes Research Team desarrolló otra clasificación, el PSI18.
De hecho, ambos sistemas son complementarios; mientras que las pautas de la British Thorax Society están dirigidas a la identificación de los pacientes de alto riesgo con el fin de que la gravedad de la enfermedad no se subestime, los índices pronósticos del Pneumonia Patient Outcomes Research Team están enfocados al reconocimiento de los pacientes de bajo riesgo para que la gravedad de la enfermedad no se sobreestime.
En cualquier caso, la estratificación clínica inicial de los pacientes, efectuada por normas validadas de predicción parece ser un paso inevitable para el manejo adecuado de la neumonía adquirida en la comunidad. Sin embargo, este tema merece una nueva evaluación, dado que nuevas clasificaciones clínicas, además de las pautas CURB y PSI, se hicieron más populares en la práctica clínica como, por ejemplo, la clasificación CURB modificada y la CURB-6581,82.
3.1. Características clínicasLas manifestaciones clínicas son consecuencia de la respuesta inflamatoria local y sistémica a la infección y de las complicaciones asociadas3–9,21–23,29,30. Las manifestaciones clínicas pueden agruparse así:
- 1.
Generales: fiebre, malestar, escalofríos, diaforesis, mialgias, cefalea y cianosis.
- 2.
Compromiso del tracto respiratorio inferior: tos, dificultad respiratoria (disnea, taquipnea), presencia de expectoración purulenta o hemoptoica, dolor torácico de características pleuríticas y anomalías en la auscultación pulmonar.
La semiología varía según el agente etiológico y la respuesta del huésped produciendo, en algunos casos, una consolidación pulmonar y en otros, un compromiso más difuso.
- 3.
Asociadas a complicaciones: falla respiratoria, sepsis y choque séptico, disfunción orgánica múltiple, signos de derrame pleural e infección extrapulmonar.
La decisión para la hospitalización de pacientes con neumonía adquirida en la comunidad debe estar basada en la presencia de condiciones concomitantes, la estabilidad de la condición clínica, el riesgo de mortalidad y las complicaciones asociadas.
Sin embargo, existen también condiciones independientes que obligan a la internación de los pacientes, que están relacionadas con condiciones sociodemográficas como son la incapacidad de autocuidado, la carencia de soporte familiar, los pacientes que residen en áreas de difícil acceso, las situaciones de conflicto y la edad avanzada.
En los diferentes estudios se ha determinado una serie de factores o condiciones consideradas de riesgo y que determinan la hospitalización de los pacientes con neumonía adquirida en la comunidad, pues su presencia implica un aumento de la probabilidad de morbilidad o muerte4–6,8,9,16,20,45,50,83.
Los factores que se deben de tener en cuenta y que están claramente implicados en mayor morbimortalidad son:
- 1)
Edad de 65 años o mayor: por sí sola no es un criterio de hospitalización.
- 2)
Presencia de enfermedades concomitantes como: EPOC, bronquiectasias, neoplasias, diabetes mellitus, insuficiencia renal crónica, insuficiencia cardíaca congestiva, enfermedad hepática crónica, abuso crónico de alcohol, desnutrición, enfermedad cerebrovascular y antecedentes de esplenectomía.
- 3)
Hospitalización en el último año.
- 4)
Hallazgos físicos: frecuencia respiratoria > 30por minuto, presión diastólica < 60mmHg o presión sistólica < 90mmHg, pulso mayor 125por minuto, temperatura < 35°C o > 40°C, estado de conciencia alterado y evidencia de infección extrapulmonar.
- 5)
Hallazgos de laboratorio: leucocitos de menos de 4.000 o más de 30.000células por mm3 y neutrófilos de menos de 1.000células por mm3; PaO2 < 60mmHg o PaCO2 > 50mmHg (a nivel del mar); creatinina > 1,2mg/dl o BUN >20 mg/dl; hematocrito < 30% o hemoglobina < 9mg/dl; evidencia de sepsis o disfunción orgánica, acidosis metabólica (pH<7,35) o coagulación intravascular diseminada.
- 6)
Hallazgos radiográficos como compromiso multilobar, presencia de neumatoceles y de derrame pleural.
- 7)
Factores sociales.
- 8)
Escalas o índices de gravedad CURB-65 o PSI: véanse los grupos de mayor riesgo según cada índice.
La neumonía adquirida en la comunidad es una causa importante de morbilidad y mortalidad en pacientes de todas las edades84–87. Es fundamental establecer su gravedad para su manejo. Se han descrito varias escalas de gravedad que ayudan a decidir si se puede tratar al paciente de manera ambulatoria o si es necesaria su hospitalización. Entre estas escalas se encuentran las siguientes: el PSI18, la escala CURB, de confusión, nitrógeno ureico sanguíneo elevado, frecuencia respiratoria alta y presión sanguínea aumentada, y la escala CURB con edad de 65 años o más (CURB-65)9,81. Estas escalas clasifican a los pacientes con neumonía adquirida en la comunidad en grupos, según su riesgo de mortalidad. Sin embargo, ninguna de ha sido desarrollada específicamente para identificar a los pacientes con neumonía grave adquirida en la comunidad o para decidir si su tratamiento hospitalario debe efectuarse en la sala general o en la UCI9,18.
La definición de la neumonía grave adquirida en la comunidad atañe a los casos que requieren hospitalización en la UCI4. Se requiere la internación directa en la UCI de los pacientes con choque séptico o falla respiratoria aguda que necesiten respiración mecánica asistida. La escala usada para definir la neumonía grave adquirida en la comunidad en las guías modificadas de la ATS les da el nombre de criterios mayores de gravedad88. Estas guías también recomiendan la hospitalización en la UCI de los pacientes que satisfagan otros criterios de gravedad menos importantes, llamados criterios menores.
Las guías más recientes de la IDSA y de la ATS para el tratamiento de pacientes adultos con neumonía adquirida en la comunidad observan los mismos criterios mayores de gravedad y desarrollan un nuevo conjunto de criterios menores, basados en los datos sobre el riesgo individual, a fin de identificar a los pacientes con neumonía grave adquirida en la comunidad58. No es claro si todos los criterios menores de gravedad tienen la misma importancia. Por ende, las guías recomiendan que se lleve a cabo una validación prospectiva de este conjunto de criterios. Debe considerarse la hospitalización del paciente en la UCI si el número de criterios menores es de 3 o más58.
Aproximadamente, el 10% de los pacientes hospitalizados con diagnóstico de neumonía adquirida en la comunidad -en quienes se espera una mayor tasa de complicaciones y de mortalidad, así como una hospitalización prolongada- necesitan ser atendidos en la UCI46,89,90. Sin embargo, el tratamiento óptimo de la neumonía adquirida en la comunidad exige que se reconozca la gravedad del paciente en el departamento de emergencias. Esto posibilita que se tomen decisiones acertadas en cuanto al lugar donde debe efectuarse el tratamiento. El lugar del tratamiento (en casa, en la sala general del hospital o en la UCI) determina frecuentemente la extensión de la evaluación diagnóstica, la elección y la vía de administración de la terapia antimicrobiana, la intensidad de la observación clínica y el costo económico91.
Se usan sistemas de escalas de pronóstico con el fin de determinar la tasa de mortalidad predicha asociada con la neumonía adquirida en la comunidad y, por inferencia, el lugar donde se ha de efectuar el tratamiento. Estas escalas recomiendan la hospitalización de los pacientes cuyas tasas de mortalidad se estimen más altas. Las escalas PSI18 y CURB-652,9,81 están diseñadas para reconocer aquellos casos cuyo manejo se puede hacer sin peligro fuera del hospital, cuando no hay anomalías serias de los signos vitales ni enfermedades asociadas. Sin embargo, estas escalas de gravedad no son buenas para predecir la probabilidad de que se necesite tratamiento en la UCI24,55,92. Una decisión errada con respecto a la hospitalización en la UCI puede llevar a que no se la utilice cuando sea necesario o a que se ingresen pacientes cuando no lo sea. Las consecuencias de esto son, en el primer caso, que se demore el tratamiento de algunos pacientes o que sea inadecuado, o bien que se malgasten recursos en los otros pacientes. Debe tomarse en consideración que el costo del tratamiento de las neumonías en pacientes hospitalizados es hasta 25 veces mayor que el del tratamiento ambulatorio25.
La creación de modelos precisos y objetivos de predicción de hospitalización en la UCI tiene varias ventajas. En primer lugar, la adecuada elección del lugar de hospitalización del paciente optimiza el uso de los limitados recursos de cuidados intensivos, ya que selecciona a los pacientes que realmente se beneficiarán del cuidado en la UCI o de la monitorización de alto nivel. En segundo lugar, un modelo de predicción preciso evita la demora en el traslado a la UCI de pacientes inicialmente hospitalizados en otras unidades, demora que se asocia con un aumento de la mortalidad93. En tercer lugar, la correcta elección del lugar del tratamiento puede optimizar la antibioticotera-pia inicial, ya que las etiologías microbianas de la neumonía grave adquirida en la comunidad son diferentes de las asociadas con la neumonía adquirida en la comunidad en general20,94. Evitar un tratamiento inicial con antibióticos inadecuados se asocia con una mortalidad más baja95,96.
La primera definición de neumonía grave adquirida en la comunidad basada en una guía comprendía 10 criterios4. La presencia de tan solo un criterio era suficiente para recomendar la hospitalización en la UCI. Por ende, la sensibilidad de esta regla era elevada (98%), pero su especificidad era insuficiente (32%)55. Se propuso una nueva escala que se basaba en 1 de 2 criterios mayores de gravedad (necesidad de respiración mecánica asistida y choque séptico), o 2 de 3 criterios menores de gravedad55. Las guías ATS del 2001 adoptaron esta escala88. Esta escala ATS modificada alcanza una sensibilidad del 69% y una especificad del 97% para predecir el ingreso en la UCI, mientras que la predicción de la mortalidad alcanza una sensibilidad del 94% y una especificidad del 93%24.
La escala ATS modificada demostró tener mejor capacidad para discriminar la hospitalización en la UCI que las escalas PSI, CURB y CURB-6524,91. Sin embargo, un estudio encontró que ninguna de las reglas de predicción era particularmente buena, en gran medida debido a su escaso valor pronóstico positivo. Este estudio demostró que la mayoría de los pacientes que cumplían los criterios nunca habían sido internados en la UCI91. El mismo estudio concluyó que la capacidad de discriminación de las escalas parecía ser demasiado baja como para servir de guía en la toma de decisiones respecto a la internación en la UCI en casos individuales.
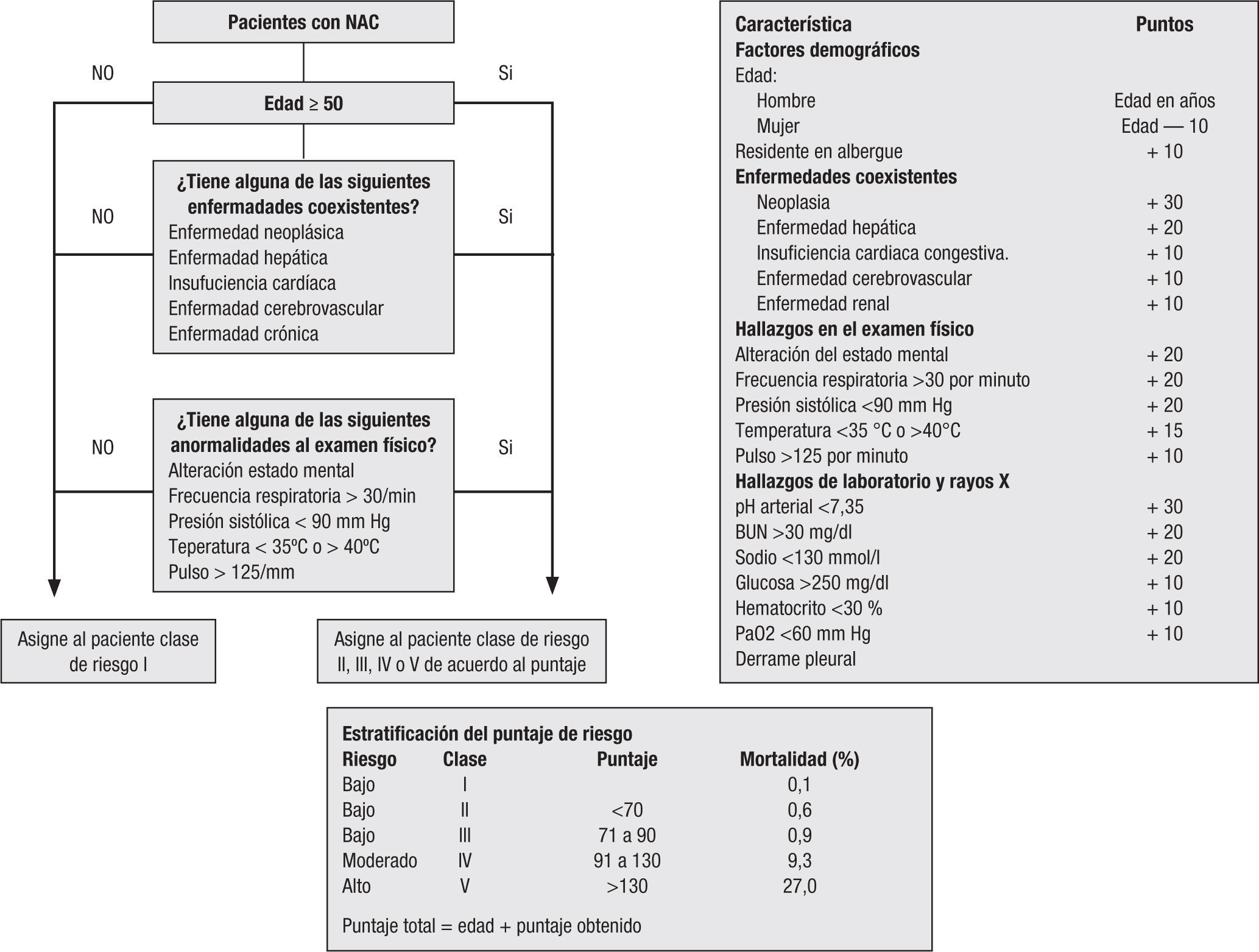
La escala PSI tiene serias limitaciones, las más importantes derivan de la gran influencia de la edad y de las enfermedades concomitantes en esta escala. Por ello puede sobrestimar o subestimar algunos pacientes con neumonía adquirida en la comunidad. Los ancianos con enfermedades concomitantes son el grupo de mayor mortalidad y casi la mitad de las muertes en este grupo ocurre fuera de la UCI. Así se puede explicar por qué menos del 20% de los pacientes de clase V ingresa en la UCI18. Además, esta escala no incluye la diabetes ni la EPOC.
La regla de predicción de las guías de IDSA/ATS para identificar los casos de neumonía grave adquirida en la comunidad es precisa, pero sobreestima ligeramente la hospitalización en la UCI en la práctica clínica. En comparación con las anteriores guías de la ATS, las actuales guías IDSA/ ATS son similares en cuanto a su capacidad de definir la necesidad de hospitalización en la UCI, y son mejores para predecir la mortalidad hospitalaria. En relación con la decisión de hospitalizar en sala general o dar salida a los pacientes con diagnóstico de neumonía adquirida en la comunidad es probable que el CURB-652,9 sea de mayor ayuda en discriminar estos pacientes con un nivel de gravedad menor97. En 2006, Capelastegui et al.98, validaron la CRB-65, es decir, sin necesidad de tener en cuenta el resultado de la urea, evitando la inclusión de un parámetro de laboratorio en la escala, sin perder capacidad discriminativa, lo cual permite que sea aplicada en cualquier nivel de atención.
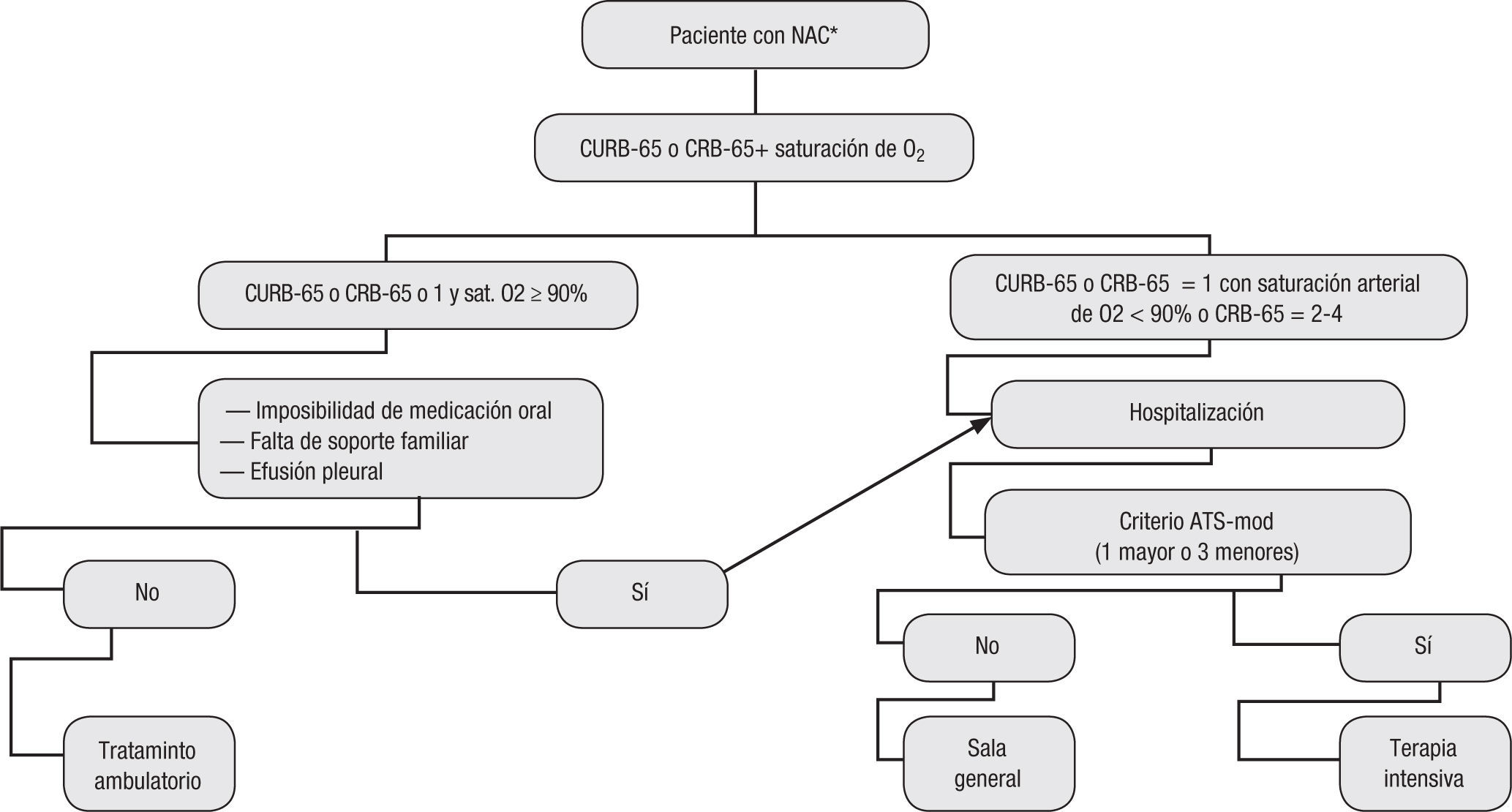
Con base en los anteriores estudios suficientemente validados, el consenso recomienda la utilización de puntajes objetivos para estratificar el riesgo (evidencia IIA) y entre ellos utilizar la escala CURB-65 o CRB-65 para definir la hospitalización en salas generales o el manejo ambulatorio (evidencia IA) y los criterios ATS/IDSA para definir el ingreso en la UCI (evidencia I IB).
3.3.1. Escala de severidad CURB-65:En el índice CURB-65 o en el CRB-65, los parámetros por determinar y cuantificar son: C: confusión; U: urea; R: frecuencia respiratoria; B: presión arterial, y edad de 65 años o más2,9.
Cada uno de estos parámetros tiene valores que deben ser cuantificados, así:
- –
C: confusión
- –
Puntuación en el test mental abreviado ≤ 8 o presencia de desorientación en persona, lugar o tiempo.
- –
U: urea > 7mmol/l (urea=BUN x 2,14) o en el sistema americano, urea > 44mg/dl o BUN > 19mg/dl
- –
R: frecuencia respiratoria ≥ 30por minuto
- –
B: Presión arterial sistólica < 90mmHg
- –
Presión arterial diastólica ≤ 60mmHg
- –
65: edad ≥65años
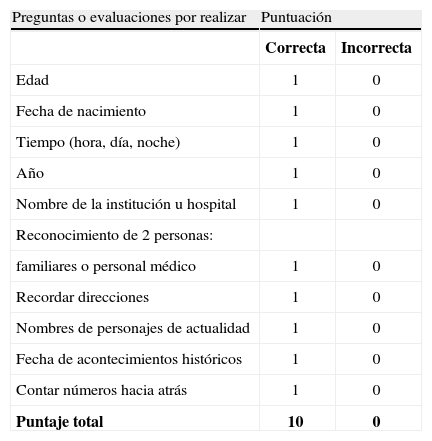
Para definir si el paciente tiene confusión o alteración del estado mental se utiliza el test mental abreviado (tabla 6).
Test mental abreviado.
| Preguntas o evaluaciones por realizar | Puntuación | |
| Correcta | Incorrecta | |
| Edad | 1 | 0 |
| Fecha de nacimiento | 1 | 0 |
| Tiempo (hora, día, noche) | 1 | 0 |
| Año | 1 | 0 |
| Nombre de la institución u hospital | 1 | 0 |
| Reconocimiento de 2 personas: | ||
| familiares o personal médico | 1 | 0 |
| Recordar direcciones | 1 | 0 |
| Nombres de personajes de actualidad | 1 | 0 |
| Fecha de acontecimientos históricos | 1 | 0 |
| Contar números hacia atrás | 1 | 0 |
| Puntaje total | 10 | 0 |
Puntuación total 0 a 10. El acierto en la respuesta a cada parámetro da una puntuación de 1, el puntaje igual a 8 o menor implica alteración.
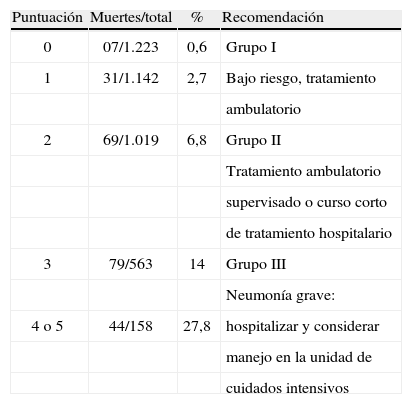
En la escala de gravedad CURB-65 (tabla 7) a cada parámetro se le asigna una puntuación de 0 o 1, según si está ausente o presente; la puntuación total va de 0 a 5 y, según la puntuación, se estratifica en 3 grupos: I, II y III.La neumonía grave adquirida en la comunidad se define por un puntaje > 2.
Escala de gravedad CURB-65.
| Puntuación | Muertes/total | % | Recomendación |
| 0 | 07/1.223 | 0,6 | Grupo I |
| 1 | 31/1.142 | 2,7 | Bajo riesgo, tratamiento |
| ambulatorio | |||
| 2 | 69/1.019 | 6,8 | Grupo II |
| Tratamiento ambulatorio | |||
| supervisado o curso corto | |||
| de tratamiento hospitalario | |||
| 3 | 79/563 | 14 | Grupo III |
| Neumonía grave: | |||
| 4 o 5 | 44/158 | 27,8 | hospitalizar y considerar |
| manejo en la unidad de | |||
| cuidados intensivos |
La escala CURB-65 o la CRB-65 deben ser aplicadas en nuestras instituciones por su sencillez, amplia validación y sin diferencias significativas con el PSI para definir sitio de tratamiento, mortalidad y complicaciones asociadas.
Se propone, entonces, clasificar la neumonía adquirida en la comunidad en 3 grupos, así:
- •
Grupo I: puntajes 0 y 1; mortalidad, 1,5%; tratamiento en casa.
- •
Grupo II: puntaje de 2; mortalidad, 9,2%; considerar tratamiento hospitalario o vigilancia ambulatoria estricta.
- •
Grupo III: puntaje igual a 3 o mayor; mortalidad, 22%; neumonía grave; es obligatoria su hospitalización y se debe considerar su ingreso en la UCI con base en los criterios de ATS/IDSA (criterios mayores y menores)4,20,24,54,55,58.
En cada grupo se deben identificar los factores de riesgo o los factores modificadores del curso de la enfermedad.
La decisión de tratamiento ambulatorio u hospitalario es de gran relevancia, clínica, ya que permite inferir la posible etiología y define la ruta de ayudas diagnósticas y la selección del tratamiento.
3.3.2. Índice de gravedad de neumonía o índice de FineEste índice también está ampliamente validado y estudiado, incluye muchos parámetros complejos, que no se encuentran disponibles en la mayoría de nuestras instituciones y que lo harían dispendioso y poco útil en instituciones de bajo nivel de complejidad. Sin embargo, es un instrumento validado y útil en instituciones donde se encuentren con recursos disponibles18 (figura 1).
Recomendaciones para hospitalización según PSI:
- 1)
Estratificación IV y V, según PSI.
- 2)
Pacientes con PSI de bajo riesgo (I, II y III), con condiciones médicas y psicosociales que contraindican el tratamiento ambulatorio:
- •
Incapacidad de autocuidado
- •
Alteración cognitiva o mental
- •
Incapacidad para mantener la ingestión oral
- •
Historia de abuso de psicofármacos
- •
Mal soporte familiar y social
- •
El reconocimiento temprano de un paciente con neumonía grave adquirida en la comunidad ayuda a la pronta iniciación de terapia tanto antimicrobiana como de resucitación basada en metas; esta es una estrategia asociada con la reducción de la mortalidad4,20,24,54,55,58.
Las guías ATS/IDSA establecieron criterios para definir el ingreso en la UCI y los clasificaron como criterios mayores y menores (tabla 8). La presencia en el ingreso a la institución de un criterio mayor o de 3 de 9 criterios menores obliga a la internación del paciente en la UCI.
- •
Criterios mayores
- a)
Choque séptico (necesidad de vasopresores).
- b)
nsuficiencia respiratoria aguda que requiera respiración mecánica asistida.
- a)
- •
Criterios menores
- a)
Frecuencia respiratoria de 30 respiraciones por minuto o más.
- b)
Relación PaO2/FiO2≤250.
- c)
Neumonía o infiltrados multilobares.
- d)
Presencia de confusión.
- e)
Urea en sangre ≥ 20mg/dl.
- f)
Leucopenia.
- g)
Trombocitopenia.
- h)
Hipotermia.
- i)
Hipotensión arterial que requiere perfusión de líquidos.
- a)
Criterios de la American Thoraci Society/Infectious Diseases Society of America para admisión en unidad de cuidado intensivo.
| Criterios mayores | Criterios menores (mínimo 3) |
| Necesidad de respiración mecánica asistida | Frecuencia respiratoria mayor de 30 por minuto |
| Soporte vasopresor | PaFiO2 < 250 |
| Infiltrados multilobares | |
| Confusión | |
| BUN > 20mg/dl | |
| Leucopenia < 4.000células/mm3 | |
| Trombocitopenia < 100.000células/mm3 | |
| Hipotermia < 36°C | |
| Hipotensión que requiere alto aporte de líquidos |
La presencia en el ingreso a la institución de un criterio mayor o de 3 de 9 criterios menores obliga a la internación del paciente en la unidad de cuidado intensivo.
La clasificación clínica de la neumonía adquirida en la comunidad está basada en condiciones de salud preexistentes que puedan comprometer el cuidado del paciente, los factores de riesgo específicos para un determinado agente etiológico, la estratificación del riesgo con base en los índices de gravedad de neumonía (CURB-65 o CRB-65, PSI y criterios ATS/IDSA para el ingreso a la UCI) y el juicio clínico del médico (tabla 9).
Clasificación de la neumonía adquirida en la comunidad para definir el sitio de tratamiento, con base en las escalas de CRB-65 (más saturación de oxígeno) y criterios de la American Thoracic Society.
| Grupo de neumonía adquirida en la comunidad con base en CRB-65 | Sitio de tratamiento |
| Grupo I: puntajes CRB-65 0 y 1 | |
| Sano sin factores de riesgo | • Ambulatorio |
| Con factores de riesgo o enfermedades concomitantes | • Ambulatorio |
| Grupo II: | |
| a) Pacientes con puntajes de 0 y 1 en CRB-65 pero con condiciones socioeconómicas de riesgo | Hospitalario en salas fuera de la unidad de cuidados intensivos |
| b) Sin factores de riesgo y sin enfermedades concomitantes con puntaje de 2 en CRB-65 | |
| c) Con factores de riesgo o enfermedades concomitantes con puntaje de 2 en CRB-65 | |
| Grupo III: puntaje de 3 o más en CRB-65 más criterios de neumonía adquirida en la comunidad grave, según los criterios de ATS/IDSA | |
| a) Sin factores de riesgo para P. aeruginosa ni para S. aureus | Hospitalización en la unidad de cuidados intensivos |
| b) Con factores de riesgo para P. aeruginosa | |
| c) Con factores de riesgo para S. aureus resistente a la meticilina | |
| Factores modificadores o enfermedades concomitantes | EPOC, insuficiencia cardíaca, diabetes mellitus, enfermedad renal crónica |
| Abuso de alcohol, inmunosupresión, neoplasia Exposición previa a antibióticos | |
| Factores específicos de riesgo | Véase la tabla 4 |
| Condiciones sociodemográficas | Incapacidad de autocuidado Carencia de soporte familiar y social |
| Residencia en áreas de difícil acceso | |
| Habitantes de la calle | |
| Situaciones de conflicto armado Edad avanzada | |
El CURB-65 o el CRB-65 deben ser aplicados en nuestras instituciones por su sencillez, amplia validación y por no tener diferencias significativas con el PSI para definir el sitio de tratamiento, la mortalidad y las complicaciones asociadas. Para completar la clasificación y graduación de la gravedad se deben aplicar de forma conjunta los criterios ATS/IDSA para definir si la atención del paciente que requiere hospitalización se hace en salas generales o se admite en la UCI.
Con base en estas aseveraciones, el consenso propone la clasificación de la neumonía adquirida en comunidad en 3 grupos, así:
- •
Grupo I: manejo ambulatorio.
- •
- •
Grupo III: enfermedad grave con necesidad de atención en cuidados intensivos.
En cada grupo se deben identificar los factores de riesgo y los factores modificadores del curso de la enfermedad.
La decisión de tratamiento ambulatorio u hospitalario es de gran relevancia, clínica, ya que permite inferir la posible etiología y definir la ruta de ayudas diagnósticas y la selección del tratamiento.
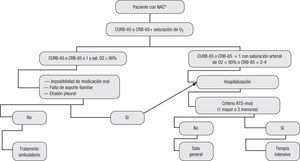
Recomendaciones:Cada paciente con diagnóstico de neumonía adquirida en la comunidad se debe estratificar según la clase de riesgo. El grupo considera que la clasificación CURB-65 o CRB-65 es un sistema adecuado de clasificación primaria. Luego de que el paciente es asignado a una categoría, se debe decidir el lugar de asistencia de acuerdo con ello, como se sugiere en la figura 2 y en la tabla 9 (evidencia IIA).
Sección 4Diagnóstico4.1. DiagnósticoEl diagnóstico de neumonía adquirida en la comunidad se establece por los datos derivados de una buena historia clínica, el examen físico y el examen radiológico.
Cuando un paciente consulta con síntomas de infección respiratoria aguda (fiebre o malestar general con tos o expectoración) pero no tiene ninguno de los siguientes criterios: frecuencia cardíaca > 100latidos por minuto, frecuencia respiratoria > 20por minuto, temperatura oral de 38°C o más, o anormalidades a la auscultación del tórax (estertores, egofonía, frémito u otros hallazgos de consolidación), la probabilidad clínica de que tenga una neumonía es muy baja y no requiere estudios adicionales (evidencia IIA)99–102. En los pacientes con síntomas de infección respiratoria aguda y alguno de esos criterios debería considerarse la toma de una radiografía de tórax para descartar neumonía (evidencia IIB)99–102.
El diagnóstico de neumonía adquirida en la comunidad puede realizarse si el paciente reúne los siguientes criterios2–4,6,8,8,21,22,30,88,103,104:
- 1)
Síntomas o signos de infección respiratoria aguda baja (presencia de, al menos, uno): tos, expectoración purulenta, disnea, dolor pleurítico, algún signo de consolidación en el examen físico del tórax (crépitos inspiratorios, frémito vocal aumentado, pectoriloquia, respiración bronquial, matidez)105.
- 2)
Síntomas o signos sistémicos (presencia de, al menos, uno): fiebre de 38°C o más, diaforesis nocturna, escalofríos, mialgias, confusión mental, leucocitos > 12.000/mm3105.
- 3)
Hallazgos en la radiografía del tórax (presencia de, al menos, uno)104: infiltrados alveolares o intersticiales seg mentarios o infiltrados en uno o más lóbulos, y que no esta ban presentes previamente, teniendo en cuenta que algunos pacientes pueden haber tenido en un inicio una radiografía normal88,104,105.
- 4)
Que no exista ninguna otra enfermedad que explique la sintomatología.
- 5)
La neumonía por aspiración puede ser considerada en pacientes con neumonía y aspiración presenciada, alteración del estado mental, alteraciones de la deglución, alteraciones en el reflejo nauseoso u obstrucción intestinal. Los infiltra]dos en la radiografía suelen localizarse en los segmentos dependientes: lóbulos inferiores (en aspiraciones que ocurran sentado o de pie), o segmentos superiores de los lóbulos inferiores o segmentos posteriores de los lóbulos superiores (aspiraciones en decúbito) (nivel de evidencia IIB)3,30,106–111.
Los pacientes con síntomas de infección respiratoria aguda (fiebre o malestar general con tos o expectoración) y alguno de los siguientes criterios: frecuencia cardíaca > 100latidos por minuto, frecuencia respiratoria > 20por minuto, temperatura oral de 38° C o más o anormalidades a la auscultación del tórax (estertores, egofonía, frémito u otros hallazgos de consolidación o de derrame pleural), deberían ser estudiados con una radiografía de tórax (evidencia IIB)99–102
A todo paciente con sospecha de neumonía adquirida en la comunidad se le debe ordenar una radiografía de tórax, tanto para confirmar el diagnóstico como para descartar la existencia de complicaciones (evidencia IIA).
4.2. Exámenes paraclínicosLa realización inicial de pruebas de laboratorio en pacientes con sospecha de neumonía adquirida en la comunidad depende del estado clínico de los individuos, la sospecha epidemiológica sobre gérmenes específicos o la necesidad de tener certeza sobre ciertos diagnósticos diferenciales. Además, pueden requerirse algunas pruebas de laboratorio para obtener una aproximación clínica en la estratificación y en algunos pacientes para redefinir un tratamiento antimicrobiano o el lugar de asistencia2,4,9,29,45.
- •
Grupo I: pacientes con CURB-65 o CRB-65 de 0 o 1, manejo ambulatorio: en principio, no requieren exámenes adicionales a una radiografía de tórax. Puede haber situaciones especiales (por ejemplo, epidemiológicas) en las que esté indicado realizar exámenes adicionales.
- •
Grupo II: pacientes con CURB-65 o CRB-65 de 2, manejo hospitalario:
- 1)
Exámenes de laboratorio: hemoleucograma, BUN, creatinina, glucemia. Algunos pacientes pueden tener indica ciones de otros exámenes paraclínicos, según el criterio médico (evidencia IIB).
- 2)
Oximetría de pulso a todos los pacientes, cuando esté disponible el recurso o gases arteriales, según criterio médico (evidencia IIA).
- 3)
Tinción de Gram y cultivo de esputo, con pruebas de sensibilidad (evidencia IIB).
- 4)
Baciloscopia seriada de esputo (evidencia IIB).
- 5)
Estudios de esputo o secreciones respiratorias para virus, de acuerdo con las recomendaciones epidemiológicas de los entes reguladores (actualmente, virus de la influenza)112.
- 6)
En pacientes con neumonía adquirida en la comunidad del grupo II, se debe considerar dentro del estudio etiológico, la posibilidad de tomar por fibrobroncoscopia muestras de la vía aérea inferior en quienes se sospecha un germen no habitual, que no mejoran a las 72h de tratamiento (véanse los criterios de mejoría) o que tengan sospecha de otra enfermedad con indicación de broncoscopia (evidencia IIB).
- 7)
Dos juegos de hemocultivos (2 frascos de hemocultivo con un volumen mínimo de 20ml de sangre en cada juego;cada juego debe ser tomado en un sitio diferente): en aquellos pacientes con abuso de alcohol, asplenia, leucopenia, derrame pleural, neumonía necrosante o con influenza previa, no se requiere dejar un espacio de tiempo entre cada juego ni que sean tomados durante un episodio de fiebre. En pacientes que hayan recibido tratamiento antibiótico previo y tengan indicación de hemocultivos, debería ordenarse un antígeno urinario para neumococo (evidencia IIC).
- 8)
Podría determinarse procalcitonina cuantitativa en aquellas instituciones que tengan la posibilidad de medirla, bajo el contexto de un programa de optimización del uso de antibióticos113 (evidencia IIC).
- 9)
Se debe estudiar el derrame pleural significativo cuando exista, es decir, > 1cm en la proyección en decúbito lateral con rayo horizontal, > 5cm en la proyección lateral de pie o documentado por ecografía de tórax, asociado a neumonía adquirida en la comunidad; se debe hacer punción pleural y enviar el liquido pleural para pruebas bioquímicas (citoquímico: recuento celular diferencial, proteínas, LDH, albúmina, pH) y microbiológicas (tinción de Gram y cultivo). No se debe olvidar en este estudio la toma de muestras en sangre para estudio comparativo (evidencia IIB).
- 1)
- •
Grupo III:
- 1)
Todos los exámenes del grupo II.
- 2)
Se debe solicitar, además de los exámenes para evaluar la disfunción orgánica (HLG, TP-TPT, gases arteriales, BUN-Cr, bilirrubina total y directa), lactato y gases venosos centrales para orientar la terapia de reanimación temprana114.
- 3)
Fibrobroncoscopia: en todo paciente con neumonía grave en respiración mecánica asistida debería tomarse por fibrobroncoscopia o por otro método alterno (aspiración traqueal, lavado broncoalveolar ciego, etc.), una muestra de las secreciones de la vía aérea inferior. Los cultivos deben ser cuantitativos.
- 4)
Pruebas pareadas de muestras de suero para gérmenes atípicos (C. pneumoniae, M. pneumoniae y Legionella spp.) y, además, antígeno urinario para Legionella spp. y S. pneumoniae (III). En caso de sospecha epidemiológica o clínica, y también en pacientes con mala evolución, se recomienda investigar los siguientes organismos (evidencia IIA): C. burnetii, virus respiratorios (virus de la influenza, virus sincitial respiratorio, adenovirus, virus de la parain- fluenza), C. psittaci y P. jirovecci.
- 1)
No se recomiendan los estudios paraclínicos de rutina en los pacientes con sospecha de neumonía adquirida en la comunidad que se manejan de forma ambulatoria (evidencia IIA). Las pruebas de laboratorio pueden ser innecesarias para pacientes menores de 50 años, con sospecha de neumonía adquirida en la comunidad, sin enfermedades concomitantes (tablas 4 y 5) y ausencia de las siguientes manifestaciones: alteración del estado mental, pulso > 125latidos por minuto, frecuencia respiratoria > 30respiraciones por minuto, presión arterial sistólica < 90mmHg y temperatura < 35°C o > 40°C; en caso contrario, se debe solicitar hemograma completo, evaluación de la función renal (incluyendo concentración de electrolitos séricos), pruebas de función hepática, glucemia y medición de saturación de oxígeno (evidencia IIB).
En pacientes con neumonía adquirida en la comunidad del grupo II se debe considerar dentro del estudio etio-lógico, la posibilidad de tomar muestras de vía la aérea inferiorpor fibrobroncoscopia en aquellos en quienes se sospecha un germen no habitual, que no mejoran a las 72h de tratamiento (véanse los criterios de mejoría) o que tengan sospecha de otra patología con indicación de broncoscopia.
Se debe estudiar el derrame pleural significativo, cuando exista, es decir, si es > 1cm en la proyección en decúbito lateral con rayo horizontal o >5 cm en la proyección lateral de pie o por ecografía de tórax, asociado a neumonía adquirida en la comunidad; se debe practicar punción pleural y estudio con pruebas bioquímicas y microbiológicas (incluye tinción de Gram y cultivo).
A todos los pacientes hospitalizados en una sala general se les debe ordenar análisis de esputo (tinción de Gram, cultivo para gérmenes comunes y tinción de Ziehl-Neelsen [baciloscopia]). La realización de hemocultivos es opcional y depende de la seriedad de la enfermedad concomitante, antecedentes de manejo antibiótico previo y sospecha de infección por germen resistente.
4.3. Clasificación con base en la etiología El diagnóstico etiológico puede considerarse:Definitivo: si en un paciente con diagnóstico clínico de neumonía adquirida en la comunidad se recupera el agente probable de muestras no contaminadas (sangre, líquido pleural o muestras obtenidas por punción transtorácica) o se recupera de secreciones respiratorias un agente patógeno que no coloniza la vía aérea superior (M. tuberculosis, Legionella spp., virus de la influenza, virus sincitial respiratorio, virus de la parainfluenza, adenovirus, SARS, P. jirovecii o H. capsulatum).
La identificación etiológica con base en pruebas de biología molecular y pruebas antigénicas, también debe ser catalogada como diagnóstico etiológico definitivo.
Los diagnósticos establecidos por pruebas serológicas se consideran definitivos si se tienen muestras comparativas con intervalo de 2 semanas en las que se demuestre un incremento de 4 veces el título de anticuerpos.
Probable: se considera como tal si en el paciente con diagnóstico clínico de neumonía adquirida en la comunidad se detecta un agente patógeno probable en secreciones respiratorias por tinciones o cultivo, con cultivos significativos por métodos semicuantitativos o cuantitativos. También se consideran como probables las serologías no pareadas con títulos cualitativos.
Sección 5Grupos especiales en neumonía adquirida en la comunidadLa neumonía adquirida en comunidad tiene comportamientos diferentes en algunos grupos ya sea por su edad, gravedad o por el agente etiológico que la ocasiona. Es importante, por tanto, conocer algunas características de importancia en cada uno de estos grupos.
5.1. Neumonía adquirida en la comunidad por neumococoEn los diferentes estudios de la neumonía adquirida en comunidad, la etiología se logra identificar solo en el 30 a 40% por los métodos convencionales y puede ascender hasta el 60% al implementarlos (tinción de Gram, cultivo de esputo y hemocultivos), pruebas serológicas para virus, M. pneumoniae, Chlamydophila spp., Legionella spp. y detección de antígenos para virus, S. pneumoniae y L. pneumophila.La etiología de la neumonía adquirida en la comunidad depende de la edad, las enfermedades concomitantes, el estado inmunitario, los factores sociodemográficos y los factores de riesgo asociados. S. pneumoniae continúa siendo el agente etiológico más frecuentemente identificado y es probable que sea el agente etiológico de ese 30 a 40% con diagnóstico de etiología desconocida.
Cuando existe etiología definida en la neumonía adquirida en la comunidad, el microorganismo aislado con más frecuencia es S. pneumoniae (20 a 60%), seguido de H. influenzae (3 a 10%), S. aureus, bacilos entéricos Gramnegativos, M. pneumoniae, C. pneumoniae, L. pneumophila y virus. Su prevalencia es variable en las diferentes series, variación que depende de los métodos diagnósticos utilizados y de otros factores, como las condiciones de salud o las enfermedades concomitantes del paciente, el uso previo de antimicrobianos, las condiciones climáticas y las condiciones sociodemográficas.
También debemos tener en cuenta que, aun en estudios de investigación, en el 40 a 60% de los casos de neumonía adquirida en la comunidad no se identifica el agente etiológico y en muchos trabajos se describen infecciones mixtas por gérmenes típicos y atípicos, lo cual tiene grandes implicaciones en el tratamiento, situación que aún desconocemos en Colombia.
Existen ciertas condiciones o factores de riesgo específicos para pensar en la probabilidad de infección por S. pneumoniae resistente a penicilinas y estos son: edad de 65 años o más, terapia con betalactámicos en los últimos 3 meses, alcoholismo, múltiples enfermedades concomitantes, inmunosupresión (incluyendo terapia con prednisona de más de 10mg/día) y exposición a menores en un centro de cuidado diario u hogar infantil.
Dadas las características del diagnóstico etiológico tardío en las neumonías adquiridas en la comunidad por los métodos convencionales, actualmente existe la tendencia a la investigación de las pruebas de detección del agente etiológico o de alguna de sus proteínas o polisacáridos que permitan un diagnóstico rápido y temprano en la neumonía adquirida en la comunidad, con el fin de orientar o dirigir la terapia antibiótica2–4,8,9,23,29,45,115.
El diagnóstico de neumonía por neumococo antes de la introducción del antígeno urinario se basaba exclusivamente en la tinción de Gram y en el cultivo de esputo, y por los hemocultivos positivos en casos de neumonía por bacteriemia116. La tinción de Gram de esputo es una prueba útil para orientar el diagnóstico etiológico de forma temprana, lo cual permite, a su vez, la instauración del tratamiento empírico inicial; sin embargo, esta prueba tiene limitaciones por la dificultad para su obtención en algunos pacientes, la calidad de la muestra que es adecuada solo en el 50 a 60% de los casos y la ausencia de expectoración en cerca del 20 a 30% de los pacientes. Los resultados positivos de los hemocultivos, que oscilan entre el 10 y 30%, son también una limitación en el diagnóstico temprano de S. pneumoniae, ya que estos se informan hasta después de 72h. Ante estas dificultades diagnósticas surgió la prueba de detección del antígeno de neumococo en orina117, prueba sencilla y rápida, que obvia las limitaciones del esputo y de los hemocultivos, dada la facilidad con que se puede recolectar una muestra de orina en los pacientes117–125.
La prueba de antígeno urinario para neumococo detecta el polisacárido C de S. pneumoniae, que se encuentra en la pared celular y es común a todos los serotipos. Es una prueba que se puede realizar de manera inmediata y rápida y obtener resultados en 15minutos, aproximadamente; la sensibilidad de la prueba oscila entre el 52 y 80% y la especificidad entre el 91 y 97%. El valor diagnóstico positivo es del 50% y el negativo del 95%117–127. La sensibilidad de la misma es mayor en pacientes con neumonía por bacteriemia, en pacientes con un cultivo de esputo positivo o tinción de Gram de esputo sugestiva de neumococo, pacientes que no hayan recibido antibióticos y pacientes con alto riesgo de desarrollar neumonía, siendo en estas situaciones de 97, 94, 93 y 92% respectivamente.
Esta prueba tiene, por lo tanto, ventajas y permite el diagnóstico temprano de neumonía por S. pneumoniae hasta 26% más veces sobre la tinción de Gram del esputo. A pesar de estas ventajas, aún la prueba del antígeno urinario para el neumococo, si bien ha sido incluida en las recomendaciones como método diagnóstico de la causa en algunas guías en el ámbito internacional, todavía existen dudas sobre su impacto para orientar el tratamiento de la neumonía adquirida en comunidad124–126.
En los estudios realizados en Antioquia12–15,37, el diagnóstico de neumococo se estableció mediante métodos convencionales (tinción de Gram, cultivo de esputo y hemocultivos) y la prueba de antígeno urinario para neumococo. Se consideró diagnostico etiológico definitivo al aislamiento de S. pneumoniae en sangre, líquido pleural o ambos, o la presencia de antígeno urinario positivo más tinción de Gram de esputo indicativo o cultivo positivo de esputo. El diagnóstico etiológico probable fue catalogado como la presencia aislada de antígeno urinario, tinción de Gram de esputo sugestiva o cultivo positivo del esputo.
El 29,1%128,129 de los pacientes hospitalizados con diagnóstico de neumonía adquirida en comunidad en 11 centros hospitalarios del Valle de Aburrá entre julio de 2005 y febrero de 2006, fueron clasificados como neumonía adquirida en la comunidad por neumococo. Con base en las definiciones establecidas, 30,8% tuvieron diagnóstico definitivo y 69,2% diagnóstico probable. El 25,6% fueron clasificados como neumonía bacteriémica y el 66,7% como neumonía no bacterié-mica. En 21 casos (53,8%), S. pneumoniae fue agente único.
Tanto en la neumonía bacteriémica como no bacteriémica por S. pneumoniae, la edad promedio fue de 44,8±19,4 años (rango, 18–94 años). Predominó el sexo masculino en ambos grupos (60 vs. 72,4%). Los principales factores de riesgo fueron: tabaco 64,1%; alcoholismo, 35,9%; uso de drogas inhaladas 29,8%; indigencia, 17,7%, y residencia en hogares geriátricos, 5,1%. Todos fueron más frecuentes en el grupo de neumonía adquirida en la comunidad por S. pneumoniae bacteriémica. Las principales enfermedades concomitantes fueron EPOC, insuficiencia cardíaca congestiva, insuficiencia renal crónica y bronquiectasias. El uso previo de antibióticos fue del 5,1% y solo estuvo presente en el grupo de neumonía bacteriémica.
Los síntomas respiratorios superiorestos y esputo purulento-, las mialgias y el dolor torácico fueron más frecuentes en la neumonía adquirida en la comunidad por bacteriemia. El compromiso hemodinámico fue del 40 vs. 10,3%. El principal compromiso radiográfico fue neumonía lobar (90 vs. 79,3%) y compromiso pleural (30 vs. 17,2%). Según el índice de gravedad de la neumonía, los grupos III del índice CURB-65 y los grupos IV y V del índice de Fine fueron del 60% en la neumonía adquirida en la comunidad por bacteriemia frente al 24,1% en la que no lo era. Se catalogaron como neumonía adquirida en la comunidad grave 80 vs. 37,9%. Las principales complicaciones fueron insuficiencia renal aguda, alteración de conciencia, choque, síndrome de disfunción orgánica múltiple y coagulación intravascular diseminada. La estancia hospitalaria promedio fue de 9,2±6,2 días (rango, 2 a 27 días) y la mortalidad de 2,6%.
En el estudio realizado en Bogotá a los pacientes que se les diagnosticó neumonía adquirida en la comunidad en urgencias y que recibieron tratamiento ambulatorio u hospitalario, se les realizaron cultivos del esputo, coloración para Pneumocystis spp., hemocultivos, anticuerpos IgM para L. pneumophila S1, M. pneumoniae, C. burnetti, C. pneumoniae, adenovirus, virus sincitial respiratorio, virus de la influenza A y B, virus de la parainfluenza 1, 2, escobillado nasofaríngeo para antígenos virales y antígeno urinario para L. pneumophila y S. pneumoniae. Esta serie también documentó que S. pneumoniae era el principal responsable de la neumonía adquirida en la comunidad con el 16% del total de pacientes (22 casos de 138 pacientes). En este trabajo no se describieron puntualmente las características de cada población ni se realizaron comparaciones entre grupos aunque en la población general las condiciones médicas descritas con más frecuencia fueron EPOC, tabaquismo, condición favorecedora de broncoaspi-ración y uso previo de antibióticos38.
La neumonía por neumococo sigue siendo la principal causa de la neumonía adquirida en la comunidad y establecer el diagnóstico de forma temprana nos ayuda a orientar el tratamiento y a reducir el espectro antimicrobiano, a pesar de tener algunos estudios contradictorios a este respecto125,126,130.
5.2. Neumonía adquirida en la comunidad por microorganismos atípicosEl término “neumonía atípica” fue acuñado inicialmente para describir las neumonías con un comportamiento clínico o radiológico diferente al considerado habitual. Dado que no siempre los comportamientos clínicos y los patrones radiológicos permiten hacer una diferenciación clara de los agentes patógenos implicados, el término ha quedado limitado a las neumonías producidas por agentes patógenos específicos. Estas infecciones pueden ser divididas en zoonóticas y no zoonóticas. En el primer grupo se encuentran Chlamydia psittaci (psittacosis), Francisella tularensis (tularemia) y Coxiella burnetii (fiebre Q); del segundo grupo forman parte C. pneumoniae, M. pneumoniae y Legionella ssp. Además, de esta definición se excluyen las infecciones virales como las producidas por hantavirus y la influenza aviar, entre otras131.
En nuestro medio, las infecciones por estas bacterias son responsables del 2 al 37% de los casos de neumonía adquirida en la comunidad39–41. Los estudios locales más recientes informan compromiso por gérmenes atípicos entre el 14 y el 26,7% en el Valle de Aburrá12,15,37,41 y del 7,4% en Bogotá38.
Clínicamente, estas infecciones son más frecuentes en el contexto del paciente joven y ambulatorio aunque también pueden producir infecciones graves, principalmente en el contexto de L. pneumophila, teniendo como común denominador el compromiso clínico o de laboratorio de otros órganos, además del pulmón.
En el abordaje del paciente con sospecha o confirmación de neumonía, es importante interrogar sobre el potencial contacto con aves, gatos, ovejas o conejos con el fin de evaluar la posibilidad de estar al frente de un caso de psittacosis, fiebre Q o tularemia. Si se descarta el contacto, los microorganismos implicados se restringen a C. pneumoniae, M. pneumoniae y L. pneumophila.
Los pacientes con infección por L. pneumophila característicamente cursan con un extenso compromiso clínico y paraclínico que compromete varios sistemas: cefalea, confusión, encefalopatía, bradicardia relativa, diarrea, dolor abdominal, elevación de las enzimas hepáticas y musculares, hematuria microscópica, falla renal, hiponatremia e hipo-fosfatemia. Este extenso compromiso produce un síndrome clínico en el cual el paciente con neumonía se puede encontrar muy comprometido en su estado general y respiratorio. Es responsable de un porcentaje bajo de casos de neumonía adquirida en la comunidad en la población general, pero puede ser el agente causante de ella hasta en el 16% de los casos que requieren hospitalización y, aunque las neumonías atípicas comúnmente han sido asociadas en conjunto con formas de neumonías más leves, la neumonía causada por L. pneumophila en particular puede ser muy grave y presentar altas tasas de mortalidad. Por lo general, se asocia con la exposición a una fuente de aguas infectadas en grandes edificios, hoteles u hospitales: sistemas de agua caliente y fría, torres de refrigeración, humidificadores, máquinas de rocío, spas y fuentes de aguas termales, etc. Se cree que no se transmite de persona a persona. El tabaquismo, la EPOC y la inmunosupresión son factores de riesgo para su desarrollo.
Los pacientes con infección por M. pneumoniae tienen más compromiso del tracto respiratorio superior con mirin-gitis bulosa, otitis o faringitis. Además, pueden tener dia rrea, lesiones en piel de eritema multiforme y, a diferencia de la infección por Legionella spp., es raro el compromiso renal, hepático, muscular y del sistema nervioso central. M. pneumoniae causa hasta el 20% de los casos de neumonía adquirida en la comunidad por gérmenes atípicos y también es responsable de algunas epidemias de neumonías adquiri das en los hospitales. La infección ocurre principalmente en niños y adultos jóvenes, por trasmisión directa de humano a humano, y se ve a menudo en entornos comunitarios cerrados, como internados, colegios y bases militares. Hay un aumento relativo de la incidencia durante los meses de verano y otoño. Las epidemias ocurren en intervalos de 3 a 5 años. La exposición previa es protectora, mientras que fumar supone un riesgo para la enfermedad.
Las infecciones por C. pneumoniae pueden tener un cuadro clínico similar al de M. pneumoniae pero en ausencia de lesiones cutáneas. Causa entre el 5 y el 10% de los casos de neumonía adquirida en la comunidad por gérmenes atípicos. Al igual que la neumonía por M. pneumoniae, la infección ocurre principalmente en niños y adultos jóvenes, transmitida también de persona a persona, y se ve, a menudo, en entornos comunitarios cerrados.
En nuestro medio, en los trabajos realizados en Medellín por Vélez et al.12,41, y Montúfar et al.15,37, los gérmenes atípicos más frecuentes fueron M. pneumoniae (11,6 a 13,8%), C. burnetii (1,2 a 5,8%), C. pneumoniae (8,7%) y L. pneu-mophila (1,2 a 1,9%) y hasta en 34,6% se confirmó etiología mixta. En el estudio de Caballero et al.38, L. pneumophila ocupó un destacado tercer lugar en prevalencia como único germen implicado con 2,9% y fue el único microorganismo atípico identificado como único implicado en la infección. Además, se encontró un número no despreciable de coinfecciones dentro de las que destacan la de S. pneumoniae y C. pneumoniae en 3 casos y L. pneumophila y K. pneumoniae, L. pneumophila y M. pneumoniae, y S. pneumoniae y L. pneumophila con un caso cada una.
DiagnósticoAnte un paciente con sospecha de neumonía atípica debemos elaborar la historia clínica que incluya identificación de los factores de riesgo, sintomatología y una exploración física general. La realización de pruebas complementarias depende de los factores de riesgo y de los hallazgos clínicos.
Historia y examen clínicoLos principales factores de riesgo incluyen la convivencia en entornos comunitarios cerrados, como internados, residencias universitarias, campamentos militares o incluso hospitales, y los estados de inmunosupresión. En la anamnesis también se valora la enfermedad concomitante si la hubiere, el contacto con animales, los viajes recientes o la historia de contacto previo con pacientes con infección respiratoria.
Por lo general, los pacientes se quejan de tos persistente no productiva. Es frecuente la presencia previa de un cuadro respiratorio de vías altas, malestar general, mialgias o artralgias. La fiebre, si está presente, suele ser de bajo grado, menos frecuentemente es elevada. En muchos casos de infecciones por M. pneumoniae y C. pneumoniae, es frecuente la presencia de faringitis, disfonía y cefalea. La diarrea y la confusión mental pueden acompañar a las infecciones por Legionella spp. La miringitis bullosa es un signo raro (5%) pero que sugiere infección por M. pneumoniae. Una erupción cutánea máculo-papular o vesicular puede acompañar a la infección por M. pneumoniae.
Los signos clínicos de neumonía, tales como sonidos crepitantes o soplo tubárico, pueden ser leves o estar ausentes.
Radiografía de tórax: en la radiografía de tórax puede observarse infiltrado intersticial o una condensación no lobar y frecuentemente presenta una importante disociación clínico-radiológica (anomalías radiológicas más importantes de lo que sugiere el examen físico). Por otro lado, la existencia de infiltrado en la radiografía, sin signos clínicos que la acompañen, obliga a descartar otras causas distintas de la que nos ocupa, y se debe tener en cuenta que no existe ningún patrón radiológico que permita reconocer la etiología de la neumonía58.
Exámenes de laboratorio: cabe resaltar que en los estudios convencionales cuando el paciente cursa con neumonía adquirida en la comunidad por gérmenes atípicos, se podría documentar: leucocitosis (por lo general, < 13.000por mm3 con una linfocitosis relativa), hemoglobina disminuida (usualmente asociada a infección por M. pneumoniae), alteración de la función hepática (sugieren infección por M. pneumoniae o L. pneumophila), hipo-natremia e hipofosfatemia (usual en neumonía adquirida en la comunidad por L. pneumophila). La elevación del nitrógeno ureico o una saturación de oxígeno disminuida, usualmente están relacionadas con un peor pronóstico y la necesidad de hospitalización.
Otras exploraciones complementarias no están indicadas de forma rutinaria, salvo que el paciente sea hospitalizado o se sospeche alguna complicación o duda diagnóstica.
5.3. Neumonía adquirida en la comunidad en adulto mayor de 65 años o másLa verdadera proporción de casos de neumonía adquirida en la comunidad en personas de 65 años o más, con respecto a la población general afectada por ella, es desconocida y, posiblemente, sea pequeña. Sin embargo, los cambios de la pirámide de la población a escala mundial han hecho que este grupo etario aumente gradualmente y, por ende, se incremente la incidencia de algunas enfermedades que afectan más a este grupo de pacientes, incluyendo la neumonía adquirida en la comunidad. Pocos datos existen sobre el comportamiento y los resultados de la atención de la neumonía adquirida en la comunidad en personas de 65 años o más, pero se considera que es una causa frecuente de hospitalización y mortalidad. Según Kaplan et al.51, en los Estados Unidos la incidencia de neumonía adquirida en la comunidad en población adulta de 65 años o más es de 18,3 por 1.000 habitantes. Sin embargo, cuando se estratifican las edades, la incidencia cambia notoriamente con la edad, pasando de 8,4 por 1.000 en personas de 65 a 69 años, a una incidencia de 48,5 por 1.000 en mayores de 90 años. El grupo etario afectado con mayor frecuencia está entre los 75 y los 80 años y existe una incidencia mayor en hombres que en mujeres (19,4 por 1.000 frente a 15,6 por 1.000). Aproximadamente, en 60 a 70% de estos pacientes se encuentran enfermedades concomitantes, y en orden de frecuencia son: insuficiencia cardíaca congestiva (32%), EPOC (25%), diabetes mellitus (17,4%), neoplasias malignas (9%) y enfermedad neurológica (8,6%)15,20,36,46,51,52,132.
En los pacientes de 65 años o más, la neumonía adquirida en la comunidad puede requerir tratamiento hospitalario en una mayor proporción y se estima que, aproximadamente el 22% de los casos son catalogados como neumonía grave adquirida en la comunidad que requiere tratamiento en la unidad de terapia intensiva y, de estos, el 30% son sometidos a respiración mecánica asistida, medidas que para muchos pudieran ser excesivas, pero que han demostrado su utilidad al lograr una supervivencia del 50% o más en pacientes mayores de 90 años que han sido sometidos a ellos, dando validez a este tipo de medidas36,52,132. Aproximadamente, el 10% de los pacientes con neumonía adquirida en la comunidad en pacientes de 65 años o más presentan complicaciones durante su hospitalización, y las más frecuentes son el derrame pleural, las atelectasias y la sepsis.
Cuando se realizan estudios tendientes a la determinación de la etiología, esta solo se puede establecer en el 30 a 35% de los casos, quedando las dos terceras partes sin diagnóstico etiológico. Los gérmenes que se han identificado con mayor frecuencia son: bacilos entéricos Gramnegativos (10%), S. pneumoniae (5,6%), S. aureus (5%), Pseudomonas spp. (4,6%) y H. influenzae (3%). Es importante, además, tener en cuenta en la etiología a los gérmenes anaerobios que colonizan la cavidad oral, pues está demostrado que los pacientes ancianos tienen un mayor número de episodios de broncoaspiración y neumonía por aspiración comparados con la población joven15,20,36,46,51,52,132,133. En las tablas 10 y 11 se pueden apreciar las características de nuestra población y las de la población española; en ambas, S. pneumoniae sigue siendo el agente etiológico de mayor importancia, seguido en este grupo de población de los bacilos entéricos Gramnegativos y no fermentadores, al igual que las bacterias atípicas, lo cual hace que este grupo de población sea de características especiales cuando pensamos en terapia empírica para la neumonía adquirida en la comunidad.
Características de neumonía adquirida en la comunidad en pacientes de 65 años o más en Colombia (n=48).
| Características | |
| Demográficas | |
| Edad promedio (años) | 77,2±8,9 |
| Rango (años) | 65–98 |
| Sexo masculino | 21(46%) |
| Factores de riesgo | |
| Tabaquismo | 24(50,0%) |
| Antibióticos en las últimas 48h | 3(6,3%) |
| Antibióticos en los últimos 3 meses | 10(20,8%) |
| Hogares de ancianos | 4(8,3%) |
| Enfermedades concomitantes | |
| EPOC | 37(77,1%) |
| Insuficiencia cardíaca congestiva | 17(35,4%) |
| Enfermedad de tejido conjuntivo o autoinmune | 5(10,4%) |
| Insuficiencia renal | 4(8,3%) |
| Diabetes mellitus | 4(8,3%) |
| Enfermedad cerebrovascular | 3(6,3%) |
| Síntomas | |
| Disnea tipo III–IV (de acuerdo a escala del NYHA) | 33(68,8%) |
| Fiebre | 30(62,5%) |
| Síntomas respiratorios altos | 24(50,0%) |
| Tos y esputo purulento | 21(43,8%) |
| Dolor pleurítico | 15(31,3%) |
| Hallazgos en el examen físico | |
| Frecuencia cardíaca > 100latidos por minuto | 19(40,0%) |
| Frecuencia respiratoria > 24por minuto | 16(33,6%) |
| Presión arterial diastólica < 60mmHg o sistólica < 90mmHg | 10(20,8%) |
| Etiología | |
| Aislamiento un solo germen | 22(45,8%) |
| Etiología mixta | 10(20,8%) |
| Desconocida | 24(50,0%) |
| Tipo de microorganismo | |
| Bacterias piógenas | 39,6% |
| Virus respiratorios | 35,4% |
| Bacterias atípicas | 22,9% |
| Radiografía de tórax | |
| Lobar | 30(62,5%) |
| Multilobar | 18(37,5%) |
| Derrame pleural | 16(33,3%) |
| Complicaciones | |
| Alteración de conciencia | 11(22,9%) |
| Insuficiencia renal aguda | 10(20,8%) |
| Síndrome de dificultad respiratoria aguda | 6(12,5%) |
| Síndrome de disfunción orgánica múltiple | 3(6,25%) |
| Coagulación intravascular diseminada | 2(4,2%) |
| Empiema | 1(2,1%) |
| Neumonía adquirida en la comunidad, grave | 26(54,2%) |
| Observancia de las guías de la ATS | 37,5% |
| Observancia de las guías de la ACNCT 2003 | 20,8% |
| Estancia hospitalaria (días) | 10,5±7,2 |
| Rango (días) | 2 a 32 |
| Estancia en unidad de cuidados intensivos (días) | 9,3±10,5 |
| Rango (días) | 1 a 21 |
| Respiración mecánica asistida (días) | 6,3±10,1 |
| Mortalidad general | 5/48(10,6%) |
| Mortalidad por neumonía adquirida en la comunidad, grave | 5/26(19,3%) |
ACNCT: Asociación Colombiana de Neumología y Cirugía del Tórax; ATS: American Thoracic Association; Escala NYHA (New York Heart Association) para valoración funcional de insuficiencia cardíaca.
Etiología de neumonía adquirida en la comunidad en mayores de 65 años.
| Agente etiológico | Montúfar et al., 2006 | Angel Vila-Corcoles 2009 |
| (%) | (%) | |
| Streptococcus pneumoniae | 12,5 | 49 |
| Mycoplasma pneumoniae | 12,5 | |
| Virus de la influenza A y B | 16,7 | |
| Chlamydophila pneumoniae | 4,2 | 9 |
| Adenovirus | 10,4 | |
| Coxiella burnetii | 4,2 | 0,7 |
| Virus sincitial respiratorio | 6,2 | |
| Enterobacteriacea | 6,2 | |
| Mycobacterium tuberculosis | 0,7 | |
| Staphylococcus aureus | 2,1 | 4,9 |
| Haemophilus influenzae | 4,2 | 6 |
| Streptococcus ß- haemolyticus | 2,1 | |
| Otros cocos Grampositivos: | ||
| Staphylococcus coagulasa negativos, | ||
| Streptococcus spp. | 4,2 | |
| Virus de la parainfluenza 1, 2 y 3 | 2,1 | |
| Legionella pneumophila | 2,1 | 2,8 |
| Otros bacilos Gramnegativos | ||
| Pseudomonas aeruginosa, | 4,2 | 15,5 |
| Acinetobacter baumanii | 2,1 | |
| Histoplasma capsulatum | ||
| Moraxella catarrhalis | 2,1 | |
| Etiología desconocida | 33,3 | 66,5 |
| Germen único | 45,8 | 33,7 |
| Etiología mixta | 20,8 | 2,7 |
| Total | 48 | 100 |
Montúfar et al. Infectio. 2006;10:113. Referencia15.
La tasa de mortalidad es variable y oscila alrededor del 10% pero, al igual que la incidencia, cuando se comparan diferentes grupos etarios incrementa a mayor edad: 15,4 por 1.000 en pacientes de 90 años o más frente a 7,8 por1.000 en personas de 65 a 69 años. La mortalidad está asociada con la edad, enfermedades concomitantes, residencia en hogares de ancianos o en hogares de cuidado crónico y la gravedad de su presentación.
5.4. Neumonía adquirida en la comunidad y embarazoLa neumonía adquirida en la comunidad es una enfermedad común que puede ser seria, con importante morbilidad y mortalidad, especialmente en pacientes embarazadas134,135. Es la mayor causa de infección fatal no obstétrica en pacientes embarazadas. La incidencia oscila entre el 0,5 y 1,5 por 1.000 partos, dependiendo de la población estudiada135; la prevalencia estimada antes del parto es similar a la de mujeres no gestantes: entre 0,78 y 2,7 por 1.000 partos129,135–139. Es ampliamente conocido que la mujer embarazada no tolera de forma adecuada la infección pulmonar, llegando a necesitar respiración mecánica asistida en el 10 a 20% de los casos y desarrollar bacteriemia en el 16%, y empiema en el 8%138. El neumotórax, la fibrilación auricular y el taponamiento pericárdico son responsables del 4% adicional de las complicaciones138. La falla respiratoria debido a neumonía es la tercera causa de intubación durante el embarazo
Aunque la mortalidad materna es todavía significativamente alta, se ha reducido con el uso adecuado de antibióticos desde el 23% a menos del 4% y las muertes que han ocurrido fueron debidas a enfermedades cardiopulmonares coexistentes129,138–140.
La neumonía que complica el embarazo tiene efectos adversos en el feto. En la serie descrita por Madinger et al., el parto prematuro ocurrió en el 44% de los casos, con una tasa de nacidos prematuros del 36%, bajo peso al nacer con menos de 2.500 g en el 33,9% de los casos frente al 13% del grupo control. Aumenta la necesidad de tactos vaginales en el 22% frente a al 4,2% del grupo control y menor edad de gestación del parto a menos de 34 semanas.
El riesgo de neumonía es bajo en el primer trimestre (0 a 16%) con aumento de la incidencia en el tercer trimestre129,135–138. La neumonía es la segunda causa de rehospitalización posterior al parto como proceso infeccioso y se duplica en caso de pacientes que tuvieron cesárea. Las molestias abdominales secundarias a las fajas luego de la cesárea, la anestesia espinal que suprime el reflejo de la tos, al menos durante 4h después de la cesárea, incrementan el riesgo de broncoaspiración y las enfermedades asociadas en pacientes que requieren de cesárea como único medio de desembarazarse y pueden predisponer a la infección134.
El embarazo conlleva una serie de cambios fisiológicos que tienen implicaciones en la respuesta materna a la neumonía. En cuanto al tórax, el diafragma se desplaza, más o menos, 4cm cefálicamente en el tercer trimestre y el diámetro transverso del tórax aumenta 2,1cm; disminuye la capacidad funcional residual hasta en un 15 a 20% en el embarazo a término, aumenta el consumo de oxígeno y aumenta el agua en el pulmón; disminuye el aclaramiento de las secreciones y aumenta el potencial de obstrucción de la vía aérea con predisposición a la neumonía134–136. La frecuencia respiratoria no cambia esencialmente pero el volumen corriente se incrementa, resultando en aumento de la ventilación minuto por encima del 50% comparado con la de mujeres no gestantes. No hay cambios en la capacidad vital forzada, capacidad de difusión y distensibilidad pulmonar135. Hay disminución de la resistencia pulmonar total, secundaria a los niveles altos de progesterona. El resultado neto de estos cambios fisiológicos es el aumento de las necesidades de oxígeno, pero con una capacidad disminuida para compensar el efecto de las enfermedades respiratorias durante el embarazo135.
Desde el punto de vista inmunológico, los cambios también pueden influir en la propensión a la infección y su desenlace. Los cambios de la inmunidad celular materna, especialmente en el segundo y tercer trimestre, protegen al feto del rechazo inmunológico de la madre, que son: supresión de las células T citotóxicas, predominio de las células ayudadoras de tipo 2 sobre las células de tipo 1 ayudadoras de 4:1, con el resultado de la disminución de la secreción de IL-2, el interferón gamma, el TNF-β y la actividad de las células asesinas también se disminuye135. La elevación de los niveles de cortisol, progesterona, gonadotropina humana y alfafetoproteína, también pueden inhibir la inmunidad celular. Estos cambios predisponen a infecciones por virus y hongos y a la tuberculosis134. En la mayoría de los casos, la neumonía adquirida en la comunidad se desarrolla cuando el agente infeccioso alcanza el tracto respiratorio inferior por inhalación del material infeccioso en aerosoles o por aspiración de microorganismos de la vía aérea superior y menos por diseminación hematógena. Las defensas anatómicas, humorales y celulares del huésped son superadas por la virulencia de los agentes patógenos y por el tamaño del inóculo135. Condiciones como el asma, la anemia, la farmacodependencia, la enfermedad hepática, la EPOC, la malnutrición, el tabaquismo y el uso de esteroides al intentar la maduración pulmonar aumentan la vulnerabilidad a complicaciones135,137,138. Los agentes tocolíticos pueden incrementar el riesgo de edema pulmonar y pueden empeorar el estado respiratorio en pacientes con neumonía adquirida en la comunidad138.
Los datos disponibles de los agentes infecciosos causantes de neumonía en mujeres embarazadas son similares a los que causan infección en mujeres no embarazadas, raramente son encontrados y el agente causal es identificado en el 40 al 60% de los casos. En adultos, el 60 al 80% de las neumonías adquiridas en la comunidad son causadas por bacterias, el 10 al 20% por gérmenes atípicos y el 10 al 15% por virus138; los virus más comunes son los de la varicela y la influenza, esta última es particularmente importante por el alto riesgo de hospitalización en el tercer trimestre y mortalidad del 12,5 al 42,1%; los hongos como causa de neumonía en el embarazo es rara138 y los parásitos también están implicados afectando poblaciones inmunocomprometidas. Estos datos son de estudios observacionales y retrospectivos en los que los patógenos más comunes fueron: S. pneumoniae, H. influenzae, M. pneumoniae y L. pneumophila136. Hopwood identificó el agente causante en 9 de 26 casos, con mezcla de bacterias Grampositivas, Gramnegativas y virus A de la influenza. Benedetti et al. encontraron bacterias en 21 de 39 pacientes, principalmente S. pneumoniae seguido por 13 casos de H. influenzae. Madinger, et al. encontraron los mismos agentes patógenos, neumococo, seguido de H. influenzae. Mercieri menciona que S. aureus causa cerca del 10% de los casos de neumonía adquirida en la comunidad, que se ha incrementado por la aparición de SAMR129. La tinción de Gram del esputo y los hemocultivos fueron los principales medios diagnósticos y los estudios serológicos en busca de patógenos atípicos fueron raramente utilizados134.
Los síntomas clínicos incluyeron fiebre, tos, escalofríos y disnea. En el artículo de Goodnight, se reporta durante el embarazo, en orden de frecuencia: tos productiva, 59,3%; taquipnea, 32,2%, y dolor pleurítico, 27,1%138.
En las mujeres embarazadas también se aplican los índices de gravedad de neumonía para hospitalización y como factores predictores de mortalidad138.
En cuanto a la evaluación de la neumonía adquirida en la comunidad, el examen físico solo tiene baja sensibilidad (47 al 69%) y especificidad (58 al 75%), y debe ser asociado a una adecuada historia, radiografía de tórax que siempre debe obtenerse (con abdomen protegido) recomendación hecha en las guías de la ATS/IDSA. Munn et al. demostraron que el 98% de las pacientes embarazadas tenían radiografías positivas para neumonía, oximetría o gases arteriales, química sanguínea de rutina, cuadro hemático y hemocultivos en los casos graves, especialmente si no habían recibido antibióticos. Se deben obtener 2 frascos para cultivos, tinción de Gram y cultivos de esputo si hay sospecha de agentes patógenos resistentes u organismos no cubiertos por la terapia empírica iniciada; las pruebas serológicas no se recomiendan o se consideran opcionales134–138.
A pesar de la falta de estudios controlados de asignación aleatoria, los estudios de casos y controles sugieren que la terapia en mujeres embarazadas deben seguir las guías actuales de tratamiento de la neumonía en adultos y la preocupación con respecto a las consecuencias sobre el feto no deben demorar el tratamiento, ya que al mejorar la oxigenación materna se asegura y protege al feto136.
Sección 6TratamientoEn el tratamiento de la neumonía adquirida en la comunidad se deben considerar las medidas generales de tratamiento en el paciente hospitalario, además del tratamiento antibiótico.
6.1. Medidas generalesEn todos los pacientes se debe garantizar (evidencia IIA):
- •
Suplencia adecuada de oxígeno para lograr saturación > 90%. En los pacientes con riesgo de hipercapnia se deben hacer mediciones de gases arteriales.
- •
Hidratación y balance electrolítico adecuado.
- •
Profilaxis para trombosis venosa profunda y embolismo pulmonar.
- •
Terapia respiratoria.
- •
Manejo de enfermedades concomitantes.
- •
Monitorización hemodinámica y respiratoria no invasiva.
- •
Para los pacientes que ingresen a las unidades de cuidados intensivos, se recomienda la reanimación protocolizada y cuantitativa de los pacientes con hipoperfusión tisular inducida por sepsis (definidos como hipotensión que persiste después de la exposición inicial de líquidos intravenosos o que tengan un lactato en sangre > 4mmol/L). Durante las primeras 6 h de resucitación, los objetivos de la reanimación inicial debe incluir todas las siguientes como parte de un protocolo de tratamiento (evidencia IB)114:
- a)
PVC de 8–12mmHg.
- b)
Presión arterial media > 65mmHg.
- c)
Diuresis > 0,5ml/kg por hora.
- d)
ScVO2 > 70% o SVO2 > 65%.
Se sugiere la orientación de la reanimación para normalizar el lactato en los pacientes con niveles elevados de lactato como un marcador de hipoperfusión tisular (evidencia I IB).
6.2. Tratamiento antimicrobianoEl inicio de la terapia para la neumonía adquirida en la comunidad es empírico y basado en la clasificación y estratificación como se mencionó anteriormente en la tabla 9 y la figura 2. Este tratamiento se debe modificar con base en el agente etiológico identificado o aislado y las pruebas de sensibilidad antimicrobiana2,6,9,20,128.
- •
Cuándo iniciar el tratamiento: con el fin de reducir la morbilidad y la mortalidad, el inicio del antibiótico debe hacerse en las primeras 4 a 6h4,6,9,128. El antibiótico debe iniciarse en la primera hora en los pacientes con choque séptico (evidencia IB) y en aquellos con sepsis grave sin choque séptico (evidencia IB). La espera de los resultados de los exámenes paraclínicos, incluida la radiografía de tórax, no debe retrasar el inicio de los antibióticos.
- •
Esquemas de tratamiento: la elección del antibiótico depende de la clasificación del paciente (tabla 8), de la epidemiología local y regional y de los factores de riesgo (tabla 4) o enfermedades concomitantes (tabla 5). Este tratamiento empírico inicial debe modificarse según el agente etiológico aislado y su perfil de sensibilidad4,6,9,141,142 (evidencia IIIA). La tasa de identificación microbiológica, en general, es baja y, por lo tanto, en estas condiciones no es posible hacer una reducción de la intensidad de la terapia antibiótica; de allí deriva la importancia de realizar la aproximación diagnóstica y la terapia empírica de inicio acorde con la estratificación del riesgo y gravedad del paciente. En la modificación del esquema antimicrobiano cuando hay identificación etioló- gica, siempre se debe realizar terapia de reducción y elegir el antibiótico efectivo de menor espectro141,142.
Con base en los estudios hechos en Colombia de neumonía adquirida en la comunidad, es recomendable que todo paciente que requiera hospitalización reciba terapia combinada con un betalactámico y un macrólido. Esta recomendación no se aplica para los pacientes en quienes se hace tratamiento ambulatorio (evidenciaII-B).
En la elección de la terapia antimicrobiana, siempre debemos propender por el uso racional y adecuado de los mismos141,142; se debe evitar, en la medida que sea posible, la utilización en forma empírica de quinolonas y cefa-losporinas de tercera generación, ya que este grupo de antibióticos está implicado en la aparición de resistencia. Además, el abuso de las quinolonas puede causar la aparición de resistencia a M. tuberculosis (evidencia IIA).
La duración de la terapia es individualizada pero, en términos generales, está entre 5 y 7 días. La presencia de enfermedades concomitantes, bacteriemia o gravedad de la neumonía adquirida en la comunidad debe ser considerada para prolongar la terapia. Mycoplasma pneumo-niae, L. pneumophila y C. pneumoniae pueden necesitar terapias más prolongadas, de 10 a 14 días. En pacientes con neumonía adquirida en la comunidad por S. aureus, la terapia puede extenderse según la respuesta y la presencia de complicaciones, a 14 o 21 días128,141,142.
Algunas recomendaciones para la utilización de antibióticos en neumonía incluyen:
- •
El diagnóstico de neumonía y la decisión de inicio del antibiótico deben ser revisadas por el clínico con mayor experiencia (médico internista, neumólogo o infectólogo).
- •
No debe haber limitaciones para descontinuar los antimicrobianos si no están indicados.
- •
La indicación de antibióticos debe documentarse en la historia clínica.
- •
La necesidad de antibióticos intravenosos se debe revisar a diario.
- •
Una terapia con selección de un medicamento de espectro más estrecho (reducción de la intensidad) debe ser considerada tan pronto como sea apropiada, teniendo en cuenta la respuesta al tratamiento y los cambios en la gravedad de la enfermedad del paciente. Esto es especialmente válido cuando se dispone de información microbio- lógica relevante.
- •
Cuando sea apropiado, se deben especificar las fechas de terminación de los medicamentos.
Las instituciones que tengan disponibilidad de determinar procalcitonina como guía en la decisión de inicio o de retiro de antibióticos, la deben usar en pacientes hospitalizados (véase la sección de uso de antimicrobianos).
- •
- •
Cambio de antibiótico a la vía oral: el tratamiento intravenoso se debe pasar a vía oral tan pronto como se logre mejoría clínica y se obtengan los siguientes objetivos: temperatura < 37,8°C, frecuencia cardíaca < 100latidos por minuto, frecuencia respiratoria < 24por minuto, presión arterial sistólica > 90mmHg por más de 8h sin vasopresores, ausencia de embolismo séptico o de diseminación hematógena de la enfermedad, enfermedades concomitantes estabilizadas y que no exista evidencia de compromiso cognitivo ni mental y que exista la capacidad para la ingestión oral adecuada16,50,83. Existe evidencia que demuestra que el cambio de la terapia intravenosa a la terapia oral se puede realizar también en pacientes con neumonía grave143,144.
Idealmente, el paciente debe darse de alta del hospital 24h después de que se haya alcanzado la estabilidad clínica.
- •
Uso de antivirales en neumonía adquirida en la comunidad: durante 2009 ocurrió la primera pandemia del siglo xxi ocasionada por el virus de la influenza A (H1N1). Este virus se inició en Norteamérica y se diseminó al mundo. Las recomendaciones actuales en Colombia indican el uso de oseltamivir en todos los pacientes con diagnóstico de neumonía grave adquirida en la comunidad. La recomendación del uso de antivirales debe ir en conjunto con la alerta epidemiológica realizada por las autoridades de salud.
Los pacientes con opción de tratamiento ambulatorio suelen encontrarse en buenas condiciones clínicas y toleran la vía oral. Los antibióticos escogidos tienen efecto sobre S. pneumoniae y, en el caso de los macrólidos, tienen actividad adicional sobre los microorganismos atípicos. La controversia sobre la necesidad de cubrir los microorganismos atípicos de forma empírica en todos los pacientes con neumonía que requieran manejo en la comunidad es antigua y no ha sido resuelta de forma satisfactoria.
Tratamiento de la neumonía adquirida en la comunidad, grupo I.
| Grupo I: puntaje entre 0 y 1 en la escala CRB-65 o CURB-65 | Localización o sitio para el tratamiento |
| a) Sano sin factores de riesgo | Tratamiento ambulatorio |
| Primera línea (evidencia IA): | |
| • Amoxicilina, 1g por vía oral, cada 8h, o claritromicina, 500mg por vía oral, cada 12h, o azitromicina, 500mg diarios, por vía oral | |
| Alternativas: | |
| • Doxiciclina, 100 mg por vía oral, cada 12h (evidencia IIB) | |
| • En casos de alergia a las penicilinas, intolerancia a los macrólidos o a las tetraciclinas se debe considerar moxifloxacina, 400mg aldía por vía oral, o levofloxacina, 750mg/día por vía oral (evidencia IA) | |
| Duración del tratamiento: 5 a 7 días; cuando se utilice azitromicina, el tratamiento debe ser por 3 a 5 días | |
| b) Con factores de riesgo o enfermedades concomitantes | Tratamiento ambulatorio |
| Primera línea (evidencia IA): | |
| • Amoxicilina-ácido clavulánico, 1g por vía oral, cada 12h, asociado a claritromicina, 500mg por vía oral, cada 12h o azitromicina 500mg vía oral diarios | |
| Alternativa: | |
| Cefuroxima, 500mg por vía oral, cada 12h, asociado a claritromicina, 500mg por vía oral, cada 12h (evidencia IA) | |
| • En caso de alergia a las penicilinas o intolerancia a los macrólidos, fluroroquinolonas: moxifloxacina, 400mg al día por vía oral, o levofloxacina, 750mg al día por vía oral (evidencia IA) |
Tres de las cuatro guías seleccionadas recomiendan el uso de amoxicilina en los pacientes que van a recibir tratamiento ambulatorio, mientras que la guía de los Estados Unidos recomienda el uso de macrólidos. Una revisión sistemática reciente identificó los estudios clínicos de asignación aleatoria que tenían tratamientos antimicrobianos en este caso145. Los estudios identificados incluyen estudios que la comparan con la claritromicina146–148, la azitromicina148,149, los cetólidos146,147 o las quinolonas149–151. Infortunadamente, no se identificaron estudios comparativos entre los betalactámi-cos, como la amoxicilina, y los macrólidos. Un estudio clínico en la década de los noventa demostró superioridad de la claritromicina frente a la eritromicina146, mientras que otro no replicó los hallazgos pero identificó 4 veces mayor frecuencia de efectos secundarios en el grupo de eritromicina147. La eritromicina tiene una mayor frecuencia de efectos adversos gastrointestinales y su dosificación es inconveniente. La frecuencia de efectos secundarios en los pacientes que reciben doxiciclina también se consideró para la decisión.
Recomendaciones- •
Se recomienda el uso de amoxicilina o claritromicina en pacientes con neumonía adquirida en la comunidad que se tratan de forma ambulatoria y no tienen factores de riesgo (evidencia IA).
- •
Se considera como alternativa el uso de doxiciclina (evidencia I IB) y en casos de alergia a los betalactámicos o intolerancia a los macrólidos, el uso de moxifloxacina o levofloxacina (evidencia IA).
- •
Se recomienda el uso de amoxicilina-acido clavulánico asociado a macrólido como tratamiento de primera línea en el paciente ambulatorio con factores de riesgo.
- •
Se recomienda el uso de cefuroxima asociado a claritromicina como alternativa en el paciente ambulatorio con factores de riesgo y en caso de alergia a penicilinas, el uso de moxifloxacina o levofloxacina (evidencia IA).
- •
No se recomienda el uso de moxifloxacina como terapia de primera línea por su amplio espectro y, además, porque dada su actividad frente a M. tuberculosis, como daño colateral, puede generar la aparición de resistencia en este germen de gran importancia epidemiológica en nuestra región.
- •
No se recomienda el uso de eritromicina por su alta tasa de efectos secundarios y poca tolerabilidad.
En el paciente hospitalizado se debe iniciar tratamiento empírico lo más pronto posible. Los estudios retrospectivos realizados en la década de los noventa encontraron que el inicio de antimicrobianos en las siguientes 8h al ingreso de los pacientes mayores de 65 años con neumonía, tuvo como resultado una reducción del 15% de la mortalidad a 30 días128. Un estudio de cohortes demostró que este beneficio se mantenía cuando el inicio de antibióticos se hacía en las primeras 4h152. Sin embargo, los estudios retrospectivos no han confirmado estos hallazgos153,154.
Tratamiento de la neumonía adquirida en la comunidad, grupo II.
| Grupo II: puntaje de 2 en la escala CRB-65 o CURB-65 | Localización o sitio para el tratamiento |
| a) Sin factores de riesgo y sin enfermedadesconcomitantes | Hospitalización en sala general (fuera de la unidad de cuidados intensivos) |
| • Primera línea: betalactámico más macrólido (evidencia IA) | |
| • Penicilina cristalina, 2 millones de unidades, intravenosos cada 4h, más claritromicina, 500mg intravenosos cada 12h | |
| Alternativas: | |
| • Ampicilina, 2g intravenosos cada 4h más claritromicina, 500mg intravenosos cada 12h (evidencia IIB). | |
| • En pacientes alérgicos a las penicilinas (evidencia IA):Quinolona ‘respiratoria’, intravenosa: moxifloxacina, 400mg diarios, intravenosos, o levofloxacina, 500mg diarios, intravenosos | |
| b) Con factores de riesgo para bacilos Gramnegativos | Hospitalización en sala general (fuera de la unidad de cuidados intensivos) |
| Primera línea (evidencia IA): | |
| • Ampicilina-sulbactam, 3g intravenosos cada 6h, más claritromicina, 500mg intravenosos cada 12h | |
| Alternativa (evidencia IIA): | |
| • Cefuroxima, 750mg intravenosos cada 8h más claritromicina 500mg intravenosos cada 12h | |
| • En pacientes alérgicos a las penicilinas (evidencia IA) :Quinolona ‘respiratoria’, intravenosa: moxifloxacina, 400mg diarios, intravenosos, o levofloxacina 500mg diarios, intravenosos | |
| c) Con factores de riesgo para neumococo resistente a la penicilina | Hospitalización en sala general (fuera de la unidad de cuidados intensivos) |
| En caso de sospecha de neumococo resistente a la penicilina (evidencia IA): | |
| • Ceftriaxona, 2g diarios, intravenosos, más claritromicina, 500mg intravenosos cada 12h | |
| • En pacientes alérgicos a las penicilinas:Quinolona ‘respiratoria’, intravenosa: moxifloxacina, 400mg diarios, intravenosos, o levofloxacina, 500mg diarios, intravenosos | |
| d) Hospitalización por razones socioeconómicas | Hospitalización en sala general (fuera de la unidad de cuidados intensivos) |
| Tratamiento igual al del grupo Ia |
Por lo tanto, es importante aclarar que aunque es prioritario el inicio de antibióticos, una política de inicio temprano sin tener en cuenta las situaciones clínicas apropiadas y la disponibilidad de pruebas diagnósticas puede llevar a un sobrediagnóstico de neumonía155, al uso indiscriminado de antibióticos y a pobres resultados clínicos.
El panel de expertos recomienda el inicio de tratamiento antibiótico tan pronto como sea posible al ingreso al servicio de urgencias (evidencia IA).
Aún no es claro cuál es el grupo de pacientes hospitalizados que se benefician de asociar macrólidos, tampoco es claro que no sea recomendable asociarlos, sin embargo, el hallazgo de etiología de gérmenes atípicos en nuestro medio justificaría su uso (evidencia IIB).
6.2.2.1. Paciente hospitalizado en salas generales sin factores de riesgo (grupo IIa)En el caso del paciente hospitalizado sin factores de riesgo adicionales, la controversia sobre la necesidad de garantizar el tratamiento antibiótico contra los microorganismos atípicos, no solo se mantiene, sino que tiene importantes defensores tanto a favor como en contra. En los últimos 8 años se han publicado tres metanálisis que revisan el beneficio del uso de betalactámicos solos frente a la combinación con inclusión de medicamentos para tratar microorganismos atípicos156–158. Estos estudios no han encontrado diferencias en los resultados en pacientes con neumonía adquirida en la comunidad, excepto para el subgrupo de pacientes con infección por Legionella spp. Algunas críticas a estos estudios incluyen el hecho de que analizaron prácticamente los mismos estudios clínicos y no se tiene en cuenta buena parte de la experiencia previa159.
Recomendaciones- •
Se recomienda el uso de penicilina cristalina, 2 millones cada 4h, más claritromicina, 500mg intravenosos, cada 12h como terapia de primera línea.
- •
Se recomienda el uso de ampicilina, 2g cada 4h, más claritromicina, 500mg intravenosos, cada 12h como tratamiento alternativo (evidencia IIB).
- •
En pacientes alérgicos a las penicilinas e intolerancia a los macrólidos, se recomienda el uso de fluroquinolonas: moxifloxacina, 400mg intravenosos al día, o levofloxacina, 500 mg intravenosos al día (evidencia IA).
- •
El uso de cefalosporinas de tercera generación y de moxifloxacina se debe limitar a pacientes que no son candidatos a otras estrategias de manejo.
- •
No se recomienda el uso de ertapenem en pacientes con neumonía adquirida en la comunidad sin enfermedades concomitantes que se tratan de forma hospitalaria.
- •
Los pacientes con neumonía adquirida en la comunidad en quienes la puntuación de la escala de CRB-65 o CURB-65 es de 0 y 1 y requieran hospitalización por situaciones socioeconómicas, el tratamiento será similar al grupo Ia.
En los pacientes hospitalizados con enfermedades concomitantes, se encuentra una mayor frecuencia de infecciones por bacilos entéricos Gramnegativos, bacilos Gramnegativos no fermentadores y de gérmenes atípicos como Legionella spp.12–15,37,38,41,44,46,49,133,159 En general, las consideraciones en estos grupos de pacientes son similares a las del grupo anterior; sin embargo, teniendo en cuenta que hay una mayor mortalidad relacionada con las enfermedades concomitantes, el panel consideró que sería beneficioso el uso de terapia combinada. La decisión del uso de medicamentos intravenosos u orales se debe hacer teniendo en cuenta el estado clínico del paciente. Para pacientes con alteraciones del estado de conciencia, aquellos con pérdida del reflejo deglu-torio, o consideraciones funcionales o anatómicas que favorezcan la mala absorción, el uso del tratamiento intravenoso se encuentra indicado160. En los pacientes que no se encuentren en un estado grave y no tengan contraindicación para el uso de terapia intravenosa, la vía oral debe instaurarse después de lograr la estabilidad clínica.
Recomendaciones- •
Se recomienda el uso de terapia combinada con un betalactámico y un macrólido (claritromicina o azitromicina) en pacientes con neumonía adquirida en la comunidad y enfermedades concomitantes que se tratarán de forma hospitalaria.
- •
Se recomienda como terapia de primera línea la ampicilina-sulbactam, 3g intravenosos cada 6h, más claritromicina, 500mg intravenosos cada 12h (evidencia IA).
- •
Se recomienda como terapia alternativa el uso de cefuroxima, 750mg intravenosos cada 8h, más claritromicina, 500mg intravenosos cada 12h (evidencia IIA).
- •
En pacientes alérgicos a la penicilina o con reacciones adversas a los macrólidos, se recomienda el uso de fluoro- quinolonas: moxifloxacina, 400mg intravenosos al día, o levofloxacina, 500mg intravenosos al día (evidencia IA).
- •
El uso de ceftriaxona queda limitado solamente a los pacientes en los que se sospecha resistencia a la penicilina, en estos casos también se debe asociar con claritromicina, 500mg cada 12h (evidencia IA).
- •
En pacientes con neumonía adquirida en la comunidad y enfermedades concomitantes que se tratan de forma hospitalaria, no se recomienda el uso de ertapenem.
- •
No se recomienda el uso de terapia combinada con un betalactámico y fluroquinolona (moxifloxacina o levofloxacina) en pacientes con neumonía adquirida en la comunidad y enfermedades concomitantes que se tratan de forma hospitalaria.
En los pacientes con neumonía grave, con base en los estudios epidemiológicos realizados en nuestro país, en el ámbito latinoamericano y mundial, S. pneumoniae sigue siendo el agente etiológico que ocupa los primeros lugares y se debe considerar la posibilidad de neumonía por bacteriemia por este microorganismo. También se deben considerar en este grupo de pacientes las infecciones por Legionella spp. y por bacilos Gramnegativos, todos ellos asociadas a mayor mortalidad161. Los estudios de tratamiento con terapia combinada en infecciones por neumococo no siempre han mostrado un claro beneficio en la mortalidad, aunque los pacientes con terapia combinada tienen una menor probabilidad de falla terapéutica a 30 días162.
Tratamiento de de la neumonía adquirida en la comunidad, grupo III, neumonía grave adquirida en la comunidad.
| Grupo III: puntaje de 3 o más en CRB-65 o CURB-65más criterios ATS/IDSA para ingreso a la unidadde cuidados intensivos (neumonía grave adquirida en la comunidad) | Localización o sitio para el tratamiento |
| a) Sin factor de riesgo para P. aeruginosa | Hospitalización en la unidad de cuidados intensivos |
| Primera línea: | |
| • Ampicilina-sulbactam, 3g intravenosos cada 6h, más claritromicina, 500mg intravenosos cada 12h, más oseltamivir más vancomicina o linezolid | |
| Alternativa: | |
| • Cefuroxima, 750mg intravenosos, cada 8 h, más claritromicina, 500mg intravenosos cada 12h, más oseltamivir, 75mg cada 12h más vancomicina o linezolidEn pacientes alérgicos a la penicilina usar: fluroquinolona moxifloxacina, 400mg diarios intravenosos, o levofloxacina, 500mg diarios intravenosos, más oseltamivir, 75mg cada 12h más vancomicina o linezolid | |
| b) Con factores de riesgo para P. aeruginosa | Hospitalización en la unidad de cuidados intensivos |
| Primera línea: | |
| • Piperacilina-tazobactam, 4,5g intravenososcada 6h, más claritromicina, 500 intravenosos cada 12 h, más oseltamivir, 75mg cada 12h | |
| Alternativa: | |
| • Cefepima, 2g intravenosos cada 8 h, más claritromicina, 500mg intravenosos cada 12h, más oseltamivir, 75mg cada 12h | |
| c) Con factores de riesgo para S. aureus resistente a la meticilina | Hospitalización en la unidad de cuidados intensivos |
| primera linea: | |
| • Ampilina-sulbactam,3g inravenosos cada 6h, más claritromicina, 500mg intravenosos cada 12h, más vancomicina (dosis de carga: 25mg/kg y luego 15mg/kg/12h) o linezolid, 600mg intravenosos cada 12h más oseltamivir, 75mg cada 12h | |
| Alternativa: | |
| • Piperacilina-tazobactam, 4,5g intravenosos cada 6h, más claritromicina, 500mg intravenosos cada 12h, más linezolid o vancomicina, más oseltamivir, 75mg cada 12h | |
| • Cefepima, 2g cada 8h, más claritromicina, 500mg intravenosos cada 12h, más vancomicina o linezolid más oseltamivir, 75mg cada 12h | |
| Aspectos relevantes del tratamiento para la neumonía adquirida en la comunidad: | |
| • Con base en los estudios de neumonía adquirida en la comunidad recientemente publicados, todo paciente con la neumonía adquirida en la comunidad que requiera hospitalización, ya sea en salas generales o en unidades de cuidados intensivos, debe recibir tratamiento para gérmenes atípicos | |
| • Realizar terapia de reducción de la intensidad cuando haya identificación microbiológica | |
| • Uso adecuado de antimicrobianos: elección con base en la gravedad, las enfermedades concomitantes y los factores de riesgo; evitar en la medida que sea posible el uso empírico de quinolonas y cefalosporinas de tercera generación | |
| • Cambio de tratamiento a la vía oral cuando se logre la estabilidad clínica | |
| • Alta temprana, 24 a 48h después de lograr la estabilidad clínica | |
| • Uso de antivirales con base en las recomendaciones del Ministerio de Salud y Protección Social en Colombia | |
| • En pacientes en los que se decide iniciar vancomicina es aconsejable determinar los niveles plasmáticos del antibiótico para ajustar la dosis (evidencia IA) | |
ATS: American Thoracic Society; IDSA: Infectious Diseases Society of America.
- •
En pacientes con neumonía grave adquirida en la comunidad que se tratan de forma hospitalaria, se recomienda el uso de terapia combinada con un betalactámico y claritromicina y, además, oseltamivir, según las recomendaciones epidemiológicas vigentes en nuestro país. Se recomienda que el betalactámico de primera línea usado sea ampicilina-sulbactam. Dado nuestro perfil epidemiológico y el incremento de SARM-AC se recomienda, además, hacer tratamiento empírico con vancomicina o linezolid en este grupo de pacientes.
- •
Como alternativa de la ampicilina-sulbactam, se recomienda la cefuroxima, asociada a los otros antibióticos.
- •
En pacientes alérgicos a las penicilinas, se recomienda el uso de fluroquinolonas (moxifloxacino o levofloxacina) asociada a oseltamivir.
- •
No se recomienda el uso de tigeciclina en la neumonía adquirida en comunidad.
- •
El uso de ceftriaxona queda limitado solamente a los pacientes en los que se sospecha resistencia a la penicilina; en estos casos también se debe asociar con claritromicina, 500mg cada 12h (evidencia I A).
Algunos pacientes pueden tener características clínicas o factores de riesgo específicos que nos orientan hacia la etiología de algunos gérmenes. Las tablas 4 y 5 muestran algunas asociaciones identificadas previamente con ciertos microorganismos.
El panel de expertos realizó recomendaciones en casos de sospecha de microorganismos como P. aeruginosa. En el estudio de Arancibia163, en el que se determinaron factores de riesgo para gérmenes Gramnegativos en la neumonía, incluyendo P. aeruginosa, se identificó la presencia de enfermedades pulmonares estructurales y la hospitalización previa como factores de riesgo principales. En el mismo estudio se identificó que los factores de riesgo para los bacilos Gramnegativos fueron la aspiración, la hospitalización previa, el uso previo de antimicrobianos y la presencia de enfermedades pulmonares. Algunos de estos factores de riesgo también fueron identificados en los estudios de neumonía grave adquirida en la comunidad y de la neumonía adquirida en la comunidad en mayores de 65 años, realizados en Colombia15,37.
Además, se ha observado en Colombia un aumento en la frecuencia de SARM en pacientes sin factores hospitalarios de riesgo. Este problema se encontraba en una baja proporción antes de 200574, sin embargo, los datos disponibles sugieren un incremento progresivo en los años siguientes164 y, recientemente, también se ha identificado este microorganismo como causante de neumonía grave adquirida en la comunidad79.
El panel de expertos consideró, bajo estas premisas, la creación de un grupo denominado IIIc, y dado el perfil de resistencia, se consideró que ameritaba recomendaciones específicas. Las alternativas terapéuticas para SARM incluyen vancomicina y linezolid165. Aunque la infección por SARM es una causa infrecuente de neumonía, se asocia con una condición grave de rápida progresión, con presencia de cavitaciones y falla multiorgánica. Estos pacientes deben admitirse para manejo en la UCI.
Recomendaciones- •
En pacientes con neumonía grave adquirida en la comunidad y con factores de riesgo para P. aeruginosa, se recomienda el uso de piperacilina-tazobactam asociado a claritromicina. En este grupo de pacientes se debe asociar, además, oseltamivir dadas las recomendaciones epidemiológicas realizadas en nuestro país.
- •
Se considera como alternativa a la piperacilina-tazobactam, el uso de cefepima con las mismas asociaciones descritas previamente.
- •
Cuando existe evidencia de uso previo de antibióticos posibles inductores de betalactamasas de espectro extendido, como las cefalosporinas de segunda o tercera generación, se recomienda el uso de meropenem o imipenem asociado a claritromicina y oseltamivir.
- •
Se recomienda el uso de vancomicina o linezolid en pacientes con factores de riesgo para SARM adquirido en comunidad (SARM-AC) y neumonía adquirida en la comunidad que requiere hospitalización, adicional a los otros antimicrobianos instaurados: betalactámico, claritromicina y oseltamivir.
- •
Se recomienda el uso de vancomicina o linezolid en pacientes con factores de riesgo para SARM-AC y neumonía adquirida en la comunidad que requiera hospitalización.
- •
En pacientes con falla renal, edad avanzada más múltiples enfermedades concomitantes y en pacientes obesos se recomienda el uso de linezolid y vancomicina.
- •
No se recomienda el uso de linezolid como terapia única para SARM en presencia de bacteriemia.
- •
Se recomienda el uso de piperacilina-tazobactam o cefepima en pacientes con factores de riesgo para bacterias Gramnegativas y neumonía adquirida en la comunidad que requieran hospitalización.
- •
No se recomienda el uso de tigeciclina.
En los pacientes con neumonía adquirida en la comunidad o en aquellas personas que tengan factores de riesgo o enfermedades concomitantes que aumentan la vulnerabilidad a las infecciones, se deben implementar estrategias que permitan lograr cambios en los hábitos de vida y causar un impacto en el resultado final de la atención. De aquí deriva la importancia de tener en mente los siguientes aspectos tendientes a disminuir los factores de riesgo para el desarrollo de infecciones respiratorias.
7.1.Cesación de tabaquismoA todos los pacientes con neumonía adquirida en la comunidad y a todos los pacientes en los que se identifique tabaquismo activo, se les debe alertar sobre los riesgos del hábito del tabaquismo y se les debe incluir en programas multidisciplinarios de cesación de tabaquismo.
7.2.Ejercicio y rehabilitación pulmonarLos pacientes con neumonía adquirida en la comunidad, usualmente tienen enfermedades concomitantes que se benefician del ingreso a los programas de rehabilitación pulmonar cuyo fin es desarrollar en el paciente autoestima, bienestar biopsicosocial y disminuir el impacto de su enfermedad concomitante en la calidad de vida.
7.3.EducaciónA los pacientes con neumonía adquirida en la comunidad se les debe incluir en programas de educación para que sean replicadores de la promoción y prevención de infecciones respiratorias, especialmente cuando hay enfermedades concomitantes subyacentes.
7.4.VacunaciónLas infecciones del tracto respiratorio causadas por S. pneumoniae y por los virus de la influenza son responsables de significativa morbilidad y mortalidad en la población general y, especialmente, en grupos específicos de población como los niños menores de 5 años, los adultos mayores de 60 años y las personas con enfermedades crónicas cardíacas, pulmonares y metabólicas -especialmente, la diabetes- e inmunodeficiencias congénitas y adquiridas. Los esfuerzos para su prevención han sido eficientes por contarse con la disponibilidad de vacunas.
La vacuna contra la influenza se produce cada año con base en la identificación de los virus circulantes durante los 12 meses inmediatamente anteriores; las vacunas anti-neumocócicas poseen antígenos polisacáridos derivados de 23 tipos diferentes de S. pneumoniae que son responsables de la mayoría de los casos de enfermedad estreptocócica invasiva y de neumonías en el mundo. En los últimos años se encuentran disponibles las vacunas conjugadas antineu-mocócicas PCV13, PCV10 que al ser obtenidas mediante nuevas tecnologías garantizan la capacidad inmunógena en niños menores y también en adultos.
Existe evidencia de la eficacia de estas vacunas para reducir las consecuencias directas e indirectas de las infecciones por los virus de la influenza y por S. pneumoniae, y se ha encontrado que aparentemente son más eficaces en personas sanas que en personas crónicamente enfermas, aunque se ha demostrado con claridad su efecto protector en niños y en ancianos. Por años han existido controversias respecto a quiénes, con qué frecuencia y cuándo vacunar, pero hasta que no haya mayor claridad al respecto, y ante la gran cantidad de información que existe actualmente, estará indicado vacunar, al menos, los grupos de personas ya claramente identificados y descritos.
7.4.1. Vacunación para la prevención de la infección por Streptococcus pneumoniae (evidencia IA)Las enfermedades neumocócicas se han identificado como uno de los problemas de salud pública más grandes en el mundo. El neumococo está rodeado por una cápsula de polisacáridos y las diferencias en la composición de esta cápsula permiten que se puedan clasificar en más de 90 diferentes serotipos, de los cuales algunos están asociados a la enfermedad neumocócica tanto en niños como en adultos, y otros serotipos nunca se han asociados con enfermedades. Las enfermedades neumocócicas invasivas reconocidas son la neumonía, la meningitis y la bacteriemia febril; como enfermedades no invasivas se reconocen la otitis media, la sinusitis, la bronquitis y la exacerbación aguda de la EPOC.
Por lo menos, un millón de niños fallece cada año en el mundo como consecuencia de las enfermedades neumocócicas, la mayoría provenientes de los países en desarrollo; en los países desarrollados, los ancianos sufren la mayoría de estas enfermedades. Otras condiciones asociadas al desarrollo con mayor facilidad de enfermedades por neumococo son la infección por virus de la inmunodeficiencia humana (VIH), la anemia de células falciformes y varias enfermedades crónicas de diferentes órganos, como la bronquitis crónica, la insuficiencia renal crónica, la diabetes y la falla cardíaca congestiva. Los ya mencionados altos índices de resistencia antibiótica del neumococo, desarrollados a lo largo de los años, resalta la importancia de la vacunación como método indispensable para la prevención de la enfermedad por neumococo. La inmunidad que se desarrolla después de la infección es contra el serotipo de la cápsula del microorganismo (serotipo) causante de la infección.
Las infecciones se consideran invasivas cuando estos gérmenes invaden sitios que normalmente son estériles, libres de bacterias, como el torrente sanguíneo y las meninges, desarrollando cuadros clínicos muy graves que generalmente requieren hospitalización y pueden causar la muerte.
Las vacunas actualmente disponibles y autorizadas para la vacunación antineumocócica son:
- •
Vacuna antineumocócica de polisacáridos (PPSV23): vacuna actualmente usada y autorizada para su utilización por la Food and Drug Administration, está desarrollada a partir de los 23 serotipos más frecuentes de la bacteria con una eficacia del 60 al 70%, aproximadamente, para la prevención de enfermedad neumocócica. Los niños menores de 2 años y las personas que sufren diferentes inmunodeficiencias como, por ejemplo, VIH, no siempre desarrollan inmunidad adecuada después de la vacunación, reduciendo así su capacidad de protección y haciendo que este grupo de personas sea particularmente vulnerable a estas enfermedades; sin embargo, los ancianos sanos adquieren un adecuado nivel de protección contra la enfermedad neumocócica invasiva.
- •
Vacuna conjugada: son más eficientes y se han introducido recientemente en el mercado, contienen de 7 a 13 polisacáridos unidos a una proteína transportadora que induce inmunidad celular dependiente de las células T. Estas vacunas inducen inmunidad en niños menores de 2 años y, posiblemente, reducen su transmisión incrementando la inmunidad de grupo o de rebaño, fenómeno importantísimo para el control de la transmisión de enfermedades en las comunidades. Estas vacunas son inactivadas y no contienen timerosal.
En general, se considera que la vacuna de polisacáridos es efectiva para prevenir la neumonía por bacteriemia, y de menor efectividad frente a la neumonía que no lo es166–168. Esta vacuna no es efectiva en niños menores de 2 años y su capacidad para generar anticuerpos disminuye en pacientes ancianos. La duración de los anticuerpos opsonizantes suele ser alrededor de 5 años, pero puede ser menor en individuos con asplenia o en pacientes con nefrosis.
Se tiene amplia experiencia con la vacuna conjugada en niños y recientemente se han adelantado estudios clínicos en adultos168,169. Ha tenido un impacto enorme desde el punto de vista de salud pública gracias al efecto rebaño. En países con gran cobertura de vacunación, la vacuna conjugada ha logrado reducciones en la morbilidad tanto en niños como en adultos, así como impactos en la circulación de cepas resistentes a la penicilina170. No se conoce con certeza el impacto de vacunar pacientes con vacuna conjugada que ya hayan sido vacunados previamente con la vacuna de polisacáridos; sin embargo, los estudios preliminares sugieren que la vacunación previa ni mejora ni disminuye la probabilidad de lograr anticuerpos protectores167,168,171,172.
Los estudios con medición de anticuerpos opsonizantes han demostrado niveles similares para algunos de los sero-tipos compartidos por las vacunas y un nivel ligeramente mayor para algunos de los serotipos incluidos. Asimismo, los estudios basados en la medición de anticuerpos sugieren que la vacunación se puede realizar secuencialmente con una u otra vacuna (primero, la vacuna de 13 serotipos o de 23 serotipos, seguida algún tiempo después de la otra vacuna) o con 2 dosis de la vacuna de 13 serotipos con niveles altos de anticuerpos (para los serotipos compartidos). La vacunación con 2 dosis de la vacuna de 23 serotipos resulta en un menor nivel de anticuerpos168.
Recientemente, el Advisory Committee on Immuniza-tion Practices ha recomendado la utilización de las 2 vacunas de forma secuencial con el fin de obtener las ventajas de las 2 vacunas: cobertura y memoria inmunológica167.
Indicaciones de vacunación- 1)
Vacuna conjugada multivalente (13 valencias) contraneumococo166–173.
- a)
Adultos de 19 años o más que no hayan recibido previamente la vacuna conjugada de 13 valencias y que tengan las siguientes condiciones médicas: asplenia funcional o adquirida, inmunodeficiencias congénitas o adquiridas, infección por VIH, falla renal crónica, síndrome nefrótico, hemoglobinopatías, leucemia, linfoma de Hodgkin, mieloma múltiple, neoplasias, trasplante de órgano sólido, terapia inmunosupresora, implantes cocleares o fístula de líquido cefalorraquídeo.
- b)
Adultos mayores de 50 años.
- a)
- 2)
Vacuna de polisacáridos contra neumococo (23 serotipos): actualmente, se recomienda la vacunación en las siguientes condiciones174,175:
- a)
Cualquier adulto de 19 a 64 años con tabaquismo activo, EPOC, asma, residente en hogares de ancianos o en hogares de cuidado crónico.
- b)
Toda persona de 65 años o más.
- c)
Pacientes menores de 65 años con enfermedades de base consideradas de riesgo para la neumonía adquirida en la comunidad, como diabetes mellitus, enfermedad coronaria, insuficiencia cardíaca congestiva, EPOC, con esplenectomía, infección VIH/sida, leucemia, linfoma, insuficiencia renal crónica o síndrome nefrótico.
- d)
Pacientes en tratamiento inmunosupresor que incluye esteroides de forma prolongada y alteraciones del estado inmunitario que comprometan la función fagocítica.
- e)
Revacunación a los 5 años (un único refuerzo) en pacientes que hayan recibido la primera dosis antes de los 65 años.
- a)
- a)
En individuos con factores de riesgo (por enfermedad concomitante) o por edad (mayores de 65 años) con indicación para ambas vacunas, se recomienda colocar la vacuna de 13 serotipos seguida, a las 8 semanas, de la vacuna de 23 serotipos.
- b)
En individuos con indicación de vacunación por la edad, se recomienda utilizar una dosis de la vacuna conjugada de 13 serotipos.
- c)
En individuos con indicación de vacunación y colocación previa de la vacuna de 23 serotipos se puede completar el esquema con la de 13 serotipos.
- d)
No se recomienda repetir la vacunación con la vacuna de 23 serotipos en individuos mayores de 65 años.
Durante más de 400 años se han documentado episodios de influenza; estos virus son capaces de desencadenar pandemias de la enfermedad con presentación mundial, con importante aumento en la incidencia de la enfermedad que puede incrementar no solamente la presencia de la dolencia aguda, sino de las complicaciones y la muerte como consecuencia de ellas. Un total de 32 pandemias han sido reportadas en diferentes partes del mundo desde el año 1580; en los últimos 100 años, ha habido 3 pandemias mayores de enfermedad causada por el virus de la influenza de tipo A en los años 1918, 1957 y 1968. La pandemia de 1918–1919 ha sido la más devastadora, con la muerte de 20 a 40 millones de personas en todo el mundo incluyendo un desproporcionado número de adultos jóvenes. Las epidemias de influenza en los Estados Unidos son responsables, aproximadamente, de 20.000 muertes cada año167,176.
Los virus de la influenza A y B son los 2 tipos de virus que pueden causar enfermedades epidémicas en humanos. El virus de tipo A puede ser clasificado en subtipos, especialmente con base en sus antígenos de superficie hema-glutinina y neuroaminidasa. Desde 1977, los virus de tipo A(H1N1), A(H3N2) e influenza por virus de tipo B han circulado globalmente. El virus A(H1N2) que, probablemente, surgió de una mezcla de los 2 anteriores también ha sido identificado durante algunas epidemias estacionales. En abril del 2009 se identificó la infección en humanos causada por un nuevo virus A(H1N1) y para junio ya había sido reportado en todo el mundo. Este virus se deriva del virus de tipo A que circula en cerdos y que es antigénicamente diferente al virus humano de tipo A(H1N1) que circula desde 1977. Las nuevas variedades de virus de la influenza resultan de cambios virales menores (graduales) y mayores (bruscos) que pueden suceder durante la replicación viral176.
Se dispone de vacuna trivalente inactivada contra la influenza: 2 virus A y 1 virus B. Debido a la naturaleza cambiante de los virus de la influenza, la Organización Mundial de la Salud (OMS) realiza una vigilancia epidemiológica de las cepas circulantes. Debido a que la circulación de virus varía en los distintos hemisferios (donde las temporadas de invierno son diferentes), la OMS recomienda cada año una vacunación diferente.
En el sitio web de la OMS se actualizan anualmente las recomendaciones (http://www.who.int/csr/disease/influenza/influenza network/vaccinerecommendations/en/index.html).
Debido a la aparición de la pandemia de influenza AH1N1, la recomendación para el 2011 en el hemisferio sur y del 2011–2012 en el hemisferio norte fue la misma. Sin embargo, la recomendación fue diferente para el invierno de 2012–2013 para los países septentrionales.
En Colombia se ha reconocido la circulación del virus de la influenza desde hace cerca de 14 años, con impacto en la mortalidad177. La vigilancia había establecido que cerca de la mitad de las veces la circulación había ocurrido por cepas predominantes en el hemisferio norte, y la otra mitad por cepas predominantes en el hemisferio sur. Sin embargo, por razones logísticas, con el fin de iniciar la vacunación entre abril y mayo, el Ministerio de la Protección Social estableció una recomendación para realizar la vacunación con la cepa sur (disponible para esta época del año) con el fin de cubrir el fin de la temporada invernal del primer semestre y realizar el cubrimiento previo a la segunda temporada invernal (septiembre-octubre) que suele ser de mayor circulación viral (Martha Velandia, comunicación personal, 2011).
Indicaciones de vacunación contra la influenza174,175- 1)
Todos los adultos, especialmente los mayores de 50 años.
- 2)
Personas con enfermedades de base consideradas como factores de riesgo para la neumonía adquirida en la comunidad como enfermedad cardiovascular, EPOC, insuficiencia cardíaca congestiva e insuficiencia renal crónica.
- 3)
Residentes en hogares de ancianos o en centros de atención crónica.
- 4)
Personal de salud en actividades asistenciales hospitalarias o ambulatorias.
- 5)
Personas que han requerido atención médica regular o que han sido hospitalizadas en el último año por diabetes mellitus, insuficiencia renal o inmunosupresión.
- 6)
Embarazadas en el 2.° y 3.° trimestre.
- 7)
Otras condiciones como infección por VIH, madres lactantes y viajeros al extranjero durante epidemias de gripe.
- 8)
Revacunación anual.
La implementación de un programa de uso racional de antibióticos en las instituciones es una práctica que garantiza una adecuada gerencia de los antimicrobianos, promoviendo su óptima selección para generar mejores resultados clínicos tanto para el paciente como para la institución178.
Los 4 objetivos principales de estos programas son: la reducción en la resistencia microbiana, el uso prudente de antimicrobianos, lograr un impacto sobre los costos de atención y mejorar la seguridad del paciente. Una revisión sistemática realizada por Kaki et al.179 evaluaba la efectividad de los programas de control de antibióticos en las unidades de cuidados intensivos en el período comprendido entre 1996 y 2010, y concluyó que su implementación se puede relacionar con la reducción del 11 al 38% en la utilización de antimicrobianos en dosis diarias definidas por 1.000 díaspaciente, disminución de los costos totales por uso de antimicrobianos, disminución de los días promedio de duración de la terapia con antibióticos y menos efectos secundarios. Además, se observó que la intervención por más de 6 meses se asociaba con reducción en las tasas de resistencia y no se vinculaba con aumento de las tasas de infección hospitalaria, duración de la estancia o mortalidad. La limitación principal de esta revisión fue la baja calidad de los estudios seleccionados, con solo 3 ensayos clínicos con asignación aleatoria, 3 series de tiempo interrumpidas y 18 estudios de antes y después sin controles.
Se han evaluado múltiples intervenciones con el fin de promover el uso adecuado de los antimicrobianos, incluyendo la educación médica continua, la elaboración y difusión de guías de práctica clínica, la aprobación de la prescripción, la evaluación posterior a la prescripción, las decisiones apoyadas en bases de datos, las alarmas del sistema de historia electrónica de las instituciones, el establecimiento de ciclos de antibióticos, la optimización de los parámetros farmacocinéticos y farmacodinámicos y las estrategias para disminuir la duración del tratamiento antimicrobiano180.
Las instituciones prestadoras de salud deben seleccionar las estrategias que han demostrado mayor efectividad y que, además, se adaptan mejor a las necesidades locales; desde el inicio, es muy importante definir los indicadores de seguimiento, que sean evaluados periódicamente, con el fin de hacer los ajustes necesarios que lleven al cumplimiento de las metas.
Una estrategia útil para el desarrollo de los programas de control de antimicrobianos en el manejo específico de la neumonía adquirida en la comunidad es el uso de marcadores que permitan establecer la necesidad del uso de antimicrobianos en los pacientes, teniendo en cuenta que los criterios clínicos definitorios de la neumonía adquirida en la comunidad no permiten distinguir claramente entre una infección bacteriana y una viral, y la gravedad de los pacientes está determinada por múltiples factores, como el tipo de organismo, el tamaño del inóculo, el uso previo de antimicrobianos, la respuesta inmunitaria, a menudo definida por los polimorfismos genéticos y la presencia concomitante de otras enfermedades.
Entre estos marcadores se distinguen 3: la procalcitonina, la proteína C reactiva y el receptor soluble de activación expresado en las células mieloides42.
El sTREM es miembro de la superfamilia de las inmunoglobulinas, y su forma soluble se difunde sobre la superficie de la membrana de los fagocitos en las secreciones bronquiales, con mayores niveles en la presencia de productos microbianos. En un estudio de pacientes con neumonía tanto adquirida en la comunidad como asociada al respirador que requerían respiración mecánica asistida, sus niveles en el lavado broncoalveolar fueron mejores predictores de infección bacteriana o fúngica (odds ratio=41,5) que la escala de infección pulmonar (Clinical Pulmonary Infection Score; odds ratio=3) o los niveles de TNF-α e IL-1 en el lavado broncoalveolar181. Los estudios recientes que evalúan la cuantificación sérica del sTREM en la neumonía adquirida en la comunidad encuentran utilidad en predecir bacteriemia y en diferenciar neumonía por gérmenes típicos o atípicos, pero son estudios pequeños que no permiten dar recomendaciones para su uso rutinario182.
La proteína C reactiva es un reactante de fase aguda; se ha evaluado su utilidad en la neumonía adquirida en la comunidad con sensibilidades que varían del 70 al 73% y especificidades que varían del 65 al 90% para el diagnóstico, mejorando su sensibilidad cuando se adicionan variables clínicas, como la taquipnea, y hallazgos típicos de neumonía en la la auscultación; sin embargo, los estudios no plantean intervenciones prospectivas que permitan diferenciar qué pacientes se beneficiarían del tratamiento antimicrobiano sin afectar los desenlaces clínicos de los pacientes183,184.
La procalcitonina es una hormocina que se produce en las células neuroendocrinas de las células tiroideas y células K del pulmón y en las células del parénquima de hígado y el riñón, y en los monocitos en respuesta a toxinas microbianas y al aumento de IL-1β, TNF-α e IL-6. Es útil para diferenciar las infecciones respiratorias bacterianas de las virales porque su producción se atenúa por la liberación de las citocinas que se producen en las infecciones virales, como el interferón-γ185
El uso de la procalcitonina ha sido evaluado para determinar la pertinencia de la formulación de antibióticos en los estudios de Briel et al.186, y en el estudio muticéntrico proHOPS187; la estrategia de administración de antibióticos con base en los niveles de procalcitonina (sin tratamiento: niveles menores de 0,1 o entre 0,1 y 0,25 con baja probabilidad clínica; con tratamiento: niveles mayores 0,25 o niveles menores de 0,25 con ascenso en las primeras 6 a 24h) redujo notablemente el uso de antibióticos; la tasa de prescripción de antibióticos fue 72% más baja y la duración del uso de antibióticos fue, de promedio, 1 día más corta. La tasa de pacientes que informaron cualquier síntoma de infección actual o recurrente en 28 días fue idéntica para las 2 terapias, no se encontró inferioridad en términos de resultados secundarios, mortalidad o estancia hospitalaria, y fue más efectivo en reducir la exposición a antibióticos y los efectos adversos asociados a ellos; en el grupo de pacientes con neumonía adquirida en la comunidad, la duración del tratamiento antimicrobiano fue de 7,2 frente a 10,7 días.
Con lo anterior, podemos concluir que el uso de la procalcitonina como guía para el inicio y la duración del tratamiento en los pacientes con neumonía adquirida en la comunidad parece ser útil para disminuir el consumo de antimicrobianos y la aparición de resistencia antimicrobiana en este grupo de pacientes.
Sección 9Recomendaciones finales9.1. Estrategias por implementar en el ámbito institucionalCon el fin de lograr un manejo adecuado de la neumonía adquirida en la comunidad en nuestras instituciones, debemos, en la medida de lo posible, implementar y poner en marcha las siguientes estrategias que han demostrado ser de gran utilidad y han sido suficientemente validadas141,142:
- 1)
Estratificación de los pacientes para determinar su sitio de atención, teniendo siempre en mente los factores de riesgo y las enfermedades concomitantes. Por su sencillez y facilidad de implementación, se recomienda la escala CURB-65 o CRB-65.
- 2)
Tener siempre en mente las indicaciones definitivas de hospitalización y los criterios de gravedad.
- 3)
En la medida que sea posible y la institución lo permita, hacer énfasis en los estudios para identificación etiológica y poder reorientar el tratamiento y reducir la intensidad de la terapia (deescalation).
- 4)
En todo paciente con neumonía adquirida en la comunidad, implemente siempre las medidas generales de atención.
- 5)
Inicio temprano de tratamiento empírico acorde con las recomendaciones o guías: primeras 6h.
- 6)
Selección apropiada del antibiótico y reducir en 48 a 72h la intensidad de la terapia (deescalation).
- 7)
Cambio de antibióticos a la vía oral cuando se logre la estabilidad clínica.
- 8)
Duración del tratamiento:
- a)
Pacientes sanos sin lesiones estructurales: 5 días.
- b)
Algún grado de alteración inmunitaria y alteración estructural leve: 7 días.
- c)
Mala respuesta, lesión estructural grave o inmunosupre- sión grave: 10 a 14 días.
- a)
- 9)
Implementar el árbol de decisiones para lograr altas tempranas.
- 10)
Indicadores de implementación, auditoría y observancia de la guía de neumonía adquirida en la comunidad:
- a)
Pertinencia del diagnóstico de neumonía adquirida en la comunidad:
- •
Proporción de pacientes con criterios clínicos y radiográficos con hospitalización por neumonía adquirida en la comunidad/número total de pacientes hospitalizados con diagnóstico de neumonía adquirida en la comunidad x 100.
- •
- b)
Pertinencia de los criterios de hospitalización de los pacientes con diagnóstico de neumonía adquirida en la comunidad:
- •
Número de pacientes hospitalizados con adecuados criterios de hospitalización de neumonía adquirida en la comunidad/número total de pacientes egresados con diagnóstico de neumonía adquirida en la comunidad x 100.
- •
- c)
Pertinencia de los criterios de tratamiento antibiótico dado a los pacientes con diagnóstico de neumonía adquirida en la comunidad:
- •
Número de pacientes adecuadamente tratados con antibióticos para neumonía adquirida en la comunidad según la guía/número total de pacientes hospitalizados con diagnóstico de neumonía adquirida en la comunidad tratados con antibióticos x 100.
- •
- d)
Pertinencia de criterios de egreso de pacientes hospitalizados y tratados por neumonía adquirida en la comunidad:
- •
Número de pacientes con diagnóstico de neumonía adquirida en la comunidad, adecuadamente egresados/ número total de pacientes egresados con diagnóstico de neumonía adquirida en la comunidad x 100.
- •
- a)
- 11)
Educación y retroalimentación.
- 12)
Propender por el desarrollo e implementación de programas regionales y nacionales de vigilancia epidemiológica.
- 13)
La información, preferiblemente, debe ser proporcionada de forma directa por el médico y apoyarse con materiales impresos para hacer énfasis en los siguientes aspectos:
- •
La neumonía adquirida en la comunidad es causada por una serie de diferentes agentes patógenos y se trata, generalmente, con antibióticos.
- •
A pesar de que la neumonía adquirida en la comunidad es una enfermedad potencialmente grave, la mayoría de los episodios se pueden tratar de manera segura en casa.
- •
Las medidas que un paciente puede seguir para acelerar la recuperación y aliviar los síntomas son: reposo en casa, ingerir abundantes líquidos (siempre y cuando no tenga restricción médica para ello), tomar acetaminofén (siempre y cuando no sea alérgico) y tomar el ciclo completo de antibióticos indicados por su médico.
- •
El tiempo de recuperación varía de paciente a paciente. El médico puede ayudar al paciente a decidir cuándo debe regresar al trabajo o al estudio. En general, esto es posible 48h después de que la fiebre haya desaparecido y haya comenzado a mejorar la tos. La tos puede persistir durante 8 semanas, más o menos, pero debe seguir una mejoría progresiva.
- •
Los pacientes tratados de forma ambulatoria deben regresar a consultar con el equipo de atención de la salud 48h después de comenzar el tratamiento para evaluar su progreso.
- •
Criterios para regresar de inmediato a consulta médica: dificultad para respirar, empeoramiento de la tos, empeoramiento o aparición de escalofríos, fiebre persistente por más de 48h, intolerancia del tratamiento antibiótico o reacción alérgica a él.
- •
Prevención secundaria: dejar de fumar, incluir a los pacientes con tabaquismo activo en programas de cesación de tabaquismo.
- •
Cuando sea posible, los pacientes deben educarse en el uso del termómetro para llevar una hoja de registro de temperatura que presentarán en la cita de control a las 48h.
¿Cuáles son las posibles complicaciones de la neumonía?:
- •
Los casos graves de neumonía pueden requerir tratamiento en el hospital. Es posible que su médico le dé oxígeno para ayudarlo a respirar o le formule antibióticos por vía intravenosa.
- •
Entre las complicaciones de la neumonía se incluye el derrame pleural y la presencia de bacterias en el torrente sanguíneo. El derrame pleural se produce cuando se acumula líquido en las capas del tejido que se encuentra entre los pulmones y la pared ósea y se infecta. Esto puedo hacer que la respiración sea muy difícil. Para drenar el líquido, es posible que necesite colocarse un tubo entre los pulmones y la pared torácica o someterse a cirugía.
- •
Aparecen bacterias en el torrente sanguíneo cuando la infección por neumonía en los pulmones se propaga a la sangre. Esto aumenta el riesgo de que la infección se propague a otros órganos del cuerpo. Las bacterias que se encuentran en el torrente sanguíneo se tratan con antibióticos.
- •
Las personas que tienen problemas cardíacos o pulmonares, las personas que fuman o las personas de 65 años o más tienen más probabilidades de experimentar complicaciones a causa de la neumonía.
¿Cómo puedo prevenir la neumonía?
Usted puede ayudar a prevenir la neumonía haciendo lo siguiente:
- •
Vacúnese contra la gripe todos los años. Las personas, a menudo, desarrollan neumonía bacteriana después de un caso de gripe. Usted puede reducir este riesgo recibiendo anualmente la vacuna contra la gripe. La vacuna contra la gripe no lo protege de todas las cepas de la gripe, solo de las 3 a 4 cepas que la OMS considera que serán las más peligrosas o las más extendidas el año siguiente.
- •
Aplíquese la vacuna antineumocócica.
- •
La vacunación contra neumococo e influenza se deben recomendar después de un episodio de neumonía, adhiriéndose a las recomendaciones de la sección de vacunación. No existe contraindicación para el uso de la vacuna para el neumococo inmediatamente después de un episodio de neumonía.
- •
Practique una buena higiene. Las manos entran en contacto con muchos gérmenes durante todo el día. Usted los recoge de superficies como las manijas de las puertas, las manos de otras personas y el teclado de su computadora. Tómese tiempo para lavarse las manos con frecuencia, en especial, después de usar el baño y antes de comer. Use agua tibia y jabón durante, al menos, 20 segundos. Otra opción igualmente efectiva para la higiene de manos es el uso de gel antiséptico.
- •
No fume. Fumar daña los pulmones y hace que sea más difícil para el cuerpo defenderse de gérmenes y enfermedades. Si fuma, hable con su médico de familia sobre cómo dejar el hábito lo antes posible.
- •
Lleve un estilo de vida saludable. Siga una dieta equilibrada con muchas frutas y verduras. Haga ejercicio de forma regular. Duerma mucho. Estas medidas ayudan a mantener fuerte el sistema inmunitario.
- •
Evite estar con personas enfermas. Estar rodeado de personas que están enfermas aumenta el riesgo de contagiarse de lo que ellos tienen.
Criterio social: la falta de soporte familiar o la indisponibilidad de cuidador o de los medicamentos y no poder garantizar la observancia del manejo son criterios de hospitalización, independientemente de la gravedad del paciente.
La saturación arterial, como parte de la evaluación clínica inicial, permite una rápida y fácil identificación de aquellos pacientes con alto riesgo de complicaciones, con lo que se logra disminuir la mortalidad en pacientes que probablemente no se habrían identificado.
La combinación de los criterios de la ATS para ingreso a la UCI, con los criterios CURB-65 permite identificar y seleccionar mejor los pacientes que requieren atención en la UCI.
Franco Eduardo Montúfar
Medicina Interna, Neumologia, Infectología, Epidemiologia Jefe, Unidad de Neumología; coordinador, Grupo de Uso de Antibióticos, IPS Universitaria Universidad de Antioquia, Clínica León XIII; coordinador, Grupo de Uso de Antibióticos, Hospital Pablo Tobón Uribe; Instituto de Enfermedades Respiratorias e Infectología, Medellín, Colombia
Fabio Andrés Varón
Medicina Interna, Neumología, Medicina Crítica y Cuidado Intensivo Fundación Neumológica Colombiana y Universidad de La Sabana, Bogotá, D.C.,Colombia
Luis Fernando Giraldo
Medicina Interna, Neumología Director, Departamento Integrado de Investigación, Facultad de Medicina, Universidad de La Sabana, Bogotá, D.C., Colombia
Óscar Alberto Sáenz
Medicina Interna, Neumología Coordinador, Servicio de Urgencias, Hospital Santa Clara y coordinador Medicina Interna, Neumología, Clínica Jorge Piñeros Corpas, Bogotá; docente Universidad El Bosque, Bogotá D.C., Colombia
Augusto Rodríguez
Medicina Interna, Neumología, Cali, Colombia
Arles María Alarcón
Medicina Interna, Neumología, Medicina Crítica y Cuidado Intensivo Hospital San Juan de Dios, Armenia, Colombia
Guillermo Ortiz
Medicina Interna, Neumología, Medicina Crítica y Cuidado Intensivo, Epidemiología Fellow, Center for Medical Simulation, Boston,MA; jefe, Cuidados Intensivos, Hospital Santa Clara; jefe de posgrado, Medicina Interna y Neumología, Universidad El Bosque; director ejecutivo, INSIMED, Bogotá, D.C., Colombia
Andrés Caballero
Medicina Interna, Neumología Director científico, Clínica Reina Sofía, Bogotá, D.C., Colombia
Carlos Aguirre
Medicina Interna, Neumología Fundación Neumológica Colombiana y Universidad de La Sabana, Bogotá, D.C., Colombia
Horacio Giraldo
Medicina Interna, Neumología Clínica del Country, Bogotá, D.C., Colombia
Carlos Álvarez
Infectología, Epidemiología Clínica Profesor asociado en Medicina, Hospital Universitario San Ignacio-Pontificia Universidad Javeriana; director, Departamento de Enfermedades Infecciosas, Colsanitas, S.A., Clínica Reina Sofía, Bogotá, D.C., Colombia
Jorge Cortés
Medicina Interna, Infectología Departamento de Medicina Interna, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
Sandra Valderrama
Infectología, aspirante MSc en Epidemiología Coordinadora Grupo de Investigación en Enfermedades Infecciosas, Hospital Universitario San Ignacio-Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
John Pedrozo
Medicina Interna, Neumología Respire, Instituto para el Cuidado Respiratorio (Previcare); Profesor de cátedra, Universidad de la Magdalena, Santa Marta, Colombia
Álvaro Morales
Medicina Interna, Neumología Fundación Santafé de Bogotá, Universidad de los Andes, Bogotá, D.C., Colombia
Carlos Saavedra
Medicina Interna, Infectología Clínica San Rafael, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
Carmelo Dueñas
Neumología, Medicina Crítica y Cuidado Intensivo Jefe, Unidad de Cuidado Intensivo, Universidad de Cartagena, Cartagena, Colombia
Francisco Molina
Medicina Interna, Medicina Crítica y Cuidado Intensivo Jefe, Unidad de Cuidado Intensivo, Clínica Universitaria Bolivariana; profesor titular,Universidad Pontificia Bolivariana, Medellín, Colombia
Diego Severiche
Medicina Interna, Neumología, Medicina Crítica y Cuidado Intensivo Clínica del Country y Universidad de La Sabana, Bogotá, D.C., Colombia
Aura Lucía Leal
Medicina, Microbiólogia Departamento de Microbiología, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
Abraham Alí Munive
Medicina Interna, Neumología, Medicina Crítica y Cuidado Intensivo Jefe, Unidad de Cuidado Intensivo, Fundación Cardioinfantil, Universidad de la Sabana, y Universidad del Rosario, Bogotá, D.C., Colombia
Rubén Darío Contreras
Medicina Interna, Neumología, Bogotá, D.C., Colombia
Natalia Londoño
Medicina Interna, Neumología, Bogotá, D.C., Colombia
Esta guía práctica cuenta con el aval de las sociedades participantes
Asociación Colombiana de Neumología y Cirugía del Tórax Presidente: Rubén Darío Contreras
Asociación Colombiana de Medicina Crítica y Cuidado Intensivo Presidente: Guillermo Ortiz
Asociación Colombiana de Medicina Interna Presidenta: Natalia Londoño
Asociación Colombiana de Infectología Presidente: Jorge Enrique Gómez