Las infecciones fúngicas invasoras en niños inmunocomprometidos han aumentado en las últimas décadas debido al incremento de la población en riesgo, así como a los avances de la medicina. La AMB y los azoles, especialmente los de primera generación, han sido los antifúngicos más utilizados en esta población. En los últimos años, se han descubierto nuevos azoles. Sin embargo, gran parte de la información acerca de la dosificación y seguridad de estos medicamentos en pediatría ha sido extrapolada de los adultos, ya que los estudios de farmacocinética y farmacodinámica en < 18 años son muy limitados. Existen diferencias propias del desarrollo, las cuales tienen un gran impacto en la farmacocinética de estos agentes. Esto ha estimulado la realización de este tipo de estudios en la población pediátrica, con el fin de tener más información al respecto. El incremento en el armamento terapéutico antifúngico ha sido un importante avance para el manejo de las infecciones fúngicas invasoras, y, por lo tanto, es necesario conocer la evidencia actual en pediatría para poder ofrecer así un mejor tratamiento. Este artículo presenta una revisión de la farmacocinética, la seguridad, la dosificación y las indicaciones terapéuticas de los azoles en pediatría.
Invasive fungal infections (IFI) in immunocompromised children have increased in recent decades due to the increasing population at risk and to medical progress. Amphotericin B and first generation azoles, have been the most commonly used antifungal agents in this population. In recent years, newer azoles have been discovered. However, most information about the dosage and safety of these drugs in children has been extrapolated from adults, as studies of pharmacokinetics and pharmacodynamics in children under 18 years are very limited. There are several differences within the childhood development that have a major impact on the pharmacokinetics of these agents. Hence, it has been encouraged to perform these kind of studies in the pediatric population in order to obtain more information. The increase in the antifungal therapeutic armamentarium has been a major advance in the management of IFIs, and therefore it is necessary to determine the current evidence in pediatrics in order to provide a better treatment. This article presents an overview of the pharmacokinetics, safety, dosing and therapeutic indications of azole antifungals in children.
Las infecciones fúngicas invasoras (IFI) se han convertido en una importante causa de morbimortalidad en niños con enfermedades graves. Estas, por lo general, son difíciles de diagnosticar, y la respuesta al tratamiento dependerá en gran parte de hacer un diagnóstico temprano, así como de iniciar el tratamiento antifúngico apropiado lo más rápido posible1,2. “Los niños no son adultos pequeños” es una frase que se utiliza ampliamente en diferentes especialidades pediátricas que referencia a que no puede extrapolarse el comportamiento de una enfermedad o de un tratamiento en el adulto a su equivalente en el niño3. Especialmente en infectología, y en lo correspondiente a las IFI, las diferencias entre los grupos de edad son claras. Hay diversos patrones epidemiológicos y factores de riesgo específicos, los protocolos de manejo en las unidades de cuidado intensivo pediátricas, así como las guías de trasplante y quimioterapia en niños también son diferentes, lo que contribuye a la divergencia en el comportamiento de las enfermedades y su respuesta al tratamiento3. El aumento progresivo de la incidencia de IFI durante las últimas décadas se relaciona directamente con el desarrollo de la medicina, que ha llevado a un aumento de la población en riesgo. Esto ha hecho que tanto en niños como en adultos, la prescripción antifúngica haya aumentado de forma notoria durante los últimos años4.
Los triazoles son los medicamentos antifúngicos sistémicos más comúnmente utilizados en la población pediátrica para la mayoría de las IFI. Los niños, particularmente los neonatos y lactantes pequeños, representan una población única en cuanto a la manera como se comportan estos medicamentos en el organismo2. Es por esto que en pediatría, la terapia antifúngica no es extrapolable, y es necesario conocer las diferencias en cuanto a la farmacocinética (PK) y farmacodinámica (PD) para poder brindar un mejor tratamiento1,2. Desafortunadamente, la información acerca de la seguridad, eficacia, PK y PD de estos medicamentos en los infantes, en especial los más recientes, continúa siendo escasa4.
En este artículo, se revisan las indicaciones terapéuticas y la información disponible acerca del comportamiento farmacocinético y farmacodinámico de este grupo de medicamentos en la población pediátrica.
Breve reseña históricaLa anfotericina B (AMB) fue descubierta en la década de los años cincuenta. Este antifúngico fue utilizado de forma amplia, y ha sido tradicionalmente considerado como uno de los antifúngicos de elección en las IFI5. Su acción fungicida y la posibilidad de usarlo de forma parenteral han sido reconocidas. Actualmente, se sigue utilizando en varias micosis endémicas e IFI6. Sin embargo, sus efectos secundarios, así como la necesidad por encontrar nuevas moléculas que pudieran emplearse con mayor seguridad tanto por vía venosa como por vía oral (VO), hicieron que en 1979 y 1980 se descubrieran los primeros imidazólicos de uso sistémico, el miconazol y el ketoconazol5,7. Esto marcó el inicio de una nueva época en el manejo de las infecciones fúngicas. Actualmente, por sus efectos secundarios e interacciones medicamentosas, son reservados para uso tópico8. Su posterior modificación química permitió crear la familia de los triazoles en la década de los años noventa, de los cuales, el fluconazol (FLU) y el itraconazol (ITR) fueron la primera generación5,7. Esta nueva familia mantenía el mecanismo de acción, pero tenía un menor efecto sobre los esteroles humanos. Estos medicamentos se han utilizado de manera amplia por su excelente espectro en candidiasis y otras infecciones fúngicas sistémicas, así como por su seguridad y fácil administración5,7,8. Sin embargo, carecían de actividad contra la mayoría de mohos, patógenos emergentes y de incidencia creciente en los últimos años. Esto hizo que, en los últimos años, se desarrollara una nueva generación de triazoles, con un mayor espectro de actividad contra mohos y especies de Candida resistentes al fluconazol8. El voriconazol (VOR), aprobado en 2002, y el posaconazol (PSC), en 20069–11, y más recientemente, otros compuestos como ravuconazol, albaconazol e isavuconazol12, aún sin aprobación por la Administración de Drogas y Medicamentos de los Estados Unidos, son ejemplos de esta nueva generación de medicamentos, aunque no todos han sido estudiados en niños10,12.
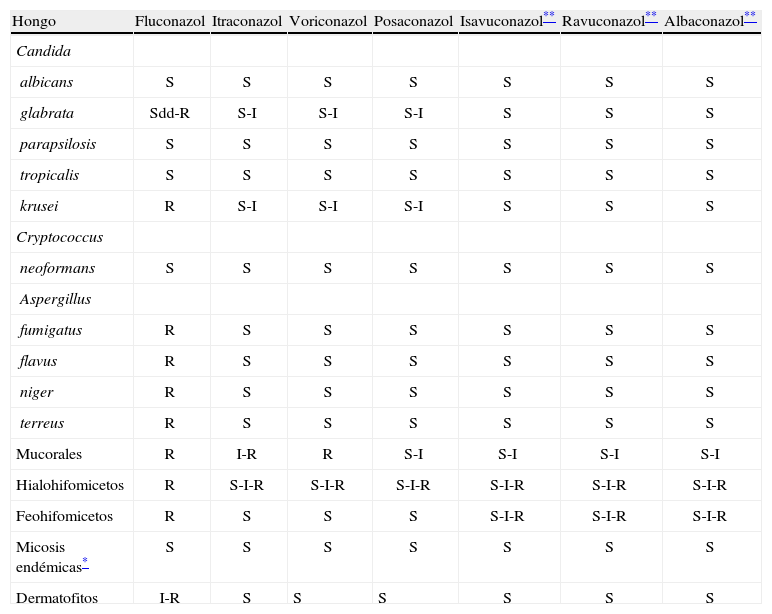
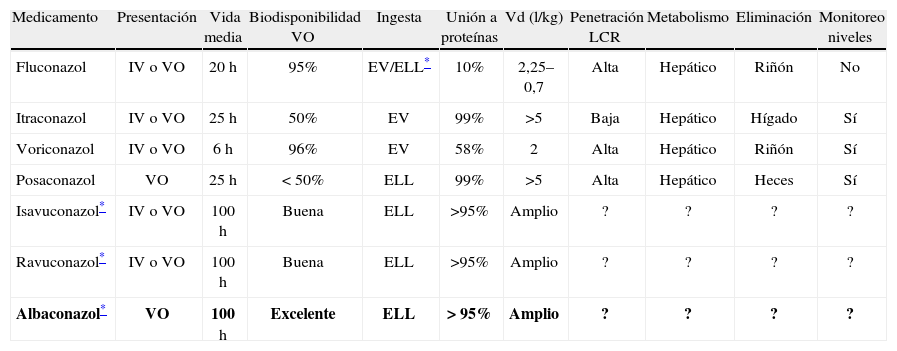
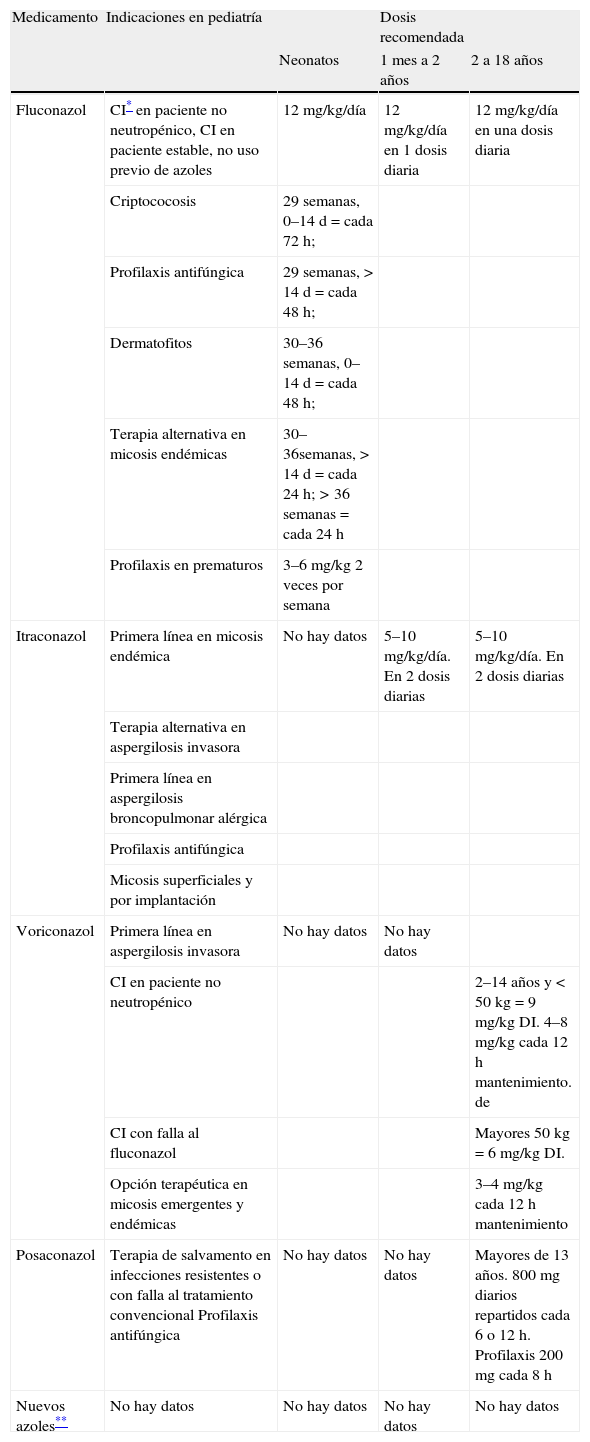
Mecanismo de acción de los azolesLos azoles actúan en la inhibición de la enzima dependiente de citocromo P450 lanosterol-14-alfa-demetilasa. Esta enzima es necesaria para la conversión de lanosterol a er-gosterol, componente vital de la membrana celular de los hongos. A su vez, se acumulan precursores tóxicos (metil esteroles), por el bloqueo de esta vía metabólica. El resultado es la disrupción de la estructura normal y de la función de la membrana celular, la detención del crecimiento, la replicación y la morfogénesis5,13. La alteración en la síntesis de ergosterol causa un daño significativo en la membrana celular al provocar el aumento de la permeabilidad, lo que lleva a lisis y muerte celular. Sin embargo, a pesar de este mecanismo de acción, los azoles son considerados como fungistáticos a las concentraciones alcanzadas en el ámbito clínico13, aunque estudios recientes in vitro han demostrado que el ITR y el VOR tienen actividad fungicida contra especies de Aspergillus14. Como el mecanismo de acción lo ejercen sobre una enzima del citocromo P450, los azoles pueden inducir cambios en la PK de otros medicamentos y tener múltiples interacciones medicamentosas (especialmente, VOR e itraconazol), y pueden inducir hepatotoxicidad, aunque este efecto es más raro con los nuevos azoles15. La inhibición de esta enzima conlleva también la disminución en la síntesis de testosterona y otros esteroides en mamíferos. Estos efectos fueron especialmente reportados con ketoconazol, pero no con los triazoles, los cuales tienen menos inhibición hormonal, mejor distribución corporal, menos efectos secundarios gastrointestinales y menos hepatotoxicidad15. Los triazoles son medicamentos concentración dependientes y tiempo dependientes, además tienen un efecto posantifúngico prolongado. El principal parámetro farmacodinámico que define la eficacia de estos agentes es la exposición total a la droga (área bajo la curva 0–24/concentración inhibitoria mínima [AUC, en inglés area under curve/MIC, en inglés minimal inhibitory concentration])7,16. Los triazoles tienen un espectro de actividad variable entre los diferentes géneros fúngicos11,17 (tabla 1). Actualmente, se utilizan como tratamiento empírico, dirigido y profiláctico8. En las tablas 2 y 3 se resumen sus principales características farmacocinéticas y las indicaciones en pediatría con sus respectivas dosis por edad.
Espectro de actividad de los triazoles
| Hongo | Fluconazol | Itraconazol | Voriconazol | Posaconazol | Isavuconazol** | Ravuconazol** | Albaconazol** |
| Candida | |||||||
| albicans | S | S | S | S | S | S | S |
| glabrata | Sdd-R | S-I | S-I | S-I | S | S | S |
| parapsilosis | S | S | S | S | S | S | S |
| tropicalis | S | S | S | S | S | S | S |
| krusei | R | S-I | S-I | S-I | S | S | S |
| Cryptococcus | |||||||
| neoformans | S | S | S | S | S | S | S |
| Aspergillus | |||||||
| fumigatus | R | S | S | S | S | S | S |
| flavus | R | S | S | S | S | S | S |
| niger | R | S | S | S | S | S | S |
| terreus | R | S | S | S | S | S | S |
| Mucorales | R | I-R | R | S-I | S-I | S-I | S-I |
| Hialohifomicetos | R | S-I-R | S-I-R | S-I-R | S-I-R | S-I-R | S-I-R |
| Feohifomicetos | R | S | S | S | S-I-R | S-I-R | S-I-R |
| Micosis endémicas* | S | S | S | S | S | S | S |
| Dermatofitos | I-R | S | S | S | S | S | S |
I: intermedio; R: resistente; S: susceptible; Sdd: susceptible dependiente de dosis.
Principales características farmacocinéticas de los azoles
| Medicamento | Presentación | Vida media | Biodisponibilidad VO | Ingesta | Unión a proteínas | Vd (l/kg) | Penetración LCR | Metabolismo | Eliminación | Monitoreo niveles |
| Fluconazol | IV o VO | 20h | 95% | EV/ELL* | 10% | 2,25–0,7 | Alta | Hepático | Riñón | No |
| Itraconazol | IV o VO | 25h | 50% | EV | 99% | >5 | Baja | Hepático | Hígado | Sí |
| Voriconazol | IV o VO | 6h | 96% | EV | 58% | 2 | Alta | Hepático | Riñón | Sí |
| Posaconazol | VO | 25h | < 50% | ELL | 99% | >5 | Alta | Hepático | Heces | Sí |
| Isavuconazol* | IV o VO | 100h | Buena | ELL | >95% | Amplio | ? | ? | ? | ? |
| Ravuconazol* | IV o VO | 100h | Buena | ELL | >95% | Amplio | ? | ? | ? | ? |
| Albaconazol* | VO | 100h | Excelente | ELL | > 95% | Amplio | ? | ? | ? | ? |
EV: estómago vacío: ELL: estómago lleno; IV: intravenoso; LCR: líquido cefalorraquídeo; Vd: volumen de distribució; VO: vía oral.
Indicaciones para el uso de azoles en pediatría. Dosis recomendadas por edad
| Medicamento | Indicaciones en pediatría | Dosis recomendada | ||
| Neonatos | 1 mes a 2 años | 2 a 18 años | ||
| Fluconazol | CI* en paciente no neutropénico, CI en paciente estable, no uso previo de azoles | 12mg/kg/día | 12mg/kg/día en 1 dosis diaria | 12mg/kg/día en una dosis diaria |
| Criptococosis | 29 semanas, 0–14 d = cada 72h; | |||
| Profilaxis antifúngica | 29 semanas, > 14 d = cada 48h; | |||
| Dermatofitos | 30–36 semanas, 0–14 d = cada 48h; | |||
| Terapia alternativa en micosis endémicas | 30–36semanas, > 14 d = cada 24h; > 36 semanas = cada 24 h | |||
| Profilaxis en prematuros | 3–6mg/kg 2 veces por semana | |||
| Itraconazol | Primera línea en micosis endémica | No hay datos | 5–10mg/kg/día. En 2 dosis diarias | 5–10mg/kg/día. En 2 dosis diarias |
| Terapia alternativa en aspergilosis invasora | ||||
| Primera línea en aspergilosis broncopulmonar alérgica | ||||
| Profilaxis antifúngica | ||||
| Micosis superficiales y por implantación | ||||
| Voriconazol | Primera línea en aspergilosis invasora | No hay datos | No hay datos | |
| CI en paciente no neutropénico | 2–14 años y < 50kg = 9mg/kg DI. 4–8mg/kg cada 12h mantenimiento. de | |||
| CI con falla al fluconazol | Mayores 50kg = 6mg/kg DI. | |||
| Opción terapéutica en micosis emergentes y endémicas | 3–4mg/kg cada 12h mantenimiento | |||
| Posaconazol | Terapia de salvamento en infecciones resistentes o con falla al tratamiento convencional Profilaxis antifúngica | No hay datos | No hay datos | Mayores de 13 años. 800mg diarios repartidos cada 6 o 12h. Profilaxis 200mg cada 8h |
| Nuevos azoles** | No hay datos | No hay datos | No hay datos | No hay datos |
A continuación, se revisará cada uno de los triazoles por separado.
FluconazolEl FLU se encuentra disponible por VO en tabletas en suspensión por vía intravenosa, y está aprobado por la Administración de Drogas y Medicamentos de los Estados Unidos para uso pediátrico desde el período neonatal18. Su PK es lineal. Tiene una alta disponibilidad (92%) por VO. La absorción no se ve afectada por alimentos, pH gástrico o estado de enfermedad. Su unión a proteínas es baja (10%), y tiene una excelente difusión al líquido cefalorraquídeo (80% de la concentración encontrada en sangre)2. La difusión a otros tejidos como las articulaciones, humor vítreo, saliva, secreciones vaginales es similar o incluso más alta que en el suero2. Tiene metabolismo hepático en muy poca cantidad. Su eliminación es renal, y se excreta sin mayores modificaciones, lo cual resulta en concen 10 a 20 veces mayores que las encontradas en sangre2,19,20. Como su eliminación depende de la función renal, se requiere el ajuste de dosis en estados de injuria renal21. Su actividad es concentración independiente (su actividad fungistática no incrementa luego de alcanzar la concentración máxima)22, En general, no se requiere monitoreo terapéutico de los niveles séricos debido a su excelente biodisponibilidad, índice terapéutico amplio y perfil farmacocinético20,23, aunque podría considerarse en pacientes con falla renal o cuando la susceptibilidad in vitro es baja para obtener una mejor respuesta terapéutica24. Estas características, así como su espectro de actividad, hacen del FLU uno de los medicamentos antifúngicos más utilizados en pediatría25.
El ajuste de la dosis de FLU correspondiente a la del adulto, según el peso corporal, es una estrategia inadecuada. Estudios en niños han demostrado cómo la eliminación de FLU es mucho más rápida en la población pediátrica19,26,27. Esto hace que la vida media del medicamento sea más corta. En los niños, esta es cercana a 20h, comparado con las 30h aproximadas descritas en los adultos. El volumen de distribución (Vd) también es más alto en niños, varía entre 1,18 a 2,25l/kg, disminuyendo progresivamente hasta 0,7l/kg después de los 15 años1,2,26. Estas diferencias implican que para alcanzar una exposición comparable en los niños, la dosis diaria de FLU debe ser mayor, y por esto la recomendación actual es utilizar 12mg/kg/día en niños mayores de un mes y hasta los 2 años. Esta dosis asegura alcanzar el objetivo de exposición al medicamento de AUC #> 400mg*h/L, lo que asegura un índice AUC/MIC ¿ 50 para especies de Candida con MIC #< 8ug/ml28. En este rango, se consideran los aislamientos con MIC entre 2 y 8ug/ml para C. albicans, C. parasilopsis y C. tropicalis, actualmente reconocidos como susceptibles dosis dependientes, es decir, que requieren con más razón de dosis altas para poder lograr el efecto clínico deseado29,30, aunque esta dosis podría ser disminuida luego de la identificación y confirmación de una MIC inferior a 2ug/ml30. Con respecto a C. glabrata, los puntos de corte son más altos. Usualmente, no hay cepas 100% susceptibles, sino que se consideran susceptibles dosis dependientes los aislamientos con MIC < 32ug/ml, por lo cual siempre se requiere de la dosis tope del medicamento29, aunque lo ideal es utilizar un triazol con mejor actividad contra esta especie de Candida31.
El FLU a las dosis mencionadas, usualmente, es bien tolerado, y los efectos secundarios ocurren en solo el 6% de los pacientes1,8. Los efectos secundarios más informados son alteraciones gastrointestinales, elevación transitoria de transaminasas y reacciones cutáneas. La suspensión del medicamento por toxicidad ocurre en < 5% de los pacientes. Se han reportado, de forma anecdótica, efectos serios incluyendo hepatotoxicidad severa y reacciones cutáneas graves1,27.
Los neonatos, especialmente los prematuros, son la excepción dentro de la población pediátrica, ya que estos sí presentan una depuración más lenta en los primeros días de vida. La vida media es casi de 90 h al nacer, disminuye a 67h en la primera semana y a 55h en la segunda semana26. El Vd también es mayor y más variable. Por estas razones, en neonatos prematuros se requieren dosis más altas pero en intervalos más largos, cada 72h las primeras 2 semanas y luego cada 48h hasta completar el primer mes22,26,32. El FLU es un medicamento ampliamente utilizado en unidades de cuidado intensivo neonatales, sin embargo, la determinación de la dosis óptima ha sido difícil debido a los pocos estudios prospectivos de PK/PD en esta población33. Sin embargo, los datos existentes soportan el ajuste de la dosis según la edad gestacional al nacer, así como la edad posnatal34. El uso de dosis de carga superiores (hasta de 25mg/kg) podría ser apropiado en neonatos y lactantes pequeños, ya que en este grupo de edad, la utilización de la dosis usual se requerirá aproximadamente entre 5 y 8 días para alcanzar el objetivo de exposición al medicamento AUC/MIC22,32. Esta dosis de carga haría que se alcance de forma más rápida el nivel deseado, incluso en los niños más críticos28,33,34. En niños críticos sometidos a circulación con membrana extracorpórea, en estado de anasarca o con inmunosupresión grave, podría requerirse una dosis de carga más alta, buscando un objetivo terapéutico AUC > 800mg*h/L, que es la recomendación actual en adultos críticos31. Sin embargo, se requieren estudios que sustenten esta teoría28.
Las principales indicaciones para el uso de FLU en pediatría son la sospecha de infección invasora por Candida spp. que sea susceptible en pacientes no neutropénicos, pacientes estables y que no hayan recibido azoles previamente. También en infecciones por Cryptococcus spp. No se recomienda su uso como primera línea en niños con enfermedad grave, estado crítico, neutropenia profunda y sospecha de infección por C. krusei o C. glabrata5. No tiene utilidad en infecciones por Aspergillus spp., Zigomicetos, Scedosporium spp. y otros mohos ambientales. Otro uso del FLU en pediatría tiene que ver con la prevención de candidiasis invasora, en concreto en la población neonatal de alto riesgo, específicamente los prematuros. En estos pacientes, el FLU ha demostrado disminuir las infecciones por Candida spp. Se han utilizado dosis entre 3 y 6mg/kg 2 veces a la semana durante 6 semanas en menores de 29 semanas para prevención de infección por Candida spp1,31. Este esquema ha demostrado una disminución en la colonización de un 60 a un 22%, y la reducción de candidiasis invasora de un 22 a un 0% en un ensayo clínico controlado35. No se encontró resistencia asociada. Sin embargo, efectos secundarios como el aumento de incidencia de hiperbilirrubinemia directa, hepatotoxicidad, entre otros, el pronóstico neurológico, así como la posibilidad de generar resistencia, han hecho que esta práctica no haya sido aceptada universalmente o realizada de forma rutinaria en todas las unidades de cuidado intensivo neonatales31,36. Por esto, la profilaxis con FLU en neonatos, actualmente, solo se recomienda en centros con una frecuencia de infecciones por Candida spp. > 10% en prematuros < 1.000g en situación de brote31. El FLU también se ha empleado de forma profiláctica en pacientes sometidos a trasplante de hígado y células hematopoyéticas, en los cuales también se ha demostrado una reducción de infecciones invasoras por Candida spp., aunque su falta de actividad contra Aspergillus limita su uso para este fin22,37–39. Aunque estudios in vitro demuestran sensibilidad en micosis endémicas, no se recomienda el uso de este medicamento para ninguna infección perteneciente a este grupo (histoplasmosis, paracoccidioidomicosis, blastomicosis, cromoblastomicosis)8,18,40.
ItraconazolFue el primer triazol con actividad contra Aspergillus spp. Está disponible en cápsulas, suspensión oral y presentación intravenosa. La absorción oral es errática y no supera el 60%, aunque es mejor en la forma líquida que en las capsulas, gracias al vehículo de hidroxipropil-beta-ciclodextrina2,41. La disminución de ácido clorhídrico disminuye la absorción de las cápsulas, mientras que las bebidas ácidas como los cítricos y las bebidas colas la mejoran41–43. La solución oral se absorbe mejor con el estómago vacío, tiene buen sabor y, usualmente, es bien aceptada42, aunque su absorción puede verse limitada cuando se administra por sonda gástrica, situación frecuente en niños44. Las cápsulas requieren de estómago lleno, generan más molestias gastrointestinales y, además, son más difíciles de deglutir20,22. El ITR tiene una alta unión a proteínas (cercana al 100%), es altamente lipofílico, por lo que la fracción libre se distribuye ampliamente en los tejidos (Vd ¿ 5l/kg), por lo que alcanza concentraciones muy adecuadas, incluido en lugares como la uña, en donde puede persistir por meses42; sin embargo, la penetración a líquido cefalorraquídeo es < 10%20. Tiene metabolismo y eliminación por vía hepática. La presentación oral no requiere ajuste de la dosis en insuficiencia renal, sin embargo, con la presentación venosa sí es recomendable, ya que la ciclodextrina se excreta por vía renal en un 80 a 90%20,42. En adultos, se reporta una vida media entre 25 y 50h, lo que permite la administración de una dosis al día. En niños, la vida media parece ser similar; sin embargo, una dosis diaria no alcanza niveles terapéuticos suficientes. Por eso, se requiere de una administración más frecuente del medicamento, usualmente, 2 dosis al día32,45. Los niños tienen una menor concentración de ácido clorhídrico hasta los 3 años, por lo cual la absorción podría ser menor.
El ITR es bien tolerado en general. En el 10% de los pacientes ocurren náuseas y vómito, puede haber elevación leve y transitoria de transaminasas hepáticas en el 5%17,22. Su principal problema está relacionado con las interacciones medicamentosas, las cuales son frecuentes y con múltiples medicamentos. El ITR es un potente inhibidor de la enzima CYP3A4, por lo que cualquier medicamento que utilice esta vía metabólica es vulnerable1,8.
La PK del ITR es muy variable, incluso inter e intrapaciente. Por esto, es recomendable el monitoreo terapéutico de los niveles del medicamento con el fin de asegurar la absorción y la eficacia, especialmente en pacientes con múltiples comorbilidades que requieren de varios medicamentos de forma simultánea y que presentan infecciones refractarias al tratamiento21,46. La recomendación es tener niveles valle > 0,5ug/ml cuando se usa de forma profiláctica, y entre 1 y 2ug/ml cuando se administra de forma terapéutica1,13,20,21. La muestra debe tomarse luego de 7 días de iniciado el tratamiento y nunca antes de la cuarta dosis. Se toma inmediatamente antes de la próxima dosis. Existen pocos estudios en población pediátrica que evalúan los niveles terapéuticos con el fin de ajustar la dosis1.
El ITR ha sido utilizado con frecuencia en pediatría, tanto para infecciones superficiales como sistémicas; sin embargo, la información acerca de la PK/PD, seguridad y dosis más recomendada en pediatría es escasa1,32,42. Este medicamento no está aprobado por la Administración de Drogas y Medicamentos de los Estados Unidos para uso en < 18 años, por lo que se utiliza off-label (sin aprobación, basado en estudios de eficacia clínica y seguridad demostrada en series de pacientes que recibieron el medicamento)1. La información en neonatos es muy limitada, aunque se ha demostrado efectividad y seguridad de la presentación parenteral, a pesar de lo cual no hay recomendaciones establecidas para este grupo de edad32.
La seguridad y la PK del ITR oral se han establecido en pacientes pediátricos inmunocomprometidos, > 2 años43,45. Inicialmente, se recomendaba una dosis de 2,5mg/kg 2 veces al día. Otros estudios realizados en pacientes con fibrosis quística y receptores de trasplante de medula ósea sugieren la necesidad de una dosis más alta, de 5mg/kg 2 veces al día, con el fin de mantener niveles > 0,5ug/ml47. En general, los diferentes reportes han mostrado el uso de dosis entre 3 y 10mg/kg/día, administrados en 2 a 3 dosis17. Un análisis de 14 pacientes oncohematológicos demostró que la dosis de 8mg/kg/día podría ser insuficiente para alcanzar los niveles recomendados, por lo que esta debería aumentarse, teniendo en cuenta un monitoreo estricto de los efectos secundarios46. En otro estudio similar, donde se incluyeron 39 pacientes con riesgo de aspergilosis y que recibieron profilaxis con ITR en dosis que variaron entre 3 y 16mg/kg/día, se documentó que la dosis mínima para alcanzar niveles era de 8mg/kg/día44. Para la presentación venosa, la información es mucho más limitada. En un estudio de 33 niños desde los 7 meses de edad, que recibieron ITR a 2,5mg/kg cada dosis en infusión de una hora, no se demostraron problemas de seguridad (solo un evento adverso menor en el sitio de venopunción), y un análisis de los parámetros farmacocinéticos permitió sugerir que el medicamento puede administrarse en niños > 6 meses, calculando la dosis según el peso48. Se requieren más estudios que permitan un mejor ajuste de la dosis en población pediátrica con el fin de utilizar mejor este medicamento.
El ITR está indicado para el manejo de infecciones leves a moderadas por Candida spp., Aspergillus spp., aspergilosis broncopulmonar alérgica (mantenimiento y profilaxis). Es la terapia de elección en paracoccidioidomicosis leve a moderada, y se utiliza como terapia de mantenimiento en micosis endémicas graves (histoplasmosis, paracoccidioidomicosis, coccidioidomicosis y blastomicosis), luego de una primera fase con AMB8,49. Es eficaz en el tratamiento de la candidiasis orofaríngea en niños con infección por el virus de inmunodeficiencia humana; además, ha sido usado con éxito en pacientes trasplantados para prevención de IFI17. En el ámbito cutáneo, el ITR se utiliza con éxito en población pediátrica para el tratamiento de las dermatofitosis tanto en piel como en uñas, debido a su excelente concentración en estos tejidos42,45,50.
Algunos estudios han demostrado que el ITR es superior al FLU en pacientes con neoplasias hematológicas con fines profilácticos51,52. Sin embargo, su uso podría limitarse en pediatría por la intolerancia. Existe riesgo de pobre adherencia debido a los efectos secundarios molestos en el ámbito gastrointestinal37,53.
La absorción errática, la variabilidad farmacocinética, la importante cantidad de interacciones medicamentosas y la disponibilidad de otros triazoles igual o más efectivos y confiables, han limitado el uso de ITR en pediatría17.
VoriconazolEs un derivado sintético del fluconazol. Combina el espectro de actividad del ITR con la biodisponibilidad del fluconazol. Tiene presentación oral e intravenosa. Aprobado para uso pediátrico en > 2 años18. En adultos, se ha descrito que tiene una alta biodisponibilidad por VO (96%), aunque esta puede ser menor en niños; incluso un estudio en 49 pacientes mostró que era del 66% en niños inmunosuprimidos8,54. Debe consumirse con el estómago vacío para mejorar su absorción. Tiene una vida media de 6h, lo cual garantiza la administración en más de una dosis al día. Se metaboliza ampliamente en el hígado, por lo cual < 5% del medicamento es excretado por orina. Su unión a proteínas es del 58%, tiene un buen Vd (2l/ kg) y penetra muy bien al líquido cefalorraquídeo8,22. Los niveles séricos de VOR varían mucho interpaciente, información que ha sido reportada tanto en niños como en adultos54. Esto se ha explicado porque su PK no es lineal, por su metabolismo de primer paso saturable, y porque hay pacientes que tienen polimorfismos en CYP2C19, enzima que participa en el metabolismo del medicamento, por lo que un porcentaje de la población puede ser metaboli-zadora pobre y el resto metabolizadora extensa54. El objetivo PK/PD del VOR no ha sido establecido en el contexto clínico, aunque por modelos preclínicos, se ha sugerido que AUC/MIC es el mejor predictor de la eficacia, como ocurre con el fluconazol55.
El VOR es bien tolerado en general. Los efectos secundarios más importantes son la hepatotoxicidad, sobre todo elevación de transaminasas (uso restringido en pacientes con falla hepática), alteraciones visuales dosis dependientes y reversibles, rash cutáneo e intolerancia gastrointestinal8,56,57. Estos eventos se han reportado en algunos casos hasta en el 33% de los pacientes pediátricos, pero la suspensión del tratamiento es < 5%. Las interacciones medicamentosas son comunes57. La presentación IV contiene un vehículo de ciclodextrina, que se acumula en pacientes con falla renal, por lo que debe usarse con precaución58.
Estudios recientes indican que existen diferencias importantes en la PK del VOR en niños2. El peso, más que la edad, es importante en la determinación de la exposición al medicamento, por lo cual es difícil extrapolar datos de los adultos. Un ensayo clínico demostró que a diferencia de los adultos, la PK en los niños que recibían VOR era lineal con dosis de 3 y 4mg/kg cada 12h de la presentación venosa56. Estas diferencias limitan la predicción de la exposición a VOR (definida con la curva AUC/tiempo), basado en la dosis de los adultos59. Incluso estudios de modelos PK demostraron que la AUC era aproximadamente 3 veces menor en niños que recibieron 4mg/kg cada 12h, que en adultos que recibieron la misma dosis54,56. En otro análisis poblacional sobre PK derivado de 3 estudios abiertos que incluyeron 82 niños de 2 a 11 años, se encontró que una dosis de 7mg/kg o 200mg cada 12h era equivalente a la dosis de los adultos57. Un estudio mucho más reciente, en donde se analizó un modelo integrado con absorción de primer orden, así como eliminación lineal y no lineal, y en el que se comparó población adulta y pediátrica, confirma hallazgos previos que demuestran que los niños requieren dosis más altas para alcanzar los objetivos terapéuticos, y propone que la mejor exposición al medicamento (AUC 0–12) se alcanza con el siguiente esquema: los niños entre 2 y 12 años y adolescentes entre 12 y 14 años con peso < 50kg requieren una dosis de carga de 9mg/kg intravenosos (IV), la cual es comparable a la dosis de 6mg/ kg utilizada en adultos. La dosis de mantenimiento puede variar entre 4 y 8mg/kg cada 12h IV. Para la presentación oral, la mejor exposición al medicamento se alcanzó con dosis de 9mg/kg cada 12h (máximo 350mg, dosis comparable con los 200mg recomendados en adultos). En pacientes entre 12 y 14 años con peso > 50kg y todos los mayores de 14 años, las dosis deberían calcularse como en el adulto (6mg/kg IV dosis de carga, 3–4mg/kg cada 12h de mantenimiento IV o 200mg cada 12h VO)55. El VOR no ha sido estudiado formalmente en neonatos, aunque hay casos reportados donde se ha utilizado como medida de salvamento en infecciones por Candida refractarias a otros tratamientos60,61.
Debido al comportamiento no lineal que presenta el VOR a dosis altas, la variación amplia interpacientes, la clara relación entre la concentración de la droga y su respuesta y la duración prolongada de la terapia, se recomienda el monitoreo terapéutico de niveles del medicamento para ayudar a ajustar la dosis. En niños, la escasa evidencia disponible sustenta el monitoreo terapéutico de niveles de VOR, sin embargo, pueden existir dificultades en alcanzar niveles con las dosis usuales, lo cual también apoya el uso de dosis más altas como se mencionó anteriormente62,63.Se recomienda en las siguientes situaciones: luego de iniciada la terapia y una vez alcanzada la concentración estable (en especial, en pacientes críticos o con infecciones serias), luego de ajustes de dosis, cambios en el estado fisiológico del paciente (falla hepática concomitante), administración concomitante de medicamentos que generen interacción, cambio de ruta IV a VO, falta de adherencia y sospecha de factores de riesgo especiales que alteren la PK del VOR23,62. Deben tomarse niveles valle entre 4 y 7 días de iniciada la terapia, y posteriormente, una vez a la semana para mantenerlos en un rango entre 1 y 6 ug/ml. Se ha demostrado aumento de la falla terapéutica y de mortalidad cuando se mantienen niveles inferiores, así como mayor toxicidad cuando los niveles están por encima de este rango23,56,62.
El VOR es el tratamiento de elección en aspergilosis in-vasora64. El estudio realizado por Herbrecht et al.65, en el cual se comparó VOR con AMB deoxicolato en 277 pacientes con aspergilosis invasora probable asociada a enfermedades de base, principalmente malignidad hematológica, se demostró mayor probabilidad de respuesta completa o parcial (53 vs. 32%), menor tasa de mortalidad (29 vs. 42%), menor probabilidad de cambio de tratamiento por intolerancia o pobre respuesta (36 vs. 80%), y menor tasa de eventos adversos65. Los datos de cohortes grandes en pediatría son escasos. El reporte más grande en pediatría sobre uso de VOR fue una evaluación de 58 niños con IFI probable o comprobada, refractarios al tratamiento o con intolerancia a la terapia convencional. Al menos el 75% de los pacientes tenían aspergilosis. Luego de 3 meses, el 45% de los pacientes mostraron una respuesta completa o parcial. Solo el 7% no terminaron el tratamiento por intolerancia. En esta misma serie, se demostró el 50% de respuesta en candidemia y el 63% en scedosporiosis66. El VOR también reveló tener utilidad en la mayoría de infecciones por levaduras que son resistentes a fluconazol, además de mohos como Penicillium spp., Scedosporium spp., Fusarium spp. y los causantes de micosis endémicas8. Su mayor espectro contra especies de Candida y su buen perfil de seguridad lo hacen una alternativa muy razonable en el paciente pediátrico no neutropénico, incluso en neonatos en unidades de cuidado intensivo neonatales. No tiene ninguna utilidad contra zigomicetos15.
PosaconazolEs el último triazol aprobado comercialmente para uso en humanos11. Es un derivado sintético del itraconazol. Su administración es por VO en forma de suspensión. La presentación IV se encuentra en fase de investigación8. Tiene una vida media de 25h y un amplio Vd (Vd ¿ 5l/kg). Las concentraciones estables en plasma se alcanzan 7 a 10 días luego de iniciada la administración11,67. De forma similar al itraconazol, estudios en voluntarios sanos han demostrado variabilidad interpacientes entre un 35 y un 50%, pero en pacientes enfermos podría ser incluso más alta68. A pesar de su larga vida media, la mejor PK se obtiene con dosis de800 mg/día, divididos en mínimo 2 dosis, esto debido a su absorción saturable (al dar más dosis durante el día, se asegura una mayor exposición sistémica al medicamento). Incluso, hay estudios en voluntarios sanos que demuestran que la administración en 4 dosis al día mejora aún más la biodisponibilidad67,69. Sin embargo, esta no supera el 50%, debido a su baja solubilidad69,70. Las dietas ricas en grasa aumentan la absorción sistémica, por lo cual se administra con el estómago lleno. El pH ácido también mejora la absorción, por esto podría administrarse con bebidas ácidas69. Medicamentos como los inhibidores de bomba de protones disminuyen su absorción hasta en un 32%11,23,68. Otros factores, como el estado de las mucosas, también influyen en su absorción. Su metabolismo es hepático, pero no es sustrato del sistema citocromo P450, aunque sí ejerce efecto inhibitorio en el sistema CP3A4, y podría tener interacciones medicamentosas, aunque estas son considerablemente menores que con otros azoles11. Se excreta por las heces, en su mayoría sin modificaciones, por lo que la diarrea también sería un factor que influye en la biodisponibilidad71. Tiene una alta unión a proteínas (cercana al 100%). El metabolismo y excreción renal es insignificante, no requiere ajuste en pacientes con falla renal11. Similar a otros azoles, el índice PK/PD que mejor describe la actividad del PSC es AUC/MIC en levaduras, mientras que en mohos, este índice y el tiempo por encima de la MIC (T¿MIC) son importantes16.
La seguridad y efectos secundarios del PSC se han descrito principalmente en adultos con IFI y neutropenia febril. Los eventos secundarios se han reportado hasta en el 38% de los pacientes. Los más comunes son náuseas, vómito, cefalea, dolor abdominal y diarrea. La alteración de la función hepática es infrecuente. Se describen eventos serios, posiblemente relacionados con el medicamento, en el 8%, que incluyen erupción severa, alteración importante de enzimas hepáticas y niveles alterados del medicamento72. Los estudios en niños son muy escasos. Se limitan a reportes de casos, en los cuales el medicamento ha sido bien tolerado, y no se relatan abandonos de tratamiento73,74.
La PK del PSC en niños < 18 años no ha sido estudiada, por lo tanto, se desconoce la dosis apropiada11. Estudios exploratorios, que han incluido pacientes desde los 8 años, han demostrado que no existe una diferencia significativa del comportamiento del medicamento en niños con respecto a adultos; incluso en aquellos que reciben dosis similares a las del adulto, en este grupo de edad se han alcanzado niveles similares en plasma. Un estudio multi-céntrico retrospectivo describió 15 pacientes entre 3 y 17 años que recibieron PSC como terapia de salvamento en IFI probables o probadas a una dosis media de 21mg/kg/ día por un tiempo promedio de 1 mes. No hubo suspensión de tratamiento, y la respuesta fue parcial o completa en 10 de los 15 pacientes, lo que permitió concluir que el PSC era una alternativa segura, bien tolerada y se podía considerar como opción de tratamiento de salvamento en IFI73. Están en proceso estudios patrocinados por la casa farmacéutica creadora del medicamento, en los que se analizan las características farmacocinéticas y el perfil de seguridad en niños por fuera del período neonatal1. El monitoreo de los niveles no se utiliza actualmente, ya que no ha sido definida la concentración sérica más adecuada; tampoco su correlación con la eficacia clínica. Sin embargo, la PK no lineal, la baja disponibilidad por VO, la variabilidad en la biodisponibilidad y el comportamiento del medicamento en el ámbito interpaciente, especialmente en población enferma, la relación impredecible entre la dosis y la concentración plasmática, la absorción saturable, además de las interacciones medicamentosas, soportan la necesidad de realizar monitoreo de niveles y que en un futuro cercano, el monitoreo de niveles posiblemente será una recomendación importante68,75,76. Debido al tiempo entre 7 y 10 días que demora el medicamento en alcanzar su concentración estable, los niveles deberían medirse idealmente luego del séptimo día. De manera provisional, los estudios realizados en adultos sugieren mantener unos niveles valle superiores a 700ng/ml tanto para profilaxis como para tratamiento, requiriendo un aumento de los mismos a 1.250ng/ml si la respuesta es pobre68,77, aunque estos niveles pueden ser difíciles de conseguir78.
El PSC es un antifúngico de amplio espectro. Tiene potente actividad contra hongos endémicos, oportunistas y dermatofitos. Su principal característica, es que además de los hongos cubiertos por el VOR, es el único con actividad in vitro e in vivo contra zigomicetos70,79. En Europa, ha sido aprobado en > 18 años para el tratamiento de aspergilosis, fusariosis, cromoblastomicosis y coccidioidomicosis refractarias o con intolerancia a tratamiento estándar, y como tratamiento de primera línea en candidiasis orofaríngea11,64,69. Su amplio espectro lo ha convertido en una alternativa muy importante para la prevención de las IFI en pacientes de alto riesgo. Actualmente, está indicado en profilaxis contra las IFI en pacientes con quimioterapia para leucemia mieloide aguda, síndrome mielodisplásico y receptores de trasplante hematopoyético con altas dosis de esteroides68. En Estados Unidos, está aprobado en > 13 años bajo las mismas indicaciones, y además, para profilaxis de aspergilosis y candidiasis en pacientes de alto riesgo por neutropenia prolongada11. En pediatría, las indicaciones probablemente son las mismas si se tiene en cuenta que por ahora su uso es sobre todo experimental en esta población11,73.
Nuevos azolesLa frecuencia y espectro creciente de las IFI y otras micosis emergentes durante los últimos años han inducido un incremento en el uso de antifúngicos. Sin embargo, problemas como las resistencias intrínsecas o adquiridas han llevado a investigar nuevos medicamentos con espectros más amplios, menos toxicidad y biodisponibilidad mejorada. Dentro de estos medicamentos, se encuentra una nueva generación de azoles que tienen en común una vida media prolongada, mejor tolerancia y biodisponibilidad, menos interacciones medicamentosas y amplio espectro contra la mayoría de especies cubiertas por los otros azoles, incluyendo aquellas cepas con resistencias intrínsecas o adquiridas, así como contra hongos emergentes. Estos medicamentos se encuentran en fases de investigación, los estudios de eficacia y seguridad en adultos aún son escasos, la información con la que se cuenta proviene hasta el momento de modelos animales y estudios de primera y segunda fase en humanos adultos. No existe ningún tipo de información publicada sobre el uso de estos medicamentos en población pediátrica80. Aunque los resultados parecen ser esperanzadores, las posibilidades reales de estos agentes solamente serán entendidas en los próximos años cuando se disponga de más información disponible de los ensayos clínicos que se encuentran en proceso12,80.
IsavuconazolEl isavuconazonium, que es la prodroga hidrosoluble del isavuconazol, está disponible en presentación IV y VO8. Es un medicamento de amplio espectro, con algunas ventajas potenciales sobre otros azoles con espectro similar. A diferencia del ITR y el VOR, no requiere de ciclodextrina para aumentar su solubilidad81. Hasta el momento, la información sobre la PK del medicamento ha sido definida en modelos animales y en humanos voluntarios81. Su absorción se ve afectada mínimamente con los alimentos. Tiene una vida media de eliminación muy prolongada, lo cual podría representar esquemas de dosificación intermitentes (incluso hasta una vez por semana). Tiene un amplio Vd y alta unión a proteínas, además su PK es lineal. Parece tener menos interacciones medicamentosas12,81. Este medicamento tiene actividad in vitro e in vivo en modelos murinos contra Candida spp., Cryptococcus spp., Aspergillus spp., Paecilomyces spp., y dermatofitos. También parece ser efectivo contra Cladophialophora spp.82. Su potencial actividad contra zigomicetos puede ser una ventaja. No tiene actividad contra Fusarium spp. y Scedosporium spp.83. Entre los aspectos que aún se desconocen sobre el medicamento están la variabilidad PK entre pacientes, el perfil tóxico, especialmente lo correspondiente a alteraciones hepáticas (evento común en todos los azoles), así como el impacto clínico. A la fecha, es el más avanzado de los nuevos azoles, con el que se están realizando estudios defaselllenadultos12,80,81.
RavuconazolEs un medicamento similar al isavuconazol. Es fungicida, con una biodisponibilidad de 47 a 74%, con PK lineal y una vida media larga, de aproximadamente 100h, lo que podría permitir dosis intermitentes2,80. Se absorbe muy bien por VO, y esta mejora con los alimentos. Estudios en ratones demuestran una excelente concentración en tejidos, especialmente el pulmonar84,85. Además del espectro del isavuconazol, parece ser activo contra Histoplasma capsu-latum86. Ha sido probado en estudios de fase I y II12,80. En un estudio comparativo con el FLU para manejo de candidiasis esofágica, mostró una eficacia del 76%, luego de 7 días de terapia87.
AlbaconazolEs el triazol más reciente, disponible en presentación oral8. Altamente potente, con una excelente biodisponibilidad y amplia distribución en los tejidos. Tiene actividad contra Candida spp., Cryptococcus spp., Malassezia spp., dermatofitos, Aspergillus spp. y Paecilomyces spp.12,88,89. En adultos, se han llevado estudios fase II en onicomicosis y vulvovaginitis80,90.
ConclusiónEn comparación con la población adulta, los pacientes pediátricos presentan diferencias en su biología, factores predisponentes, epidemiologia y presentación de las infecciones fúngicas. Durante la última década, se ha presentado un rápido desarrollo de nuevos antifúngicos. A pesar de que no todos han sido aprobados para ser usados en niños, cada vez hay más información disponible acerca del uso y desarrollo de estos medicamentos en esta población, esto debido a que las IFI también han venido en ascenso, y problemas como la aparición de nuevos agentes etiológicos, la resistencia a medicamentos, tanto intrínseca como adquirida, son cada vez más comunes. Por esto, la terapia antifúngica cada día es más compleja, y es importante conocerla y entenderla para poder brindar un tratamiento más objetivo a los pacientes. Los triazoles hacen parte fundamental del armamento terapéutico antifúngico en pediatría. El FLU ha sido el más estudiado y ampliamente utilizado, y a la fecha, es el que cuenta con mejor evidencia sobre las características farmacocinéticas y farmacodinámicas en pediatría. Para los otros triazoles, la información aún es muy limitada, y se deriva en su mayoría de series de casos en los cuales estos medicamentos se han utilizado en indicaciones similares a las vigentes para los adultos, que revelan similitudes y diferencias con respecto a la respuesta. Pero los datos recogidos en los estudios sobre FLU han demostrado que la extrapolación de información de estudios realizados en adultos es completamente inadecuada, ya que estos han sido incapaces de demostrar el comportamiento y disposición de estos medicamentos en niños. Lo anterior resalta la necesidad de realizar estudios de PK/PD dedicados exclusiva mente a la población pediátrica, ya que para lograr el éxito terapéutico es fundamental obtener conocimientos sobre la adecuada administración del tratamiento, basándose en la manera como se distribuya en el organismo y en su interacción con el huésped y el agente etiológico. Debe tenerse en cuenta que uno de los principales inconvenientes para lograr lo anterior son las dificultades concernientes a la investigación en menores de edad.
AgradecimientosA las doctoras Ángela Restrepo M., Andrea Restrepo G. y Mónica Trujillo H., por su asesoría.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses de ningún tipo en el trabajo realizado.