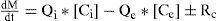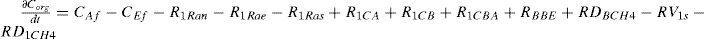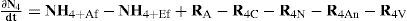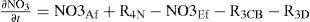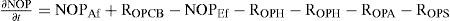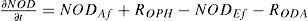El modelo se formuló para COT y CO2, y NH4+,NO3− y NTK, a partir de información de literatura y lo que se obtuvo en campo durante el seguimiento a tres unidades piloto de laguna facultativa secundaria: laguna convencional, LC, laguna de bafles, LB y laguna de bafles-mallas LBM. Los modelos mostraron sensibilidad a las variables caudal de entrada, radiación solar, pH y contenido de oxígeno; a nivel de parámetros se encontró que el modelo de Carbono resultó sensible a: KCOT Ba, umax Ba, umax Al, K10X, VAl, RIDCH4, YBh. El modelo de Nitrógeno resultó sensible a los parámetros: KCOT Ba, umax Ba, umax Al, VAl, KOPH, KOPA, r4An. Las pruebas t pareada realizadas indicaron que el modelo de Carbono reprodujo de manera confiable el comportamiento del COT en una laguna facultativa secundaria; mientras que el modelo de Nitrógeno lo hizo para el caso de NH4+. Diferentes topologías afectan la ecología del sistema promoviendo distintas rutas de transformación del nitrógeno; la topología LBM podría alcanzar transformaciones de C empleando volúmenes inferiores, sin embargo se requiere una calibración de los modelos propuestos. Los modelos podrían ser acoplados a modelos hidrodinámicos para un modelado eco-hidrodinámico.
Ecological models formulated for TOC, CO2, NH4+,NO3− and NTK, based in literature reviewed and field work were obtained monitoring three facultative secondary stabilization ponds, FSSP, pilots: conventional pond, CP, baffled pond, BP, and baffled-meshed pond, BMP. Models were sensitive to flow inlet, solar radiation, pH and oxygen content; the sensitive parameters in Carbon Model were KCOT Ba, umax Ba, umax Al, K10X, VAl R1DCH4, YBh. The sensitive parameters in the Nitrogen model were KCOT Ba, umax Ba, umax Al, VAl, KOPH, KOPA, r4An. The test t-paired showed a good simulating of Carbon model refers to TOC in FSSP; on the other side, the Nitrogen model showed a good simulating of NH4+. Different topological models modify ecosystem ecology forcing different transformation pathways of Nitrogen; equal transformations of the Carbon BMP topology could be achieved using lower volumes, however, a calibration for a new model would be required. Carbon and Nitrogen models developed could be coupled to hydrodynamics models for better modeling of FSSP.
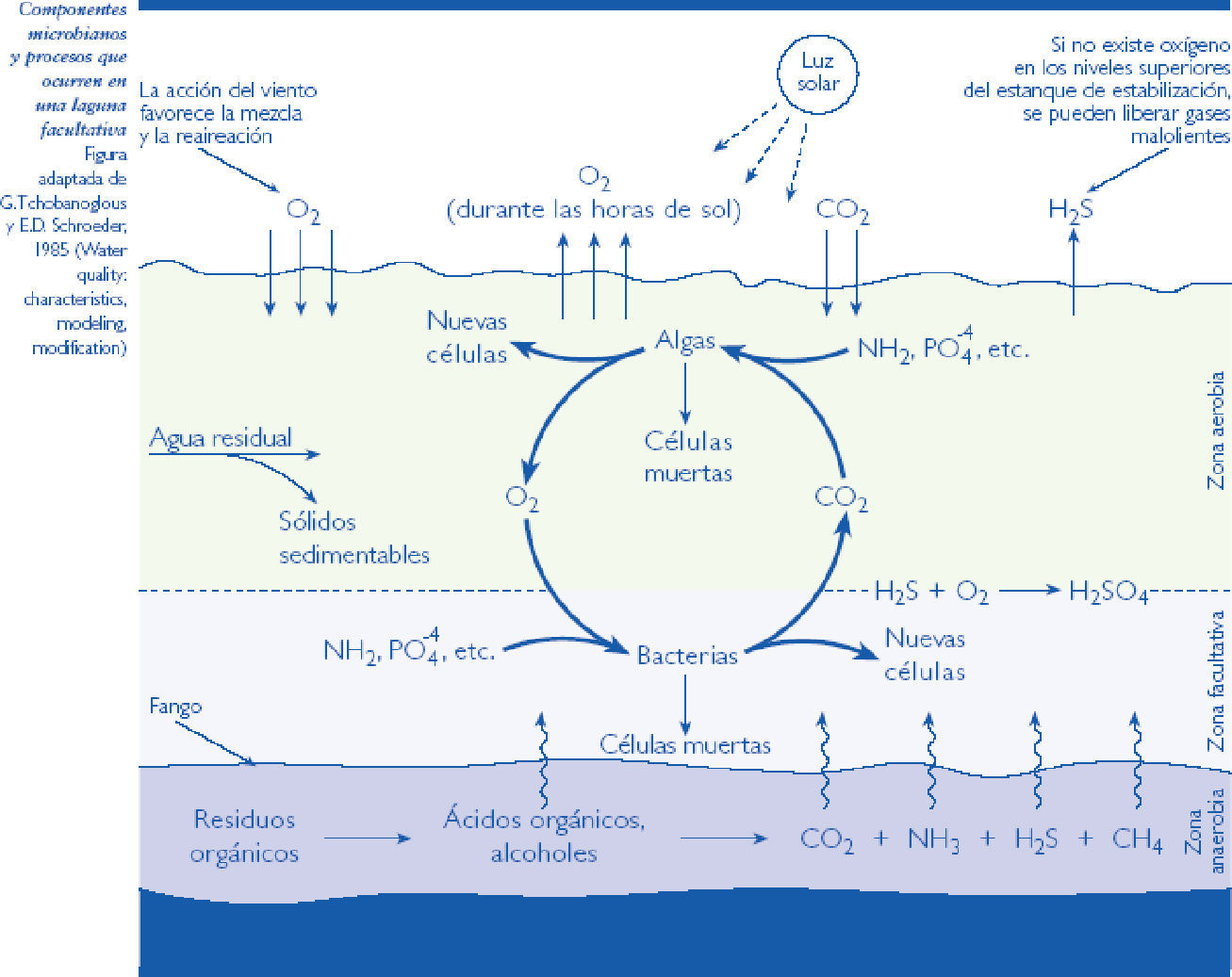
Controlar la contaminación hídrica ocasionada por aguas residuales municipales tiene justificación en problemas ambientales como la generación de gases efecto invernadero, GEI, la presencia de disruptores endocrinos (Janex et al., 2009), la eutrofización de fuentes de agua (Zimmo et al, 2004; Wallace y Austin, 2008) y el deterioro de la calidad de las fuentes de agua. Un enfoque ecológico en el estudio de lagunas facultativas secundarias, LFS (figura 1), apunta a conocer las relaciones establecidas entre la estructura de este ecosistema y las funciones que cumple. Un proceso de simulación-mo-delación puede explicar dichas relaciones, haciéndolo una herramienta útil para su análisis (Jamu y Piedrahita, 2002). Para analizar una LFS es posible apelar a procedimientos matemáticos que analicen los fenómenos multidimensionales (Legendre y Legendre, 2004) que suceden en estos complejos ecosistemas; el modelado puede integrar variables hidrodinámicas y cinéticas y es una herramienta con amplias posibilidades en el campo del tratamiento de las aguas residuales (Zima et al, 2009; Alvarado et al, 2012; Sah, 2009; Beran y Kargi, 2005; Houweling et al, 2008; Abbas et al, 2006). Disponer de modelos de LFS que conjuguen su ecología, incorporen sus propiedades dinámicas, componentes y variables (Jamu y Piedrahita, 2002) posibilitará la búsqueda de un ambiente sano con criterios de justicia ambiental (Rees, 2008).
Ecosistema en una LFS. Fuente: Metcalf y Eddy (1995)
La abundancia y disponibilidad del carbono, C, y nitrógeno, N, en la biósfera como constituyentes de la materia orgánica, dependen de transformaciones biogeoquímicas (Jenkins y Zehr, 2008) como las existentes en un LFS, además regulan la productividad de los ecosistemas acuáticos y terrestres, pues posibilitan la existencia de los productores primarios (Lampert y Sommer, 2007). Por otro lado, el modelado de la generación de gases efecto invernadero desde LFS podría validar modelos ecológicos que plantean balances de compuestos orgánicos y nutrientes (Pepperell et al., 2011). Así mismo, los mecanismos de eliminación de nitrógeno se siguen estudiando (Zimmo et al., 2004; Shen et al., 2012) pues existen divergencias frente a cuáles son los más efectivos y cuáles son los predominantes en estos reactores (Camargo, 2008). De ahí la importancia de desarrollar modelos ecológicos en LFS para C y N. Este documento aborda una propuesta de modelado ecológico en LFS para ambos elementos.
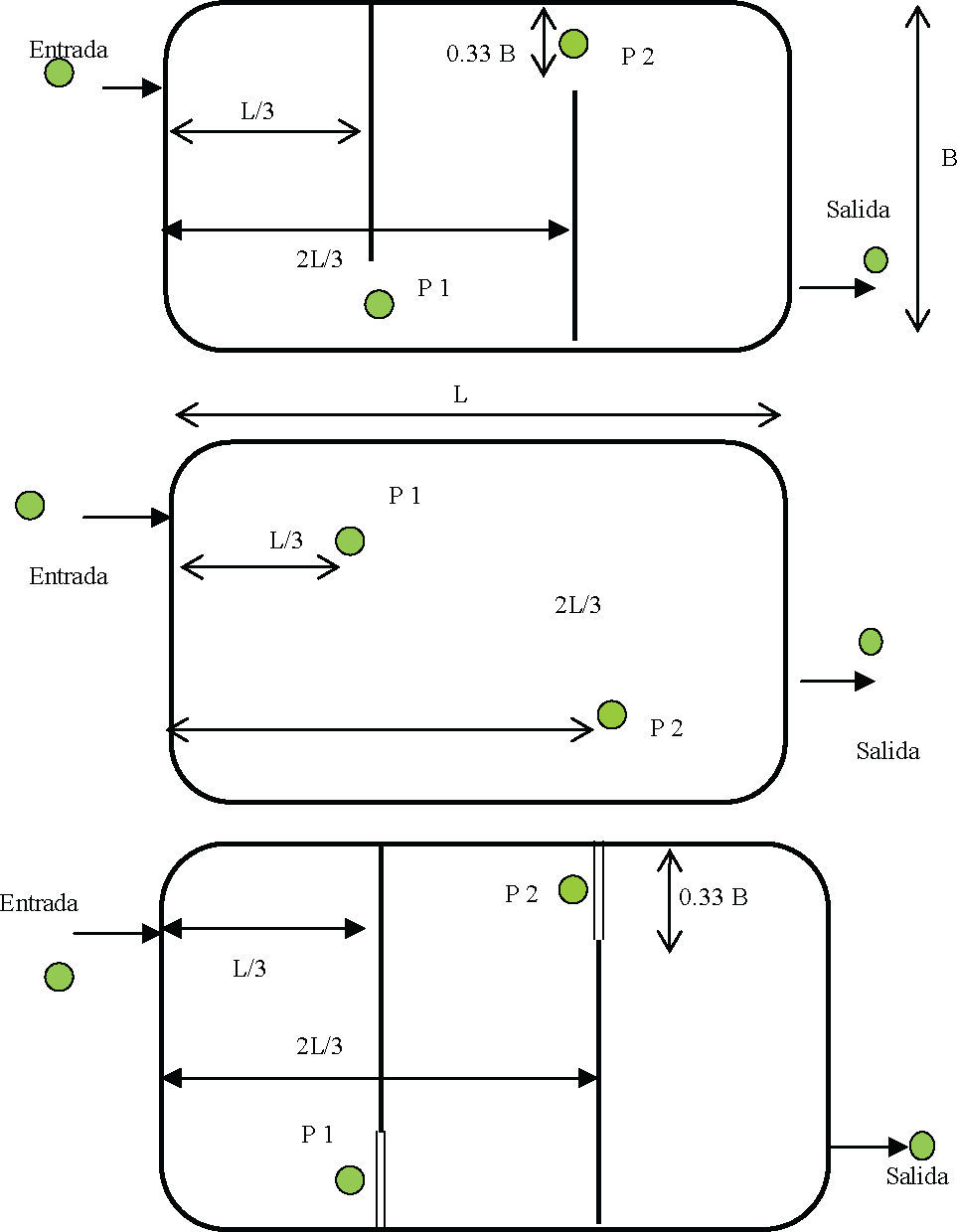
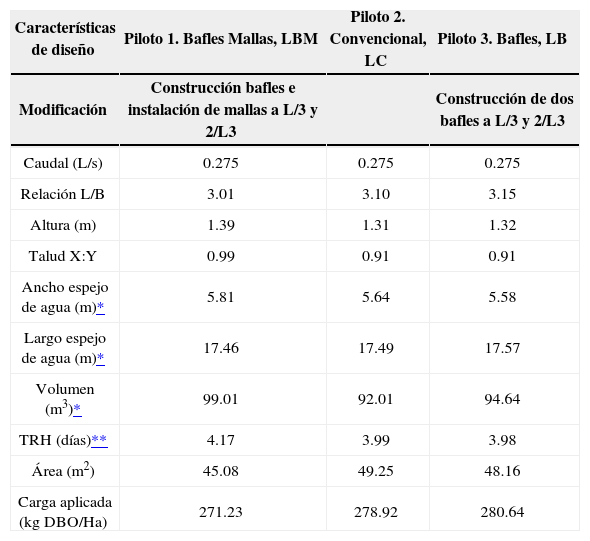
DesarrolloLa investigación fue ejecutada en la Estación de Investigación de Aguas residuales y reúso de Ginebra, EIG, localizada en el Valle del Cauca, Colombia, a 3° 43′ 50″ latitud norte y 76° 16′ 20″ longitud este, a 1040 ms.n.m. La temperatura promedio es 23°C y la precipitación promedio es 1280mm. Se hizo seguimiento a tres LFS con distintas configuraciones físicas (tabla 1). El diseño de las unidades piloto se realizó empleando la metodología de carga orgánica superficial (Mara, 2001) aplicando un análisis de incertidumbre (Von Sperling, 1996) con base en la propuesta de Banda (2003).
Características de las unidades piloto
| Características de diseño | Piloto 1. Bafles Mallas, LBM | Piloto 2. Convencional, LC | Piloto 3. Bafles, LB |
|---|---|---|---|
| Modificación | Construcción bafles e instalación de mallas a L/3 y 2/L3 | Construcción de dos bafles a L/3 y 2/L3 | |
| Caudal (L/s) | 0.275 | 0.275 | 0.275 |
| Relación L/B | 3.01 | 3.10 | 3.15 |
| Altura (m) | 1.39 | 1.31 | 1.32 |
| Talud X:Y | 0.99 | 0.91 | 0.91 |
| Ancho espejo de agua (m)* | 5.81 | 5.64 | 5.58 |
| Largo espejo de agua (m)* | 17.46 | 17.49 | 17.57 |
| Volumen (m3)* | 99.01 | 92.01 | 94.64 |
| TRH (días)** | 4.17 | 3.99 | 3.98 |
| Área (m2) | 45.08 | 49.25 | 48.16 |
| Carga aplicada (kg DBO/Ha) | 271.23 | 278.92 | 280.64 |
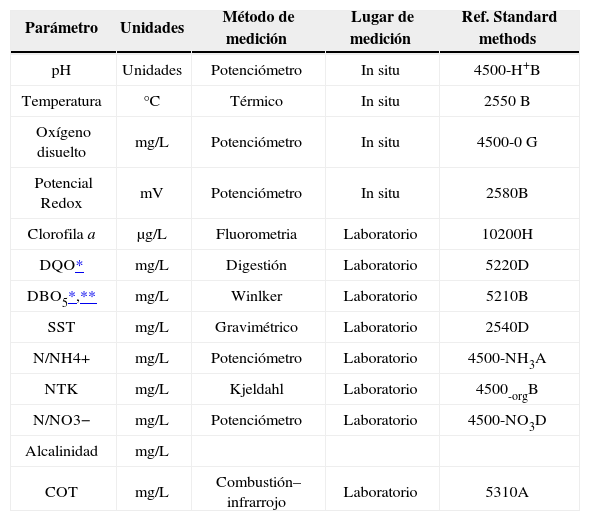
La figura 2 ilustra los pilotos y los puntos de muestreo. En P1 y P2 se tomaron muestras puntuales a dos profundidades, 0.05m y 0.75m, a las 10:00, 13:00, 17:00 y 22:00 horas teniendo en cuenta las variaciones meteorológicas; también se tomaron muestras puntuales y compuestas a la entrada y la salida de cada unidad. Se midieron caudales en forma volumétrica a la entrada y a la salida y se realizaron pruebas físico-químicas de las variables de interés a todas las muestras recolectadas (tabla 2). Con esta información de seguimiento se obtuvo información para la validación y calibración de los modelos ecológicos propuestos.
Variables medidas en las unidades piloto
| Parámetro | Unidades | Método de medición | Lugar de medición | Ref. Standard methods |
|---|---|---|---|---|
| pH | Unidades | Potenciómetro | In situ | 4500-H+B |
| Temperatura | °C | Térmico | In situ | 2550 B |
| Oxígeno disuelto | mg/L | Potenciómetro | In situ | 4500-0 G |
| Potencial Redox | mV | Potenciómetro | In situ | 2580B |
| Clorofila a | μg/L | Fluorometria | Laboratorio | 10200H |
| DQO* | mg/L | Digestión | Laboratorio | 5220D |
| DBO5*,** | mg/L | Winlker | Laboratorio | 5210B |
| SST | mg/L | Gravimétrico | Laboratorio | 2540D |
| N/NH4+ | mg/L | Potenciómetro | Laboratorio | 4500-NH3A |
| NTK | mg/L | Kjeldahl | Laboratorio | 4500-orgB |
| N/NO3− | mg/L | Potenciómetro | Laboratorio | 4500-NO3D |
| Alcalinidad | mg/L | |||
| COT | mg/L | Combustión–infrarrojo | Laboratorio | 5310A |
Fuente: APHA-AWWA-WEF (2005)
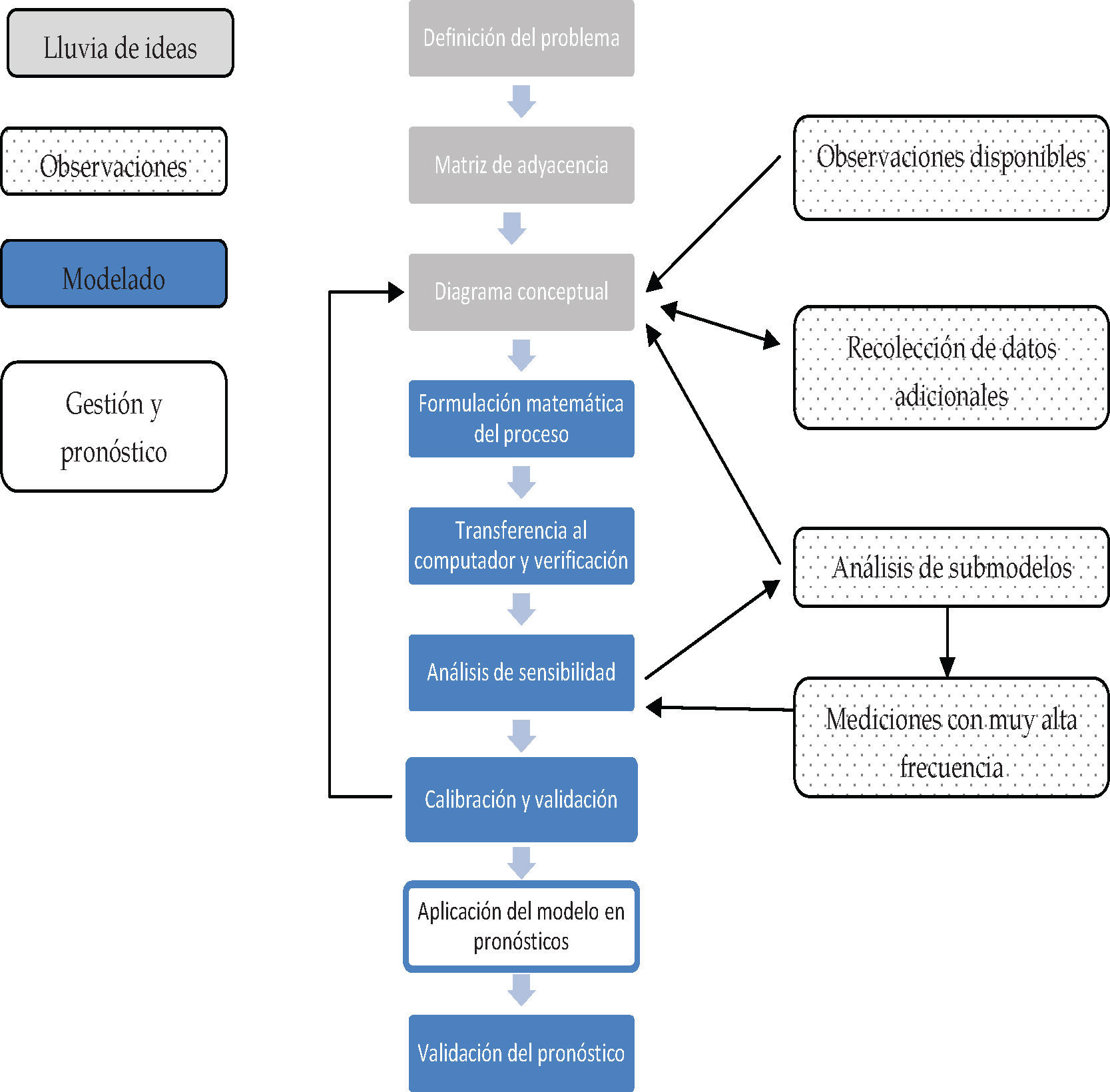
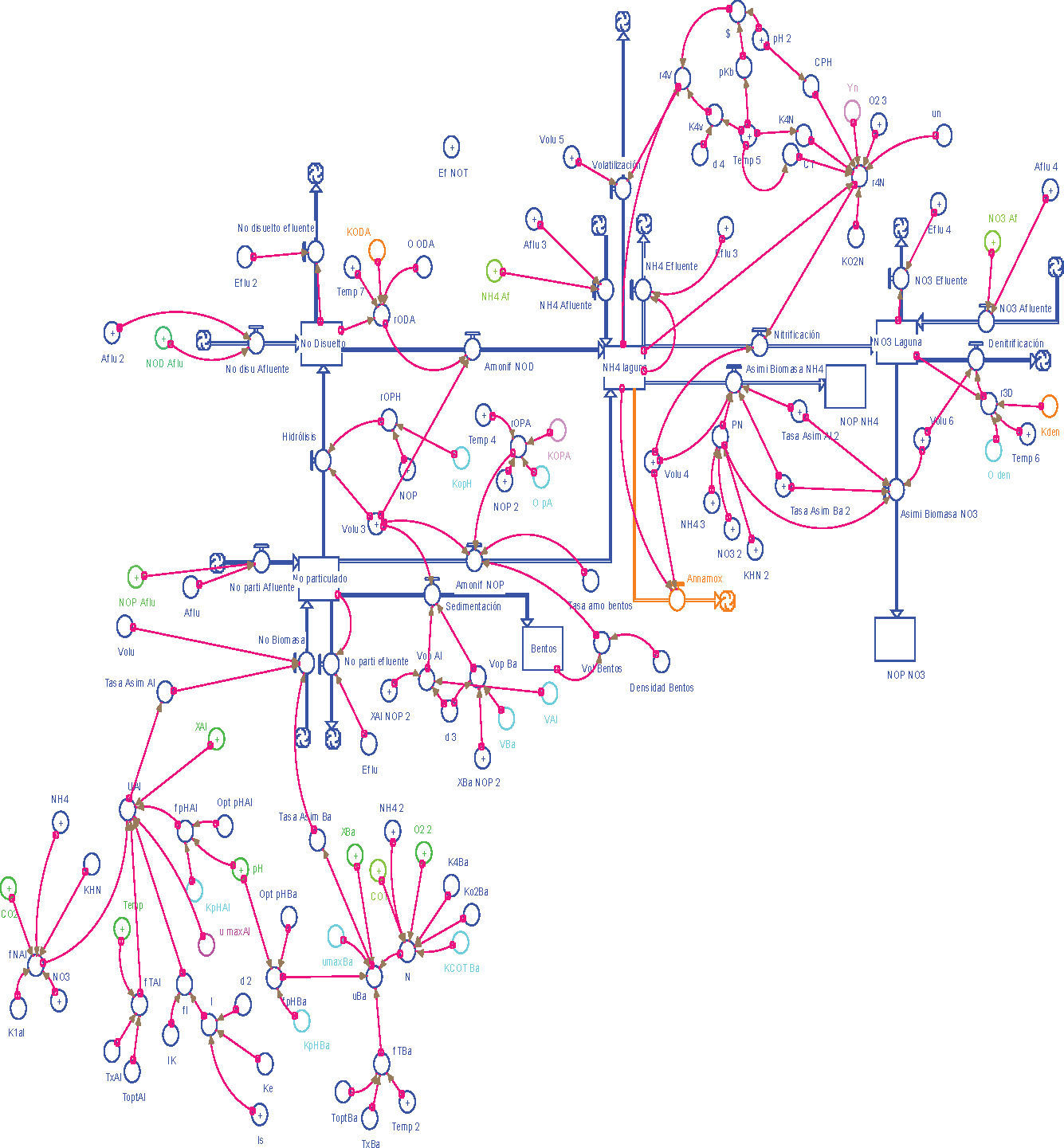
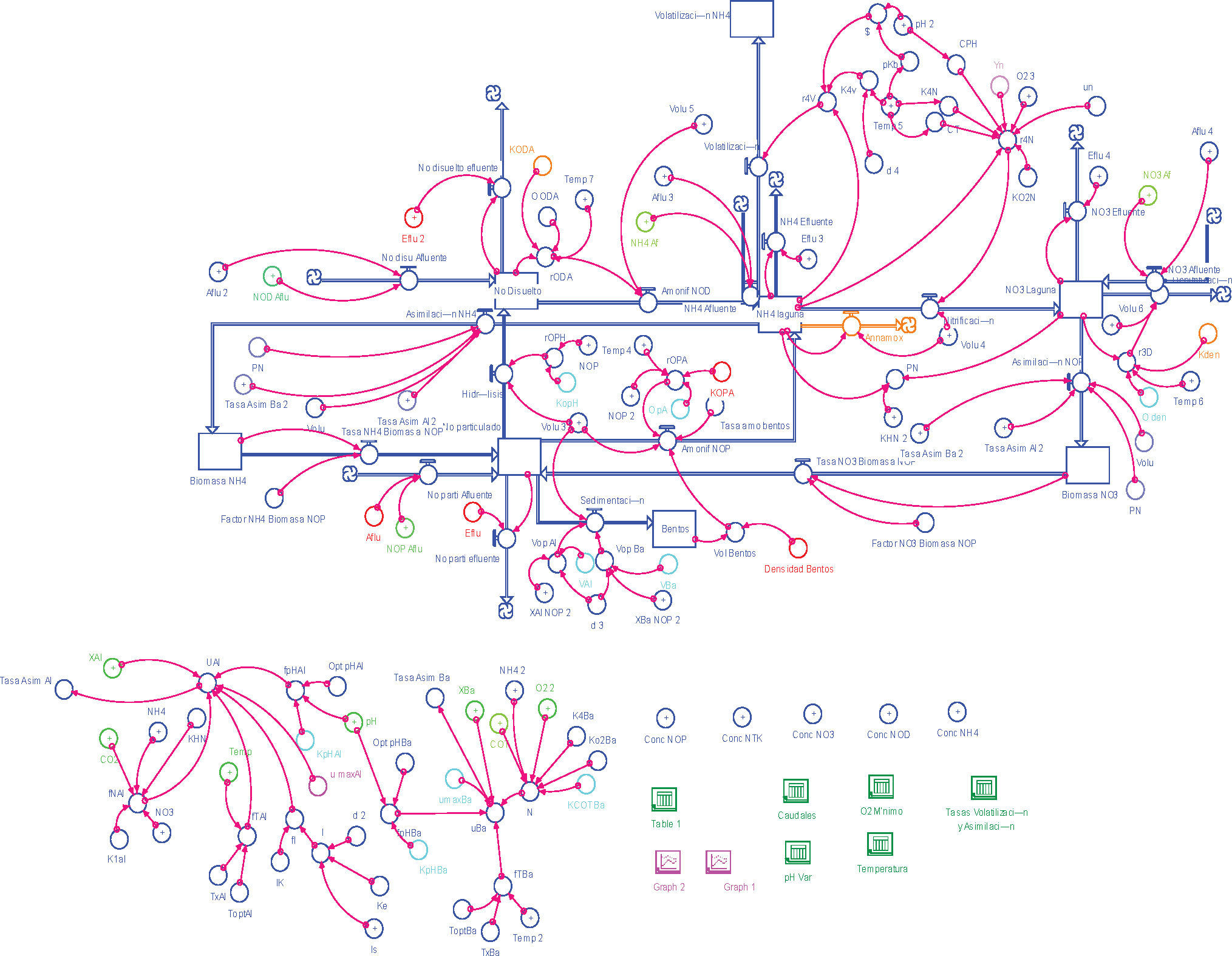
La formulación de los modelos fue guiada por la propuesta de Jorgensen y Bendoricchio (2001) (figura 3). El diagrama conceptual se desarrolló con el software Structural Thinking Experimental Learning Laboratory with Animation, Stella, de ISEE Systems Inc.® Este software se ha utilizado para simular modelos ecológicos y ofrece ventajas desde el punto de vista gráfico y de cuantificación (Jamu y Piedrahita, 2002). Las expresiones de balance de materia para cada especie fueron la base para la formulación matemática de los modelos ecológicos (ecuación 1). Los modelos consideraron condiciones no estacionarias, lo que definió una variación con respecto al tiempo de las especies químicas estudiadas.
donde:
Rc=rM * V(MT−1)
rM = transformación de la especie de interés en la LFS (aparición o desaparición) (ML−3t−1)
V = volumen de la laguna. (L3)
Q = caudal (L3t−1)
[Ci]= concentración de la especie a la entrada (ML−3)
[Ce]= concentración de la especie a la salida (ML−3)
(MtCada ecuación de balance de materia para las especies de interés fue implementada en el software Stella®. Se construyeron sub modelos (Pereira et al., 2006) para:
- •
Carbono orgánico total
- •
Carbono inorgánico total
- •
Nitrógeno orgánico particulado
- •
Nitrógeno orgánico disuelto
- •
Nitrógeno de nitratos
- •
Nitrógeno amoniacal
A partir de los resultados para LC se verificó el modelo correspondiente a LBM, ajustando los parámetros respectivos. El software Stella® fue utilizado en un equipo Toshiba Tecra, Procesador Intel® Core™2 Duo, CPU T8100 @ 2.10GHz 2.09GHz 1.99GB de RAM. El Apéndice 1 resume las expresiones matemáticas empleadas para la formulación de los modelos; la mayoría de ellas respondieron a cinéticas tipo Monod, considerando las condiciones hipertróficas de las LFS. La tabla 3 y 4 presentan los parámetros y valores empleados para ambos modelos. La LC se asumió como reactor completamente mezclado, RCM, con base en información de estudios de trazadores realizados en la LC y la LBM (Bravo y Rodriguez, 2010; Fichmann, 2012) los cuales arrojaron como resultado un comportamiento de flujo mixto con tendencia a RCM, correspondiente con lo planteado por otros investigadores (Mara, 2004), los números de dispersión hallados para LBM oscilaron entre 0.31 y 0.43 y para LC entre 0.19 y 1.5. Las concentraciones de biomasa algal y bacterial se hallaron a partir de los contenidos de COT en las lagunas piloto.
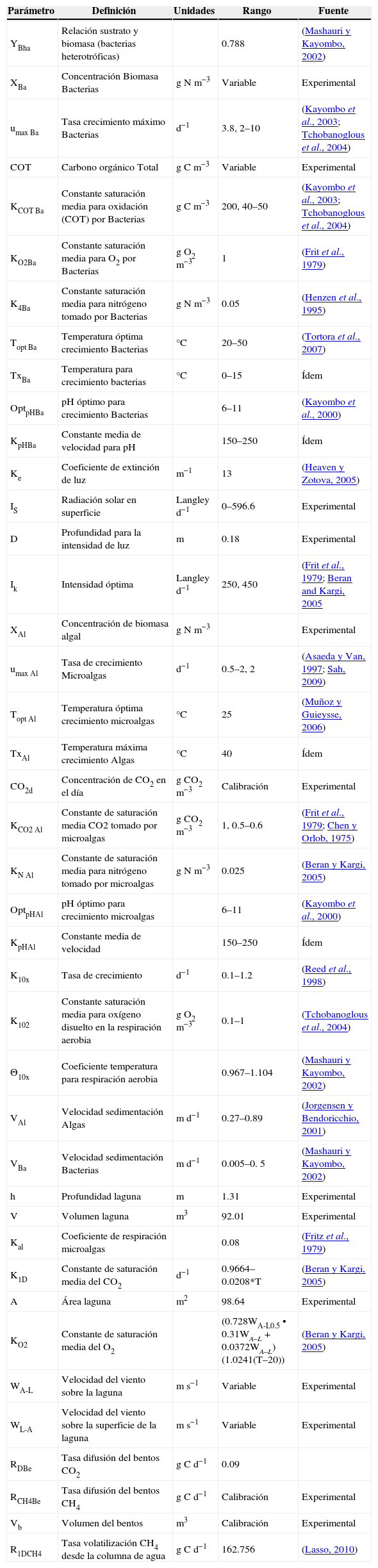
Parámetros modelos de Carbono
| Parámetro | Definición | Unidades | Rango | Fuente |
|---|---|---|---|---|
| YBha | Relación sustrato y biomasa (bacterias heterotróficas) | 0.788 | (Mashauri y Kayombo, 2002) | |
| XBa | Concentración Biomasa Bacterias | g N m−3 | Variable | Experimental |
| umax Ba | Tasa crecimiento máximo Bacterias | d−1 | 3.8, 2–10 | (Kayombo et al., 2003; Tchobanoglous et al., 2004) |
| COT | Carbono orgánico Total | g C m−3 | Variable | Experimental |
| KCOT Ba | Constante saturación media para oxidación (COT) por Bacterias | g C m−3 | 200, 40–50 | (Kayombo et al., 2003; Tchobanoglous et al., 2004) |
| KO2Ba | Constante saturación media para O2 por Bacterias | g O2 m−3 | 1 | (Frit et al., 1979) |
| K4Ba | Constante saturación media para nitrógeno tomado por Bacterias | g N m−3 | 0.05 | (Henzen et al., 1995) |
| Topt Ba | Temperatura óptima crecimiento Bacterias | °C | 20–50 | (Tortora et al., 2007) |
| TxBa | Temperatura para crecimiento bacterias | °C | 0–15 | Ídem |
| OptpHBa | pH óptimo para crecimiento Bacterias | 6–11 | (Kayombo et al., 2000) | |
| KpHBa | Constante media de velocidad para pH | 150–250 | Ídem | |
| Ke | Coeficiente de extinción de luz | m−1 | 13 | (Heaven y Zotova, 2005) |
| IS | Radiación solar en superficie | Langley d−1 | 0–596.6 | Experimental |
| D | Profundidad para la intensidad de luz | m | 0.18 | Experimental |
| Ik | Intensidad óptima | Langley d−1 | 250, 450 | (Frit et al., 1979; Beran and Kargi, 2005 |
| XAl | Concentración de biomasa algal | g N m−3 | Experimental | |
| umax Al | Tasa de crecimiento Microalgas | d−1 | 0.5–2, 2 | (Asaeda y Van, 1997; Sah, 2009) |
| Topt Al | Temperatura óptima crecimiento microalgas | °C | 25 | (Muñoz y Guieysse, 2006) |
| TxAl | Temperatura máxima crecimiento Algas | °C | 40 | Ídem |
| CO2d | Concentración de CO2 en el día | g CO2 m−3 | Calibración | Experimental |
| KCO2 Al | Constante de saturación media CO2 tomado por microalgas | g CO2 m−3 | 1, 0.5–0.6 | (Frit et al., 1979; Chen y Orlob, 1975) |
| KN Al | Constante de saturación media para nitrógeno tomado por microalgas | g N m−3 | 0.025 | (Beran y Kargi, 2005) |
| OptpHAl | pH óptimo para crecimiento microalgas | 6–11 | (Kayombo et al., 2000) | |
| KpHAl | Constante media de velocidad | 150–250 | Ídem | |
| K10x | Tasa de crecimiento | d−1 | 0.1–1.2 | (Reed et al., 1998) |
| K102 | Constante saturación media para oxígeno disuelto en la respiración aerobia | g O2 m−3 | 0.1–1 | (Tchobanoglous et al., 2004) |
| Θ10x | Coeficiente temperatura para respiración aerobia | 0.967–1.104 | (Mashauri y Kayombo, 2002) | |
| VAl | Velocidad sedimentación Algas | m d−1 | 0.27–0.89 | (Jorgensen y Bendoricchio, 2001) |
| VBa | Velocidad sedimentación Bacterias | m d−1 | 0.005–0. 5 | (Mashauri y Kayombo, 2002) |
| h | Profundidad laguna | m | 1.31 | Experimental |
| V | Volumen laguna | m3 | 92.01 | Experimental |
| Kal | Coeficiente de respiración microalgas | 0.08 | (Fritz et al., 1979) | |
| K1D | Constante de saturación media del CO2 | d−1 | 0.9664–0.0208*T | (Beran y Kargi, 2005) |
| A | Área laguna | m2 | 98.64 | Experimental |
| KO2 | Constante de saturación media del O2 | (0.728WA-L0.5 • 0.31WA–L+0.0372WA–L) (1.0241(T–20)) | (Beran y Kargi, 2005) | |
| WA-L | Velocidad del viento sobre la laguna | m s−1 | Variable | Experimental |
| WL-A | Velocidad del viento sobre la superficie de la laguna | m s−1 | Variable | Experimental |
| RDBe | Tasa difusión del bentos CO2 | g C d−1 | 0.09 | |
| RCH4Be | Tasa difusión del bentos CH4 | g C d−1 | Calibración | Experimental |
| Vb | Volumen del bentos | m3 | Calibración | Experimental |
| R1DCH4 | Tasa volatilización CH4 desde la columna de agua | g C d−1 | 162.756 | (Lasso, 2010) |
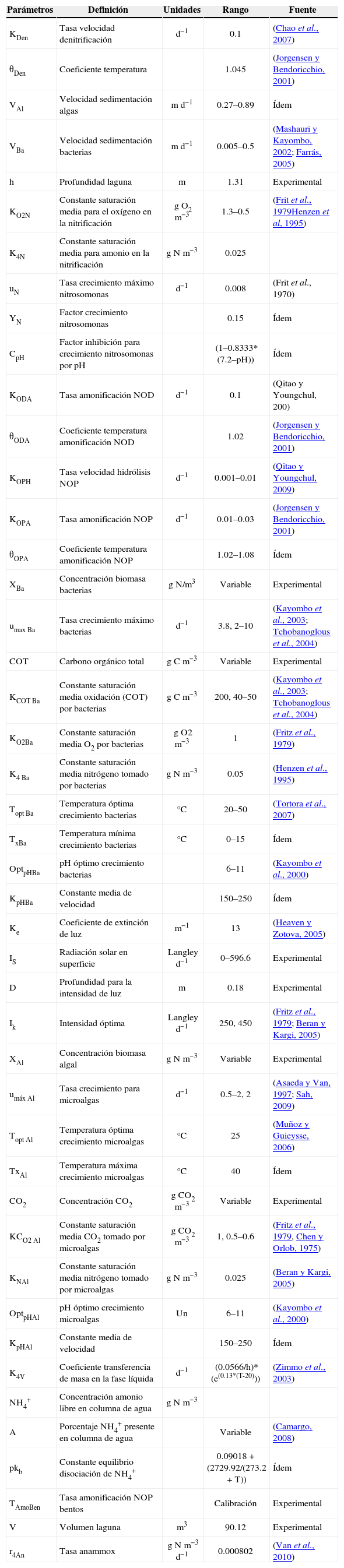
Parámetros modelos de Nitrógeno
| Parámetros | Definición | Unidades | Rango | Fuente |
|---|---|---|---|---|
| KDen | Tasa velocidad denitrificación | d−1 | 0.1 | (Chao et al., 2007) |
| θDen | Coeficiente temperatura | 1.045 | (Jorgensen y Bendoricchio, 2001) | |
| VAl | Velocidad sedimentación algas | m d−1 | 0.27–0.89 | Ídem |
| VBa | Velocidad sedimentación bacterias | m d−1 | 0.005–0.5 | (Mashauri y Kayombo, 2002; Farrás, 2005) |
| h | Profundidad laguna | m | 1.31 | Experimental |
| KO2N | Constante saturación media para el oxígeno en la nitrificación | g O2 m−3 | 1.3–0.5 | (Frit et al., 1979Henzen et al, 1995) |
| K4N | Constante saturación media para amonio en la nitrificación | g N m−3 | 0.025 | |
| uN | Tasa crecimiento máximo nitrosomonas | d−1 | 0.008 | (Frit et al., 1970) |
| YN | Factor crecimiento nitrosomonas | 0.15 | Ídem | |
| CpH | Factor inhibición para crecimiento nitrosomonas por pH | (1–0.8333*(7.2–pH)) | Ídem | |
| KODA | Tasa amonificación NOD | d−1 | 0.1 | (Qitao y Youngchul, 200) |
| θODA | Coeficiente temperatura amonificación NOD | 1.02 | (Jorgensen y Bendoricchio, 2001) | |
| KOPH | Tasa velocidad hidrólisis NOP | d−1 | 0.001–0.01 | (Qitao y Youngchul, 2009) |
| KOPA | Tasa amonificación NOP | d−1 | 0.01–0.03 | (Jorgensen y Bendoricchio, 2001) |
| θOPA | Coeficiente temperatura amonificación NOP | 1.02–1.08 | Ídem | |
| XBa | Concentración biomasa bacterias | g N/m3 | Variable | Experimental |
| umax Ba | Tasa crecimiento máximo bacterias | d−1 | 3.8, 2–10 | (Kayombo et al., 2003; Tchobanoglous et al., 2004) |
| COT | Carbono orgánico total | g C m−3 | Variable | Experimental |
| KCOT Ba | Constante saturación media oxidación (COT) por bacterias | g C m−3 | 200, 40–50 | (Kayombo et al., 2003; Tchobanoglous et al., 2004) |
| KO2Ba | Constante saturación media O2 por bacterias | g O2 m−3 | 1 | (Fritz et al., 1979) |
| K4 Ba | Constante saturación media nitrógeno tomado por bacterias | g N m−3 | 0.05 | (Henzen et al., 1995) |
| Topt Ba | Temperatura óptima crecimiento bacterias | °C | 20–50 | (Tortora et al., 2007) |
| TxBa | Temperatura mínima crecimiento bacterias | °C | 0–15 | Ídem |
| OptpHBa | pH óptimo crecimiento bacterias | 6–11 | (Kayombo et al., 2000) | |
| KpHBa | Constante media de velocidad | 150–250 | Ídem | |
| Ke | Coeficiente de extinción de luz | m−1 | 13 | (Heaven y Zotova, 2005) |
| IS | Radiación solar en superficie | Langley d−1 | 0–596.6 | Experimental |
| D | Profundidad para la intensidad de luz | m | 0.18 | Experimental |
| Ik | Intensidad óptima | Langley d−1 | 250, 450 | (Fritz et al., 1979; Beran y Kargi, 2005) |
| XAl | Concentración biomasa algal | g N m−3 | Variable | Experimental |
| umáx Al | Tasa crecimiento para microalgas | d−1 | 0.5–2, 2 | (Asaeda y Van, 1997; Sah, 2009) |
| Topt Al | Temperatura óptima crecimiento microalgas | °C | 25 | (Muñoz y Guieysse, 2006) |
| TxAl | Temperatura máxima crecimiento microalgas | °C | 40 | Ídem |
| CO2 | Concentración CO2 | g CO2 m−3 | Variable | Experimental |
| KCO2 Al | Constante saturación media CO2 tomado por microalgas | g CO2 m−3 | 1, 0.5–0.6 | (Fritz et al., 1979, Chen y Orlob, 1975) |
| KNAl | Constante saturación media nitrógeno tomado por microalgas | g N m−3 | 0.025 | (Beran y Kargi, 2005) |
| OptpHAl | pH óptimo crecimiento microalgas | Un | 6–11 | (Kayombo et al., 2000) |
| KpHAl | Constante media de velocidad | 150–250 | Ídem | |
| K4V | Coeficiente transferencia de masa en la fase líquida | d−1 | (0.0566/h)*(e(0.13*(T-20))) | (Zimmo et al., 2003) |
| NH4+ | Concentración amonio libre en columna de agua | g N m−3 | ||
| A | Porcentaje NH4+ presente en columna de agua | Variable | (Camargo, 2008) | |
| pkb | Constante equilibrio disociación de NH4+ | 0.09018+(2729.92/(273.2+T)) | Ídem | |
| TAmoBen | Tasa amonificación NOP bentos | Calibración | Experimental | |
| V | Volumen laguna | m3 | 90.12 | Experimental |
| r4An | Tasa anammox | g N m−3 d−1 | 0.000802 | (Van et al., 2010) |
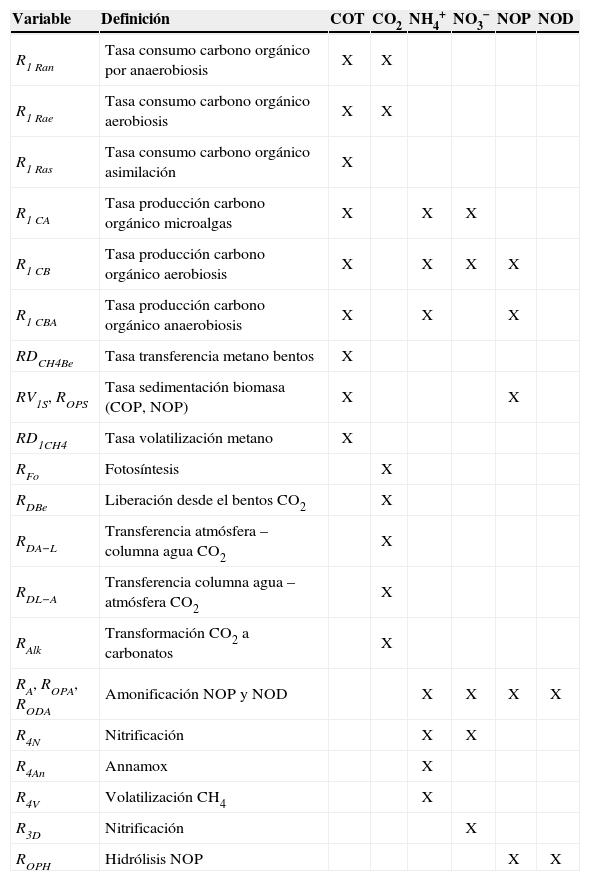
Los valores de nitrógeno asociado a microalgas y bacterias se estimaron a partir de la literatura (Mišurcová et al., 2010; Bradley y Nichols, 1918; Fagerbakke et al., 1996). En la tabla 5 se presentan las interacciones entre las distintas especies de análisis de los modelos propuestos para C y N.
Matriz de adyacencia
| Variable | Definición | COT | CO2 | NH4+ | NO3− | NOP | NOD |
|---|---|---|---|---|---|---|---|
| R1 Ran | Tasa consumo carbono orgánico por anaerobiosis | X | X | ||||
| R1 Rae | Tasa consumo carbono orgánico aerobiosis | X | X | ||||
| R1 Ras | Tasa consumo carbono orgánico asimilación | X | |||||
| R1 CA | Tasa producción carbono orgánico microalgas | X | X | X | |||
| R1 CB | Tasa producción carbono orgánico aerobiosis | X | X | X | X | ||
| R1 CBA | Tasa producción carbono orgánico anaerobiosis | X | X | X | |||
| RDCH4Be | Tasa transferencia metano bentos | X | |||||
| RV1S, ROPS | Tasa sedimentación biomasa (COP, NOP) | X | X | ||||
| RD1CH4 | Tasa volatilización metano | X | |||||
| RFo | Fotosíntesis | X | |||||
| RDBe | Liberación desde el bentos CO2 | X | |||||
| RDA−L | Transferencia atmósfera – columna agua CO2 | X | |||||
| RDL−A | Transferencia columna agua – atmósfera CO2 | X | |||||
| RAlk | Transformación CO2 a carbonatos | X | |||||
| RA, ROPA, RODA | Amonificación NOP y NOD | X | X | X | X | ||
| R4N | Nitrificación | X | X | ||||
| R4An | Annamox | X | |||||
| R4V | Volatilización CH4 | X | |||||
| R3D | Nitrificación | X | |||||
| ROPH | Hidrólisis NOP | X | X |
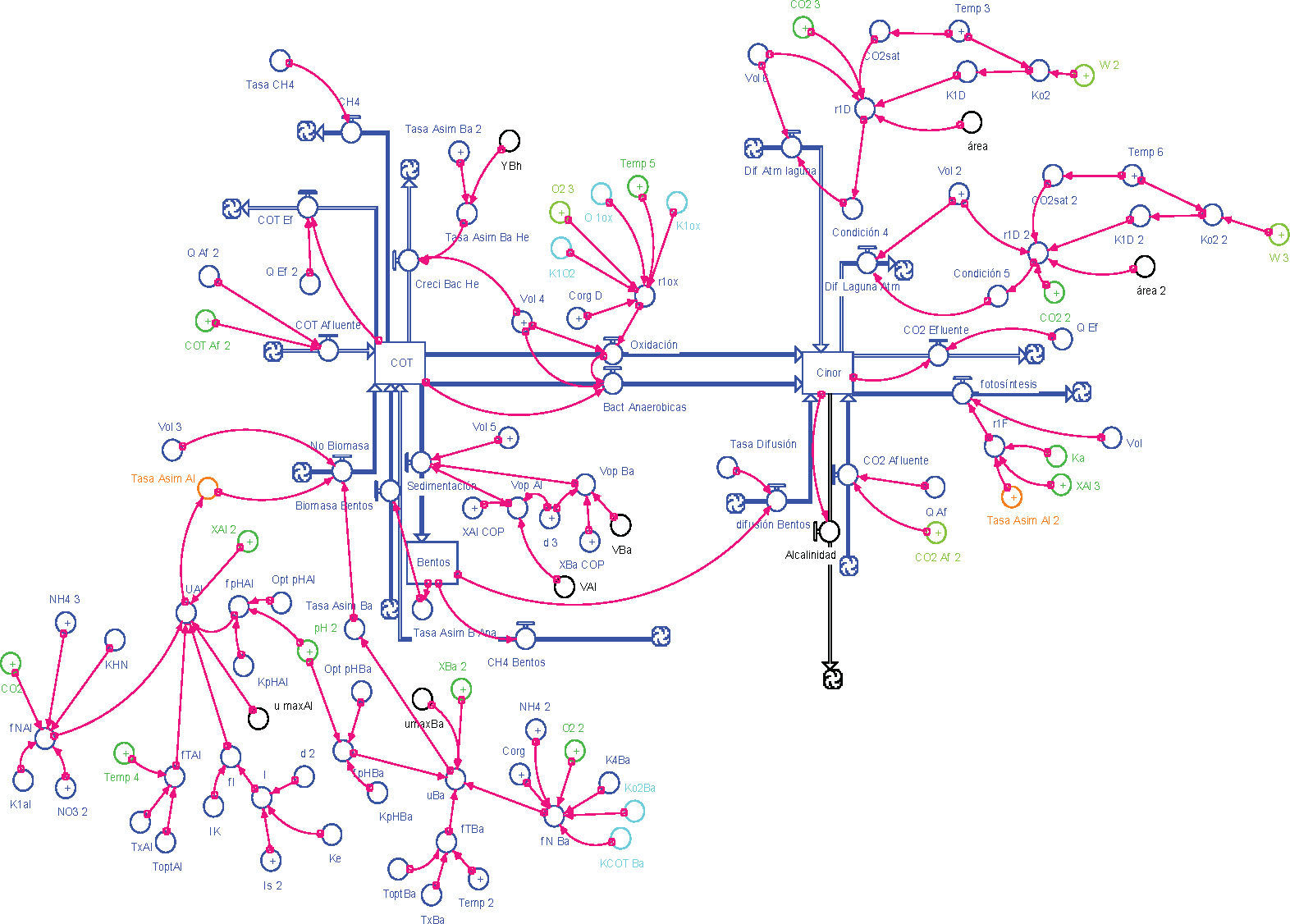
Los diagramas conceptuales para los modelos de C y N, se presentan en las figuras 4 y 5.
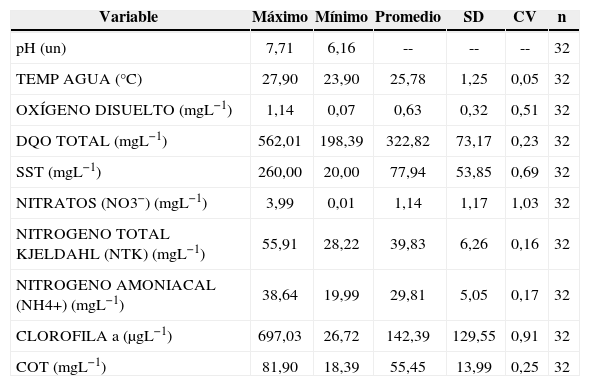
Análisis y discusiónResumen de estadísticas descriptivas de entrada de agua a los sistemas. Muestras puntuales
| Variable | Máximo | Mínimo | Promedio | SD | CV | n |
|---|---|---|---|---|---|---|
| pH (un) | 7,71 | 6,16 | -- | -- | -- | 32 |
| TEMP AGUA (°C) | 27,90 | 23,90 | 25,78 | 1,25 | 0,05 | 32 |
| OXÍGENO DISUELTO (mgL−1) | 1,14 | 0,07 | 0,63 | 0,32 | 0,51 | 32 |
| DQO TOTAL (mgL−1) | 562,01 | 198,39 | 322,82 | 73,17 | 0,23 | 32 |
| SST (mgL−1) | 260,00 | 20,00 | 77,94 | 53,85 | 0,69 | 32 |
| NITRATOS (NO3−) (mgL−1) | 3,99 | 0,01 | 1,14 | 1,17 | 1,03 | 32 |
| NITROGENO TOTAL KJELDAHL (NTK) (mgL−1) | 55,91 | 28,22 | 39,83 | 6,26 | 0,16 | 32 |
| NITROGENO AMONIACAL (NH4+) (mgL−1) | 38,64 | 19,99 | 29,81 | 5,05 | 0,17 | 32 |
| CLOROFILA a (μgL−1) | 697,03 | 26,72 | 142,39 | 129,55 | 0,91 | 32 |
| COT (mgL−1) | 81,90 | 18,39 | 55,45 | 13,99 | 0,25 | 32 |
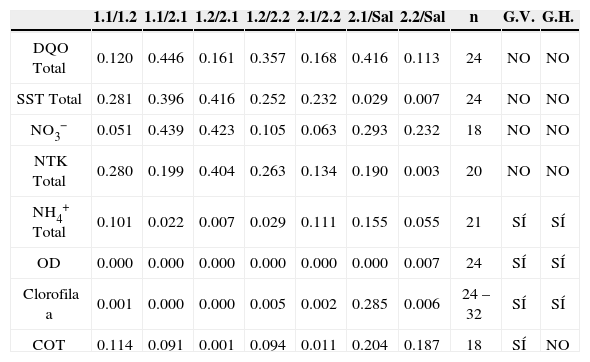
Las siguientes tablas ilustran las diferencias encontradas entre las unidades piloto. Las pruebas estadísticas fueron adelantadas usando el software SPSS® v. 13.0 for Windows®.
Se realizaron pruebas de normalidad para los datos y se definieron las pruebas estadísticas a utilizar. Se emplearon pruebas t-pareada para establecer diferencias en términos de gradientes horizontales y verticales (tablas 9,10 y 11).
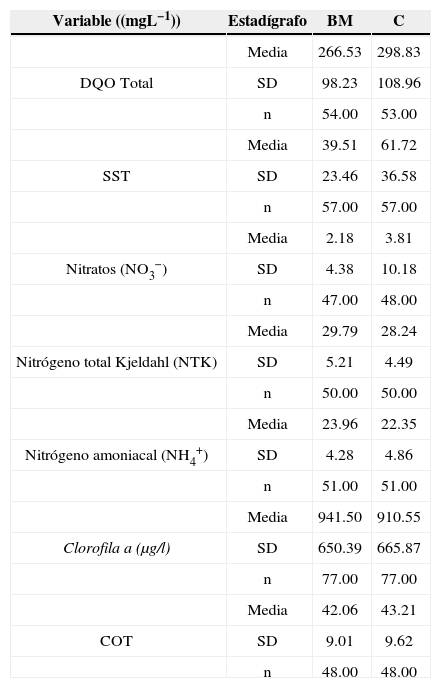
Estadísticas descriptivas Salida pilotos. Muestras puntuales
| Variable ((mgL−1)) | Estadígrafo | BM | C |
|---|---|---|---|
| Media | 266.53 | 298.83 | |
| DQO Total | SD | 98.23 | 108.96 |
| n | 54.00 | 53.00 | |
| Media | 39.51 | 61.72 | |
| SST | SD | 23.46 | 36.58 |
| n | 57.00 | 57.00 | |
| Media | 2.18 | 3.81 | |
| Nitratos (NO3−) | SD | 4.38 | 10.18 |
| n | 47.00 | 48.00 | |
| Media | 29.79 | 28.24 | |
| Nitrógeno total Kjeldahl (NTK) | SD | 5.21 | 4.49 |
| n | 50.00 | 50.00 | |
| Media | 23.96 | 22.35 | |
| Nitrógeno amoniacal (NH4+) | SD | 4.28 | 4.86 |
| n | 51.00 | 51.00 | |
| Media | 941.50 | 910.55 | |
| Clorofila a (μg/l) | SD | 650.39 | 665.87 |
| n | 77.00 | 77.00 | |
| Media | 42.06 | 43.21 | |
| COT | SD | 9.01 | 9.62 |
| n | 48.00 | 48.00 |
Comparación entre puntos internos y entre salida LBM. Pruebas t-pareada
| 1.1/1.2 | 1.1/2.1 | 1.2/2.1 | 1.2/2.2 | 2.1/2.2 | 2.1/Sal | 2.2/Sal | n | G.V. | G.H. | |
|---|---|---|---|---|---|---|---|---|---|---|
| DQO Total | 0.120 | 0.446 | 0.161 | 0.357 | 0.168 | 0.416 | 0.113 | 24 | NO | NO |
| SST Total | 0.281 | 0.396 | 0.416 | 0.252 | 0.232 | 0.029 | 0.007 | 24 | NO | NO |
| NO3− | 0.051 | 0.439 | 0.423 | 0.105 | 0.063 | 0.293 | 0.232 | 18 | NO | NO |
| NTK Total | 0.280 | 0.199 | 0.404 | 0.263 | 0.134 | 0.190 | 0.003 | 20 | NO | NO |
| NH4+ Total | 0.101 | 0.022 | 0.007 | 0.029 | 0.111 | 0.155 | 0.055 | 21 | SÍ | SÍ |
| OD | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.007 | 24 | SÍ | SÍ |
| Clorofila a | 0.001 | 0.000 | 0.000 | 0.005 | 0.002 | 0.285 | 0.006 | 24 – 32 | SÍ | SÍ |
| COT | 0.114 | 0.091 | 0.001 | 0.094 | 0.011 | 0.204 | 0.187 | 18 | SÍ | NO |
G.V., Gradiente Vertical; G.H. Gradiente Horizontal
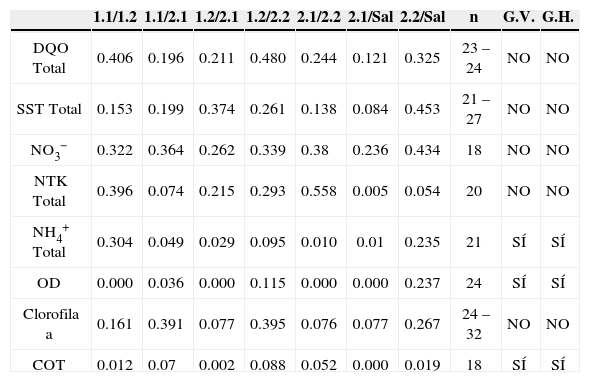
Comparación entre puntos internos y entre salida LC – Pruebas t– pareada
| 1.1/1.2 | 1.1/2.1 | 1.2/2.1 | 1.2/2.2 | 2.1/2.2 | 2.1/Sal | 2.2/Sal | n | G.V. | G.H. | |
|---|---|---|---|---|---|---|---|---|---|---|
| DQO Total | 0.406 | 0.196 | 0.211 | 0.480 | 0.244 | 0.121 | 0.325 | 23 – 24 | NO | NO |
| SST Total | 0.153 | 0.199 | 0.374 | 0.261 | 0.138 | 0.084 | 0.453 | 21 – 27 | NO | NO |
| NO3− | 0.322 | 0.364 | 0.262 | 0.339 | 0.38 | 0.236 | 0.434 | 18 | NO | NO |
| NTK Total | 0.396 | 0.074 | 0.215 | 0.293 | 0.558 | 0.005 | 0.054 | 20 | NO | NO |
| NH4+ Total | 0.304 | 0.049 | 0.029 | 0.095 | 0.010 | 0.01 | 0.235 | 21 | SÍ | SÍ |
| OD | 0.000 | 0.036 | 0.000 | 0.115 | 0.000 | 0.000 | 0.237 | 24 | SÍ | SÍ |
| Clorofila a | 0.161 | 0.391 | 0.077 | 0.395 | 0.076 | 0.077 | 0.267 | 24 – 32 | NO | NO |
| COT | 0.012 | 0.07 | 0.002 | 0.088 | 0.052 | 0.000 | 0.019 | 18 | SÍ | SÍ |
G.V., Gradiente Vertical; G.H. Gradiente Horizontal
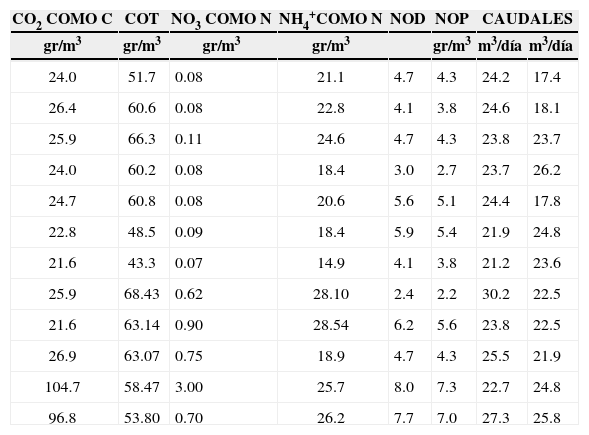
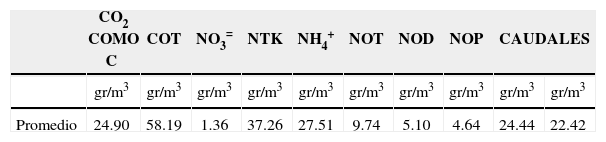
Datos de entrada, verificación de modelos de carbono y nitrógeno
| CO2 COMO C | COT | NO3 COMO N | NH4+COMO N | NOD | NOP | CAUDALES | |
|---|---|---|---|---|---|---|---|
| gr/m3 | gr/m3 | gr/m3 | gr/m3 | gr/m3 | m3/día | m3/día | |
| 24.0 | 51.7 | 0.08 | 21.1 | 4.7 | 4.3 | 24.2 | 17.4 |
| 26.4 | 60.6 | 0.08 | 22.8 | 4.1 | 3.8 | 24.6 | 18.1 |
| 25.9 | 66.3 | 0.11 | 24.6 | 4.7 | 4.3 | 23.8 | 23.7 |
| 24.0 | 60.2 | 0.08 | 18.4 | 3.0 | 2.7 | 23.7 | 26.2 |
| 24.7 | 60.8 | 0.08 | 20.6 | 5.6 | 5.1 | 24.4 | 17.8 |
| 22.8 | 48.5 | 0.09 | 18.4 | 5.9 | 5.4 | 21.9 | 24.8 |
| 21.6 | 43.3 | 0.07 | 14.9 | 4.1 | 3.8 | 21.2 | 23.6 |
| 25.9 | 68.43 | 0.62 | 28.10 | 2.4 | 2.2 | 30.2 | 22.5 |
| 21.6 | 63.14 | 0.90 | 28.54 | 6.2 | 5.6 | 23.8 | 22.5 |
| 26.9 | 63.07 | 0.75 | 18.9 | 4.7 | 4.3 | 25.5 | 21.9 |
| 104.7 | 58.47 | 3.00 | 25.7 | 8.0 | 7.3 | 22.7 | 24.8 |
| 96.8 | 53.80 | 0.70 | 26.2 | 7.7 | 7.0 | 27.3 | 25.8 |
Lo anterior indica que existieron condiciones distintas de transformación de C y N en las unidades teniendo en cuenta las variaciones identificadas entre los puntos cercanos a la salida y las salidas (P21/Sal, P22/Sal). Encontrar gradientes de Clorofila a como indicador de la presencia de microalgas en el caso de la LBM sugiere que la transformación de los compuestos de C y N está ligado a la fotosíntesis; esta aseveración coincide con los gradientes de microalgas identificados en otros ejercicios de modelado (Beran y Kargi, 2005; Sah, 2009). El uso del modelo de RCM quedó verificado para LC y para LBM, en el sentido de suponer disponibilidad de recursos de manera homogénea; sin embargo, los bafles y las mallas de las LBM promueven una mayor compartimentación de los procesos, como lo encontrado en el modelado hidrodinámico de lagunas con bafles que indican tendencia a Flujo Pistón, (Shilton y Harrison, 2003; Sah, 2009; Abbas et al., 2006).
Verificación de los modelos de Carbono y Nitrógeno en LCLos modelos se consideraron verificados si para alguno de los parámetros la prueba t-pareada era positiva (aceptación de hipótesis nula) o si los errores entre las estimaciones y los valores de campo fueron inferiores a 50%. Las etapas de análisis de sensibilidad y calibración del modelo dieron respuesta a que las pruebas t-pareada para todas las variables en estudio resultaran en la aceptación de la hipótesis nula. Para la verificación (tabla 11), se definieron las siguientes condiciones de configuración en el software Stella (isse-Systems, 2005).
Periodo simulación, t. 25 días.
Paso temporal, dt. 1/40.
Método de integración de las ecuaciones. método Runge-Kutta (isse-Systems, 2005).
Unidad de medida, u. Días.
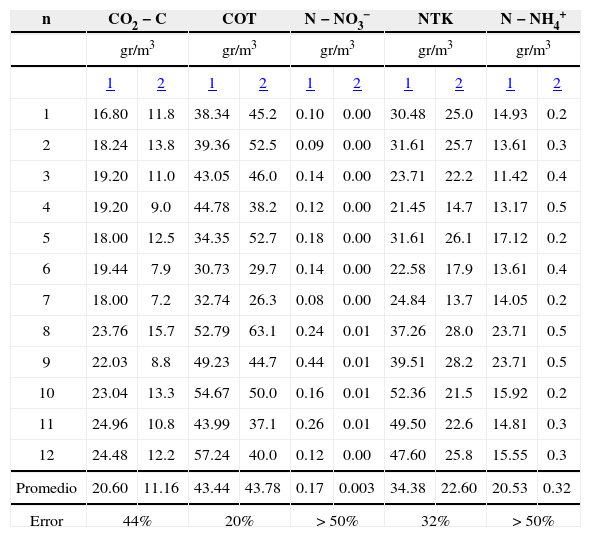
La tabla 12 presenta los resultados obtenidos en el proceso de verificación. Las pruebas estadísticas indican que los datos se distribuyeron de forma normal y que los valores de COT del modelo (tabla 13) fueron estadísticamente iguales a los medidos en campo. Dado que los promedios de las diferencias entre los valores simulados y los valores medidos para las variables CO2, COT y NTK fueron inferiores a 50%, a excepción de las variables NH4+ y NO3−, se consideró que los modelos quedaron verificados. Las etapas de análisis de sensibilidad y calibración permitirían ajustar los modelos para las variables CO2, NO3−, NH4+ y NTK; solo se presenta el ejercicio para COT y NH4+.
Resultados de verificación
| n | CO2−C | COT | N−NO3− | NTK | N−NH4+ | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| gr/m3 | gr/m3 | gr/m3 | gr/m3 | gr/m3 | ||||||
| 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | |
| 1 | 16.80 | 11.8 | 38.34 | 45.2 | 0.10 | 0.00 | 30.48 | 25.0 | 14.93 | 0.2 |
| 2 | 18.24 | 13.8 | 39.36 | 52.5 | 0.09 | 0.00 | 31.61 | 25.7 | 13.61 | 0.3 |
| 3 | 19.20 | 11.0 | 43.05 | 46.0 | 0.14 | 0.00 | 23.71 | 22.2 | 11.42 | 0.4 |
| 4 | 19.20 | 9.0 | 44.78 | 38.2 | 0.12 | 0.00 | 21.45 | 14.7 | 13.17 | 0.5 |
| 5 | 18.00 | 12.5 | 34.35 | 52.7 | 0.18 | 0.00 | 31.61 | 26.1 | 17.12 | 0.2 |
| 6 | 19.44 | 7.9 | 30.73 | 29.7 | 0.14 | 0.00 | 22.58 | 17.9 | 13.61 | 0.4 |
| 7 | 18.00 | 7.2 | 32.74 | 26.3 | 0.08 | 0.00 | 24.84 | 13.7 | 14.05 | 0.2 |
| 8 | 23.76 | 15.7 | 52.79 | 63.1 | 0.24 | 0.01 | 37.26 | 28.0 | 23.71 | 0.5 |
| 9 | 22.03 | 8.8 | 49.23 | 44.7 | 0.44 | 0.01 | 39.51 | 28.2 | 23.71 | 0.5 |
| 10 | 23.04 | 13.3 | 54.67 | 50.0 | 0.16 | 0.01 | 52.36 | 21.5 | 15.92 | 0.2 |
| 11 | 24.96 | 10.8 | 43.99 | 37.1 | 0.26 | 0.01 | 49.50 | 22.6 | 14.81 | 0.3 |
| 12 | 24.48 | 12.2 | 57.24 | 40.0 | 0.12 | 0.00 | 47.60 | 25.8 | 15.55 | 0.3 |
| Promedio | 20.60 | 11.16 | 43.44 | 43.78 | 0.17 | 0.003 | 34.38 | 22.60 | 20.53 | 0.32 |
| Error | 44% | 20% | > 50% | 32% | > 50% | |||||
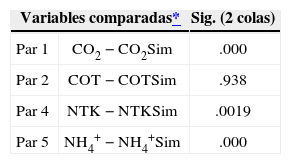
Prueba t-pareada. Medición – Simulación
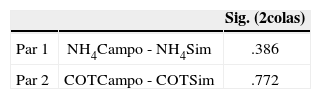
| Variables comparadas* | Sig. (2 colas) | |
|---|---|---|
| Par 1 | CO2−CO2Sim | .000 |
| Par 2 | COT−COTSim | .938 |
| Par 4 | NTK−NTKSim | .0019 |
| Par 5 | NH4+−NH4+Sim | .000 |
Se hicieron ajustes al modelo de nitrógeno, pues los valores obtenidos para NH4− no fueron satisfactorios y contrastaron con cerca de 60% que representa en el NTK según datos de campo. Durante el análisis de sensibilidad se modificó el modelo articulando en el modelo las formas de nitrógeno particulado con las de NH4− y NO3− como generadores de biomasa (figura 6).
Análisis de sensibilidad, ASLas variables y parámetros en este análisis se presentan en las tablas 14 y 5, respectivamente; para su selección se analizaron los valores medidos en campo y se revisaron los parámetros que fueron objeto de calibración en otros estudios (Beran y Kargi, 2005; Sah, 2009; Senzia et al., 2002).
Las formas de biomasa NH4+ y NO3− y sus tasas de conversión a NOP señaladas con línea punteada fueron las modificaciones planteadas al modelo inicial presentado antes.
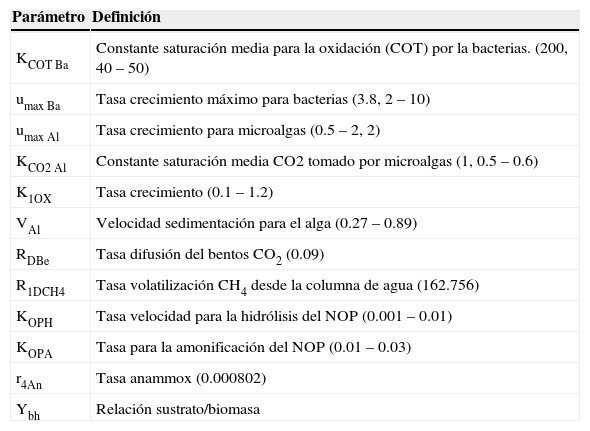
Parámetros para AS
| Parámetro | Definición |
|---|---|
| KCOT Ba | Constante saturación media para la oxidación (COT) por la bacterias. (200, 40 – 50) |
| umax Ba | Tasa crecimiento máximo para bacterias (3.8, 2 – 10) |
| umax Al | Tasa crecimiento para microalgas (0.5 – 2, 2) |
| KCO2 Al | Constante saturación media CO2 tomado por microalgas (1, 0.5 – 0.6) |
| K1OX | Tasa crecimiento (0.1 – 1.2) |
| VAl | Velocidad sedimentación para el alga (0.27 – 0.89) |
| RDBe | Tasa difusión del bentos CO2 (0.09) |
| R1DCH4 | Tasa volatilización CH4 desde la columna de agua (162.756) |
| KOPH | Tasa velocidad para la hidrólisis del NOP (0.001 – 0.01) |
| KOPA | Tasa para la amonificación del NOP (0.01 – 0.03) |
| r4An | Tasa anammox (0.000802) |
| Ybh | Relación sustrato/biomasa |
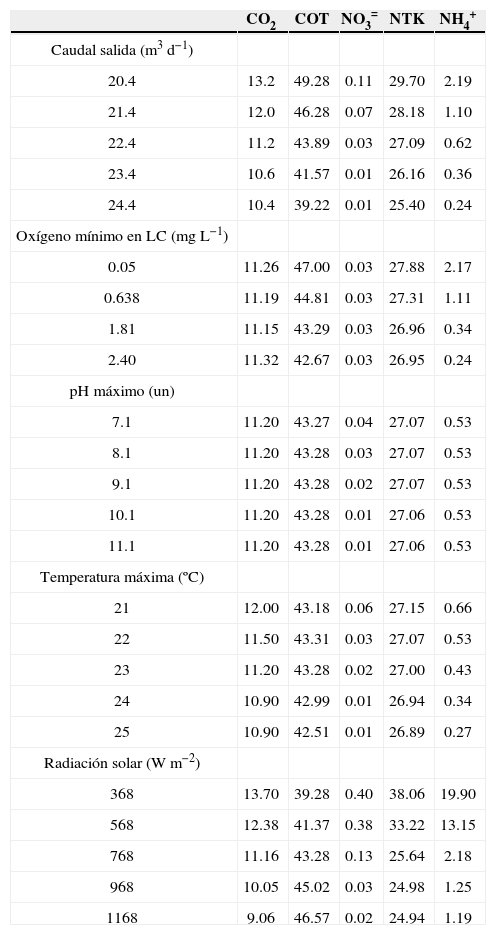
Los modelos se corrieron empleando los valores promedio de los datos de entrada utilizados durante la etapa de verificación (tabla 16). Los resultados corresponden al promedio del último día de simulación (tabla 17). El oxígeno mínimo afectó los modelos hasta en 10% para COT y NH4+, fue una relación inversa. El pH tuvo una relación inversa con NO3− con diferencias superiores a 10%. La temperatura afectó de manera inversa todas las especies analizadas. La temperatura afectó NO3− y NH4− en más de 10%. La influencia de la radiación solar generó variaciones hasta de 25%. Luego se efectuó el AS para los parámetros de interés y se relacionaron con base en las relaciones halladas entre ellos y las especies, así como lo encontrado en la etapa de verificación, se procedió a realizar la calibración de los modelos de C y N (tabla 18).
Resultados AS – Variables
| CO2 | COT | NO3= | NTK | NH4+ | |
|---|---|---|---|---|---|
| Caudal salida (m3 d−1) | |||||
| 20.4 | 13.2 | 49.28 | 0.11 | 29.70 | 2.19 |
| 21.4 | 12.0 | 46.28 | 0.07 | 28.18 | 1.10 |
| 22.4 | 11.2 | 43.89 | 0.03 | 27.09 | 0.62 |
| 23.4 | 10.6 | 41.57 | 0.01 | 26.16 | 0.36 |
| 24.4 | 10.4 | 39.22 | 0.01 | 25.40 | 0.24 |
| Oxígeno mínimo en LC (mg L−1) | |||||
| 0.05 | 11.26 | 47.00 | 0.03 | 27.88 | 2.17 |
| 0.638 | 11.19 | 44.81 | 0.03 | 27.31 | 1.11 |
| 1.81 | 11.15 | 43.29 | 0.03 | 26.96 | 0.34 |
| 2.40 | 11.32 | 42.67 | 0.03 | 26.95 | 0.24 |
| pH máximo (un) | |||||
| 7.1 | 11.20 | 43.27 | 0.04 | 27.07 | 0.53 |
| 8.1 | 11.20 | 43.28 | 0.03 | 27.07 | 0.53 |
| 9.1 | 11.20 | 43.28 | 0.02 | 27.07 | 0.53 |
| 10.1 | 11.20 | 43.28 | 0.01 | 27.06 | 0.53 |
| 11.1 | 11.20 | 43.28 | 0.01 | 27.06 | 0.53 |
| Temperatura máxima (ºC) | |||||
| 21 | 12.00 | 43.18 | 0.06 | 27.15 | 0.66 |
| 22 | 11.50 | 43.31 | 0.03 | 27.07 | 0.53 |
| 23 | 11.20 | 43.28 | 0.02 | 27.00 | 0.43 |
| 24 | 10.90 | 42.99 | 0.01 | 26.94 | 0.34 |
| 25 | 10.90 | 42.51 | 0.01 | 26.89 | 0.27 |
| Radiación solar (W m−2) | |||||
| 368 | 13.70 | 39.28 | 0.40 | 38.06 | 19.90 |
| 568 | 12.38 | 41.37 | 0.38 | 33.22 | 13.15 |
| 768 | 11.16 | 43.28 | 0.13 | 25.64 | 2.18 |
| 968 | 10.05 | 45.02 | 0.03 | 24.98 | 1.25 |
| 1168 | 9.06 | 46.57 | 0.02 | 24.94 | 1.19 |
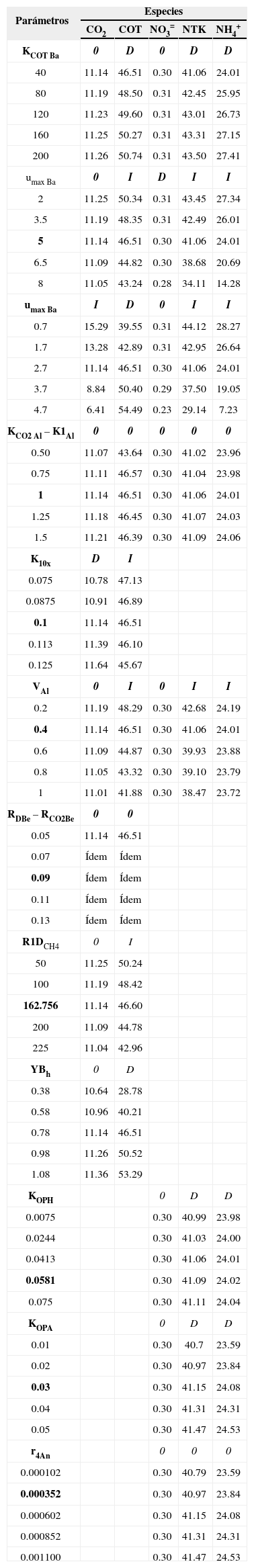
Resultados AS–Parámetros
| Parámetros | Especies | ||||
|---|---|---|---|---|---|
| CO2 | COT | NO3= | NTK | NH4+ | |
| KCOT Ba | 0 | D | 0 | D | D |
| 40 | 11.14 | 46.51 | 0.30 | 41.06 | 24.01 |
| 80 | 11.19 | 48.50 | 0.31 | 42.45 | 25.95 |
| 120 | 11.23 | 49.60 | 0.31 | 43.01 | 26.73 |
| 160 | 11.25 | 50.27 | 0.31 | 43.31 | 27.15 |
| 200 | 11.26 | 50.74 | 0.31 | 43.50 | 27.41 |
| umax Ba | 0 | I | D | I | I |
| 2 | 11.25 | 50.34 | 0.31 | 43.45 | 27.34 |
| 3.5 | 11.19 | 48.35 | 0.31 | 42.49 | 26.01 |
| 5 | 11.14 | 46.51 | 0.30 | 41.06 | 24.01 |
| 6.5 | 11.09 | 44.82 | 0.30 | 38.68 | 20.69 |
| 8 | 11.05 | 43.24 | 0.28 | 34.11 | 14.28 |
| umax Ba | I | D | 0 | I | I |
| 0.7 | 15.29 | 39.55 | 0.31 | 44.12 | 28.27 |
| 1.7 | 13.28 | 42.89 | 0.31 | 42.95 | 26.64 |
| 2.7 | 11.14 | 46.51 | 0.30 | 41.06 | 24.01 |
| 3.7 | 8.84 | 50.40 | 0.29 | 37.50 | 19.05 |
| 4.7 | 6.41 | 54.49 | 0.23 | 29.14 | 7.23 |
| KCO2 Al – K1Al | 0 | 0 | 0 | 0 | 0 |
| 0.50 | 11.07 | 43.64 | 0.30 | 41.02 | 23.96 |
| 0.75 | 11.11 | 46.57 | 0.30 | 41.04 | 23.98 |
| 1 | 11.14 | 46.51 | 0.30 | 41.06 | 24.01 |
| 1.25 | 11.18 | 46.45 | 0.30 | 41.07 | 24.03 |
| 1.5 | 11.21 | 46.39 | 0.30 | 41.09 | 24.06 |
| K10x | D | I | |||
| 0.075 | 10.78 | 47.13 | |||
| 0.0875 | 10.91 | 46.89 | |||
| 0.1 | 11.14 | 46.51 | |||
| 0.113 | 11.39 | 46.10 | |||
| 0.125 | 11.64 | 45.67 | |||
| VAl | 0 | I | 0 | I | I |
| 0.2 | 11.19 | 48.29 | 0.30 | 42.68 | 24.19 |
| 0.4 | 11.14 | 46.51 | 0.30 | 41.06 | 24.01 |
| 0.6 | 11.09 | 44.87 | 0.30 | 39.93 | 23.88 |
| 0.8 | 11.05 | 43.32 | 0.30 | 39.10 | 23.79 |
| 1 | 11.01 | 41.88 | 0.30 | 38.47 | 23.72 |
| RDBe – RCO2Be | 0 | 0 | |||
| 0.05 | 11.14 | 46.51 | |||
| 0.07 | Ídem | Ídem | |||
| 0.09 | Ídem | Ídem | |||
| 0.11 | Ídem | Ídem | |||
| 0.13 | Ídem | Ídem | |||
| R1DCH4 | 0 | I | |||
| 50 | 11.25 | 50.24 | |||
| 100 | 11.19 | 48.42 | |||
| 162.756 | 11.14 | 46.60 | |||
| 200 | 11.09 | 44.78 | |||
| 225 | 11.04 | 42.96 | |||
| YBh | 0 | D | |||
| 0.38 | 10.64 | 28.78 | |||
| 0.58 | 10.96 | 40.21 | |||
| 0.78 | 11.14 | 46.51 | |||
| 0.98 | 11.26 | 50.52 | |||
| 1.08 | 11.36 | 53.29 | |||
| KOPH | 0 | D | D | ||
| 0.0075 | 0.30 | 40.99 | 23.98 | ||
| 0.0244 | 0.30 | 41.03 | 24.00 | ||
| 0.0413 | 0.30 | 41.06 | 24.01 | ||
| 0.0581 | 0.30 | 41.09 | 24.02 | ||
| 0.075 | 0.30 | 41.11 | 24.04 | ||
| KOPA | 0 | D | D | ||
| 0.01 | 0.30 | 40.7 | 23.59 | ||
| 0.02 | 0.30 | 40.97 | 23.84 | ||
| 0.03 | 0.30 | 41.15 | 24.08 | ||
| 0.04 | 0.30 | 41.31 | 24.31 | ||
| 0.05 | 0.30 | 41.47 | 24.53 | ||
| r4An | 0 | 0 | 0 | ||
| 0.000102 | 0.30 | 40.79 | 23.59 | ||
| 0.000352 | 0.30 | 40.97 | 23.84 | ||
| 0.000602 | 0.30 | 41.15 | 24.08 | ||
| 0.000852 | 0.30 | 41.31 | 24.31 | ||
| 0.001100 | 0.30 | 41.47 | 24.53 | ||
0: efecto nulo, D: relación directa, I: relación inversa
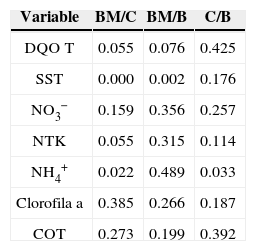
El modelo de C resultó sensible a: KCOT Ba′ umax Ba′ umax Al′ K1OX′ VAl′ R1DCH4′ YBh. Sin embargo, solo umax Al y K1OX tuvieron influencia sobre el CO2=. El modelo de N resultó sensible a: KCOT Ba′ umax Ba′ umax Al′ VAl′ KOPH′ KOPA′ r4An. En ambos modelos la radiación solar, afectó sensiblemente todas las especies en estudio.
CalibraciónPara el caso del modelo de C se calibró el COT. Se aceptó un error promedio hasta de 10% entre los datos del modelo y los de campo. Se adoptó un valor constante de CO2= correspondiente al promedio de los datos de campo, dado que la influencia de esta variable sobre el COT no fue significativa, el caudal de salida se adoptó igual al de entrada (tabla 19).
Los resultados de la calibración se probaron con una prueba t-pareada, relacionando los datos de campo y los datos de la simulación (tabla 20).
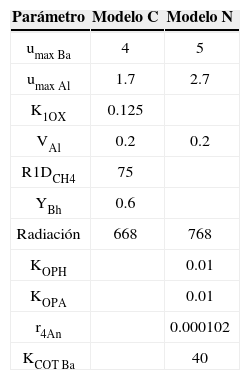
Los valores arrojados por los modelos para las especies NH4+ y COT no presentaron diferencias con los valores medidos en campo. De acuerdo con los datos de campo solo se encontraron diferencias en el caso de la especie NH4+ entre las unidades piloto evaluadas LC y LBM, entre LBM y LC no se evidenciaron diferencias, por lo anterior se procedió a calibrar los modelos de C y N en la LBM. Para el caso del modelo de C, para la LBM se modificaron los valores del modelo topológico, volumen y profundidad; adicionalmente; se detectó que para un valor de μMáxAl igual a 1.1 d−1, los resultados de las pruebas estadísticas fueron similares (tabla 21). Es importante mencionar este elemento, ya que abre la posibilidad de reducir el tamaño de esta unidad piloto, pues una tasa de menor producción de microalgas corresponde a la menor liberación de materia orgánica del sistema. Para el caso del NH4+ se ajustaron los parámetros así: KOpH: 0.005, μMáxAl: 1.7 Y r4An: 0.0. Los errores entre lo medido y lo simulado no superaron 10%.
Al igual que para el caso de la LC los modelos arrojaron resultados satisfactorios para COT y NH4+ de la LBM. El AS demostró que existen variables que le dan características redundantes al modelo, la selección de una u otra variable o parámetro hace que el modelo pueda ser afectado de igual forma por distintas vías; las etapas de sensibilidad y calibración pudieron reducir las suposiciones que otras experiencias de modelado ecológico han tomado (Sah, 2009), haciendo que existan más elementos de juicio para evaluar el modelo propuesto. Es necesario llevar a cabo ajustes y validación del componente de bentos de los modelos para corroborar el papel que juega, pues funciona de manera independiente de la columna de agua (Roy et al., 2008). El desarrollo de todas las etapas de construcción del modelo fueron determinantes para darle validez al ejercicio (Legendre y Legendre, 2004). La sensibilidad del modelo a variables como radiación solar se evidencia por otros autores (Sweeney et al., 2005) y en esta experiencia fue posible validarlo.
ConclusionesLa información que se obtuvo durante la investigación permitió seguir un proceso riguroso de verificación, validación y calibración de dos modelos topológicos de LFS, LC y LBM. Se encontraron diferencias significativas en la transformación de las sustancias de interés SST y NH4+, entre los dos modelos topológicos. Los modelos ecológicos arrojaron resultados satisfactorios en la simulación de las variables de interés y lo medido en campo y contrastado con otras propuestas de modelado de LFS; su implementación sobre una plataforma hidrodinámica permitiría contar con una herramienta de diseño significativa en la perspectiva de proponer innovaciones de la tecnología. El modelado ecológico para LBM promete la posibilidad de reducir el tamaño de LFS promoviendo eliminación de C y N a distintos niveles utilizando facilidades como bafles y mallas. Es conveniente llevar a cabo el modelado bajo propuestas de comportamiento hidráulico distintas al de RCM. El modelado permite explorar las variables y parámetros que dan redundancia a estos sistemas y facilitan de esa manera su resiliencia.
El autor agradece al Departamento Administrativo de Ciencia, Tecnología e Innovación, Colciencias, Colombia, a ACUAVALLE S.A. ESP y a la Universidad del Valle por el soporte financiero y logístico de la investigación.
COT = Afluente - efluente - respiración anaeróbica - respiración aeróbica (oxidación de materia orgánica) - consumo carbono asimilación bacterias + fotosíntesis (microalgas) + asimilación aeróbica + asimilación anaeróbica + transferencia de CH4 desde el bentos - sedimentación de materia orgánica al bentos - transferencia de CH4 desde la columna
| Definición | Expresión | Expresión matemática extendida | Fuente | |
|---|---|---|---|---|
| CAf | Carbono orgánico total afluente | QAf *COTAf | Dato de campo | |
| CEf | Carbono orgánico total efluente | QEf *COTEf | Dato de campo | |
| R1Ran | Tasa consumo de carbono orgánico por anaerobiosis | V×r1Ran | r1Ran=COT*Xco2r1Rae | (Picot et al., 2003) |
| R1Rae | Tasa consumo de carbono orgánico aerobiosis | V×r1Rae | r1Rae=K1ox*θ1OxT−20*O2K1O2+O2*CODr1=XBaYBha*μmaxBa*fNBafTBa*fpHBa | (Mashauri y Kayombo, 2002) |
| R1Ras | Tasa consumo carbono orgánico asimilación | V×r1 | fNBa=NH4K4ba+NH4*O2kO2Ba+O2*COTkCOTBa+COTfTBae−2.3T−ToptBaTxBa−ToptBa2,fpHBa=KpHBaKpHBa+10OptpHBa−pH−1 | (Mashauri y Kayombo, 2002; Beran y Kargi, 2005) |
| R1CA | Tasa producción de carbono orgánico en microalgas | V×r1CA | r1CA=μBAlμAl=XAl*μmaxAL*fNAl*fI*fTAl*fpHAlfNAl=NH4+NO3KNAl+NH4+NO3*CO2KCO2Al+CO2,fI=IIK*e1−IIK,I=Is*e−ke*DfT=e−2.3T−ToptAlTxAl−ToptAl2,fpH=KpHAlKpHAl+10OptpHAl−pH)−1 | (Jorgensen y Bendoricchio, 2001) |
| R1CB | Tasa producción de carbono orgánico por aerobiosis | V×r1CB | r1CB=μB,μB=XBa×μmaxBa×fNO3Ba×fTBa×fOBa×fNH4Ba,fNO3Ba=NH4K4ba+NH4*O2kO2Ba+O2*COTkCOTBa+COT,fTBa=e−2.3T−ToptBaTxBa−ToptBa2fpHBa=KpHBaKpHBa+10OptpHBa−pH−1 | (Beran y Kargi, 2005) |
| RBBe | Tasa producción de carbono orgánico por anaerobiosis | Vb×rBBe | Vb = Densidad Bentos* Bentos, rBBe | Calibración |
| RDCH4Be | Tasa transferencia de metano desde el bentos | Vb×rCH4Be | Vb=Densidad Bentos * Bentos, rCH4Be | Calibración |
| RV1S | Tasa sedimentación de biomasa | V1Al + V1Ba | V1Al=VAlh*XAl=VAlh*0.6*COP,V1Ba=VBah*XBa=VBah*XBa=VBah*0.4*COP | (Senzia et al., 2002) |
| RD1CH4 | Tasa volatilización metano | Dato de campo | (Lasso, 2010) |
C Inorgánico = afluente - efluente + respiración aeróbica (oxidación de matéria orgánica) + respiración anaeróbicafotosíntesis (asimilación microalgas) + transferencia de CO2 desde el bentos - transferencia de CO2 desde la columna + transferencia de CO2 desde la atmósfera - disolución de CO2 a carbonatos
| Definición | Expresión resumida | Expresión matemática extendida | Fuente | |
|---|---|---|---|---|
| CIAf | Carbono inorgánico total afluente | QAf * CO2Af | Dato de campo | |
| CIEf | Carbono inorgánico total efluente | QAf * CO2Ef | Dato de campo | |
| R1Ran | Respiración anaerobia | V × r1Ran | r1Ran = COT * Xco2 − r1Rae | (Picot et al., 2003) |
| R1Rae | Respiración aerobia | V × r1Rae | r1Rae=K1ox*θ1OxT−20*O2K1O2+O2*COD | (Mashauri y Kayombo, 2002) |
| RFO | Fotosíntesis | V × r2F | r2F = μAl − XAl * Kal | |
| RDBe | Liberación desde el bentos CO2 | Vb × rCO2Be | Vb = Densidad Bentos * Bentos, rCO2Be′ | Calibración |
| RDA-L | Transferencia atmósfera - columna de agua CO2 | V × rDA-L | r2DA−L=1244AVK1DCO2s−CO2d,K1D=4432Ko2Ko2=0.728WA−L0.5−0.31WA−L+0.0372WA−L21.0241T−20CO2s=0.9664−0.0208T | (Beran y Kargi, 2005) |
| RDL-A | Transferencia columna de agua - atmósfera CO2 | V × rDL-A | Ídem | Ídem |
| RAlk | Transformación CO2 a carbonatos | V × r2Alk | r2Alk = CO2 * XAlk | (Picot et al., 2003) |
NH4+ = Afluente - efluente + amonificación NO - nitrificación - asimilación biomasa - annamox - volatilización
| Definición | Expresión resumida | Expresión matemática extendida | Fuente | |
|---|---|---|---|---|
| NH4Af | Nitrógeno amoniacal afluente | QAf * NH4Af | ||
| NH4Ef | Nitrógeno amoniacal efluente | QEf * NH4Ef | ||
| RA | Amonificación nitrógeno orgánico particuladoy disuelto | V × (rOPA + rODA) + VB × rAB | rOPA = kOPAθOPA(T-20) * OP, rODA=kODAθOPA(T-20)*OD | (Ji, 2008) |
| R4N | Nitrificación | V × r4N | r4N=μNYN*O2KO2N+O2*NH4NH4+K4N*CpH*CT′CpH=1−0.8337.2−pHCT=e0.098T−15,K4N=100.051*T−1.58 | (Frite et al., 1979) |
| R4C | Asimilación amonio para crecimiento de biomasa | V × (r1CB + r1CAlr1CBA) | r4CB=PN*ropCBPN=NH4*NO3KNAl+NH4*KNAl+NO3+NH4*KNAlNO3+NH4*NNAl+NO3ropCB=μAl+μBa | (Ji, 2008) |
| R4An | Annamox | V × r4An | 0.000202gN/m3 | (Van Hulle et al., 2010) |
| R4V | Volatilización | V × r4V | r4V = K4ε * NH3 | (Zimmo et al, 2004) |
NO3− = Afluente + nitrificación - efluente - asimilación biomasa - denitrificación
| Definición | Expresión resumida | Expresión matemática extendida | Fuente | |
|---|---|---|---|---|
| N03Af | Nitrógeno nitratos afluente | QAf * NOPAf | ||
| NO34Ef | Nitrógeno nitratos efluente | QEf *NO3Ef | ||
| R4N | Nitrificación | V × 4N | ||
| R3D | Denitrificación | (V × r3D) | r3D = θDen(T-20) * KDen * NO3 | (Frite et al., 1979) |
| R3CB | Asimilación nitrato para crecimiento de biomasa | (V × r3CB) | r3CB= (1-PN)*(r1Al+r1CB) | (Senzia et al, 2002) |
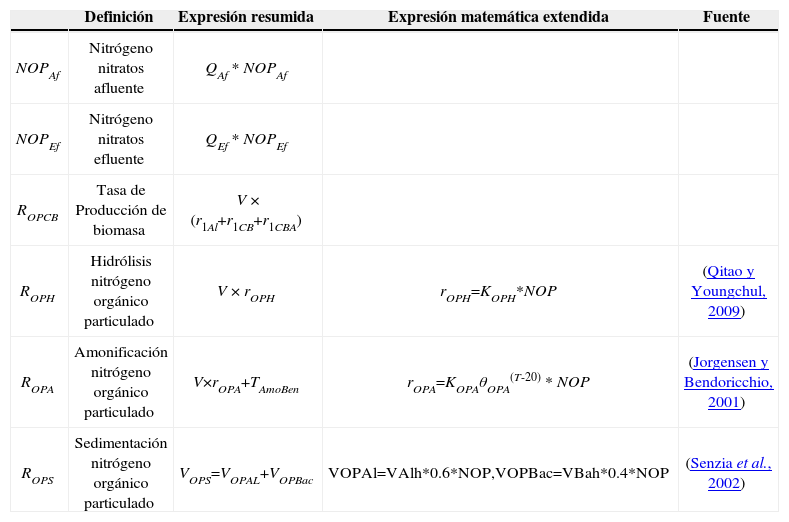
NOP = Afluente + biomasa - efluente - hidrólisis - amonificación NOP - sedimentación
| Definición | Expresión resumida | Expresión matemática extendida | Fuente | |
|---|---|---|---|---|
| NOPAf | Nitrógeno nitratos afluente | QAf * NOPAf | ||
| NOPEf | Nitrógeno nitratos efluente | QEf * NOPEf | ||
| ROPCB | Tasa de Producción de biomasa | V × (r1Al+r1CB+r1CBA) | ||
| ROPH | Hidrólisis nitrógeno orgánico particulado | V × rOPH | rOPH=KOPH*NOP | (Qitao y Youngchul, 2009) |
| ROPA | Amonificación nitrógeno orgánico particulado | V×rOPA+TAmoBen | rOPA=KOPAθOPA(T-20) * NOP | (Jorgensen y Bendoricchio, 2001) |
| ROPS | Sedimentación nitrógeno orgánico particulado | VOPS=VOPAL+VOPBac | VOPAl=VAlh*0.6*NOP,VOPBac=VBah*0.4*NOP | (Senzia et al., 2002) |
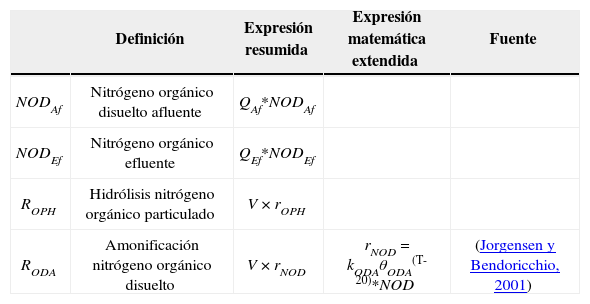
NOD= Afluente + hidrólisis - efluente - amonificación NOD
| Definición | Expresión resumida | Expresión matemática extendida | Fuente | |
|---|---|---|---|---|
| NODAf | Nitrógeno orgánico disuelto afluente | QAf*NODAf | ||
| NODEf | Nitrógeno orgánico efluente | QEf*NODEf | ||
| ROPH | Hidrólisis nitrógeno orgánico particulado | V × rOPH | ||
| RODA | Amonificación nitrógeno orgánico disuelto | V × rNOD | rNOD = kODAθODA(T-20)*NOD | (Jorgensen y Bendoricchio, 2001) |
Alexander Aponte-Reyes. Es ingeniero sanitario, con maestría en ingeniería sanitaria y ambiental, actualmente es candidato a doctor en la misma área. Sus áreas de trabajo son el abastecimiento de agua y el control de la contaminación ambiental a través de un enfoque ecológico, incluyendo proyectos de investigación y desarrollo sobre tecnologias naturales, el empoderamiento de la comunidad y el comportamiento higiénico. Su perfil profesional incluye proyectos de investigación y la experiencia en las actividades relacionadas con la promoción y ejecución de proyectos de desarrollo, orientados hacia las zonas rurales, municipios pequeños y medianos.