Los óxidos de manganeso, conocidos como manganitas, es uno de los sistemas de la materia condensada de mayor interés actual. Estos materiales presentan transiciones magnéticas y eléctricas tales como ferromagnética–paramagnética y conductor–aislante. El estudio de sus propiedades, en particular la magnetorresistencia gigante, es de gran interés por sus importantes aplicaciones. En este trabajo se obtuvieron polvos cerámicos del sistema Pr/Sr–Mn–O por el método de precursor polimérico (Pechini) usando como precursores el cloruro de manganeso y los acetatos de praseodimio y estroncio. Los principales objetivos del proyecto optimizaron los diferentes parámetros de síntesis, colocándole especial atención al contenido de estroncio, y determinar el efecto del método de síntesis sobre las características del polvo obtenido. El método de síntesis utilizado permitió obtener a baja temperatura, partículas micrométricas del sistema PrxSr1-xMnO3 con alta pureza química, bien cristalizadas. Las condiciones más adecuadas para obtener los polvos de PrxSr1-xMnO3 fueron: solución inicial a pH 8, calentamiento de esta solución a 140°C y calcinación de la resina a 250°C, por 24 horas. El óxido mixto se obtuvo tratando el polvo calcinado a 600°C, durante 2 horas.
Manganese oxides, known as manganites, are one of the systems of condensed matter of current major interest. These materials show magnetic and electrical transitions such as ferromagnetic-paramagnetic and conductor-insulator. The study of their properties, in particular giant magnetoresistance, is of great interest for their important applications. In this work ceramic powders of the Pr/Sr–Mn–O system were obtained by the polymer precursor method (Pechini) using manganese chloride and praseodymium and strontium acetates as precursors. The principal objectives of the project were those of optimizing the different parameters of synthesis, placing special attention on the content of strontium, and determining the effect of the method of synthesis on the characteristics of the powder obtained. The method of synthesis used allowed obtained, at a low temperature, micron particles of the PrxSr1-xMnO3 system, with a high chemical purity, well crystallized. The conditions most suitable for obtaining the powders of PrxSr1-xMnO3 were: initial solution at pH 8, heating of this solution to 140°C and calcining of the resin at 250°C, for 24hours. The mixed oxide was obtained treating the calcined powder at 600°C, for 2hours.
Actualmente existe un gran interés en el estudio de las manganitas, desde el punto de vista teórico y experimental (Li et al., 2008 y Yang et al., 2007), debido principalmente a tres aspectos:
- 1)
La inesperada propiedad alta de magneto-transporte, que presentan y permiten con pequeños campos magnéticos, lo que ocasiona grandes cambios en varios órdenes de magnitud, en la resistencia de estos materiales (magneto-resistencia colosal).
- 2)
El rico diagrama de fases que exhiben las manganitas permite obtener una gran variedad de fases con inusual valor de spin, carga, red cristalina y orden orbital, es decir, que al menos dos orbitales son activos por ión.
- 3)
El hecho de que, aun contando con los mejores cristales disponibles, las manganitas son inhomogéneas intrínsecamente, tal que coexisten agrupaciones “clusters” de fases que compiten, por ejemplo fases ferromagnéticas y anti-ferromagnéticas.
Por otro lado, el creciente interés de las manganitas también se puede argumentar considerando su potencial uso en diversos campos de aplicación tecnológica (Dagotto et al., 2001). Cuando las manganitas del sistema A1-xBxMnO3 se utilizan como material para cátodo en celdas de combustible de electrolito sólido (SOFC) (Huang et al., 2000 y Fergus et al., 2009), los grandes retos se relacionan con el compromiso entre los requerimientos electroquímicos e ingenieriles, así como en la reducción de costos de la celda. En esta aplicación se requiere que los compuestos presenten buenas propiedades de transporte eléctrico, así como adecuadas propiedades mecánicas y químicas para garantizar una larga vida del electrodo en las condiciones de operación de la celda, donde el cátodo estaría sujeto a significativos esfuerzos debido al desacople en la expansión térmica entre los componentes de la celda. Es evidente el gran interés que existe en la comunidad científica en mejorar las propiedades eléctricas de las manganitas con base en lantano-estroncio (La1-xSrxMnO3-δ – LMS), considerando la incorporación de otro metal de transición, para favorecer su potencial uso como cátodo en las pilas SOFC (Lu et al., 2014). La optimización de la conductividad eléctrica y el sobre-potencial en la interface electrolito-cátodo para estas manganitas, tipo perovskitas, se aborda considerando tanto su dopado con diferentes elementos de transición, tierras raras y alcalino térreos, como empleando diferentes técnicas de síntesis.
Por otro lado, aunque los óxidos con estructura perovskita, entre ellos las manganitas, no han encontrado todavía aplicación como catalizadores comerciales, hay que reconocer su importancia dadas sus propiedades catalíticas; lo anterior convierte a estos óxidos en modelos prototipo de materiales catalíticos con aplicaciones específicas. Estos compuestos se han utilizado en diferentes reacciones catalíticas (Tejuca et al., 1989 y Fierro et al., 2006), tales como: oxidación de CO, oxidación de hidrocarburos y compuestos oxigenados, reducción de NO, hidrogenación e hidrogenólisis de hidrocarburos, hidrogenación de CO y CO2, reducción de SO2, electrocatálisis y fotocatálisis, así como en la combustión de metano dada su buena estabilidad. Recientemente, Najjar et al. (2014), usando síntesis por combustión, obtuvieron perovskitas del tipo La1-xLnxMnO3+d dopadas con Pr o Eu (Ln: Pr o Eu) para determinar la actividad catalítica de las mismas en la oxidación del metano. Ellos encontraron diferencias significativas en la segregación de La, Pr, Eu y Mn hacia la superficie, dependiendo de la composición del material, tal que la alta actividad del La0.8Eu0.2MnO3.11, en la oxidación del metano, se podría justificar con la existencia de un mínimo local de La y Eu y un máximo de segregación de Mn en la muestra; por otro lado, la baja actividad de los catalizadores que contenían praseodimio se debe a la alta difusión del Pr hacia la superficie.
Otra aplicación que ha reactivado el interés por las manganitas, tipo perovskita, es el efecto magnético-calórico gigante (EMC) que ellas podrían presentar, ocasionado por una transición estructural magnética de primer orden (Gschneidner et al., 2005). El fenómeno EMC es el fundamento de la tecnología de refrigeración magnética que es energéticamente más eficiente y más amigable con el medio ambiente si se compara con la tecnología de refrigeración convencional. Dentro de los materiales que presentan un alto valor del cambio isotermal de la entropía magnética (ΔSm) se encuentran las manganitas tipo perovskitas con fórmula general R1-xAxMnO3 (R = La3+, Pr3+, etcétera, y A = Sr2+, Ca2+, etcétera), para ciertas combinaciones de R y A y cierto grado de dopado x (Kuwahara et al., 1996). Por lo tanto, actualmente es de interés sintetizar y conformar manganitas de esta familia que permitan incrementar el efecto magneto-calórico, tal como lo indican Kumar y Mahendiran (2010). Para ello hay que garantizar adecuados métodos de síntesis, reproducibles y económicos. Por ejemplo, Wan et al. (2014), sintetizaron nanopartículas de Ln0.67Sr0.33MnO3 (Ln = La, Pr y Nd), por el método sol-gel, y encontraron que la temperatura de Curie y la magnetización de saturación de estas muestras se reducían, asimismo la transición de fases se ensanchaba por las sustituciones de Pr y Nd comparadas con las muestras dopadas con La. Todas las muestras exhibieron significante efecto magneto-calórico, en un amplio rango de temperaturas, con valores máximos de ΔSm (en campos de 0 a 5 T) de 2.49, 1.94 y 0.93J/Kg K para las muestras con Ln = La, Pr y Nd, respectivamente, con valores de poder de enfriamiento relativo de 225, 265 y 246J/kg, valores que indican que estas nanopartículas pueden ser muy útiles para construir refrigeradores magnéticos en un amplio rango de temperatura.
Por las diversas aplicaciones que tienen las manganitas ilustradas anteriormente, se requieren métodos confiables, controlables y reproducibles de síntesis. Comúnmente estas manganitas se obtienen por reacción en estado sólido. Huang et al. (2000) obtuvieron muestras de Pr0.6-xSr0.4MnO3 (x = 0, 0.01, 0.05, 0.1, 0.15, 0.2) usando como materias primas polvos de Pr6O11, SrCO3 y MnO2 de alta pureza. Después de mezclar los polvos y molerlos, en un mortero de ágata, los prensaron y las piezas obtenidas las trataron térmicamente a 1000°C durante 8 horas. Estas piezas sinterizadas se molieron y el polvo obtenido se volvió a prensar; el material prensado se trató térmicamente a 1150°C por 4 horas. Las piezas de Pr0.6-xSr0.4MnO3 que obtuvieron presentaron como estructura cristalina principal una tipo perovskita con presencia de Pr6 O11, para las muestras con x = 0 y x = 0.01, y de SrMn3O6-δ, para las muestras con x = 0.1–0.2. Con el fin de optimizar las condiciones de síntesis de las manganitas de praseodimio, los investigadores han optado por usar otras técnicas de síntesis. Tal es el caso de los trabajos de Kostogloudis et al. (1997 y 1999), en el primero se obtuvieron polvos de Pr1-xSrxMnO3±δ por el método de síntesis pirólisis de citratos. Para ello disolvieron el Pr6O11 en ácido nítrico mientras que el Sr(NO3)2 y el (CH3COO)2Mn.4H2O los disolvieron en agua destilada. Mezclaron las soluciones y adicionaron una solución acuosa de ácido cítrico. De forma similar, en su segundo trabajo se obtuvieron polvos de Pr1-xSrxCo1-yMnyO3-δ donde se analiza el efecto de la sustitución del Mn por el Co. Una condición que destacan los investigadores y que hay que garantizar, es que el sistema tenga un valor de pH menor que 7 para que no aparezcan en él hidróxido sales básicas. Después de que realizaron la pirólisis de la masa viscosa, que obtuvieron al calentar la suspensión previamente obtenida, el polvo homogéneo fino resultante lo calcinaron en aire a 1100°C por 15 horas; este polvo se sometió a molienda durante 72 horas y fue la materia prima que utilizaron para conformar las piezas de interés para su estudio. Los polvos de Pr1-xSrxMnO3±δ presentaron una estructura tipo perovskita con simetría ortorrómbica que se deformó a medida que se incrementaba el valor de x.
Recientemente, Azevedo et al. (2011) sintetizaron polvos de Pr0.70Sr0.30MnO3±δ (PSM) por el método solución-combustión usando como precursores nitratos metálicos, Pr(NO3)3·6H2O – Nd (NO3)3·6H2O – Sr(NO3)2 – Mn(NO3)2·4H2O, como combustible urea, CO(NH2)2, y como solvente de síntesis agua destilada. Ellos disolvieron los nitratos en el agua y lentamente le adicionaron la urea. Esta mezcla de nitratos se calentó entre 300 y 400°C para iniciar la reacción de combustión, tal que su proceso de auto-ignición se realizó, inicialmente, sobre una plancha calefactora para luego tratar térmicamente el polvo obtenido en un horno a 900°C, con el fin de remover todo el carbón de la muestra y propiciar su cristalización; posteriormente, los polvos obtenidos se molieron. El polvo de Pr0.70Sr0.30MnO3±δ que ellos obtuvieron presentó una fase perovskita pura, con estructura ortorrómbica, y un tamaño de aglomerado entre 0.5 y 1μm, tal que las partículas con un tamaño menor a 1μm se presentaron homogéneas. Otras técnicas que se han utilizado para obtener las manganitas son: sol-gel (Jung et al., 2003), hidrotermal (Wang et al., 2007), co-precipitación controlada (Zi et al., 2007) y combustión (Aruna et al., 2007). Por otro lado, el método de precursor polimérico o Pechini es poco empleado en la síntesis de manganitas a pesar de ser un método que posee múltiples ventajas, tal como lo indican los resultados obtenidos en otros sistemas (Ávila et al., 2004; Mosquera et al., 2008; Mosquera et al., 2008).
En este trabajo se reporta la obtención de manganitas del sistema Pr/Sr–Mn–O por el método deprecursor polimérico (PECHINI). Los polvos cerámicos obtenidos se caracterizaron utilizando difracción de rayos x (DRX), espectroscopias infrarroja con transformada de Fourier (FTIR) y Raman, y microscopia electrónica de barrido (MEB).
Materiales y métodosSíntesis de los polvos cerámicos del sistema Pr/Sr–Mn–OPara obtener los polvos cerámicos de Pr/Sr–Mn–O, por el método Pechini, se partió de una mezcla de etilenglicol (Mallinckodt) y ácido cítrico (Carlo Erba 99%), en una relación de 4:1 molar, agitando continuamente la solución a una temperatura de 70°C, hasta alcanzar una disolución completa del ácido cítrico en el polialcohol (etanodiol – C2H6O2). Simultáneamente, y de forma independiente, se diluyeron en constante agitación (a 300rpm) cloruro de manganeso, acetato de praseodimio y acetato de estroncio en agua. Cada una de las soluciones obtenidas, y que contienen los cationes de interés, se adicionaron de forma independiente a la solución de etilenglicol y ácido cítrico; la solución resultante se mantuvo en agitación por aproximadamente 10 minutos. Finalmente, a la solución transparente se le adicionó NH4OH hasta llevarla a pH 8. Una vez que se alcanza el valor de pH, garantizando que no se forme precipitado alguno en el sistema, se calentó la solución a 140°C para eliminar los solventes utilizados y favorecer, además, las reacciones de poli-esterificación y por lo tanto, la conformación de la resina. Esta resina viscosa se calcinó a 250°C, por 24 horas. El polvo obtenido se sometió a un tratamiento térmico a 600°C durante dos horas en un horno para eliminar el material orgánico y obtener así el polvo cerámico con la fase de interés. Las composiciones consideradas en el presente trabajo, se indican en la tabla 1
Caracterización estructural y morfológica de los polvos cerámicosPara determinar las características de los polvos sintetizados, utilizando el método de precursor polimérico, se emplearon las siguientes técnicas de caracterización: espectroscopia infrarroja (FTIR) para determinar grupos funcionales presentes, donde los espectros se tomaron con un espectrofotómetro FTIR Nicolet Model IR200. El análisis con micro Raman se realizó para complementar el estudio de espectroscopia vibracional de las muestras, donde se empleó el equipo LambRamHRhighre solution Raman spectroscope, acoplado a un microscopio Seico DM300, usando un láser de onda de 532nm, y un tiempo de integración de 10 s para el espectro (Universidad de Brasilia - Brasil), a temperatura ambiente. La difracción de rayos x (DRX) se utilizó para conocer las fases cristalinas que existen en las muestras. Para este estudio se empleó un difractómetro marca Philips, con radiación Kα del Cu (λ = 1.54¿) y en un rango de barrido entre 10–70° (2θ). Finalmente se usó microscopia electrónica de barrido (MEB) para determinar el tamaño de las partículas y para ello se empleó un microscopio JEOL 6460 LV.
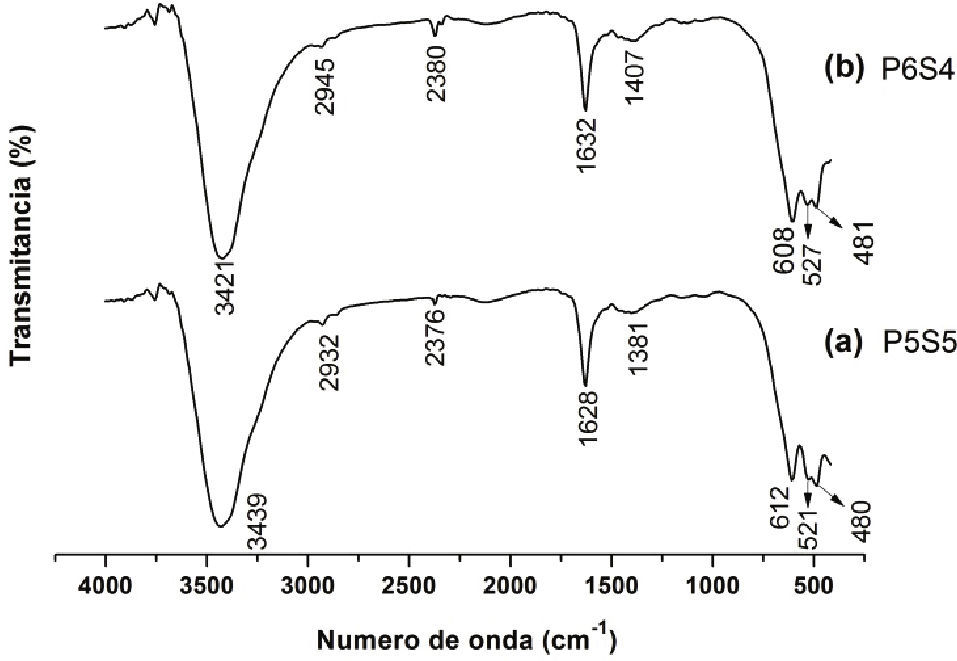
Discusión y análisis deresultadosCaracterización de la fase sólida de las suspensionesEspectroscopia Infrarroja con Transformada de Fourier (FTIR)En la figura 1 se observan los espectros IR correspondientes de las muestras obtenidas mediante el método Pechini, tratadas térmicamente a 600°C durante 2 horas. Las bandas que predominan en los espectros IR de las diferentes muestras (figura 1) son las que corresponden al enlace Mn–O y las asociadas a las vibraciones de tracción de los grupos hidroxilo, así como las características del agua adsorbida, tal como se indica en la tabla 2. Las bandas por debajo de los 800cm-1 se asocian principalmente, a grupos funcionales que contienen manganeso y que existen en los compuestos sintetizados; estas bandas corresponden a enlaces que forma el manganeso con otras especies y es por ello la zona que ofrece más información sobre la naturaleza de los complejos que forman este elemento en el sistema. Las bandas alrededor de 510–527cm-1 corresponden al enlace Mn–O–Pr (Rivera et al., 2009).
Principales bandas presentes en los espectros IR correspondientes a las muestras P5S5 y P6S4 obtenidas por el método Pechini y calcinadas a 600°C (durante dos horas)
| P5S5 | P6S4 | Grupo funcional |
|---|---|---|
| 3439 | 3421 | O–H |
| 2932 | 2945 | (CH3) |
| 2376 | 2380 | CO2 |
| 1628 | 1632 | H–O–H |
| 1381 | 1407 | CH- |
| 1058 | 1045 | (CH3) |
| 612 | 608 | Mn–O en coordinación Tetraédrica |
| 521 | 527 | Mn–O–Pr |
| 480 | 481 | Mn3+ en coordinación. octaédrica |
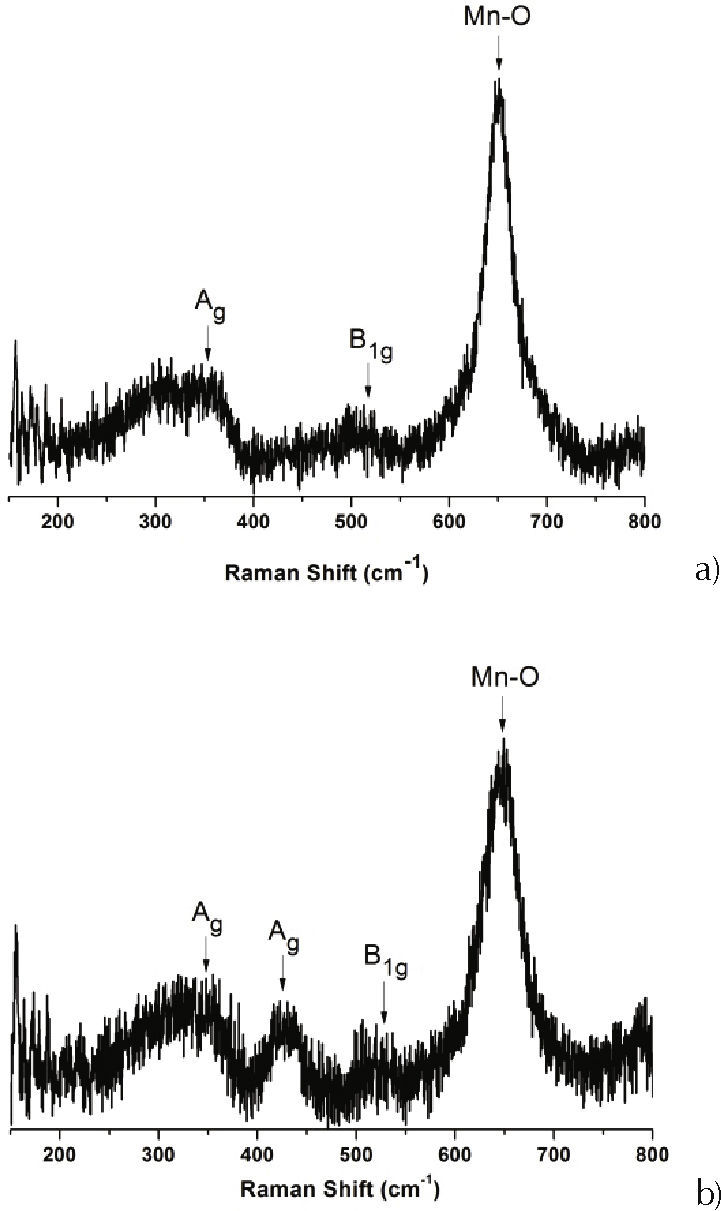
Con el fin de complementar los datos sobre los diferentes modos vibracionales que presentan los polvos cerámicos sintetizados, obtenidos en las diferentes etapas del proceso de síntesis, se utilizó espectroscopia Raman. Se tomaron los espectros en un rango entre 200 y 1100cm-1, a las muestras P5S5 y P6S4.
En las figuras 2a y 2b se muestran los espectros correspondientes a las muestras dopadas con estroncio P5S5 y P6S4, respectivamente, obtenidas por el método Pechini y que se trataron térmicamente a 600°C durante 2 horas. En ellas se observan bandas localizadas alrededor de 350 y 550cm-1, donde la primera corresponde al grupo Ag, “modo Jahn-Teller estática”, asociada a la inclinación de los octaedros [MnO6], y la otra relacionada con los modos B1g, “modo Breat-Hing”, asociada al estiramiento de los enlaces Mn–O (Vargas et al., 2009 y Wei et al., 2005). En los espectros es evidente la banda ubicada a 650cm-1 asociada a la extensión simétrica del oxígeno basal del octaedro (simetría B1g) y para la muestra P6S4 la banda a 450cm-1 correspondiente a la extensión asimétrica (Ag asimétrica) asociada a la distorsión Jahn-Teller (Wei et al., 2005).
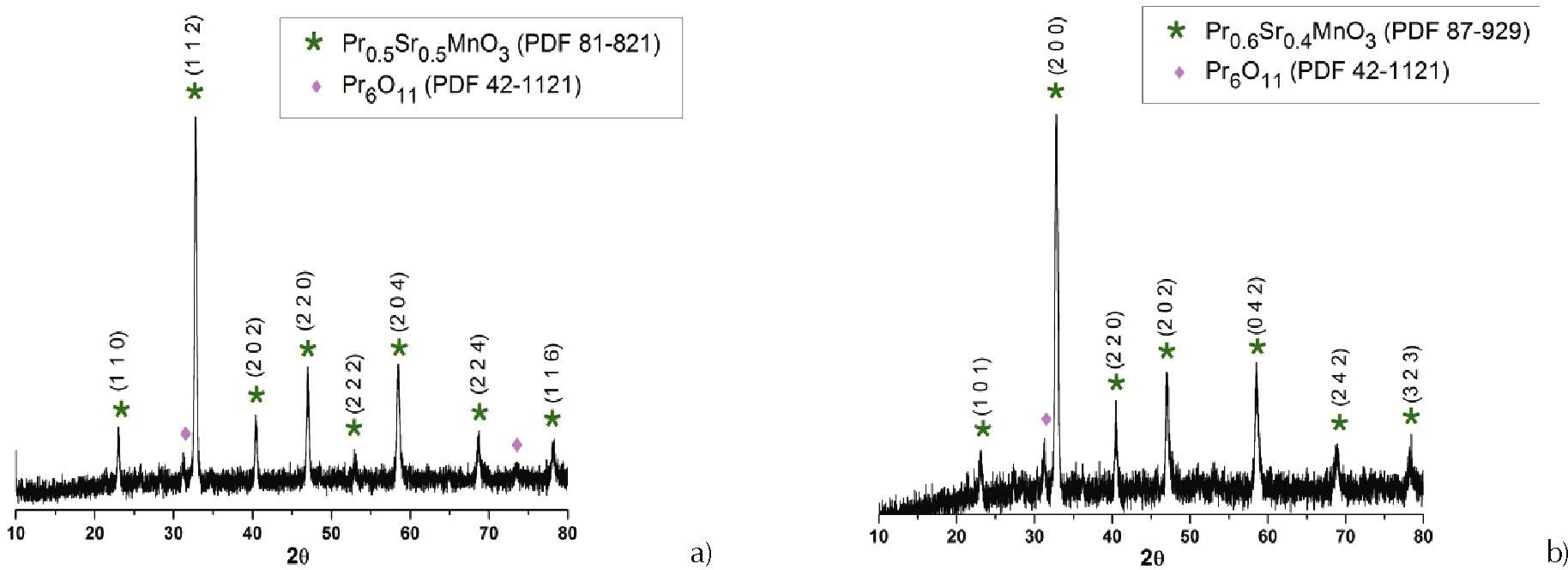
Difracción de rayos xEl difractograma de rayos x correspondiente a la muestra P5S5 se observa en la figura 3a, donde se pueden observar los picos correspondientes a las fases cristalinas: Pr0.5Sr0.5MnO3 (PDF 81–821) y Pr6O11 (PDF 42–1121). En la figura 3b se muestra el difractograma de rayos x correspondiente a un sólido del sistema P6S4. En el difractograma se aprecia una fase secundaria, el Pr6O11 (PDF 42–1121). Para determinar de manera precisa el porcentaje de fase secundaria en las muestras se requiere un estudio cuantitativo que incorpore un patrón (Cullity y Stock, 2001). La pequeña cantidad de Pr6O11 pre- sente en las muestras se debe a un exceso de Pr en la dosificación inicial de la manganita de praseodimio, aspecto que hay que considerar en trabajos futuros. Por otro lado, a diferencia de trabajos reportados en la literatura, aquí se logró obtener la fase de praseodimio deseada, Pr1-xSrxMnO3 (x = 0.4, 0.5), a más baja tempe- ratura, 600°C durante 2 horas frente a 900°C (Azevedo et al. 2011), 1100°C por 15 horas (Kostogloudis et al. 1997), 1400°C por 1 hora (Pfluge et al. 2005) y 1150°C por 4 horas en el método convencional (Huang et al., 2000), lo que muestra que el método Pechini sería más favorable para obtener este tipo de manganitas.
Microscopia electrónica de barridoLas fotografías tomadas a la microestructura de las muestras sintetizadas (figura 4) permitieron apreciar el grado de formación de aglomerados de un tamaño entre 2 y 8μm, conformados por partículas primarias de un tamaño < 100nm, que podrían ser fácilmente eliminados empleando un proceso de molienda; la distribución de tamaño de las partículas de los polvos calcinados no es homogénea. A pesar de que en este trabajo no se obtuvo un polvo cerámico con partículas submicrónicas, no se requirió, como lo reportan otros trabajos, de largas etapas de molienda para obtener tamaños de partícula similares a las que se muestran en la figura 4 (por ejemplo 72 horas en la investigación de Kostogloudis et al. (1997).
ConclusionesSe estableció una metodología confiable y reproducible para obtener polvos cerámicos de manganitas de praseodimio y praseodimio-estroncio, Pr/Sr–Mn–O, utilizando como ruta de síntesis el método de precursor polimérico (Pechini). Las condiciones que se utilizaron: solución inicial a pH 8, calentamiento de esta solución a 140°C y calcinación de la resina a 250°C por 24 horas. El polvo obtenido se sometió a un tratamiento térmico de 600°C durante dos horas, y a este se le realizó una cuidadosa caracterización microestructural utilizando diferentes técnicas. En el presente trabajo se redujo apreciablemente, con respecto a trabajos reportados en la literatura, la temperatura y el tiempo requerido para sintetizar este tipo de manganitas.
Los resultados obtenidos de la caracterización muestran que al tratar térmicamente las muestras en polvo P5S5 y P6S4 a 600°C, se favoreció la presencia de las fases Pr0.5Sr0.5MnO3 (PDF 81–821) y Pr0.6Sr0.4MnO3 (PDF 87–929), como principales fases cristalinas, respectivamente. Por otro lado, las fotografías tomadas con MEB, a las muestras sintetizadas, permitieron apreciar aglomerados de un tamaño entre 2 y 8μm, conformados por partículas primarias de tamaño < 500nm. Para obtener este tamaño de partícula no se requirió de una etapa de molienda como lo reportan otros trabajos.
Este trabajo se financió por el proyecto BANCO DE LA REPÚBLICA, ID 2637. Agradecimientos especiales a la Universidad Nacional de Mar del Plata, Argentina y la Universidad de Brasilia, Brasil por el uso de los equipos de laboratorio, asimismo a la VRI de la Universidad del Cauca por el co-financiamiento y apoyo logístico.
Citación estilo Chicago
Citación estilo ISO 690
Carol Julieth Aguilar-Paz. Egresada del programa de ingeniera física (2009). Obtuvo su título de maestría en ingeniería física en 2013, ambos grados por la Facultad de Ciencias Naturales, Exactas y de la educación de la Universidad del Cauca. Es miembro activo del grupo de investigación en ciencia y tecnología de materiales cerámicos (CYTEMAC). Sus temas de interés son: la síntesis, procesamiento y caracterización de óxidos metálicos con propiedades eléctricas.
Yasser Halil Ochoa-Muñoz. Egresado del programa de ingeniera física (2010). Obtuvo su título de maestría en ingeniería física en 2015, ambos grados por la Facultad de Ciencias Naturales, Exactas y de la educación de la Universidad del Cauca. Es miembro activo del grupo de investigación en ciencia y tecnología de materiales cerámicos (CYTEMAC). Sus temas de interés son: la síntesis, procesamiento y caracterización de óxidos metálicos con propiedades eléctricas.
Sonia Gaona-Jurado. Egresada del programa de física de la Universidad del Valle, magíster en ciencias físicas y doctora en ciencias físicas por la Universidad Federal de Minas Gerais. Actualmente es docente investigador del Departamento de Física-FACNED/Universidad del Cauca, Colombia. Es miembro activo del grupo de investigación en ciencia y tecnología de materiales cerámicos (CYTEMAC). Sus temas de interés son: la síntesis, procesamiento y caracterización de óxidos metálicos con propiedades ferromagnéticas.
Jorge Enrique Rodríguez-Páez. Egresado del programa de física de la Universidad Nacional de Colombia (1983). Obtuvo su maestría en ciencia de materiales por la Universidad Nacional de Mar del Plata, Argentina (1990) y su doctorado en ciencias con énfasis en física de materiales por la Universidad Autónoma de Madrid, España (1999). Actualmente es docente investigador del Departamento de Física-FACNED/Universidad del Cauca, Colombia y coordina el Grupo CYTEMAC. Sus temas de interés son: nuevos métodos de síntesis de óxidos metálicos, conformado de electrocerámicos (sensores de gases) y uso de nanopartículas en remediación ambiental.