La integridad del eje interleucina 12/interferón gamma (IL-12/INF-γ) es esencial para un correcto control de la infección por Mycobacterium tuberculosis. El objetivo del presente estudio fue evaluar si la alta incidencia de tuberculosis (TB) en Galicia (España) podría estar relacionada con una respuesta alterada en el eje IL-12/INF-γ en los pacientes con TB. Se estudió a 20 enfermos con TB y 21 controles sanos: 7 con prueba de la tuberculina positiva (PT+) y 14 con prueba de la tuberculina negativa (PT–). El estudio del eje IL-12/INF-γ se realizó mediante la determinación de los niveles de INF-γ y la expresión celular de los receptores IL-12Rβ1 e INF-γR1 en linfocitos y monocitos, respectivamente. Los ensayos se realizaron tanto a nivel basal, como tras estimulación mediante incubación in vitro de células mononucleares de sangre periférica con fitohemaglutinina (PHA) y derivado proteico purificado (PPD). Se analizaron y compararon las respuestas de los enfermos y de los controles sanos. La estimulación in vitro con PHA y PPD incrementó de forma significativa los niveles de INF-γ, y la expresión celular de los marcadores IL-12Rβ1 y INF-γR1 respecto a los niveles basales, tanto en el grupo de enfermos con TB, como en el de controles sanos (con PT+ y PT–). Todo ello es indicativo de una respuesta inmunitaria adecuada en todos los grupos, en los que la funcionalidad del eje IL-12/INF-γ está conservada en los pacientes analizados con TB en Galicia. Aunque nuestro estudio no ha analizado todas las vías de alteración posibles del eje IL-12/INF-γ, las altas tasas de enfermedad que históricamente se observan en esta comunidad no parecen estar causadas por una disfunción de la respuesta inmunitaria a este nivel.
The integrity of the interleukin 12/interferon gamma (IL-12/INF-γ) axis has been shown to be essential in the control of the Mycobacterium tuberculosis infection. The aim of this study was to assess whether the high incidence of tuberculosis (TB) in Galicia, Spain, could be related to an altered response in the IL-12/INF-γ axis in patients with TB. We studied 20 TB patients and 21 healthy controls: 7 with positive Tuberculin Skin test (TST+) and another 14 with TST–. The study of the IL-12/INF-γ axis was conducted by the analysis of INF-γ levels (in serum and supernatants of non-activated and activated cells) and by the cellular expression of IL-12Rβ1 and INF-γR1 in lymphocytes and monocytes, respectively. The assays were performed at baseline levels and after in vitro stimulation of peripheral blood mononuclear cells with phytohaemagglutinin (PHA) and purified protein derivative (PPD). Responses in patients and in healthy controls were analysed and compared. PHA and PPD in vitro stimulation significantly increased INF-gamma levels and the cellular expression of IL-12Rβ1 and INF-γR1 receptors compared to baseline levels in both TB patients and healthy controls (either with positive or negative TST). Our results suggest that there is an adequate immune response in all groups. Although the IL-12/INF-γ axis may have other abnormalities not analysed in this work, the functionality of the IL-12/INF-γ axis is preserved in the patients analysed with TB in Galicia. The high rates of disease historically observed in this community does not seem to be caused by a malfunction of the immune response at this level.
La tuberculosis (TB) es una enfermedad de alta incidencia y prevalencia en el mundo, que llevó a la propia Organización Mundial de la Salud a declararla ya en el año 1993 emergencia global1, situación que se mantiene hoy día con una prevalencia mundial estimada de 14 millones de casos2. Sin embargo, se estima que únicamente un 10 % de pacientes con infección tuberculosa llegarán a desarrollar TB en algún momento de su vida. No es posible determinar con exactitud qué personas infectadas van a desarrollar enfermedad. Sin embargo, sí son bien conocidas una serie de condiciones de mayor riesgo de progresión de infección latente a enfermedad, en relación con alteraciones del sistema inmunitario, como son la coinfección por el virus de la inmunodeficiencia humana (VIH) y otras situaciones en los que la integridad de la respuesta inmunitaria celular puede estar alterada3.
En los últimos años varios grupos de trabajo están realizando grandes esfuerzos por conocer la importancia de esta respuesta celular y de todos sus componentes. Los macrófagos, la subpoblación de linfocitos T helper tipo 1 (Th1), y en especial el eje interleucina 12/interferón gamma (IL-12/INF-γ), han demostrado que son de importancia crucial para el control de la infección tuberculosa4-7.
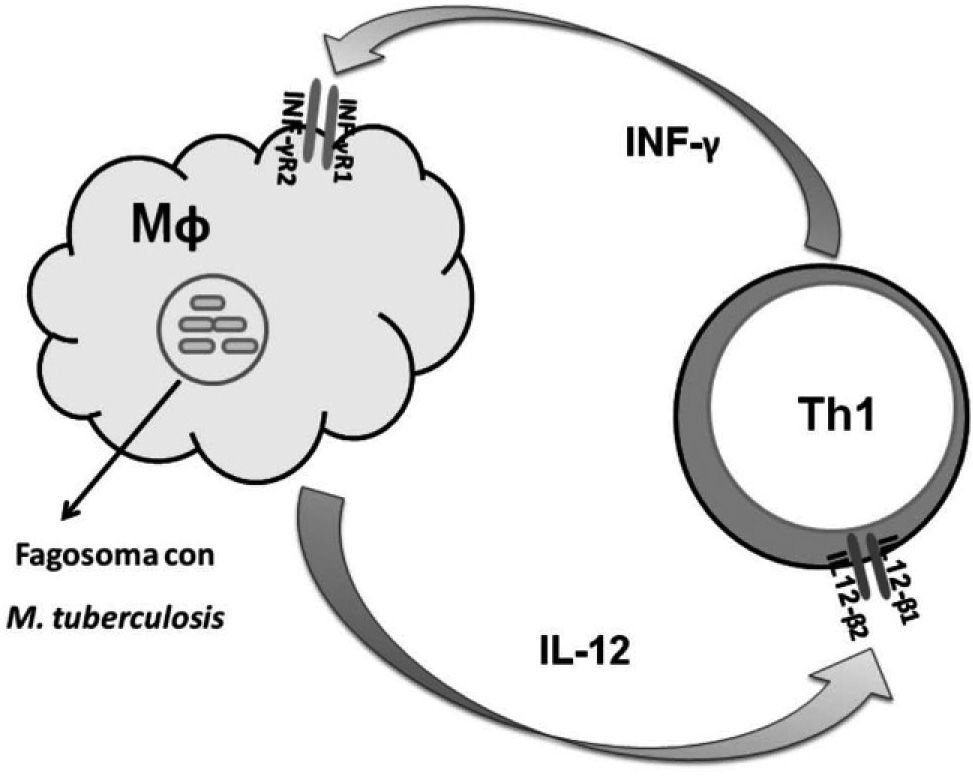
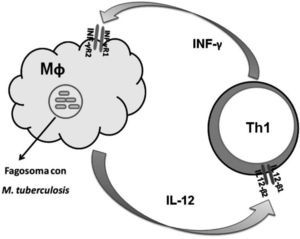
La inmunidad mediada por células es la principal línea de defensa frente a patógenos intracelulares como Mycobacterium tuberculosis. Macrófagos infectados liberan IL-12 que induce la proliferación de células T y su diferenciación hacia linfocitos Th1 (fig. 1). La subpoblación Th1 produce interferón gamma (INF-γ), el cual, además de estabilizar el fenotipo Th1, activa a los macrófagos potenciando su capacidad de destruir al patógeno. La mayoría de las células linfoides expresan el receptor para INF-γ, formado por las subunidades R1 (INF-γR1) y R2 (INF-γR2), mientras que las células T y las células natural killer (NK) activadas expresan las cadenas beta 1 y beta 2 del receptor para la IL-12 (IL-12Rβ1 y IL-12Rβ2). La integridad del eje IL-12/INF-γ puede estudiarse midiendo la respuesta a estimulación in vitro de los niveles de IL-12, INF-γ y mediante la expresión de los receptores para cada una de estas citocinas8.
Esquema del eje IL-12/INF-γ durante la respuesta inmunitaria frente al patógeno intracelular Mycobacterium tuberculosis. IL-12: interleucina 12; IL-12Rβ1 y β2 basal: subunidades de receptor para IL-12; INF-γ: interferón gamma; INF-γR1 y INF-γR2: subunidades de receptor para INF-γ; Mf: macrófago; Th1: linfocito T helper tipo 1.
A pesar de que la incidencia de TB sigue un patrón inverso al nivel de desarrollo socioeconómico de los pueblos, Galicia (región del noroeste de España) ha presentado históricamente unas tasas muy elevadas de enfermedad para su nivel de desarrollo económico y social9,10, con uno de los niveles de incidencia de TB más elevados de España y de Europa Occidental. La prevalencia de infección del virus de la inmunodeficiencia humana (VIH), así como la presencia de inmigrantes entre los pacientes con TB, es baja en esta comunidad, por lo que las razones de la elevada incidencia de enfermedad tuberculosa no se conocen bien.
Algunos estudios han demostrado la existencia de grupos poblacionales que presentan una alta susceptibilidad para el desarrollo de enfermedad tuberculosa 11-14, debido a alteraciones en los niveles de secreción de INF-γ, o en el de la expresión, o funcionalidad de los receptores para INF-γ e IL-12, por lo que nuestro grupo se planteó la hipótesis de que la alta incidencia de TB en Galicia podría deberse a una respuesta alterada del eje IL-12/INF-γ en los pacientes gallegos.
Material y métodosPoblación de estudioSe estudió a 20 enfermos adultos con diagnóstico reciente de TB pulmonar con confirmación microbiológica y 21 controles sanos (voluntarios con actividad normal, sin datos de enfermedad ni otra afección, y sin antecedentes epidemiológicos conocidos de TB, ni factores de riesgo de progresión a enfermedad tuberculosa). Todos ellos pertenecían a las áreas sanitarias de Vigo y Pontevedra (Galicia [España]) y eran gallegos de origen. Para el estudio se excluyó a los pacientes con serología positiva para el VIH o que recibieran tratamiento inmunodepresor.
Estudio del eje IL-12/INF-γEn todos los pacientes y controles se estudió el eje IL-12/INF-γ mediante la cuantificación de los niveles de producción de INF-γ, expresión linfocitaria de IL-12Rβ1 y expresión de INF-γR1 en macrófagos, tanto a nivel basal como tras estimulación mediante incubación in vitro durante 3 días con fitohemaglutinina (PHA) (activador policlonal) y 7 días con derivado proteico purificado (PPD) como activador específico15. En los pacientes del grupo control, inmediatamente después de la extracción de la muestra, se les realizó la prueba intradérmica de la tuberculina (PT) según la técnica de Mantoux, inyectando intradérmicamente en la cara ventral del antebrazo 0,1 ml (2 UT) de PPD RT-23 (Evans, Celltech Pharma SA, Madrid [España]). La lectura se realizó a las 48–72 h y se consideró positiva si la induración era mayor o igual de 15 mm. A pesar de que las recomendaciones establecidas por la Sociedad Española de Patología Respiratoria marcan 5 mm como punto de corte de positividad16, se decidió considerar la prueba positiva con una induración mayor o igual de 15 mm, tanto en no vacunados, como en vacunados con bacilo Calmette-Guérin (BCG), por tratarse de pacientes sin antecedentes epidemiológicos conocidos de contacto con TB, ni factores de riesgo personales de progresión a enfermedad17. La comprobación de la vacunación con BCG fue mediante certificación escrita o comprobación de cicatriz posvacunal en región deltoidea o escapular.
Obtención de muestras y análisis de laboratorioSe obtuvieron muestras de sangre periférica mediante punción venosa con mariposa en tubos Vacutainer, con y sin anticoagulante, inmediatamente después del diagnóstico. Los tubos sin anticoagulante se incubaron 6 horas a 4 °C y luego se centrifugaron a 3.000 rpm y 4 °C durante 15 minutos. Posteriormente, se recogió el suero y se almacenó a −80 °C hasta su análisis. A partir de sangre con anticoagulante, se obtuvieron las células mononucleares por centrifugación en gradiente de densidad usando Ficoll-Paque Plus (Amersham Biosciences, Uppsala [Suecia]). Para ello se colocaron 7 ml de sangre diluida 1:2 con medio de cultivo RPMI 1640 (GIBCO, Invitrogen [Escocia]) sobre 3 ml de Ficoll en tubos Falcon de 15 ml y fueron centrifugados a 1.800 rpm durante 30 minutos a temperatura ambiente. Posteriormente se recogió la banda de la interfase y se lavó dos veces con medio completo (RPMI 1640 suplementado con 100 U/ml de penicilina, 100 mg/ml de estreptomicina (GIBCO, Invitrogen Incorporation, Paisley [Escocia]) y 10 % de suero fetal bovino (PAA Laboratories [Austria]). La concentración y viabilidad celular fueron determinadas por recuento con azul tripán en cámara de Neubauer bajo microscopio óptico.
Expresión de IL-12Rβ1 e INFγ-R1Se analizó la expresión de las subunidades IL-12Rb1 e INF-γR1 en linfocitos y macrófagos, respectivamente, tanto a nivel basal como tras activación celular con PHA y PPD, mediante inmunofluorescencia directa. La expresión de los receptores tras activación celular se determinó mediante el cultivo de 1 x 106 células mononucleares en 1 ml de medio completo en presencia de PHA (10 μg/ml) (SIGMA), o PPD (RT 23, Evans) (600 U/ml), a 37 °C y 5 % de CO2 durante 3 y 7 días respectivamente, según lo descrito por Kori et al15. Transcurrido ese tiempo, se recogieron las células, se centrifugaron y su sobrenadante se almacenó a −80 °C para estudios posteriores. Para despegar a los monocitos adheridos, se añadió 1 ml de EDTA 0,5 M a 37 °C durante 10 minutos. El estudio de inmunofluorescencia se realizó con 5 x 105 células en 50 ml de medio completo y 10 ml de los anticuerpos monoclonales correspondientes: anti-IL-12Rβ1-RPE o antiINF-γR1-FITC (R&D Systems [Estados Unidos]) a 4 °C, en oscuridad, durante 45 minutos. Se lavaron con 3 ml de medio completo, se centrifugaron a 1.200 rpm durante 5 minutos y se resuspendieron en 600 ml de formaldehído al 0,1 %. Las muestras fueron analizadas en citómetro de flujo (Beckman Coulter, Epics XL-MCL). Los datos obtenidos se analizaron utilizando el programa MXP versión 2.0 para Cytomics FC 500 (Beckman Coulter). La expresión de receptores IL-12γ1 y de INF-γR1 se determinó como el porcentaje de células que expresaban el receptor. Las poblaciones de linfocitos y monocitos se determinaron a partir de su tamaño y complejidad (FSC/SSC), y posteriormente confirmadas con los marcadores CD3-FITC y CD14-FITC (Beckman Coulter), respectivamente, en ensayos independientes siguiendo el protocolo descrito anteriormente.
Determinación de la producción de INF-γLa producción de INF-γ tanto a nivel basal (en muestras de suero) como tras activación celular (en los sobrenadantes de las células estimuladas), se determinó mediante el uso del ELISA comercial OptEIA, Human INF-γ ELISA SET (BD Biosciences [Estados Unidos]), siguiendo las recomendaciones del fabricante. Placas de ELISA (Corning Incorporated, NY [Estados Unidos]) con anticuerpo de captura anti-INF-γ humano fueron incubadas durante toda la noche a 4 °C. La producción basal de INF-γ se determinó en suero y no en sobrenadante ya que el nivel de INF-γ en sobrenadante basal (a tiempo cero) es indetectable. Posteriormente se bloquearon con suero bovino fetal al 10 % en buffer fosfato salino (PBS) durante 1 hora a temperatura ambiente. Se incubaron distintas diluciones de las muestras y del estándar durante 2 horas a temperatura ambiente. El INF-γ se detectó mediante 1 hora de incubación a temperatura ambiente, con el anticuerpo de detección biotinilado junto con avidina conjugada con peroxidasa de rábano picante, provisto por el kit. Se utilizó una solución comercial de tetrametilbencidina (TMB Reagent Set, BD [Estados Unidos]) como cromógeno, siguiendo las recomendaciones del fabricante. Tras 30 minutos de incubación en oscuridad, se paró la reacción con H2SO4, y se midió la absorbancia. Los niveles de INF-γ se expresan en pg/ml.
Análisis estadísticoLas variables cuantitativas se describen mediante la media y la desviación estándar. Las variables cualitativas se describen mediante el porcentaje de cada categoría. Dado el número de efectivos de los grupos de comparación se han utilizado pruebas no paramétricas en el análisis.
La comparación de la respuesta obtenida intragrupos de los niveles basales con los obtenidos tras estimulación, tanto en enfermos como en controles, se realizó mediante la prueba de Wilcoxon para datos pareados. Para la comparación intergrupos enfermos-controles se utilizó el test de Mann–Whitney. Se consideró significación estadística un valor de p<0,05.
Por otra parte, se calculó si el porcentaje de enfermos no respondedores en cualquier nivel del eje IL-12/INF-γ era superior entre los enfermos respecto a los controles sanos mediante el test exacto de Fisher.
Se definió "ausencia de respuesta" a la estimulación con PHA y PPD en estos casos:
- —
Los niveles de INF-γ: aumentaban<×4,5 veces sobre el valor basal.
- —
El porcentaje de células con expresión de marcadores de IL-12Rβ1 y de INF-γR1 aumentaba<10 % sobre el valor basal.
El estudio fue aprobado por el Comité Ético de Investigación Clínica de Galicia. Todos los enfermos y los controles aceptaron la inclusión en el estudio mediante consentimiento informado escrito.
ResultadosSe estudió a un total de 20 enfermos con TB y 21 controles sanos, de los cuales 15 de los enfermos con TB y 4 de los controles sanos eran varones. La edad media de los pacientes fue de 37,8±12,6 años, frente a 26,2±10,4 de los controles. Cuatro enfermos y 11 controles presentaban cicatriz indicativa de antecedentes de vacunación por BCG. De los 21 controles sanos, en 7 de ellos la PT fue positiva (PT+, mayor de 15 mm de induración), mientras que los otros 14 tenían PT negativa (PT-). Ninguno de ellos refería contacto epidemiológico conocido con pacientes tuberculosos.
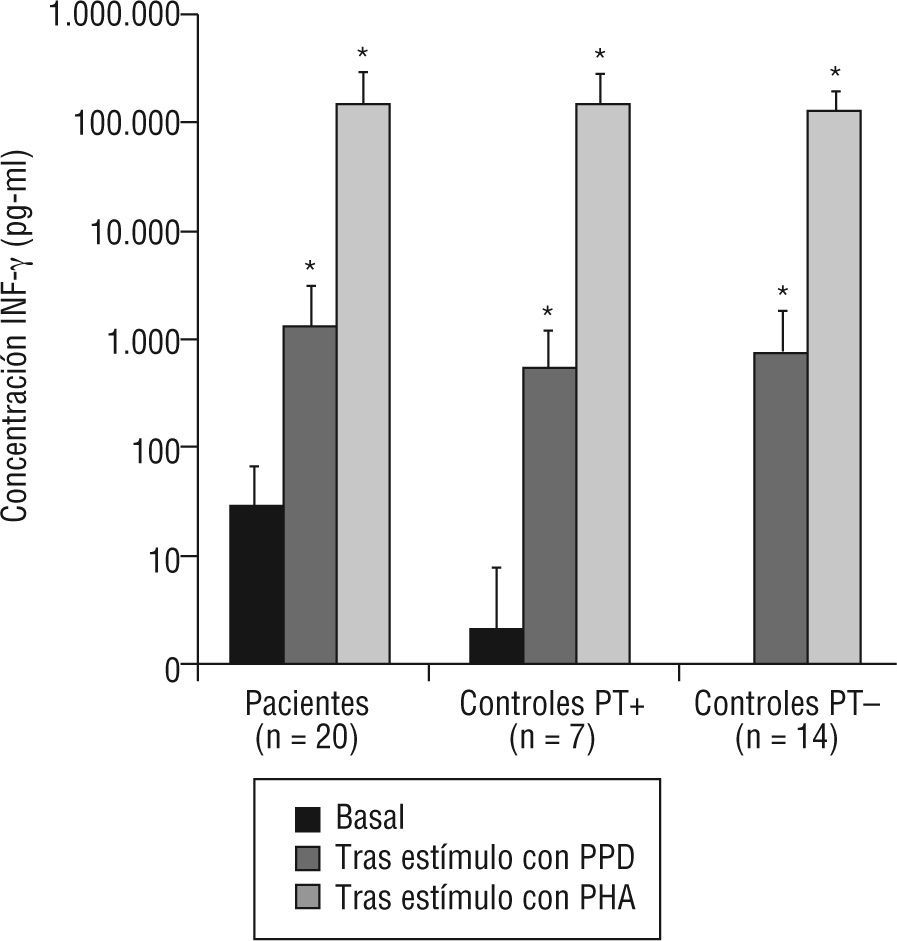
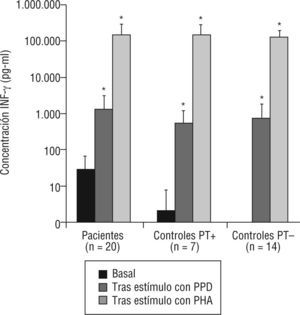
1Niveles de INF-γSe determinaron los niveles de INF-γ basal en muestras de suero, en enfermos y controles sanos, así como tras estimulación in vitro. En todos los grupos (fig. 2) se observó un incremento significativo de la producción de interferón tras estímulo con PPD y con PHA, indicativo de una respuesta conservada en la producción de INF-γ. Es importante destacar que el nivel de INF-γ basal (fig. 2 y tabla 1) fue significativamente mayor en enfermos que en controles (p<0,001). Sin embargo, no se observaron diferencias significativas en los niveles tras estimulación con PPD y PHA (p=0,42 y p=0,97, respectivamente). En los controles sanos, se observó un incremento significativo de la producción de interferón tras estímulo con PPD y con PHA, tanto en vacunados con BCG (p=0,008 y p=0,003, respectivamente) como en no vacunados (p=0,012 y p=0,005, respectivamente).
Niveles de interferón gamma (INF-γ) basal y respuesta proliferativa a estímulos en pacientes con tuberculosis y controles sanos.
PHA: fitohemaglutinina; PPD: derivado proteico purificado; PT+: prueba de la tuberculina positiva (≥ 15 mm); PT-: prueba de la tuberculina negativa (< 15 mm).
*p<0,0001 respecto al valor basal (prueba de Wilcoxon para datos pareados).
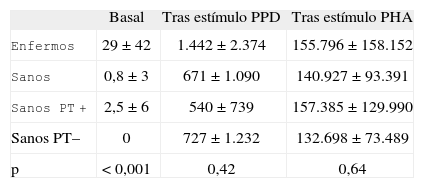
Niveles de interferón gamma (INF-γ) (pg/ml) en pacientes de tuberculosis y contactos sanos
| Basal | Tras estímulo PPD | Tras estímulo PHA | |
| Enfermos | 29±42 | 1.442±2.374 | 155.796±158.152 |
| Sanos | 0,8±3 | 671±1.090 | 140.927±93.391 |
| Sanos PT+ | 2,5±6 | 540±739 | 157.385±129.990 |
| Sanos PT– | 0 | 727±1.232 | 132.698±73.489 |
| p | < 0,001 | 0,42 | 0,64 |
p: nivel de significación de enfermos respecto a sanos (Prueba de Mann–Whitney); PHA: fitohemaglutinina; PPD: derivado proteico purificado; PT: prueba de la tuberculina. Resultados expresados como media±desviación estándar.
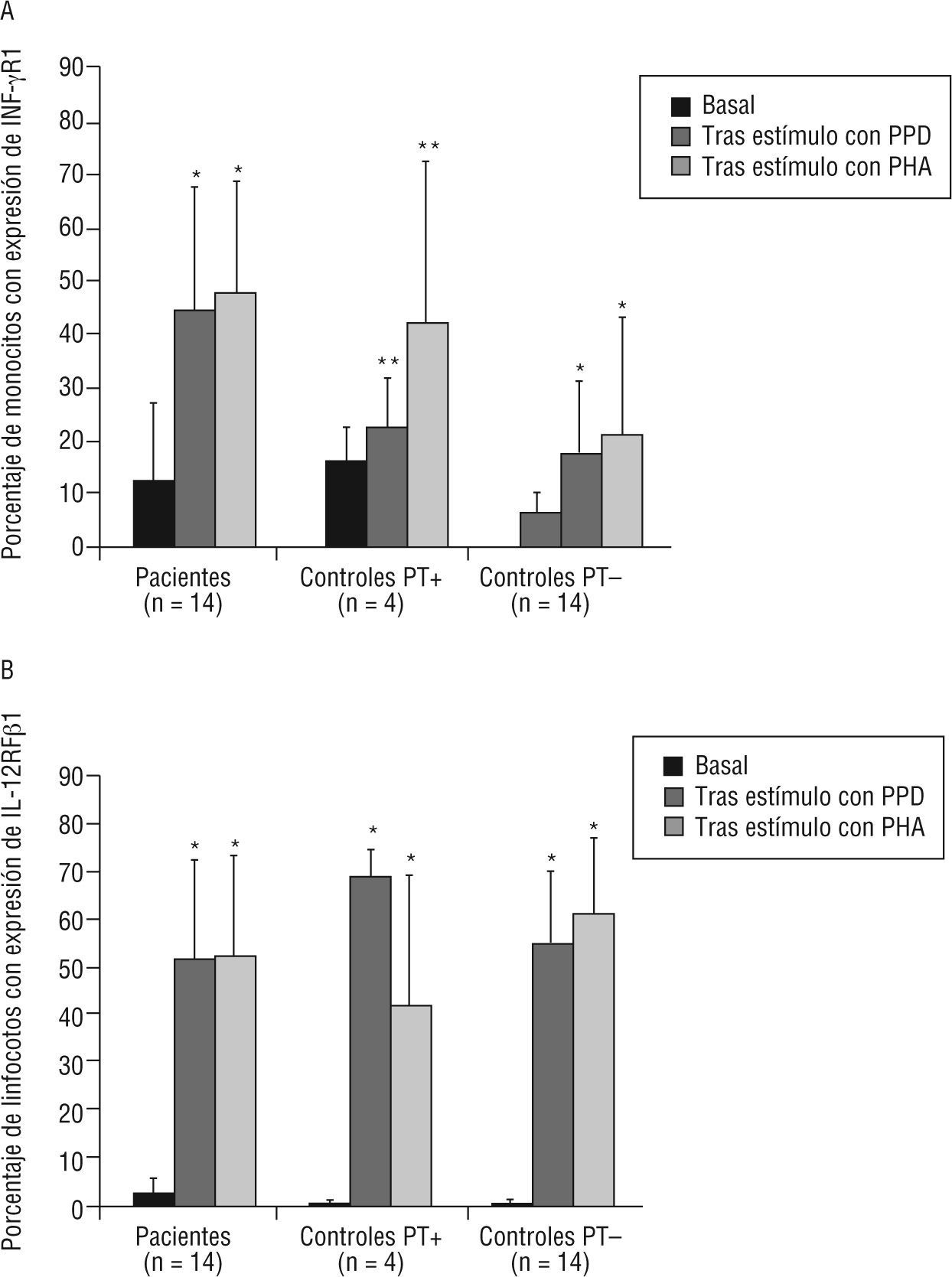
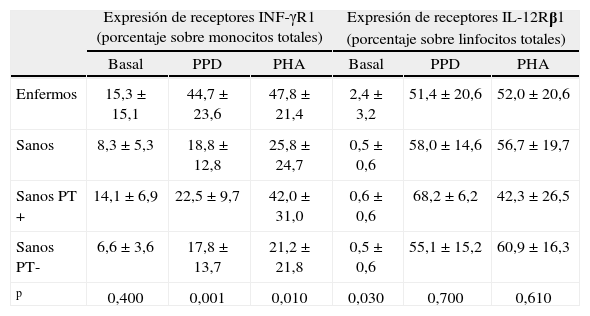
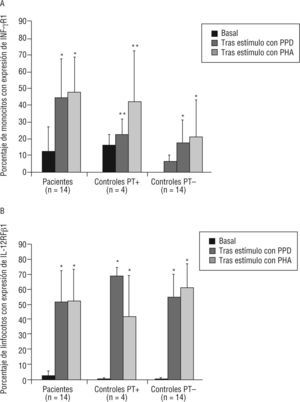
Se estudió la proporción de monocitos y linfocitos que expresaban INF-γR1 e IL-12Rβ1, respectivamente, en 14 enfermos de TB y en 18 controles sanos (4 con PT+y 14 con PT-), tanto basalmente como tras estimulación con PPD y con PHA. En la figura 3A se muestra que los monocitos aumentaron la expresión del receptor para interferón tras estimulación tanto con PPD y con PHA en todos los grupos, indicativo de una estimulación conservada de los receptores INF-γR1 en cada grupo. El porcentaje de células que expresaban basalmente INF-γR1 no fue distinto entre enfermos y controles sanos (tabla 2); sin embargo fue mayor en los pacientes tras estimulación con PPD y PHA (p=0,001 y p=0,01, respectivamente). En los controles sanos, los monocitos aumentaron la expresión del receptor de INF-γR1 tras estímulo con PPD y PHA de forma significativa, tanto en vacunados con BCG (p=0,008 en ambos), como en no vacunados (p=0,011 y p=0,050, respectivamente).
Porcentaje de monocitos (A) y linfocitos (B) con expresión de los receptores para interferón gamma (INF-γR1) e interleucina 12 (IL-12Rβ1), respectivamente. Se han analizado tanto basalmente como tras activación con fitohemaglutinina (PHA) o derivado proteico purificado (PPD) en pacientes con tuberculosis y controles sanos con prueba de tuberculina (PT+) positiva (≥ 15 mm) o negativa (PT-).
*p<0,0001 respecto al nivel basal.
**p<0,03 respecto al nivel basal (prueba de Wilcoxon para datos pareados).
Expresión de los receptores INF-γR1 e IL-12Rβ1 en monocitos y linfocitos, respectivamente, en pacientes de tuberculosis y en controles sanos
| Expresión de receptores INF-γR1 (porcentaje sobre monocitos totales) | Expresión de receptores IL-12Rβ1 (porcentaje sobre linfocitos totales) | |||||
| Basal | PPD | PHA | Basal | PPD | PHA | |
| Enfermos | 15,3±15,1 | 44,7±23,6 | 47,8±21,4 | 2,4±3,2 | 51,4±20,6 | 52,0±20,6 |
| Sanos | 8,3±5,3 | 18,8±12,8 | 25,8±24,7 | 0,5±0,6 | 58,0±14,6 | 56,7±19,7 |
| Sanos PT+ | 14,1±6,9 | 22,5±9,7 | 42,0±31,0 | 0,6±0,6 | 68,2±6,2 | 42,3±26,5 |
| Sanos PT- | 6,6±3,6 | 17,8±13,7 | 21,2±21,8 | 0,5±0,6 | 55,1±15,2 | 60,9±16,3 |
| p | 0,400 | 0,001 | 0,010 | 0,030 | 0,700 | 0,610 |
p: nivel de significación de enfermos respecto a sanos (prueba de Mann–Whitney); PPD: derivado proteico purificado; PHA: fitohemaglutinina; PT: prueba de la tuberculina.
Resultados expresados como media±desviación estándar.
En el caso de la expresión del receptor IL-12Rβ1 en linfocitos, se observó un incremento tras estimulación con PPD y con PHA en todos los grupos (fig. 3B), lo que de nuevo indica una conservación adecuada de la función del IL-12Rβ1. Es interesante indicar que el porcentaje de linfocitos que expresaron basalmente marcadores de IL-12Rβ1 fue mayor en enfermos que en controles (p=0,03) (tabla 2). Sin embargo, estas diferencias desaparecieron tras la estimulación de las células in vitro. En los controles sanos, los monocitos aumentaron la expresión del receptor tanto de IL-12Rβ1 de forma significativa, tanto en vacunados con BCG, como en no vacunados (p=0,008 frente a estimulación con PHA y PPD en ambos grupos).
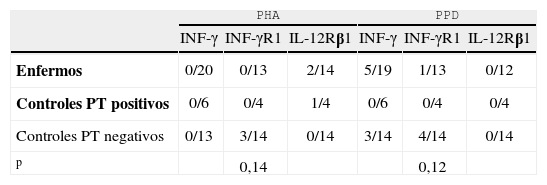
3Estudiode enfermos y controles no respondedores a PHA y PPDSe analizó de forma individualizada a los pacientes no respondedores a los estímulos in vitro en presencia de PHA y PPD. Para ello, se comparó la proporción de pacientes que presentaban al menos una alteración en la respuesta frente a PHA o PPD con los controles sanos, en cualquiera de los tres niveles estudiados del eje IL-12/INF-γ.
En la tabla 3 se muestra a los pacientes no respondedores respecto al total de pacientes estudiados para cada determinación. En presencia de PHA, no respondieron en algún punto 2 pacientes, 1 control PT+y 3 controles PT-, y no se observaron diferencias significativas en ninguno de los grupos (p=0,14). Se encontraron resultados semejantes tras la estimulación con PPD. No respondieron en algún punto 5 pacientes y 5 controles (todos ellos PT-), pero tampoco se observaron diferencias significativas (p=0,12) entre el grupo de pacientes y el grupo de controles sanos.
Proporción de pacientes no respondedores tras estímulo con PHA y PPD en 3 puntos del eje IL-12/INF-γ
| PHA | PPD | |||||
| INF-γ | INF-γR1 | IL-12Rβ1 | INF-γ | INF-γR1 | IL-12Rβ1 | |
| Enfermos | 0/20 | 0/13 | 2/14 | 5/19 | 1/13 | 0/12 |
| Controles PT positivos | 0/6 | 0/4 | 1/4 | 0/6 | 0/4 | 0/4 |
| Controles PT negativos | 0/13 | 3/14 | 0/14 | 3/14 | 4/14 | 0/14 |
| p | 0,14 | 0,12 | ||||
IL-12: interleucina 12; INF-γ: interferón gamma; PPD: derivado proteico purificado; PHA: fitohemaglutinina; PT: prueba intradérmica de la tuberculina.
Por último, se estudió conjuntamente la respuesta frente a PHA y a PPD. Para ello se incluyó únicamente a los pacientes en los que se pudo realizar todas las pruebas basales y en todos y cada uno de los tres niveles de respuesta proliferativa a todos los estímulos (PPD y PHA). Se observó que no respondieron al menos en algún punto 6 pacientes (6/12), un control PT+(1/4) y 6 controles PT(6/14). No se observaron diferencias significativas (p=0,68), indicando nuevamente que la respuesta proliferativa entre el grupo de pacientes y de controles sanos es muy semejante. Por tanto, todos los resultados apuntan a que no se muestran claras alteraciones del eje IL-12/INF-γ en los pacientes gallegos enfermos de TB, comparados con los individuos sanos.
DiscusiónM. tuberculosis es un patógeno capaz de evadir la respuesta inmunitaria, haciendo que ésta no sea enteramente efectiva para erradicar definitivamente la infección. En la respuesta inmunitaria frente a micobacterias, la integridad del eje IL-12/INF-γ es decisoria para que ésta sea efectiva18, por lo que nuestro grupo se planteó si la alta incidencia de TB en Galicia podría estar asociada a una alteración en la funcionalidad de esta vía.
Sin embargo, en el presente estudio no se observaron diferencias en la respuesta de los pacientes respecto al grupo control formado por personas no enfermas, tanto con PT+como PT-, lo que hace suponer que la integridad del eje IL-12/INF-γ está conservada en los enfermos con TB. La respuesta está conservada en todos los niveles estudiados: la producción de INF-γ, y la expresión de receptores IL-12Rβ1 e INF-γR1, tanto a nivel basal como tras la estimulación con PHA y con PPD.
Hemos encontrado que los enfermos presentan niveles basales de INF-γ y expresión de IL-12Rβ1 más elevados que los controles, lo que indicaría un estado de activación de su sistema inmunitario como consecuencia de la infección. Sin embargo, este estado de activación no les impide responder adecuadamente a estímulos in vitro, como son el PPD o la PHA, ya que no se encontraron diferencias entre los enfermos y controles después de la activación. Por el contrario, en el caso del INF-γR1, mientras que los niveles basales fueron similares entre enfermos y controles, la expresión de este receptor fue mayor en los enfermos.
Al comparar nuestros resultados en la población gallega con otros estudios que analizan y comparan la producción de citocinas y su respuesta frente a estímulos en pacientes con TB y sanos, hemos observado la enorme controversia que hay entre distintos autores y estudios realizados. Así, en función del artículo analizado, los niveles basales de interferón y la respuesta frente a estímulos se ha encontrado en los enfermos: menor19-21, igual22,23 o incluso superior24 a los controles. Estas diferencias pueden atribuirse al distinto protocolo utilizado en cada uno de los casos, e indica que una correcta estandarización de los estudios es deseable para poder comparar entre distintos ensayos.
Son bien conocidos distintos polimorfismos genéticos que resultan en incapacidad de una producción adecuada de INF-γ o en su funcionalidad25. Los pacientes portadores de este tipo de alteración genética presentan infecciones graves por M. tuberculosis y otros patógenos intracelulares, habitualmente de gravedad extrema y en edades tempranas de la vida26,27. Sin embargo, este tipo de alteraciones se ha logrado observar en un número muy limitado de pacientes, por lo que no justifican la alta tasa de prevalencia de TB en el mundo28, ni tampoco en el caso concreto que nos ocupa en Galicia. Aún así, estos estudios han demostrado la importancia clave del eje IL-12/INF-γ, ya que la alteración cuantitativa o funcional en cualquier punto del eje se traduce en infecciones graves por patógenos intracelulares como las micobacterias.
Nuestro estudio está en concordancia con otros trabajos que demuestran que los individuos con enfermedad tuberculosa desarrollan aparentemente una respuesta inmunitaria adecuada, con producción conservada de INF-γ29,30. Estos autores encuentran una respuesta Th1 conservada en pacientes con TB frente a controles sanos o pacientes con infección latente. Kori et al15 estudiaron la respuesta Th1 en una población de inmigrantes etíopes en Israel, con alta prevalencia de enfermedad. Estudiaron la respuesta basal y proliferativa de INF-γ e IL-2. Al igual que en nuestro trabajo, encontraron una respuesta celular conservada en los enfermos con TB. Nuestro trabajo amplía el estudio de la respuesta del eje IL-12/INF-γ a otros niveles ya que se analizó la expresión de receptores IL-12Rβ1 e INF-γR1, encontrando también una respuesta conservada, indicativo de que la respuesta Th1 es efectiva. Otro estudio reciente evalúa la función Th1 observando los niveles de INF-γ, IL-2R e IL-12, tanto a nivel basal como tras la estimulación con PPD24. Este estudio encuentra también una funcionalidad conservada de la respuesta Th1 en enfermos en comparación con grupos de control. Sin embargo, otros autores encuentran que la capacidad de respuesta frente al mitógeno PHA está reducida en enfermos de TB respecto a controles sanos31. No obstante, estos trabajos evalúan la respuesta en fases tempranas de enfermedad, ya que la menor producción de citocinas en la respuesta Th1 es reversible una vez iniciado el tratamiento antituberculoso.
El estudio presenta algunas limitaciones que merecen consideración. Si bien no hemos hallado diferencias significativas en la respuesta de los enfermos con TB respecto a los controles sanos, tanto a nivel de producción de INF-γ como en la expresión de los receptores IL-12Rβ1 y INF-γR1, respectivamente, no se puede excluir definitivamente que la alta incidencia de TB en Galicia pueda estar relacionada con disfunción del eje IL-12/INF-γ. Así, se ha descrito que M. tuberculosis puede bloquear a distintos niveles la respuesta macrofágica a INF-γ llevando a una deficiente eliminación de bacilo32,33, y otros autores han indicado que la alteración en la respuesta inmunitaria puede deberse a una incapacidad de los macrófagos a responder adecuadamente a la producción de INF-γ frente al patógeno. De esta manera, el bacilo podría evadir los mecanismos de control inmunológico dependientes de INF-γ34.
La conservación de la respuesta cuantitativa del eje IL-12/INF-γ demostrada en nuestro trabajo abre las puertas para el estudio de otras posibles vías que podrían explicar una respuesta alterada no detectable con los análisis realizados en nuestro estudio. Entre ellas se han descrito innumerables posibilidades, como son alteraciones en las otras cadenas de los receptores de IL-12 e INF-γ (IL-1202, e INF-γR2, respectivamente), o en los niveles en STAT1 (implicado en la señalización intracelular)35-37, alteración de linfocitos T reguladores CD4+CD25+FoxP3+38,39, de linfocitos Th240, de células CD8+ citotóxicas, o de células TCRgS41. También se ha indicado que el eje IL-12/INF-γ exige la presencia de factores complementarios para ser enteramente efectivo en su acción, como son la 1a,25-dihidroxi-vitamina D3 y el TNFa41 o incluso alteraciones en la transcripción de la vía NFkB cinasa, IKKg, IL-1R-associated kinasa (IRAK4) 41,42. Cualquier alteración de estos factores podría, al menos en teoría, ser la causa de una respuesta inmunitaria alterada.
Por otra parte, los prolongados tiempos de incubación de las muestras (7 días en el caso de PPD) han podido ser decisivos a la hora de obtener una respuesta tan alta a la estimulación, incluso en pacientes sanos sin BCG como en aquéllos con PT(y por tanto indicativo de ausencia de infección por M. tuberculosis). Para solventar esta posible limitación, los períodos de incubación de pruebas diagnósticas basadas en liberación de citocinas se han reducido a tiempos menores de 24 horas por parte de algunos autores43.
Concluimos que, aunque en nuestro estudio el eje IL-12/INF-γ no ha sido enteramente analizado, nuestros datos indican que la alta incidencia de enfermedad en Galicia no parece estar causada por una alteración del eje IL-12/INF-γ en la población enferma, a nivel de la respuesta cuantitativa de INF-γ, y expresión de IL-12Rβ1 o INF-γR1. El control de la enfermedad debe continuar basándose en los programas clásicos de prevención y control de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos especialmente al Dr. Francisco Gambón Deza y a Christian Sánchez Espinel del Servicio de Inmunología del Hospital Meixoeiro de Vigo su colaboración y soporte técnico en la realización de este trabajo.