El EPF es una proteína con propiedades inmunomoduladoras y reguladoras del crecimiento, presente en el suero de los animales durante la gestación. Es un marcador temprano de viabilidad embrionaria durante la fase peri-implantacional. La obtención de anticuerpos (Acs) anti-EPF nos permitiría contar con una valiosa herramienta para investigar las funciones biológicas de este factor. No se ha logrado obtener Acs monoclonales anti-EPF debido a su función como factor de crecimiento autócrino para los hibridomas. La distancia filogenética que existe entre las aves y los mamíferos resulta potencialmente ventajosa para la producción de un alto porcentaje de Acs específicos contra antígenos mamíferos. El objetivo de este trabajo fue la obtención de Acs policlonales anti-EPF porcino aviarios y de mamífero, comparando la producción y la especificidad de cada lote de anticuerpos. Se inmunizaron gallinas y conejos con un péptido sintético de EPF o con la banda de 29kDa aislada por SDS-PAGE proveniente de suero de una cerda de 7 días de gestación. Las IgY aviarias anti-EPF se purificaron por el método de precipitación con ácido caprílico y polietilenglicol 6000, y las IgG anti-EPF de conejo por precipitación salina con sulfato de amonio. El rendimiento proteico fue evaluado por Bradford y la especificidad de los Acs por “Dot Blot” e Inmunoblot. El rendimiento proteico fue satisfactorio en todos los lotes de Acs. El lote de Acs obtenidos en conejos inmunizados con el péptido sintético presentó especificidad satisfactoria. Los lotes obtenidos en conejos y gallinas inmunizadas con la banda de SDS-PAGE de 29kDa presentaron baja especificidad, mientras que el lote obtenido en gallinas inmunizadas con el péptido sintético presentó nula especificidad. El péptido sintético de EPF indujo la producción de Acs más específicos en conejos, pero la banda de 29kDa de SDS-PAGE no es adecuada para obtener Acs específicos contra este factor dado que además del EPF reconoce otras proteínas presentes en el suero.
Early Pregnancy Factor (EPF) is a secreted protein with known functions as immunomodulator and growth factor, released very early in mammalian gestation. EPF represents an early marker of gestation and a very useful tool to supervise embryonic viability during the peri-implantational period. Obtaining anti-EPF antibodies (Abs) would mean having a valuable tool to investigate the biological functions of this factor, but it has failed so far due to EPF’s function as an autocrine growth factor for hibridomas. The phylogenetic distance between birds and mammals is potentially advantageous for the efficient production of specific Abs against mammalian antigens. Thus, the objective of this work was to obtain avian and mammalian polyclonal anti-porcine EPF Abs and to evaluate the protein yield and the specificity of each batch of antibodies. Hens and rabbits were immunized with a synthetic EPF peptide, or with EPF isolated and purified from porcine serum of 7 days of gestation by SDS-PAGE (29kDa band). IgY anti-EPF antibodies from hens were purified by combined caprylic acid and polyethylene glycol 6000 precipitation, and rabbit anti-EPF IgG by sulphate ammonium precipitation. Protein yield was evaluated by Bradford, and Ab specificity by Dot Blot and Immunoblot. The protein yield was satisfactory in all batches of Abs. The specificity of Abs obtained from rabbits immunized with the synthetic EPF peptide was satisfactory. Batches of immunoglobulins obtained from rabbits and hens immunized with the SDS-PAGE 29kDa band displayed low specificity, whereas the batch obtained from hens immunized with the synthetic peptide presented null specificity. The synthetic peptide induced the production of more specific Abs when they were raised in rabbits. In contrast, the SDS-PAGE 29kDa band is not useful to obtain specific Abs against this factor, since in addition to EPF it recognizes other proteins present in the serum.
La preñez exitosa requiere del reconocimiento inmunológico entre la madre y los fetos. Se ha sugerido que tanto el conceptus como la madre producen factores inmunosupresores que ayudan a proteger los fetos del posible rechazo materno. Uno de estos factores involucrados en el reconocimiento materno es el Factor Precoz de Preñez (EPF)(1-4). En la especie porcina, su secreción se detecta en suero a partir de las 72 horas post-fertilización y a lo largo de toda la preñez(5). Koch et al.(6), postularon que, para que se produzca la señal de producción del EPF, es necesaria la presencia de más de dos embriones viables en el útero y que su actividad desaparece bruscamente con la muerte o remoción de los embriones. En estudios realizados en murinos se ha demostrado que el bloqueo de este factor por anticuerpos produce retraso en el desarrollo de los embriones, fallas en la implantación y muerte embrionaria(7,8).
Hasta el presente, la detección del EPF se realiza mediante la Prueba de Inhibición de Rosetas ("Rosette Inhibition Test", RIT) que es un ensayo semi-cuantitativo, muy laborioso y de pobre reproducibilidad(5,9). La obtención de anticuerpos anti-EPF porcino de calidad nos daría una herramienta muy valiosa para poder ahondar en los conocimientos sobre la funcionalidad biológica y la localización de este importante factor. Además, estos anticuerpos podrían ser utilizados en el futuro para desarrollar una técnica directa, rápida, sencilla y de alta sensibilidad, como el Enzimoinmunoanálisis (EIA), para el diagnóstico temprano de la gestación en cerdos.
Los intentos por obtener anticuerpos anti-EPF monoclonales han fracasado. Se sabe que el EPF actúa como un factor de crecimiento autócrino para los hibridomas. Por lo tanto, los anticuerpos anti-EPF liberados por los hibridomas neutralizan el EPF producido por ellos mismos. De este modo, se seleccionan y sobreviven sólo aquellos hibridomas que producen anticuerpos anti-EPF débilmente neutralizantes que no serían de utilidad para el estudio de la funcionalidad del EPF(7). Por este motivo se está trabajando para lograr obtener anticuerpos policlonales anti-EPF.
La producción de los anticuerpos policlonales requiere normalmente del uso de animales de laboratorio (conejo, ratón, rata, etc.) o de animales mayores (cabra, oveja, caballo, etc.). El uso de anticuerpos tiene una gran importancia en la terapia médica, y actualmente han cobrado un gran interés en el diagnóstico y la investigación científica. Por tanto, hoy en día se hace más exigente no sólo su calidad sino también la metodología empleada para su producción(10).
Dentro de las especies comúnmente empleadas para obtener anticuerpos policlonales se encuentran los conejos, ya que representan una buena elección por la practicidad en el manejo y facilidad relativa para el sangrado. Además, los anticuerpos que produce esta especie han sido ampliamente estudiados, caracterizados y estandarizadas las técnicas para su purificación(11).
El uso de aves en la producción de anticuerpos policlonales se ha reconocido en las últimas décadas, cobrando cada vez más importancia. La distancia filogenética que existe entre las aves y los mamíferos resulta potencialmente ventajosa para la producción de un alto porcentaje de anticuerpos específicos frente a antígenos de mamíferos o de patógenos; por otro lado, también se refina el proceso mismo de obtención, reemplazando el sangrado de los animales por la recolección de los huevos. El hecho que la IgY se extraiga de la yema del huevo hace que su rendimiento sea muy superior (50 a 100mg de IgY/huevo; alrededor de 1.800mg IgY/animal/mes) versus al rendimiento logrado en conejos (200mg de IgG/animal/mes)(12,13).
En nuestro laboratorio, se aisló y purificó una banda de 29kDa que mantenía la actividad EPF a partir de un suero con actividad EPF positiva proveniente de una cerda de 7 días de gestación. La secuencia de aminoácidos correspondiente al extremo N-terminal de la banda electroforética de 29kDa es la siguiente: Lys-Thr-Tyr-Lys-Ser-Glu-Ile-Ala-His-Arg-Asp-Phe-Lys-Leu-Asp-Gly-Gln-Gln-Leu-Tyr(14). Con esta secuencia se sintetizó el péptido sintético de EPF. El objetivo de este trabajo fue obtener anticuerpos policlonales aviarios y mamíferos anti-EPF porcinos y evaluar su rendimiento y especificidad; para poder investigar en el futuro la funcionalidad biológica de este importante factor.
MATERIALES Y MÉTODOSAnimalesConejosSe utilizaron dos lotes de conejos machos albinos (n=3 c/u), de raza Gigante Flandes, de aproximadamente 3kg. Un lote de conejos fue inmunizado con el péptido sintético de EPF. El otro lote fue inmunizado con EPF aislado y purificado de sueros de cerdas de 7 días de gestación con actividad EPF positiva.
GallinasSe utilizaron dos lotes de gallinas (n=3 c/u), de líneas comerciales de postura de raza Rhodelander New Hampshire, de 8 a 10 meses de edad. Un lote de gallinas fue inmunizado con el péptido sintético de EPF. El otro lote fue inmunizado con EPF aislado y purificado de sueros de cerdas de 7 días de gestación con actividad EPF positiva.
InmunógenosFactor Precoz de Preñez sintéticoEn el Instituto de Bioquímica, Universidad de Humboldt (Charité), Alemania se sintetizó el péptido Lys-Thr-Tyr-Lys-Ser-Glu-Ile-Ala-His-Arg-Asp-Phe-Lys-Leu-Asp-Gly-Gln-Gln-Leu-Tyr-NH2(14) usando la metodología estándar Fluorofenilmetiloxicarbonil (Fmoc) en un sintetizador automático Applied Biosystem 433A (Foster City, MA, USA)(15).
Se utilizó suero de cerda de 7 días de gestación con actividad EPF positiva (indicativo de preñez), los cuales fueron sometidos a Electroforesis en gel de Poliacrilamida en presencia de Dodecil Sulfato de Sodio (SDS-PAGE) al 12,5% según la metodología de Laemmli(16), para localizar la proteína de interés (PM de 29kDa). Luego de la corrida se aisló el sector del gel que contenía la banda de 29kDa y se fragmentó por pasajes sucesivos a través de un sistema de doble jeringa y se emulsionó en Adyuvante de Freund Completo (AFC Sigma® F-5881) o solución fisiológica según el esquema de inmunización(11).
Protocolo de InmunizaciónInmunización de conejosPrevio a comenzar la inmunización se sangraron los animales para obtener muestras de sueros no inmunes (control negativo). Se conformaron dos lotes de animales: Lote A1 constituido por tres conejos que fueron inmunizados con EPF sintético. Lote A2 constituido por tres conejos que fueron inmunizados con EPF aislado de suero de cerda de 7 días de gestación por SDS-PAGE (banda de 29kDa).
La inmunización inicial se realizó en las fosas poplíteas por vía intramuscular (i.m.) con 1ml de la mezcla antigénica (10μg/ml de AFC) preparado en un sistema de doble jeringa hasta obtener una emulsión estable. A los 30 y 60 días se aplicaron cuatro dosis de 0,5ml (10μg/ml de AFC) a lo largo de la columna vertebral, por vía subcutánea (s.c.). Siete días después se repitió una inoculación igual a la primera utilizando solución fisiológica en vez de AFC. Para obtener suero hiperinmune, un mes posterior de la última inmunización, se inoculó una dosis de 1ml de mezcla antigénica (10μg/ml de EPF en solución fisiológica) en la región lumbar, vía s.c.
A partir de los siete días posteriores a esta última inmunización se realizaron 4 sangrías con intervalos de una semana a través de la vena marginal de la oreja. Se obtuvieron en promedio 12ml de sangre cada vez que se sangraron, un total de 48ml de sangre por animal en un mes.
Los sueros fueron tratados para eliminar el complemento mediante calentamiento a 56°C por 30 minutos y conservados a -20°C.
Inmunización de GallinasPrevio a comenzar la inmunización se colectaron los huevos de las gallinas, los que fueron usados como muestras preinmunización (control negativo). Se conformaron dos lotes de animales: Lote B1 constituido por tres gallinas que fueron inmunizadas con EPF sintético. Lote B2 constituido por tres gallinas que fueron inmunizadas con EPF aislado de suero de cerda de 7 días de gestación por SDS-PAGE (banda de 29kDa).
Se realizaron 3 inmunizaciones con intervalo de 30 días por vía i.m. en múltiples sitios en el músculo pectoral, se aplicó 0,5ml de solución antigénica (10μg/ml en AFC).
Se recolectaron los huevos diariamente a partir de los 10 días de la última inmunización y por 30 días, se marcaron para la identificación y se conservaron a 4°C.
Purificación de los anticuerposAnticuerpos mamíferos (IgG anti-EPF)Los anticuerpos IgG mamíferos anti-EPF fueron purificados del suero de conejo por precipitación salina con sulfato de amonio(17). Se mezcló un volumen de suero con 1 volumen de solución saturada de sulfato de amonio (760g de (NH4)2SO4/l, pH 7) y se centrifugó a 1.500 xg durante 30min. Al precipitado se le agregó agua hasta la mitad del volumen inicial y se adicionó 1 volumen de solución de sulfato de amonio preparada mezclando 2/3 de solución saturada con 1/3 de agua destilada. Se centrifugó a 1.500 xg durante 30min y se repitió el paso anterior 4 veces. El precipitado se disolvió en PBS pH 7,2 en un volumen igual al inicialmente tomado del suero. Esta solución fue dializada contra NaCl 0,15M para eliminar totalmente la sal.
Anticuerpos aviarios (IgY anti-EPF)Los anticuerpos IgY aviarios anti-EPF fueron purificados de la yema del huevo por el método combinado de sulfato de amonio, ácido caprílico y polietilenglicol (PEG) 6000(18). Se separaron las yemas de los huevos, se colocaron en un vaso de precipitado y se pesaron las yemas (1g=1ml). Se agregaron 2 volúmenes de PBS pH 7,4 en agitación y lentamente 3,5% (P/V) de PEG 6.000. Se centrifugó a 10.000 xg durante 20min. Se recuperó el sobrenadante y se ajustó a pH 5,5 con ácido acético 1M. Se agregó gota a gota 6% (V/V) de ácido caprílico y se agitó durante 30min. Se agregó el sulfato de amonio sólido hasta una concentración final de 40% (P/V) y se agitó por 6 horas a 4°C y centrifugó a 10.000 xg durante 20min a 4°C. Se disolvió el precipitado en PBS pH 7,2 en un volumen igual al inicialmente tomado de yema y se dializó contra PBS 0,5x durante toda la noche a 4°C.
Medición de proteínas en los extractos purificadosLuego de realizada la purificación de las inmunoglobulinas (IgG o IgY) se realizó la medición de proteínas utilizando el Método de Bradford(19) realizando una curva estándar con albúmina sérica bovina (Sigma®, A-7030). Se analizaron los sueros y las yemas correspondientes a los 4 lotes de animales conformados, y además, se analizaron los sueros y las yemas tomadas previo a las inmunizaciones, las que se tomaron como controles negativos.
Análisis estadísticoLos valores de proteínas fueron analizados por un estudio paramétrico usando una Prueba "t" de Student comparando la concentración de proteínas de cada lote de anticuerpos con su control negativo. Para ello se utilizó el Software Statistica® 6,0" para Windows (Stafsoft Inc., Tulsa, Oklahoma, USA) provisto por el Dpto. de Matemáticas, Facultad de Ciencias Exactas, Fco-Qcas y Naturales, UNRC (N° de serie: ABA11113362827d60). Los valores de p≤0,05 se consideraron significativos.
Evaluación de la especificidad de los anticuerposPrevio a realizar las técnicas de inmunodetección se titularon los anticuerpos de los diferentes lotes (A1, A2, B1, B2) para determinar la mejor dilución de trabajo. Para ellos se realizó la técnica de Western Blot y Dot Blot probando las siguientes diluciones: 1:10, 1:50, 1:100, 1:500, 1:1000. Se determinó que la dilución adecuada de trabajo sería 1:100 para los lotes A1 y A2 y 1:50 para el lote B2. Para el lote B1 se probaron además diluciones 1:2, 1:5 e inclusive utilizando el anticuerpo puro, en ningún caso se encontró marcación alguna de la proteína de interés.
Dot BlotSe sembró 1,5μl de suero de cerdas no preñadas, preñadas de 10, 30, 60, 90 días de gestación y suero de macho en una membrana de polivinilfluoruro (PVDF) previamente activada con metanol y bloqueada con leche descremada al 10% en solución tampón Tris salino. Se incubó con el anticuerpo primario (IgG anti-EPF mamífero: 1/100 o IgY anti-EPF aviario: 1/50) durante 60min a temperatura ambiente en agitación. Luego de tres lavados con solución tampón Tris salino con 0,1% de Tween 20 se incubó con el correspondiente anticuerpo secundario (anti-IgG de conejo desarrollado en cabra marcado con Peroxidasa Sigma® A6154 en dilución 1:1000 o Ac anti-IgY desarrollado en conejo marcado con Peroxidasa Sigma® A9046 en dilución 1:1000) durante 30min a temperatura ambiente en agitación. Posteriormente se realizaron nuevamente tres lavados similares a los anteriores y se incubó con Diaminobenzidina preparado según especificaciones del fabricante (3,3'-diaminobenzidina DAB FastTM Tabletas, Sigma® D4418) hasta que se visualizaron los puntos. Se enjuagó la membrana minuciosamente en agua bi-destilada para detener la reacción
Western BlotSe corrieron muestras de sueros de cerdas no preñadas, preñadas de 10, 30, 60, 90 días de gestación y sueros de machos en SDS-PAGE en condiciones desnaturalizantes sobre un gel de 12,5% hasta finalizar la corrida según la metodología Laemmli(16). Se sembraron 10μg de proteína total por calle diluidas en tampón muestra 2x en presencia de agentes reductores. Se utilizó un marcador de peso molecular para proteína de amplio rango de 17 a 245 kD (Roti®-Mark PRESTAINED). Se retiró el gel y se transfirió a una membrana de PVDF previamente activada con metanol y equilibrada con solución tampón de transferencia por 15min. Se incubó con el anticuerpo primario (IgG anti-EPF mamífero: 1/100 o IgY anti-EPF aviario: 1/50) diluido en solución de bloqueo (solución tampón Tris salino con leche descremada al 10%) toda la noche a 4°C. Luego de tres lavados con solución tampón Tris salino con 0,1% de Tween 20 se incubó con el anticuerpo secundario correspondiente (anti-IgG de conejo desarrollado en cabra marcado con Peroxidasa, Sigma® A6154 en dilución 1:1000 o anti-IgY desarrollado en conejo marcado con Peroxidasa, Sigma® A9046 en dilución 1:1000) durante 90min a temperatura ambiente. Posteriormente se realizaron nuevamente tres lavados similares a los anteriores y se incubó con el sustrato de la enzima (3,3'-diaminobenzidina DAB FastTM Tabletas, Sigma® D4418) hasta que se visualizaron las bandas. Se enjuagó la membrana minuciosamente en agua bi-destilada para detener la reacción.
Además, se evaluó la especificidad de los anticuerpos secundarios utilizados en las técnicas de inmunoblot. Se realizó la técnica en iguales condiciones a las descritas pero incubando la membrana solamente con el Ac secundario a evaluar: Anti-IgY conjugado con Peroxidasa (Sigma® A9046, dilución 1:1.000) y Anti-IgG de conejo conjugado con Peroxidasa (Sigma® A6154, dilución 1:1.000).
RESULTADOSNiveles proteicos en los extractos purificadosEn la Tabla I se presenta la concentración promedio de proteínas encontradas en los purificados de sueros y yemas
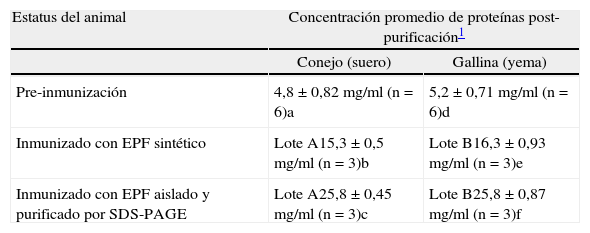
Concentración promedio de proteínas en los purificados de sueros y yemas pre y post inmunización
| Estatus del animal | Concentración promedio de proteínas post-purificación1 | |
| Conejo (suero) | Gallina (yema) | |
| Pre-inmunización | 4,8±0,82mg/ml (n=6)a | 5,2±0,71mg/ml (n=6)d |
| Inmunizado con EPF sintético | Lote A15,3±0,5mg/ml (n=3)b | Lote B16,3±0,93mg/ml (n=3)e |
| Inmunizado con EPF aislado y purificado por SDS-PAGE | Lote A25,8±0,45mg/ml (n=3)c | Lote B25,8 ±0,87mg/ml (n=3)f |
obtenidas de los animales inmunizados y no inmunizados (controles negativos). Tanto en el caso de conejos como en las gallinas no se encontraron diferencias significativas en la concentración de proteínas pre y post-inmunización. En los conejos, el promedio de proteínas encontrado en el purificado proteico, luego de la precipitación con sulfato de amonio, fue levemente superior en ambos lotes postinmunización en comparación con el control negativo (animal no inmunizado). Esta diferencia no fue estadísticamente significativa. En el caso de las gallinas, los niveles proteicos encontrados en los purificados de yema post-inmunización fueron levemente mayores con respecto al control negativo, pero estos aumentos no tuvieron significancia estadística.
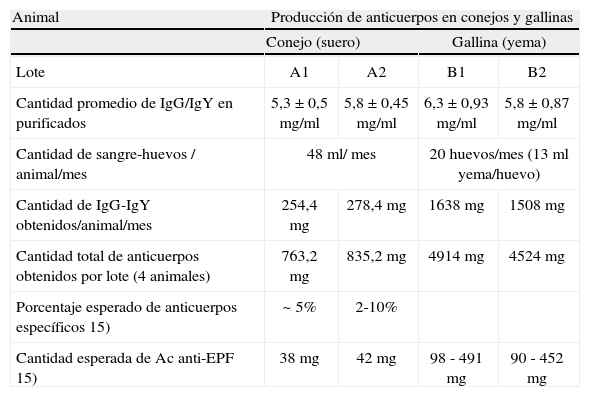
En la Tabla II se muestra que el rendimiento de anticuerpos específicos anti-EPF producidos por el total de los animales correspondientes a los diferentes lotes en un período de un mes fue aproximadamente siete veces mayor en gallinas comparadas con mamíferos.
Comparación del rendimiento de anticuerpos por lote de gallinas y conejos
| Animal | Producción de anticuerpos en conejos y gallinas | |||
| Conejo (suero) | Gallina (yema) | |||
| Lote | A1 | A2 | B1 | B2 |
| Cantidad promedio de IgG/IgY en purificados | 5,3±0,5mg/ml | 5,8±0,45mg/ml | 6,3±0,93mg/ml | 5,8±0,87mg/ml |
| Cantidad de sangre-huevos / animal/mes | 48ml/ mes | 20 huevos/mes (13ml yema/huevo) | ||
| Cantidad de IgG-IgY obtenidos/animal/mes | 254,4mg | 278,4mg | 1638mg | 1508mg |
| Cantidad total de anticuerpos obtenidos por lote (4 animales) | 763,2mg | 835,2mg | 4914mg | 4524mg |
| Porcentaje esperado de anticuerpos específicos 15) | ~ 5% | 2-10% | ||
| Cantidad esperada de Ac anti-EPF 15) | 38mg | 42mg | 98 - 491mg | 90 - 452mg |
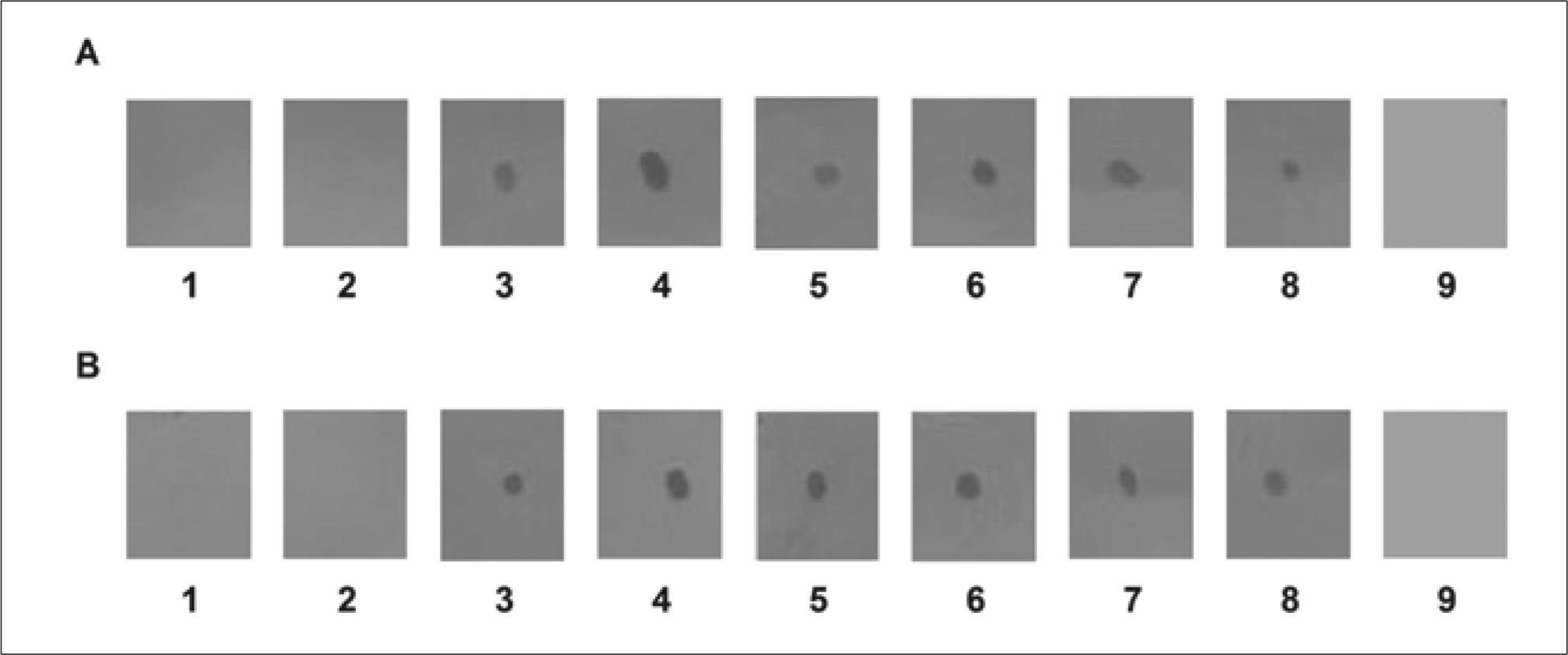
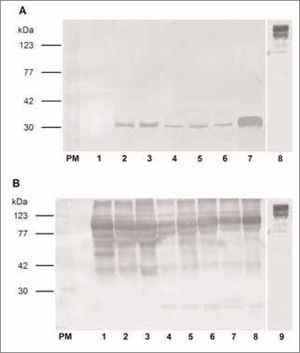
Tanto el lote A1 de anticuerpos IgG anti-EPF proveniente de los conejos inmunizados con el péptido sintético (Fig. 1A), como el lote A2 proveniente de los conejos inmunizados con la banda de gel de poliacrilamida de 29kDa (Fig. 1B), mostraron una especificidad satisfactoria mediante Dot Blot en las muestras de suero de cerdas de 10, 30, 60 y 90 días de gestación, no detectando la proteína en la muestra de suero de macho ni en la de hembra no preñada. El control de especificidad del anticuerpo secundario no mostró marcación.
Análisis de sueros de conejo anti-EPF por "Dot Blot". Dot Blot de suero de macho (1), suero de cerda no preñada (2), suero de cerda de 10 (3-4), de 30 (5-6), de 60 (7) y de 90 días de preñez (8). Control de Ac secundario anti-IgG de conejo conjugado con Peroxidasa-Sigma® A6154 (9). A. Se utilizó como primer Ac IgG de conejo anti-péptido EPF proveniente del lote A1 (Anti-EPF sintético) en una dilución 1/100. B. Se utilizó como primer Ac IgG de conejo anti- banda de SDS-PAGE correspondiente a EPF proveniente del lote A2 (Anti-EPF aislado) en una dilución 1/100. Los resultados que se muestran son representativos de cuatro experimentos independientes.
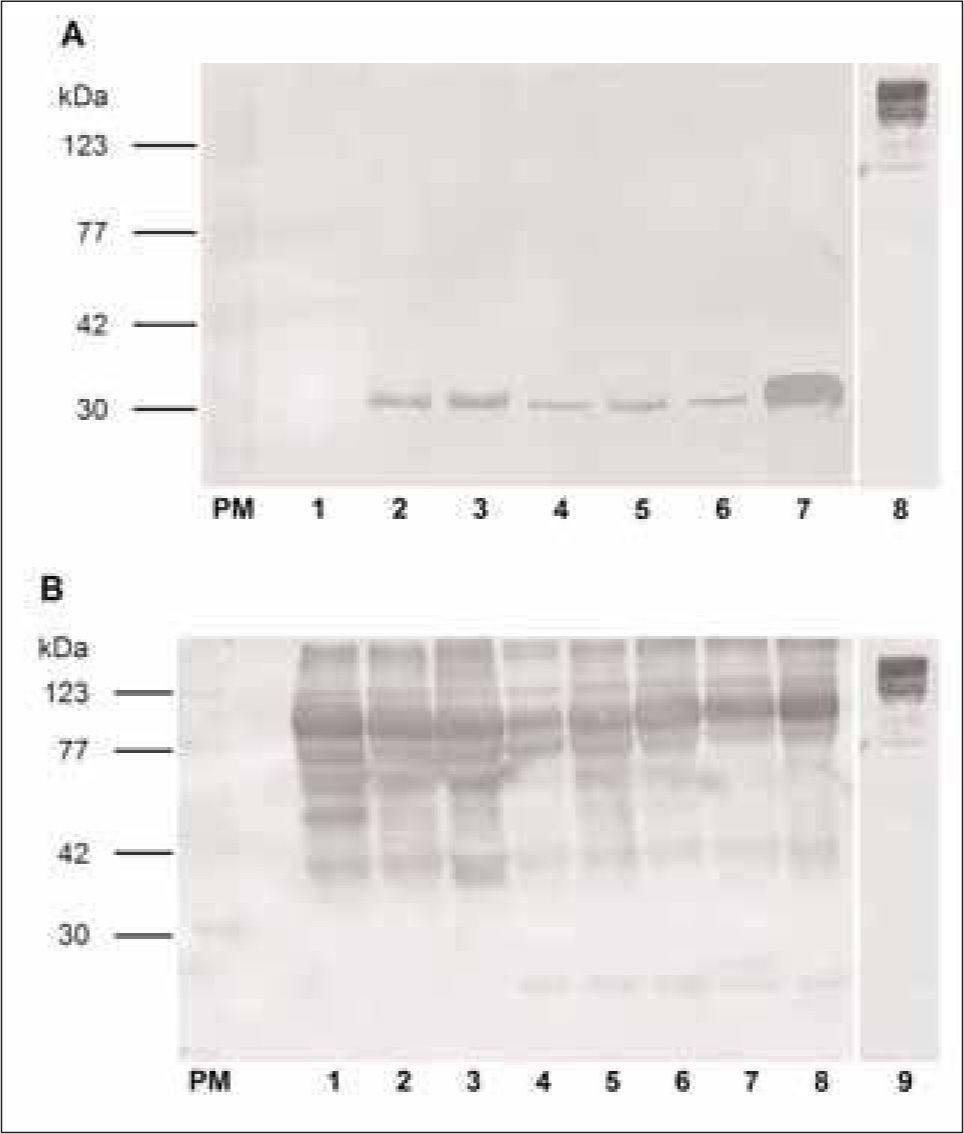
En la técnica de Western Blot, el lote de anticuerpos anti-EPF proveniente de conejo inmunizado con el péptido sintético (A1) presentó la aparición de una banda de 29kDa en los sueros de las cerdas preñadas y no así en el suero de cerdas no preñadas. Con este anticuerpo se encontró una mayor señal en el suero correspondiente a 90 días de gestación (Fig. 2A).
Análisis de sueros de conejo anti-EPF por "inmunoblot" frente a proteínas de suero procino. A. Western Blot de suero de cerda no preñada (1), suero de cerda de 10 (2,3), de 30 (4), 60 (5,6) y de 90 días de preñez (7). Control de Ac secundario anti-IgG de conejo conjugado con PeroxidasaSigma® A6154 (8). Se utilizó como primer Ac IgG de conejo anti-péptido EPF proveniente del lote A1 (Anti-EPF sintético) en una dilución 1/100. B. Western Blot de suero de cerdas no preñadas (1,2,3), de 10 (4,5), de 30 (6), de 60 (7) y de 90 días de preñez (8). Control de Ac secundario anti-IgG de conejo conjugado con Peroxidasa -Sigma® A6154 (9). Se utilizó como primer Ac IgG de conejo anti- banda de SDS-PAGE correspondiente a EPF proveniente del lote A2 (Anti-EPF aislado) en una dilución 1/100. PM: Estándares de pesos moleculares conocidos. Los resultados que se muestran son representativos de cuatro experimentos independientes.
Por otra parte, el Western Blot realizado con el lote de anticuerpos IgG anti-EPF provenientes de conejos inmunizados con la banda de gel de poliacrilamida (A2) reveló una serie de bandas de diferentes pesos moleculares además de la banda de interés (29kDa), la cual aparece en los sueros de cerdas de 10, 30, 60 y 90 días de gestación y no en los sueros de las cerdas no preñadas (Fig. 2B).
Cuando se realizó el ensayo de control de la especificidad del anticuerpo secundario Anti-IgG de conejo conjugado con Peroxidasa (Sigma® A6154) mostró una baja especificidad ya que presentó uniones inespecíficas en la zona de proteínas de alto peso molecular aproximadamente entre 245 y 123kDa (Fig. 1 y 1B).
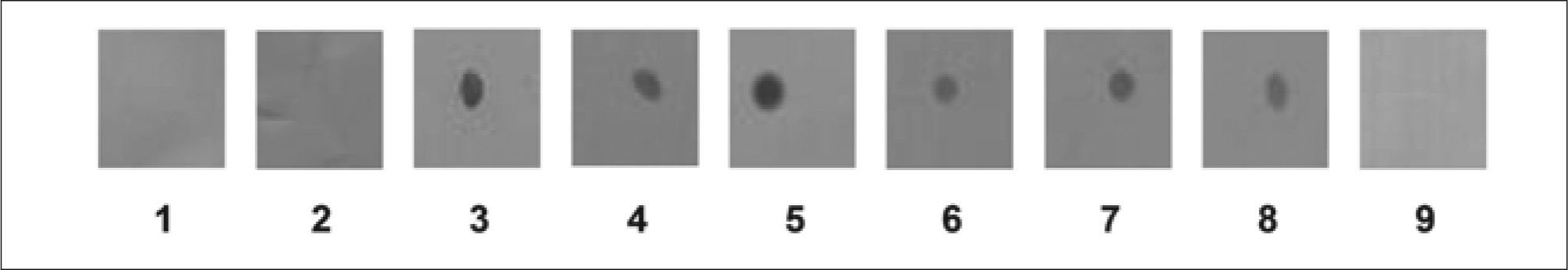
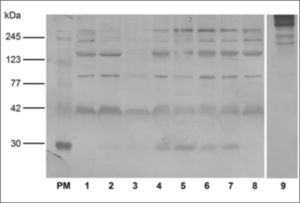
Evaluación de la especificidad de anticuerpos policlonales aviarios (IgY) anti-EPFEl lote de anticuerpos IgY anti-EPF obtenidos al inmunizar las gallinas con el EPF aislado y purificado a partir de suero de 7 días de gestación por SDS-PAGE (B2) en Dot Blot reveló marcación positiva para los sueros de cerdas de 10, 30, 60 y 90 días de gestación, y negativa para el suero de cerda no preñada (Fig. 3). El control de especificidad del anticuerpo secundario no mostró marcación.
Dot Blot de suero de macho (1), suero de cerda no preñada (2), suero de cerda de 10 (3-4), de 30 (5-6), de 60 (7) y de 90 días de preñez (8). Control de especificidad del Ac secundario anti-IgY marcado con Peroxidasa -Sigma® A9046 (9). Se utilizó como primer Ac IgY de gallina anti-banda de SDSPAGE correspondiente a EPF proveniente del lote B2 (Anti-EPF aislado) en una dilución 1/50. El resultado que se muestra es representativo de cuatro experimentos independientes.
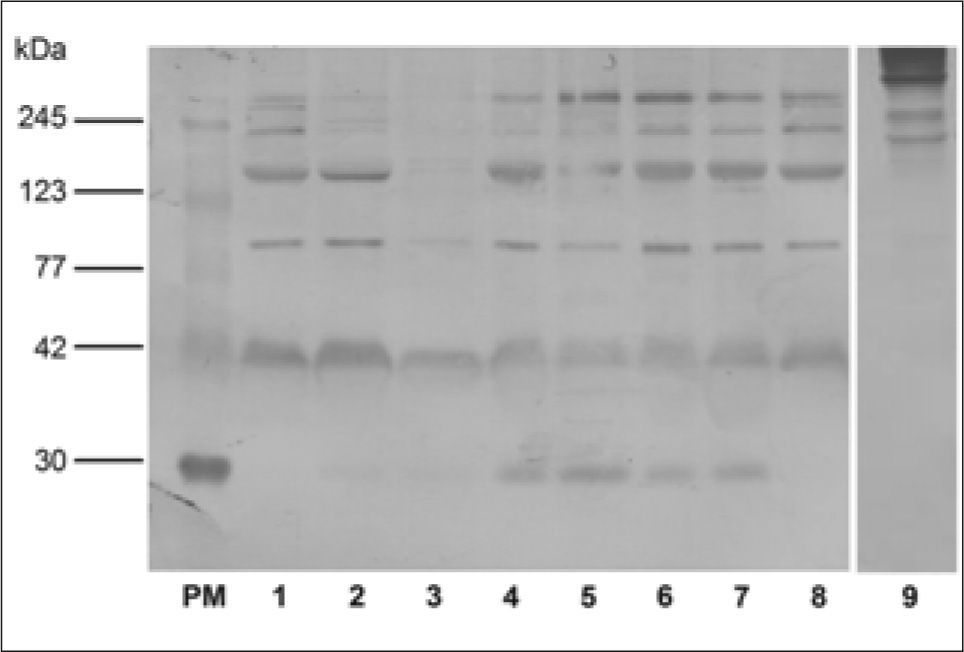
Cuando se realizó la inmunotrasferencia empleando este lote de anticuerpos (B2) se vio que, si bien presentó marcación de la banda correspondiente a los 29kDa en los sueros de cerdas preñadas (10, 30, 60 y 90 días), también presentó marcación inespecífica en la zona de pesos moleculares altos, medios y bajos (245 a 42kDa) en todas las muestras de sueros (Fig. 4).
Inmunoblot de proteínas de suero de cerda no preñada (1), suero de cerdas de 10 (2-3), de 30 (4), de 60 (5) y de 90 días de preñez (6-7) y suero de macho (8). Control de especificidad del Ac secundario anti-IgY conjugado con Peroxidasa Sigma® A9046 (9). PM: Estándares de pesos moleculares conocidos. Se utilizó como primer Ac IgY de gallina antibanda de SDS- PAGE correspondiente a EPF proveniente del lote B2 (Anti-EPF aislado) en una dilución 1/50. El resultado que se muestra es representativo de cuatro experimentos independientes.
Los anticuerpos provenientes de gallinas pertenecientes al lote inmunizado con el péptido sintético del EPF (B1) en ningún caso presentaron títulos suficientes de especificidad anti-EPF (datos no mostrados).
El ensayo de control de la especificidad del anticuerpo secundario Anti-IgY de gallina conjugado con Peroxidasa mostró una baja especificidad ya que presentó uniones inespecíficas en la zona de alto peso molecular aproximadamente entre 245 y 123kDa (Fig. 4).
DISCUSIÓNEn este trabajo nos propusimos desarrollar anticuerpos anti-EPF del tipo policlonal ya que en la bibliografía están descriptos varios intentos por desarrollar anticuerpos monoclonales, todos infructuosos(20). El Factor Precoz de Preñez es una proteína secretada durante las primeras etapas de la gestación, con propiedades reguladoras del crecimiento e inmunomoduladoras que constituye un marcador sérico de fertilización(3). Estudios in vitro indican que el EPF es secretado durante el crecimiento y la división de células normales, transformadas y neoplásicas(7). Se ha propuesto que actuaría como un factor de crecimiento autócrino para las células tumorales y un factor autócrino y parácrino para el crecimiento de células normales. Por lo tanto, los
hibridomas y mielomas producen EPF y requieren la presencia de éste para crecer. Por este motivo los intentos por desarrollar anticuerpos monoclonales anti-EPF han acarreado complicaciones dado que los anticuerpos anti-EPF secretados neutralizan el EPF producido por los propios hibridomas, causando la sobrevida sólo de aquellos hibridomas que producen anticuerpos anti-EPF débilmente neutralizantes. Sólo se consiguieron purificar anticuerpos monoclonales de baja afinidad del tipo IgMs y los hibridomas que los produjeron fueron muy inestables(7).
La obtención de anticuerpos policlonales anti-EPF resulta ser efectiva utilizando conejos y gallinas. El uso de gallinas se puede tomar como una alternativa interesante en la producción de anticuerpos policlonales por los bajos costos y porque evita en parte las manipulaciones invasivas y logra así una mejora en el bienestar animal, ya que se obtiene una gran cantidad de anticuerpos policlonales específicos a partir de la yema de huevo(10,18,21,22). Esta metodología está siendo muy estudiada y utilizada, no sólo en pruebas diagnósticas sino también como medida terapéutica y profiláctica(12,13,23,24).
En el caso de los conejos, los anticuerpos obtenidos si bien presentaron una mayor especificidad su rendimiento fue significativamente menor.
En los conejos se utilizó un esquema de inmunización convencional que constó de 5 dosis, inoculando un total de 50 ^g de antígeno empleando un total de 127 días, en el que se aplicó la primera dosis intramuscular y las restantes subcutáneas. Se encontraron anticuerpos contra EPF porcino a los 97 días posteriores al comienzo del esquema de inmunización, sin embargo la óptima concentración se halló a los 127 días.
El esquema de inmunización empleado en las gallinas fue de 90 días, en el que se aplicaron 3 dosis intramusculares con un total de antígeno de 15μg. En este caso se encontraron anticuerpos específicos contra EPF porcino a partir del día 90 post-inoculación; sin embargo sólo se encontró un título satisfactorio de anticuerpos en el lote inmunizado con el EPF aislado y purificado por SDS-PAGE (lote B2). Diferentes métodos de inmunización aplicados en gallinas han sido descritos en la bibliografía: intramuscular(25), intrabursal subcutáneo y oral, como también se ha reportado que las aves sufren inflamaciones y desarrollan granulomas en las áreas de inoculación(26). La vía de inoculación aplicada a las gallinas en este estudio (i.m.) no causó ningún malestar, ni proceso inflamatorio, debido a que se empleó un volumen por dosis y concentración de antígeno moderadamente bajo para la especie, resultado que fue congruente con hallazgos previos(27).
Como medida de la producción de anticuerpos (rendimiento) se valoraron los niveles proteicos en los sueros y en las yemas luego de la purificación de las IgG o las IgY respectivamente. Se encontró que en ambos lotes de conejos, inmunizados con EPF sintético y con EPF aislado y purificado por SDS-PAGE, los niveles de proteínas fueron 5,3±0,5mg/ml y 5,8±0,45mg/ml. Si bien estos valores fueron levemente superiores a los encontrados en los sueros obtenidos previo a las inmunizaciones (4,8±0,82mg/ml) estos valores no mostraron diferencia significativa.
Por otro lado, en el caso de las gallinas, el lote inmunizado con el EPF sintético presentó una concentración levemente superior de proteínas (6,3±0,93mg/ml) en el purificado de las yemas en comparación al promedio de proteínas en el purificado de yemas previas a la inmunización (5,2±0,71mg/ml). También se encontró un aumento de proteínas, pero en menor medida, en el lote inmunizado con EPF aislado y purificado por SDS-PAGE (5,8±0,87mg/ml). En todos los casos esta diferencia no fue estadísticamente significativa. Todos estos hallazgos tienen concordancia con los datos encontrados en la bibliografía que describen que el aumento de la fracción correspondiente a las IgG postinmunización es insignificante(11,28).
Cuando se comparó el rendimiento de anticuerpos específicos anti-EPF obtenidos en el total de animales de los diferentes lotes utilizados en un período de un mes, se pudo observar que usando gallinas se obtiene una cantidad mucho mayor de anticuerpos. Este hecho nos lleva a confirmar lo descrito en numerosa bibliografía en relación a que una gallina es capaz de producir cantidades de anticuerpo semejantes a un animal mayor (cabra u oveja) pero con el costo de mantenimiento similar a un conejo(7,20,29).
Al evaluar la especificidad de estos anticuerpos por técnicas de inmunodetección los resultados indican que los anticuerpos policlonales de tipo IgG desarrollados en conejos inmunizados con el EPF sintético fueron los de mayor especificidad ya que al ser utilizados en técnicas de Western Blot revelan la presencia del factor en los sueros de cerdas de diferentes días de gestación y no en los sueros de cerdas no preñadas y machos (controles negativos). El alto grado de pureza del péptido sintético utilizado en el esquema de inmunización permitió que los anticuerpos obtenidos no presentaran reactividad cruzada contra otras proteínas presentes en los sueros, lo que se pudo evidenciar mediante la técnica de Western Blot, pues sólo una banda es reconocida por el anticuerpo, la cual se corresponde con el peso molecular del EPF porcino. Al presentar mayor especificidad este anticuerpo logró detectar mayor concentración de EPF en los sueros provenientes de 90 días de gestación. Este aumento de señal de EPF a los 90 días de gestación está en concordancia con un segundo pico encontrado al realizar la técnica RIT a diferentes períodos de gestación en cerdos(5). Esta mayor concentración se debe probablemente al crecimiento exponencial de los fetos en el último tercio de gestación y a la funcionalidad del EPF como factor de crecimiento en este período(30).
En cambio, los anticuerpos obtenidos en conejos y gallinas inmunizadas con la banda del gel de poliacrilamida correspondiente al peso molecular del EPF al ser usados como primer anticuerpo en técnicas de inmunotransferencia dan como resultado la aparición de una serie de bandas correspondientes a altos pesos moleculares, además de la correspondiente al factor en estudio (29kDa). Si bien se ve una falta de especificidad en estos dos lotes de anticuerpos, en ambos casos los anticuerpos producen la marcación del EPF en los sueros provenientes de cerdas preñadas y no así en los controles negativos (cerdas vacías y machos). O sea que, si bien el rendimiento de estos lotes de anticuerpos fue aceptable, la falta de especificidad de los anticuerpos debió ser analizada. Es conocido que el uso de la banda del gel de poliacrilamida (SDS-PAGE) como inmunógeno induce una buena respuesta de anticuerpos, pero debido a que el antígeno purificado por SDS-PAGE es desnaturalizado durante el método de preparación de la muestra, los anticuerpos resultantes a menudo no se unen de una forma adecuada al antígeno en forma nativa(10). Además, al utilizar esta metodología se describe otra desventaja, al cortar la banda del gel que contiene la proteína de interés generalmente se incorporan otras proteínas que están muy próximas a la banda primaria en los geles de SDS-PAGE y por lo tanto, se aplican al animal antígenos innecesarios. Esto indica que los antígenos obtenidos por geles de SDS-PAGE no tienen la suficiente pureza(31). Por lo tanto, la falta de especificidad de estos anticuerpos podría deberse al inmunógeno utilizado, ya que una gran cantidad de factores de crecimiento y citocinas tienen un peso molecular alrededor de los 30kDa.
En los ensayos realizados para evaluar la especificidad de los anticuerpos secundarios se pudo observar que producen uniones inespecíficas en la zona de alto peso molecular. El hecho de que esta inespecificidad no se haya hecho visible en Dot Blot se debe probablemente a que ésta es una técnica de menor sensibilidad (prueba tamiz). En cambio, el Western Blot presenta mayor sensibilidad dado que las proteínas son separadas previamente a la incubación con el anticuerpo primario. Por otro lado, en la técnica de Western Blot las incubaciones con el anticuerpo primario se realizaron a 4°C durante toda la noche, dando de esta manera una unión más fuerte y estable. En cambio, al realizar la técnica de Dot Blot el anticuerpo primario fue incubado a temperatura ambiente durante 60 minutos. Estos mismos factores (tiempo, temperatura y menor sensibilidad) podrían explicar el hecho que al realizar el control de especificidad de los anticuerpos secundarios éstos no presentaron marcación inespecífica en el Dot Blot, en ningún caso. Consecuentemente, las uniones inespecíficas (245 y 123kDa) que presentaron los anticuerpos provenientes de los lotes de animales inmunizados con la banda del gel de poliacrilamida se puede atribuir a estas reacciones inespecíficas de los anticuerpos secundarios. El lote de gallinas inmunizadas con el péptido sintético del EPF no tuvo títulos suficientes de anticuerpos específicos anti-EPF.
Como conclusión podríamos decir que para la obtención de anticuerpos anti-EPF, utilizados posteriormente para la detección del EPF a partir de suero de cerdas, el péptido sintético induce la producción de anticuerpos más específicos cuando son desarrollados en conejos. También se podría concluir que la utilización de la banda de 29kDa proveniente del gel de poliacrilamida como inmunógeno no es adecuada ya que, si bien produce anticuerpos capaces de detectar la proteína de interés, éstos son de baja especificidad.
AGRADECIMIENTOSFinanciado por FONCYT 08-09155, SECYT-UNRC, CONICET (Argentina), Proyecto de Cooperación Bilateral en Ciencia y Tecnología Argentina Alemania (SECYTArgentina/BMBF -Alemania AL/PA BIO 14-ARG 01/19).
CONFLICTO DE INTERÉSLos autores declaran no tener conflicto de interés.