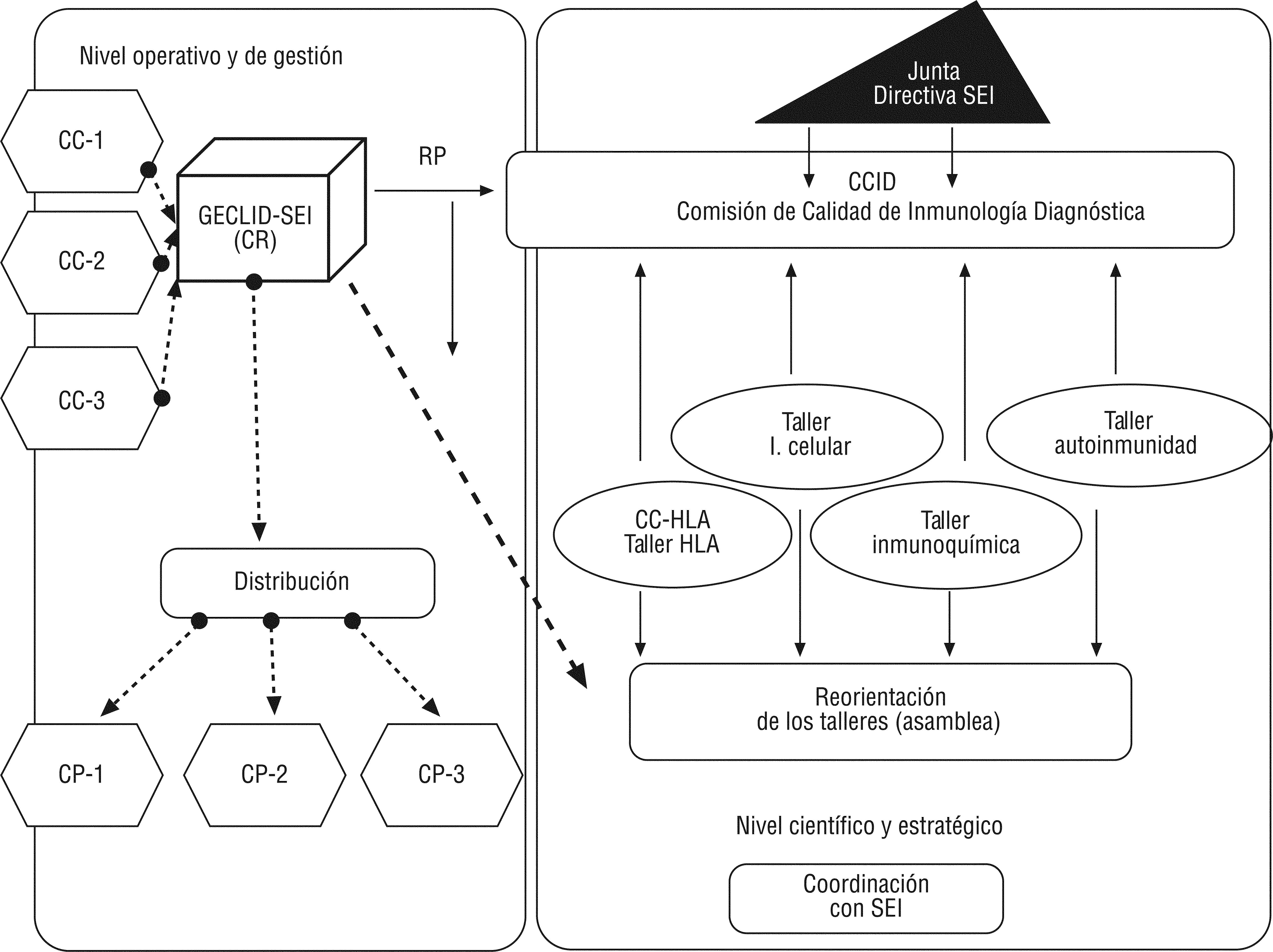
El programa de Garantía Externa de Calidad para Laboratorios de Inmunología Diagnóstica-Sociedad Española de Inmunología (GECLID-SEI) se ha desarrollado a propuesta de la Junta Directiva de la SEI tras su aprobación en asamblea general1. Esto supone un salto evolutivo respecto al funcionamiento tradicional de los talleres de la SEI, que se han desarrollado durante los últimos 20 años como verdaderas herramientas de intercomparación analítica entre laboratorios. Éste es el primer programa que nace en España para la provisión de garantía externa de calidad dirigida a laboratorios de inmunología. Esta iniciativa de la SEI es también importante a nivel internacional, dado que hay muy pocos programas de intercomparaciones que cubran todos los aspectos de la inmunología: autoinmunidad, inmunoquímica e inmunoalergia, inmunología celular, histocompatibilidad e inmunogenética.
El programa nace con el objetivo de ser un proveedor de servicios internacional: para ello, la Junta Directiva de la SEI promoverá GECLID-SEI en sociedades nacionales e internacionales de intereses afines. Cuanto mayor sea el número de participantes, más eficiente será el sistema de intercomparaciones y permitirá análisis por subgrupos de laboratorios (según su técnica diagnóstica y/o equipo analizador).
Además, en los últimos años, los programas de intercomparación (EQA, del inglés External Quality Assessment) han evolucionado hacia programas de garantía externa de la calidad (EQAP, del inglés External Quality Assurance Program). Este salto supone no sólo proveer a los laboratorios con ejercicios de intercomparación, sino también ayudarles en los procesos preanalíticos y postanalíticos, así como brindarles herramientas de formación continuada (tanto en aspectos puramente técnicos, como en la elaboración de informes diagnósticos). GECLID-SEI nace con el objetivo de ser un EQAP de excelencia.
Panorama nacional e internacional en garantía de calidadNo podemos perder de vista la situación real a la que nos enfrentamos al ofertar un EQAP. Hay una seria y clara competencia en este campo. En el ámbito que se ha desarrollado más y con más trayectoria es en bioquímica clínica. En este sector, hay proveedores de calidad externa tanto públicos como privados. En el ámbito internacional, está controlado por las empresas privadas: así, el programa RIQAS (de la empresa Randox) tiene más de 16.000 laboratorios inscritos en todo el mundo en sus programas de calidad2. El segundo programa con más participantes (más de 3.000 usuarios) es el programa UNITY (de la empresa Bio-Rad) implantado en más de 90 países3 que, a diferencia de RIQAS, oferta un subprograma de autoinmunidad. Por último, dentro de los programas privados, cabe destacar el programa PREVECAL (de la empresa BioSystems), por ser de producción nacional y tener más de 3.000 usuarios de 34 países4. PREVECAL tiene una implantación amplia en Sudamérica, África, Asia y Europa Oriental, y recientemente ha incorporado en su cartera de servicios un programa de autoinmunidad.
De la parte de programas de garantía de calidad públicos, también hay una importante oferta en Europa. Quizás el más conocido en nuestro ámbito es UK-NEQAS, pero hay otros, como el programa VEQ (con sede en Italia), el programa LAB-Quality (Finlandia) y el programa EQUALY (Suecia).
UK-NEQAS surge en 1969 inicialmente para dar servicio a laboratorios del Reino Unido5. En la actualidad dan servicio a más de 8.000 laboratorios de más de 100 países. Cubren todos los subprogramas que tiene que desarrollar GECLID-SEI: autoinmunidad, inmunoquímica y alergia, histocompatibilidad e inmunología celular. En cualquier caso, cabe resaltar que este programa, a diferencia de GECLID-SEI, no incluye ninguna prueba de función celular.
El programa VEQ está organizado por un consorcio de instituciones hospitalarias y universitarias de Bolonia (Italia)6. Tiene una historia de 20 años, y recientemente se ha incorporado a un grupo intercolaborativo de programas de garantía de calidad en América, Australia, África y Europa, junto con la empresa americana DigitalPT, que ha desarrollado un software basado en web para el análisis de los diferentes programas de calidad. Aunque no aporta datos de participación, tiene esquemas de estandarización en inmunoquímica, autoinmunidad, alergia, citometría de flujo e inmunohematología.
En LAB-Quality, fundado en 19717, participan al menos 4.000 laboratorios de 38 países diferentes. Tienen una plantilla de 23 miembros, un panel de expertos con más de 100 personas y consiguen muestras de 19 centros hospitalarios. Están fundamentalmente centrados en química clínica, pero ofertan un esquema de pruebas reumáticas (que incluye factor reumatoide y anticuerpos antipéptidos citrulinados).
De modo similar, en Suecia también hay un programa nacional denominado EQUALY8. Tienen un panel de inmunología clínica con algunos parámetros de autoinmunidad, inmunidad celular e inmunoquímica. Es una compañía nacida en 1992, sin ánimo de lucro, y formada por un consorcio entre una empresa privada y 2 sociedades médicas.
De modo que hay una red europea en la que todos los laboratorios que ofertan EQAP están asociados, tienen grupos de trabajo y realizan reuniones anuales para mejorar la oferta de programas de calidad, así como estandarizar procedimientos en el contexto de la garantía externa de calidad. Se trata de la Comisión EQALM (del inglés European Committee for External Quality Assurance Programs in Laboratory Medicine)9.
Por último, no podemos olvidar la situación del panorama nacional. La Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC)10 es una sociedad con dilatada experiencia en calidad, en concreto con 30 años de programas de calidad en el área de bioquímica clínica, en los que en la actualidad participan cerca de 2.000 laboratorios. Hace unos años ha incorporado a su oferta un programa específico de autoinmunidad y alergia, en consorcio con UK-NEQAS, en el que en estos momentos están participando más de 100 laboratorios españoles (en el esquema de anticuerpos antinucleares), lo que supone aproximadamente un 17 % de todos los participantes en el esquema NEQAS. También solaparíamos con la SEQC en el subprograma de inmunoquímica (puesto que en su esquema de proteínas hay cuantificación de inmunoglobulinas, por ejemplo).
Asimismo, la Asociación Española de Hematología y Hemoterapia (AEHH) tiene una larga trayectoria en este campo11, la cual tiene su laboratorio de garantía externa de calidad ubicado en el Hospital Clínic de Barcelona. En concreto, no tendríamos solapamientos con los esquemas de calidad que ofertan, ya que no tienen ninguno actualmente basado en citometría de flujo (ni para subpoblaciones linfocitarias, ni para el fenotipado de leucemias/linfomas).
La necesidad de participar en programas de intercomparación externos no está tan arraigada en España como lo está en otros países europeos, al menos en la especialidad de inmunología. Por otra parte, no hay ningún organismo oficial (y la SEI sólo puede recomendar, nunca obligar) que obligue a los laboratorios a acreditarse/certificarse o a participar en programas anuales de garantía externa de calidad. La única excepción es el Servicio Andaluz de Salud, que de modo anual convoca concursos para que todos los laboratorios públicos de su red participen en estos programas.
La mayor parte de los laboratorios asociados a la SEI han participado durante un número variable de años en los talleres de la SEI, donde llegaban unas muestras de modo gratuito. Cada laboratorio sabe más o menos cuál ha sido su acierto o error en cada determinación, pero no tienen un certificado de su participación y/o calidad emitido por un tercero. Claramente, hay que romper esta dinámica, pues la viabilidad del proyecto depende de que se llegue a una N de participantes en cada esquema lo suficientemente elevada para que los resultados globales sean óptimos. Pero éste no es el único reto. Habrá que convencer a los laboratorios que están participando ya en diferentes programas de garantía de calidad de que migren al programa GECLID-SEI. No tenemos trayectoria (fuera de la ya mencionada en los 4 talleres de intercomparación que llevan funcionando los últimos años), y mientras no tengamos los primeros resultados, no habrá tampoco excelencia contrastada del programa.
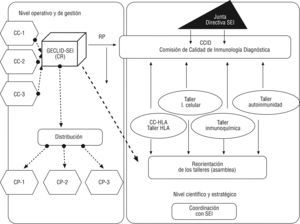
Estructura de GECLID-SEIEl programa GECLID-SEI será supervisado anualmente por la Comisión de Calidad de Inmunología Diagnóstica (CCID). Esta comisión se ha constituido recientemente y está integrada por 7 miembros (tabla 1). Inicialmente interviene un representante por cada taller hasta que en el próximo Congreso de la SEI sea ratificado o sustituido. En todo caso, los representantes elegidos por los talleres deberán mantenerse en la CCID al menos 3 años renovables hasta 2 períodos. Hay además 2 representantes de la Junta de la SEI (actuará como presidente el representante de la Junta de mayor rango y, en el caso de que se trate de 2 vocales, el que tenga más antigüedad como socio de la SEI. El otro vocal será el secretario de la CCID). Por otro lado, forma parte de la CCID el responsable de Programa (RP)1.
Componentes de la Comisión de Calidad en Inmunología Diagnóstica en el momento de su constitución
| I) Por la Junta de la SEI | Cecilia Muñoz CallejaManel Juan Otero |
| II) Por los talleresAutoinmunidadInmunoquímica y alergiaInmunología celularHistocompatibilidad e inmunogenética | M. Carme GelpíJuan José RodríguezAlfredo Minguela PurasJaume Martorell |
| III) Por GECLIDResponsable del Programa | M. Carmen Martín Alonso |
GECLID: Garantía Externa de Calidad para Laboratorios de Inmunología Diagnóstica; SEI: Sociedad Española de Inmunología.
Además, cada subprograma ofertado (tanto analítico como formativo) tendrá un Comité Asesor (Steering Comitte) propio, formado por 4–5 inmunólogos de prestigio reconocido en cada una de las áreas. Cada comité, bajo la supervisión de la CCID, deberá cada año aprobar los esquemas ofertados y toda la documentación que reciban los participantes. Estos comités serán nombrados por la CCID antes de finalizar el año 2010.
El programa GECLID-SEI estará coordinado con los talleres de la Sociedad para implementar mejoras e ir incorporando nuevos paneles analíticos adecuados a las necesidades reales de los laboratorios de inmunología. Además, servirán de asamblea de los diferentes subprogramas ofertados, y en ellos (con periodicidad anual), se analizarán y discutirán los resultados obtenidos para cada muestra, las sugerencias que propongan los laboratorios participantes, como corresponde al espíritu de mejora continua que debe guiar cualquier sistema de calidad.
Además, GECLID-SEI establecerá convenios de colaboración con diferentes centros sanitarios para obtener muestras de intercomparación (de este modo nos aseguraremos una representación fiel de la realidad diagnóstica de los laboratorios de inmunología). Ya se están estableciendo convenios con diferentes entidades sanitarias (centros colaboradores) en Andalucía, Castilla y León, Cataluña, Comunidad de Madrid, Región de Murcia y País Vasco. En el espíritu de GECLID-SEI está implícito tener la mayor y mejor cartera de centros colaboradores que sea posible.
En la figura 1 se refleja la estructura del programa GECLID-SEI.
Política de calidad de GECLID-SEIGECLID-SEI ofrece un servicio de máxima calidad que estará atento y considerará las necesidades y las peticiones de sus usuarios. Para ello:
- —
Desarrollará paulatinamente un EQAP que integra organización, procedimientos, métodos y recursos.
- —
Establecerá objetivos de calidad y planes anuales para implementar la política de calidad establecida (de acuerdo con la Comisión de Calidad de la SEI y los diferentes talleres y grupos de trabajo).
- —
Se asegurará de que todo el personal que trabaja en GECLID-SEI está familiarizado con las políticas de calidad y trabaja para obtener la máxima satisfacción de los usuarios del programa.
- —
Mantendrá un nivel máximo de profesionalidad, comprometiéndose a ejercer buenas prácticas de conducta y acción.
GECLID-SEI se desarrolla desde el inicio, de acuerdo con la normativa aplicable a un proveedor de calidad externa, y se compromete a:
- —
Seleccionar y formar a personal que garantice en todo momento un servicio eficiente hacia los usuarios del programa.
- —
Dotarse de las herramientas y los equipos necesarios para que el servicio sea fiable, ágil, confidencial y personalizado, incluidas las tecnologías de la información y la comunicación (web y correos electrónicos) en la gestión y en los programas formativos.
- —
Obtener, manipular y transportar las muestras biológicas en las mejores condiciones, lo que permitirá a los participantes obtener resultados adecuados.
- —
Seleccionar y utilizar para los diferentes esquemas de calidad muestras que reflejan la realidad diaria en inmunología diagnóstica.
- —
Utilizar las herramientas estadísticas más adecuadas en cada proceso, de modo que los informes que se generen sean de utilidad para sus usuarios.
- —
Proveer a todos los usuarios de informes de calidad entendibles, fiables, confidenciales y en cortos períodos de tiempo, para que tengan impacto en el trabajo diagnósticoclínico de los participantes.
- —
Someterse a controles internos, auditorías externas y programas de acreditación, así como solicitar informes de satisfacción de los usuarios, para tener un plan de mejora de calidad permanente.
- —
Incorporar criterios de garantía de la calidad (subprogramas de las fases extraanalíticas del laboratorio).
- —
Desarrollar programas de formación continuada en temas de vanguardia o de especial interés dirigidos al personal técnico y/o en formación de los laboratorios diagnósticos.
Los objetivos generales de GECLID-SEI son:
- —
Ofrecer a sus usuarios la opción de verificar el mayor número de determinaciones inmunológicas. Esto se realizará mediante esquemas y subprogramas de calidad que sean fieles a las necesidades asistenciales de los laboratorios que realicen diagnóstico en inmunología.
- —
Aportar datos objetivos para que cada laboratorio pueda conocer su fiabilidad analítica, a partir de la verificación del nivel de precisión de cada laboratorio participante y la aceptabilidad de sus resultados analíticos.
- —
Realizar la intercomparación de los resultados analíticos, métodos diagnósticos, procedimientos preanalíticos y resultados de gestión de calidad de cada laboratorio con los del conjunto de laboratorios que participan en los mismos esquemas.
- —
Complementar los sistemas de control interno de calidad de los laboratorios (tanto en áreas analíticas como extraanalíticas).
- —
Ofrecer formación continuada a los participantes (tanto a nivel técnico como facultativo). La formación será fundamentalmente virtual mediante el uso de la plataforma Moodle (que permite una completa interacción entre el profesorado y los participantes); según los casos, los participantes recibirán muestras y/o kits diagnósticos desde GECLID-SEI, y podrá haber sesiones presenciales que se harán coincidir con los congresos anuales de la SEI.
- —
Cumplir con las exigencias de las normativas nacionales e internacionales respecto a los programas de intercomparación, para los laboratorios que quieran implantar un sistema de gestión de calidad y/u obtener su correspondiente acreditación o certificación.
- —
Ayudar a todos los laboratorios diagnósticos a mejorar su rendimiento y eficacia, a potenciar su credibilidad y reputación, y a implantar modelos de calidad y planes de excelencia continuados.
El programa GECLID-SEI es independiente de cualquier empresa comercial/distribuidora del área de inmunología diagnóstica, por lo que tendrá absoluta imparcialidad en cuanto a los métodos e instrumentos empleados por los participantes. Se pretende, además, analizar en la medida de lo posible la repercusión de los diferentes métodos/marcas en el rendimiento de los laboratorios.
Posibles participantes en los esquemas de calidad de GECLID-SEI:
- —
Todos los laboratorios con personal asociado a la SEI que quieran participar en los esquemas, podrán adherirse mediante un boletín de inscripción disponible en el sitio web de GECLID-SEI (que ya se ha distribuido en formato físico y digital a todos los miembros de la SEI).
- —
También podrán participar en los esquemas laboratorios que no estén asociados a la SEI, y que realicen diferentes analíticas inmunológicas.
- —
Todos los esquemas (independientemente del mes de inicio del esquema) se contratarán por una periodicidad anual. Se admitirá la incorporación a los diferentes esquemas ofertados, una vez ya iniciados. En este caso, se facturará la parte proporcional correspondiente al resto del ejercicio.
- —
Los fabricantes y distribuidores de kits y reactivos diagnósticos pueden también participar en los esquemas de calidad de las técnicas que venden y/o distribuyen. Podrán suscribir una participación completa a los esquemas, o exclusivamente para recibir los informes anuales que sean relevantes para su actividad comercial.
Si bien la normativa de calidad más popular es la ISO 900112, que recoge los requisitos para un sistema de gestión de la calidad, actualmente la mayoría de los laboratorios de diagnóstico eligen acreditarse según la norma ISO 1518913, que recoge los requisitos de gestión de la ISO 9001, así como los de competencia de la ISO 1072514, e incorpora además parámetros de calidad preanalítica y postanalítica. De esta manera, el laboratorio consigue acreditarse poniendo de manifiesto su competencia. En este sentido, uno de los principales requisitos de la norma es realizar de forma periódica controles de calidad internos y externos. Aquí entran en juego los programas de intercomparaciones, como sistema de garantía de calidad externo15.
Desde febrero de 2010 existe una norma ISO que recoge los requisitos a cumplir por los proveedores de intercomparaciones, la ISO 1704316. Esta norma establece los requisitos de competencia y funcionamiento de los proveedores de programas de intercomparación. La nueva norma tiene su origen en las guías ISO 43-117 y 34-218 y en la guía ILAC G13:200719 (International Laboratory Accreditation Cooperation), documento utilizado hasta la fecha por las entidades de acreditación para sus evaluaciones. La Entidad Nacional de Acreditación ha propuesto un año como plazo de adaptación a la nueva norma para proveedores de intercomparación. Hasta la fecha no se ha acreditado ningún laboratorio relacionado con el ámbito sanitario con esta nueva normativa.
Los requisitos que nos marca, no sólo esta normativa, sino también la Federación Europea de Inmunogenética (EFI)20, en el caso de histocompatibilidad e inmunogenética, nos llevan a tener que realizar una planificación exhaustiva a priori de todos los subprogramas, que se refleja en la documentación que pronto llegará a vuestras manos. De la misma manera, se hace patente la necesidad de nombrar comités asesores para cada uno de los subprogramas analíticos.
MetodologíaLa metodología básica del programa es la obtención de muestras (sanas y/o patológicas) para remitirlas a todos los laboratorios participantes para cada analítica, realizar posteriormente el análisis de los resultados emitidos por todos los laboratorios y emitir un informe de calidad personalizado para cada laboratorio participante.
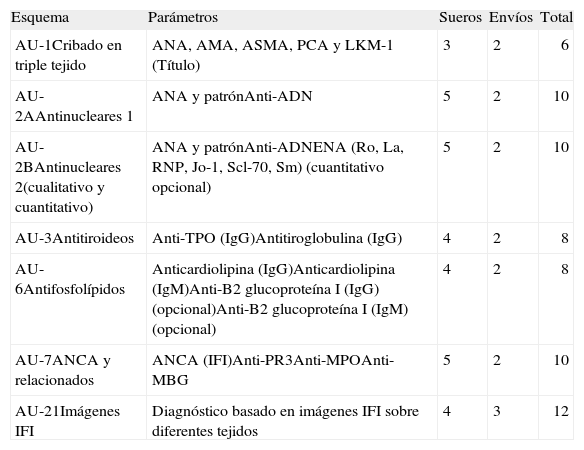
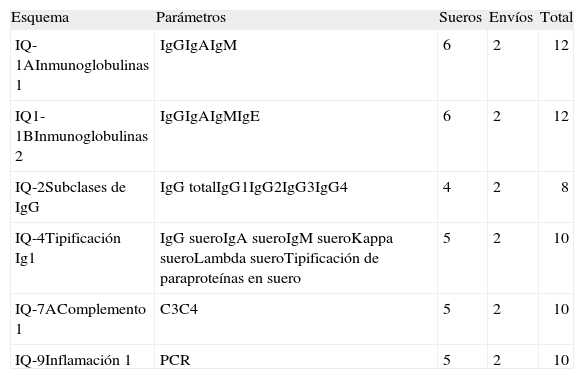
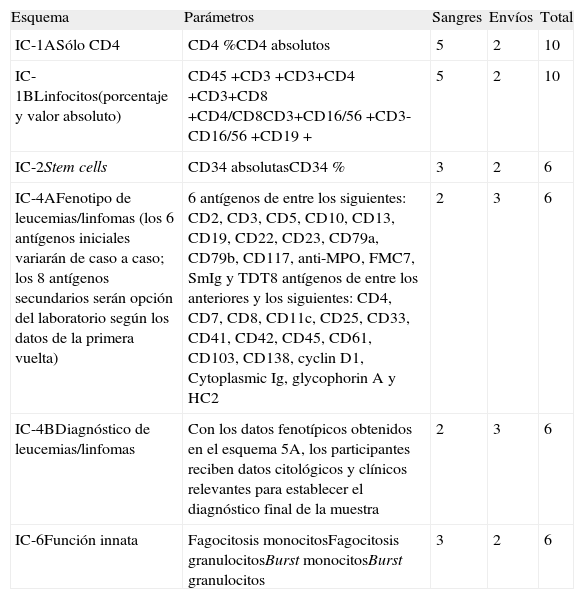
Dado el elevado número de parámetros diagnósticos en inmunología, éstos se han clasificado en 4 subprogramas analíticos, habiendo otros subprogramas formativos y/o de calidad preanalítica y postanalítica. Cada subprograma se ha organizado en un número variable de esquemas que pretenden reflejar los diferentes procedimientos analíticos habituales en los laboratorios de inmunología diagnóstica. En cada esquema se evaluará un número variable de parámetros (tablas 2–5).
Esquemas del Subprograma de autoinmunidad 2011
| Esquema | Parámetros | Sueros | Envíos | Total |
| AU-1Cribado en triple tejido | ANA, AMA, ASMA, PCA y LKM-1 (Título) | 3 | 2 | 6 |
| AU-2AAntinucleares 1 | ANA y patrónAnti-ADN | 5 | 2 | 10 |
| AU-2BAntinucleares 2(cualitativo y cuantitativo) | ANA y patrónAnti-ADNENA (Ro, La, RNP, Jo-1, Scl-70, Sm) (cuantitativo opcional) | 5 | 2 | 10 |
| AU-3Antitiroideos | Anti-TPO (IgG)Antitiroglobulina (IgG) | 4 | 2 | 8 |
| AU-6Antifosfolípidos | Anticardiolipina (IgG)Anticardiolipina (IgM)Anti-B2 glucoproteína I (IgG) (opcional)Anti-B2 glucoproteína I (IgM) (opcional) | 4 | 2 | 8 |
| AU-7ANCA y relacionados | ANCA (IFI)Anti-PR3Anti-MPOAnti-MBG | 5 | 2 | 10 |
| AU-21Imágenes IFI | Diagnóstico basado en imágenes IFI sobre diferentes tejidos | 4 | 3 | 12 |
Esquemas del Subprograma de inmunoquímica y alergia 2011
| Esquema | Parámetros | Sueros | Envíos | Total |
| IQ-1AInmunoglobulinas 1 | IgGIgAIgM | 6 | 2 | 12 |
| IQ1-1BInmunoglobulinas 2 | IgGIgAIgMIgE | 6 | 2 | 12 |
| IQ-2Subclases de IgG | IgG totalIgG1IgG2IgG3IgG4 | 4 | 2 | 8 |
| IQ-4Tipificación Ig1 | IgG sueroIgA sueroIgM sueroKappa sueroLambda sueroTipificación de paraproteínas en suero | 5 | 2 | 10 |
| IQ-7AComplemento 1 | C3C4 | 5 | 2 | 10 |
| IQ-9Inflamación 1 | PCR | 5 | 2 | 10 |
Ig: inmunoglobulina.
Esquemas del Subprograma de inmunidad celular 2011
| Esquema | Parámetros | Sangres | Envíos | Total |
| IC-1ASólo CD4 | CD4 %CD4 absolutos | 5 | 2 | 10 |
| IC-1BLinfocitos(porcentaje y valor absoluto) | CD45+CD3+CD3+CD4+CD3+CD8+CD4/CD8CD3+CD16/56+CD3-CD16/56+CD19+ | 5 | 2 | 10 |
| IC-2Stem cells | CD34 absolutasCD34 % | 3 | 2 | 6 |
| IC-4AFenotipo de leucemias/linfomas (los 6 antígenos iniciales variarán de caso a caso; los 8 antígenos secundarios serán opción del laboratorio según los datos de la primera vuelta) | 6 antígenos de entre los siguientes: CD2, CD3, CD5, CD10, CD13, CD19, CD22, CD23, CD79a, CD79b, CD117, anti-MPO, FMC7, SmIg y TDT8 antígenos de entre los anteriores y los siguientes: CD4, CD7, CD8, CD11c, CD25, CD33, CD41, CD42, CD45, CD61, CD103, CD138, cyclin D1, Cytoplasmic Ig, glycophorin A y HC2 | 2 | 3 | 6 |
| IC-4BDiagnóstico de leucemias/linfomas | Con los datos fenotípicos obtenidos en el esquema 5A, los participantes reciben datos citológicos y clínicos relevantes para establecer el diagnóstico final de la muestra | 2 | 3 | 6 |
| IC-6Función innata | Fagocitosis monocitosFagocitosis granulocitosBurst monocitosBurst granulocitos | 3 | 2 | 6 |
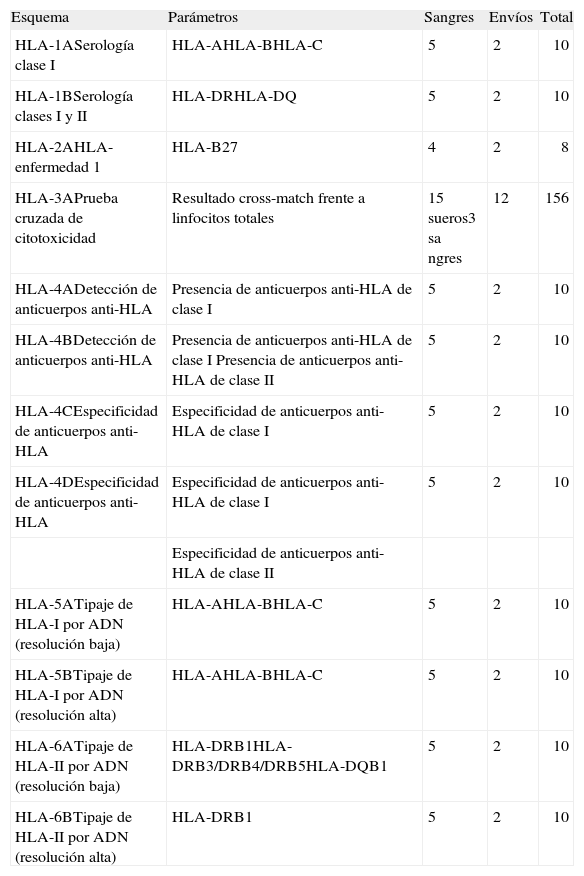
Esquemas del Subprograma de histocompatibilidad e inmunogenética 2011
| Esquema | Parámetros | Sangres | Envíos | Total |
| HLA-1ASerología clase I | HLA-AHLA-BHLA-C | 5 | 2 | 10 |
| HLA-1BSerología clases I y II | HLA-DRHLA-DQ | 5 | 2 | 10 |
| HLA-2AHLA-enfermedad 1 | HLA-B27 | 4 | 2 | 8 |
| HLA-3APrueba cruzada de citotoxicidad | Resultado cross-match frente a linfocitos totales | 15 sueros3 sa ngres | 12 | 156 |
| HLA-4ADetección de anticuerpos anti-HLA | Presencia de anticuerpos anti-HLA de clase I | 5 | 2 | 10 |
| HLA-4BDetección de anticuerpos anti-HLA | Presencia de anticuerpos anti-HLA de clase I Presencia de anticuerpos anti-HLA de clase II | 5 | 2 | 10 |
| HLA-4CEspecificidad de anticuerpos anti-HLA | Especificidad de anticuerpos anti-HLA de clase I | 5 | 2 | 10 |
| HLA-4DEspecificidad de anticuerpos anti-HLA | Especificidad de anticuerpos anti-HLA de clase I | 5 | 2 | 10 |
| Especificidad de anticuerpos anti-HLA de clase II | ||||
| HLA-5ATipaje de HLA-I por ADN (resolución baja) | HLA-AHLA-BHLA-C | 5 | 2 | 10 |
| HLA-5BTipaje de HLA-I por ADN (resolución alta) | HLA-AHLA-BHLA-C | 5 | 2 | 10 |
| HLA-6ATipaje de HLA-II por ADN (resolución baja) | HLA-DRB1HLA-DRB3/DRB4/DRB5HLA-DQB1 | 5 | 2 | 10 |
| HLA-6BTipaje de HLA-II por ADN (resolución alta) | HLA-DRB1 | 5 | 2 | 10 |
Entre el total de muestras anuales de cada esquema propuesto, habrá muestras de individuos sanos, y sueros/sangres patológicos (con valores por debajo y por encima de los rangos de normalidad de las diferentes magnitudes analizadas). Todas las muestras que se envíen habrán sido previamente testadas y negativas para el virus de la inmunodeficiencia humana, hepatitis B, hepatitis C y sífilis.
Las muestras distribuidas en los subprogramas y esquemas GECLID-SEI se obtendrán de centros colaboradores o, cuando las necesidades de un esquema o subprograma así lo requieran, se podrán adquirir muestras de proveedores, siempre que se pueda asegurar su trazabilidad, su seguridad (serologías negativas) y el cumplimiento de la normativa aplicable. En algunos esquemas/parámetros habrá muestras de diseño. Y para evaluar la reproducibilidad de los laboratorios participantes (cuando sea posible), se enviarán muestras duplicadas y/o diluciones de un mismo espécimen sin que los participantes puedan identificar este hecho.
Subprogramas y esquemasComo se ha mencionado anteriormente, dada la gran cantidad de parámetros a evaluar, GECLID-SEI ha definido 4 subprogramas analíticos y 1 subprograma de formación continuada. La oferta para el año 2011 queda como sigue:
- 1.
Subprograma de autoinmunidad (AU): 6 esquemas (tabla 2).
- 2.
Subprograma de inmunoquímica y alergia (IQ): 5 esquemas (tabla 3).
- 3.
Subprograma de inmunidad celular (IC): 4 esquemas (tabla 4).
- 4.
Subprograma de histocompatibilidad e inmunogenética (HLA): 6 esquemas (tabla 5).
- 5.
Subprograma de formación continuada (FT y FDT): 5 esquemas (tabla 6).
Tabla 6.Programación preliminar del Subprograma de formación continuada 2011
Formación técnica autoinmunidad - •
FT-AU1 Patrones ANA en inmunofluorescencia (variaciones según el sustrato, empleo de colorantes de contraste, introducción al consenso en la nomenclatura)
- •
FT-AU2 Análisis EIA de anticuerpos antifosfolípidos
- •
FT-HLA1 Tipaje de HLA de clase I: serología frente a ADN
- •
FT-HLA2 Determinación de B27 mediante diversas técnicas
- •
FT-IQ1 Estudio de inmunoglobulinas por nefelometría-turbidimetría (estabilidad, influencia de conservantes y condiciones de almacenamiento, sustratos, etc.)
- •
FT-IQ2 Determinación de subclases de inmunoglobulinas (ELISA o RID frente a nefelometría)
- •
FT-IC1 Fluorocromos: diferencias en la detección de antígenos de superficie
- •
FT-IC2 Recuentos: diferencias entre los estudios de plataforma doble y única
- •
FDT-IP1 Informes diagnósticos en inmunodeficiencias
- •
FDT-IP2 Informes diagnósticos en patología autoinmune
- •
FDT-IP3 Informes diagnósticos en trasplante
- •
Por la complejidad de alguno de los esquemas, los laboratorios podrán elegir suscribir diferentes variantes de ellos (p. ej., Esquema AU-2A/AU-2B; tabla 2).
EsquemasanalíticosEn las tablas 2–5 se recogen los esquemas para el primer año del programa.
En cuanto a la formación, queremos dar respuesta a las necesidades reales tanto a nivel técnico, como especializado. El programa para 2011 se encuentra en la tabla 6. Este programa deberá aprobarlo el Comité Asesor de Formación y Calidad Preanalítica y Postanalítica, por lo que aún puede que presente alguna modificación.
Resultados- —
Para las respuestas cualitativas en la mayoría de subprogramas (p. ej., positivo, negativo o equívoco), para cada parámetro un grupo de laboratorios especializados preseleccionados por su gran sensibilidad y especificidad en los últimos Talleres de la SEI definirá un resultado de referencia. De los resultados aportados por cada participante se calculará el índice de evaluación de errores, que penaliza los resultados aportados según se comparan con el resultado de referencia.
- —
Para las respuestas cuantitativas (con resultado numérico), se utilizará el sistema de puntuaciones por índice de variación: la unidad básica de medida es este índice es el coeficiente de variación (CV), y en particular la relación entre el CV del laboratorio participante y el CV de la técnica para determinar un parámetro en particular (siendo este último un valor arbitrario).
- —
Además, al finalizar el esquema anual, para los parámetros en los que haya sido posible, se podrá calcular el índice de reproducibilidad, basado en muestras que se hayan enviado más de una vez (ya sea en la misma dilución o en diferentes diluciones).
- —
En el caso particular de los esquemas de histocompatibilidad e inmunogenética, se seguirán las directrices establecidas por la EFI, tanto para los parámetros serológicos, como para los esquemas moleculares (Standars for Providers of External Proficiency Testing (EPT) Schemes)20.
En todo caso, los aspectos relativos al análisis de datos se llevarán a cabo siguiendo las pautas recogidas en la ISO1352819.
Todos los laboratorios participantes en cada uno de los esquemas obtendrán:
- —
Certificado de inscripción.
- —
Informe de resultados y puntuación obtenida en cada muestra analizada.
- —
Al cierre anual de cada esquema, cada laboratorio participante recibirá un informe acreditativo de calidad analítica (para cada esquema/parámetro analizado).
Además, se elaborarán informes resumidos del rendimiento de cada esquema/parámetro (cuando sea posible, subdividiendo por metodología y/o analizador) para cada muestra analizada, así como para el conjunto anual de ellas. Estos informes detallarán las muestras que resultaron equívocas o problemáticas, y será presentado en los congresos anuales de la SEI, en el contexto de los talleres correspondientes a cada subprograma.
PerspectivasGECLID-SEI quiere convertirse en uno de los primeros proveedores de intercomparaciones para pruebas de inmunología diagnóstica acreditado según la norma ISO17043.
Buscamos también recoger y dar forma a la experiencia de los talleres que se han desarrollado hasta la fecha y de ahora en adelante integrar las propuestas que se reciban de ellos, tanto en la parte analítica, como en las necesidades de formación.
Además de los esquemas para el 2011, hay otra serie de esquemas diseñados para incorporarlos más adelante al programa, según las necesidades y las impresiones de los participantes y las sugerencias de la CCID y de los comités asesores correspondientes (tabla 7).
Esquemas con fecha de inicio a partir de 2012
| Esquema | Parámetros | Inicio |
| AU-5 endocrino | ICA, anti-GAD | 2012 |
| AU-6 anemias | PCA, FI | 2013 |
| AU-8 celíaca | Gliadina, endomisio, Tg | 2012 |
| AU-10 citrulina | Péptido citrulinado | 2012 |
| AU-11 dermatosis bullosa | Membrana basal/desmosoma | 2013 |
| AU-12 miastenia gravis | AcR, músculo estriado | 2013 |
| AU-13 polimiositis | SRP | n/d |
| AU-14 trombopenia autoinmune | Antiplaquetas | n/d |
| AU-15 neutropenia autoinmune | Antineutrófilos | n/d |
| AU-16 neuropatías autoinmunes | Hu, Ri, Yo | n/d |
| IQ-3 IgE específica | IgE total, 5 alérgenos | 2012 |
| IQ-5 tipificación Ig2 | Kappa, lambda y tipificación paraproteínas orina | 2013 |
| IQ-6 oligoclonales | Bandas oligclonales CSF | 2013 |
| IQ-7B complemento 2 | C3, C4, C1q, C1inh | 2012 |
| IQ-8 complemento funcional | C1inh f; CH50 | 2012 |
| IQ-10 PCR | PCR de alta sensibilidad | n/d |
| IQ-11 anticuerpos específicos | Neumococo, Haemophilus y toxoide tetánico | 2013 |
| IQ-9B inflamación | ASLO, anti-ADNsaB, b2m | n/d |
| IQ-12 aspergilosis | Precipitinas (IgG) | n/d |
| IQ-13 alergia | IgE, ECP, Triptasa | n/d |
| HLA-2B HLA enfermedad 2 | HLA-B5701 | 2012 |
| HLA-2C HLA enfermedad 3 | HLA-DQ2, DQ8 | 2012 |
| HLA-3B | Prueba cruzada por citometría | 2012 |
| HLA-7 | Tipaje HFE | 2013 |
| HLA-2D HLA enfermedad 4 | HLA-A29, B51, DR2 | n/d |
| HLA-8 | Estudios de quimerismo | n/d |
| HLA-9 | Polimorfismos y/o mutaciones prevalentes en IDP | n/d |
| IC-3 leucocitos residuales | CD45 | 2012 |
| IC-5 función de linfocitos | PHA, PWM | 2012 |
| IC-7 molecular leucemias | JAK-2; BCR-ABL y AML; clonalidades IgH/TcR | 2013 |
| IC-8 enfermedad mínima residual | 2013 | |
| Desglose de IC-4 A | Leucemias linfoides crónicas y linfomas T, B y NK | n/d |
| Desglose de IC-4 B | Leucemias linfoides agudas | n/d |
| Desglose de IC-4 C | Procesos mieloides agudos y crónicos | n/d |
| Desglose de IC-4 D | Mielomas | n/d |
| IC-9 | Fenotipo HPN | n/d |
| PRE | Calidad preanalítica | 2012 |
| GES | Indicadores de gestión de calidad | 2013 |
Ig: inmunoglobulina; n/d: fecha de inicio por determinar.
Para cualquier duda relacionada con el programa, se puede contactar con el personal de GECLID-SEI en la dirección, teléfono o correo electrónico que se detallan. Además, toda la documentación que se vaya generando se publicará en formato digital en la web de la SEI (http://www.inmunologia.org/esp/areas/sanidad.php). Asimismo, se ha constituido un grupo GECLID-SEI en Facebook, en el que se irá informando puntualmente de las novedades en el programa y al que invitamos a unirse a todos los inmunólogos interesados por la calidad. Queremos dejar constancia de nuestro más sincero agradecimiento a la acogida de esta iniciativa (en el Congreso de San Sebastián y estos meses posteriores), a todos los que os habéis propuesto como centros colaboradores, así como vuestra comprensión por los posibles errores/cambios que estemos realizando para la puesta en marcha de este proyecto. Seguiremos trabajando para cumplir las expectativas que todos hemos puesto en el Programa GECLID-SEI.