La recombinación V(D)J consiste en el ensamblaje de los segmentos génicos presentes en los genes de las cadenas variables de los receptores de antígeno para generar la diversidad del reconocimiento antigénico en linfocitos. El conocimiento de su regulación en condiciones normales es esencial para entender los casos en que este proceso se desregula, dando lugar a transformaciones leucémicas. La recombinación V(D)J se inicia por acción de una endonucleasa específica presente exclusivamente en linfocitos inmaduros. Según el «modelo de accesibilidad» propuesto hace más de 25 años, la recombinación V(D)J está regulada a través del control de la accesibilidad de esta endonucleasa a sus sitios de corte en el ADN, de acuerdo con unos programas de diferenciación celular muy definidos. En esta revisión se resumen los hallazgos descubiertos en este campo en los últimos años, tales como el importante papel que tiene la conformación génica y la posición de estos genes en el núcleo celular, así como aquellos que muy recientemente han permitido la validación definitiva del «modelo de accesibilidad».
V(D)J recombination is the assembly of gene segments at the antigen receptor loci in order to generate antigen receptor diversity in T and B lymphocytes. Detailed knowledge of how V(D)J recombination is normally regulated during lymphocyte development is essential to understand the cases of dysregulation of this process that result in leukemic transformation. V(D)J recombination is triggered by action of a specific endonuclease which is exclusively expressed in immature lymphocytes. According to the “accessibility model” proposed more than 25 years ago, DNA cleavage by this endonuclease is very strictly controlled during cell differentiation by regulating its accessibility to chromatin. This review summarizes the advances in the field over the last few years, including the important role of the genomic conformation and position of the antigen receptor loci within the nucleus, as well as those that have recently culminated with the validation of the “accessibility model” to control this process.
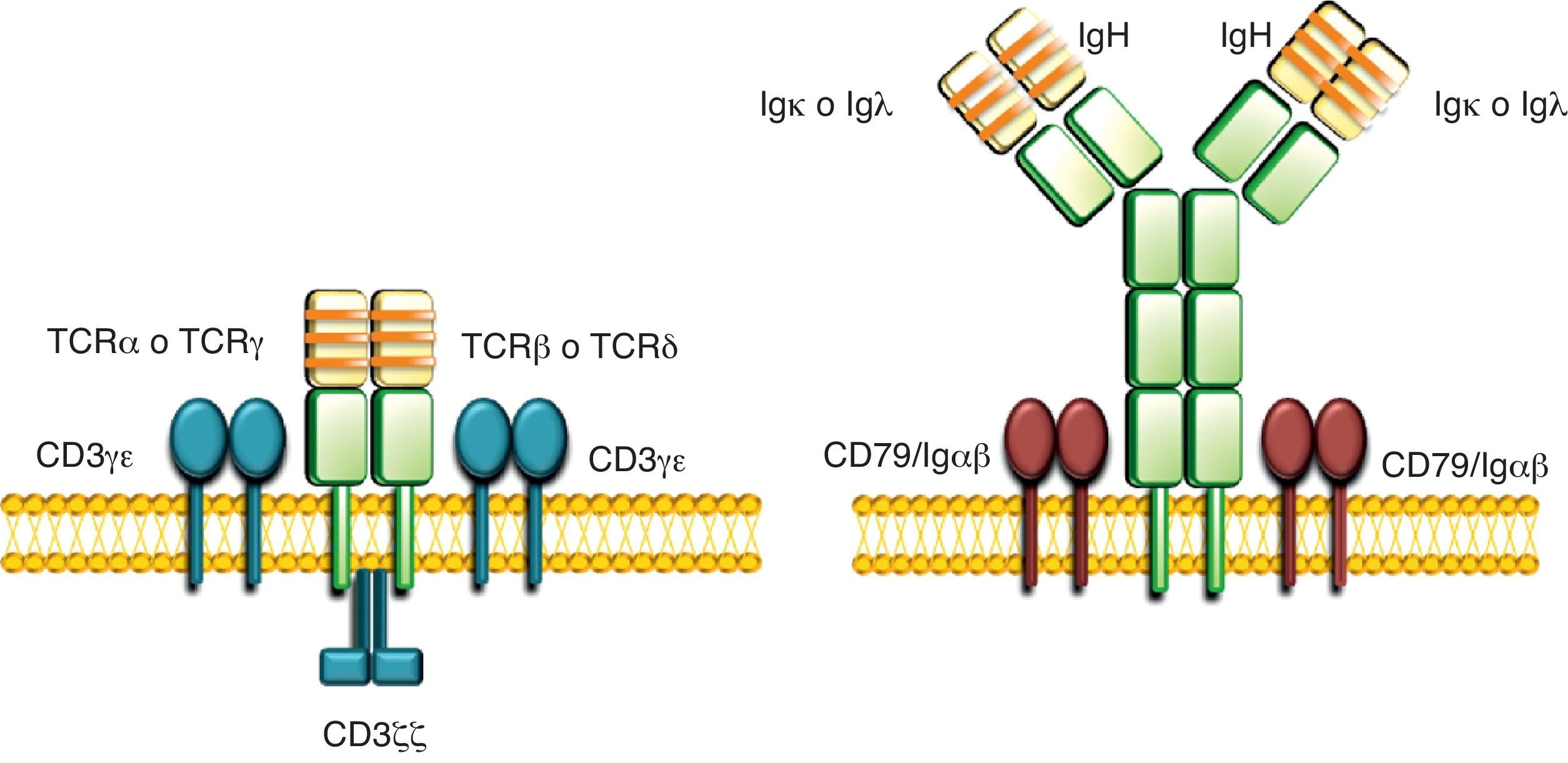
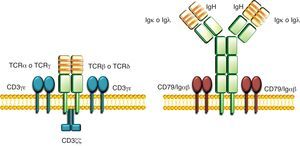
Existen 2 tipos de linfocitos, linfocitos T y B, los cuales maduran a partir de precursores linfoides comunes presentes en la médula ósea. Cada linfocito expresa un único tipo de receptor que reconoce un antígeno de forma específica, lo que se conoce como receptores clonotípicos. Los receptores de antígeno de los linfocitos T (TCR) reconocen antígenos peptídicos, presentados por las moléculas del complejo principal de histocompatibilidad en la membrana de las células presentadoras de antígeno1, mientras que los receptores de antígeno de los linfocitos B (BCR) reconocen antígenos solubles2. A pesar de estas importantes diferencias funcionales, los TCR y los BCR tienen muchas características estructurales comunes1,2. Ambos están formados por dímeros de cadenas peptídicas variables unidas por puentes disulfuro, las cuales son responsables del reconocimiento antigénico. Estas cadenas variables están asociadas a una serie de cadenas invariables, importantes para la expresión del receptor en membrana y para la transducción de las señales intracelulares (fig. 1). Las cadenas invariables también se asocian entre sí como dímeros. Los dímeros de cadenas invariables presentes en los TCR están formados por distintas asociaciones de miembros de la familia CD3: CD3¿δ, CD3γ¿ y CD3ζζ. Los dímeros de cadenas invariables presentes en los BCR están formados por miembros de la familia CD79: CD79αβ (también conocidos como Igαβ).
Estructura de los TCR e BCR. Los TCRαβ y TCRγδ están formados por 2 cadenas variables TCRα y TCRβ, o TCRγ y TCRδ, respectivamente, unidas covalentemente por puentes disulfuro asociadas a tres dímeros de cadenas CD3 (CD3δ¿, CD3γδ y CD3ζζ). Los BCR están formados por 2 cadenas variables, una cadena pesada IgH y una cadena ligera Igκ o Igλ, unidas covalentemente por puentes disulfuro asociadas a 2 dímeros de cadenas CD79 (CD79αβ, también conocidas como Igαβ). En amarillo se representan las regiones variables y en verde se representan las regiones constantes de las cadenas variables. Las regiones hipervariables o CDR se representan como franjas naranjas. Las cadenas de los dímeros CD3 se representan en azul y las cadenas de los dímeros CD79αβ/Igαβ se representan en marrón.
Existen 7 cadenas variables de los receptores de antígeno: TCRα, TCRβ, TCRγ, TCRδ, IgH, Igκ e Igλ, que se emparejan entre sí, de forma específica, para generar los 4 posibles tipos de receptores de antígeno en linfocitos. Los linfocitos T pueden expresar 2 tipos de TCR, en función de las cadenas variables que expresen sus receptores de antígeno: TCRαβ o TCRγδ. La asociación específica de una cadena TCRα con una cadena TCRβ o de una cadena TCRγ con una cadena TCRδ da lugar a la generación de los 2 linajes de linfocitos T: los linfocitos Tαβ y los linfocitos Tγδ con funcionalidades diferentes3. Los linfocitos B también pueden expresar 2 tipos de BCR en función de la expresión de las cadenas variables que expresen sus receptores de antígeno. La asociación de la cadena de inmunoglobulina pesada, IgH, con una de las 2 posibles cadenas de inmunoglobulina ligeras, Igκ o Igλ, da lugar a las inmunoglobulinas de membrana presentes en los BCR.
Cada una de las cadenas variables consta de 2 regiones diferenciadas: una región variable extracelular localizada en el extremo amino terminal y una región constante localizada en el extremo carboxilo terminal (fig. 1). Las regiones variables de cada una de estas cadenas están encargadas del reconocimiento antigénico. Estas regiones contienen 3 tramos cortos de secuencias hipervariables4 denominadas «regiones determinantes de complementariedad» (CDR)(fig. 1). Hay un total de 6 CDR por receptor. La combinación tridimensional de los segmentos peptídicos constituidos por los CDR de cada cadena es lo que confiere una mayor especificidad de antígeno a cada receptor. La región constante de todas las cadenas variables de los receptores de antígeno, excepto las de las cadenas ligeras de inmunoglobulinas, incluye una región transmembrana y una región citoplásmatica corta. Estas regiones constantes tienen un papel importante en la interacción física y funcional de las cadenas variables con los dímeros de las cadenas invariables1,2.
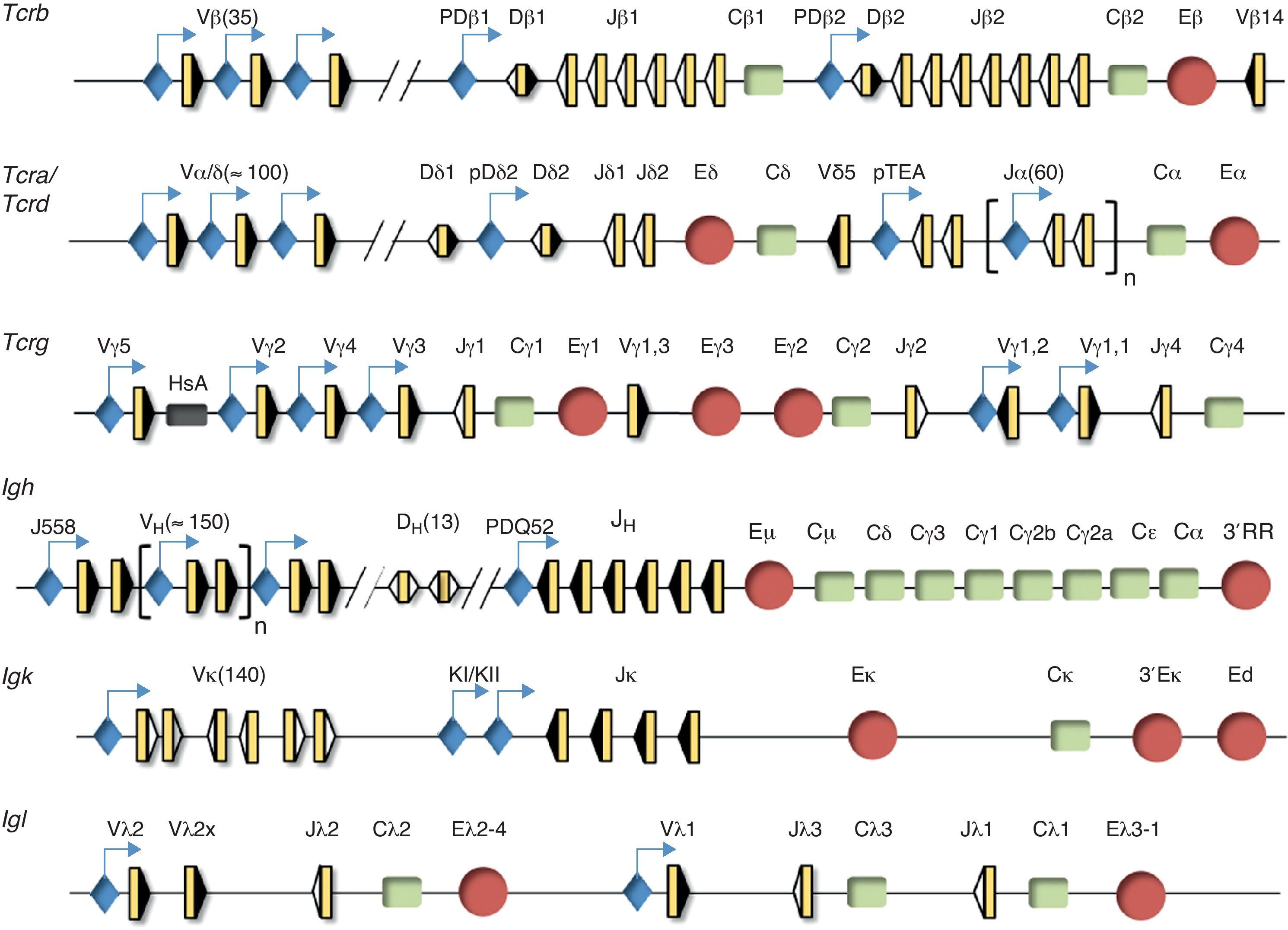
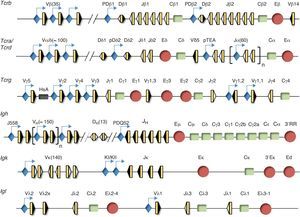
Organización genómica de los genes de las cadenas variables de los receptores de antígenoLas regiones variables de las cadenas de los receptores de antígeno vienen determinadas por distintas combinaciones génicas de los segmentos V (variable), D (diversidad) y J (joining) que componen cada uno de los genes que las codifican (Tcra, Tcrb, Tcrg, Tcrd, Igh, Igk, Igl)5. Los segmentos génicos V, D y J se encuentran en las regiones 5’ de cada gen con una distribución de segmentos muy conservada entre humano y ratón, mientras que los exones que dan lugar a las regiones constantes se encuentran en las regiones 3’ (fig. 2). Los segmentos V, D y J se reordenan a nivel génico durante el desarrollo de los linfocitos mediante un proceso denominado «recombinación V(D)J»5. Este proceso permite la generación de un enorme repertorio de receptores para antígenos distintos en linfocitos T y B con una mínima inversión en material genético. Este proceso confiere una especificidad antigénica distinta a cada linfocito vírgen, lo que permite un reconocimiento prácticamente ilimitado de antígenos distintos. La existencia de este mecanismo de generación de los distintos TCR y BCR en linfocitos es la base de la inmunidad específica o adaptativa, a diferencia de la inmunidad innata. La inmunidad innata está implicada en la protección del huesped frente a los patógenos o antígenos extraños de una forma inespecífica. En la inmunidad innata tienen un papel importante tanto mecanismos celulares como moleculares. La inmunidad innata celular está basada en la activación de células que reconocen y responden frente a patógenos de forma inespecífica. Entre las células responsables de la inmunidad innata se encuentran los fagocitos, como los macrófagos, los neutrófilos y las células dendríticas, los basófilos y los eosinófilos, los mastocitos y las células asesinas naturales, además de las células que participan en la presentación de los antígenos a los linfocitos T. La inmunidad innata molecular está basada en el desencadenamiento de distintas cascadas, tales como la inflamación o el complemento. Ambas cascadas cooperan con la inmunidad específica para ayudar en la eliminación de los patógenos. Una diferencia fundamental entre los sistemas inmunitarios innato y adaptativo es que el primero no confiere inmunidad protectora al huesped a largo plazo.
Estructura génica de los genes de las cadenas variables de los receptores de antígeno. Se representa la estructura génica de los genes Tcrb, Tcra/Tcrd, Tcrg, Igh, Igk e Igl. Los segmentos génicos se representan por rectángulos amarillos y las RSS con triángulos negros o blancos, según contengan una RSS con una secuencia espaciadora de 23 pares de bases o de 12 pares de bases, respectivamente. Las regiones constantes se representan como rectángulos verdes. Los promotores están asociados a determinados segmentos génicos y se representan en azul. Los enhancers se representan como círculos rojos.
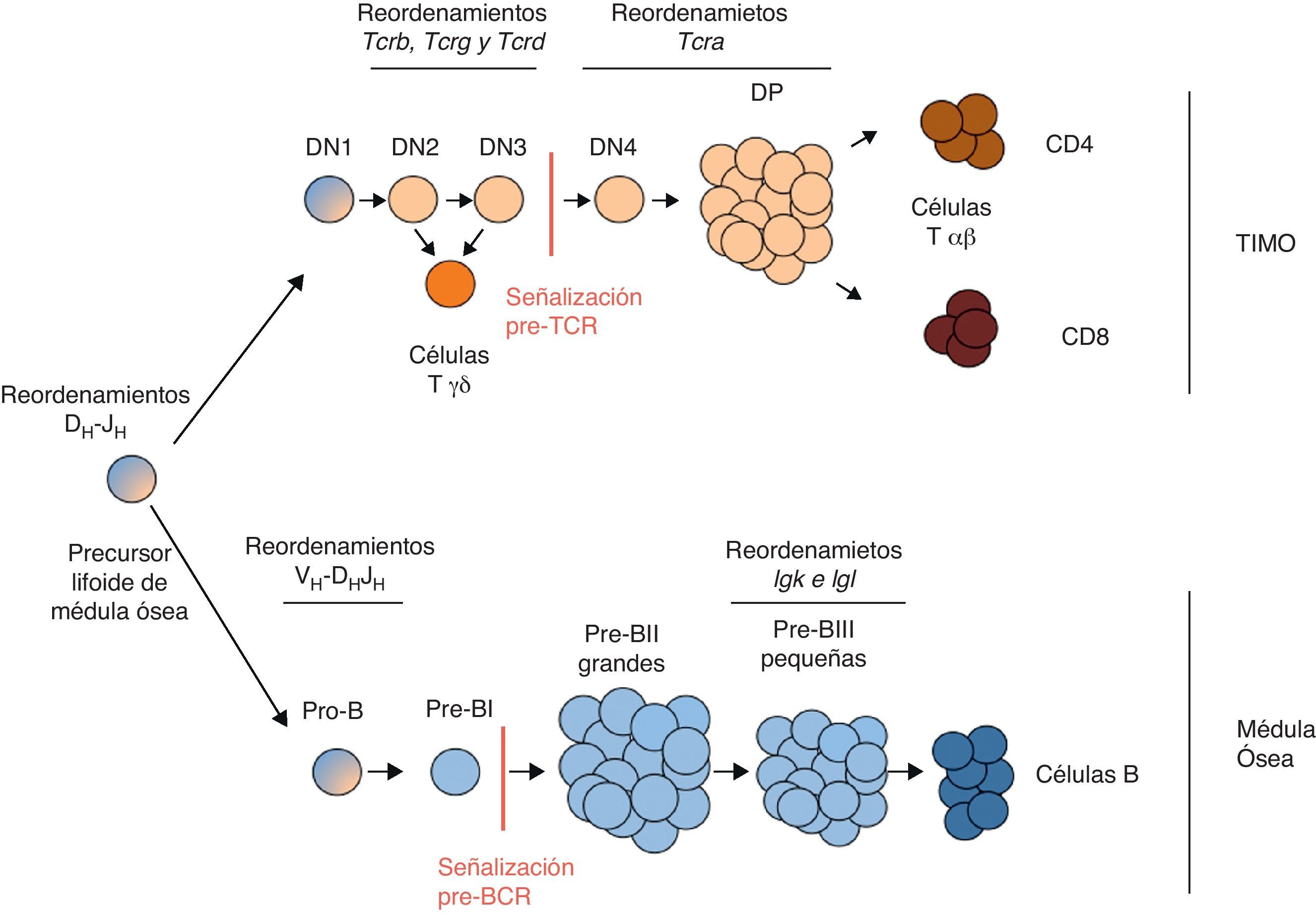
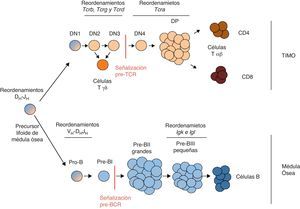
Los linfocitos T y B proceden de un precursor linfoide común de médula ósea (fig. 3) donde se detectan reordenamientos DH-JH del gen Igh3,6. Algunos de estos precursores migran al timo, donde reciben la señalización mediada a través de los receptores Notch, comenzando así la diferenciación del linaje de los linfocitos T3. Los timocitos más inmaduros se denominan timocitos doble-negativos (DN) por carecer de la expresión de los receptores de superficie CD4 y CD8. Los timocitos DN pueden subdividirse en 4 estadios de diferenciación sucesivos en función de la expresión de los receptores CD25 y CD44: DN1 (CD25-CD44+), DN2 (CD25+CD44+), DN3 (CD25+CD44−) y DN4 (CD25-CD44−). Los timocitos DN1 son las células que acaban de migrar al timo desde la médula ósea y, por tanto, portan los reordenamientos DH-JH del gen Igh que ocurrieron anteriormente. En los timocitos DN2 y DN3 ocurren los reordenamientos productivos de los genes Tcrb, Tcrg y Tcrd, permitiendo la generación de los linfocitos Tγδ (en el caso de reordenamientos productivos de los genes Tcrg y Tcrd) o la expresión de un pre-TCR (en el caso de un reordenamiento productivo del gen Tcrb). El pre-TCR consiste en una cadena TCRβ y una cadena invariable denominada pre-Tα, asociadas a los dímeros de las cadenas invariables CD37. La señalización mediada a través del pre-TCR dispara la proliferación y la diferenciación de los timocitos DN3 a timocitos doble-positivos (DP) CD4+CD8+. A partir del estadio DN4, se detectan los primeros reordenamientos del gen Tcra, siendo estos muy abundantes en los timocitos DP. La expresión de un TCRαβ en las células DP inhibe la expresión de las proteínas RAG-1/2, inhibiéndose sucesivos reordenamientos en el gen Tcra, y permite su diferenciación a linfocitos Tαβ CD4 o Tαβ CD8 que migran fuera del timo como linfocitos Tαβ maduros.
Representación de la maduración de los linfocitos T y B. El diagrama representa los distintos estadios por los que van pasando los precursores de los linfocitos T (tonos tostados) y B (tonos azules) a lo largo de su desarrollo para su maduración3,6. Se especifican los estadios donde ocurren los reordenamientos de las distintas cadenas variables de los receptores de antígeno, así como los momentos donde ocurren las señalizaciones a través del pre-TCR y el pre-BCR.
La diferenciación de los linfocitos B se rige por un esquema muy similar al de la diferenciación de los linfocitos T (fig. 3). Los precursores linfoides que permanecen en la médula ósea van diferenciando a través de distintos estadios intermedios (células pro-B, células pre-BI y células pre-BII) antes de dar lugar a los linfocitos B maduros6. Tal y como ocurre durante el desarrollo de los linfocitos T, durante la maduración de los linfocitos B se activan sucesivamente los reordenamientos de los distintos genes de las cadenas de inmunoglobulinas. Primero reordena el gen de la cadena pesada, Igh, y después reordenan los genes de las cadenas ligeras, Igk e Igl. En las células pro-B ocurren los reordenamientos completos del gen Igh, lo que da lugar a la expresión de un pre-BCR en las células pre-BI. El pre-BCR consiste en una cadena IgH y 2 cadenas invariables, V-preB (1 o 2) y λ5, asociadas a las cadenas invariables CD79αβ. La señalización mediada a través del pre-BCR en las células pre-BI dispara su proliferación y su diferenciación a células pre-BII. En la fase de reposo que sigue a la proliferación mediada por esta señalización, en las llamadas células pre-BII pequeñas, ocurren los reordenamientos de los genes de las cadenas ligeras de las inmunoglobulinas, Igk e Igl. La expresión de un BCR en estas células inhibe la expresión de las proteínas RAG-1/2, inhibiéndose futuros reordenamientos génicos, y permite su diferenciación a linfocitos B maduros que migrarán a periferia.
Regulación de la recombinación V(D)J in vivo: «Modelo de accesibilidad»El proceso de recombinación V(D)J es específico de los genes de los receptores de antígeno ya que es dependiente de la presencia de una secuencia señal de recombinación (RSS) que flanquea cada uno de los segmentos génicos V, D y J5 (fig. 2). El proceso de recombinación V(D)J se inicia cuando las proteínas Recombination Antigen Gene (RAG)-1 y RAG-2 reconocen juntas a 2 RSS compatibles de 2 segmentos génicos distintos (V y D, D y J o V y J), para formar un complejo sináptico5. Para que 2 RSS sean compatibles se necesita que cumplan la llamada regla 12/23, por la cual una RSS ha de tener una secuencia espaciadora de 12 pares de bases y la otra una secuencia espaciadora de 23 pares de bases entre sus secuencias consenso de reconocimiento por las proteínas RAG-1/2. Una vez formado este complejo, las proteínas RAG-1/2, que juntas forman una endonucleasa, introducen un corte de doble cadena entre cada RSS y cada segmento génico a recombinar; por ejemplo, introducen un corte de doble cadena entre la unión de un segmento Vα y su RSS asociada y otro corte entre la unión de un segmento Jα y su RSS asociada para poder generar una recombinación VαJα. Estos cortes son procesados y ligados mediante la ruta de reparación de rupturas de doble cadena de ADN no homólogo. Las uniones que ocurren entre los segmentos génicos V-D, D-J o V-J se denominan uniones codificantes, mientras que las uniones que ocurren entre las RSS se denominan uniones no codificantes. Las uniones codificantes generan una nueva estructura genómica del gen que, en caso de ser productiva, será capaz de dar lugar a una cadena variable funcional de TCR o BCR. Las uniones no codificantes generan unos círculos extracromosómicos que contienen las secuencias génicas existentes entre los segmentos génicos que han sido reordenados. Estos círculos extracromosómicos permanecerán en el núcleo celular de los linfocitos en reposo y solo desaparecerán por dilución cuando las células proliferen, ya que no tienen capacidad de replicación.
La especificidad génica de esta reacción viene dada por el hecho de que solo los segmentos génicos V, D y J de los genes de las cadenas variables de los receptores de antígeno están flanqueados por las RSS. Este hecho determina por qué son estos los únicos genes de todo el genoma que sufren el proceso de recombinación V(D)J. Por otro lado, existe también una especificidad que determina que este proceso ocurra exclusivamente en precursores linfoides, debido a que las proteínas RAG-1/2 solo se expresan durante la maduración de los linfocitos5. Sin embargo, existen otros niveles de regulación no explicados por la mera presencia de las RSS en estos genes o la expresión restrictiva de las proteínas RAG-1/2 en los precursores de linfocitos. En concreto, se pueden distinguir 4 niveles adicionales de regulación (i-iv)5. (i) Control del linaje celular: que determina que los genes Igh, Igk e Igl solo reordenen de forma completa en precursores de linfocitos B y que los genes Tcra, Tcrb, Tcrd y Tcrg solo reordenen de forma completa en precursores de linfocitos T. (ii) Control temporal: que establece el orden en que ocurren los reordenamientos de estos genes durante el desarrollo de los linfocitos (fig. 3). Los reordenamientos de los genes Tcrb, Tcrg y Tcrd ocurren en timocitos DN2-DN3, mientras que los reordenamientos del gen Tcra ocurren en la transición de timocitos DN4 a timocitos DP tras recibir los timocitos DN3 una señalización a través del pre-TCR. Los reordenamientos del gen Igh ocurren en células pro-B, mientras que los genes Igl e Igk reordenan en células pre-BII tras recibir las células pre-BI una señalización a través del pre-BCR. (iii) Control del orden de los reordenamientos entre los distintos segmentos génicos: que controla que los segmentos D y J de los genes Tcrb e Igh reordenen antes que los segmentos V; así, primero ocurren los reordenamientos DβJβ o DHJH y luego se completan los reordenamientos VβDβJβ o VHDHJH, respectivamente. (iv) Control de la exclusión alélica: que determina que solo se reordene de forma productiva uno de los 2 alelos en los genes Tcrb, Igh, Igk e Igl. Este fenómeno de exclusión alélica a nivel del reordenamiento génico determina que solo exista un tipo de receptor clonotípico en cada linfocito. En los demás genes de las cadenas de los receptores de antígeno, Tcra, Tcrd y Tcrg, no existe exclusión alélica a nivel de los reordenamientos génicos. Sin embargo, existe una exclusión alélica a nivel de la expresión de los TCR en la membrana celular que viene determinada por el mejor emparejamiento entre sí de unas determinadas cadenas variables de cada receptor respecto a otras durante el ensamblaje de los receptores8. Por ejemplo, aunque puedan expresarse 2 cadenas TCRα en un timocito DP, una de ellas siempre tendrá una mejor afinidad que la otra para asociarse establemente con la cadena TCRβ expresada en esa célula. Este mecanismo de exclusión alélica a nivel del ensamblaje de los receptores en la membrana participa, junto con el otro mecanismo de exclusión alélica a nivel de reordenamientos génicos, en la expresión de los receptores clonotípicos en linfocitos T.
Para explicar estos 4 niveles adicionales de control de la recombinación V(D)J a nivel génico, hace 25 años, G.D. Yancopoulos y F.W. Alt (1985) propusieron el llamado «modelo de accesibilidad»9. Este modelo propone que la estructura de la cromatina, la cual es específica de cada gen de cadena variable de los receptores de antígeno y de cada estadio celular durante el desarrollo linfoide, determina la accesibilidad de las proteínas RAG-1/2 a las RSS y, por tanto, la propia especificidad y regulación de la recombinación V(D)J. Este modelo ha sido avalado por numerosos experimentos que han evidenciado que la activación de la recombinación V(D)J se correlaciona con una apertura de la cromatina y la presencia de determinadas marcas epigenéticas asociadas, tales como son la sensibilidad generalizada a las enzimas nucleasas, la activación de la transcripción, las modificaciones covalentes de las histonas relacionadas con la activación de la transcripción y la hipometilación del ADN5. Además, numerosos experimentos in vivo e in vitro han demostrado que la cromatina, en sí misma, representa una barrera física para la iniciación de la recombinación V(D)J, tal y como ocurre con el proceso de transcripción. Así, el grupo de D. Baltimore, en 1990, demostró que las proteínas RAG-1/2 son suficientes para activar la recombinación V(D)J de construcciones reporteras transfectadas en fibroblastos, pero no la de los genes endógenos de las cadenas variables de los receptores de antígeno10, indicando que estos genes tienen una estructura de cromatina cerrada que impide su recombinación en otros tipos celulares distintos a los precursores linfoides. En 1996, el grupo de M. Schlissel demostró que estos genes tienen una estructura de cromatina distinta dependiendo del tipo celular y de su estadio de diferenciación, lo cual determina la accesibilidad de las proteínas RAG-1/2 en cada gen a lo largo de la diferenciación de los linfocitos B y T11. Los ensayos in vitro, utilizando secuencias purificadas y proteínas RAG-1/2 recombinantes, han demostrado que la cromatinización del ADN inhibe la reacción de recombinación V(D)J12,13. Estos experimentos, junto con el papel esencial demostrado por las secuencias reguladoras, tales como potenciadores (enhancers) y promotores transcripcionales5, han apoyado de forma sólida el «modelo de accesibilidad» en el control de la recombinación V(D)J.
Como se muestra en la figura 2, todos los genes de cadenas variables de los receptores de antígeno contienen numerosos promotores transcripcionales asociados a múltiples segmentos génicos V, D y J, y uno o 2 enhancers situados cerca de las regiones constantes5. Los enhancers son los elementos responsables de la expresión génica específica de tejido14,15, activando a promotores situados a largas distancias. Estos elementos funcionan mediante el reclutamiento de factores de transcripción (FT) dando lugar al ensamblaje de unos complejos multiproteicos denominados enhanceosomas16. Se acepta que, para que estos factores regulen los programas de expresión génica específica de tejido, múltiples FT han de unirse a los enhancers de una forma combinatorial, explicando así la gran diversidad existente de enhancers y programas de diferenciación génica. Una vez unidos a los enhancers, los FT reclutan otros complejos proteicos y enzimáticos para la activación de la transcripción génica, tales como el denominado complejo mediador, las enzimas modificadores de histonas y los complejos remodeladores de cromatina. El complejo mediador dirige la unión de los FT a los promotores y a los enhancers, facilitando las interacciones físicas entre ambos17. Los complejos modificadores de la cromatina y las enzimas modificadoras de histonas funcionan cambiando la estructura de la cromatina en el área de influencia de los enhancers18. Los complejos modificadores de la cromatina, tales como el complejo SWI/SNF, reposicionan o eliminan nucleosomas a lo largo del ADN de una forma dependiente de ATP19, siendo responsables de la creación de regiones libres de nucleosomas que, a su vez, facilitan el reclutamiento de otros FT dentro de un enhancer. Por otro lado, las enzimas modificadoras de las histonas son las responsables de las marcas epigenéticas que definen la estructura de la cromatina de un determinado gen. Los estudios epigenéticos han demostrado que los enhancers se caracterizan por tener marcas epigenéticas comunes, tales como altos niveles de acetilación de la histona H3, altos niveles de monometilación de la lisina 4 de la histona H3 (H3K4me1), bajos niveles de trimetilación de H3K4 (H3K4me3) y altos niveles de acetilación de la lisina 27 de la histona H3 (H3K27ac)15,20,21. Dentro de estas marcas, los altos niveles de H3K4me1 y los bajos niveles de H3K4me3 son altamente predictivos de la identidad de un enhancer, mientras que los altos niveles de H3K27ac son altamente predictivos de su actividad20. En cuanto a las marcas epigenéticas para la identificación de otros elementos reguladores destacan los altos niveles de H3K4me3, descritos para la identificación de promotores activos, y el reclutamiento del factor de unión a la secuencia CCCTC (CTCF), descrito para la identificación de secuencias aisladoras15.
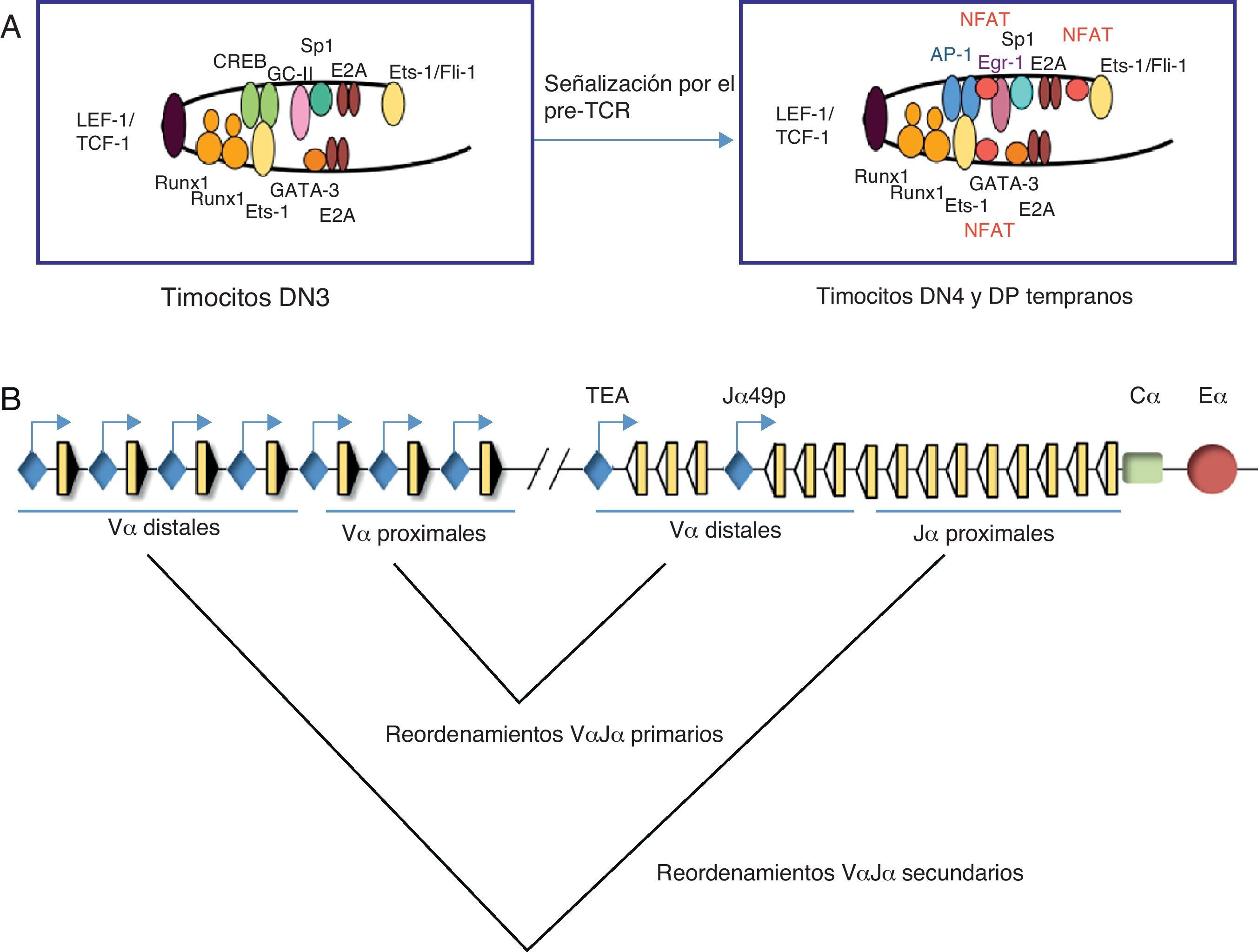
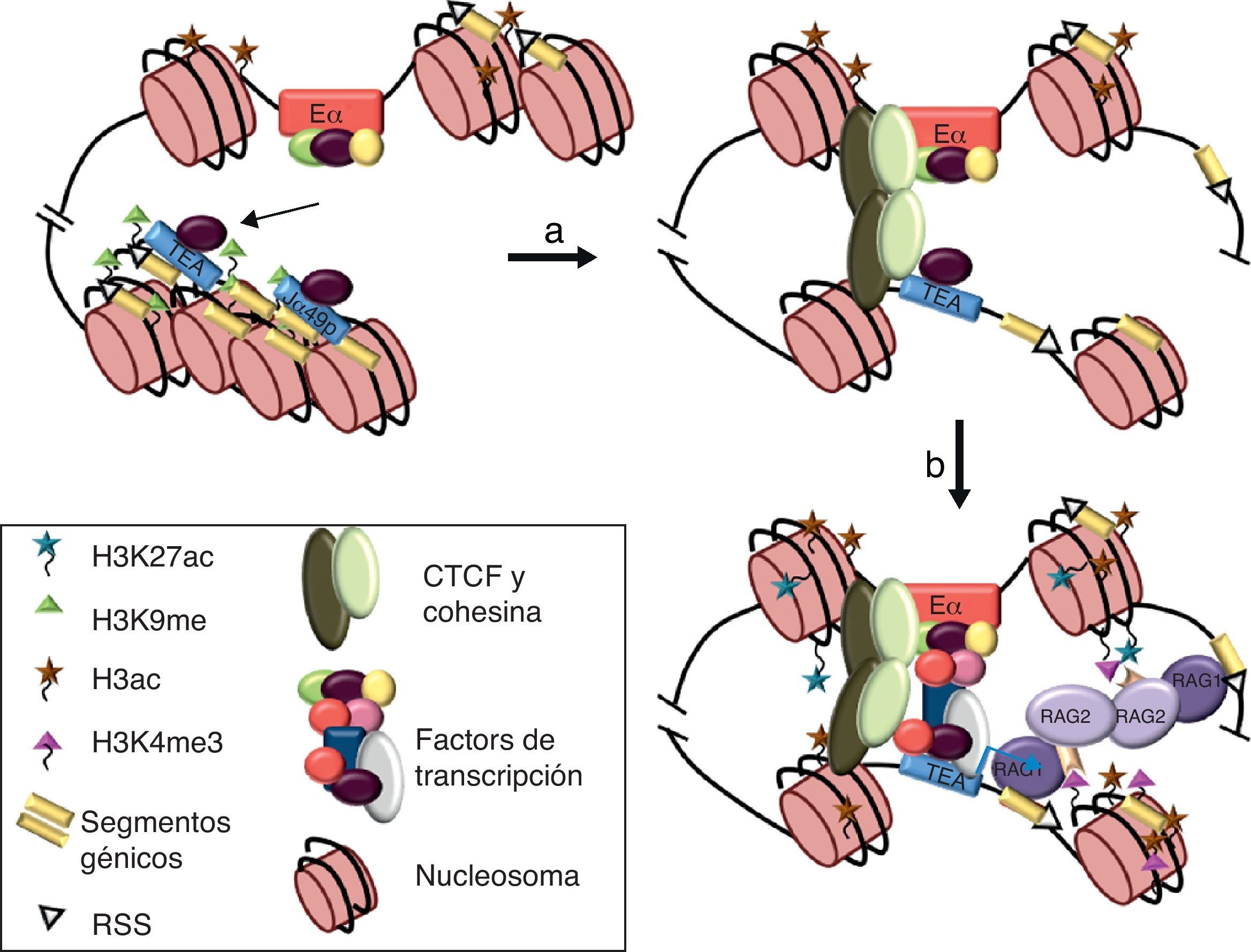
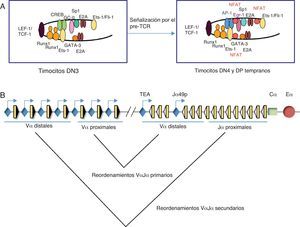
Los estudios realizados a gran escala han establecido que los enhancers son los elementos responsables de dirigir los programas de diferenciación celular, mediante la formación de plataformas moleculares constituidas por FT constitutivos específicos de tejido, capaces de guiar la unión de FT inducibles en respuesta a señales extracelulares15,18. Los enhanceosomas formados por FT constitutivos constituirían un estado preactivado del enhancer, permitiendo que este responda rápidamente a una señalización. De acuerdo con estos datos, nuestros experimentos de caracterización de los distintos enhanceosomas ensamblados en el enhancer del gen Tcra (Eα), durante el desarrollo de los timocitos (fig. 4A), han determinado que Eα se encuentra en un estado inactivo y ocupado por numerosos FT constitutivos en timocitos DN3, tales como CREB, Ets-1, Fli-1, GATA-3, y las proteínas E2A y HEB, constituyendo una plataforma molecular para el rápido reclutamiento de FT inducibles por la ruta de activación del pre-TCR en timocitos DN4-DP, tales como NFAT, AP-1 y Egr-1, pasando así a un estado activo22,23. Por tanto, el ensamblaje combinatorial de FT constitutivos e inducibles dicta la activación de Eα durante el desarrollo de los timocitos. Este mecanismo de activación de enhancers inducibles, específicos de tejido, parece representar un paradigma general en la regulación de la expresión génica en respuesta a una señalización extracelular.
Representación esquemática de los enhanceosomas de Eα y reordenamientos en el gen Tcra durante el desarrollo de los timocitos. (A) Modelo para el ensamblaje de distintos enhanceosomas de Eα durante el desarrollo de los timocitos. Los FT están indicados por óvalos o círculos coloreados. En timocitos DN3, Eα está ocupado por FT constitutivos de timocitos. Los FT TCF-1 o LEF-1 (óvalo de color morado) unidos al ADN provocan una curvatura que facilita la interacción entre los factores unidos a ambos lados. Tras la señalización por el pre-TCR, se reclutan FT inducibles, tales como NFAT (círculos rojos), AP-1 (óvalos azules) y Egr-1 (óvalo violáceo), dando lugar a la activación del enhancer en timocitos DN4 y timocitos DP tempranos23. (B) Esquema de los reordenamientos VαJα primarios y secundarios en el gen Tcra. Los segmentos génicos Vα y Jα se representan por rectángulos amarillos y las RSS con triángulos negros o blancos (según contengan una RSS con una secuencia espaciadora de 23 pares de bases o de 12 pares de bases, respectivamente). La región constante Cα se representa como un rectángulo verde. Los promotores están representados en azul. Se indica la posición de los promotores TEA y Jα49p, y la de los promotores asociados a los segmentos génicos Vα. Eα se representa como un círculo rojo.
Múltiples estudios funcionales han establecido el papel esencial de los enhancers presentes en los genes de las cadenas variables de los receptores de antígeno en el control de la recombinación V(D)J, tanto mediante su deleción en el genoma de ratón (ratones knock-out) o mediante su integración en construcciones reporteras de recombinación V(D)J transfectadas en células o microinyectadas en oocitos de ratón (ratones transgénicos)5. Por ejemplo, la deleción del enhancer presente en un gen concreto inhibe específicamente la transcripción y el reordenamiento génicos de ese gen. Estos datos funcionales se correlacionan con la disminución de las marcas epigenéticas relacionadas con la actividad de ese enhancer, lo cual se traduce en una inaccesibilidad del complejo de la ARN polimerasa ii (Pol-II) a los promotores y de las proteínas RAG-1/2 a las RSS presentes en el área de influencia del enhancer. Por tanto, los enhancers son los elementos controladores de la accesibilidad a largas distancias, actuando como iniciadores de la apertura de la cromatina en grandes regiones del genoma y controlando la activación de la transcripción y del reordenamiento génicos durante el desarrollo.
Los promotores, por otro lado, dirigen la iniciación de la transcripción desde sitios concretos, proporcionando una plataforma para el reclutamiento del complejo de la Pol-II y dirigiendo la recombinación V(D)J de un segmento o un grupo de segmentos génicos concretos5. Las evidencias experimentales demuestran que los promotores modifican la estructura de la cromatina a nivel local a diferencia del papel más global que ejercen los enhancers. Por ejemplo, (i) la deleción del promotor asociado al segmento Dβ1 inhibe la transcripción y la recombinación de ese segmento génico en concreto, dentro del grupo de segmentos génicos Dβ1Jβ, sin afectar al grupo de segmentos génicos Dβ2Jβ24; (ii) la deleción del promotor asociado al segmento génico Vβ14 inhibe su transcripción germinal y su recombinación sin afectar a los demás segmentos génicos Vβ25; (iii) en el caso del gen Tcra, los promotores TEA y Jα49p dirigen los reordenamientos que afectan a los segmentos Jα génicos situados inmediatamente 3’ del promotor, sin afectar a los situados más 3’ en el gen26. En conjunto, estas observaciones indican que, en contraste con la acción global realizada por los enhancers en los genes de las cadenas variables de los receptores de antígeno, los promotores tienen un efecto localizado en la estructura de la cromatina, estando su efecto restringido a uno o a unos pocos segmentos génicos.
Es interesante destacar el papel de Eα y los promotores asociados a los segmentos Jα y Vα en la regulación de los reordenamientos sucesivos que ocurren en el gen Tcra durante el desarrollo de los timocitos (fig. 4B) con el fin de maximizar las oportunidades para expresar una cadena TCRα productiva27. Los primeros reordenamientos VαJα que ocurren en el gen Tcra se denominan reordenamientos primarios y afectan a los segmentos Vα proximales y a los segmentos Jα distales (en función de su distancia con respecto a la localización de la región Cα). Los reordenamientos primarios ocurren en la primera fase de diferenciación de los timocitos DN3 a DP: timocitos DN4 y DP tempranos28. Si los reordenamientos VαJα primarios resultan improductivos se activan subsecuentes reordenamientos VαJα denominados reordenamientos secundarios en timocitos DP tardíos27. Los reordenamientos secundarios afectan a los segmentos Vα distales y a los segmentos Jα proximales (en función de su distancia con respecto a la localización de la región Cα). Los mecanismos moleculares implicados en la activación de los reordenamientos primarios y secundarios del gen Tcra son muy distintos entre sí. La activación de los promotores TEA y Jα49p por Eα es responsable de la activación de los reordenamientos VαJα primarios en respuesta a la señalización que reciben los timocitos DN3 a través del pre-TCR26. Nuestros recientes estudios in silico y de validación de sitios de unión para FT en las secuencias de estos promotores revelan la presencia de numerosas secuencias específicas para la unión de FT constitutivos e inducibles, tales como TCF-1/LEF-1, Egr, NFAT y AP-1, entre otros (datos no publicados), de una forma similar a como ocurre en Eα23. La activación de TEA por FT inducibles podría constituir las bases moleculares para explicar su capacidad de responder a la señalización mediada por el pre-TCR, activando los reordenamientos VαJα primarios en timocitos DN4 y DP tempranos, y de no responder a la acción del enhancer del gen Tcrd, Eδ, en timocitos DN2-DN329. Los reordenamientos secundarios se activan como consecuencia de la apertura de la cromatina de los segmentos Jα proximales, mediada por el acercamiento de los promotores Vα distales, los cuales se activan de forma independiente de Eα como consecuencia de los reordenamientos primarios30. La activación de los promotores Vα distales no es dependiente de Eα y promueve la apertura de la cromatina de los segmentos Jα proximales, permitiendo así los reordenamientos VαJα secundarios sucesivos que ocurren en el gen Tcra30.
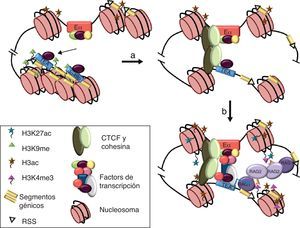
La naturaleza de la arquitectura de los genes, que codifican para las cadenas variables de los receptores de antígeno con los enhancers y promotores situados a largas distancias entre sí, precisa del establecimiento de puentes moleculares entre estos elementos para la activación de la transcripción y la recombinación V(D)J. La existencia de interacciones físicas directas entre promotores y enhancers ha sido demostrada experimentalmente en los genes de las cadenas variables de los receptores de antígeno mediante la técnica de captura de la conformación cromosómica31–33. En el caso de la activación del gen Tcra se ha demostrado además que la interacción entre Eα y el promotor TEA está facilitada por la unión de CTCF y sus cohesinas asociadas33. Aunque CTCF y las cohesinas puedan tener un papel importante en la mediación de la interacción física entre ambas secuencias y en la formación del lazo intracromosómico resultante, los FT unidos a los promotores TEA/Jα49p y Eα podrían ser esenciales en esta interacción mediante la formación de un holocomplejo funcional (fig. 5). Es interesante destacar que interacciones entre FT que se unen a Eα y los promotores TEA y Jα49p, tales como LEF-1 y AP-1, se han demostrado capaces de mediar lazos intramoleculares entre regiones 5’ y 3’ distantes en el genoma para la activación de la transcripción34.
Modelo de interacción física entre Eα y el promotor TEA para la activación de la recombinación VαJα en el gen Tcra. (a) En timocitos DN3, Eα y los promotores TEA y Jα49p están ocupados por FT constitutivos. Las histonas H3 están hiperacetiladas por acción de acetilasas de histonas unidas al enhancer, y los promotores TEA y Jα49p están reprimidos y empaquetados en cromatina silenciada por la marca epigenética H3K9me. (b y c) La interacción entre Eα y un promotor requiere la formación de un puente molecular mediado por los FT unidos a las secuencias reguladoras y facilitado por la unión de CTCF y cohesinas33. La formación de un holocomplejo funcional entre ambas secuencias reguladoras permite el ensamblaje del complejo de la Pol-II en el promotor. La activación de la transcripción conlleva la aparición de nuevas marcas epigenéticas que incluyen H3K27ac en Eα y H3K4me3 en el promotor. El paso del complejo de la Pol-II a través del ADN de los segmentos Jα situados inmediatamente 3’ del promotor abre la estructura de la cromatina y permite que las RSS sean permisibles para el reconocimiento de las proteínas RAG-1/2, iniciándose así las recombinaciones VαJα primarias del gen Tcra35,37.
El «modelo de accesibilidad» estaba basado en la observación de que la transcripción germinal (transcripción iniciada en los promotores de los segmentos génicos no reordenados de los genes de las cadenas variables de los receptores de antígeno) se correlaciona con la activación de la recombinación V(D)J durante el desarrollo de los linfocitos9. Hasta hace pocos años se pensaba que la transcripción germinal era el resultado inherente de la accesibilidad de la cromatina impartida por la activación de promotores y enhancers, de tal forma que la activación de estos elementos regularía conjuntamente la accesibilidad de las proteínas RAG-1/2 y la Pol-II al ADN mediante una apertura general de la estructura de la cromatina. El grupo de M.S. Krangel demostró que la elongación transcripcional, a lo largo de los segmentos Jα, media la activación de los reordenamientos VαJα35. Estos investigadores introdujeron una secuencia bloqueadora de la elongación transcripcional en medio de los segmentos génicos Jα e inhibieron la recombinación VαJα de los segmentos Jα situados inmediatamente 3’ de la región bloqueadora. Estos resultados han sido concluyentes para determinar que la elongación transcripcional en sí misma, procedente de los promotores asociados a los segmentos Jα, tiene un papel causal en la iniciación de la recombinación VαJα. La regulación de la recombinación V(D)J mediada por la elongación transcripcional parece ser esencial en el control del reordenamiento V(D)J en genes largos, tales como el gen Tcra, en los que la accesibilidad de la cromatina de las RSS de los segmentos Jα, dirigida por la activación de los promotores, necesita propagarse a varios segmentos génicos Jα que carecen de promotor. En el caso de segmentos génicos que tengan asociados un promotor en exclusiva no haría falta la elongación transcripcional para activar su recombinación. En estos casos, el simple ensamblaje del complejo de la Pol-II a esos promotores abriría la cromatina permitiendo el acceso de las proteínas RAG-1/2 a las RSS asociadas a esos segmentos génicos.
Aunque todos los datos anteriormente descritos apoyan el «modelo de accesibilidad», este no ha sido validado de forma definitiva hasta muy recientemente por los grupos de D.G. Schatz y M.S. Krange mediante el análisis de la unión in vivo de la proteína RAG-1 a los RSS en los genes de las cadenas variables de los receptores de antígeno durante el desarrollo de los linfocitos36,37. La proteína RAG-2 reconoce una marca de cromatina abierta, H3K4me3, a lo largo de todo el genoma en los precursores de los linfocitos38,39. Por tanto, RAG-2 se encuentra unida a toda la cromatina activa en estas células, independientemente que se trate o no de las RSS. Sin embargo, la proteína RAG-1 solo reconoce a las RSS accesibles36,37, por lo que su unión es predictiva de una recombinación V(D)J activa. Por tanto, el reclutamiento de RAG-1, y no de RAG-2, es lo que determina la especificidad de la recombinación V(D)J. En estos experimentos36,37 se analizó el reclutamiento de RAG-1 por inmunoprecipitación de cromatina a los genes de las cadenas variables de los receptores de antígeno y se observó que los promotores, los enhancers y la transcripción activa son todos esenciales para que RAG-1 pueda ser reclutada a determinadas RSS, validando de forma definitiva el «modelo de accesibilidad»9. En resumen, estos estudios han demostrado que el control de la recombinación V(D)J ocurre a través de la regulación de la accesibilidad de las RSS a la proteína RAG-1 (que funciona en conjunción con la proteína RAG-2) mediada a través de la activación de las secuencias reguladoras presentes en cada gen y de la elongación transcripcional. Actualmente, se desconoce el mecanismo molecular del reclutamiento de la proteína RAG-1 a través de la elongación transcripcional, pero probablemente esté mediada por la apertura de la cromatina que acompaña o es consecuencia del paso del complejo de la Pol-II.
Papel de la conformación génica y de la localización nuclear de los genes de las cadenas variables de los receptores de antígeno en la regulación de la recombinación V(D)JAunque está aceptado que la accesibilidad de la cromatina es fundamental para que la recombinación V(D)J pueda tener lugar, se ha demostrado que esta no es suficiente en algunos casos40, existiendo otro nivel de regulación que se ha denominado «más allá de la accesibilidad». Este nivel de regulación adicional depende de 2 procesos que ocurren en los genes de las cadenas variables de los receptores de antígeno a nivel nuclear: cambios de la conformación génica y cambios de la localización subnuclear.
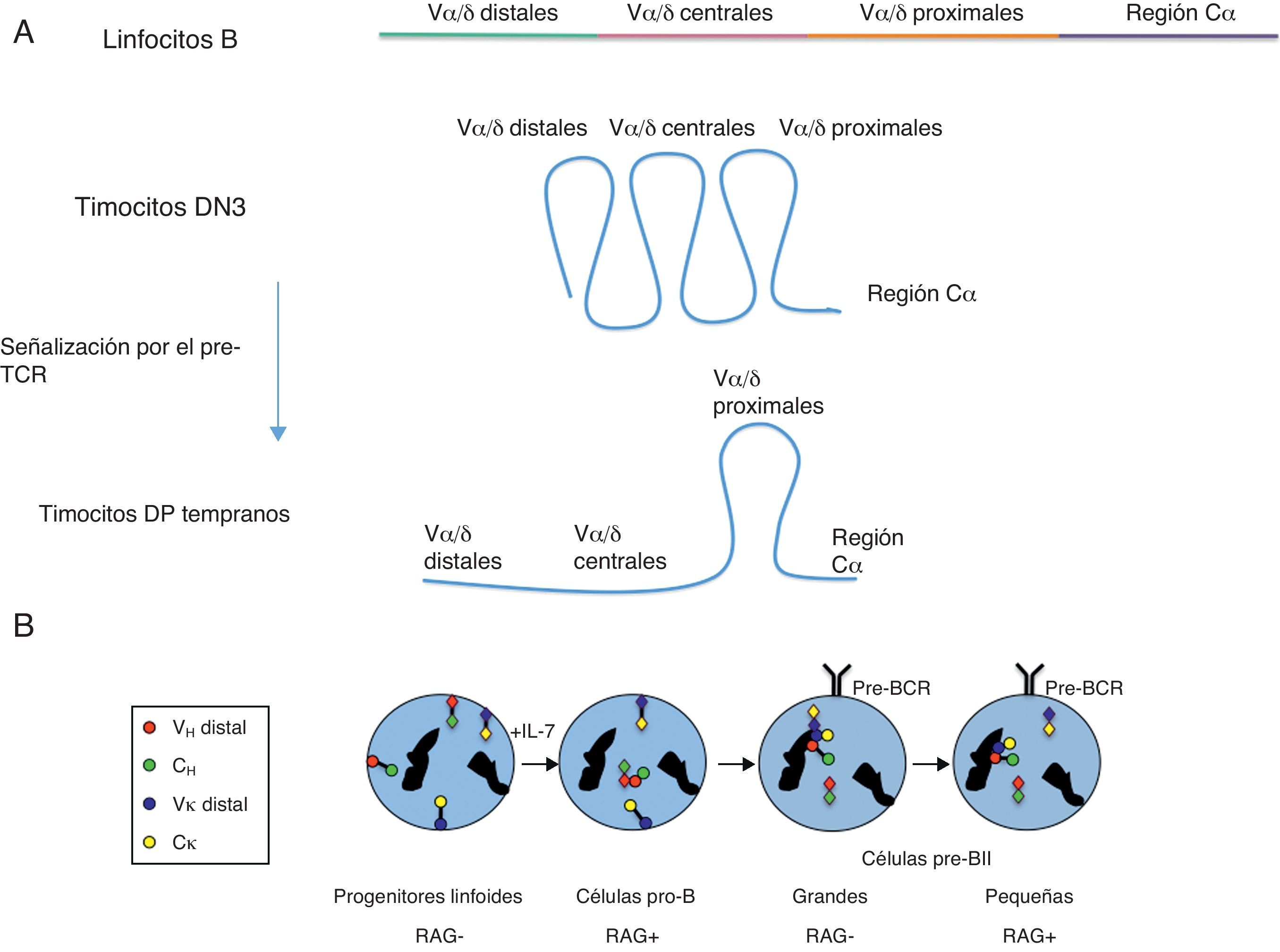
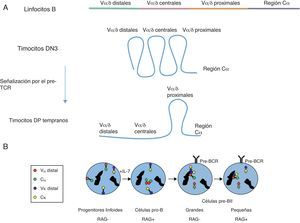
Mediante experimentos de hibridación in situ con sondas fluorescentes para las regiones proximales y distales, analizados por microscopía confocal (3D-FISH), el grupo de J.A. Skok demostró que la conformación génica y la localización en el núcleo de los genes de las cadenas variables de los receptores de antígeno tienen un papel fundamental en el proceso de recombinación V(D)J41. Así estos genes pueden encontrarse en configuraciones extendidas o contraídas como consecuencia de la separación o yuxtaposición de las regiones V con las regiones J, respectivamente. De hecho, la contracción de un gen ocurre en el mismo momento en que ese gen se transcribe y está listo para ser recombinado, incluso en ausencia de las proteínas RAG-1/241. Un ejemplo interesante de regulación de la conformación génica ha sido revelado en el análisis del locus Tcra/Tcrd por el grupo de M.S. Krangel42. Este locus contiene 2 genes que codifican para 2 cadenas variables de los receptores de antígeno, Tcrd y Tcra (fig. 2), con distintos programas de recombinación y expresión durante el desarrollo de los timocitos (fig. 3). Cada alelo del gen Tcrd solo tiene una oportunidad para reordenar sus segmentos génicos en timocitos DN2-DN3 y, por ello, los segmentos Vδ, que están distribuidos a lo largo de toda la región Vα/δ, deben tener las mismas oportunidades de reordenarse en estas células. De forma coherente con esta situación, los experimentos de 3D-FISH del locus Tcra/Tcrd han mostrado que esta región se encuentra totalmente contraída en timocitos DN3 (fig. 6A). En timocitos DP, el gen Tcra puede sufrir múltiples rondas de reordenamientos VαJα hasta conseguir una cadena TCRα capaz de ensamblarse con la cadena TCRβ (fig. 4B). Para favorecer los reordenamientos sucesivos del gen Tcra primero se activa Eα por la señalización mediada por el pre-TCR en timocitos DN4 y DP tempranos, lo cual dispara la transcripción mediada por los promotores de los segmentos Vα proximales y de los segmentos Jα distales, TEA y Jα49p, para generar los reordenamientos primarios. Como consecuencia de estos reordenamientos primarios, y si estos no han resultado productivos, se activan los reordenamientos secundarios que afectan a los segmentos Vα distales/centrales y a los segmentos Jα proximales. De forma coherente con esta situación, los experimentos de 3D-FISH han mostrado que la región que contiene los segmentos Vα distales y centrales se encuentra en una configuración extendida en timocitos DP, lo cual favorecería un uso secuencial 5’-3’ de los segmentos Vα (fig. 6A). Se desconoce el mecanismo molecular responsable de la contracción de los genes de las cadenas variables de los receptores de antígeno. Los análisis de la conformación génica del locus Tcra/Tcrd, en ausencia de Eα o Eδ, han demostrado que los enhancers no están implicados en la yuxtaposición de las regiones distales con las regiones proximales del locus42. Recientemente se ha evaluado la posible contribución de CTCF en este proceso43–45. Los datos obtenidos indican que, aunque este factor media en la regulación de la recombinación V(D)J, CTCF no es el responsable de la contracción génica de los genes de las cadenas variables de los receptores de antígeno44–46. Otros candidatos que podrían mediar en la contracción génica de estos genes incluyen determinados FT, tales como Pax5, Ikaros, YY1, el factor X de células pro/pre-B y las proteínas E41. También se postula que la transcripción por sí misma esté implicada en la regulación de la conformación génica de las cadenas variables de los receptores de antígeno.
Conformación génica y localización subnuclear de los genes de las cadenas variables de los receptores de antígeno. (A) Estados conformacionales del locus Tcra/Tcrd. Los segmentos Vα/δ están localizados en 3 regiones: distal (segmentos génicos Vα/δ situados en la región más alejada de la región constante Cα), central (segmentos génicos Vα/δ situados en la región central) y proximal (segmentos génicos Vα/δ situados en la región más cercana a la región constante Cα). El diagrama describe las distintas conformaciones génicas del locus observadas en los distintos tipos celulares: extendida del locus en linfocitos B, totalmente contraída en timocitos DN3, y extendida en las regiones Vα/δ distales/centrales y contraída de las regiones Vα/δ proximales en timocitos DP tempranos42. (B) Conformación génica y localización subnuclear de los genes Igh e Igk durante el desarrollo de los linfocitos B. Los círculos y rombos coloreados representan los extremos de los genes Igh e Igk detectados mediante sondas fluorescentes utilizadas en experimentos de 3D-FISH41. La representación de rombos y círculos permite distinguir los 2 alelos de cada gen. Las regiones VH del gen Igh se representan mediante círculos o rombos rojos. Las regiones CH del gen Igh se representan mediante círculos o rombos verdes. Las regiones Vκ del gen Igk se representan mediante círculos o rombos azules. Las regiones Cκ del gen Igk se representan mediante círculos o rombos amarillos. Las manchas negras representan las zonas de heterocromatina.
Durante los últimos 10 años se ha demostrado que la localización nuclear de estos genes tiene también un papel fundamental en la regulación de la recombinación V(D)J. Así, para que un gen recombine, se necesita que ese gen se encuentre fuera de las zonas represivas del núcleo (alejado de las regiones que contienen la heterocromatina y de la lámina interna del núcleo)41,47. Además, en el caso de los genes de las cadenas variables de los receptores de antígeno que sufren exclusión alélica, se ha observado que la asociación de estos genes con compartimentos nucleares represivos tiene un papel fundamental en este proceso41,47. La exclusión alélica de los genes Igh y Tcrb se regula a través de su fuerte tendencia a asociarse con compartimentos nucleares represivos, lo cual determina una reducida eficiencia de recombinación, contribuyendo así a que las posibilidades de que ambos alelos reordenen simultáneamente sean muy bajas48,49. En el caso del gen Igk, el mecanismo que regula su exclusión alélica es distinto. El ADN de los 2 alelos de este gen están diferencialmente metilados, lo que determina su distinta predisposición a asociarse con las áreas represivas del núcleo y a sufrir recombinación50. Actualmente se desconocen los elementos reguladores y los factores implicados en la asociación de determinados genes de cadenas variables de los receptores de antígeno con compartimentos represivos nucleares.
En la figura 6B se resumen los cambios detectados en la conformación génica y localización nuclear de los genes Igh e Igk durante el desarrollo de los linfocitos B41. En los progenitores linfoides de linfocitos T y B ambos genes están transcripcionalmente inactivos. Los estudios mediante 3D-FISH de estos genes en estos estadios tempranos indican que estos genes tienen una conformación génica extendida y se encuentran asociados a la lámina interna de la membrana nuclear. Los progenitores linfoides maduran en médula ósea, recibiendo una señalización a través de IL-76. En las células pro-B, el gen Igh sufre una relocalización nuclear hacia regiones transcripcionalmente activas, un cambio de su conformación génica a una configuración contraída y un emparejamiento de los 2 alelos del gen a través de los segmentos VH, todo lo cual permite el reordenamiento VH a DHJH en uno solo de los alelos. No se conoce el mecanismo que media en el emparejamiento de los 2 alelos Igh, pero ocurre de forma dependiente de la presencia de las proteínas RAG-1/2. Si ese reordenamiento es improductivo se inicia el reordenamiento en el otro alelo del gen Igh. En las células pro-B el gen Igk continúa con una conformación génica extendida y asociado a la membrana nuclear. En células pre-BI el alelo correctamente reordenado del gen Igh se expresa y se encuentra en zonas transcripcionalmente permisibles del núcleo, mientras que el alelo Igh no reordenado se asocia con las áreas nucleares de heterocromatina para inhibir su posible recombinación. La recombinación VHDHJH productiva de uno de los alelos del gen Igh permite su expresión en la membrana celular junto con las cadenas invariables V-preB y λ5 para dar lugar al pre-BCR, lo cual transduce una señalización intracelular que dirige la diferenciación de las células pre-BI a células pre-BII. En las células pre-BII grandes, no hay expresión de proteínas RAG-1/2 por lo que la recombinación V(D)J está inhibida. En estas células, los alelos del gen Igk sufren una contracción de su conformación génica, a la vez que estos se asocian con áreas de heterocromatina. El alelo Igh no reordenado (o reordenado improductivamente) se asocia junto con los alelos del gen Igk en zonas de heterocromatina, sufriendo una descontracción en su conformación génica. En células pre-BII pequeñas, las proteínas RAG-1/2 vuelven a reexpresarse. Esto permite el reordenamiento Vκ-Jκ de un alelo del gen Igk que se ha movido hacia posiciones del núcleo permisivas para la transcripción y el reordenamiento génicos. Si este reordenamiento resulta improductivo se activa el mismo proceso en el otro alelo del gen Igk. El alelo no reordenado (o reordenado de forma improductiva) del gen Igh permanece asociado con la heterocromatina y con una configuración extendida, reforzándose la exclusión alélica de este gen mediante la inhibición del reordenamiento VH a DHJH. El alelo del gen Igh que sufrió un reordenamiento productivo en las células pro-B permanece transcripcionalmente activo y se encuentra localizado en las áreas permisivas del núcleo celular en células pre-BII. El correcto reordenamiento de uno de los alelos del gen Igk permite la expresión de una cadena Igk que se empareja con la cadena Igh para la expresión de un BCR en la membrana celular, dando lugar a la diferenciación de las células pre-BII a linfocitos B. En los linfocitos B ambos alelos de cada gen tienen una configuración extendida y se encuentran en regiones transcripcionalmente permisivas. De esta forma, se asegura que solo un alelo de cada gen, Igh e Igk, porte un reordenamiento productivo y solo se exprese un tipo de receptor clonotípico en cada linfocito B vírgen.
En resumen, podemos concluir que las evidencias experimentales indican que la accesibilidad de la cromatina, junto con la conformación génica y la localización subnuclear de los genes que codifican para las cadenas variables de los receptores de antígeno de linfocitos, regulan de forma conjunta el proceso de recombinación V(D)J37,41,47.
FinanciaciónEl trabajo presentado está financiado por el Ministerio de Economía y Competitividad (BFU2009-08796), la Junta de Andalucía (CTS-6587 y CVI-4526) y el Consejo Superior de Investigaciones Científicas (201020E060), parcialmente financiados con fondos FEDER de la Unión Europea.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.