Los talleres de histocompatibilidad, español primeramente e ibérico posteriormente, tienen una trayectoria amplia y tradicional desde hace muchos años, así como los talleres internacionales1–3. Estos han permitido la estandarización y el control de calidad en los diferentes laboratorios, cuando los programas de calidad actuales eran solo un rudimento. Hoy en día, tras la implementación de Garantía Externa de Calidad para Laboratorios de Inmunología Diagnóstica (GECLID) como programa de calidad diagnóstica en inmunología, amparado por la Sociedad Española de Inmunología, los talleres funcionan más como una intercomparación de resultados y métodos entre laboratorios con metodologías distintas, cuyo resultado no es el cumplimiento de unas normas más o menos estrictas, sino un foro de discusión y análisis.
El Taller Ibérico de Histocompatibilidad del año 2013 ha constado, al igual que en años precedentes, de 2 componentes principales: un primer componente de asignación e identificación de alelos HLA que proseguía abierto desde hace 2 años y dirigido por Antonio Balas del Centro de Transfusión de Madrid, y un segundo componente de análisis de situación de los procedimientos de realización de pruebas cruzadas en guardias de trasplante de órganos y dirigido por Manuel Muro del Hospital Universitario Virgen de la Arrixaca de Murcia y Alberto Torio del Hospital Insular de Gran Canaria.
A partir de este punto, los resultados referenciados y comentados corresponderán al segundo componente de este Taller de Histocompatibilidad 2013.
Datos referentes al procedimiento de pruebas cruzadas en guardias de trasplante de órganosLa realización de pruebas cruzadas en la guardia de trasplante de órganos así como la implementación de la tecnología luminex ha generado un amplio conocimiento del campo de la sensibilización HLA como nunca antes se había producido4–7 pero, al mismo tiempo, genera una serie de problemáticas y una gran necesidad de homogenización y estandarización entre los diferentes laboratorios. El componente del año anterior ya publicado hace referencia a la estandarización en los análisis de tecnología luminex8, por ello nos parecía interesante abordar la problemática en una guardia de trasplante.
En este segundo componente participaron y enviaron resultados válidos un total de 25 laboratorios de España y uno de Argentina, los cuales se reflejan en la tabla 1.
Laboratorios participantes en el Taller de Histocompatibilidad 2013 de Pruebas Cruzadas de Trasplante
| Taller 2013: pruebas cruzadas | ||
| Coordinadores: Manuel Muro y Alberto Torio | ||
| N.o | Responsables | Laboratorio |
| 1 | Manuel Muro | Hospital Clínico U. Virgen de la Arrixaca – Murcia |
| 2 | Antonio Balas/José L. Vicario | Centro de Transfusión de la Comunidad de Madrid |
| 3 | Alberto Torio | Hospital Insular - Las Palmas |
| 4 | Francisca González Escribano | Hospital U. Virgen del Rocío – Sevilla |
| 5 | Luis Marín | Hospital Clínico Universitario – Salamanca |
| 6 | Dolores Planelles | Centro Transfusión Comunidad Valenciana |
| 7 | Javier Gonzalo Ocejo | Hospital U. Marqués de Valdecilla – Santander |
| 8 | Pilar Sánchez Mozo | Complejo Hospitalario Universitario - A Coruña |
| 9 | Susana M. Soto de Ferrini | Laboratorio Central Redes y Programas – Corrientes |
| 10 | María J. Castro, Estella Paz | Hospital U. 12 de Octubre – Madrid |
| 11 | Iván Bernardo | Hospital San Pedro – Logroño |
| 12 | Cristina Moreno | Clínica Universitaria de Navarra - Pamplona |
| 13 | Antonio López/Rebeca Alonso | Hospital Central de Asturias - Oviedo |
| 14 | Natalia Pomar/Julio Iglesias | Hospital Son Espases - Mallorca |
| 15 | Cristina González Roiz | Hospital Infanta Cristina - Badajoz |
| 16 | Antonio Nieto | Hospital Puerta del Mar - Cádiz |
| 17 | Jesús Ontañón | Hospital General - Albacete |
| 18 | Jose L. Castañer | Hospital U. Ramón y Cajal - Madrid |
| 19 | Pilar Lasierra | Hospital Clínico Universitario - Zaragoza |
| 20 | Abelardo Caballero | Hospital Regional Carlos Haya - Málaga |
| 21 | Andrés Franco | Complejo Hospitalario de Canarias - Tenerife |
| 22 | Arantxa Rementeria | Clínica Puerta de Hierro – Madrid |
| 23 | Rafael Solana/Rafael González | Hospital U. Reina Sofía - Córdoba |
| 24 | Mercedes Nocito | Hospital Clínico - Valladolid |
| 25 | María D. de Juan | Hospital de Donostia – San Sebastián |
| 26 | Jaume Martorell | Hospital Clínic i Provincial - Barcelona |
A cada laboratorio se le envío por correo electrónico una encuesta con diferentes cuestiones relevantes para el procedimiento de pruebas cruzadas en guardias de trasplante, de las cuales obtuvimos datos interesantes, que se comentan a continuación.
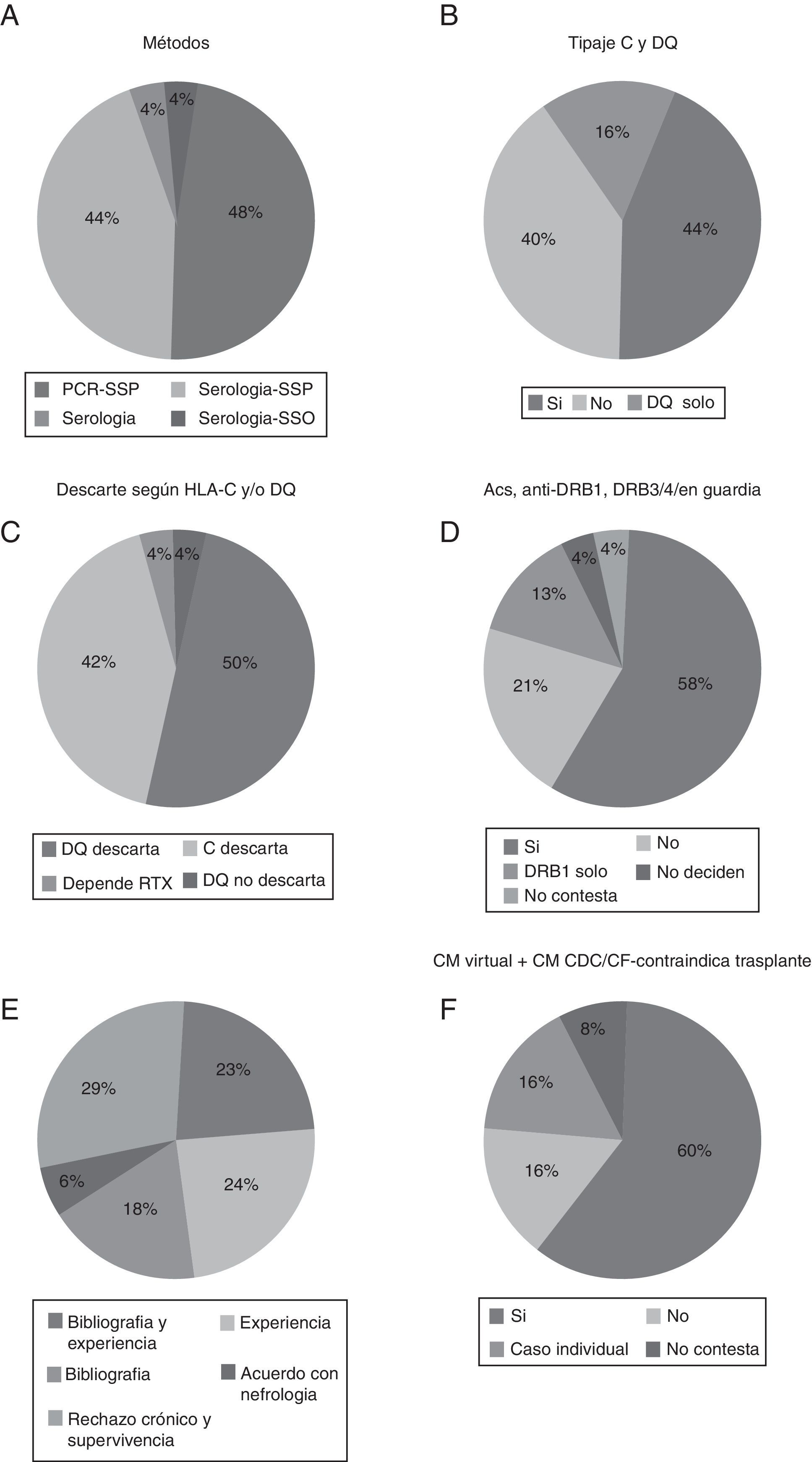
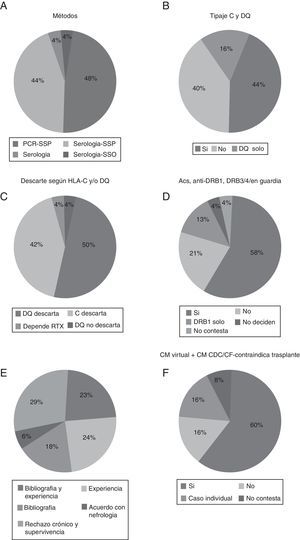
En primer lugar, respecto al método de tipificación utilizado en la guardia de trasplante de órganos evidenciamos que la técnica utilizada preferentemente era la de PCR-SSP, aunque sorprende que el 44% de los laboratorios que enviaron sus resultados utilizaban aún las técnicas serológicas, generalmente para HLA de clase i (fig. 1A).
A) Método de tipificación HLA utilizado en la guardia de trasplante de órganos. B) Porcentaje de laboratorios que tipifican HLA-C y -DQ en guardia. C) Porcentajes según los tengan en cuenta en la guardia. D) Porcentaje de laboratorios que descartan si hay presencia de anti-DSA frente DRB1 y/o DRB3/4/5. E) Justificación de ello. F) Porcentaje de laboratorios que descartan trasplante si aparece anti-DSA por luminex pero no por serología o citometría.
En segundo lugar, más de la mitad de los laboratorios hacen tipificación de HLA-C y/o HLA-DQ en la guardia (60%) (fig. 1B) y la mayoría de los laboratorios descartan el trasplante si aparece un anti-DSA para estos loci, un 50% descartan en HLA-DQ y un 40% para HLA-C (fig. 1C). También se preguntó por si la presencia de anticuerpos anti-DRB1 y -DRB3/4/5 contraindicaba el trasplante en su centro. Un 71% utilizaban DRB1 como contraindicación para el trasplante (fig. 1D). La mayoría de los laboratorios también tienen claro que intervienen en el rechazo y la supervivencia, y la bibliografía consultada y la experiencia propia del laboratorio son preponderantes en las causas aportadas para su uso (fig. 1E).
Con respecto a si los anticuerpos detectados por tecnología luminex y no detectados por una prueba cruzada, bien serológica bien citométrica, contraindican el trasplante, obtuvimos que en la gran mayoría (60%) de los laboratorios la presencia de estos anticuerpos detectados solo por luminex sí contraindican el trasplante (fig. 1F).
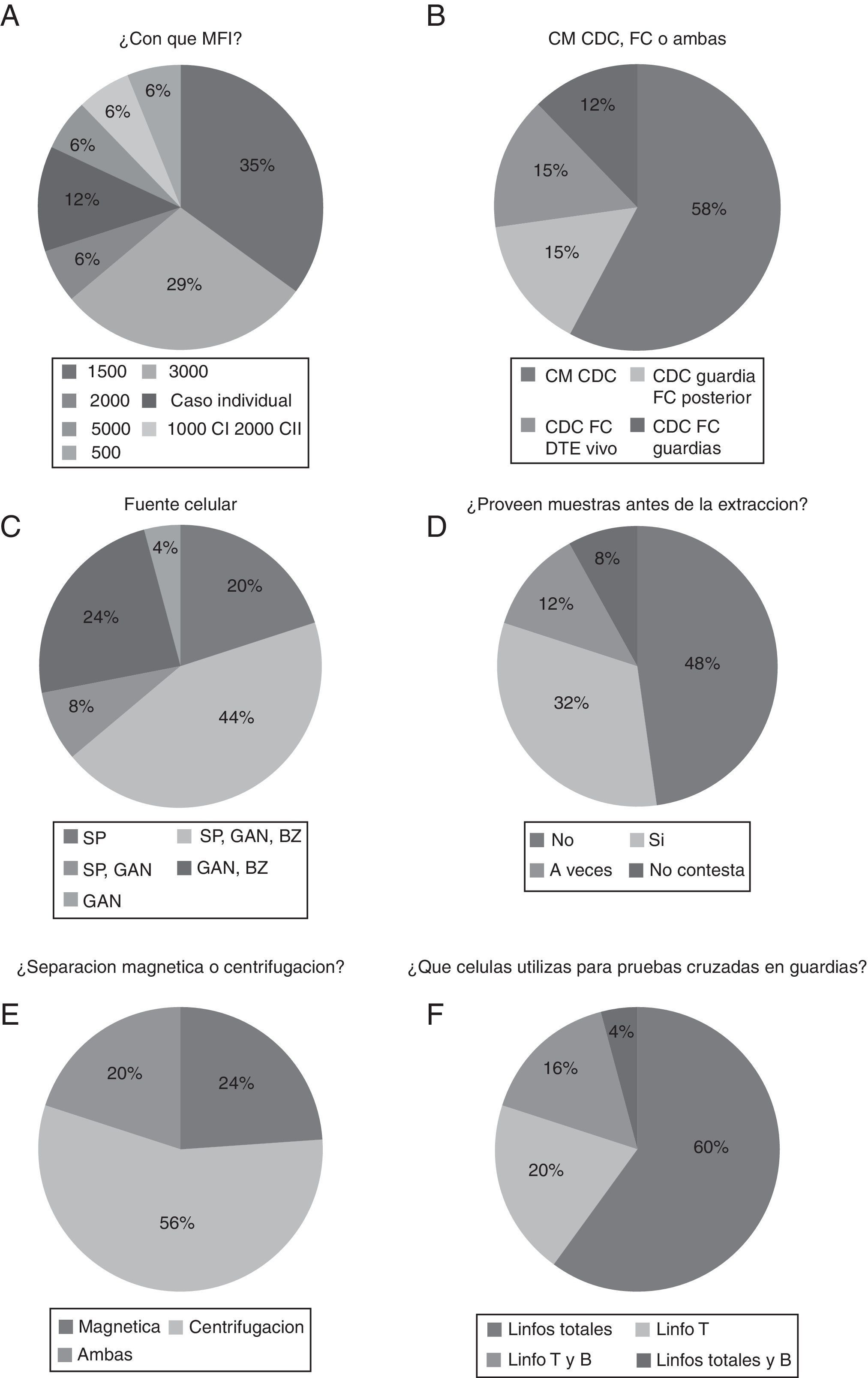
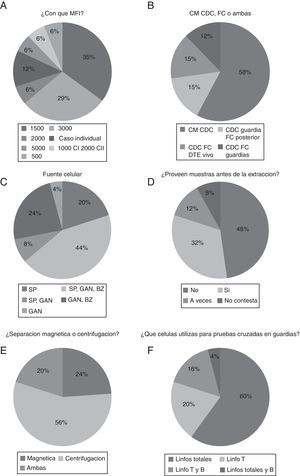
Respecto al punto de corte en tecnología luminex que podría contraindicar un trasplante, la mayoría lo ponen en 1.500-3.000 (70%), siendo 1.500 la más utilizada (35%), y 3.000 (29%) (fig. 2A). Con respecto a la utilización de diferentes métodos para la realización de la prueba cruzada, la mayoría (73%) de los laboratorios hacen prueba cruzada por CDC en la guardia y solo 12% de ellos lo hacen por citometría de flujo en la guardia de trasplante y 15% de ellos hacen CDC en la guardia y citometría en días posteriores (fig. 2B). En cuanto a la fuente de células utilizadas por los laboratorios en la guardia, obtuvimos que un gran porcentaje de laboratorios usan las 3 fuentes principales (sangre periférica, ganglio linfático y bazo del donante de órganos) (44%) con un 74% de laboratorios que utilizan sangre periférica sola o combinada con ganglio y/o bazo (fig. 2C). Con respecto a si se recibe muestra del donante en el laboratorio previa a la extracción, los resultados obtenidos es que solo al 32% de los laboratorios se les provee de la misma (fig. 2D). En el análisis de la técnica de separación celular la centrifugación en gradiente de densidad es realizada en el 76% de laboratorios, siendo la técnica mayoritaria (fig. 2E). Por otro lado, las células mayoritariamente utilizadas en la prueba cruzada son linfocitos totales (60%) con un porcentaje del 20% que utilizan solamente linfocitos T (fig. 2F).
A) Proporción de laboratorios que descartan con una MFI determinada. B) Laboratorios que realizan prueba cruzada o cross-match por diferentes métodos. C) Fuente de células utilizadas por los laboratorios en la guardia. D) Proporción de laboratorios que reciben las muestras antes de la extracción. E) Laboratorios que realizan separación celular magnética o centrifugación en gradiente de densidad. F) Resumen de los laboratorios según las células utilizadas en la prueba cruzada.
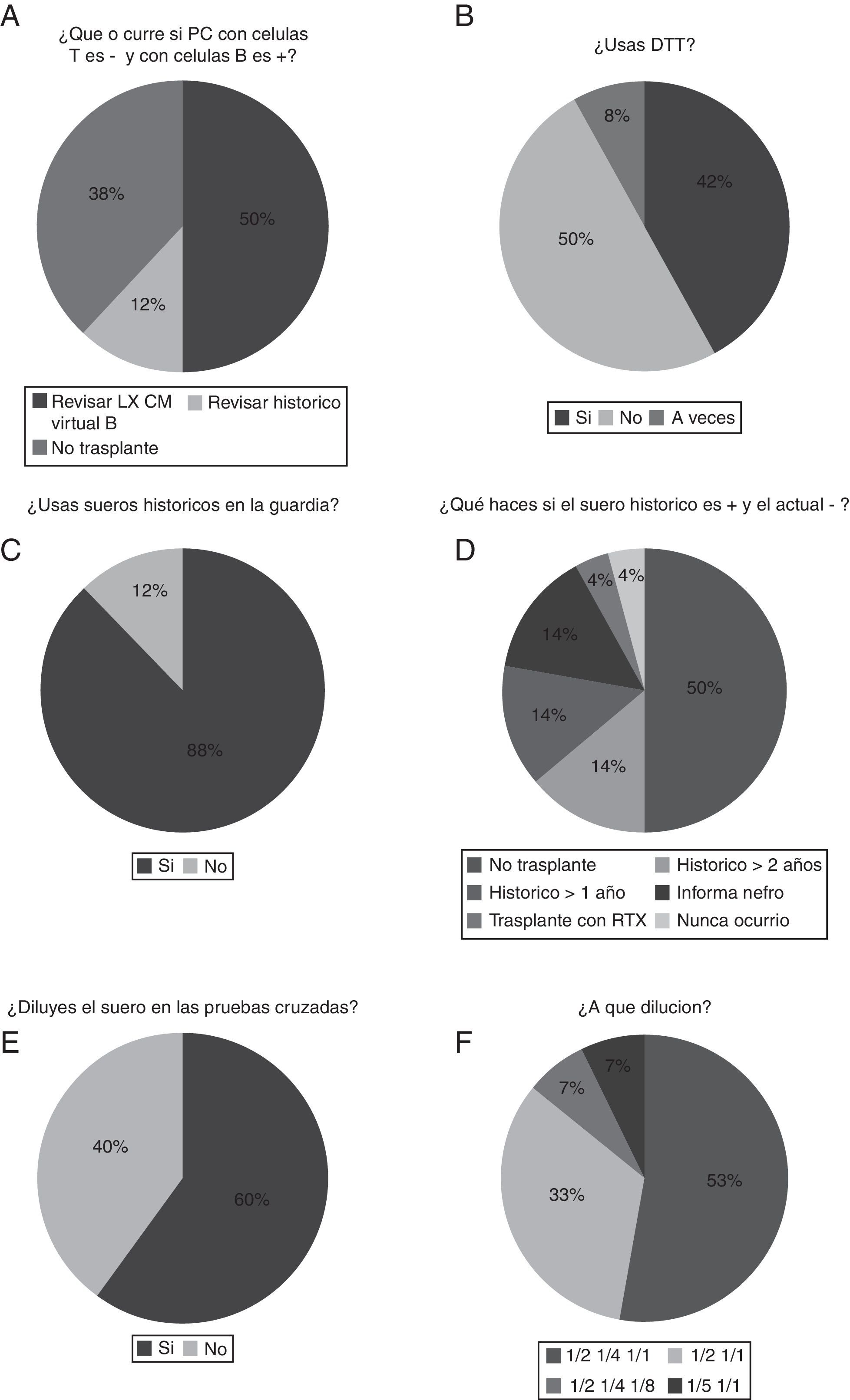
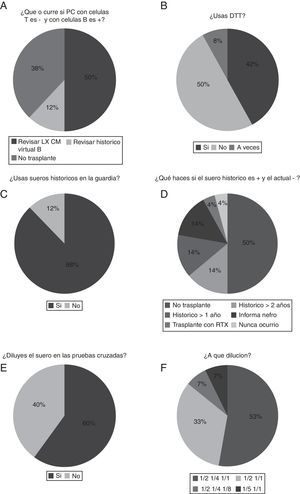
Si la prueba cruzada resulta negativa para células T y positiva para células B, el 38% de los laboratorios contraindican el trasplante y el 50% revisa el dato de luminex mediante una prueba cruzada virtual (fig. 3A). Con respecto al uso de ditiotreitol, el porcentaje de laboratorios que lo utilizan en las pruebas cruzadas es del 42% (fig. 3B).
A) Discrepancia en el caso de que la prueba cruzada con linfocitos T sea negativa y la de linfocitos B sea positiva. B) Porcentaje de laboratorios que utilizan ditiotreitol (DTT). C) Porcentaje de laboratorios que utilizan sueros históricos en la guardia. D) Decisión de actuación si la prueba cruzada con suero histórico es positiva y la prueba cruzada con suero actual es negativa. E) Proporción de laboratorios que hacen dilución del suero en la prueba cruzada. F) Resumen de la dilución efectuada.
Analizando el uso o no de sueros históricos, el porcentaje de laboratorios que utilizan sueros históricos en la guardia es realmente mayoritario (88%) (fig. 3C).
Respecto a la decisión de actuación si la prueba cruzada con suero histórico es positiva y la prueba cruzada con suero actual es negativa, el 50% opta por no trasplantar y, sin embargo, el 28% de los laboratorios si este histórico es mayor de un año (14%) o de 2 (14%) deciden realizar el trasplante (fig. 3D). La proporción de laboratorios que hacen dilución del suero en la prueba cruzada es del 60% (fig. 3E). La dilución efectuada suele ser de ½ y ¼ (53% de laboratorios [fig. 3F]). Un 33% de los laboratorios solo diluyen a ½. Además, todos los laboratorios hacen duplicados de los sueros en la prueba cruzada.
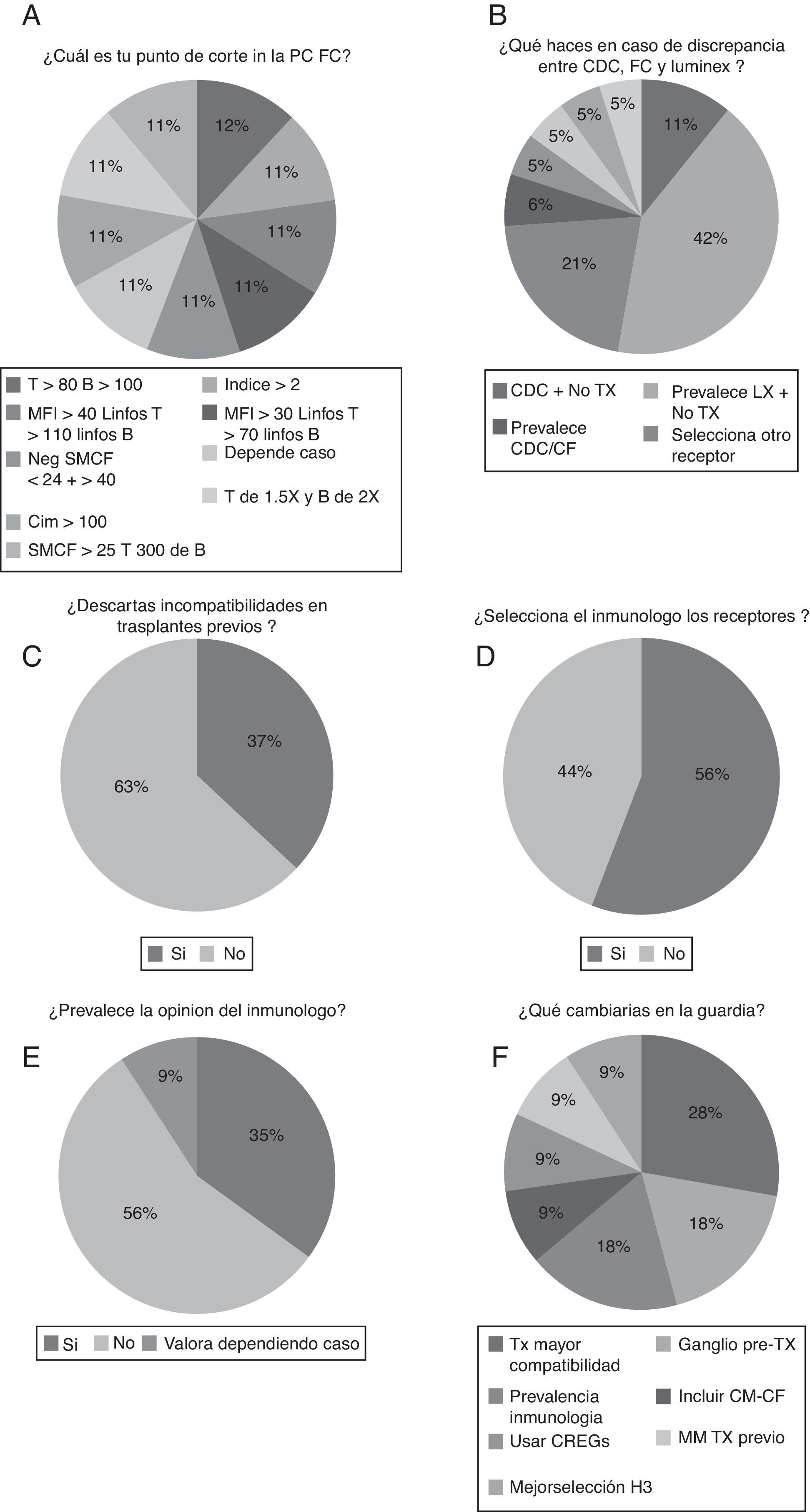
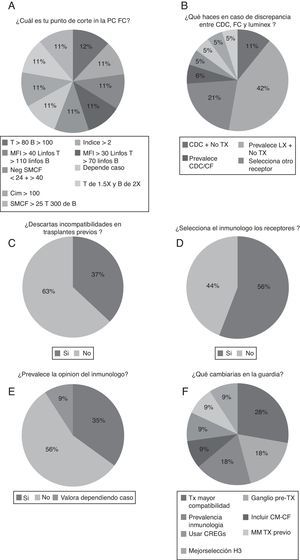
En cuanto a los criterios para establecer un punto de corte para dar una prueba cruzada citométrica como positiva fueron diversos y sin homogeneidad (fig. 4A). Con respecto a la decisión final ante una discrepancia entre los resultados de diferentes métodos, la tecnología luminex es la que parece predominar sobre las otras y puede contraindicar el trasplante (42%) (fig. 4B).
A) Criterios de punto de corte para dar una prueba cruzada citométrica como positiva. B) Decisión ante discrepancia entre los resultados de diferentes métodos. C) Porcentaje de laboratorios que descartan las incompatibilidades en trasplantes previos. D) Laboratorios en los que el responsable del mismo selecciona los receptores. E) Proporción de laboratorios en los que en la guardia prevalece la opinión del inmunólogo. F) Resumen de propuestas de cambio en los protocolos de guardia de trasplante.
Por otro lado, el porcentaje de laboratorios que descartan las incompatibilidades presentes en trasplantes previos es solo del 37% (fig. 4C). Además, la mayoría solo descarta en HLA de clase i (90%).
En cuanto a la cuestión referente a la selección de los receptores renales, el 56% de los laboratorios de histocompatibilidad selecciona los receptores (fig. 4D), sin embargo, en la guardia prevalece la opinión del inmunólogo en un 35% de los casos (fig. 4E). No obstante, la mayoría de los laboratorios no cambiaría ningún parámetro de su guardia (57%) (fig. 4F) y las propuestas de cambio en los protocolos de guardia de trasplante serían una necesidad de trasplantar con una mayor compatibilidad HLA (28%), la posibilidad de obtención de un ganglio linfático pretrasplante (18%) y una mayor prevalencia de los criterios inmunológicos (18%).
Conclusiones del tallerBuena participación con un total de 26 centros con resultados enviados. En la guardia de trasplante la técnica PCR-SSP es preferentemente utilizada, además la mitad de los laboratorios aproximadamente tipifican HLA-C y -DQ y además los tiene en cuenta para contraindicar trasplante. Igualmente para DRB1, siendo la razón aportada los datos proporcionados por la bibliografía y la experiencia de los laboratorios.
La mayoría de los laboratorios tienen en cuenta los anticuerpos detectados solamente por luminex y con un límite de MFI con punto de corte entre 1.500-3.000. Asimismo, la mayoría hacen únicamente prueba cruzada CDC en guardia y solo un 12% hace prueba cruzada citométrica en guardia. La fuente de células empleada para las pruebas cruzadas es diversa, aunque mayoritariamente son sangre periférica y ganglio linfático. La separación celular en su mayoría se realiza por centrifugación en gradiente de densidad. La mayoría de los laboratorios hacen pruebas cruzadas con células no separadas o T solas. Los laboratorios que hacen pruebas cruzadas con células B, si esta es positiva y negativa en células T, realizan prueba cruzada virtual por luminex para resolver. La técnica con el uso de ditiotreitol no es ampliamente utilizada. La mayoría de los laboratorios usan sueros históricos y la mitad de ellos contraindican trasplante aunque el resultado con el suero actual sea negativo. La mayoría de los laboratorios hacen dilución de los sueros en las pruebas cruzadas y preferentemente a diluciones ½ y ¼. Todos los laboratorios hacen duplicados de los sueros. El punto de corte de la prueba cruzada por citometría de flujo es diverso, y en caso de discrepancias entre los diferentes métodos prevalece mayoritariamente el resultado aportado por luminex. La mayoría de los laboratorios no descartan incompatibilidades en trasplantes previos y más de la mitad seleccionan los receptores, aunque no prevalece la opinión del inmunólogo. Sin embargo, más de la mitad de los laboratorios no cambiaría nada de su protocolo de guardia. Los que sí cambiarían su protocolo de guardia, lo harían preferentemente buscando una mayor compatibilidad HLA la cual sería deseable. Y, por último, otra conclusión de este taller es la posibilidad de la obtención de ganglio linfático antes del comienzo de la extracción y un mayor peso en la opinión del criterio inmunológico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores expresamos nuestro agradecimiento a todos los laboratorios que han podido enviar los resultados y por el tiempo empleado en los análisis, así como por las sugerencias y anotaciones de los mismos. Asimismo agradecemos las interesantes sugerencias emitidas por los laboratorios. Este trabajo fue realizado, en parte, gracias a la ayuda del proyecto FISPI11/02686. Instituto de Salud Carlos III. Ministerio de Sanidad y Consumo.
El orden de los autores, a partir del tercer autor es arbitrario y depende del envío de los resultados del Taller.