El estudio de biomarcadores pronósticos en gammapatías monoclonales de significado incierto (MGUS) exige usar cohortes muy grandes y seguimientos prolongados, dada la baja tasa de conversión a mieloma múltiple (MM). Nuestro objetivo fue poner a punto un modelo que permita usar con alta fiabilidad cohortes menores y seguimientos más reducidos.
Pacientes y métodosEstudiamos 64 pacientes con MGUS, seguidos prospectivamente durante 6±0,24 años. Los clasificamos en fenotipo evolving y non-evolving dependiendo del aumento o no de los niveles de inmunoglobulina monoclonal a lo largo del tiempo. Evaluamos el riesgo de conversión a MM en función de estos fenotipos y si los factores que predicen la conversión a MM se asocian con la aparición de un fenotipo evolving.
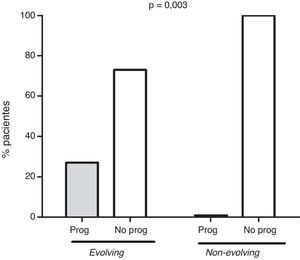
ResultadosOnce pacientes mostraron fenotipo evolving y 53 fenotipo non-evolving. Todos los pacientes que convirtieron a MM mostraron previamente un fenotipo evolving (p=0,003). Al diagnóstico el fenotipo evolving se asoció con proteínas monoclonales de isotipo IgA (27 vs. 9%), niveles de IgG monoclonal superiores a 1.500mg/dl (p=0,007, OR 9,8) y cocientes kappa/lambda alterados (p=0,001, OR 11,7).
ConclusionesLos factores de riesgo de desarrollar un fenotipo evolving en pacientes con MGUS coinciden con los que ya se han descrito para el desarrollo de MM. Estos datos muestran la validez del modelo evolving/non-evolving para estudiar marcadores que predigan la evolución de pacientes con MGUS, y confirman el papel de los niveles de inmunoglobulina monoclonal y la ratio de cadenas ligeras en el pronóstico de esta enfermedad.
The assessment of prognostic biomarkers in monoclonal gammopathies of uncertain significance (MGUS) requires using large cohorts and long follow-ups, due to the low rate of conversion to multiple myeloma (MM). The aim of this article is to develop a model that allows smaller cohorts and shorter follow-ups to be used with high reliability.
Patients and methodsA total of 64 MGUS patients were studied and followed-up prospectively for 6±0.24 years. Patients were classified as evolving or non-evolving, depending on whether the monoclonal protein levels increased or not over time. The risk of conversion to MM was tested based on these phenotypes, and whether the factors that predict conversion to MM are also associated with the appearance of an evolving phenotype.
ResultsEleven patients showed an evolving phenotype, and 53 a non-evolving one. All patients who converted to MM previously showed evolving phenotype (P=.003). At diagnosis, evolving phenotype associated with monoclonal gammopathies of IgA isotype (27 vs. 9%), monoclonal IgG levels above 1,500mg/dl (P=.007, OR 9.8) and altered kappa/lambda ratios (P=.001, OR 11.7).
ConclusionsRisk factors for developing an evolving phenotype in MGUS patients are the same as those already described for the development of MM. These data show the validity of the evolving/non-evolving model to study markers to predict the outcome of MGUS patients, and confirm the role of the levels of monoclonal IgG and the light chains ratio in the prognosis of this disease.
Las gammapatías monoclonales son un grupo de desórdenes caracterizados por la proliferación de un clon de células plasmáticas (CP) que sintetiza una inmunoglobulina monoclonal1. La gammapatía monoclonal de significado incierto (MGUS) es la alteración de CP más frecuente. Su incidencia aumenta con la edad y afecta aproximadamente al 3% de la población mayor de 50 años1–3. Es un estado asintomático, de etiología no clara, caracterizado por presentar un porcentaje de CP menor del 10% en la médula ósea y una inmunoglobulina monoclonal menor de 3.000mg/dl4–6.
Estos pacientes requieren un seguimiento indefinido debido al riesgo (1% al año) de progresión a mieloma múltiple (MM)7–9. En estos pacientes la progresión ocurre cuando el clon de CP escapa a los mecanismos reguladores. Se han descrito una serie de alteraciones genéticas que promueven la inestabilidad genómica de la célula, como traslocaciones que afectan a la cadena pesada de la inmunoglobulina, deleciones del cromosoma 13, desregulación de la ciclina D y fenómenos de hiperdiploidía10.
Sin embargo, muchos pacientes con MGUS nunca progresan a mieloma, y sus niveles de inmunoglobulina monoclonal permanecen estables a lo largo de su vida. Por ello, es de gran interés definir biomarcadores que identifiquen a los pacientes con la mayor probabilidad de progresión2. Se han definido 2 subtipos de MGUS: evolving y non-evolving. Los primeros muestran un aumento progresivo y constante de la inmunoglobulina monoclonal durante los 3 primeros años desde el diagnóstico y una mayor probabilidad de progresión a mieloma, mientras que los segundos se caracterizan por una cantidad de inmunoglobulina monoclonal estable a lo largo del tiempo11,12.
Sin embargo, la definición de evolving y non-evolving requiere de un periodo de seguimiento. A lo largo del tiempo, se han descrito una serie de factores que al diagnóstico estratifican el riesgo de conversión a MM en el MGUS. Así, un porcentaje elevado de CP en la médula ósea (entre 6 y 9%) o la presencia de CP circulantes (entidades que se ven raramente en el MGUS) se asocian con una mayor probabilidad de progresión13,14. La presencia de CP con un fenotipo aberrante también aumenta el riesgo de progresión14–16. Sin embargo, los marcadores más usados actualmente son la ratio de cadenas ligeras, los niveles elevados de componente monoclonal (>1.500mg/dl) y una proteína monoclonal distinta de IgG7,13,17. Se ha descrito recientemente en una cohorte de 1.148 pacientes seguidos durante 20 años que la combinación de los 3 factores anteriores se asocia con un elevado riesgo de progresión (58% a 20 años frente a un 5% en aquellos pacientes sin ninguno de estos factores)17. Sin embargo, tanto la validación de estos marcadores pronósticos como el descubrimiento de otros que se asocien más estrechamente con la conversión a MM es complicada porque se necesitan series muy amplias de pacientes seguidas durante largos periodos de tiempo. Basándonos en la asociación del fenotipo evolving con un mayor riesgo de conversión a mieloma nos propusimos estudiar si el clasificar a los pacientes en evolving/non-evolving es un modelo adecuado para el estudio de nuevos marcadores pronósticos en el MGUS. Esto requeriría menos tiempo de seguimiento, ya que en 3 años se puede saber si un paciente es evolving. También requeriría cohortes más reducidas, ya que entre un 15 y un 20% de los MGUS muestran este fenotipo.
Materiales y métodosEn este estudio se incluyeron 64 pacientes diagnosticados de MGUS en el Hospital Ramón y Cajal de Madrid siguiendo los criterios del International Myeloma Working Group4. Todos los pacientes firmaron un consentimiento informado antes de ser incluidos en el estudio. Todas las muestras de sangre que se usaron en el estudio se extrajeron para el seguimiento de su enfermedad.
Las características de los pacientes se muestran en la tabla 1.
Características de los pacientes (N=64)
| Sexo (hombres/mujeres) | 22/42 |
| Edad (años), media±EE | 66,47±1,45 |
| Isotipo (IgG/IgA), n (%) | 56/8 (86/14) |
| Tiempo de seguimiento (años), media±EE | 6±0,24 |
| Conversión a MM (sí/no) | 3/61 |
| Fenotipo (evolving/non-evolving) | 11/53 |
EE: error estándar; MM: mieloma múltiple.
Se estudió al menos una muestra anual de suero de cada paciente. La caracterización del tipo de proteína monoclonal se realizó mediante electroforesis de proteínas séricas y posterior inmunofijación en el sistema electroforético Hydrasys (Sebia).
La concentración de inmunoglobulinas (IgG, IgA e IgM) en suero se cuantificó por nefelometría (IMMAGE® 800, Beckman Coulter, California, EE. UU.). La concentración de cadenas ligeras (kappa y lambda) se ensayó por turbidimetría (Analizador SPAplus®, Binding Site, Birmingham, Reino Unido) mediante el kit Freelite® (Binding Site). Dado que ningún paciente mostraba alteraciones renales se tomó como intervalo de normalidad para la ratio kappa/lambda 0,26-1,6511.
La cuantificación de inmunoglobulina monoclonal durante el seguimiento se utilizó para monitorizar la aparición de fenotipo evolving (aumento de la inmunoglobulina monoclonal a lo largo del tiempo) o non-evolving (componente monoclonal estable durante el seguimiento).
El estudio de CP en la médula ósea se realizó mediante citometría de flujo en un citómetro FACScan (Becton-Dickinson, New Jersey, EE. UU.).
Para el análisis estadístico se utilizó el programa GraphPad Prism® 5. Las variables categóricas se analizaron mediante el test exacto de Fisher. Se estudió su valor pronóstico mediante el estudio de la odds ratio y el intervalo de confianza (95%). Las variables cuantitativas se analizaron mediante el test no paramétrico de Mann-Whitney. Las diferencias se consideraron estadísticamente significativas cuando la p fue inferior a 0,05.
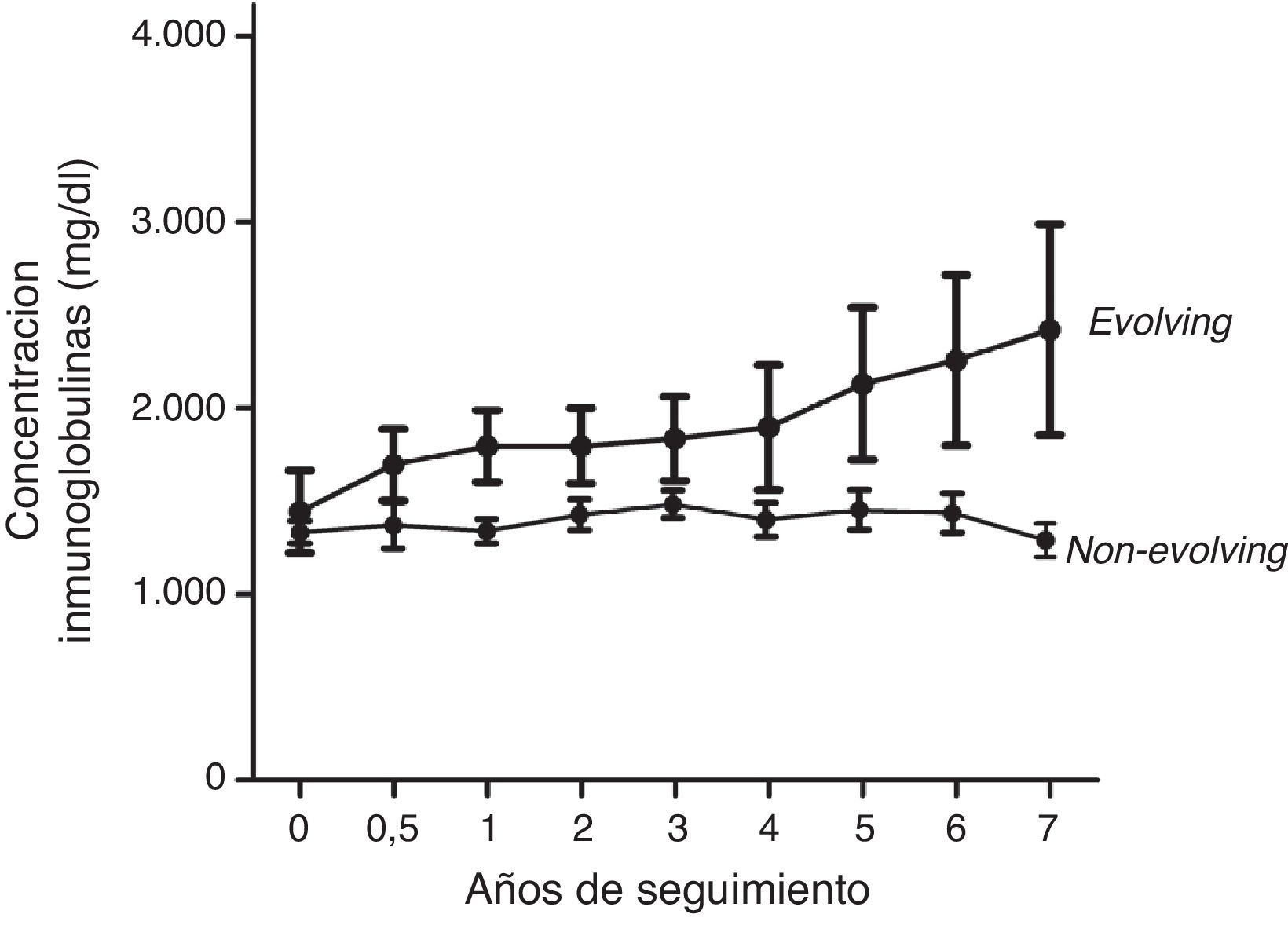
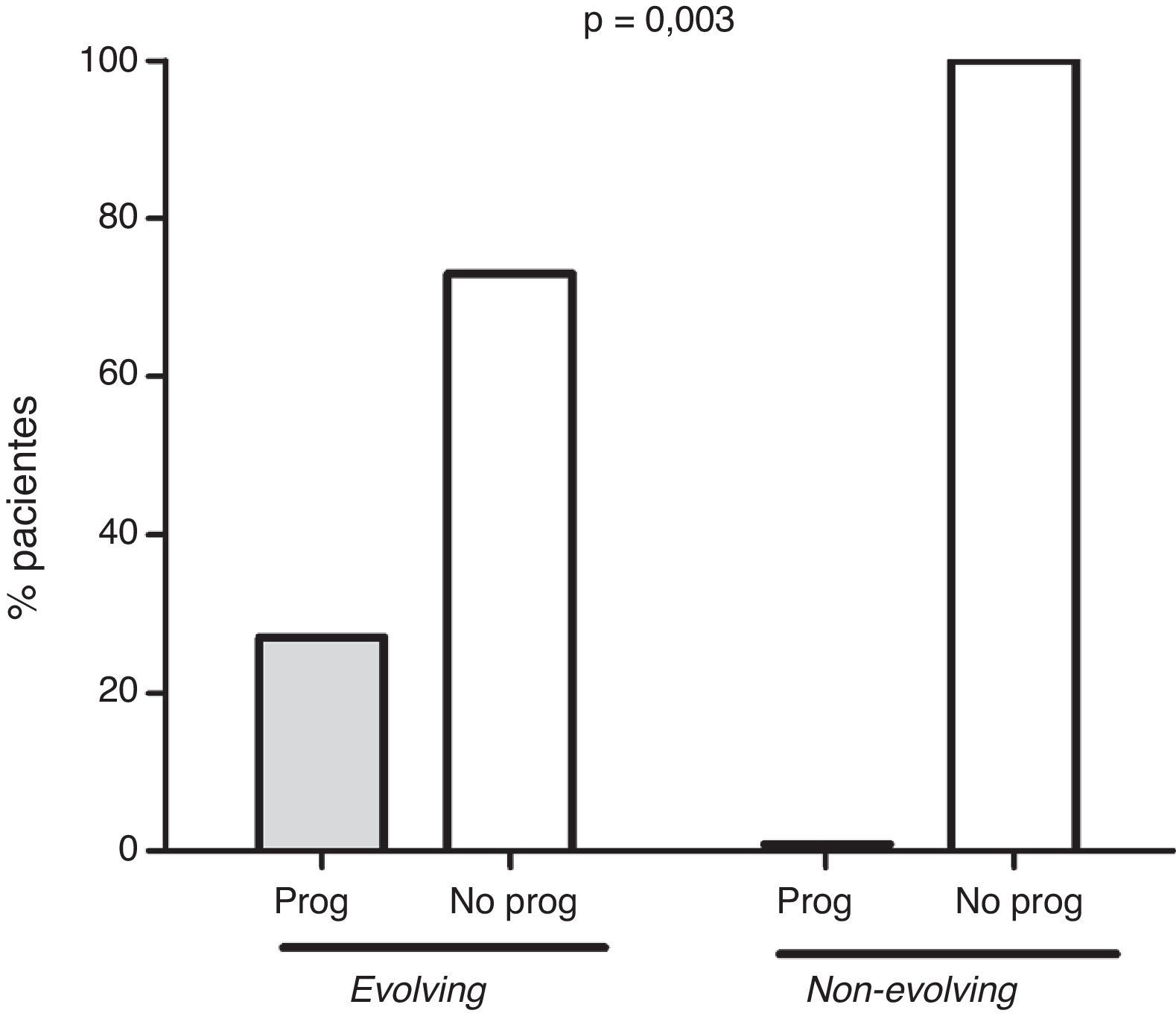
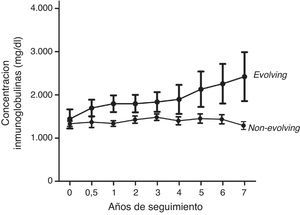
ResultadosOnce pacientes mostraron un fenotipo evolving y otros 53 mostraron niveles estables de inmunoglobulina monoclonal durante el seguimiento. En la figura 1 se muestra el patrón de evolución de ambos grupos. Tres pacientes (27%) con fenotipo evolving progresaron a MM. Dos de ellos presentaban isotipo IgG kappa, y uno, IgG lambda. Los tiempos de evolución hasta la progresión fueron de 5, 6 y 7 años, respectivamente. Ningún paciente non-evolving desarrolló un mieloma durante el seguimiento (fig. 2). Estos datos confirman en nuestra serie la asociación entre el fenotipo evolving y el riesgo de conversión a mieloma.
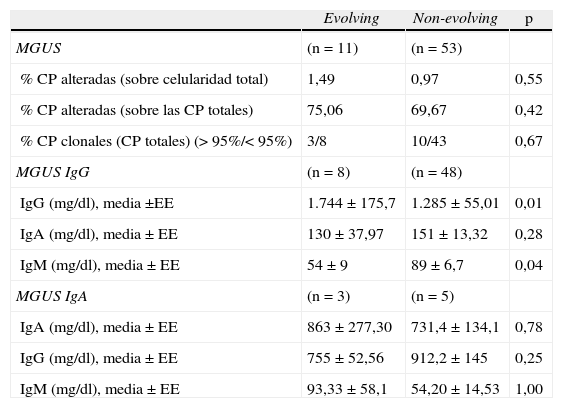
No encontramos diferencias significativas al diagnóstico en los porcentajes de CP alteradas respecto a la celularidad total en la médula ósea, ni respecto al total de CP, entre los 2 grupos de pacientes. Tampoco observamos diferencias al establecer un punto de corte en 95% de CP alteradas respecto al total de CP de médula ósea (tabla 2).
Diferencias entre pacientes evolving y non-evolving
| Evolving | Non-evolving | p | |
| MGUS | (n=11) | (n=53) | |
| % CP alteradas (sobre celularidad total) | 1,49 | 0,97 | 0,55 |
| % CP alteradas (sobre las CP totales) | 75,06 | 69,67 | 0,42 |
| % CP clonales (CP totales) (>95%/<95%) | 3/8 | 10/43 | 0,67 |
| MGUS IgG | (n=8) | (n=48) | |
| IgG (mg/dl), media±EE | 1.744±175,7 | 1.285±55,01 | 0,01 |
| IgA (mg/dl), media±EE | 130±37,97 | 151±13,32 | 0,28 |
| IgM (mg/dl), media±EE | 54±9 | 89±6,7 | 0,04 |
| MGUS IgA | (n=3) | (n=5) | |
| IgA (mg/dl), media±EE | 863±277,30 | 731,4±134,1 | 0,78 |
| IgG (mg/dl), media±EE | 755±52,56 | 912,2±145 | 0,25 |
| IgM (mg/dl), media±EE | 93,33±58,1 | 54,20±14,53 | 1,00 |
CP: células plasmáticas; EE: error estándar; MGUS: gammapatía monoclonal de significado incierto.
Los pacientes con mieloma frecuentemente presentan inmunosupresión de los isotipos no monoclonales. Estudiamos en nuestra serie la presencia de dicha inmunosupresión y solo se vio una pequeña disminución de IgM en MGUS IgG evolving (tabla 2).
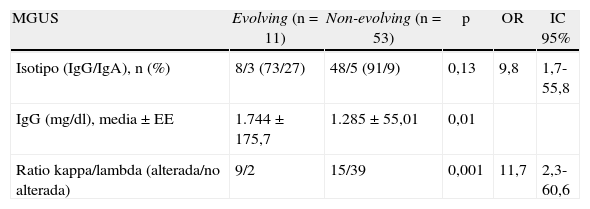
A continuación estudiamos si los factores que predicen en el momento del diagnóstico un mayor riesgo de conversión a MM también predicen la aparición de un fenotipo evolving. Los resultados se muestran en la tabla 3.
Marcadores de progresión
| MGUS | Evolving (n=11) | Non-evolving (n=53) | p | OR | IC 95% |
| Isotipo (IgG/IgA), n (%) | 8/3 (73/27) | 48/5 (91/9) | 0,13 | 9,8 | 1,7-55,8 |
| IgG (mg/dl), media±EE | 1.744±175,7 | 1.285±55,01 | 0,01 | ||
| Ratio kappa/lambda (alterada/no alterada) | 9/2 | 15/39 | 0,001 | 11,7 | 2,3-60,6 |
EE: error estándar; IC: intervalo de confianza; MGUS: gammapatía monoclonal de significado incierto; OR: odds ratio.
En el grupo evolving se observó un mayor porcentaje de pacientes con MGUS IgA (27 vs. 9%), aunque, probablemente por el bajo número de pacientes, no había significación estadística (p=0,1). Además, los pacientes con fenotipo evolving y MGUS IgG mostraron niveles significativamente superiores de IgG al diagnóstico que los non-evolving (p=0,01). Al estratificarlos por sus niveles de IgG, observamos que una concentración de IgG superior a 1.500mg/dl al diagnóstico se asocia con un fenotipo evolving (p=0,007).
Finalmente, vimos que el grupo evolving presentaba un mayor número de pacientes con una ratio kappa/lambda alterada (p=0,0011).
DiscusiónEl término MGUS, introducido por primera vez hace 34 años, denota la presencia de proteína monoclonal con un pronóstico incierto, con solo un bajo porcentaje de pacientes que convierten a mieloma1. En este periodo de tiempo, se han publicado pocos estudios de marcadores de progresión en MGUS ya que se necesitan series muy amplias y de elevado seguimiento temporal, debido al bajo porcentaje de progresión. Sin embargo, es de gran relevancia identificar a los pacientes con alto riesgo de evolución a mieloma y poder realizar un seguimiento más exhaustivo de los mismos que permita instaurar terapias de manera precoz.
Un importante avance en este sentido ha sido el hallazgo de 2 grupos de pacientes con pronóstico diferente según la evolución de la proteína monoclonal: evolving y non-evolving11. El primer grupo se ha asociado claramente con un mayor riesgo de progresión. En este trabajo quisimos estudiar la utilidad de un modelo basado en esta clasificación para poder ensayar nuevos marcadores de progresión en el MGUS y para validar los anteriormente descritos. Confirmamos que los pacientes con fenotipo evolving presentan un mayor riesgo de progresión a mieloma. Además, estudiamos una serie de biomarcadores que predicen conversión a MM en el MGUS13,17. Observamos que dichos marcadores también predicen la aparición de un fenotipo evolving. Así, hemos visto que los pacientes evolving mostraron, al diagnóstico, una frecuencia mayor de MGUS IgA, un mayor número de MGUS IgG con niveles altos de esta proteína y un mayor porcentaje de casos con cociente kappa/lambda alterado. Estos datos demuestran la utilidad de la monitorización del fenotipo evolving/non-evolving en la búsqueda de marcadores pronósticos en el MGUS y nos han permitido validar el papel pronóstico de estos factores en una cohorte más de 15 veces menor y con un tiempo de seguimiento inferior a un tercio del estudio original. Futuros estudios demostrarán la validez de este modelo para el descubrimiento de nuevos marcadores pronósticos en el MGUS.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.