Las células madre mesenquimales (CMM) muestran un gran potencial en el campo de la medicina regenerativa debido a su alta plasticidad y a su capacidad de modular la respuesta inmune. La fuente más habitual de obtención es la médula ósea. aunque se ha puesto en evidencia la necesidad de una fuente alternativa de CMM rápida y sencilla. Uno de los primeros candidatos fue la sangre del cordón umbilical (SCU) pero se ha demostrado que el rendimiento de recuperación de CMM es bajo.
Material y métodosEn el presente trabajo hemos analizado la obtención de CMM utilizando como tejido fuente el cordón umbilical (CU). Todas las muestras se obtuvieron a partir de las donaciones incluidas en nuestro programa altruista de donación de SCU.
ResultadosLos resultados muestran que es posible obtener CMM a partir de CU (CMM-CUh) con una tasa de éxito del 100%, mediante una combinación de fragmentación mecánica y digestión enzimática. Las CMM-CUh obtenidas muestran el fenotipo propio de las CMM de médula ósea: CD45−CD31−CD34−HLA-DR− y CD105+CD90+CD73+. Además, al igual que las CMM de médula ósea, las CMM-CUh son capaces de diferenciarse en osteoblastos y adipocitos, y ejercer un efecto supresor de la capacidad proliferativa de los linfocitos de sangre periférica estimulados con fitohemaglutinina.
ConclusionesEn conclusión, es posible establecer un programa estructurado de obtención de CMM utilizando la misma logística que se usa para obtener las unidades de SCU. Este hecho abre las puertas al desarrollo de un biobanco de CMM humanas que puedan ser suministradas a proyectos de investigación y para su uso clínico terapéutico.
Mesenchymal stem cells (MSC) offer a great potential for regenerative medicine due to their unique properties of self-renewal, high plasticity and modulation of immune response. Although the original source of MSC has been bone marrow, there is a clear need for a source of MSC as an “off-the-shelf” product for quick and effective treatment. One of the first candidates was the umbilical cord blood (UCB) but the poor recovery discourages its use.
Material and methodsIn the present paper, we tested umbilical cord (UC) tissue as a source for obtaining MSC. All the samples were obtained from donations included in our UCB altruistic procurement program.
ResultsOur results showed that is possible to obtain MSC from UC (hUC-MSC) with a 100% success rate by using a combination of mechanical fragmentation and enzymatic digestion. The MSC thus obtained show a phenotype very similar to that observed in the MSC of bone marrow origin: CD45−CD31−CD34−HLA-DR-CD−105+CD90+CD73+. In addition, we have demonstrated that hUC-MSC, like the MSC from bone marrow, are able to differentiate into osteoblasts and adipocytes, and also exert a suppressive effect on the proliferative capacity of peripheral lymphocytes stimulated with phytohaemagglutinin.
ConclusionsWe conclude that it is possible to implement a structured program of MSC derivation by using the same logistics that are used to obtain UCB. This opens the way to developing a biobank of human MSC that could be useful for research and clinical use.
Las células madre se definen como aquellas células que poseen capacidad clonogénica, de autorrenovación y de diferenciación en múltiples linajes celulares. Mientras que las células madre embrionarias se derivan del blastocisto de los embriones de mamíferos y tienen la capacidad de generar cualquier célula diferenciada del cuerpo, las células madre adultas se localizan en los diferentes tejidos del organismo posnatal y se encuentran comprometidas a diferenciarse en el propio linaje. La función primordial de estas células es mantener, generar y reemplazar las células diferenciadas de cada tejido como consecuencia de la autorrenovación tisular fisiológica o de la respuesta al daño tisular secundario a una agresión.
El ejemplo más evidente y conocido lo encontramos en la médula ósea adulta, ya que contiene varias poblaciones de células madre multipotentes. Estas células se caracterizan por su capacidad de autorrenovación y por su capacidad para diferenciarse en al menos un tipo celular maduro. Además de las células madre hematopoyéticas, la medula ósea contiene células progenitoras mesenquimales1. Estas células madre mesenquimales (CMM) tienen la capacidad de proliferar extensamente y formar colonias de células con aspecto fibroblástico. Además de en la médula ósea, es posible aislar CMM en otros tejidos, entre los que se incluyen: periostio2, hueso trabecular3, músculo esquelético4, sangre periférica5, tejido adiposo6, pulpa dental7, ligamento periodontal8 y tejido sinovial9. De entre todos ellos, el que genera más controversia es la sangre de cordón, ya que mientras algunos investigadores han sido capaces de aislar este tipo de células10–12, otros en cambio únicamente lo consiguen de manera esporádica13,14. Por el contrario, son numerosos los trabajos que describen la obtención de CMM a partir de tejidos de la placenta15,16, el líquido amniótico17, la gelatina de Wharton18 y del cordón umbilical (CU) completo19.
Las células obtenidas de todos estos tejidos comparten numerosas propiedades y características, lo que ha llevado a la International Society for Cellular Therapy a establecer un conjunto mínimo de propiedades que debe cumplir una célula para ser considerada CMM20. Estos criterios son: adherencia al plástico, expresión en membrana de CD105, CD73, CD90 y ausencia de CD45, CD34, CD14 o CD11b, CD79α o CD19, HLA-DR, y capacidad de diferenciación en las 3 líneas básicas: hueso, cartílago y tejido graso, al ser cultivadas en las condiciones adecuadas y en presencia de estímulos precisos para cada estirpe celular. Desde el punto de vista funcional podemos considerar que esta capacidad de diferenciación es su característica primordial. Otras 2 características de las CMM de especial relevancia son su capacidad para producir factores de crecimiento y citocinas que promuevan la expansión y diferenciación de las células progenitoras hematopoyeticas21 y, especialmente, la capacidad para modificar la respuesta de las células inmunes inflamatorias22. Así, el efecto antiproliferativo, inmunomodulador y antiinflamatorio de las CMM ha centrado la atención en estas células como potenciales agentes terapéuticos en enfermedades causadas por el sistema inmune, que incluyen la enfermedad injerto contra el huésped (EICH), el rechazo tras el trasplante de órganos sólidos y las enfermedades autoinmunes23.
De todos estos datos se deduce el alto potencial terapéutico que poseen las CMM, y de ahí el interés en su obtención y expansión in vitro. Tal como se ha comentado anteriormente, en la actualidad la médula ósea representa la principal fuente de obtención de CMM para terapia celular. No obstante, hay que tener en cuenta que la aspiración de la médula ósea representa un procedimiento invasivo que requiere anestesia. Además es importante recalcar que la frecuencia de CMM en la médula ósea decrece con la edad de manera significativa, lo que dificulta su obtención en individuos adultos24,25. Todas estas consideraciones nos llevan a la conclusión de que sería útil disponer de un banco de CMM que asegurara la disponibilidad de estas células para tratar a todo tipo de pacientes independientemente de su edad y situación patológica. De entre todos los tejidos en los que se ha descrito la presencia de CMM, los que forman el CU pueden considerarse como fuentes ideales para la obtención de CMM debido a su accesibilidad, procedimiento de obtención indoloro para el donante, bajo riesgo de contaminación viral y por tratarse de productos de deshecho.
Desde el año 2004 se ha venido desarrollando, en el seno de la Fundació Banc de Sang i Teixits de les Illes Balears, el Programa Balear de Donación de Sangre de Cordón Umbilical que se integró posteriormente en el Programa Concordia, conjuntamente con Cataluña, Aragón, Navarra, Extremadura y Cantabria. Mediante este programa se obtiene sangre de CU para su conservación en un banco público y su posterior utilización en el trasplante de progenitores hematopoyéticos de aquellos pacientes que muestran una compatibilidad adecuada. Por ello nos planteamos la posibilidad de utilizar los mecanismos y la infraestructura del Programa Concordia en nuestra comunidad para obtener CU de los que derivar CMM y conservarlas almacenadas en un biobanco. A las claras ventajas logísticas (mismo consentimiento informado, caracterización serológica, tipificación HLA) que abaratarían claramente el proceso, se une el hecho de que sería posible la conservación de los precursores hematopoyéticos a la vez que las CMM del mismo individuo, facilitando su utilización terapéutica.
En el presente trabajo pretendemos demostrar que es posible obtener CMM a partir de los CU obtenidos conjuntamente con las unidades de sangre de CU. Esta demostración abriría la posibilidad de establecer un biobanco de estas células en paralelo al banco de progenitores hematopoyéticos de sangre de cordón.
Material y métodosObtención de cordones umbilicalesLos CU se obtuvieron simultáneamente a la donación de sangre de cordón umbilical en el Programa Concordia de Obtención de Sangre de Cordón Umbilical, tras la obtención del consentimiento informado y con la aprobación del Comité Ético de las Islas Baleares (CEIC-IB). Los CU se recogieron en un frasco esterilizado y se trasladaron al Banco de Tejidos en un plazo máximo de 24h desde su recolección. A su recepción se mantuvieron en tampón fosfato salino (PBS) a 4°C hasta su procesamiento.
Aislamiento de células madre mesenquimales a partir de cordón umbilicalDespués de lavar con PBS para eliminar cualquier contaminante de sangre, el CU fue cortado transversalmente y los fragmentos (0,5-1cm) se sometieron a digestión enzimatica durante 3h a 37°C con agitación rotatoria en presencia de distintas combinaciones de las enzimas colagenasa (Sigma®) al 0,075%, hialuronidasa (Sigma®) 0,05% o tripsina 0,125% (Sigma®). Después de la digestión, el tejido sobrante se eliminó mediante filtración con un filtro de 100μm. Se realizó un recuento para determinar el número de células viables y se resuspendieron las células en medio de crecimiento: DMEM-low glucose suplementado con 2mM GlutaMAXTM-I (Gibco®), 20% FBS Hyclone (ThermoScientific®), penicilina (100U/ml), estreptomicina (100μg/ml) y anfotericina B (0,25mg/ml) (Gibco®). La suspensión se cultivó en frascos de 25cm2 a 37°C en un incubador humidificado con una concentración de CO2 del 5%. Después de 2 días de cultivo se reemplazó el medio, pudiéndose observar al microscopio la presencia de células adherentes que proliferaron hasta alcanzar la confluencia. Al superar la confluencia el 80%, se trataron con una solución de tripsina para despegarlas del frasco de cultivo. Tras comprobar su viabilidad y ajustar la concentración se transfirieron a frascos de cultivo de 75cm2, a una densidad de 2×103/cm2 y se cultivaron de nuevo con el fin de expandir el cultivo.
Recuento célulaLas suspensiones de células obtenidas de los CU digeridos o de los cultivos de células madre mesenquimales a partir de cordón umbilical (CMM-CUh) se tiñeron con el reactivo ViaCount® (Millipore®) según lo descrito por el fabricante. Este reactivo permite distinguir entre células viables y no viables basándose en la permeabilidad diferencial de los tintes de unión al ADN presente en el mismo. El recuento celular se llevó a cabo mediante el citómetro de flujo Guava EasyCyte Mini® (Millipore®).
Caracterización fenotípica de la célula madre mesenquimal a partir de cordón umbilicalSe utilizaron técnicas estándar de citometría de flujo para determinar el patrón de expresión de antígenos de diferenciación en la superficie de estas células. De manera resumida, las células fueron incubadas con concentraciones saturantes de los siguientes anticuerpos monoclonales marcados con fluorocromo: CD105-ficoeritrina (PE), CD90-PE-Cy5, CD73-PE, CD34-PE, CD45-fluoresceína (FITC), CD31-PE y HLA-DR-FITC (BD Biosciences®), durante 30min a temperatura ambiente. Tras eliminar el exceso de anticuerpo mediante lavado con PBS, las células se analizaron por citometría de flujo realizándose la lectura de fluorescencia en un instrumento Guava EasyCyte Mini® (Millipore®).
Diferenciación osteogénicaLas CMM-CUh se sembraron a una concentración de 5×104 células por pocillo en placas de 6 pocillos y se cultivaron en medio de crecimiento a 37°C en un incubador humidificado en presencia de CO2 al 5%. Dos veces por semana se sustituyó el medio de crecimiento por medio fresco. En el momento de alcanzar la confluencia, designado como día 0, se añadió medio de cultivo suplementado con 200nM de hidrocortisona, 50μg/ml de ácido ascórbico y 10mM de ß-glicerofosfato para inducir la diferenciación osteogénica. Las células fueron cultivadas durante 21 días, reemplazando el medio de diferenciación 2 veces por semana. Los cultivos se fijaron en formalina al 10% y fueron teñidos con Alizarin Red (Sigma®) para detectar los depósitos de calcio.
Diferenciación adipogénicaLas CMM-CUh se sembraron a una concentración de 5×104 células por pocillo en placas de 6 pocillos y se cultivaron en medio de crecimiento a 37°C en un incubador humidificado en presencia de CO2 al 5%. Dos veces por semana se sustituyo el medio de crecimiento por medio fresco. En el momento de alcanzar la confluencia, designado como día 0, se añadió medio de cultivo suplementado con 60μM de indometacina, 10μM de dexametasona y 5mg/ml de insulina para inducir la diferenciación adipogénica. Los cultivos fueron fijados en formalina al 10% y se tiñeron con solución de Oil Red O (Thermo Scientific®) para evidenciar la presencia de los lípidos intracelulares.
Ensayo de proliferación linfocitariaMediante gradiente de densidad en ficoll se aislaron células mononucleares de sangre periférica (PBMC) de donantes sanos tras consentimiento informado. La proliferación se analizó mediante la tinción con diacetato de carboxifluoresceína ester succinimidil (CFSE)26,27. Para ello se incubó una suspensión de 2×106/ml PBMC en PBS con CFSE a 0,125uM durante 5min a temperatura ambiente. Posteriormente se bloqueó la reacción añadiendo PBS+2% suero fetal de ternera (SFT). A continuación se lavaron las células 2 veces en PBS+2% SFT, resuspendiéndose finalmente en medio de crecimiento+5% SFT. Las PBMC se cultivaron a una concentración de 2×105/pocillo. Como estímulo mitogénico se utilizó fitohemaglutinina (PHA) (Sigma) a una concentración de 1,25 μg/ml. Las CMM-CUh se añadieron en determinados pocillos a una relación de 1:10 respecto a las PBMC, es decir 2×104/pocillo.
Resultados y discusiónComparación de diferentes enzimas para el aislamiento de células mesenquimales de cordón umbilicalA pesar de la gran cantidad de publicaciones que describen el aislamiento de CMM a partir de sangre de cordón, en todas ellas se coincide en reconocer la dificultad del proceso y la baja tasa de éxito en la obtención de este tipo de células, que varía según los autores entre un 0 y un 60% de las unidades en las que se ensaya10–12,14. Si esto se debe a una baja frecuencia de estas células en la sangre de cordón o es debido a las condiciones de cultivo (medio de cultivo, factores de crecimiento, inóculo celular inicial,…) es objeto de controversia. No existe, por tanto, una técnica estandarizada que asegure la obtención de CMM en todas las unidades de sangre de CU en las que se inicie el proceso. Bieback et al.10 han demostrado cómo optimizando el procedimiento de obtención y las características de la unidad de sangre de cordón de partida es posible pasar de una tasa de éxito en la obtención de CMM del 29 al 63%. No obstante, estos autores no fueron capaces de obtener CMM en el 100% de las unidades incluso cuando estas eran de gran volumen y se procesaban a las pocas horas de su obtención. Donde sí parecen coincidir los autores es en que los mejores rendimientos se obtienen cuando se parte de unidades óptimas, con una alta celularidad. No obstante, esto plantea el problema de que en caso de derivarse estas unidades hacia la obtención de CMM se perderían para el propósito principal, que es la conservación de precursores hematopoyéticos.
Una fuente alternativa para la obtención de CMM han sido los tejidos que forman la placenta y el CU. Se ha demostrado la posibilidad de aislar CMM a partir de la gelatina de Wharton, del tejido perivascular, del tejido placentario y del CU completo15,16,18,19,28. En el caso de la placenta, las CMM obtenidas muestran un origen tanto materno como fetal, dependiendo del tejido placentario utilizado. Así, el tejido amniótico es una fuente de CMM de origen fetal mientras que la decidua basalis y la decidua parietalis constituyen una fuente de CMM de origen materno.
Experimentos preliminares llevados a cabo en nuestro laboratorio confirmaron los datos mostrados en la literatura, ya que pudimos comprobar cómo era posible obtener CMM de los tejidos placentarios y de la sangre de cordón con desigual eficacia. Los tejidos ensayados fueron: membrana amniótica (50%; n=4), placenta coriónica (50%; n=4), gelatina de Wharton (40%; n=10) y sangre de CU (20%; n=8). Únicamente utilizando el UCl completo obtuvimos una eficacia en el aislamiento de CMM del 100% (n=40).
Con estos resultados preliminares, decidimos centrar nuestros esfuerzos en optimizar la obtención de CMM a partir de CU. Para ello realizamos un análisis comparativo de diferentes combinaciones enzimáticas capaces de digerir el cordón y liberar las CMM. Las combinaciones ensayadas incluyen: a) colagenasa 0,075% durante 3h, b) tripsina 0,125% durante 3h, añadiendo colagenasa 0,075% los últimos 30min, y c) hialuronidasa 0,05% y colagenasa 0,075% durante 3h.
Los CU se obtuvieron simultáneamente al proceso de donación de sangre de CU y se procesaron antes de las 24h de su obtención, no detectándose ninguna relación entre el lapso de tiempo transcurrido y el rendimiento en la obtención (datos no presentados). Tras limpiar los cordones con PBS para eliminar los restos de sangre, se obtuvo un segmento de cordón de entre 9 y 11g, que se cortó posteriormente en fragmentos transversales de 0,5-1cm. Estos fragmentos se incubaron con las diferentes combinaciones enzimáticas antes mencionadas en un agitador orbital a 37°C. Posteriormente se filtró el producto de digestión a través de una malla de 100μm de tamaño de poro para eliminar los restos de tejido no digerido y obtener una suspensión celular. Se determinó el número de células viables presentes en la suspensión, expresándose el resultado por gramo de tejido.
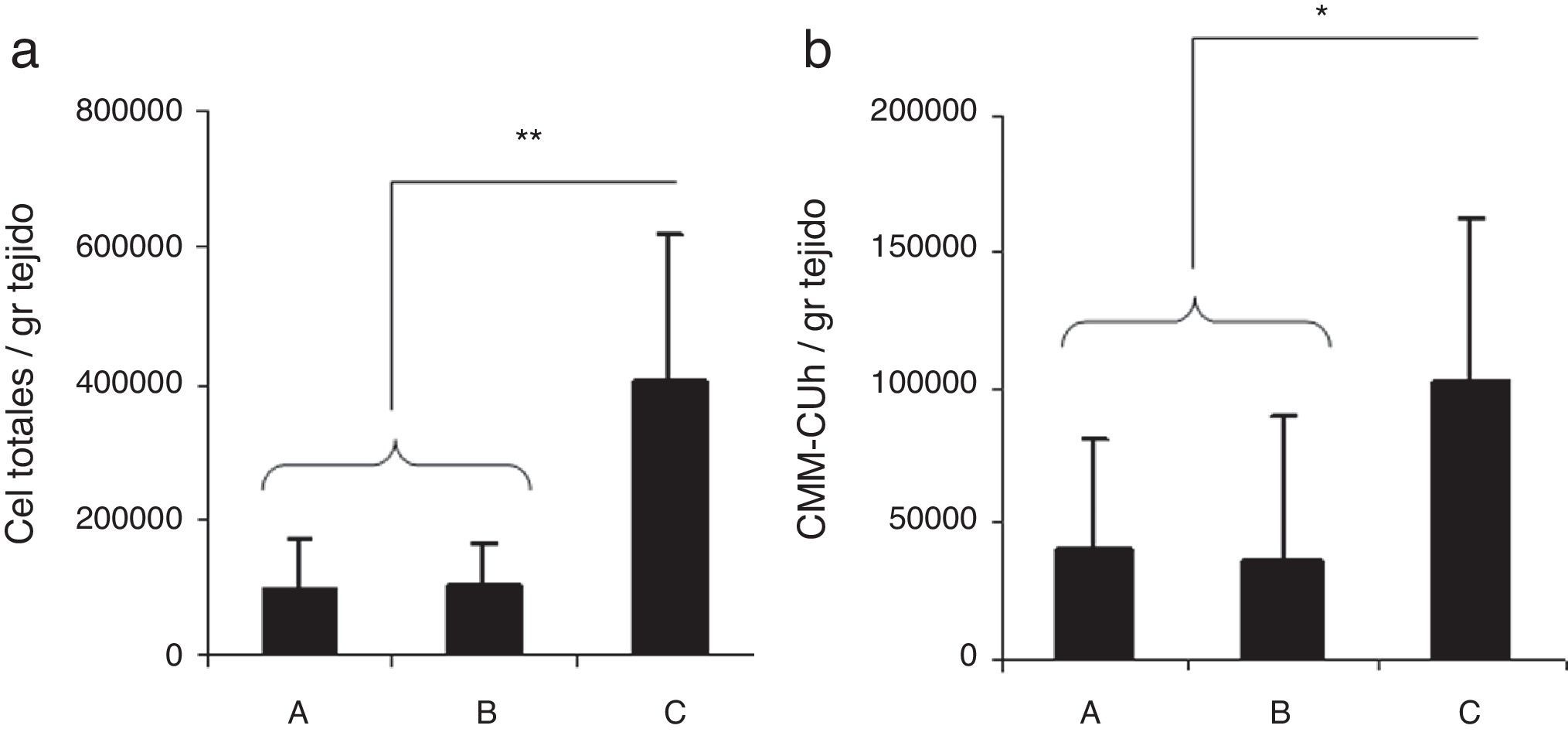
Como puede observarse en la figura 1a, el mayor número de células se obtiene cuando se utiliza la combinación enzimática de colagenasa con hialuronidasa, mientras que no hay diferencias entre la utilización de colagenasa sola o en presencia de tripsina. Con el fin de aislar las CMM presentes en la suspensión, la suspensión celular obtenida se cultivó en frascos de 25cm2 con medio de crecimiento. A las 48h se eliminaron las células no adherentes y se mantuvo el cultivo, cambiándose el medio de crecimiento 2 veces por semana. A los 7-10 días se despegaron las células adheridas mediante tratamiento con tripsina y se contaron las células viables. El resultado se expresa como número de CMM por gramo de tejido digerido. Tal como se observa en la Figura 1b, la digestión con colagenasa y hialuronidasa fue el método que proporcionó mayor número de células mesenquimales por gramo de tejido digerido. Asimismo, los resultados confirman que no es necesario separar los diferentes componentes del cordón, pudiéndose realizar la digestión sobre el tejido completo, lo que proporciona ventajas logísticas evidentes al acortar la manipulación. Este es un hecho de gran importancia si se pretende aplicar este método para la obtención sistemática de las CMM, simultáneamente con las donaciones de sangre de UCl, en el contexto de un biobanco.
Comparación del rendimiento celular obtenido utilizando diferentes combinaciones enzimáticas. Los cordones umbilicales se pesaron, seleccionándose un segmento de 10g del que se obtuvieron fragmentos transversales de 0,5-1cm. Seguidamente se utilizaron 3 combinaciones enzimáticas para digerir los trozos de cordón umbilical y obtener una suspensión celular: colagenasa 0,075% durante 3h (A), tripsina 0,125% durante 3h añadiendo colagenasa 0,075% los últimos 30min (B) y colagenasa 0,075% con hialuronidasa 0,05% durante 3h (C). a) Se calculó el número de células viables totales obtenidas después de la digestión y se dividió por los gramos de tejido cortado y digerido. b) Se contaron las células adherentes a los 7-10 días después de sembrar el producto de digestión en frascos de cultivo con medio de crecimiento y se dividieron por los gramos de tejido digerido.** p<0,01; * p<0,05.
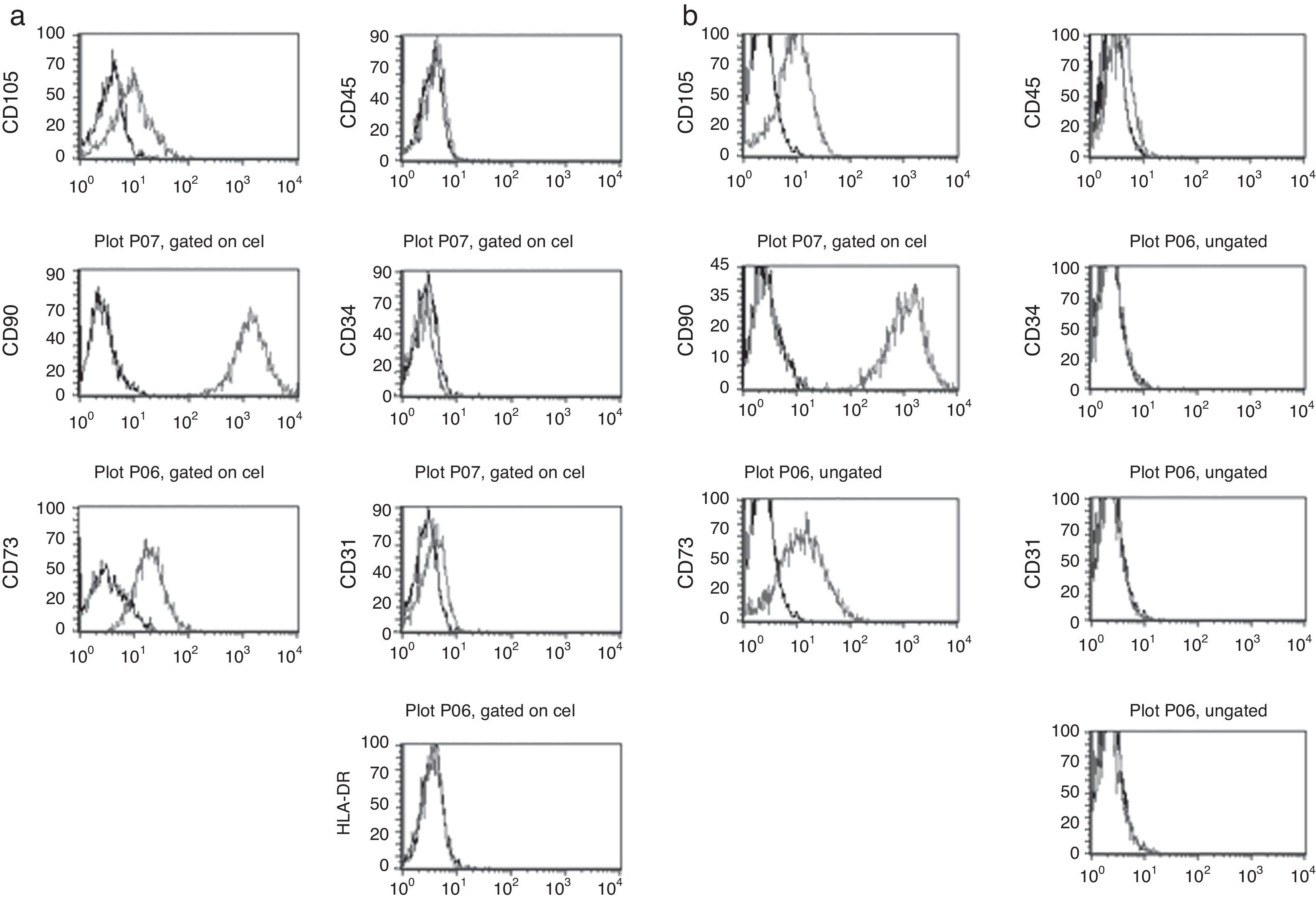
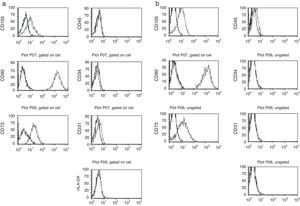
Tal como se ha comentado en la introducción, es ampliamente aceptado que si bien las CMM carecen de un marcador específico que las identifique, sí presentan un patrón de expresión de antígenos de diferenciación que las define. Por ello, nos propusimos comprobar si las células adherentes derivadas de la digestión de los cordones umbilicales presentaban el patrón de expresión de moléculas de superficie característico de las CMM. Para ello, se utilizaron células que habían sido expandidas durante 4-5 pases y se tiñeron con anticuerpos monoclonales conjugados con marcadores fluorescentes. Los marcadores utilizados incluían el panel básico establecido por la International Society for Cellular Therapy que permite definir las células mesenquimales20: CD90, CD105, CD73, CD45, CD34 y HLA-DR. Se incluyó además un anticuerpo frente a CD31, que permite identificar la presencia de células endoteliales29. Los resultados del análisis por citometría de flujo que se muestran en la figura 2 permiten comprobar cómo tanto las células obtenidas mediante digestión con tripsina y colagenasa (fig. 2a) como las obtenidas tras digestión con hialuronidasa y colagenasa (fig. 2b) presentan el mismo patrón de expresión de las moléculas analizadas y que se corresponde con el patrón definido para las CMM. Así, se detecta en todas las células estudiadas la presencia de los marcadores mesenquimales CD73, CD90 y CD105 mientras que en ningún caso se detectó la presencia de marcadores propios de células progenitoras hematopoyéticas como CD45, CD34 o HLA-DR. La ausencia de expresión de CD31 permite descartar que las células adherentes obtenidas puedan considerarse como células endoteliales. Esta última comprobación era especialmente relevante si tenemos en cuenta que se utilizó el cordón completo sin eliminar los vasos que lo integran, por lo que existía la posibilidad de obtener células endoteliales. Los resultados muestran, además, que no existen diferencias entre las líneas celulares obtenidas en función del tratamiento enzimático utilizado.
Inmunofenotipo de las CMM aisladas mediante diferentes digestiones enzimáticas. Las células adherentes obtenidas mediante la digestión enzimática de cordón umbilical con colagenasa y tripsina (a) o con colagenasa y hialuronidasa (b), según se describe en el apartado «Material y métodos», se expandieron en cultivo durante 4-5 pases y posteriormente se analizaron por citometría de flujo tras incubación con anticuerpos fluorescentes frente a los antígenos de diferenciación CD105, CD90, CD73, CD45, CD34, CD31 y HLA-DR. La curva en negro corresponde a la señal de base, mientras que la curva en gris corresponde al anticuerpo marcado.
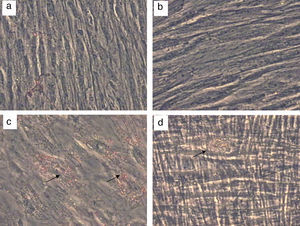
Las CMM se caracterizan fundamentalmente por su capacidad para diferenciarse in vitro en varios tejidos mesenquimales, que incluyen básicamente hueso, cartílago y tejido adiposo. Por todo ello, y especialmente teniendo en cuenta su comportamiento como progenitoras de tejidos bien diferenciados, estas células se han convertido en un objetivo de estudio de la mayor trascendencia en el campo de la terapia celular y la medicina regenerativa23. Para cerciorarnos de la capacidad de diferenciación osteogénica y adipogénica de las células obtenidas con la combinación enzimática de colagenasa con hialuronidasa, sembramos las células en placas de 6 pocillos y las cultivamos hasta que llegaron al 100% de confluencia. En este punto añadimos factores de diferenciación al medio de crecimiento, renovándolo cada 3-4 días. Tras 21 días en cultivo, las células cultivadas en presencia de estímulos adipogénicos se fijaron y se tiñeron con Oil Red O. Tal como se observa en la figura 3b, la presencia de vacuolas lipídicas intracelulares en las células incubadas con medio adipogénico es evidente en comparación con las células cultivadas sin estimulo (fig. 3a), confirmando la diferenciación de las CMM hacia la estirpe adipogénica. Asimismo, las células cultivadas en paralelo en presencia de estímulos osteogénicos fueron fijadas y teñidas con alizarina. Tal como se observa en la microfotografía (fig. 3d), la tinción permitió revelar la presencia de depósitos de calcio, producto de la diferenciación ostogénica, mientras que estos depósitos no se detectaron en las células igualmente teñidas pero que no habían sido tratadas con estímulos diferenciadores (fig. 3c).
Diferenciación adipogénica y osteogénica de CMM-CUh. Las CMM-CUh se sembraron en placas de 6 pocillos y se cultivaron hasta la confluencia. En este punto las células control se siguieron cultivando con medio de crecimiento (a y c) o se añadieron factores de diferenciación adipogénicos (b) u osteogénicos (d). A los 21 días de tratamiento las células fueron fijadas y teñidas con Oil Red O para evidenciar depósitos de lípidos intracelulares (a y b) o con Alizarin Red para evidenciar depósitos de calcio (c y d). Las flechas marcan la presencia de depositos de lipidos (c) y de calcio (d).
Una de las propiedades características de las CMM es su capacidad para suprimir la proliferación linfocitaria. Con la finalidad de determinar si las CMM derivadas de CU poseían también esta propiedad, ensayamos la capacidad de estas células de inhibir la proliferación de linfocitos de sangre periférica estimulados con el mitógeno PHA. Para monitorizar la activación y proliferación celular los linfocitos se tiñeron con CFSE. Este colorante se incorpora pasivamente al citoplasma de las células donde se une de manera irreversible a las proteínas intracelulares, adquiriendo en el proceso propiedades fluorescentes. Al dividirse la célula, el CFSE presente en el citoplasma se reparte por igual entre las 2 células hijas, por lo que la intensidad de fluorescencia disminuye en consecuencia a la mitad26. Al analizar la suspensión celular mediante citometría de flujo, esta disminución secuencial de la fluorescencia se evidencia como diferentes picos y puede utilizarse para monitorizar la progresión de las divisiones celulares27.
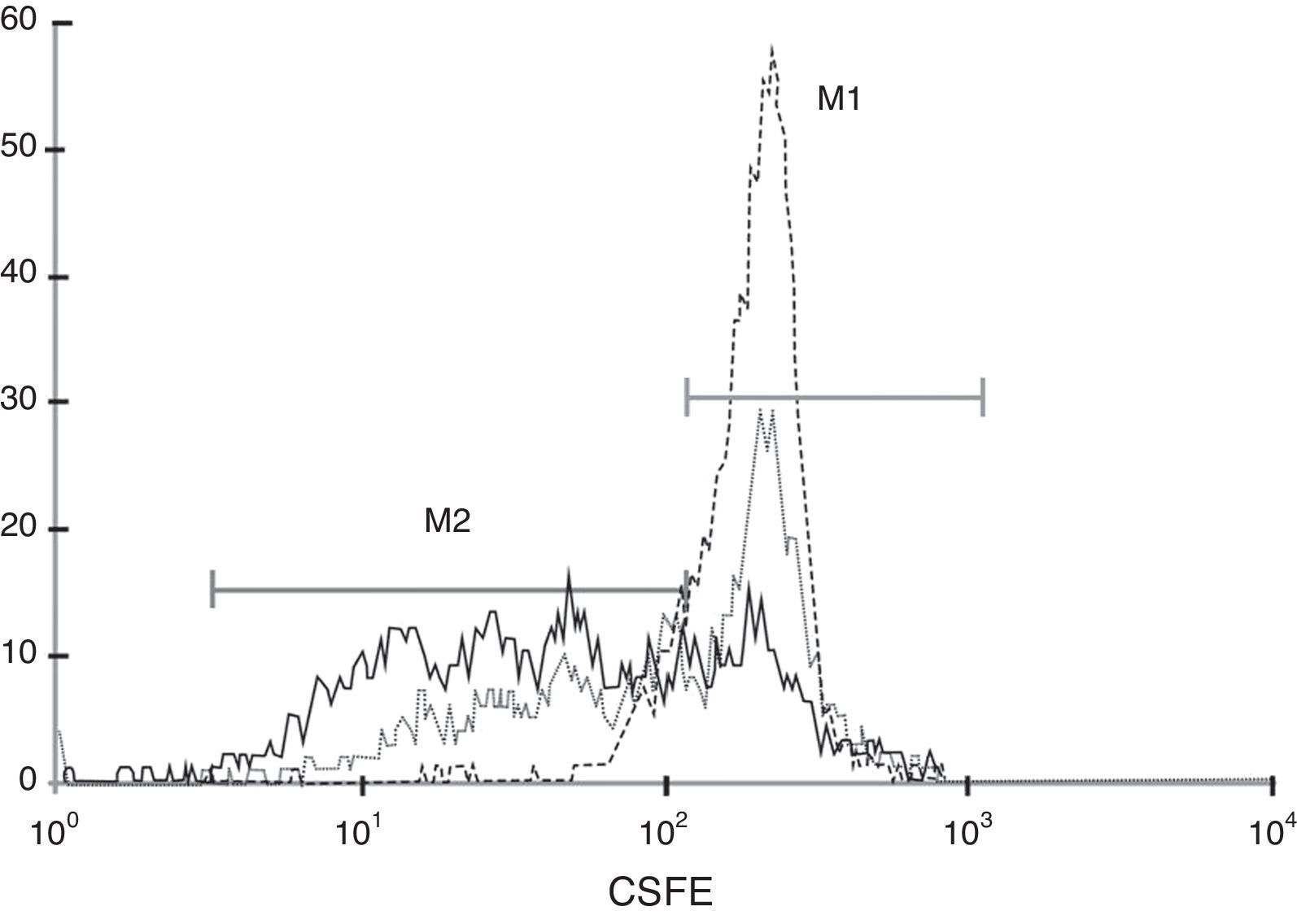
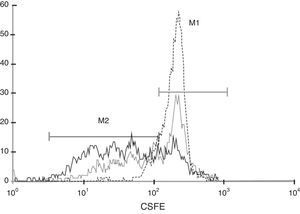
Tal como se describe en el apartado «Material y métodos», se obtuvieron PBMC y se tiñeron con CFSE. Posteriormente estas células se incubaron en presencia de medio de cultivo, PHA o PHA+CMM-CUh y a los 5 días se analizaron mediante citometría de flujo. En la figura 4 podemos observar cómo los linfocitos teñidos y mantenidos en presencia de medio de cultivo presentan un único pico de fluorescencia (línea de rayas), ya que las células se mantienen en reposo ante la ausencia de estímulo. Por el contrario, las células estimuladas con PHA (línea continua) muestran diversos picos de fluorescencia correspondientes a los sucesivos ciclos de proliferación, de tal manera que únicamente un 25,79% de las células se encuentran en la región M1, correspondiente a las células en reposo. Cuando los linfocitos fueron estimulados con PHA en presencia de CMM-CUh (línea de puntos), si bien se observa proliferación celular, esta es mucho menor que en el grupo control, siendo el porcentaje de células que permanecen en reposo, en la región M1, del 52,05%. Estos datos, representativos de 4 experimentos, confirman el poder inmunosupresor que poseen las CMM y que también está presente en las CMM-CUh.
La proliferación linfocitaria inducida por PHA es inhibida en presencia de CMM-CUh. 2×105 PBMC marcadas con CFSE se estimularon mediante la adición de PHA (1,25μg/ml) en presencia (…) o ausencia (—) de 2×104 CMM. Al final del periodo de incubación (5 días) las células se analizaron por citometría de flujo. Como control del marcaje se utilizaron PBMC marcadas con CFSE, incubadas durante el mismo periodo en ausencia de estímulo (---). El marcador M1 delimita la fracción celular que ha permanecido en reposo, mientras que M2 muestra la fracción de células que han proliferado.
Estos resultados coinciden con las observaciones que muestran que cuando las CMM están presentes en un cultivo mixto linfocitario o se añaden a cultivos de linfocitos estimulados con mitógenos, se observa una supresión de la proliferación celular T de manera dosis dependiente30. Esta supresión es independiente de MHC y, en seres humanos, parece ser mediada por factores solubles, ya que la proliferación se mantiene si las CMM y los linfocitos se encuentran separados por un sistema «transwell»31. Además, los resultados de los experimentos in vitro han sido corroborados por datos obtenidos en modelos experimentales animales. En un modelo murino de encefalomielitis autoinmune, Zappia et al.32 han demostrado que la infusión de CMM determina una mejoría notable en la evolución de la enfermedad, siempre y cuando las células se administren al inicio de la enfermedad o durante el pico de la misma, pero no tras la estabilización del proceso. En experimentos in vivo, Tian et al.22 han observado que las CMM alogénicas permanecen inalteradas durante un periodo más prolongado del que lo hacen otras células alogénicas en las mismas condiciones, lo que lleva a estos autores a sugerir que las CMM ni son capaces de iniciar ni son el objetivo de respuestas inmunes en base a un reconocimiento alogénico33.
De los modelos animales se ha pasado ya a la utilización clínica de estas células. Así, recientemente se han publicado varios trabajos en los que se muestra la potencialidad de las CMM en el tratamiento de la EICH. Ringden et al.34 describen una desaparición total de la EICH en 6 de 8 pacientes tratados con la infusión de CMM alogénicas con diferentes grados de compatibilidad HLA. Además, su tasa de supervivencia fue significativamente mayor que la de 16 pacientes con EICH demostrada mediante biopsia gastrointestinal que no fueron tratados con CMM durante el mismo periodo35. Uno de los principales problemas con el que se enfrenta esta opción terapéutica es el de obtener las células y expandirlas hasta alcanzar un número adecuado en el lapso de tiempo suficiente para poder ser administradas con garantías de eficacia. Además de en el trasplante de progenitores hematopoyéticos, la utilización de CMM en el trasplante de órgano sólido despierta crecientes expectativas, ya que los modelos de trasplante preclínicos han demostrado la eficacia de las CMM para prolongar la supervivencia del injerto36.
Numerosas enfermedades crónicas son el resultado del fracaso en los procesos de reparación o regeneración. Las aproximaciones terapéuticas actuales se basan en la sustitución del órgano o tejido dañado por medios farmacológicos o mediante trasplante, en ocasiones con resultados limitados. La existencia de células madre en la etapa posnatal, con plasticidad para diferenciarse hacia distintos tejidos, fundamenta su utilización en la regeneración tisular. La capacidad de estas células de escapar al control del sistema inmune y su potencial tolerizante que apunta a su utilidad en el control de la respuesta de rechazo o de EICH, justifica la creación de un banco alogénico de uso investigacional e incluso clínico. Las ventajas del mismo son la bioseguridad de producto, la disponibilidad inmediata y la consiguiente universalización de su uso. Además, al tratarse de células jóvenes se minimizan los riesgos de haber acumulado mutaciones genéticas.
Los resultados que presentamos en el presente trabajo confirman la hipótesis inicial al mostrar cómo es factible, en el contexto de un banco de sangre de CU, desarrollar un banco de CMM obtenidas a partir del CU. Esta estrategia nos permite disponer de manera simultánea tanto de las CMM como de los progenitores hematopoyéticos del mismo donante. Este hecho conlleva la ventaja añadida de disponer de los datos serológicos y de tipificación HLA de estas células, que una vez almacenadas y caracterizadas podrían utilizarse durante la fase aguda de lesiones tisulares y además complementar otras terapias como la facilitación del trasplante de sangre de cordón, la expansión ex vivo de células madre hematopoyéticas y la inducción de tolerancia inmunológica en situaciones como la EICH, el rechazo de órganos sólidos o las enfermedades autoinmunes. El hecho de almacenar células funcionales ya expandidas elimina los inconvenientes que implica su producción a partir de donantes adultos: coste, individualización y tiempo de producción. A la vez evita la situación de base (enfermedades subsidiaria, edad...) que el donante pueda tener en el momento de la indicación terapéutica.
FinanciaciónEste trabajo ha podido ser realizado gracias a la financiación obtenida en los proyectos PI07-1021 y PLE2009-0102.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen la excelente asistencia técnica de Celia Ordinas y Cristina Corbillo así como la colaboración de Javier Peña en la elaboración del material gráfico.