El principio de autonomía de la voluntad de los pacientes en la participación e incorporación de sus datos de salud en los proyectos de investigación es una obligación legal y deontológica. El objetivo de este estudio fue conocer el grado de cumplimiento y adecuación del consentimiento informado en los proyectos de investigación clínica en un hospital universitario.
Material y métodosSe diseñó un estudio observacional descriptivo y de corte transversal en el que se analizó la evaluación realizada por el Comité Ético de investigación (CEI) de un hospital universitario y se estudió su adecuación a la legislación vigente en cuanto al proceso de obtención de datos de los pacientes. La adecuación de los consentimientos y motivos de exención de obtención de datos se describió con la distribución de frecuencias y se evaluó con la odds ratio (OR), ajustando un modelo de regresión logística binaria por pasos hacia atrás incluyendo las variables significativas predictivas evaluadas en el análisis previo univariante.
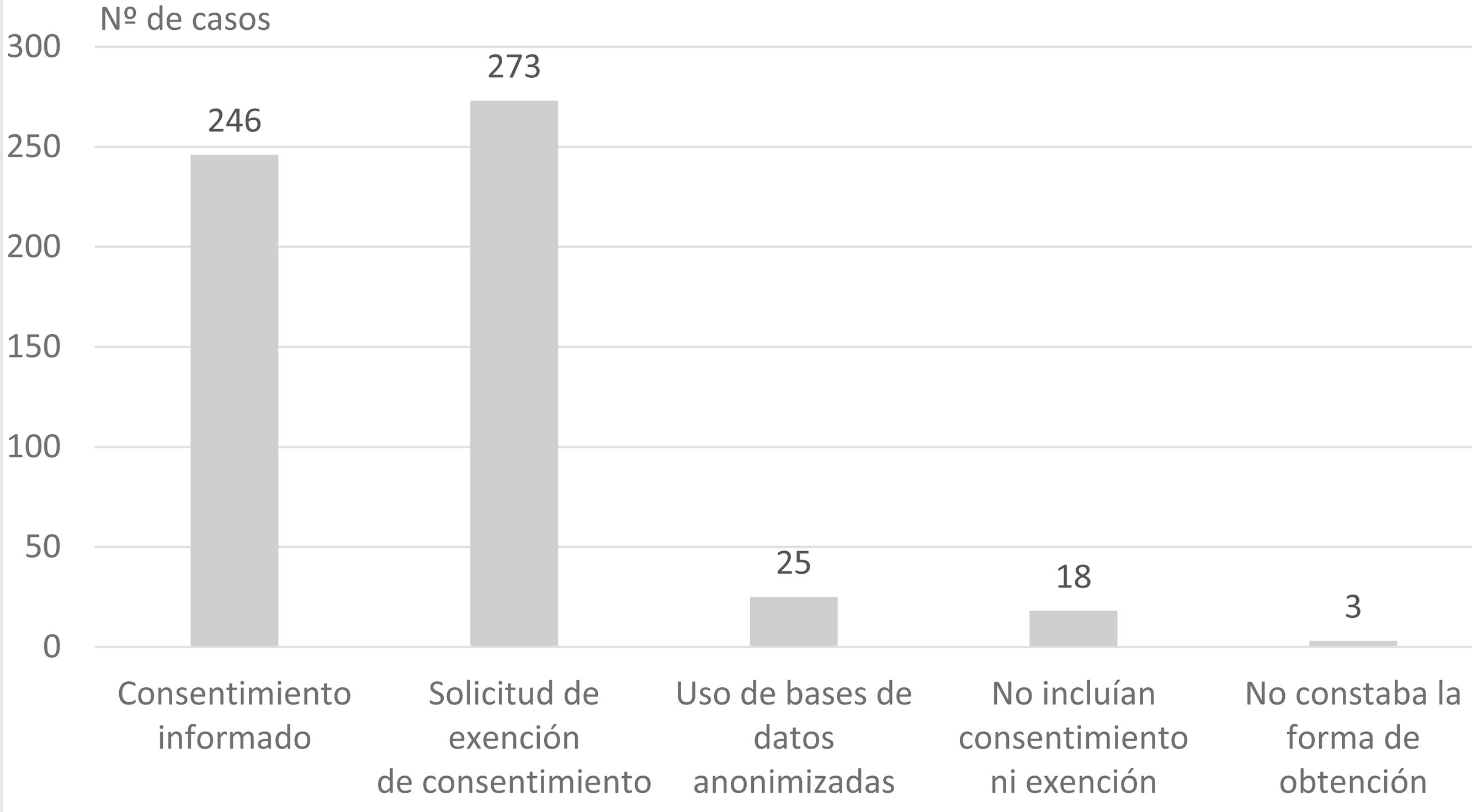
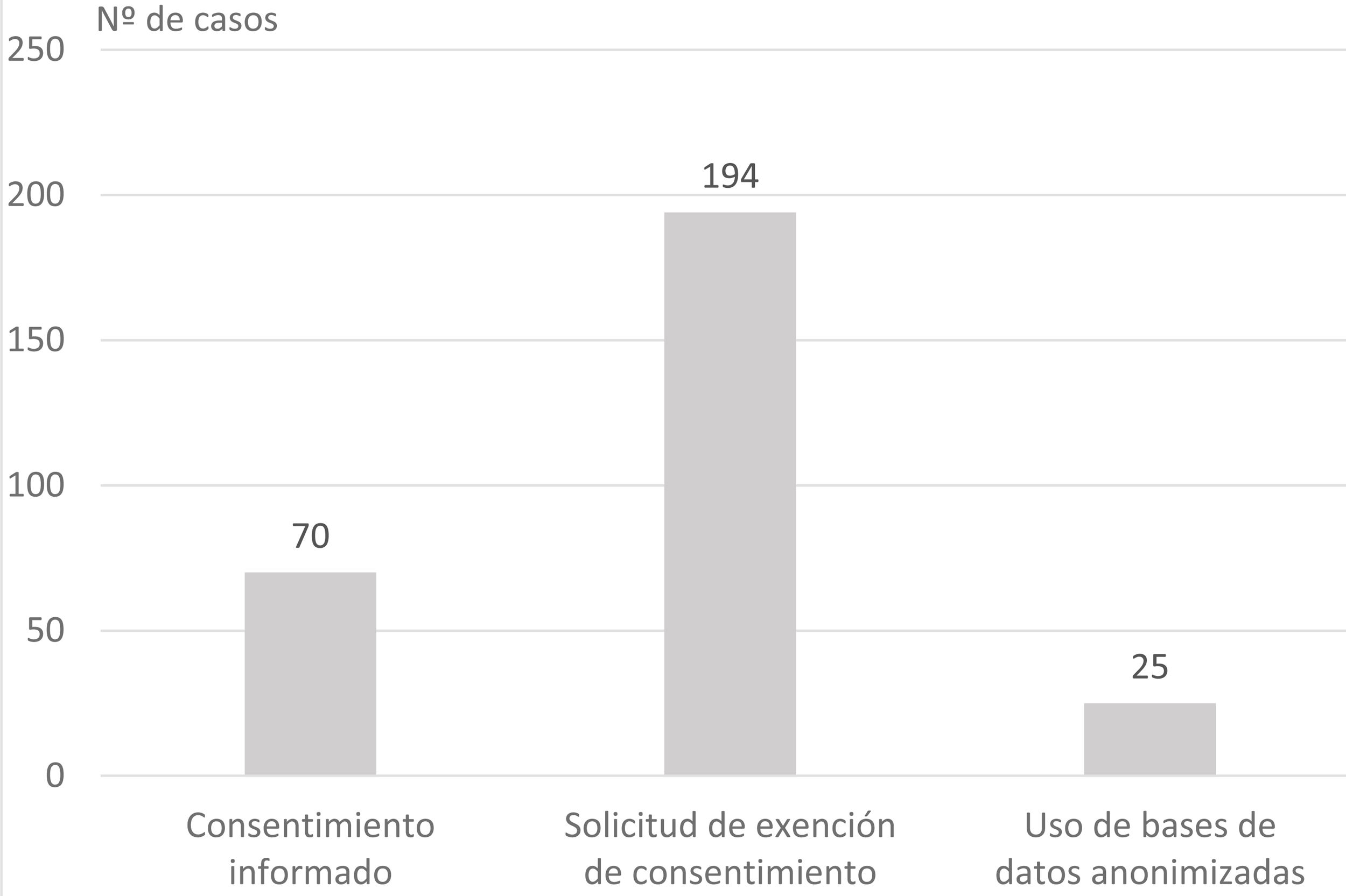
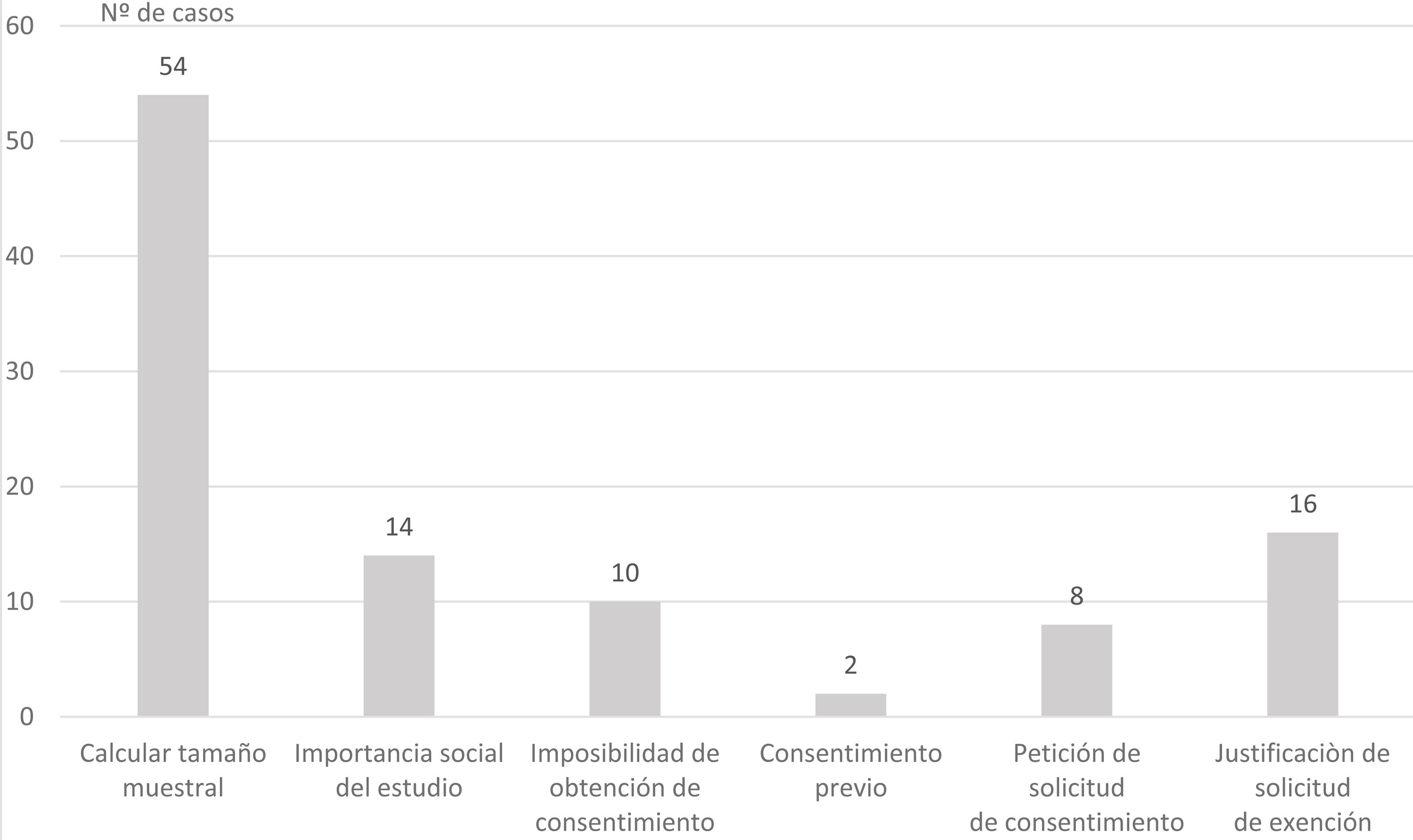
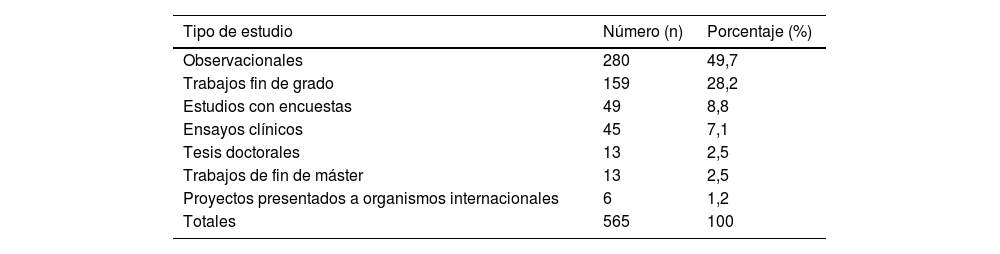
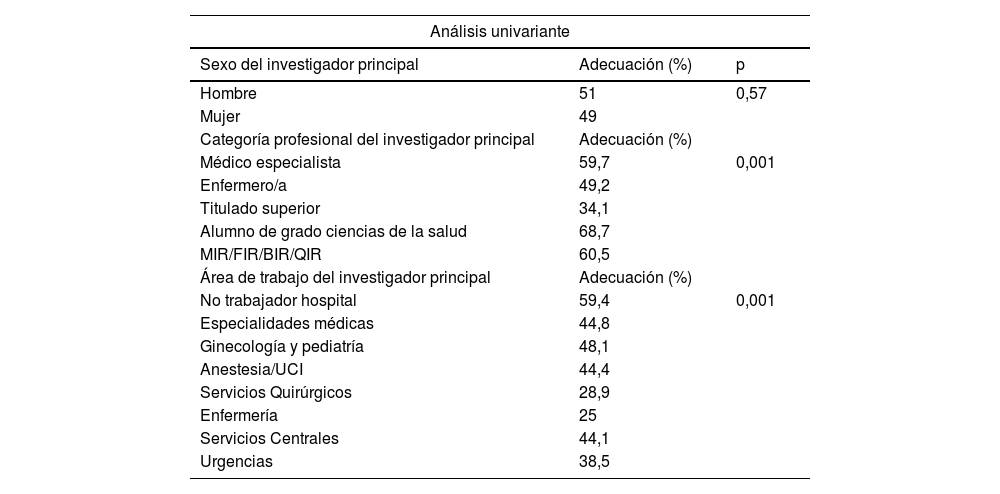
ResultadosSe evaluaron 565 protocolos. Los tipos de estudios presentados más frecuentes fueron observacionales retrospectivos (49,6%) y trabajos fin de grado (28,1%). La obtención de datos más frecuente fue por exención de consentimiento informado (48,3%) y fue adecuada en el 51,1% de los proyectos en la primera evaluación del CEI. Los proyectos más adecuados fueron los solicitados por los alumnos de grado (OR=4,2; intervalo de confianza [IC] 95%=2,0-8,8) y profesionales en formación OR=3,0; IC 95%=1,2-2,4).
ConclusionesLa mayoría de los estudios evaluados fueron observacionales retrospectivos en los que se solicitó la exención del consentimiento informado. La mayor adecuación se dio en proyectos solicitados por alumnos de grado y personal en formación (médicos internos residentes).
The principle of patient autonomy in the participation and incorporation of their health data in research projects is a legal and deontological obligation that must be fulfilled. The aim of this study was to know the degree of compliance and adequacy of informed consent in clinical research projects in a university hospital.
Material and methodsThrough this cross-sectional study, the adequacy of the way patient data are obtained in the research projects presented to the Research Committee of a university hospital was analyzed. The adequacy of the way patient data were obtained in the research projects, dealing with informed consent and causes of exemption, was described with their frequencies distributions. It was assessed by means of the adjusted odds ratio through a backstep logistic regression model, including the predictable significant variables previously analyzed in the univariant analysis.
ResultsA total of 565 protocols were included. The most frequent type of studies assessed were observational retrospectives (49.6%) and end-of-year projects (28.1%). The most frequent way of obtaining the patient data were by means of soliciting exemption of informed consent (48.3%). Obtaining the patient data process was considered appropriated in 51.1% of the projects. Projects with higher adequacy were those solicited by students (OR=4.2; CI95%=2.0–8.8) and residents OR=3.0; CI95%=1.2–2.4).
ConclusionsThe majority of the projects assessed was retrospective observational studies in which exemption of informed consent was solicited. Projects with higher adequacy were solicited by students and residents.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora