Analizar si existe asociación entre el uso de glucocorticoides a dosis altas y la evolución de la SAFI (saturación/fracción inspirada de oxígeno) o el tiempo hasta el alta, en pacientes hospitalizados por COVID-19.
MétodosEstudio observacional sobre una cohorte de 418 pacientes ingresados en 3 hospitales comarcales de Cataluña (España). Como resultados primarios se estudiaron la evolución de la SAFI en las primeras 48h de tratamiento y el tiempo hasta el alta. Los resultados se compararon entre pacientes tratados y no tratados con glucocorticoides (metilprednisolona 1-2mg/kg/día o dexametasona 20-40mg/día), mediante el análisis de subcohortes emparejadas por múltiples factores clínicos y pronósticos, así como mediante modelos multivariantes de Cox, ajustados por diversos factores pronósticos. El uso simultáneo de diferentes tratamientos para la COVID-19 fue tenido en cuenta, tanto en el emparejamiento de subcohortes como en la regresión de Cox.
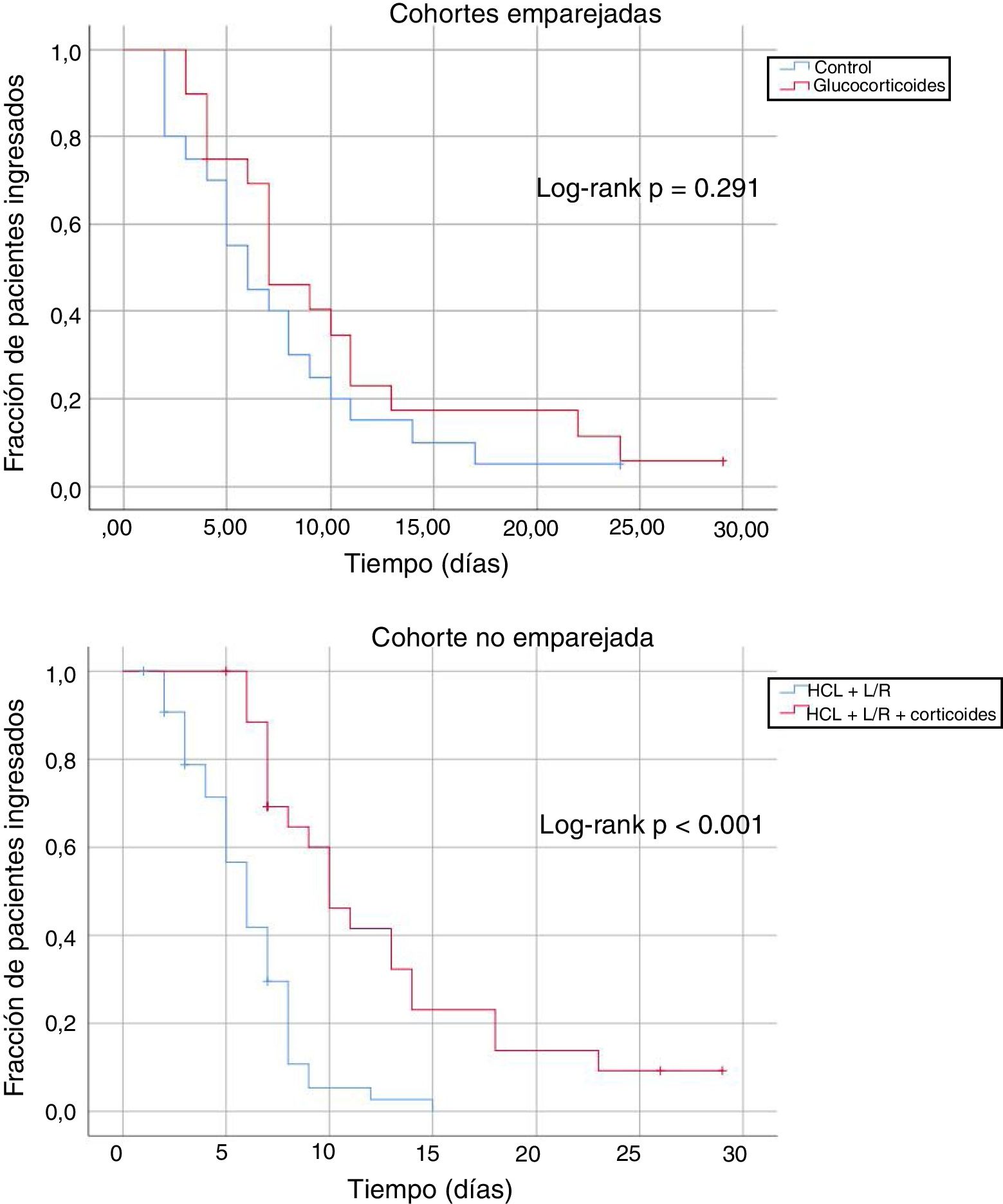
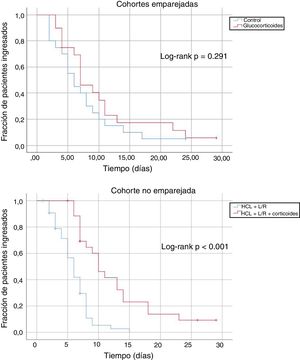
ResultadosHubo 187 pacientes con glucocorticoides; de ellos, 25 pacientes pudieron ser emparejados con un número equivalente de pacientes control. En las subcohortes emparejadas, no se apreció diferencia en el tiempo hasta el alta (log-rank: p=0,291), ni en el cambio en la SAFI a las 48h desde la basal (glucocorticoides: −0,04; controles: +0,37; p=0,095). Los modelos multivariantes mediante regresión de Cox mostraron un tiempo hasta el alta significativamente más largo en pacientes tratados con glucocorticoides (hazard ratio: 7,26; IC 95%: 3,30-15,95).
ConclusionesNo hemos encontrado mejoría en la función respiratoria o tiempo hasta el alta, asociado al uso de glucocorticoides a dosis altas.
To analyze whether there is an association between the use glucocorticoids at high doses, and the evolution of saturation/fraction of inspired oxygen (SAFI) or time to discharge, in patients hospitalized with COVID-19.
MethodsThis was an observational study on a cohort of 418 patients admitted to three regional hospitals in Catalonia, Spain. As primary outcomes, we studied the evolution of SAFI in the first 48hours of treatment and the time to discharge. The results were compared between patients treated and untreated with glucocorticoids (methylprednisolone 1-2mg/kg/day o dexamethasone 20-40mg/day) through sub-cohort analyses matched for multiple clinical and prognostic factors, as well as through Cox multivariate models adjusted for prognostic factors. The simultaneous use of different treatments for COVID-19 was taken into account, both in sub-cohorts matching and in Cox regression.
ResultsThere were 187 patients treated with glucocorticoids; of these, 25 patients could be matched with an equivalent number of control patients. In the analysis of these matched sub-cohorts, no significant difference was observed in time to discharge (log-rank: p=0.291) or the increment in SAFI at 48hours of treatment (glucocorticoides: −0.04; controls: +0.37; p=0.095). Multivariate models using Cox regression showed a significantly longer time to discharge in patients treated with glucocorticoids (hazard ratio: 7.26; 95% IC: 3.30-15.95).
ConclusionsWe have not found improvement in respiratory function or time until discharge, associated with the use of glucocorticoids at high doses.
En diciembre de 2019 se reportó en Wuhan (China) un brote epidémico asociado a un nuevo coronavirus (SARS-CoV-2) con manifestaciones clínicas principalmente respiratorias1. La extensión del brote alcanzó tal magnitud, que la OMS declaró el estado de pandemia el 12 de marzo del 20202. Aunque las tasas de mortalidad en los afectados (alrededor del 2% entre los pacientes atendidos médicamente)3 parecen estar sobreestimadas debido al infradiagnóstico de las personas afectadas con síntomas leves, la extensión de la pandemia ocasiona que la búsqueda de tratamientos efectivos constituya una máxima prioridad en el momento actual.
Diversos agentes farmacológicos se han propuesto como tratamiento potencial en base a consideraciones teóricas, estudios in vitro, o ensayos clínicos realizados en afecciones por otros virus relacionados. Sin embargo, la evidencia actual no ha confirmado la presencia o ausencia de beneficio de estos tratamientos e incluso se alerta de sus probables riesgos o efectos adversos asociados a su uso4,5.
Los glucocorticoides se han considerado como tratamiento potencial, en base a la experiencia de su uso en el síndrome de distrés respiratorio agudo (SDRA)6,7, la infección por influenza8 y las infecciones por otros coronavirus similares como el severe acute respiratory syndrome (SARS-CoV) o el Middle East respiratory syndrome (MERS-CoV)9–13, aun cuando en estas patologías no se ha demostrado un claro beneficio a partir de su uso. Se ha propuesto su potente acción antiinflamatoria como base de su efecto benéfico, especialmente en el estado hiperinflamatorio («tormenta de citoquinas») asociado a la COVID-1914,15. Sin embargo, los resultados de los estudios observacionales disponibles hasta el momento son dispares, y difíciles de interpretar, ya que la mayoría de estudios que tienen un grupo comparativo, no han realizado un emparejamiento de pacientes en función de características clínicas y pronósticas relevantes y tampoco han ajustado suficientemente sus análisis por dichas características16–19.
Los estudios observacionales con metodología más robusta han usado el Propensity Score como técnica de emparejamiento20,21, pero esta técnica no sirve para emparejar grupos en función de variables que cambian con el tiempo, como por ejemplo, la introducción progresiva de múltiples fármacos contra la COVID-19, que tan frecuente ha sido en los pacientes hospitalizados durante la ola epidémica.
Por otro lado, de los diversos ensayos clínicos que están en marcha, solo se han publicado hasta el momento resultados preliminares del ensayo clínico RECOVERY22. Según estos resultados, el uso de dexametasona a dosis bajas (6mg/día) se asocia con una mejoría en la supervivencia de los pacientes más graves. Sin embargo, quedan muchas preguntas por responder sobre el uso de glucocorticoides en esta enfermedad, y mientras no haya más resultados de los ensayos clínicos, los estudios observacionales siguen siendo una fuente de evidencia no despreciable.
En este estudio nos propusimos analizar el efecto del tratamiento con esteroides a dosis altas (1-2mg/kg/día de metilprednisolona o 20-40mg/día de dexametasona) en cohortes de pacientes tratados y no tratados con esteroides, fuertemente emparejadas por factores pronósticos y clínicos.
MetodologíaEste estudio observacional se llevó a cabo sobre una cohorte de 418 pacientes ingresados en los hospitales del Consorci Sanitari de l’Alt Penedès y Garraf (CSAPG), que son 3 hospitales de ámbito comarcal, que en total disponen de 275 camas de agudos y atienden a una población de referencia de 247.357 habitantes de las comarcas del Alt Penedès y Garraf, en Cataluña (España). Esta cohorte fue diseñada para poder estudiar la eficacia de los diferentes fármacos usados en la COVID-19, permitiendo el estudio mediante emparejamiento de casos.
Se recogieron datos de todos los pacientes con cuadro clínico compatible con enfermedad COVID-19, desde el 12 de marzo hasta el 2 de mayo de 2020, desde el momento del ingreso hasta el alta, o hasta un máximo de 30 días de ingreso. Se excluyeron los pacientes sin afectación pulmonar y aquellos con PCR negativa para SARS-CoV-2 en muestra obtenida por frotis nasal.
Los datos fueron recogidos de la historia clínica electrónica por el grupo de investigadores para la COVID-19 del CSAPG. Los datos recogidos incluyeron datos sociodemográficos, enfermedades previas, tratamientos crónicos, síntomas de presentación de la enfermedad, las constantes vitales y la evolución clínica cada día del ingreso, incluyendo la necesidad de oxigenoterapia, la fracción inspirada de oxígeno (FiO2) y el sistema de administración de oxígeno (gafas nasales, mascarilla venturi, mascarilla reservorio, ventilación mecánica invasiva o no invasiva). Se registraron todos los tratamientos usados durante el ingreso, y todos los análisis y radiografías de tórax practicados. Los investigadores encargados de recoger los datos, lo hicieron en un formulario estructurado creado en Open Clínica® (Copyright© OpenClinica LLC and collaborators, Waltham, MA, EE.UU.), siguiendo un procedimiento común, en el que fueron previamente entrenados. Se establecieron controles de calidad durante el proceso de recogida de datos y los errores detectados fueron subsanados, reentrenando además a los investigadores responsables cuando fue preciso.
Como variable de exposición se consideró el tratamiento con glucocorticoides. Según el protocolo hospitalario, los glucocorticoides estaban indicados en neumonía moderada o grave en dos posibles pautas: a) metilprednisolona intravenosa 1-2mg/kg/día, 3-5 días; b) bolo de dexametasona de 20-40mg/día 3-5 días. A efectos de este estudio, se consideró a un paciente expuesto a glucocorticoides si había recibido 3 dosis de cualquiera de los 2 fármacos, y no expuesto si no había recibido dosis alguna.
Las variables resultado principales para los análisis de eficacia fueron: el tiempo hasta el alta y la SAFI [saturación (%)/FiO2 (%)] a las 48h del inicio del tratamiento. Como variables secundarias se analizaron la SAFI a las 72h y a las 96h del inicio del tratamiento y la mortalidad.
En el análisis estadístico se usó una doble estrategia: 1) análisis de subcohortes emparejadas por factores de confusión y 2) análisis de subcohortes no emparejadas, ajustado por factores de confusión.
Como parte de la primera estrategia, se formó una subcohorte de pacientes tratados con glucocorticoides y una subcohorte emparejada de pacientes no tratados con glucocorticoides (ratio de emparejamiento 1:1). Los pacientes fueron emparejados por los siguientes marcadores pronósticos, que fueron identificados en análisis bivariados y modelos multivariantes realizados como paso inicial: sexo, edad, obesidad, insuficiencia cardiaca, insuficiencia renal crónica y síndrome de apnea-hipopnea del sueño (SAHS). El momento de inicio del seguimiento para los pacientes tratados con los fármacos a estudio fue el día que tomaron la primera dosis del fármaco. Como momento de inicio del seguimiento de cada uno de los controles se seleccionó aquel día del ingreso en el que la SAFI, las constantes vitales (presión arterial, frecuencia cardiaca y temperatura), la afectación radiológica y la PCR fueron similares a las del paciente con el que se emparejaron. Para ello, se tomó como referencia la PCR del análisis del día de inicio del seguimiento del paciente que recibió el tratamiento a estudio, o en su defecto, del día previo al inicio del tratamiento. Así mismo, se consideró la afectación radiológica del día de inicio del tratamiento, o de cualquier momento anterior, hasta un máximo de 2 días antes del inicio del tratamiento. En ningún momento se emparejaron los pacientes, en función de datos posteriores al inicio del tratamiento esteroideo, o al inicio del tiempo de seguimiento, en el caso de los controles. Se imputaron datos perdidos respecto a la afectación radiológica de la siguiente manera: se supuso que la afectación radiológica de los días intermedios entre 2 radiografías iguales era la misma que la de dichas radiografías (p. ej, si un paciente tenía una radiografía con 3 cuadrantes afectos el día 1 y otra con 3 cuadrantes afectos el día 6, se supuso que todos los días intermedios seguía teniendo 3 cuadrantes afectos). Esta interpolación se permitió hasta un máximo de 6 días de separación entre radiografías. No se imputaron datos perdidos en otras variables. Los pacientes que recibieron el tratamiento a estudio y sus controles fueron emparejados solamente si habían recibido por igual otros tratamientos para la COVID-19 incluyendo: hidroxicloroquina, lopinavir/ritonavir, interferón y azitromicina. Se toleró un margen de 3 días de desfase en el inicio de los otros tratamientos, entre los pacientes a estudio y sus controles. En análisis previos independientes, no se demostró que el uso de tocilizumab se encontrara asociado a los resultados principales del estudio en nuestra muestra, por lo que se permitió que las subcohortes de comparación no estuvieran emparejadas por este fármaco.
Para el emparejamiento se realizó un primer paso mediante algoritmos de computación de fuerza bruta, que identificaban todos los posibles controles existentes en la base de datos, para cada uno de los pacientes que recibieron el tratamiento a estudio. En este primer paso se escogieron controles que tuvieran el mismo sexo y estado de obesidad («sí» vs. «no», según el antecedente recogido en la historia clínica), la misma afectación radiológica (número de cuadrantes afectos en radiografía anteroposterior: de 0 hasta 4) y una diferencia de edad no superior a 15 años. Se permitió que el control tuviera una SAFI desde 1,1 puntos más baja hasta 2 puntos más alta que el paciente tratado y una PCR desde 6mg/dL más baja hasta 4mg/dL más alta que el paciente tratado. El emparejamiento se refinó después, escogiendo entre los potenciales controles previamente identificados el más similar en cuanto a SAFI, presión arterial, frecuencia cardiaca y PCR, utilizando el Propensity Score.
Se verificó el éxito del emparejamiento mediante comparación de medias o porcentajes entre grupos. Se descartó una diferente tendencia en la evolución de los pacientes (mejoría en un grupo y empeoramiento en otro), comprobando que la diferencia entre la SAFI del día 1 de análisis, y el día previo a entrar en el análisis, fuera similar. En las subcohortes emparejadas se estudió la SAFI a las 48, 72 y 96h, mediante la t de Student para muestras independientes y el tiempo hasta el alta mediante el log-rank test. En los análisis de la SAFI se excluyó a los pacientes con sedación paliativa, pues en ellos la SAFI no está relacionada con la gravedad de la enfermedad. En los análisis de tiempo hasta el alta, se excluyó a los fallecidos.
En el análisis de subcohortes no emparejadas (segunda estrategia de análisis), se analizó el efecto de los glucocorticoides en una subcohorte en la que todos los pacientes habían sido tratados con hidroxicloroquina y lopinavir/ritonavir, de la que se excluyó a los pacientes tratados con azitromicina u otros fármacos con distribución desigual entre el subgrupo expuesto a glucocorticoides y el subgrupo no expuesto a glucocorticoides. En el análisis de esta subcohorte se incluyó el total del tiempo de hospitalización desde el día uno del ingreso, y se consideró a los pacientes expuestos a glucocorticoides, si los habían tenido en cualquier momento del ingreso (al menos 3 dosis). Se estudió el tiempo hasta el alta (excluyendo a los fallecidos), y la mortalidad, mediante modelos de regresión de Cox, ajustados por las siguiente covariables, que fueron seleccionadas tanto por su asociación estadística con el resultado como por su relevancia clínica en opinión de los investigadores: sexo, edad, obesidad, insuficiencia cardiaca, insuficiencia renal crónica, SAHS, saturación basal en urgencias, PCR en urgencias y cuadrantes afectos en la radiografía de urgencias. La afectación radiológica se introdujo en el modelo de forma discreta, con 5 valores (de 0 a 4 cuadrantes afectos), la edad, la PCR y la saturación se introdujeron en el modelo lineal como variables numéricas, mientras que el resto de factores se trataron de forma dicotómica (presencia vs. ausencia del factor).
Para el análisis estadístico se usaron R software, versión 3.6.1 (R Project for Statistical Computing) y IBM SPSS statistics, versión 26.
El comité de ética de investigación del Hospital Universitario de Bellvitge revisó el estudio y aceptó la exención del consentimiento informado del paciente por tratarse de un estudio observacional y ambispectivo, basado en la revisión de datos clínicos, y con datos personales de los pacientes anonimizados para su publicación (ref. PR252/20).
ResultadosDe 464 pacientes consecutivos con diagnóstico clínico de COVID-19 y afectación pulmonar, ingresados entre el 12 de marzo y 2 de mayo de 2020, 46 fueron excluidos por presentar PCR para SARS-CoV-2 negativa. De los 418 pacientes incluidos en los análisis, 238 (56,9%) eran hombres y 180 (43,1%) mujeres; la edad media de la muestra fue de 65,4 años (DE 16,6 años) y la mediana de seguimiento fue de 9,5 días (RIQ 7 días).
En total, 164 (39,2%) pacientes recibieron tratamiento con metilprednisolona y 23 (5%) pacientes recibieron dexametasona. Los pacientes que durante el ingreso recibieron tratamiento doble con hidroxicloroquina y lopinavir/ritonavir fueron 346 (82,8%). En los primeros 30 días de ingreso fallecieron 79 pacientes (18,9%).
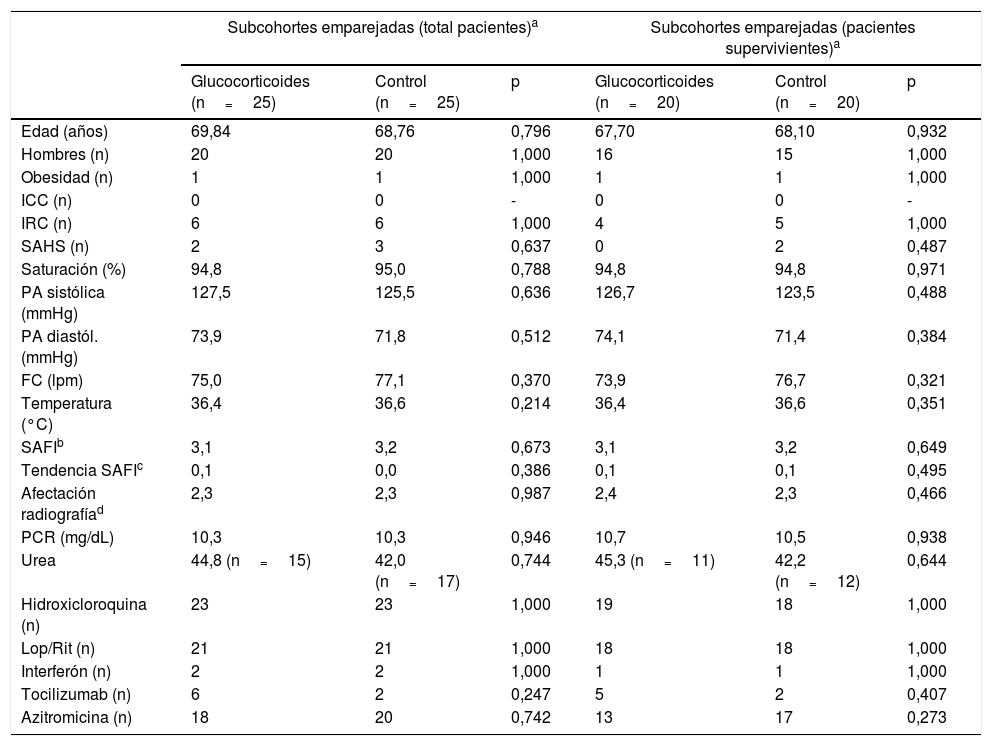
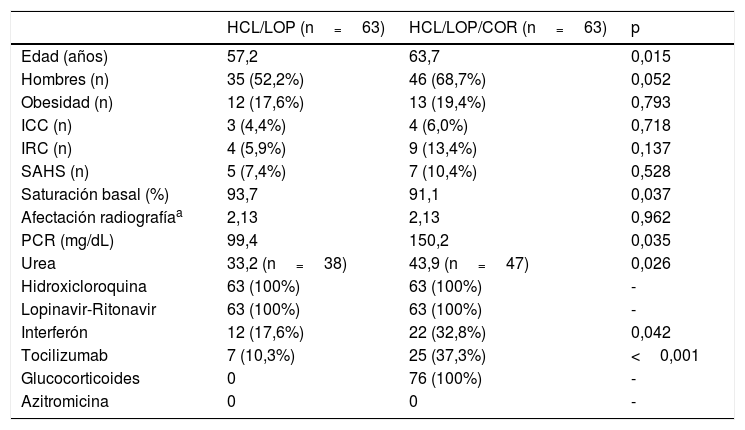
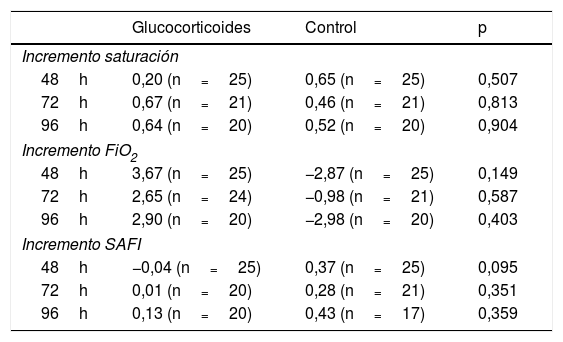
Las características de las subcohortes emparejadas se muestran en la tabla 1 y las características de la subcohorte no emparejada se muestran en la tabla 2. La tabla 3 muestra el cambio promedio en la saturación, la FiO2 y la SAFI respecto a la basal a las 48, 72 y 96h tras el tratamiento en las subcohortes emparejadas.
Características basales de los pacientes tratados con glucocorticoides y sus controles emparejados
| Subcohortes emparejadas (total pacientes)a | Subcohortes emparejadas (pacientes supervivientes)a | |||||
|---|---|---|---|---|---|---|
| Glucocorticoides (n=25) | Control (n=25) | p | Glucocorticoides (n=20) | Control (n=20) | p | |
| Edad (años) | 69,84 | 68,76 | 0,796 | 67,70 | 68,10 | 0,932 |
| Hombres (n) | 20 | 20 | 1,000 | 16 | 15 | 1,000 |
| Obesidad (n) | 1 | 1 | 1,000 | 1 | 1 | 1,000 |
| ICC (n) | 0 | 0 | - | 0 | 0 | - |
| IRC (n) | 6 | 6 | 1,000 | 4 | 5 | 1,000 |
| SAHS (n) | 2 | 3 | 0,637 | 0 | 2 | 0,487 |
| Saturación (%) | 94,8 | 95,0 | 0,788 | 94,8 | 94,8 | 0,971 |
| PA sistólica (mmHg) | 127,5 | 125,5 | 0,636 | 126,7 | 123,5 | 0,488 |
| PA diastól. (mmHg) | 73,9 | 71,8 | 0,512 | 74,1 | 71,4 | 0,384 |
| FC (lpm) | 75,0 | 77,1 | 0,370 | 73,9 | 76,7 | 0,321 |
| Temperatura (°C) | 36,4 | 36,6 | 0,214 | 36,4 | 36,6 | 0,351 |
| SAFIb | 3,1 | 3,2 | 0,673 | 3,1 | 3,2 | 0,649 |
| Tendencia SAFIc | 0,1 | 0,0 | 0,386 | 0,1 | 0,1 | 0,495 |
| Afectación radiografíad | 2,3 | 2,3 | 0,987 | 2,4 | 2,3 | 0,466 |
| PCR (mg/dL) | 10,3 | 10,3 | 0,946 | 10,7 | 10,5 | 0,938 |
| Urea | 44,8 (n=15) | 42,0 (n=17) | 0,744 | 45,3 (n=11) | 42,2 (n=12) | 0,644 |
| Hidroxicloroquina (n) | 23 | 23 | 1,000 | 19 | 18 | 1,000 |
| Lop/Rit (n) | 21 | 21 | 1,000 | 18 | 18 | 1,000 |
| Interferón (n) | 2 | 2 | 1,000 | 1 | 1 | 1,000 |
| Tocilizumab (n) | 6 | 2 | 0,247 | 5 | 2 | 0,407 |
| Azitromicina (n) | 18 | 20 | 0,742 | 13 | 17 | 0,273 |
FC: frecuencia cardiaca; ICC: insuficiencia cardiaca congestiva; IRC: insuficiencia renal crónica; Lop/Rit: lopinavir-ritonavir; PA: presión arterial; PCR: proteína C reactiva; SAFI: saturación (%)/fracción inspirada de O2 (%); SAHS: síndrome de apnea-hipopnea del sueño.
Características basales de las subcohortes de pacientes tratados con hidroxicloroquina/lopinavir-ritonavir y pacientes con tratamiento adicional con glucocorticoides
| HCL/LOP (n=63) | HCL/LOP/COR (n=63) | p | |
|---|---|---|---|
| Edad (años) | 57,2 | 63,7 | 0,015 |
| Hombres (n) | 35 (52,2%) | 46 (68,7%) | 0,052 |
| Obesidad (n) | 12 (17,6%) | 13 (19,4%) | 0,793 |
| ICC (n) | 3 (4,4%) | 4 (6,0%) | 0,718 |
| IRC (n) | 4 (5,9%) | 9 (13,4%) | 0,137 |
| SAHS (n) | 5 (7,4%) | 7 (10,4%) | 0,528 |
| Saturación basal (%) | 93,7 | 91,1 | 0,037 |
| Afectación radiografíaa | 2,13 | 2,13 | 0,962 |
| PCR (mg/dL) | 99,4 | 150,2 | 0,035 |
| Urea | 33,2 (n=38) | 43,9 (n=47) | 0,026 |
| Hidroxicloroquina | 63 (100%) | 63 (100%) | - |
| Lopinavir-Ritonavir | 63 (100%) | 63 (100%) | - |
| Interferón | 12 (17,6%) | 22 (32,8%) | 0,042 |
| Tocilizumab | 7 (10,3%) | 25 (37,3%) | <0,001 |
| Glucocorticoides | 0 | 76 (100%) | - |
| Azitromicina | 0 | 0 | - |
HCL: hidroxicloroquina; COR: glucocorticoides; ICC: insuficiencia cardiaca congestiva; IRC: insuficiencia renal crónica; LOP: lopinavir-ritonavir; PCR: proteína C reactiva; SAHS: síndrome de apnea-hipopnea del sueño.
Incremento en parámetros de función respiratoria, con respecto al primer día de seguimiento, en pacientes tratados con glucocorticoides y controles emparejados
| Glucocorticoides | Control | p | |
|---|---|---|---|
| Incremento saturación | |||
| 48h | 0,20 (n=25) | 0,65 (n=25) | 0,507 |
| 72h | 0,67 (n=21) | 0,46 (n=21) | 0,813 |
| 96h | 0,64 (n=20) | 0,52 (n=20) | 0,904 |
| Incremento FiO2 | |||
| 48h | 3,67 (n=25) | −2,87 (n=25) | 0,149 |
| 72h | 2,65 (n=24) | −0,98 (n=21) | 0,587 |
| 96h | 2,90 (n=20) | −2,98 (n=20) | 0,403 |
| Incremento SAFI | |||
| 48h | −0,04 (n=25) | 0,37 (n=25) | 0,095 |
| 72h | 0,01 (n=20) | 0,28 (n=21) | 0,351 |
| 96h | 0,13 (n=20) | 0,43 (n=17) | 0,359 |
FiO2: fracción inspirada de oxígeno; SAFI: saturación/fracción inspirada de oxígeno.
En las cohortes emparejadas, el tiempo promedio hasta el alta de los pacientes que no fallecieron fue de 10,3 días (IC 95%: 6,9-13,7 días) en el caso de los pacientes tratados con glucocorticoides, y de 7,5 días (IC 95%: 5,1-9,9 días) en el caso de los pacientes control. En la cohorte no emparejada este tiempo fue de 12,0 días (IC 95%: 10,0-16,0 días) para los pacientes tratados con glucocorticoides y de 7,0 días para los no tratados con glucocorticoides (IC 95%: 6,0-8,0). La figura 1 muestra curvas comparativas de Kaplan-Meier, no ajustadas, y log-rank test, para el tiempo hasta el alta, en las subcohortes estudiadas. Los modelos multivariantes de regresión de Cox mostraron que el tratamiento con glucocorticoides se asoció a un mayor tiempo de ingreso, una vez ajustado el modelo por el resto de confusores contemplados (hazard ratio 7,26; IC 95%: 3,30-15,95).
Se registraron 6 muertes (8,1%) en la subcohorte de control no emparejada (pacientes tratados con hidroxicloroquina y lopinavir/ritonavir), y murieron 10 personas (13,2%) entre los pacientes que recibieron tratamiento adicional con glucocorticoides. Hemos considerado este número de eventos insuficiente para sacar conclusiones.
DiscusiónNuestro estudio no ha mostrado beneficio asociado al uso de glucocorticoides a dosis alta en cuanto a la función respiratoria (SAFI) o el tiempo hasta el alta, apreciándose incluso un incremento de la estancia hospitalaria en el grupo tratado con glucocorticoides en los análisis de la subcohorte no emparejada.
Nuestros resultados coinciden con los reportados por Lu et al.20 y también con los de Yuan et al.21, que en muestras de tamaño similar y con grupos comparativos ajustados (Propensity Score) tampoco encontraron beneficio en el uso de corticosteroides. Lu et al. encontraron un exceso de mortalidad en pacientes críticos con el incremento de dosis de esteroides (4% por cada incremento de 10mg de hidrocortisona), mientras que los resultados de Yuan et al. muestran un efecto negativo en la recuperación del daño pulmonar en pacientes sin neumonía grave.
Por el contrario, Chroboczek et al.23, en un estudio ajustado por factores de confusión relevantes, encontraron que la terapia esteroidea disminuía el riesgo de intubación. Desafortunadamente, en la publicación no se reporta el tipo y pauta de terapia corticoide analizada. En la misma línea, un pequeño estudio publicado previamente en esta revista por Callejas et al. muestra una ventaja significativa en cuanto a supervivencia de grupos de pacientes tratados con glucocorticoides en comparación con un grupo de pacientes control tratados con tocilizumab24. Hay que decir que el tamaño muestral y el número de eventos de este estudio fueron escasos (el grupo control tenía 9 pacientes), razón por la que suponemos no realizaron ajuste por variables confusoras, lo que dificulta la generalización e interpretación de los resultados.
Recientemente se han publicado resultados preliminares del ensayo clínico RECOVERY22. Este ensayo analiza el uso de dexametasona a dosis baja (6mg/día) en la supervivencia de pacientes con COVID-19. Según estos datos preliminares, el tratamiento con 6mg diarios de dexametasona estaría asociado a una mayor supervivencia, especialmente en pacientes críticos. Nosotros no hemos podido analizar la mortalidad en nuestro estudio, debido al escaso número de eventos en nuestra muestra, sin embargo, parece que el resultado positivo del ensayo RECOVERY es discordante con nuestros resultados, en los que no se observa beneficio en el uso de glucocorticoides en cuanto a función pulmonar o tiempo hasta el alta. Al margen de la diferencia en los parámetros primarios de evaluación (endpoints), una serie de factores pueden explicar esta discrepancia. El corticoide mayoritariamente usado en nuestro ensayo fue metilprednisolona (78% en la subcohorte emparejada y 98% en la subcohorte no emparejada) y, más importante, los glucocorticoides en nuestra cohorte no fueron usados a dosis baja, sino a dosis alta (dosis 3 a 6 veces más alta en el caso de la dexametasona y dosis equivalente a 2,2 veces más alta en el caso de la metilprednisolona). Tal y como señalan los propios autores en la publicación de los resultados del ensayo RECOVERY, cabe la posibilidad de que el uso de dosis altas de glucocorticoides sea más perjudicial que beneficioso, y por tanto pueda estar relacionado con complicaciones que puedan, por ejemplo, prolongar el ingreso, como por otra parte apuntaba el estudio observacional de Lu et al.20. Por último, los pacientes que más se beneficiaron del tratamiento en el ensayo RECOVERY fueron los pacientes críticos intubados, siendo más modesto el beneficio en pacientes con oxigenoterapia, e inexistente en pacientes leves. Nuestras subcohortes emparejadas solo incluyeron una pareja de pacientes intubados, siendo el resto de pacientes más leves (como se puede apreciar en la SAFI promedio de ambos grupos), por lo que puede haber sido difícil observar en ellos un beneficio22.
Aunque dado el carácter observacional de nuestro estudio no puede descartarse la existencia de confusión residual, principalmente debida a la tendencia a administrar glucocorticoides a pacientes de mayor riesgo o más graves, el exhaustivo método de emparejamiento utilizado y la comprobación de la comparabilidad de los grupos nos hace suponer que dicha confusión fue poco probable o de poca magnitud. Por otro lado, la pérdida de pacientes tras el emparejamiento puede conducir al desequilibrio entre grupos, respecto a las características inicialmente emparejadas, y por tanto a la aparición de confusión residual. En nuestro estudio, esto no afecta a los resultados primarios (SAFI a las 48h y tiempo hasta el alta), pues no hay pérdida de pacientes tras el emparejamiento; sin embargo, puede afectar a los resultados secundarios, pues los datos de la SAFI son incompletos a partir de las 72h de seguimiento.
Además de por su diseño observacional, nuestro estudio está limitado por su escaso tamaño muestral, que imprime problemas de poder estadístico, especialmente en el caso de algunos de los resultados de mayor interés, como es la mortalidad, que no ha podido ser estudiada en esta muestra. Por otro lado, el uso de datos secundarios, obtenidos de la historia clínica, hace temer sesgos de información. Sin embargo, dado que las variables principales son parámetros cuantitativos, poco influidos por el observador o su pericia en la medición, y dado que estos parámetros se recogen habitualmente en la práctica clínica y en la gestión hospitalaria, consideramos poco probable la existencia de un sesgo relevante de este tipo. En todo caso, el tamaño muestral y la naturaleza observacional de nuestro estudio hacen necesaria la espera de resultados de los ensayos clínicos aleatorizados, en los que se hayan utilizado dosis altas de glucocorticoides, para confirmar los nuestros.
En conclusión, en este estudio observacional no hemos encontrado evidencia de un beneficio clínico del uso de glucocorticoides a dosis altas en pacientes hospitalizados por COVID-19. El uso de glucocorticoides a dosis altas podría alargar el tiempo de ingreso en estos pacientes.
FinanciaciónEste estudio está financiado por el Consorci Sanitari de l’Alt Penedès i Garraf.
Conflicto de interesesNinguno.
Alberti Casas, Anna PhD, MD; Avalos Garcia, Jose L MD; Borrego Ruiz, Manel BS, Campo Pisa, Pedro L; Capielo Fornerino, Ana M. MD; Dapena, María Dolores; MD; Fenollosa Artes, Andreu MD; Gris Ambros, Clara MD; Hernandez Martinez, Lourdes MD; López, Gabriela F.; Martín Puig, Mireia MD; Martínez, Sergi MD; Macho Pérez, Oscar MD; Molina Hinojosa, José C. MD; Peramiquel Fonollosa, Laura MD; Pisani Zambrano, Italo G. MD; Rives, Juan P. MD; Robles, Maria Teresa MD; Sabria Bach, Enric MD; Sanchez Rodriguez, Yris M. MD; Segura Martín, Maria del Mar RN; Tremosa Llurba, Gemma MD; Ventosa Gili, Ester MD; Venturini Cabanellas, Florencia I. MD; Vidal Meler, Natàlia RN.