Tras la pandemia de la COVID-19, la variante ómicron del virus SARS-CoV-2 se convirtió en el linaje dominante en España en 2022. Aunque posee una patogenicidad más leve que las anteriores variantes, sigue suponiendo un riesgo elevado de ocasionar una forma de COVID-19 grave para la población inmunodeprimida.
Se realizó una revisión sistemática para evaluar la carga de la COVID-19 en España en pacientes inmunocomprometidos durante la predominancia de ómicron (1/04/2022- 1/04/2023), en PubMed, Cochrane Library y EPICOVIDEHA entre mayo y julio de 2023.
La búsqueda recuperó 217 artículos, incluyéndose un total de cinco. Tras su análisis, se observó que los pacientes inmunocomprometidos durante el predominio del linaje ómicron siguen presentando una mayor tasa de hospitalizaciones, ingresos en la Unidad de Cuidados Intensivos (UCI) y mortalidad que la población general afectada por COVID-19. Aunque la pandemia ha terminado, para los inmunodeprimidos continua el riesgo.
After the COVID-19 pandemic, the omicron variant of the SARS-CoV-2 virus became the dominant lineage in Spain in 2022. Although it possesses a milder pathogenicity than previous variants, it still poses a high risk of causing severe COVID-19 for immunocompromised populations.
A systematic review was conducted to assess the burden of COVID-19 in Spain among immunocompromised patients during the omicron predominance (1/04/2022-1/04/2023), using PubMed, Cochrane Library, and EPICOVIDEHA between May and July 2023.
The search retrieved 217 articles, of which a total of 5 were included. Upon analysis, it was observed that immunocompromised patients during the omicron lineage predominance continue to exhibit higher rates of hospitalizations, ICU admissions, and mortality compared to the general population affected by COVID-19. Although the pandemic has ended, the risk persists for immunocompromised individuals.
La pandemia de la enfermedad por coronavirus de 2019 (COVID-19), causada por el coronavirus de tipo 2 del síndrome respiratorio agudo severo (SARS-CoV-2), declarada por la Organización Mundial de la Salud (OMS) en 2020, tuvo devastadoras consecuencias sanitarias mundialmente1. Hasta marzo de 2023, se contabilizaron alrededor de 700 millones de casos en todo el mundo y casi siete millones de defunciones2. En España, se notificaron cerca de 14 millones de afectados y más de 120.000 fallecidos3.
La mortalidad por COVID-19 tiene mayor incidencia en personas de edad avanzada y con enfermedades subyacentes como diabetes mellitus (DM), hipertensión, enfermedad renal crónica (ERC) o enfermedad cardiovascular4. Diversos estudios han identificado que los pacientes con neoplasias hematológicas, inmunodeficiencias, trasplantes de órgano sólido o en quimioterapia, es decir, los grandes inmunocomprometidos, presentan un mayor riesgo de baja respuesta a la vacunación y de persistencia del virus durante más tiempo al infectarse por SARS-CoV-2. Este aspecto es de importancia clave en la aparición de nuevas variantes del virus. Por otra parte, estos pacientes registran formas más graves de COVID-19, mayor tiempo de hospitalización y mayor mortalidad5–7. La pandemia de COVID-19ha afectado con mayor incidencia a los pacientes inmunodeprimidos por su respuesta inmunitaria deficiente a la infección y a la vacunación, y por sus comorbilidades8. Actualmente, resulta difícil cuantificar la población de personas inmunodeprimidas en España. Sin embargo, según la Organización Nacional de Trasplantes, se realizaron 5.385 trasplantes de órgano sólido en España, sobre todo, trasplante renal9 y 3.630 trasplantes de progenitores hematopoyéticos10. Además, la Red Española de Registros de Cáncer (REDECAN) estima que los cánceres más diagnosticados en España en 2023 serán: colon y recto (42.721), mama (35.001), pulmón (31.282), próstata (29.002) y vejiga (21.694)11.
Hasta la fecha, se han identificado diversas variantes del virus SARS-CoV-2, entre ellas, la variante ómicron (B.1.1.529) a finales de 202112. Ómicron presentó un elevado impacto para la salud pública y fue considerada por la OMS como variante de preocupación (VOC) dada su elevada transmisibilidad, aunque menor virulencia y su capacidad para evadir total o parcialmente respuestas inmunes a variantes previas13. La variante ómicron originó cinco linajes distintos (BA.1, BA.2, BA.3, BA.4 y BA.5) y fue predominante desde marzo hasta junio de 2022. En octubre de 2022 se detectó la circulación de la variante BQ.1 y otros sublinajes próximos, responsables de la enésima onda epidémica de COVID-1914. A diferencia de las ondas pandémicas por variantes previas, esta última se caracterizó por una elevada tasa de portadores asintomáticos15, sintomatología más leve, periodos de incubación y de enfermedad más breves, una menor afectación de las vías respiratorias bajas y menor probabilidad de ingreso hospitalario16. Esta reducción de la gravedad en la población se explica por una inmunidad adquirida previa y una atenuación de la virulencia de las variantes y sublinajes ómicron actuales17.
Los pacientes inmunocomprometidos siguen siendo actualmente una población de riesgo diferenciada, ya que, a su vulnerabilidad de respuesta clínica se suma la dificultad de generar una respuesta protectora mediante la vacunación. Algunos estudios han mostrado que los pacientes inmunocomprometidos presentan un mayor riesgo de hospitalización y muerte en la COVID-19 por la variante ómicron y los linajes posteriores18,19. En España, la carga de enfermedad de dichas variantes en pacientes inmunocomprometidos no ha sido todavía adecuadamente revisada y sintetizada, no existiendo una revisión de la evidencia acumulada al respecto. El objetivo del presente estudio fue realizar una revisión sistemática de la literatura para evaluar la carga de la COVID-19 por la variante ómicron en España en pacientes inmunocomprometidos durante la séptima onda epidémica, declarada a partir del 28/3/2022, momento de entrada en vigor de la nueva estrategia de vigilancia20.
MétodosLa revisión sistemática se registró en PROSPERO (CRD42023425793)21.
Fuentes de información y estrategia de búsquedaSe revisó la literatura publicada para identificar estudios que evaluaran la carga de la COVID-19 en pacientes inmunocomprometidos, durante el periodo de las variantes ómicron en España. La búsqueda se realizó entre mayo-julio de 2023 en bases de datos electrónicas: PubMed, Cochrane Library y EPICOVIDEHA. Se siguieron las directrices Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) para el proceso de selección de estudios22. La lista de comprobación PRISMA se incluye como Apéndice A del material suplementario.
En la búsqueda se utilizaron las palabras clave relacionadas, títulos de la materia médica y términos de texto siguientes: («SARS-CoV-2» OR COVID OR Omicron) en el título AND (Spain OR Spanish OR español OR España) en el texto completo AND (immunocompromis* OR immunosuppress* OR «hematologic malignan*» OR «hematologic neoplasm*» OR oncohematologic* OR «solid transplant*» OR «onco hematologic*» OR immunodeficient* OR «bone marrow transplant*» OR HSCT OR «CAR T cell therapy» OR Rituximab OR «Anti CD20» OR mAbs OR azathioprine OR Imuran OR mycophenolate OR Belimumab OR Anakinra OR Infliximab OR Abatacept OR Ibrutinib OR Secukinumab OR Tofacitinib OR chemotherap*) en el título, el resumen o las palabras clave AND («2022/04/01»[Fecha de Publicación]: «2023/04/01»[Fecha de Publicación]). La decisión de seleccionar estudios con fechas de infección o estudios realizados entre 01/04/2022 y 01/04/2023 se ejecutó con el objetivo de acotar la población infectada por la variante ómicron.
Selección de estudiosSe seleccionaron los estudios con datos originales sobre la carga de la COVID-19 en pacientes inmunocomprometidos, incluyendo ensayos clínicos (EECC) aleatorizados (fase III y IV), estudios de cohortes/casos y controles, estudios transversales, estudios ecológicos, estudios comparativos, etc. con datos cuantitativos o cualitativos con fecha de infección por SARS-CoV-2 o fecha de estudio situada entre 01/04/2022 y 01/04/2023, incluyéndose publicaciones en inglés o español con resúmenes disponibles.
Se excluyeron los protocolos Cochrane y los EECC sin resultados publicados, así como los estudios realizados fuera de España y los multicéntricos que no proporcionaban datos desglosados para España.
Dos revisores examinaron de forma independiente todos los títulos para comprobar su relevancia, eliminaron duplicados y confirmaron los criterios de elegibilidad en una hoja de recogida de datos. Cualquier desacuerdo entre los dos revisores principales fue resuelto por un tercero. El Apéndice B muestra los estudios excluidos y las razones de exclusión.
Medición de resultadosPara cada manuscrito se recogió en un formulario estandarizado: la incidencia acumulada de la enfermedad tras un año desde la vacunación, las hospitalizaciones, los ingresos en la Unidad de Cuidados Intensivos (UCI), el requerimiento de oxígeno, la mortalidad, la sintomatología, neumonía, los factores de riesgo de infección, el título de anticuerpos (inmunoglobulina G contra el dominio de unión de receptor [IgG-RBD] e inmunoglobulina A contra el dominio de unión de receptor [IgA-RBD]) y otros signos y síntomas clínicos de interés.
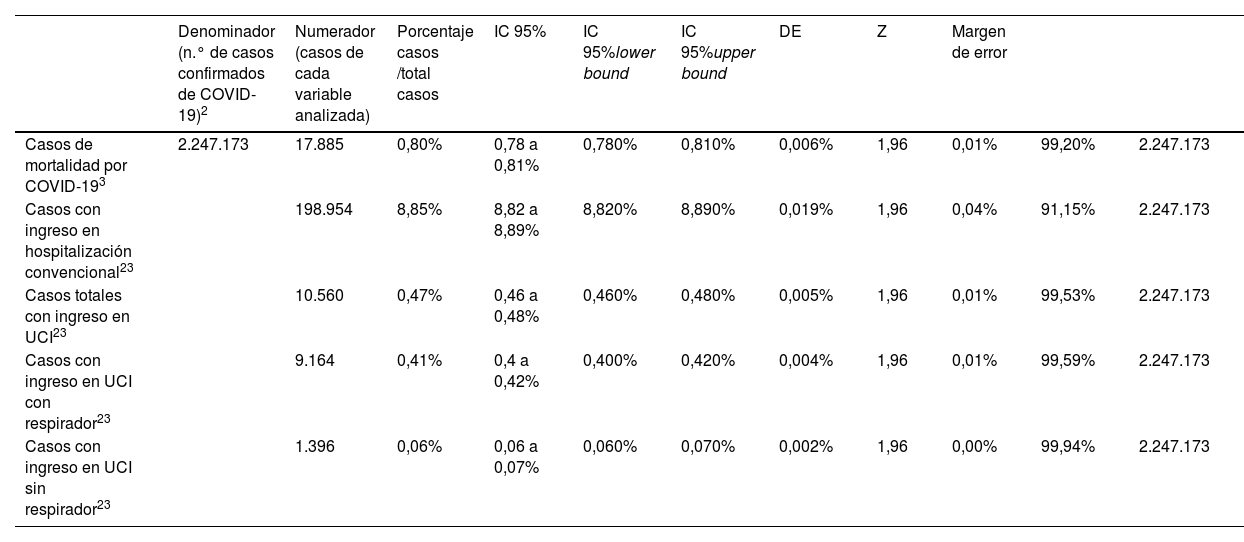
Durante la extracción de datos se detectó la ausencia de grupos control comparadores de pacientes no inmunocomprometidos. Por ello, se revisaron datos de estadísticas generales de la población de España relativos a la mortalidad, hospitalizaciones e ingresos en la UCI, para extraer información sobre las variables de estudio en la población general y para el mismo periodo de estudio (tabla 1)3,23. Para poder establecer la comparación entre los datos de la población inmunocomprometida frente a la población general se estimaron los intervalos de confianza del 95% para la población de referencia y se analizó si los resultados obtenidos en los estudios se encontraban dentro de estos intervalos de referencia o no.
Datos poblacionales en España durante el periodo de estudio (01/04/2022 a 31/03/2023)
| Denominador (n.° de casos confirmados de COVID-19)2 | Numerador (casos de cada variable analizada) | Porcentaje casos /total casos | IC 95% | IC 95%lower bound | IC 95%upper bound | DE | Z | Margen de error | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Casos de mortalidad por COVID-193 | 2.247.173 | 17.885 | 0,80% | 0,78 a 0,81% | 0,780% | 0,810% | 0,006% | 1,96 | 0,01% | 99,20% | 2.247.173 |
| Casos con ingreso en hospitalización convencional23 | 198.954 | 8,85% | 8,82 a 8,89% | 8,820% | 8,890% | 0,019% | 1,96 | 0,04% | 91,15% | 2.247.173 | |
| Casos totales con ingreso en UCI23 | 10.560 | 0,47% | 0,46 a 0,48% | 0,460% | 0,480% | 0,005% | 1,96 | 0,01% | 99,53% | 2.247.173 | |
| Casos con ingreso en UCI con respirador23 | 9.164 | 0,41% | 0,4 a 0,42% | 0,400% | 0,420% | 0,004% | 1,96 | 0,01% | 99,59% | 2.247.173 | |
| Casos con ingreso en UCI sin respirador23 | 1.396 | 0,06% | 0,06 a 0,07% | 0,060% | 0,070% | 0,002% | 1,96 | 0,00% | 99,94% | 2.247.173 |
COVID-19: enfermedad de coronavirus de 2019; DE: desviación estándar; IC: intervalo de confianza; n: tamaño de la muestra; Z: Puntuación Z; UCI: Unidad de Cuidados Intensivos; q: valor de cuantil.
Dos revisores independientes analizaron la calidad de los estudios con Mixed Methods Appraisal Tool (MMAT)24 para evaluar el riesgo de sesgo. En caso de desacuerdo, un tercero evaluó la calidad del estudio discordante.
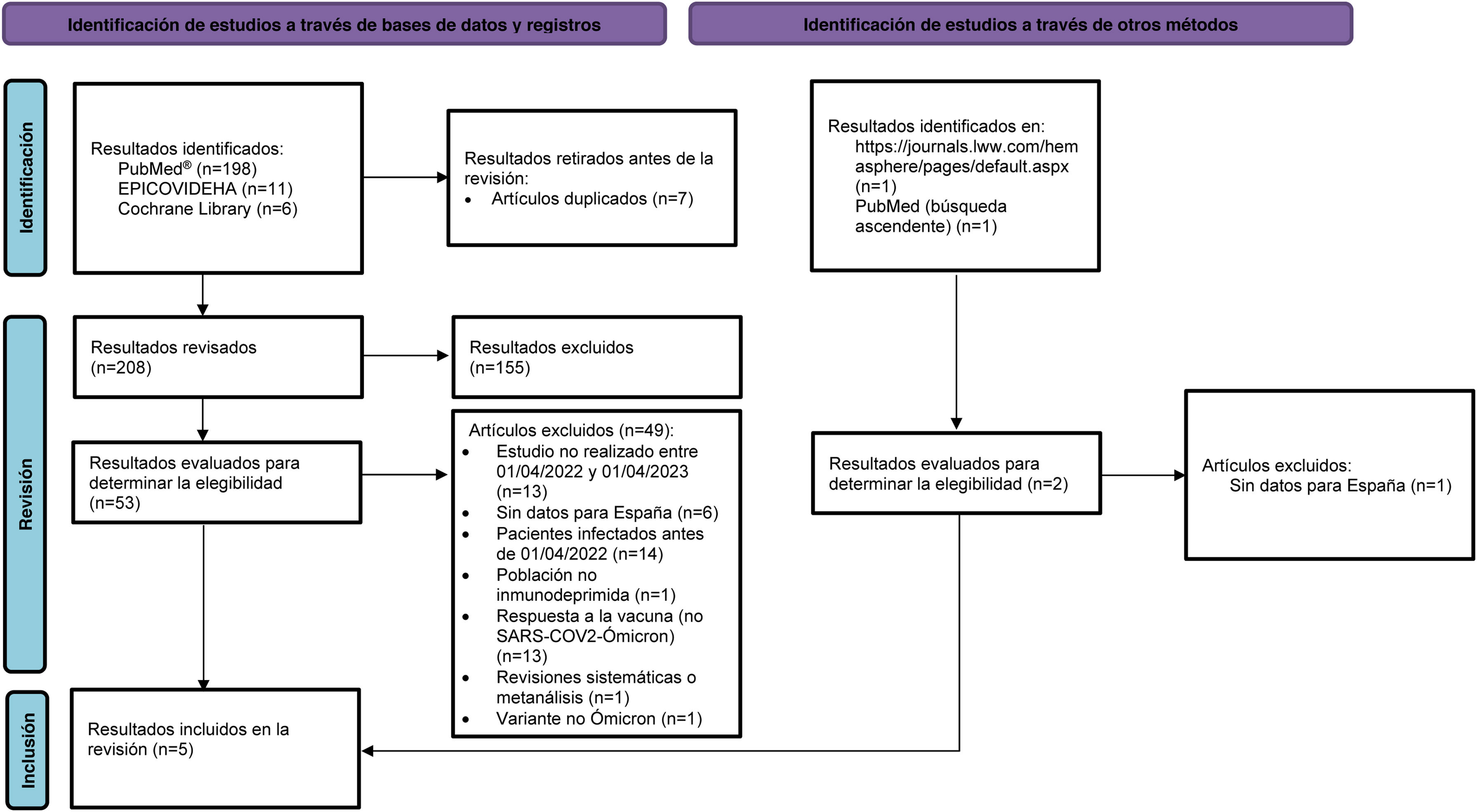
ResultadosDescripción y características de los estudiosSe identificaron 198 resultados en PubMed, 11 en la base EPICOVIDEHA y seis en Cochrane Library. De estos 215, se eliminaron siete duplicados. Después de una revisión inicial del título y resumen, 155 artículos fueron excluidos por no cumplir con los criterios de selección (Apéndice B. Material suplementario). Paralelamente se identificaron dos estudios a través de otros métodos (fig. 1). Tras cotejar los artículos preseleccionados con los criterios de elegibilidad se seleccionaron cinco artículos para la revisión sistemática25–29. En la figura 1 se observa el flujo de selección de artículos según PRISMA y los motivos de exclusión22.
Diagrama de flujo PRISMA de la selección de publicaciones. Adaptado de Page et al22.
n: número; PRISMA: Preferred Reporting Items for Systematic Reviews and Meta-Analyses; SARS-CoV-2: coronavirus de tipo 2 causante del síndrome respiratorio agudo severo 2.
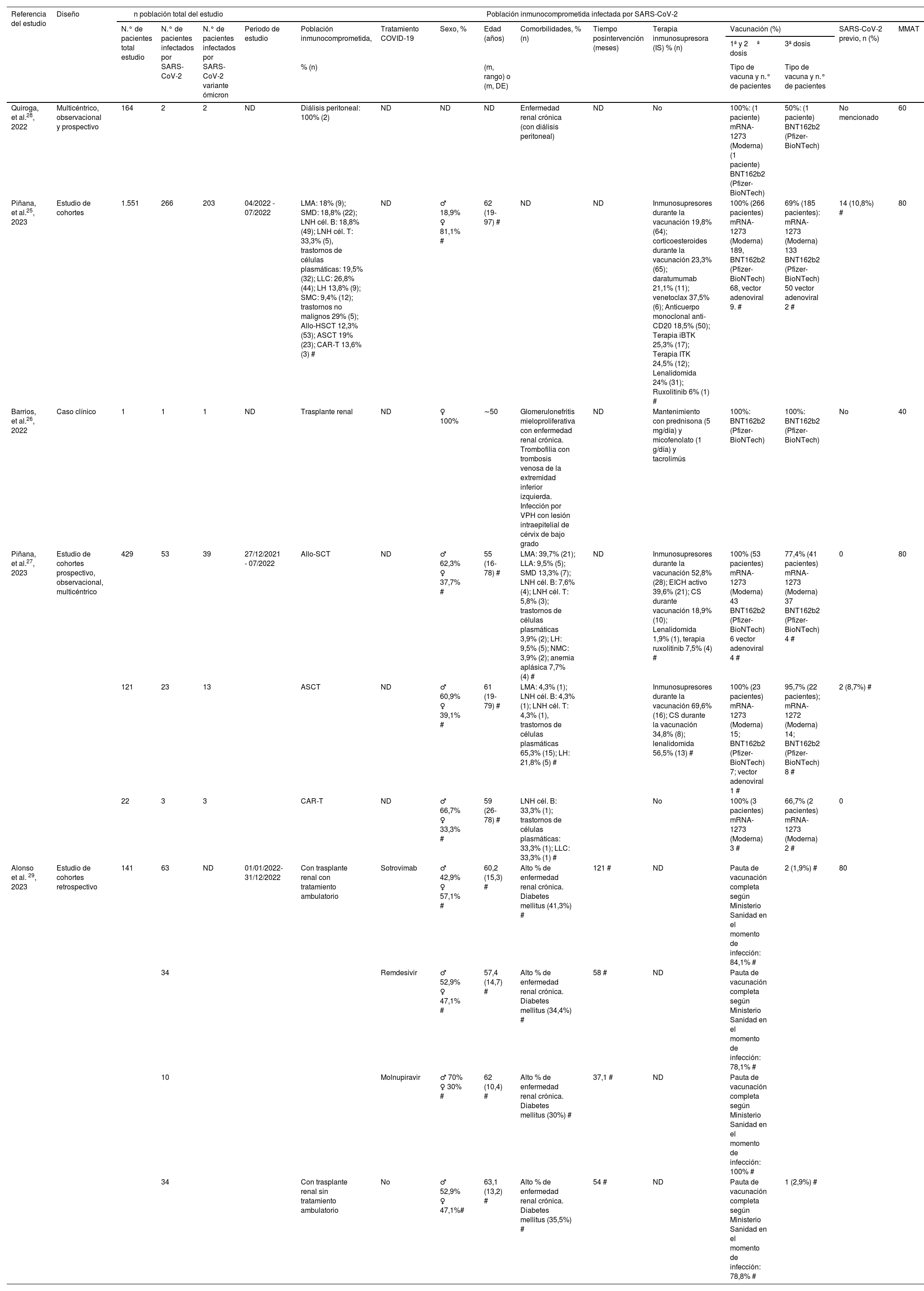
En la tabla 2 se muestran las características de los estudios y de la población incluidos.
Características de los estudios incluidos y la población descrita en los mismos. Descripción de la población inmunocomprometida
| Referencia del estudio | Diseño | n población total del estudio | Población inmunocomprometida infectada por SARS-CoV-2 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N.° de pacientes total estudio | N.° de pacientes infectados por SARS-CoV-2 | N.° de pacientes infectados por SARS-CoV-2 variante ómicron | Periodo de estudio | Población inmunocomprometida, | Tratamiento COVID-19 | Sexo, % | Edad (años) | Comorbilidades, % (n) | Tiempo posintervención (meses) | Terapia inmunosupresora (IS) % (n) | Vacunación (%) | SARS-CoV-2 previo, n (%) | MMAT | |||
| 1ª y 2ª dosis | 3ª dosis | |||||||||||||||
| % (n) | (m, rango) o (m, DE) | Tipo de vacuna y n.° de pacientes | Tipo de vacuna y n.° de pacientes | |||||||||||||
| Quiroga, et al.28, 2022 | Multicéntrico, observacional y prospectivo | 164 | 2 | 2 | ND | Diálisis peritoneal: 100% (2) | ND | ND | ND | Enfermedad renal crónica (con diálisis peritoneal) | ND | No | 100%: (1 paciente) mRNA-1273 (Moderna) (1 paciente) BNT162b2 (Pfizer-BioNTech) | 50%: (1 paciente) BNT162b2 (Pfizer-BioNTech) | No mencionado | 60 |
| Piñana, et al.25, 2023 | Estudio de cohortes | 1.551 | 266 | 203 | 04/2022 - 07/2022 | LMA: 18% (9); SMD: 18,8% (22); LNH cél. B: 18,8% (49); LNH cél. T: 33,3% (5), trastornos de células plasmáticas: 19,5% (32); LLC: 26,8% (44); LH 13,8% (9); SMC: 9,4% (12); trastornos no malignos 29% (5); Allo-HSCT 12,3% (53); ASCT 19% (23); CAR-T 13,6% (3) # | ND | ♂ 18,9% ♀ 81,1% # | 62 (19-97) # | ND | ND | Inmunosupresores durante la vacunación 19,8% (64); corticoesteroides durante la vacunación 23,3% (65); daratumumab 21,1% (11); venetoclax 37,5% (6); Anticuerpo monoclonal anti-CD20 18,5% (50); Terapia iBTK 25,3% (17); Terapia ITK 24,5% (12); Lenalidomida 24% (31); Ruxolitinib 6% (1) # | 100% (266 pacientes) mRNA-1273 (Moderna) 189, BNT162b2 (Pfizer-BioNTech) 68, vector adenoviral 9. # | 69% (185 pacientes): mRNA-1273 (Moderna) 133 BNT162b2 (Pfizer-BioNTech) 50 vector adenoviral 2 # | 14 (10,8%) # | 80 |
| Barrios, et al.26, 2022 | Caso clínico | 1 | 1 | 1 | ND | Trasplante renal | ND | ♀ 100% | ∼50 | Glomerulonefritis mieloproliferativa con enfermedad renal crónica. Trombofilia con trombosis venosa de la extremidad inferior izquierda. Infección por VPH con lesión intraepitelial de cérvix de bajo grado | ND | Mantenimiento con prednisona (5 mg/día) y micofenolato (1 g/día) y tacrolimús | 100%: BNT162b2 (Pfizer-BioNTech) | 100%: BNT162b2 (Pfizer-BioNTech) | No | 40 |
| Piñana, et al.27, 2023 | Estudio de cohortes prospectivo, observacional, multicéntrico | 429 | 53 | 39 | 27/12/2021 - 07/2022 | Allo-SCT | ND | ♂ 62,3% ♀ 37,7% # | 55 (16-78) # | LMA: 39,7% (21); LLA: 9,5% (5); SMD 13,3% (7); LNH cél. B: 7,6% (4); LNH cél. T: 5,8% (3); trastornos de células plasmáticas 3,9% (2); LH: 9,5% (5); NMC: 3,9% (2); anemia aplásica 7,7% (4) # | ND | Inmunosupresores durante la vacunación 52,8% (28); EICH activo 39,6% (21); CS durante vacunación 18,9% (10); Lenalidomida 1,9% (1), terapia ruxolitinib 7,5% (4) # | 100% (53 pacientes) mRNA-1273 (Moderna) 43 BNT162b2 (Pfizer-BioNTech) 6 vector adenoviral 4 # | 77,4% (41 pacientes) mRNA-1273 (Moderna) 37 BNT162b2 (Pfizer-BioNTech) 4 # | 0 | 80 |
| 121 | 23 | 13 | ASCT | ND | ♂ 60,9% ♀ 39,1% # | 61 (19-79) # | LMA: 4,3% (1); LNH cél. B: 4,3% (1); LNH cél. T: 4,3% (1), trastornos de células plasmáticas 65,3% (15); LH: 21,8% (5) # | Inmunosupresores durante la vacunación 69,6% (16); CS durante la vacunación 34,8% (8); lenalidomida 56,5% (13) # | 100% (23 pacientes) mRNA-1273 (Moderna) 15; BNT162b2 (Pfizer-BioNTech) 7; vector adenoviral 1 # | 95,7% (22 pacientes); mRNA-1272 (Moderna) 14; BNT162b2 (Pfizer-BioNTech) 8 # | 2 (8,7%) # | |||||
| 22 | 3 | 3 | CAR-T | ND | ♂ 66,7% ♀ 33,3% # | 59 (26-78) # | LNH cél. B: 33,3% (1); trastornos de células plasmáticas: 33,3% (1); LLC: 33,3% (1) # | No | 100% (3 pacientes) mRNA-1273 (Moderna) 3 # | 66,7% (2 pacientes) mRNA-1273 (Moderna) 2 # | 0 | |||||
| Alonso et al. 29, 2023 | Estudio de cohortes retrospectivo | 141 | 63 | ND | 01/01/2022-31/12/2022 | Con trasplante renal con tratamiento ambulatorio | Sotrovimab | ♂ 42,9% ♀ 57,1% # | 60,2 (15,3) # | Alto % de enfermedad renal crónica. Diabetes mellitus (41,3%) # | 121 # | ND | Pauta de vacunación completa según Ministerio Sanidad en el momento de infección: 84,1% # | 2 (1,9%) # | 80 | |
| 34 | Remdesivir | ♂ 52,9% ♀ 47,1% # | 57,4 (14,7) # | Alto % de enfermedad renal crónica. Diabetes mellitus (34,4%) # | 58 # | ND | Pauta de vacunación completa según Ministerio Sanidad en el momento de infección: 78,1% # | |||||||||
| 10 | Molnupiravir | ♂ 70% ♀ 30% # | 62 (10,4) # | Alto % de enfermedad renal crónica. Diabetes mellitus (30%) # | 37,1 # | ND | Pauta de vacunación completa según Ministerio Sanidad en el momento de infección: 100% # | |||||||||
| 34 | Con trasplante renal sin tratamiento ambulatorio | No | ♂ 52,9% ♀ 47,1%# | 63,1 (13,2) # | Alto % de enfermedad renal crónica. Diabetes mellitus (35,5%) # | 54 # | ND | Pauta de vacunación completa según Ministerio Sanidad en el momento de infección: 78,8% # | 1 (2,9%) # | |||||||
Allo-HSCT: trasplante alogénico de células madre; ASCT: trasplante autólogo de células madre; CAR-T: receptor de antígeno quimérico de células T; CD20: cluster de diferenciación 20; COVID-19: enfermedad de coronavirus de 2019, CS: corticoesteroides; DE: desviación estándar; EICH: enfermedad de injerto contra huésped; iBTK: inhibidores de la tirosina cinasa de Bruton; ITK: inhibidores de tirosina cinasa; IS: inmunosupresor; LH: linfoma de Hodgkin; LLA: leucemia linfocítica aguda; LLC: leucemia linfocítica crónica; LMA: leucemia mieloide aguda; LNH: linfoma no-Hodgkin; m: media; MMAT: herramienta de evaluación de métodos mixtos; mRNA: ácido ribonucleico mensajero; n: número; ND: no disponible; NMC: neoplasia mieloproliferativa crónica; SARS-CoV-2: coronavirus de tipo 2 causante del síndrome respiratorio agudo severo 2; SMC: síndrome mieloproliferativo crónico; SMD: síndrome mielodisplásico; VPH: virus del papiloma humano.
# Estos datos corresponden a la población infectada por SARS-CoV-2, sin especificar variantes. El estudio no proporciona los datos para la variante ómicron.
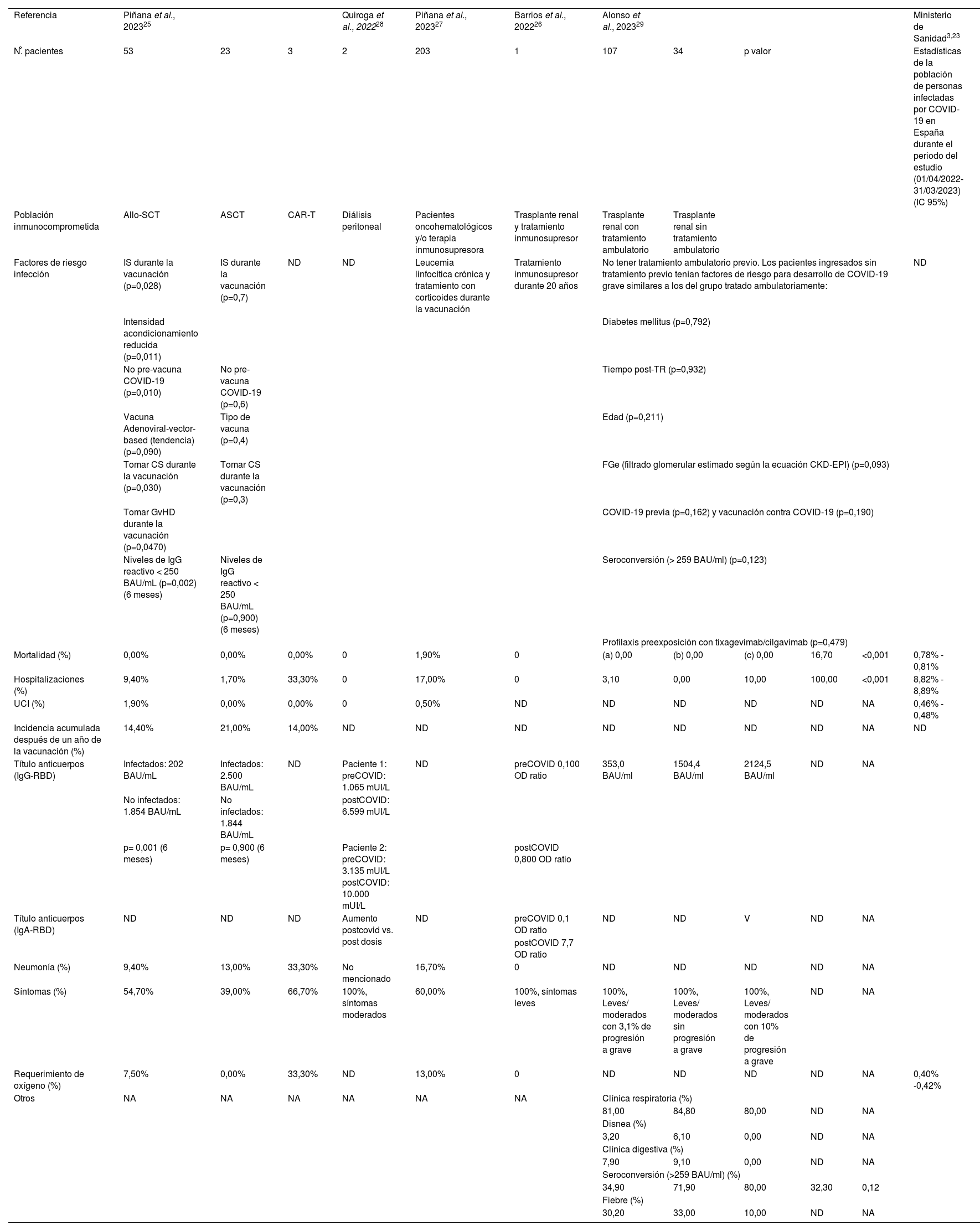
En la tabla 3 se muestran los resultados de salud de la población inmunocomprometida con COVID-19 grave o persistente descrita en los estudios seleccionados y las estadísticas de la población general infectada por COVID-19 en España durante el periodo de estudio (01/04/2022-31/03/2023). Todos los pacientes inmunocomprometidos afectados por COVID-19 por variantes del periodo de predominancia de ómicron presentaron una sintomatología más leve o moderada25–29 respecto a variantes anteriores; no obstante, estos estudios también mostraron que la infección con esta variante iba asociada a una carga clínica importante con tasas más elevadas de hospitalización, ingreso en la UCI y mortalidad que en la población general. De esta forma, los datos relativos a la hospitalización mostraron tasas significativamente más altas en la población inmunodeprimida que en la población general (entre el 9,4-100% vs. 8,82-8,89%)25,27,29.
Factores de riesgo y resultados en salud de la población inmunocomprometida con COVID-19
| Referencia | Piñana et al., 202325 | Quiroga et al., 202228 | Piñana et al., 202327 | Barrios et al., 202226 | Alonso et al., 202329 | Ministerio de Sanidad3,23 | ||||||
| N.̊ pacientes | 53 | 23 | 3 | 2 | 203 | 1 | 107 | 34 | p valor | Estadísticas de la población de personas infectadas por COVID-19 en España durante el periodo del estudio (01/04/2022-31/03/2023) (IC 95%) | ||
| Población inmunocomprometida | Allo-SCT | ASCT | CAR-T | Diálisis peritoneal | Pacientes oncohematológicos y/o terapia inmunosupresora | Trasplante renal y tratamiento inmunosupresor | Trasplante renal con tratamiento ambulatorio | Trasplante renal sin tratamiento ambulatorio | ||||
| Factores de riesgo infección | IS durante la vacunación (p=0,028) | IS durante la vacunación (p=0,7) | ND | ND | Leucemia linfocítica crónica y tratamiento con corticoides durante la vacunación | Tratamiento inmunosupresor durante 20 años | No tener tratamiento ambulatorio previo. Los pacientes ingresados sin tratamiento previo tenían factores de riesgo para desarrollo de COVID-19 grave similares a los del grupo tratado ambulatoriamente: | ND | ||||
| Intensidad acondicionamiento reducida (p=0,011) | Diabetes mellitus (p=0,792) | |||||||||||
| No pre-vacuna COVID-19 (p=0,010) | No pre-vacuna COVID-19 (p=0,6) | Tiempo post-TR (p=0,932) | ||||||||||
| Vacuna Adenoviral-vector-based (tendencia) (p=0,090) | Tipo de vacuna (p=0,4) | Edad (p=0,211) | ||||||||||
| Tomar CS durante la vacunación (p=0,030) | Tomar CS durante la vacunación (p=0,3) | FGe (filtrado glomerular estimado según la ecuación CKD-EPI) (p=0,093) | ||||||||||
| Tomar GvHD durante la vacunación (p=0,0470) | COVID-19 previa (p=0,162) y vacunación contra COVID-19 (p=0,190) | |||||||||||
| Niveles de IgG reactivo < 250 BAU/mL (p=0,002) (6 meses) | Niveles de IgG reactivo < 250 BAU/mL (p=0,900) (6 meses) | Seroconversión (> 259 BAU/ml) (p=0,123) | ||||||||||
| Profilaxis preexposición con tixagevimab/cilgavimab (p=0,479) | ||||||||||||
| Mortalidad (%) | 0,00% | 0,00% | 0,00% | 0 | 1,90% | 0 | (a) 0,00 | (b) 0,00 | (c) 0,00 | 16,70 | <0,001 | 0,78% - 0,81% |
| Hospitalizaciones (%) | 9,40% | 1,70% | 33,30% | 0 | 17,00% | 0 | 3,10 | 0,00 | 10,00 | 100,00 | <0,001 | 8,82% - 8,89% |
| UCI (%) | 1,90% | 0,00% | 0,00% | 0 | 0,50% | ND | ND | ND | ND | ND | NA | 0,46% - 0,48% |
| Incidencia acumulada después de un año de la vacunación (%) | 14,40% | 21,00% | 14,00% | ND | ND | ND | ND | ND | ND | ND | NA | ND |
| Título anticuerpos (IgG-RBD) | Infectados: 202 BAU/mL | Infectados: 2.500 BAU/mL | ND | Paciente 1: preCOVID: 1.065 mUI/L | ND | preCOVID 0,100 OD ratio | 353,0 BAU/ml | 1504,4 BAU/ml | 2124,5 BAU/ml | ND | NA | |
| No infectados: 1.854 BAU/mL | No infectados: 1.844 BAU/mL | postCOVID: 6.599 mUI/L | ||||||||||
| p= 0,001 (6 meses) | p= 0,900 (6 meses) | Paciente 2: preCOVID: 3.135 mUI/L postCOVID: 10.000 mUI/L | postCOVID 0,800 OD ratio | |||||||||
| Título anticuerpos (IgA-RBD) | ND | ND | ND | Aumento postcovid vs. post dosis | ND | preCOVID 0,1 OD ratio | ND | ND | V | ND | NA | |
| postCOVID 7,7 OD ratio | ||||||||||||
| Neumonía (%) | 9,40% | 13,00% | 33,30% | No mencionado | 16,70% | 0 | ND | ND | ND | ND | NA | |
| Síntomas (%) | 54,70% | 39,00% | 66,70% | 100%, síntomas moderados | 60,00% | 100%, síntomas leves | 100%, Leves/ moderados con 3,1% de progresión a grave | 100%, Leves/ moderados sin progresión a grave | 100%, Leves/ moderados con 10% de progresión a grave | ND | NA | |
| Requerimiento de oxígeno (%) | 7,50% | 0,00% | 33,30% | ND | 13,00% | 0 | ND | ND | ND | ND | NA | 0,40% -0,42% |
| Otros | NA | NA | NA | NA | NA | NA | Clínica respiratoria (%) | |||||
| 81,00 | 84,80 | 80,00 | ND | NA | ||||||||
| Disnea (%) | ||||||||||||
| 3,20 | 6,10 | 0,00 | ND | NA | ||||||||
| Clínica digestiva (%) | ||||||||||||
| 7,90 | 9,10 | 0,00 | ND | NA | ||||||||
| Seroconversión (>259 BAU/ml) (%) | ||||||||||||
| 34,90 | 71,90 | 80,00 | 32,30 | 0,12 | ||||||||
| Fiebre (%) | ||||||||||||
| 30,20 | 33,00 | 10,00 | ND | NA | ||||||||
Allo-HSCT: trasplante alogénico de células madre, ASCT: trasplante autólogo de células madre, BAU: unidades de unión a anticuerpo, CAR-T: Receptor de antígeno quimérico de células T, COVID-19: enfermedad de coronavirus de 2019, CS: corticoesteroides, CKD-EPI: Colaboración epidemiológica de la enfermedad crónica renal, FGe: filtrado glomerular estimado, IgG: inmunoglobulina G, IgA: inmunoglobulina A, IS: inmunosupresores, NA: no aplica, ND: no disponible, OD: densidad óptica, RBD: dominio de unión al receptor, TR: trasplante renal, UCI: Unidad de Cuidados Intensivos. (a)Sotrovimab (b) Remdesivir (c) Molnupiravir.
El paciente oncohematológico sufre un inmunocompromiso debido a la propia enfermedad y los tratamientos administrados para su control.
En España el Grupo Español de Trasplante Hematopoyético y Terapia Celular (GETH-TC), realizó el registro VACUNHEM para determinar la carga en función de la enfermedad. El estudio de cohortes prospectivo multicéntrico demostró una tasa de hospitalización del 18%, y otra de mortalidad del 1,9% durante la circulación de linajes ómicron (n=203)25. El análisis multivariante identificó la mayor incidencia en pacientes con leucemia linfocítica crónica (29%) tratados con corticoides (24,5%)25.
Piñana et al. en un análisis adicional del registro VACUNHEM, estudiaron la tasa de ingreso en la UCI y observaron tasas significativamente más altas entre los pacientes con trasplante alogénico comparados con población general (1,9% vs. 0,46-0,48%)27,29. En dichos pacientes, el análisis multivariante identificó como factores de riesgo significativos tanto el tratamiento inmunosupresor durante la vacunación (p=0,028), como la intensidad de acondicionamiento reducida (p=0,011). Además, dicho análisis mostró otros factores de riesgo para la infección por SARS-CoV-2 como la ausencia de infección por SARS-CoV-2 previa a la vacunación (p=0,01), terapia con glucocorticoesteroides coincidente con la vacunación (p=0,03), enfermedad activa de injerto contra huésped (EICH) coincidente con la vacunación (p=0,047) o niveles de IgG <250 binding antibody units (BAU)/mL a los seis meses de la vacunación (p=0,002)27.
Carga clínica en el paciente trasplantado renalLa baja respuesta humoral en el paciente con ERC y, en particular, en el trasplantado renal (TR) ha conducido a la recomendación de sucesivas dosis de refuerzo vacunal en estos pacientes. La mayoría de los estudios han focalizado los resultados en TR mediante su respuesta inmune humoral. El estudio SENCOVAC, el más importante publicado hasta la fecha, analizó durante el primer año de vacunación en España la respuesta humoral tras las sucesivas dosis de vacuna (28 días [n=301], tres meses [n=3.439], seis meses [n=1.018] y 12 meses [n=4.079])28,30. En el último reporte, publicado a finales del 2022, se demostró que hasta el 9% de los pacientes TR presentaban una respuesta humoral negativa (tasa de anticuerpos inferior a 32 BAU/mL) tras cuatro dosis de la vacuna30,31. El análisis demostró que entre los factores asociados a desarrollar un menor título de anticuerpos se incluía la prescripción de tratamiento con esteroides y micofenolato de mofetilo31. Especialmente preocupante es la situación de los pacientes con respuesta humoral persistentemente negativa que no seroconvierten, ni siquiera, tras recibir las dosis de refuerzo, puesto que son en su mayoría TR30.
La necesidad de proteger al paciente con TR, incluso durante la circulación de linajes ómicron, se demuestra en otro estudio retrospectivo sobre la carga de enfermedad en 141 pacientes con TR de una serie recogida entre enero y diciembre del 2022. Dichos pacientes presentaron COVID-19 grave en el momento del ingreso hospitalario, a excepción de tres de ellos que habían recibido tratamiento ambulatorio previo con anticuerpos monoclonales. La mortalidad alcanzó el 16,7% en aquellos que no habían recibido tratamiento ambulatorio29, mostrando una tasa 20 veces superior a la notificada en la población general (0,78-0,81%)3,29. Más del 80% de los pacientes con TR tratados ambulatoriamente experimentaron síntomas respiratorios29.
Alonso et al., al investigar el impacto del tratamiento ambulatorio con anticuerpos monoclonales, observaron que un reducido número de pacientes (n=107) requirieron hospitalización, y ninguno de ellos falleció, contrastando notablemente con el 100% de hospitalizaciones y la tasa de mortalidad registrada en aquellos que no recibieron tratamiento ambulatorio. Cabe destacar que los pacientes ingresados sin tratamiento previo (n=34) tenían factores de riesgo para desarrollo de COVID-19 grave similares a los del grupo tratado ambulatoriamente: DM (p=0,792), tiempo postransplante (p=0,932), edad (p=0,211), filtrado glomerular estimado según la ecuación Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) (FGe) (p=0,093), COVID-19 previa (p=0,162), vacunación contra la COVID-19 (p=0,19), seroconversión (> 259 BAU/mL) (p=0,123) y profilaxis preexposición con tixagevimab/cilgavimab (p=0,479)29.
Evaluación de la calidadLos resultados de la evaluación de la calidad según el modelo MMAT se muestran resumidos en la tabla 2. En todos los estudios seleccionados, se respondió afirmativamente a las preguntas de selección. La evaluación de calidad reveló que la mayoría de los estudios cumplían con criterios de representatividad, mediciones adecuadas y datos completos. Sin embargo, en algunos estudios no se consideraron factores de confusión. La puntuación global de la calidad de los estudios fue «alta» en tres de ellos (80%), «media» en uno (60%) y «baja» en el restante (40%). Se incluyeron todos los estudios independientemente de su calidad metodológica.
DiscusiónEsta es la primera revisión sistemática publicada de datos españoles en la que se analiza el impacto de la variante ómicron en el paciente inmunocomprometido. El análisis realizado demuestra que, a pesar de que ómicron es una variante menos virulenta, las consecuencias de COVID-19 en los pacientes inmunocomprometidos son especialmente relevantes.
Los pacientes inmunocomprometidos constituyen una población heterogénea que incluye situaciones clínicas diversas como las neoplasias hematológicas, receptores de trasplante de órgano sólido, pacientes con terapias tratamiento de linfocitos T con receptores quiméricos de antígenos (CAR-T), pacientes con inmunodeficiencias primarias o secundarias (p. ej., infección por el virus de la inmunodeficiencia humana [VIH]), y aquellos que reciben tratamiento con fármacos inmunosupresores7. Estas poblaciones con una respuesta inmunitaria alterada son más vulnerables que la población general generando una carga de enfermedad substancial en pacientes que además consumen o han consumido una gran cantidad de recursos sanitarios.
Los factores que aumentan el riesgo de desarrollar COVID-19 grave en la población general (edad avanzada, enfermedades subyacentes: ERC, enfermedad cardiovascular y DM) son también factores de riesgo con presencia significativa en la población inmunocomprometida4. De hecho, en el presente estudio, muchos de los pacientes presentaban comorbilidades adicionales (DM, ERC o multimorbilidades) que per se, incrementan más el riesgo intrínseco derivado de su respuesta inmunitaria deficiente28,29. Muchos de los pacientes incluidos estaban en tratamiento activo con fármacos inmunosupresores, habiéndose descrito que tratamientos como terapias reductoras o supresoras de los linfocitos T (inhibidores de la calcineurina –ciclosporina, tacrolimús–, micofenolato mofetilo, belatacept) o terapias reductoras de los linfocitos B (rituximab, ocrelizumab, obinutuzumab) se han asociado con más probabilidad de muerte por COVID-1932,33.
Todos los pacientes incluidos en esta revisión experimentaron mayoritariamente una infección por COVID-19 de sintomatología leve25–29. Esta menor gravedad de la enfermedad puede deberse en parte a la extensiva vacunación de la población en el momento de aparición de la variante ómicron. Sin embargo, aunque más del 80% de la población total de los trasplantados de progenitores hematopoyéticos autólogos o alogénicos y CAR-T había recibido tres dosis de vacuna, hasta un 12,4%, 19% y 13,6%, respectivamente, se contagiaron por SARS-CoV-227. Además, hasta un 10% de los pacientes con TR y tratamiento ambulatorio con molnupiravir frente a COVID-19, vacunados con pauta completa, mostraron progresión a enfermedad grave29 y tasas de hospitalización, ingreso en la UCI y mortalidad más elevadas que en la población general. Por otro lado, en pacientes inmunocomprometidos también se observa una disminución significativa de los títulos de anticuerpos de tres a seis meses después de la vacunación inicial y las dosis de refuerzo34. En el estudio de Piñana et al. se ha descrito que las infecciones por SARS-CoV-2 son más frecuentes en pacientes con títulos de anticuerpo <250 BAU/mL que en aquellos con títulos ≥ 250 BAU/mL27. Además, esta diferencia se mostró significativa a partir de los seis meses de la vacunación. En el estudio hubo casos de infección en pacientes con valores> 250 BAU/mL, pero significativamente menos que en el grupo <250 BAU/mL a partir de los seis meses de la vacunación.
Los EECC pivotales que evaluaron la seguridad y eficacia de las vacunas frente al SARS-CoV-2 no incluyeron en su mayoría a pacientes inmunocomprometidos35–37. Sin embargo, datos de estudios observacionales posteriores han demostrado que una significativa proporción de los pacientes inmunocomprometidos necesitan un mayor número de dosis para obtener títulos de anticuerpos compatibles con la protección humoral. A pesar de ello, hasta un 46% de los pacientes receptores de órganos sólidos no presentan respuesta ante una segunda dosis38,39. En pacientes con neoplasias hematológicas, el número de casos de COVID-19 graves o críticos es significativamente menor después de administrar la cuarta dosis de vacunación40. Por ello, las recomendaciones sanitarias nacionales indican administrar cuatro dosis de vacuna en pacientes inmunodeprimidos31. Aun así, los pacientes TR presentan respuestas subóptimas a la cuarta dosis de vacunación, con una tasa de hasta el 10% de no respondedores30,31,41. En consecuencia, puede ser crucial considerar la posibilidad de llevar a cabo un seguimiento más frecuente entre las dosis recomendadas, ya que parece que simplemente vacunar anualmente a los pacientes con niveles de anticuerpos bajos o a aquellos que los pierden tempranamente podría no ser suficiente42.
En línea con estos datos en el espectro de la ERC, los pacientes TR han demostrado mayor vulnerabilidad a la infección por SARS-CoV-2 y una respuesta subóptima a la vacunación. En España, el Registro COVID-19 de la Sociedad Española de Nefrología (SEN), demostró que pese a la vacunación sistemática de los pacientes con ERC (incluyendo hemodiálisis, diálisis peritoneal y TR) y al descenso de la virulencia del linaje ómicron, la mortalidad ha persistido más elevada que en la población general, especialmente en la cohorte de trasplantados renales43. Los factores asociados a esta vulnerabilidad incluyen el estado de inmunosupresión inherente a la ERC, la extensa comorbilidad que exhiben estos pacientes y la necesidad de prescribir fármacos inmunosupresores31,44.
Por otro lado, Cazorla et al. han publicado recientemente la efectividad de administrar una quinta dosis de la vacuna a pacientes TR, demostrando que, aunque permite aumentar la tasa de anticuerpos y reducir el porcentaje de pacientes seronegativos, no llega a proteger a todos41.
Análogamente, los estudios que han evaluado la inmunidad celular demuestran una disminución en la respuesta tras las sucesivas dosis de la vacunación frente a SARS-CoV-245.
Además de la vacuna y los anticuerpos monoclonales como estrategias de prevención, se han ensayado otras estrategias terapéuticas como el tratamiento antiviral con nirmatrelvir/ritonavir en pacientes con COVID-19. De un total de 1.859 pacientes incluidos, el 47,9% (479) enfermaron por la variante ómicron. En este estudio, los pacientes con neoplasias hematológicas tenían más probabilidades de recibir nirmatrelvir/ritonavir cuando presentaban sintomatología extrapulmonar o una segunda dosis de refuerzo de la vacuna al inicio de la COVID-19, frente a la enfermedad pulmonar crónica y la obesidad. La tasa de mortalidad en los pacientes tratados con nirmatrelvir/ritonavir fue inferior a la de aquellos con otras terapias dirigidas distintas46. Es importante señalar a este respecto, que los pacientes TR no pueden ser tratados con nirmatrelvir/ritonavir debido a su ERC y estar polimedicados, lo cual les deja en una situación de vulnerabilidad fisiológica y terapéutica47.
Otros antivirales administrados en el mismo contexto, como el molnupiravir, no ha demostrado diferencias significativas en términos de hospitalización, supervivencia y mortalidad, aunque este antiviral presenta un perfil de interacciones farmacológicas más favorable48.
En cuanto a las terapias preexposición, existen diversos estudios que describen la efectividad de estas en distintas poblaciones de pacientes inmunocomprometidos, que no presentan una respuesta inmunitaria adecuada a la vacunación, demostrando que el uso profiláctico de anticuerpos monoclonales combinados para la COVID-19 puede detener la progresión a enfermedad grave49.
Esta revisión pone de manifiesto que mientras que todos los pacientes sin tratamiento con anticuerpos monoclonales fueron hospitalizados por COVID-19, solo un bajo porcentaje de aquellos que lo recibieron requirieron hospitalización. Además, la tasa de mortalidad llegó a ser significativamente alta en los que no recibieron monoclonales frente a la tasa nula reportada en los pacientes a los que sí se les administró29. Hasta hace pocos meses, había diversos tratamientos con anticuerpos monoclonales aprobados para la población inmunocomprometida de uso profiláctico y terapéutico. Sin embargo, en los últimos meses se ha informado de la pérdida de eficacia de casi todos estos fármacos50.
Los pacientes con inmunosupresión corren el riesgo de presentar infección prolongada por SARS-CoV-2. En concreto, si hablamos sobre pacientes con neoplasias oncohematológicas, surge el término «infección crónica persistente», en la cual el virus desarrolla mecanismos de evasión inmune con excreción viral aumentada, produciendo un daño paulatino pero continuo en las vías respiratorias bajas. Este tipo de enfermedad surge en pacientes generalmente inmunocomprometidos, o bien, por su enfermedad de base (síndromes linfoproliferativos en su mayoría) o bien, por su tratamiento (fundamentalmente, anticuerpos monoclonales anti-cluster de diferenciación 20 [CD20]). En la evasión inmune mencionada han sido identificadas mutaciones en las vías ORF-1ab y PL2pro, y otros substratos enzimáticos, lo que podría explicar la falta de inmunogenicidad de este perfil de pacientes a las técnicas de inmunización activas actuales49 y la aparición de nuevas variantes. Otro aspecto fundamental en los pacientes con neoplasias oncohematológicas es el denominado COVID «long term», con una fisiopatología desconocida parcialmente. Este concepto, al contrario del anterior, se refiere a la infección de un paciente que no desarrolla síntomas, pero con una carga viral positiva persistente. Su incidencia es elevada con la variante ómicron, aunque menor que con otras variantes51.
Una problemática indirecta de la infección persistente de COVID-19 añadida a las anteriores consideraciones clínicas es que dicha condición clínica de COVID-19 persistente se considera como criterio de exclusión para participar en EECC de terapias nuevas, obligando a retrasar su administración e impactando de manera negativa en el pronóstico de estos pacientes52.
Por todo lo expuesto, la prevención de la COVID-19 en pacientes inmunodeprimidos debería ser un objetivo clave en las políticas de prevención en la era pospandémica. Durante la etapa ómicron, la combinación tixagevimab-cilgavimab fue el único tratamiento profiláctico distinto de la vacunación, autorizado para la preexposición de COVID-19, que mostró eficacia durante un periodo frente a ciertas variantes ómicron en pacientes inmunocomprometidos53,54. En España, la experiencia con tixagevimab-cilgavimab en pacientes con ausencia de respuesta humoral tras las sucesivas dosis de la vacuna, demostró ser segura y efectiva, en la consecución de una tasa de anticuerpos protectores aceptable55. La aprobación temprana de dicho tratamiento en otros países permitió evaluar su utilidad durante la fase ómicron. Un metaanálisis de 18 estudios con 25.345 sujetos inmunocomprometidos tratados con estos fármacos, 5.438 de ellos siendo pacientes oncohematológicos, reportó una reducción de la tasa de hospitalización, de UCI y de mortalidad en un 66,19%, 82,13% y 92,39%, respectivamente56. Además, otro estudio publicado en Francia incluyendo a 322 pacientes que recibieron tixagevimab-cilgavimab demostró su efectividad frente a ómicron, pero no frente a las variantes BQ.1.1 y XBB57. En línea con estos resultados, la Comisión de Salud Pública aprobó la recomendación de uso de tixagevimab-cilgavimab en personas con alto grado de inmunosupresión y en otras personas que no podían vacunarse frente a COVID-19. Sin embargo, la aparición posterior de nuevas variantes frente a las que tixagevimab-cilgavimab no presenta actividad neutralizante, interrumpió la recomendación de su uso en marzo de 202358,59. Por todo esto, aunque las vacunas frente a la SARS-CoV-2 son muy eficaces, sigue siendo necesario usar estrategias adicionales de profilaxis con inmunización pasiva en personas inmunocomprometidas que no responden suficientemente a la vacunación, junto con las ya clásicas medidas no farmacológicas (mascarillas, ventilación, etc.).
Una limitación importante de esta revisión es su periodo de análisis desde abril de 2022 a abril de 2023, lo que podría omitir datos aún no publicados. Otra es la importancia de no considerar a pacientes con VIH independientemente. Sin embargo, los datos disponibles para este estudio con los criterios señalados no nos permitieron incluir resultados específicos para pacientes con VIH debido a la variabilidad clínica entre ellos. La inclusión de estudios exclusivamente españoles resulta en la admisión de cinco estudios, lo cual puede limitar la generalización de conclusiones por la cantidad limitada de datos analizados. Sin embargo, la focalización en la población española puede considerarse una ventaja para proporcionar información relevante y específica que contribuya a la estrategia sanitaria real en España. Además, este estudio se centra en la variante ómicron de COVID-19, por lo que los resultados no pueden extrapolarse directamente para futuras variantes, aunque sean válidas las conclusiones generales. En descargo a estas limitaciones, los datos recopilados muestran de manera insoslayable que la población de inmunocomprometidos españoles será una de las últimas en verse adecuadamente protegida de la emergencia de este nuevo virus.
Esta revisión destaca que, aunque la infección por la variante ómicron de COVID-19 parece menos grave en la población general, sigue siendo preocupante para los pacientes inmunocomprometidos. Las tasas de hospitalización, ingresos en UCI y mortalidad siguen siendo altas en este grupo, lo que subraya la importancia de medidas profilácticas dirigidas específicamente a ellos. Es necesario mantener la recopilación de evidencias y continuar la vigilancia clínico-epidemiológica, profundizando en la identificación de factores pronósticos asociados a la carga de enfermedad COVID-19 en pacientes inmunocomprometidos. Aunque la fase aguda de la pandemia ha terminado, el riesgo de COVID-19 para los inmunodeprimidos sigue siendo alto.
Consideraciones éticasNo aplica
FinanciaciónEsta publicación ha sido financiada por AstraZeneca Farmacéutica Spain S.A. Los autores no recibirán honorarios por su participación y autoría.
Conflicto de interesesRaúl Ortiz-de-Lejarazu ha recibido compensación económica por actividades académicas, ponencias o informes científicos de Abbott, AstraZeneca, bioMerieux, CSL, GSK, Moderna, MSD, Novavax, Pfizer, Roche y Sanofi.
Borja Quiroga es vocal de la SEN y ha recibido pagos por ponencias y financiación para asistir a cursos y congresos por parte de Vifor-Pharma, Astellas, Amgen, Bial, Ferrer, Novartis, AstraZeneca, Sandoz, Laboratorios Bial, Esteve, Sanofi-Genzyme y Otsuka en los últimos 36 meses.
Alberto López García ha recibido pagos por ponencias y financiación para asistir a cursos y congresos por parte de Janssen, Abbvie, Abbot, Roche, Astrazeneca y Beigene en los últimos 36 meses. Ha recibido pagos por asesoría para Janssen, Astrazeneca y Beigene.
Agradecemos a la Dra. María Fernández-Prada, del Servicio de Medicina Preventiva y Salud Pública del Hospital Vital Álvarez Buylla (Asturias) y a la Dra. Patricia Aparicio-Domingo de AstraZeneca por su contribución al estudio y lectura crítica del mismo, no incluidas en autoría por limitación editorial y a Ana Corcuera Sánchez de AstraZeneca y a Inmaculada Molina, Gloria González, Maite Artés y María Ruart de Adelphi Targis, SL por su contribución a la recogida e interpretación de datos, así como la preparación de este manuscrito.