No se conocen bien potenciales factores de riesgo bioquímicos relacionados con la presencia y progresión de la polineuropatía diabética (PND).
Material y métodoHemos estudiado en 405 diabéticos tipo 2 (169 mujeres) la asociación de las concentraciones plasmáticas de homocisteína con la PND evaluada con la prueba del monofilamento de Semmes-Weinstein (SW). Se consideró prueba alterada una puntuación menor o igual de 4, y normal, puntuaciones de 5 y 6. La medición de la homocisteína plasmática, la vitamina B12 y el ácido fólico se hizo con método estandarizado (enzimoinmunoanálisis).
ResultadosLos pacientes con diabetes tipo 2 (DM2) con PND evaluada por prueba alterada del monofilamento presentaron de forma estadísticamente significativa mayor edad, tiempo de evolución de la enfermedad y hemoglobina glucosilada (HbA1c), y menor aclaramiento de creatinina. Además, este grupo presentó de forma significativa e independiente mayores valores plasmáticos de homocisteína (media [DE] de 13,64 [4,93] frente a 12,22 [4,48]μmol/l, p<0,01), con valores similares de vitamina B12 y ácido fólico al comparar ambos grupos.
ConclusiónLa homocisteína plasmática y la HbA1c son los factores biológicos independientes y modificables que se asociaron con la presencia de PND evaluada con la prueba del monofilamento de SW.
Few modifiable risk factors are known to be associated with the presence and progression of diabetic polyneuropathy (DPN).
Material and methodWe have analyzed in 405 type 2 diabetic (T2DM) subjects (169 women) the association of plasma homocysteine with the presence of DPN measured with the Semmes-Weinstein (SW) monofilament test. A score below 4 was considered an altered SW monofilament test. Plasma homocysteine, vitamin B12 and folic acid were measured using standard procedures (ELISA).
ResultsPatients with T2DM with altered SW test have significantly higher age, evolution of disease, HbA1c and lower creatinine clearance values. In addition, plasma homocysteine values were independently and significantly higher in T2DM with DPN measured as altered SW test (13.64±4.93 vs. 12.22±4.48μmol/l, P<.01) with similar vitamin B12 and folic acid values comparing the 2 groups.
ConclusionPlasma homocysteine and HbA1c values are the 2 modifiable biological factors associated with the presence of DPN evaluated as an altered SW monofilament test in T2DM subjects.
La polineuropatía sensitivomotora distal simétrica diabética (PND) es una complicación frecuente de la diabetes. Su prevalencia oscila entre el 30-60%, dependiendo de los métodos diagnósticos utilizados1. El riesgo de desarrollar PND está asociado con el grado de control glucémico, la edad, el tiempo de evolución de la enfermedad y el grado de retinopatía y nefropatía diabética1. Esta complicación crónica de la diabetes genera una elevada morbilidad por ser el principal factor de riesgo para desarrollar complicaciones en el pie1,2. Además, el 75% de los pacientes con PND desarrolla un cuadro de dolor neuropático de difícil control2.
El control glucémico intensivo, tanto en pacientes con diabetes tipo 1 como en aquellos con diabetes tipo 2 (DM2), evita la progresión de la PND, como ha sido mostrado en diferentes estudios de intervención3,4. Pero una vez presentan dolor neuropático, el tratamiento sintomático se basa en el uso de antiepilépticos y antidepresivos, sin conocerse un tratamiento con una base fisiopatológica que evite o frene la progresión de la PND4. Por ello, el estudio de factores biológicos asociados con PND podría incrementar el conocimiento de la patogenia de esta complicación e identificar a los sujetos con predisposición a la PND, así como nuevas dianas terapéuticas.
Algunos estudios han mostrado una asociación de potenciales factores de riesgo bioquímicos con la PND5. Así, Ambrosch et al.6 encontraron una asociación de las concentraciones elevadas de homocisteína sérica con la presencia de neuropatía, pero otros estudios no han encontrado dicha asociación7,8. En cambio, de forma sistemática las concentraciones elevadas de homocisteína plasmática se han relacionado con otras complicaciones crónicas microvasculares como la retinopatía diabética, la nefropatía diabética y la macroangiopatía diabética8,9. En estudios experimentales es bien conocido cómo la homocisteína está involucrada en la lesión endotelial y genera estrés oxidativo, también implicado en la patogenia de las complicaciones crónicas microvasculares de la diabetes10. Además, la homocisteína se asocia en estudios experimentales y clínicos con lesión neurológica directa11,12.
La prueba del monofilamento de Semmes-Weinstein (SM) es un test de fácil aplicación en la práctica clínica que permite conocer si el paciente con diabetes tiene afectada la propiocepción, y es útil en el cribado de la PND1,13. Además, es el más potente marcador de riesgo para desarrollo de úlceras neuropáticas en el pie diabético1,13.
Con todas estas premisas, nuestra hipótesis es que potenciales factores de riesgo bioquímicos, como las concentraciones de homocisteína plasmática, deben asociarse con la presencia de PND evaluada con la prueba del monofilamento SM en pacientes con DM2.
Sujetos y métodoSujetosNuestra población fueron los pacientes con DM2, y como población de estudio, los pacientes que acudieron a la Unidad de Diabetes de nuestro hospital y a 2 centros de Atención Primaria de nuestra ciudad. La selección de los pacientes se realizó por muestreo aleatorio simple usando un programa estadístico.
Los criterios de inclusión fueron: diagnóstico de DM2, pacientes no amputados o con amputación menor o mayor unilateral, edad comprendida entre 40 y 70 años y ser varón o mujer. Los criterios de exclusión fueron: ser paciente con diabetes tipo 1, haber sufrido una amputación menor o mayor bilaterales, presentar enfermedad avanzada cardiaca (insuficiencia cardiaca, definida por una clase funcional de la New York Heart Association>II), insuficiencia renal (aclaramiento de creatinina<30ml/min), hepática (cirrosis), endocrinológica (hipotiroidismo no corregido), neumológica (enfermedad pulmonar obstructiva crónica), neurológica (neuropatías de otro origen) y oncológica (cualquier tumor o antecedente de quimioterapia) que per se modificasen los factores a estudio, y presentar una artropatía de Charcot.
DiseñoEl diseño del estudio fue de casos y controles. Se consideraron casos los pacientes con DM2 y prueba de monofilamento SM alterada, y los controles, diabéticos con prueba normal.
MétodoA cada uno de los pacientes que cumplió los criterios de inclusión y ninguno de exclusión se le explicó la finalidad del estudio. Tras firmar el consentimiento informado (según los requerimientos del Comité de Ética de nuestro centro) se aplicó el protocolo de investigación.
Parámetros antroprométricos y biodemográficosSe recogieron los siguientes parámetros: edad, sexo, tabaquismo y años en caso de ex fumador, consumo de alcohol, ejercicio físico, tiempo de evolución de la diabetes, presencia y tratamiento de hipertensión arterial, dislipidemia y patología cardiovascular, definida como infarto agudo de miocardio, ictus isquémico (definido como sintomatología clínica que no se resuelve en 24h, junto con tomografía axial computarizada craneal normal o con imagen hipodensa) y vasculopatía periférica evaluada por el índice tobillo-brazo (ITB) (ver más adelante).
El investigador recogió la talla, el peso, el índice de masa corporal (IMC), el perímetro de cintura y la presión arterial medidos con métodos estandarizados convencionales.
La presencia sintomática de vasculopatía periférica se midió por el Cuestionario de Edimburgo modificado para claudicación intermitente vascular y la determinación del ITB. Para determinar este se calculó la medida de la presión arterial en brazo y en tobillo mediante esfigmógrafo de mercurio (Dr. V. Recklinghausen) y un doppler (Bi-directional Smartdrop® 20 [Hadeco Inc., Kawasaki, Japón]) tras 5-10min de reposo y con una temperatura ambiental agradable.
El grado de neuropatía diabética se estableció por el Neuropathy Symptom Score (NSS) y prueba del monofilamento de SM. La escala NSS recoge la presencia de cansancio, calambres, dolor, quemazón y parestesias con una puntuación de 0 al 9.
Prueba del monofilamentoPara la valoración de la sensibilidad a la presión se empleó el monofilamento de SW de 5,07mm de diámetro, que ejerce una fuerza constante al presionarlo sobre la piel de 10g. El paciente se colocó en decúbito supino sobre la camilla de exploración y con los ojos cerrados. A continuación se presionó con el filamento, que se dobló en parte, durante 1-1,5seg, y se preguntó al paciente si sentía o no su contacto. Las zonas exploradas fueron: sobre las cabezas del primero y quinto metatarsiano, así como la base del primer dedo en la cara dorsal. No se aplicó sobre zonas con hiperqueratosis. Se dio una puntuación 0 cuando el paciente no notó la presión y 1 si el paciente notaba la presión ejercida por el monofilamento al menos en 2 de los 3 intentos. Si tenemos en cuenta que la exploración se realizó en 3 puntos de cada pie, la puntuación máxima para un paciente fue de 6, ajustándose el resultado si el paciente tenía una amputación que afectara a la zona a explorar. Agrupamos los resultados en 2 categorías, la primera con valor 0 para una puntuación de 0 a 4, que sería patológica, y la segunda con valor 1, para puntuaciones de 5 y 6, que consideramos normal.
Parámetros bioquímicosLos estudios bioquímicos se realizaron tras 10h de ayuno en la Unidad de Pruebas Funcionales y Laboratorio Central de nuestro centro.
Las concentraciones de glucosa (método colorimétrico enzimático), hemoglobina glucosilada (HbA1c) (cromatografía líquida de alta presión), creatinina y urea (método fotocolorimétrico mediante reacción ácido pícrico), colesterol total (método enzimático fotocolorimétrico), triglicéridos (método enzimático fotocolorimétrico), colesterol HDL (precipitación con polianiones con ácido fosfotúngstico-cloruro de magnesio), colesterol LDL (mediante la fórmula de Friedewald), Apo A y B (inmunoturbimetría), homocisteína plasmática (enzimoinmunoanálisis), ácido fólico y vitamina B12 (enzimoinmunoanálisis) se midieron siguiendo procedimientos estandarizados. El filtrado glomerular fue estimado por fórmula del aclaramiento de creatinina (Modification of Diet in Renal Disease).
En orina se midió por métodos estandarizados la creatinuria (fotocolorimetría) y la albuminuria (inmunoturbidimetría) para el cálculo de índice albúmina/creatinina.
Análisis estadísticoEl tamaño muestral se calculó teniendo en cuenta un error α inferior al 5% y un error β inferior al 20%, para un riesgo atribuible (odds ratio [OR])>2. Las variables cuantitativas continuas se describieron como media y desviación estándar; las variables cualitativas, como número total y porcentajes. Se consideró estadísticamente significativo un valor de p<0,05 (bilateral).
Las medias de las variables cuantitativas se compararon entre grupos con la prueba t de Student para datos no emparejados. La comparación de las variables cualitativas entre grupos se realizó con el test de la Ji al cuadrado. Las asociaciones univariantes se realizaron con la prueba de Spearman o Pearson.
El riesgo atribuible se calculó entre casos y controles, teniendo en cuenta la presencia o ausencia de variables de confusión mediante regresión logística. La significación estadística de las variables se calculó con el método de Wald. Se consideró variable dependiente la presencia de prueba de monofilamento alterada, e independientes, las que previamente mostraron una asociación o diferencia estadísticamente significativa en el estudio univariante. Se consideraron como variables de confusión la edad, la vasculopatía (incluyendo periférica, cardiaca y cerebral), la ingesta de alcohol y el tabaquismo.
El paquete estadístico utilizado para los análisis fue el SSPS® v.9 (SSPS, Inc., Chicago, Illinois, EE.UU.).
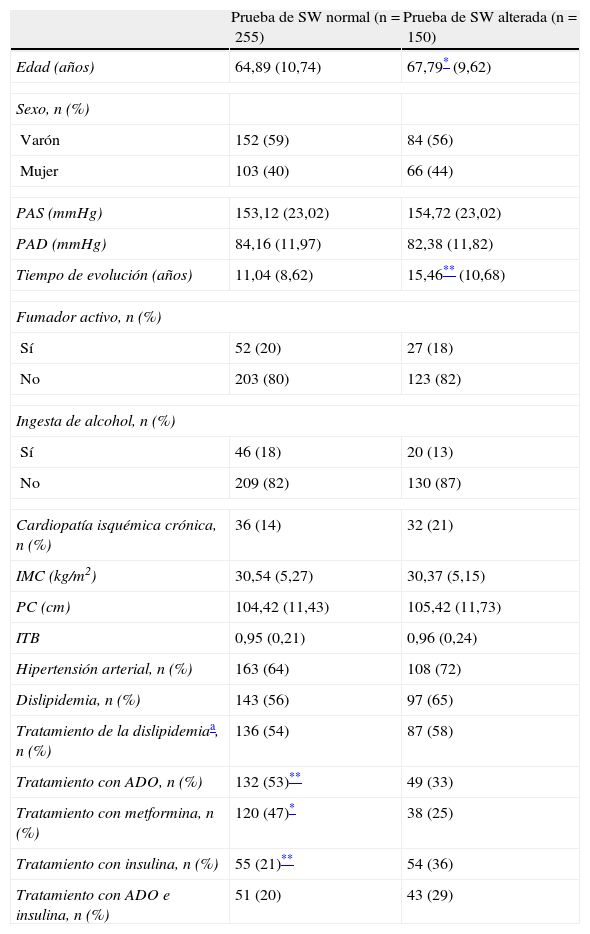
ResultadosEn la tabla 1 mostramos las características generales del grupo de 405 pacientes con DM2 estudiados (169 mujeres y 236 varones).
Características clínicas de los pacientes con diabetes mellitus tipo 2 estudiados, clasificados según la prueba del monofilamento de Semmes-Weinstein alterada
| Prueba de SW normal (n=255) | Prueba de SW alterada (n=150) | |
| Edad (años) | 64,89 (10,74) | 67,79* (9,62) |
| Sexo, n (%) | ||
| Varón | 152 (59) | 84 (56) |
| Mujer | 103 (40) | 66 (44) |
| PAS (mmHg) | 153,12 (23,02) | 154,72 (23,02) |
| PAD (mmHg) | 84,16 (11,97) | 82,38 (11,82) |
| Tiempo de evolución (años) | 11,04 (8,62) | 15,46** (10,68) |
| Fumador activo, n (%) | ||
| Sí | 52 (20) | 27 (18) |
| No | 203 (80) | 123 (82) |
| Ingesta de alcohol, n (%) | ||
| Sí | 46 (18) | 20 (13) |
| No | 209 (82) | 130 (87) |
| Cardiopatía isquémica crónica, n (%) | 36 (14) | 32 (21) |
| IMC (kg/m2) | 30,54 (5,27) | 30,37 (5,15) |
| PC (cm) | 104,42 (11,43) | 105,42 (11,73) |
| ITB | 0,95 (0,21) | 0,96 (0,24) |
| Hipertensión arterial, n (%) | 163 (64) | 108 (72) |
| Dislipidemia, n (%) | 143 (56) | 97 (65) |
| Tratamiento de la dislipidemiaa, n (%) | 136 (54) | 87 (58) |
| Tratamiento con ADO, n (%) | 132 (53)** | 49 (33) |
| Tratamiento con metformina, n (%) | 120 (47)* | 38 (25) |
| Tratamiento con insulina, n (%) | 55 (21)** | 54 (36) |
| Tratamiento con ADO e insulina, n (%) | 51 (20) | 43 (29) |
ADO: antidiabéticos orales; IMC: índice de masa corporal; ITB: índice tobillo-brazo; PC: perímetro de cintura; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SW: prueba del monofilamento de Semmes-Weinstein.
Valores expresados como media (desviación estándar), excepto donde se indica.
Los sujetos fueron divididos en 2 grupos según presentaron o no alterada la prueba del monofilamento de SW (ver apartado de Método). La prueba de monofilamento de SW estaba alterada en 66 mujeres y 84 varones.
Los pacientes con DM2 y la prueba del monofilamento de SW alterada (n=150) presentaron de forma significativa mayor edad, mayores concentraciones de triglicéridos en ayunas, más años de evolución de la diabetes, peor control glucémico (HbA1c) y menor aclaramiento de creatinina (tablas 1 y 2). No encontramos diferencias estadísticamente significativas en la distribución por sexos, ingesta de alcohol, diagnóstico y tratamiento de la dislipidemia, diagnóstico de hipertensión arterial, IMC y concentraciones de albuminuria o cociente albúmina/creatinina al comparar ambos grupos de pacientes con DM2 (tablas 1 y 2). El porcentaje de pacientes con DM2 con prueba alterada en tratamiento con insulina fue significativamente mayor, y en tratamiento con antidiabéticos orales, incluida la toma de metformina, menor comparado con los que presentaron la prueba normal (tabla 1).
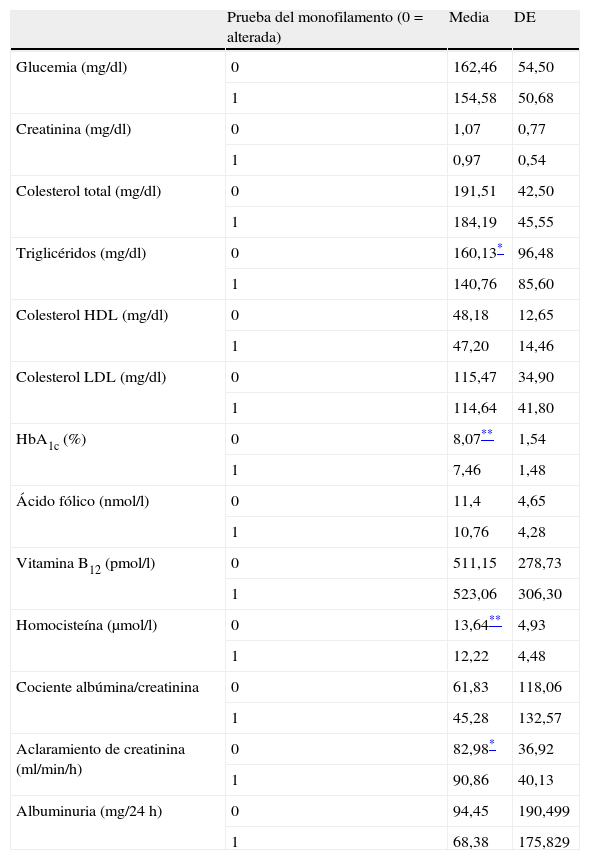
Características biológicas de los pacientes con diabetes mellitus tipo 2 agrupados según presentasen o no la prueba del monofilamento de Semmes-Weinstein alterada
| Prueba del monofilamento (0=alterada) | Media | DE | |
| Glucemia (mg/dl) | 0 | 162,46 | 54,50 |
| 1 | 154,58 | 50,68 | |
| Creatinina (mg/dl) | 0 | 1,07 | 0,77 |
| 1 | 0,97 | 0,54 | |
| Colesterol total (mg/dl) | 0 | 191,51 | 42,50 |
| 1 | 184,19 | 45,55 | |
| Triglicéridos (mg/dl) | 0 | 160,13* | 96,48 |
| 1 | 140,76 | 85,60 | |
| Colesterol HDL (mg/dl) | 0 | 48,18 | 12,65 |
| 1 | 47,20 | 14,46 | |
| Colesterol LDL (mg/dl) | 0 | 115,47 | 34,90 |
| 1 | 114,64 | 41,80 | |
| HbA1c (%) | 0 | 8,07** | 1,54 |
| 1 | 7,46 | 1,48 | |
| Ácido fólico (nmol/l) | 0 | 11,4 | 4,65 |
| 1 | 10,76 | 4,28 | |
| Vitamina B12 (pmol/l) | 0 | 511,15 | 278,73 |
| 1 | 523,06 | 306,30 | |
| Homocisteína (μmol/l) | 0 | 13,64** | 4,93 |
| 1 | 12,22 | 4,48 | |
| Cociente albúmina/creatinina | 0 | 61,83 | 118,06 |
| 1 | 45,28 | 132,57 | |
| Aclaramiento de creatinina (ml/min/h) | 0 | 82,98* | 36,92 |
| 1 | 90,86 | 40,13 | |
| Albuminuria (mg/24h) | 0 | 94,45 | 190,499 |
| 1 | 68,38 | 175,829 |
Colesterol HDL: colesterol unido a lipoproteínas de alta densidad; colesterol LDL: colesterol unido a lipoproteínas de baja densidad; DE: desviación estándar; HbA1c: hemoglobina glucosilada.
Encontramos las concentraciones plasmáticas de homocisteína significativamente más elevadas en los pacientes con prueba del monofilamento de SW alterada, sin encontrar diferencias estadísticamente significativas en las concentraciones de vitamina B12 y ácido fólico (tabla 2). Además, estas diferencias se mantuvieron al corregir por edad, sexo, tabaquismo, ingesta de alcohol y aclaramiento renal. Es conocido que a mayor edad, consumo de tabaco, ingesta de alcohol y menor aclaramiento las concentraciones plasmáticas de homocisteína se elevan; así, los valores plasmáticos de homocisteína se relacionaron de forma significativa con la edad (r=0,231, p<0,001) y con el aclaramiento de creatinina (r=-0,358, p<0,001). No se relacionaron con el grado de control glucémico, el tabaquismo, los valores de albuminuria ni el tiempo de evolución de la enfermedad.
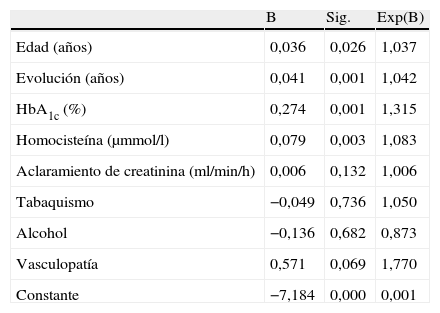
Al realizar una regresión logística introduciendo como variable dependiente la prueba del monofilamento alterada y como independientes la edad, los años de evolución de la diabetes, el tabaco, la ingesta de alcohol, la presencia de vasculopatía, el aclaramiento de creatinina, la HbA1c y las concentraciones plasmáticas de homocisteína, permanecieron todas en el modelo excepto el tabaco, la ingesta de alcohol, la presencia de vasculopatía y el aclaramiento de creatinina (tabla 3). Por cada incremento en un 1% de la HbA1c, el riesgo de prueba patológica fue del 28%, mientras que por cada elevación de 1μmol/l en las concentraciones plasmáticas de homocisteína, el riesgo de prueba patológica se incrementó un 8% (tabla 3).
Regresión logística teniendo como variable dependiente la prueba del monofilamento de Semmes-Weinstein e independientes la edad, los años de evolución de la diabetes, la hemoglobina glucosilada, la homocisteína plasmática, el tabaquismo, la ingesta de alcohol, la vasculopatía y el aclaramiento de creatinina
| B | Sig. | Exp(B) | |
| Edad (años) | 0,036 | 0,026 | 1,037 |
| Evolución (años) | 0,041 | 0,001 | 1,042 |
| HbA1c (%) | 0,274 | 0,001 | 1,315 |
| Homocisteína (μmmol/l) | 0,079 | 0,003 | 1,083 |
| Aclaramiento de creatinina (ml/min/h) | 0,006 | 0,132 | 1,006 |
| Tabaquismo | −0,049 | 0,736 | 1,050 |
| Alcohol | −0,136 | 0,682 | 0,873 |
| Vasculopatía | 0,571 | 0,069 | 1,770 |
| Constante | −7,184 | 0,000 | 0,001 |
HbA1c: hemoglobina glucosilada.
Al igual que en estudios previos, nuestro trabajo de investigación mostró cómo la presencia de PND evaluada por la prueba del monofilamento de SW alterada se asoció con mayor edad, duración de la diabetes y grado de control glucémico1,2,4. Así, en nuestro estudio, los valores de HbA1c predijeron, por cada elevación de un 1%, un 28% de riesgo de presentar PND. También en otros estudios las cifras elevadas de la HbA1c se asociaron de forma independiente con la presencia y progresión de la PND3,4,14. Además, la optimización de la HbA1c evita la progresión de la PND, como ha sido mostrado en los estudios DDCT y UKPDS1,3.
En nuestro estudio hemos encontrado cómo otro factor biológico modificable, las concentraciones elevadas de homocisteína plasmática, se relacionaron con la presencia de PND evaluada por la prueba alterada del monofilamento de SW. Este efecto de asociación se mantuvo al incluir en el análisis multivariante potentes predictores conocidos como la edad, el sexo, el tiempo de evolución de la diabetes, el grado de control glucémico, el tabaquismo, la ingesta de alcohol y el aclaramiento renal.
En este sentido, apoyando nuestros resultados, diferentes estudios han relacionado los valores elevados de homocisteína plasmática y sérica con la angiopatía, siendo la homocisteína un potente factor de disfunción endotelial y lesión microvascular y macrovascular10,15–18. Así, estas lesiones vasculares pueden producir isquemia en la vaina de mielina, contribuyendo a desarrollar la lesión del nervio periférico. Además, estudios in vitro han mostrado un efecto neurotóxico directo de la hiperhomocisteinemia11,12. Este efecto neurotóxico puede ser mediado por el estrés oxidativo12. Finalmente, estudios epidemiológicos han mostrado cómo en pacientes con DM2 se encontró que por cada 5μmol/l de incremento de la homocisteína sérica la OR para PND fue del 2,6 (intervalo de confianza del 95% [IC 95%] 1,07-6,33), y que el riesgo se duplicaba a partir de los 13μmol/l comparado con 9μmol/l5. Recientemente, en población asiática se ha encontrado una asociación independiente de las concentraciones de homocisteína con la PND evaluada por criterios clínicos y confirmada con criterios electrofisiológicos19. Por tanto, todos estos hallazgos apoyan la asociación entre concentraciones elevadas de homocisteína y la presencia y desarrollo de PND.
Por otro lado, nuestro grupo publicó recientemente cómo las concentraciones elevadas de homocisteína plasmática se asociaron de forma independiente con la presencia de úlcera en el pie diabético20. En este sentido, es también explicable cómo estos valores elevados de homocisteína se asociaron con el más potente predictor de riesgo de ulceración, como es la prueba alterada del monofilamento de SW1,13.
Pensamos que nuestros resultados tienen un importante valor clínico. En primer lugar, porque se ha mostrado cómo fármacos comúnmente usados en el tratamiento de la DM2 pueden elevar las concentraciones plasmáticas y séricas de la homocisteína y empeorar la PND. Así, la metformina puede incrementar la homocisteína y agravar la PND21. Además, en el estudio FIELD, los fibratos elevaron la homocisteína, sin que se sepa cuál puede ser la consecuencia en estos pacientes tratados a medio-largo plazo22,23. No recogimos en nuestro estudio la toma de fibratos y/o estatinas, que fue categorizada en el protocolo de recogida de datos como tratamiento de la dislipidemia, lo que limita la interpretación de los resultados. En segundo lugar, porque las concentraciones plasmáticas de homocisteína son fácilmente modificables con suplementos vitamínicos e intervenciones dietéticas. La ingesta diaria de 400μg de ácido fólico, 2,4μg de vitamina B12 y 1,7mg de vitamina B6 se asoció con valores normales-bajos de homocisteína en la población general24. Nuestros resultados y los obtenidos por otros autores apoyarían la idea de recomendar dietas con alimentos ricos en estos micronutrientes en pacientes con DM2, si bien es cierto que no existen estudios de intervención nutricional o con suplementos farmacológicos de estos micronutrientes que apoyen esta recomendación.
Las limitaciones de nuestro trabajo son, por un lado, que al tratarse de un estudio de casos y controles no es posible establecer con seguridad la asociación etiológica entre las concentraciones elevadas de homocisteína plásmatica y la PND. Por otro lado, no se han realizado pruebas complementarias diagnósticas de la PND como son los estudios electrofisiológicos. Además, la prueba del monofilamento tiene limitaciones en cuanto a su uso como prueba diagnóstica de la PND, puesto que solo evalúa la sensación de presión.
En resumen, hemos encontrado en una amplia cohorte de pacientes con DM2 una correlación independiente de las concentraciones de homocisteína plasmática con la presencia de PND evaluada por la prueba del monofilamento SW. Este factor biológico es fácilmente modificable, por lo que sería interesante ensayar intervenciones preventivas de la PND, pero para confirmar nuestros resultados e hipótesis son necesarios más estudios prospectivos y de intervención en este grupo de pacientes.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.